ACTILYSE 50 mg 1 flakon Saklanması
{ Alteplaz }
Kan ve Kan Yapıcı Organlar > Antitrombotik İlaçlar > Alteplaz Boehringer Ingelheim İlaç Tic. A.Ş. | Güncelleme : 7 September 2012ACTILYSE'in saklanması
Normal koşullarda doktor tarafından uygulanacağı için ACTILYSE'i saklamanız sizden istenmeyecektir.
ACTILYSE'i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
25°C'nin altındaki sıcaklıkta saklayınız. Işıktan korumak için orijinal ambalajında saklayınız.
ACTILYSE, şişe etiketinde ve karton kutu üzerinde belirtilen son kullanma tarihinden sonra kullanılmamalıdır. Son kullanma tarihi o ayın son gününü gösterir.
Sulandırılmış çözelti
Sulandırılarak hazırlanan çözeltinin 2°C - 8°C' de 24 saat, 25°C' de ise 8 saat stabil olduğu gösterilmiştir.
Mikrobiyolojik açıdan, ürün sulandırıldıktan hemen sonra kullanılmalıdır. Eğer hemen kullanılmazsa, kullanım-sırası saklama süreleri ve kullanımdan önceki koşulların sorumluluğu kullanıcıya aittir ve sulandırılan ilacın saklama süresi, normalde 2-8 ° C' de 24 saatten daha uzun olmamalıdır.
Son kullanma tarihiyle uyumlu olarak kullanınız.
Ambalajdaki son kullanma tarihinden sonra ACTILYSE'i kullanmayınız.
Eğer üründe ve/veya ambalajında bozukluklar fark ederseniz ACTILYSE'i kullanmayınız. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilik ve
İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz.
Ruhsat sahibi:
Boehringer Ingelheim İlaç Tic. A.Ş.
Esentepe Mah. Harman 1 Sok. Nidakule Levent No:7/9 Kat: 15 34394 Şişli / İstanbul
Tel: (0 212) 329 1100
Faks: (0 212) 329 1101
Üretim yeri:
Boehringer Ingelheim Pharma GmbH&Co. KG Birkendorfer Str. 65
D-88400 Biberach an der Riss 1 / Almanya
Bu kullanma talimatı …/…/… tarihinde onaylanmıştır.
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
İzlenebilirlik
Biyolojik tıbbi ürünlerin izlenebilirliğini arttırmak için, uygulanan ürünün ticari ismi ve seri numarası hasta dosyasına net bir şekilde kaydedilmelidir.
Uygun kullanım ve doz/uygulama sıklığı için talimatlar:
Alteplazın 2 mg'lık flakonu akut miyokard enfarktüsü, akut masif pulmoner embolizm veya akut iskemik inme (masif düşük doz riskine bağlı) için endike değildir. Bu endikasyonlarda, sadece 10 mg, 20 mg veya 50 mg flakonlar endikedir.
Sulandırma
mg/mL alteplaz konsantrasyonu elde etmek için, ambalaj içinde bulunan çözücünün tamamı ACTILYSE toz içeren flakona aktarılmalıdır. Bu amaç için, 20 ve 50 mg' lık ambalaj büyüklükleri içine, kullanılacak olan transfer kanülü de eklenmiştir. 10 mg'lık ambalaj büyüklüğü için bir enjektör kullanılmalıdır.
mg/mL alteplaz konsantrasyonu elde etmek için, ambalaj içinde bulunan çözücünün yalnızca yarısı kullanılmalıdır (aşağıdaki tabloya göre). Bu gibi durumlarda, gerekli miktardaki çözücüyü ACTILYSE toz içeren flakona aktarmak için her zaman bir enjektör kullanılmalıdır.
Aseptik koşullar altında, ACTILYSE enjeksiyonluk flakon içeriği (10 mg veya 20 mg veya 50 mg) enjeksiyonluk su ile aşağıdaki tabloya göre, final konsantrasyon 1 mg alteplaz/mL veya 2 mg alteplaz/mL elde etmek için çözülür:
ACTILYSE kuru madde | 10 mg | 20 mg | 50 mg |
(a) Kuru maddeye eklenecek enjeksiyonluk sterilize su miktarı |
10 mL |
20 mL |
50 mL |
Final konsantrasyon | 1 mg alteplaz/mL | 1 mg alteplaz/mL | 1 mg alteplaz/mL |
(b) Kuru maddeye eklenecek enjeksiyonluk sterilize su miktarı |
5 mL |
10 mL |
25 mL |
Final konsantrasyon | 2 mg alteplaz/mL | 2 mg alteplaz/mL | 2 mg alteplaz/mL |
Sonra sulandırılmış çözelti intravenöz olarak uygulanmalıdır. 1 mg alteplaz/mL sulandırılmış çözelti, steril sodyum klorür 9 mg/mL (% 0,9) enjeksiyonluk çözelti ile 0,2 mg/mL düzeyindeki bir minimal konsantrasyona kadar seyreltilebilir, çünkü sulandırılmış çözeltide bulanıklık ortaya çıkması göz ardı edilemez. 1 mg alteplaz/mL sulandırılmış çözeltinin enjeksiyonluk steril su ile daha fazla seyreltilmesi, ya da genel olarak örneğin, dekstroz gibi karbonhidratlı infüzyon solüsyonlarının kullanılması önerilmez, çünkü sulandırılmış çözeltide bulanıklık oluşumu artar. ACTILYSE, aynı infüzyon flakonu içinde, diğer ilaçlarla (heparin ile bile) karıştırılmamalıdır.
Saklama koşulları için bu kullanma talimatının Bakınız Bölüm 5 “ACTILYSE'in saklanmasıâ€.
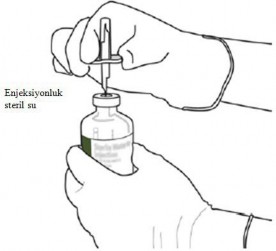
1 | Uygulamadan hemen önce sulandırınız. |
|
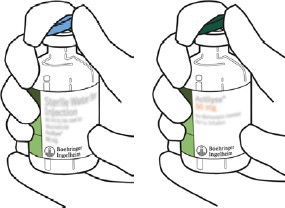
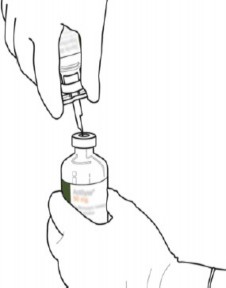
2 | Steril su ve ACTILYSE kuru maddenin bulunduğu iki flakondaki koruyucu başlığı baş parmakla yukarı kaldırarak çıkarınız. |
|
3 | Her flakonun üst kauçuk bölümünü alkollü bir bezle siliniz. |
|
Hazırlanmış çözelti yalnızca tek kullanımlıktır. Kullanılmayan çözelti atılmalıdır. ACTILYSE' in sulandırma talimatları
![]()
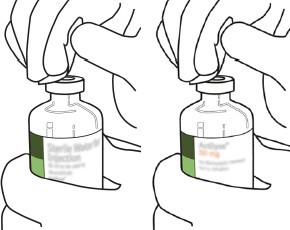
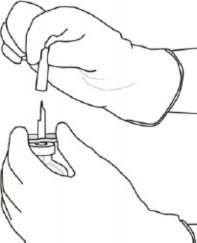
4 | Transfer kanülünü* kabından çıkarınız. Transfer kanülünü dezenfekte etmeyiniz veya sterilize etmeyiniz; sterildir. Kapağı çıkarınız. |
|
5 | Steril su flakonunu stabil yüzeye dik tutunuz. Doğrudan yukarıdan, transfer kanülü ile kauçuk tıpayı, tıpa merkezine dikey olarak yavaşça bastırarak ancak dümdüz, bükmeden deliniz. |
|
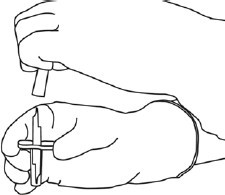
6 | Steril su flakonunu ve transfer kanülünü, iki taraflı kanadı kullanarak bir elinizle sabit tutunuz.
Transfer kanülünün üstündeki kalan kapağı çıkarınız. |
|
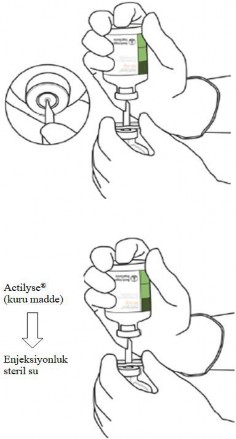
7 | Steril su flakonunu ve transfer kanülünü, iki taraflı kanadı kullanarak bir elinizle sabit tutunuz.
ACTILYSE kuru madde içeren flakonu, transfer kanülü üzerinde dik olarak tutunuz ve transfer kanülünün ucunu tıpanın tam ortasına yerleştiriniz.
Kuru madde flakonunu, yukarıdan doğrudan transfer kanülünün üzerine, kauçuk tıpayı dikey olarak ve yavaşça ancak dümdüz, bükmeden delerek itiniz. |
|
8 | İki flakonu ters çeviriniz ve suyun tamamen kuru maddeye aktarılmasına izin veriniz. |
|
9 | Boş su flakonu ile transfer kanülünü çıkarınız. Su flakonu ve transfer kanülü imha edilebilir. |
|
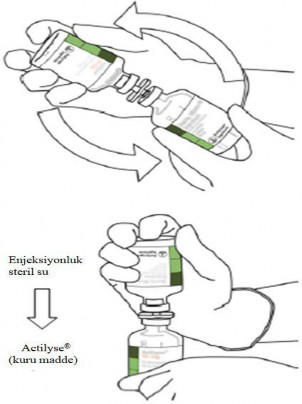
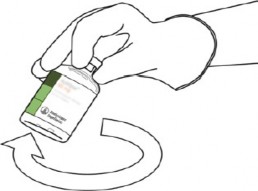
10 | Sulandırılmış ACTILYSE flakonunu alınız ve geri kalan tozu çözmek için yavaşça döndürünüz, ancak sallamayınız, çünkü bu köpük üretecektir.
Kabarcıklar varsa, kaybolması için, çözeltinin hareketsiz olarak birkaç dakika durmasına izin veriniz. |
|
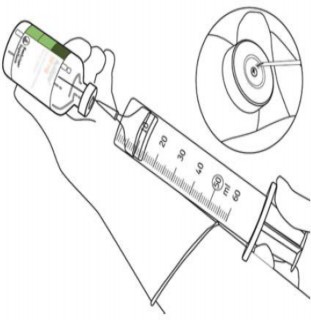
11 | Sulandırılmış çözelti, 1 mg/mL alteplazdan oluşur. Şeffaf ve renksiz ila soluk sarı olmalı ve herhangi bir partikül içermemelidir. | |
12 | Sadece bir iğne ve bir şırınga kullanarak gereken miktarı çekiniz. Sızıntıyı önlemek için transfer kanülünden kalan delik yeri kullanmayınız. |
|
13 | Derhal kullanınız. Kullanılmayan çözeltiyi imha ediniz. | |
(*Kit içinde transfer kanülü varsa. Sulandırma işlemi bir şırınga ve iğne ile de gerçekleştirilebilir.)
Pozoloji ve uygulama yolu
Akut miyokard enfarktüsü
Pozoloji
Tedaviye, semptomların başlangıcını izleyen 6 saat içinde başlanabilen akut miyokard enfarktüsü hastalarında, 90 dakikalık (hızlandırılmış) doz rejimi:
Vücut ağırlığı ≥65 kg olan hastalarda:
Alteplaz konsantrasyonuna göre uygulanması gereken hacim
1 mg/mL
2 mg/mL
İntravenöz bolus olarak 15 mg, hemen sonrasında ise
15 mL
7,5 mL
İlk 30 dakika boyunca sabit hızla intravenöz infüzyon şeklinde 50 mg, hemen sonrasında ise
50 mL
25 mL
60 dakika boyunca sabit hızla intravenöz infüzyon şeklinde 35 mg, maksimum toplam doz olan 100 mg'a ulaşıncaya kadar
35 mL
17,5 mL
Vücut ağırlığı <65 kg olan hastalarda toplam doz, aşağıdaki tablo doğrultusunda vücut ağırlığına göre ayarlanmalıdır:
Alteplaz konsantrasyonuna göre uygulanması gereken hacim
1 mg/mL
2 mg/mL
İntravenöz bolus olarak 15 mg, hemen sonrasında ise
15 mL
7,5 mL
İlk 30 dakika boyunca sabit hızla intravenöz infüzyon şeklinde 0,75 mg/kg vücut ağırlığı (va), hemen sonrasında
ise
0,75 mL/kg
va
0,375 mL/kg
va
60 dakika boyunca sabit hızla intravenöz infüzyon şeklinde
0,5 mg/kg vücut ağırlığı (va)
0,5 mL/kg va
0,25 mL/kg va
Tedaviye, semptomların başlangıcını izleyen 6-12 saat arasında başlanabilen akut miyokard enfarktüslü hastalarda, 3 saatlik doz rejimi:
Vücut ağırlığı ≥65 kg olan hastalarda:
| Alteplaz konsantrasyonuna göre uygulanması gereken hacim | |
1 mg/mL | 2 mg/mL | |
İntravenöz bolus olarak 10 mg, hemen sonrasında ise | 10 mL | 5 mL |
İlk saat boyunca sabit hızla intravenöz infüzyon şeklinde 50 mg, hemen sonrasında ise | 50 mL | 25 mL |
2 saat boyunca sabit hızla intravenöz infüzyon şeklinde 40 mg, maksimum toplam doz olan 100 mg'a ulaşıncaya kadar. | 40 mL | 20 mL |
Vücut ağırlığı <65 kg olan hastalarda:
| Alteplaz konsantrasyonuna göre uygulanması gereken hacim | |
1 mg/mL | 2 mg/mL | |
İntravenöz bolus olarak 10 mg, hemen sonrasında ise | 10 mL | 5 mL |
3 saat boyunca, sabit hızla intravenöz infüzyon, maksimum toplam doz 1,5 mg/kg va değerine ulaşıncaya kadar | 1,5 mL/kg va | 0,75 mL/kg va |
Yardımcı tedavi: ST yükselmeli miyokard enfarktüsü olan hastaların tedavisine yönelik
güncel uluslararası kılavuzlar doğrultusunda, yardımcı antitrombotik tedavi uygulaması önerilmektedir.
Uygulama şekli
Sulandırılarak hazırlanmış solüsyon intravenöz yoldan uygulanmalı ve hazırlanan solüsyon hemen kullanılmalıdır.
![]()
2 mg'lik alteplaz flakonları bu endikasyonda kullanım için endike değildir.
Akut masif akciğer embolisi
Pozoloji
Vücut ağırlığı ≥65 kg olan hastalarda:
Toplam doz olan 100 mg alteplaz, 2 saat içinde uygulanmalıdır. En fazla deneyim aşağıdaki doz rejimi ile mevcuttur:
| Alteplaz konsantrasyonuna göre uygulanması gereken hacim | |
1 mg/mL | 2 mg/mL | |
1-2 dakikalık intravenöz bolus şeklinde 10 mg, hemen sonrasında ise | 10 mL | 5 mL |
2 saat boyunca sabit hızla intravenöz infüzyon şeklinde 90 mg, maksimum toplam doz olan 100 mg'a ulaşıncaya kadar | 90 mL | 45 mL |
Vücut ağırlığı <65 kg olan hastalarda:
| Alteplaz konsantrasyonuna göre uygulanması gereken hacim | |
1 mg/mL | 2 mg/mL | |
1-2 dakikalık intravenöz bolus şeklinde 10 mg, hemen sonrasında ise | 10 mL | 5 mL |
2 saat boyunca sabit hızla intravenöz infüzyon, maksimum toplam doz 1,5 mg/kg va değerine ulaşıncaya kadar | 1,5 mL/kg va | 0,75 mL/kg va |
Yardımcı tedavi: ACTILYSE tedavisinden sonra, aPTT değerleri normalin üst sınırının 2 katından daha düşük bir değere döndüğünde, heparin tedavisine başlanmalıdır (ya da devam edilmelidir). İnfüzyon, aPTT değerini 50 – 70 saniye (referans değerin 1,5-2,5 katı) arasında tutacak şekilde ayarlanmalıdır.
Uygulama şekli
Sulandırılarak hazırlanmış çözelti intravenöz yoldan uygulanmalı ve hazırlanan çözelti hemen kullanılmalıdır.
2 mg'lik alteplaz flakonları bu endikasyonda kullanım için endike değildir.
Akut iskemik inme
Tedavi sadece nörovasküler bakımda eğitimli ve deneyimli bir doktorun sorumluluğu ve takibi altında gerçekleştirilmelidir, Bakınız: Kısa Ürün Bilgisi Bölüm 4.3. ve Bölüm 4.4.
ACTILYSE ile tedavi semptomların ortaya çıkmasından sonraki 4,5 saat içinde, mümkün olan en erken zamanda başlatılmalıdır (Bkz. Kısa Ürün Bilgisi Bölüm 4.4). İnme semptomlarının başlamasını takiben 4,5 saat geçtikten sonra, ACTILYSE uygulamasıyla ilişkili negatif bir yarar/risk oranı vardır ve bu durumda uygulanmamalıdır (Bakınız Kısa Ürün Bilgisi Bölüm 5.1.).
Pozoloji
Önerilen toplam doz, 0,9 mg alteplase/kg va'dır (maksimum 90 mg). Uygulamaya toplam dozun %10'unun intravenöz bolus şeklinde verilmesi ile başlanır, hemen sonrasında, toplam dozun kalan kısmı, 60 dakika boyunca intravenöz infüzyon şeklinde uygulanır.
AKUT İSKEMİK İNME İÇİN DOZ TABLOSU | |||
Önerilen 1 mg/mL standart konsantrasyonunun kullanılmasıyla uygulanacak hacim (mL), önerilen doz değerine (mg) eşittir | |||
Ağırlık (kg) | Toplam doz (mg) | Bolus doz (mg) | İnfüzyon dozu* (mg) |
40 | 36 | 3,6 | 32,4 |
42 | 37,8 | 3,8 | 34 |
44 | 39,6 | 4 | 35,6 |
46 | 41,4 | 4,1 | 37,3 |
48 | 43,2 | 4,3 | 38,9 |
50 | 45 | 4,5 | 40,5 |
52 | 46,8 | 4,7 | 42,1 |
54 | 48,6 | 4,9 | 43,7 |
56 | 50,4 | 5 | 45,4 |
58 | 52,2 | 5,2 | 47 |
60 | 54 | 5,4 | 48,6 |
62 | 55,8 | 5,6 | 50,2 |
64 | 57,6 | 5,8 | 51,8 |
66 | 59,4 | 5,9 | 53,5 |
68 | 61,2 | 6,1 | 55,1 |
70 | 63 | 6,3 | 56,7 |
72 | 64,8 | 6,5 | 58,3 |
74 | 66,6 | 6,7 | 59,9 |
76 | 68,4 | 6,8 | 61,6 |
78 | 70,2 | 7 | 63,2 |
80 | 72 | 7,2 | 64,8 |
82 | 73,8 | 7,4 | 66,4 |
84 | 75,6 | 7,6 | 68 |
86 | 77,4 | 7,7 | 69,7 |
88 | 79,2 | 7,9 | 71,3 |
90 | 81 | 8,1 | 72,9 |
92 | 82,8 | 8,3 | 74,5 |
94 | 84,6 | 8,5 | 76,1 |
96 | 86,4 | 8,6 | 77,8 |
98 | 88,2 | 8,8 | 79,4 |
100+ | 90 | 9 | 81 |
*60 dakika boyunca sabit hızla infüzyon şeklinde 1 mg/mL konsantrasyonda verilir.
Yardımcı tedavi:
Bu rejimin, semptomların ortaya çıkmasından sonraki ilk 24 saat içinde eş zamanlı heparin veya asetilsalisilik asit gibi platelet agregasyon inhibitörleri ile birlikte uygulanmasının güvenlilik ve etkililiği yeterince araştırılmamıştır. Bu nedenle, hemorajik riskin artmasına bağlı olarak, ACTILYSE tedavisinden sonraki ilk 24 saat içinde heparin veya asetilsalisilik asit gibi platelet agregasyon inhibitörlerinin uygulanmasından kaçınılmalıdır. Eğer başka endikasyonlar nedeniyle heparin kullanılması gerekiyorsa (örneğin, derin ven trombozunun önlenmesi), deri altına uygulanan günlük doz 10.000 Uluslararası Ünite'yi aşmamalıdır.
Uygulama şekli
Sulandırılarak hazırlanmış çözelti intravenöz yoldan uygulanmalı ve hazırlanan çözelti derhal kullanılmalıdır.
2 mg'lik alteplaz flakonları bu endikasyon kullanımı için endike değildir. Pediyatrik popülasyon
ACTILYSE' in çocuklarda ve ergenlerde kullanımı hakkında sınırlı deneyim vardır. ACTILYSE'in çocuklar ve 16 yaşından küçük ergenlerde akut inme tedavisinde kullanılması kontrendikedir (Bkz. KÜB, Bölüm. 4.3). 16-17 yaşındaki ergenler için doz, yetişkinlerinki ile aynıdır (Önceden uygulanması gereken görüntüleme teknikleri ile ilgili öneriler için Bkz. KÜB, Bölüm 4.4.).
≥16 yaşındaki ergenler, uygun tekniklerle yapılacak görüntüleme ile inmeyi taklit eden durumlar elimine edildikten ve nörolojik sorunla ilişkili arteriyel tıkama teyit edildikten sonra, ürün bilgilerinde yetişkinler için verilen talimatlara göre tedavi edilir.
 Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
 Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
 Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
 Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
 Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A09182 |
| Satış Fiyatı | 18953.6 TL [ 7 Apr 2025 ] |
| Önceki Satış Fiyatı | 18953.6 TL [ 24 Mar 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693790040 |
| Etkin Madde | Alteplaz |
| ATC Kodu | B01AD02 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > Antitrombotik İlaçlar > Alteplaz |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ FİYATLARI
| Tarihi | İlaç Fiyatı |
|---|---|
| 7 Apr 2025 | 18,953.60 TL |
| 24 Mar 2025 | 18,953.60 TL |
| 17 Mar 2025 | 18,953.60 TL |
| 7 Mar 2025 | 18,953.60 TL |
| 28 Feb 2025 | 18,953.60 TL |
| 21 Feb 2025 | 18,953.60 TL |
| 14 Feb 2025 | 18,953.60 TL |
| 7 Feb 2025 | 18,953.60 TL |
| 2025 / 2008 İlaç Fiyatları |