ADCETRIS 50 mg IV infüzyonluk çözelti konsantresi içeren flakon (1 flakon) Kısa Ürün Bilgisi
{ Brentuksimab Vedotin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ADCETRİS 50 mg IV infüzyonluk çözelti konsantresi için toz içeren flakon Steril, Sitotoksik
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir flakon 50 mg brentuximab vedotin içerir.
Kullanıma hazırlandıktan sonra (bkz. bölüm 6.6), her mL'si 5 mg brentuximab vedotin içerir.
ADCETRİS, antimikrotübül ajan monometil auristatin E'ye (MMAE) kovalent bağlı bir CD30 güdümlü monoklonal antikordan (Çin hamsterı over hücrelerinde rekombinant DNA teknolojisi ile üretilen rekombinant kimerik immünoglobulin G1 [IgG1]) oluşan bir antikor-ilaç konjügatıdır.
Yardımcı maddeler
Sodyum sitrat dihidrat 56,1 mg
Yardımcı maddelerin tam listesi için bkz. bölüm 6.1.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti konsantresi tozu. Beyaz ila kırık beyaz kek veya toz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Hodgkin lenfoma (HL)
ADCETRİS, Evre IV CD30 pozitif klasik Hodgkin lenfoma tanısı konmuş olan hastalardan;
60 yaş üzerinde olup, nöropatisi bulunmayan IPS≥4 olgularda,
4.2. Pozoloji ve uygulama şekli
ADCETRİS, anti-kanser ajanlarının kullanımında deneyimli bir hekimin gözetimi altında uygulanmalıdır.
Pozoloji / uygulama sıklığı ve süresi
Önceden Tedavi Edilmemiş Hodgkin lenfoma
Kemoterapi ile kombinasyon halinde (doksorubisin [A], vinblastin [V] ve dakarbazin [D] [AVD]) önerilen doz, her bir siklusun 28 gün olduğu toplam 6 siklus süren bir tedavide her bir siklusun 1. ve 15. günlerinde 30 dakika süreyle intravenöz infüzyon şeklinde uygulanan 1.2 mg/kg'dır (bkz. bölüm5.1).
Kombinasyon tedavisi alan, daha önce tedavi edilmemiş Hodgkin lenfomalı tüm hastaların tedavisi için ilk dozdan başlayarak büyüme faktörü (G-CSF) ile desteklenen primer profilaksi önerilmektedir.(bkz. bölüm
4.4.).
Hodgkin lenfomalı (HL) hastaların birinci basamak tedavisinde ADCETRİS ile birlikte verilen kemoterapi ajanlarının kısa ürün bilgilerine (KÜB) bakınız.
Nüks veya progresyon riski artan Hodgkin lenfoma (HL)
Önerilen doz, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulanan 1,8 mg/kg'dır. ADCETRİS tedavisine, klinik yargıya göre, otolog kök hücre nakline bağlı iyileşme sürecinden sonra başlanmalıdır. Bu hastalar 16 siklusa kadar tedavi almalıdır (bkz. bölüm 5.1.)
Nükseden veya tedaviye dirençli Hodgkin lenfoma (HL)
Önerilen doz, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulan an 1,8 mg/kg'dır.
Daha önce ADCETRİS tedavisine yanıt veren hastalar için tavsiye edilen başlangıç dozu her 3 haftada bir 30 dakika boyunca intravenöz infüzyon olarak uygulanan 1,8 mg/kg'dır. Alternatif olarak, tedavi tolere edilmiş en son doz ile başlatılabilir (bkz. bölüm 5.1).
Hastalık progrese olana ya da kabul edilemez düzeyde toksisite meydana gelene kadar tedaviye devam edilmelidir (bkz. bölüm 4.4).
Stabil hastalığa ya da daha iyidüzeye ulaşan hastalar en az 8 siklus ve en fazla 16 siklus (yaklaşık 1 yıl) tedavi
almalıdır (bkz. bölüm5.1).
Nükseden veya tedaviye dirençli sistemik anaplastik büyük hücreli lenfoma (sALCL)
Önerilen doz, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulan an 1,8 mg/kg'dır.
Daha önce ADCETRİS tedavisine yanıt veren hastalar için tavsiye edilen başlangıç dozu her 3 haftada bir 30 dakika boyunca intravenöz infüzyon olarak uygulanan 1,8 mg/kg'dır. Alternatif olarak, tedavi tolere edilmiş en son doz ile başlatılabilir (bkz. bölüm 5.1).
Hastalık progrese olana ya da kabul edilemez düzeyde toksisite meydana gelene kadar tedaviye devam edilmelidir (bkz. bölüm 4.4).
Stabil hastalığa ya da daha iyidüzeye ulaşan hastalar en az 8 siklus ve en fazla 16 siklus (yaklaşık 1 yıl) tedavi almalıdır (bkz. bölüm5.1).
Kutanöz T-hücreli lenfoma (CTCL)
Önerilen doz, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulanan 1,8 mg/kg'dır. CTCL'si olan hastalara 16 siklusa kadar uygulanmalıdır (bkz. bölüm 5.1).
Önceden tedavi edilmemiş sistemik anaplastik büyük hücreli lenfoma (sALCL) ve diğer CD30 pozitifliği olan periferik T-hücreli lenfomalar (PTCL)
Kemoterapi ile kombinasyon tedavisinde (siklofosfamid [C], doksorubisin [H] ve prednizon [P] [CHP]) tavsiye edilen doz, 3 haftada bir 6 ila 8 siklusolarak, en fazla 180 mg olacak şekilde, 30 dakika süreyle intravenöz infüzyon olarak uygulanan 1.8 mg/kg'dır (Bkz. bölüm 5.1)
Kombinasyon tedavisi alan, daha önce tedavi edilmemiş tüm sALCL ve diğer CD30 pozitiflik belirlenen
PTCL hastalarının tedavisi için ilk dozdan itibaren büyüme faktörü (G-CSF) ile desteklenen primer profilaksi önerilmektedir (bkz. bölüm 4.4.).
Daha önce tedavi edilmemiş sALCL ve diğer CD30 pozitiflik belirlenen PTCL hastaları için ADCETRİS ile birlikte uygulanan kemoterapi ajanlarının kısa ürün bilgilerine bakınız.
Genel
Eğer hastanın beden ağırlığı 100 kg'ın üzerinde ise doz hesaplamasında 100 kg kullanılmalıdır (bkz. bölüm 6.6).
Bu tedavinin her bir dozunun uygulanmasından önce tam kan sayımı izlemi yapılmalıdır (bkz. bölüm 4.4).
Hastalar, infüzyon sırasında ve sonrasında izlenmelidir (bkz. bölüm 4.4). Doz ayarlamaları
Nötropeni
Eğer tedavi sırasında nötropeni gelişirse, bu durum dozlar ertelenerek giderilmelidir. Sırasıyla monoterapi ve kombinasyon terapisinde uygun doz uygulaması önerileri için aşağıda, Tablo 1 ve Tablo 2'ye bakınız (ayrıca bkz. bölüm 4.4).
Tablo 1: Monoterapi olarak nötropeni için doz uygulaması önerileri
Nötropeninin şiddet derecesi (belirti ve semptomlar [kısaltılmış CTCAEtanımı]) | Doz uygulaması programında düzenleme |
Derece 1 (<LLN - 1500/mm3 <LLN - 1,5 x 109/L) veya | Aynı doza ve doz programına devam edilir |
Derece 2 (<1500 - 1000/mm3 <1,5 – 1,0 x 109/L) | |
Derece 3 (<1,000 - 500/mm3 <1,0 - 0,5 x 109/L) veya | Toksisite ≤ Derece 2 olana veya başlangıçtaki düzeye dönene kadar |
Derece 4 (<500/mm3 <0,5 x 109/L) | dozlara ara verilir, ardından aynı doz ve program ile tedaviye kaldığı yerden devam edilir . |
| Derece 3 veya Derece 4 nötropeni gelişen hastalar için sonraki sikluslarda G-CSF veya GM-CSF verilmesi düşünülür. |
Tablo 2: Kombinasyon tedavisi sırasında nötropeni için doz önerileri
Nötropeni şiddeti derecesi (belirti ve semptomlar [kısaltılmış CTCAEtanımı]) | Doz uygulama programının değiştirilmesi |
Derece 1 (< LLN-1500/mm < LLN-1.5 x 10/L) veya Derece 2 (< 1500-1000/mm < 1.5-1.0 x 10/L) Derece 3 (< 1,000-500/mm < 1.0-0,5 x 10/L) veya Derece 4 (< 500/mm < 0,5 x 10/L) | Kombinasyon tedavisi alan tüm yetişkin hastalar için ilk dozdan başlayarak G-CSF ile primer profilaksi önerilir. Aynı doza ve doz programına devam edilir. |
Periferik nöropati
Eğer tedavi sırasında periferik duyusal veya motor nöropatiortaya çıkar yada kötüleşirse, sırasıyla monoterapi ve kombinasyon tedavisi için uygun doz uygulaması önerileri için aşağıda, Tablo 3 ve Tablo 4'e bakınız (bkz. bölüm 4.4).
Tablo 3: Monoterapide yeni veya kötüleşen periferik duyusal veya motor nöropati için doz uygulaması önerileri
Periferik duyusal veya motor nöropati şiddeti (işaretler ve semptomlar [kısaltılmış CTCAEa tanımı]) | Doz ve programda düzenleme |
Derece 1 (parestezi ve/veya refleks kaybı var, işlev kaybı yok) | Aynı doza ve programa devam edilir. |
Derece 2 (işlevleri engelliyor fakat günlük yaşam aktivitelerini etkilemiyor) | Toksisite ≤ Derece 1 olana veya başlangıçtaki düzeye dönene kadar dozlara ara verilir, ardından tedaviye 3 haftada bir 1,2 mg/kg (maksimum 120 mg) şeklinde azaltılmış doz ile devam edilir |
Derece 3 (günlük yaşam aktivitelerini etkiliyor) | Toksisite ≤ Derece 1 olana veya başlangıçtaki düzeye dönene kadar dozlara ara verilir, ardından tedaviye 3 haftada bir en fazla 120 mg olacak şekilde 1,2 mg/kg olarak azaltılmış doz ile devam edilir. |
Derece 4 (engelleyici duyusal nöropati veya hayatı tehdit edici ya da felce giden motor nöropati) | Tedavi kesilir |
Tablo 4: Kombinasyon tedavisi sırasında yeni veya kötüleşen periferik duyusal veya motor nöropati için doz önerileri
| AVD ile kombinasyon Tedavisi | CHP ile kombinasyon tedavisi |
Periferik duyusal veya motor nöropatinin şiddeti (belirti ve semptomlar [kısaltılmış CTCAEtanımı]) | Doz ve programda düzenleme | Doz ve programda düzenleme |
Derece 1 (parestezi ve / veya refleks kaybı var, işlev kaybı yok) | Aynı doz ve programla devam edilir. | Aynı doz ve programla devam edilir. |
Derece 2 (işlevleri engelliyor fakat | Doz 2 haftada bir | Duyusal nöropati: Aynı |
günlük yaşam aktivitelerini etkilemiyor) | maksimum 90 mg olacak şekilde 0,9 mg/kg'a kadar düşürülür. | doz seviyesinde tedaviye devam edilir. Motor nöropati: Doz her 3 haftada bir maksimum 120 mg olacak şekilde |
|
| 1,2 mg/kg'a düşürülür. |
Derece 3 (günlük yaşam | Toksisite ≤ Derece 2 | Duyusal nöropati: Doz |
aktivitelerini etkiliyor) | olana kadar ADCETRİS ile tedaviye ara verilir, | her 3 haftada bir maksimum 120 mg |
| daha sonra her 2 haftada bir maksimum 90 mg | olacak şekilde 1,2 mg/kg'a düşürülür. |
| olacak şekilde 0,9 mg/kg'a düşürülmüş bir dozda tedaviye yeniden | Motor nöropati: Tedavi kesilir. |
| başlanır. |
Derece 4 (engelleyici duyusal nöropati veya hayatı tehdit edici ya da felce giden motor nöropati) | Tedavi kesilir. | Tedavi kesilir. |
Uygulama şekli
Önerilen ADCETRİS dozu, 30 dakika süreyle infüzyon yoluyla uygulanır. Uygulama öncesinde bu tıbbi ürünün kullanıma hazırlanması ve seyreltilmesi ile ilgili talimatlar için bkz. bölüm 6.6.
ADCETRİS hızlı intravenöz infüzyon veya bolus şeklinde uygulanmamalıdır. ADCETRİS bu amaca tahsis edilmiş bir intravenöz hat yoluyla uygulanmalıdır ve diğer tıbbi ürünler ile karıştırılmamalıdır (bkz. bölüm 6.2).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Kombinasyon tedavisi
Böbrek yetmezliği olan hastalar advers olaylar açısından yakından izlenmelidir. Serum kreatinin seviyesinin ≥2,0 mg/dL veya kreatinin klerensi veya hesaplanan kreatinin klerensinin ≤40 mL/dakika olduğu böbrek yetmezliği olan hastalarda ADCETRİS ile kombinasyon kemoterapisine yönelik klinik çalışma deneyimi mevcut değildir. Şiddetli böbrek yetmezliği olan hastalarda ADCETRİS'in kemoterapi ile kombine kullanımından kaçınılmalıdır.
Karaciğer yetmezliği olan hastalar advers olaylar açısından yakından izlenmelidir. Hafif karaciğer yetmezliği olan ve ADCETRİS'i AVD ile birlikte kullanan hastalarda önerilen başlangıç dozu, 2 haftada bir 30 dakikasüreyle intravenöz infüzyonla verilen 0,9 mg/kg'dır. Hafif karaciğer yetmezliği olan ve ADCETRİS'i CHP ile birlikte kullanan hastalarda önerilen başlangıç dozu, 3 haftada bir 30 dakika süreyle intravenöz infüzyonla verilen 1,2 mg/kg'dır. Toplam biluribinin normal üst limit değerinin (ULN) 1,5 katından fazla olduğu (eğer Gilbert Sendromuna bağlı değilse) veya, aspartat aminotransferaz (AST) veya alanin aminotransferaz (ALT) değerleri normal üst limit değerinin (ULN) 3 katından fazla olduğu veya karaciğerdeki yükselen değerlerin HL varlığına bağlı olabileceği durumlarda normal üst limitdeğerinin (ULN) 5 katından fazla olduğu şiddetli karaciğer yetmezliği olan hastalarda ADCETRİS ile kombinasyon kemoterapisine yönelik klinik çalışma deneyimi mevcut değildir. Orta veya şiddetli karaciğer yetmezliği olan hastalarda ADCETRİS kemoterapi ile kombinasyon tedavisi şeklinde kullanılmamalıdır.
Monoterapi
Şiddetli böbrek yetmezliği olan hastalarda önerilen başlangıç dozu, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulanan 1,2 mg/kg'dır. Böbrek yetmezliği olan hastalar advers olaylar açısından yakından izlenmelidir (bkz. bölüm5.2).
Karaciğer yetmezliği olan hastalarda önerilen başlangıç dozu, 3 haftada bir 30 dakika süreyle intravenöz infüzyon şeklinde uygulanan 1,2 mg/kg'dır. Karaciğer yetmezliği olan hastalar advers olaylar açısından yakından izlenmelidir (bkz. bölüm5.2).
Pediyatrik popülasyon:
18 yaşın altındaki pediyatrik hastalarda ADCETRİS'in güvenlilik ve etkililiği henüz ispatlanmamıştır. Mevcut güncel veriler bölüm 4.8, 5.1 ve 5.2'de sunulmuştur ancak pozolojiye yönelik bir tavsiye verilememektedir.
Geriyatrik popülasyon:
65 yaş ve üzeri hastalar için önerilen doz yetişkinler ile aynıdır. Mevcut güncel veriler bölüm 4.8,
5.1 ve 5.2'de sunulmuştur.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Progresif multifokal lökoensefalopati
ADCETRİS ile tedavi edilen hastalarda John Cunningham Virüsü (JCV) reaktivasyonu sonucu progresif multifokal lökoensefalopati (PML) ve ölüm meydana gelebilir. Önceden çoklu kemoterapi rejimleri aldıktan sonra bu tedaviyi gören hastalarda PML bildirilmiştir. PML latent, JCV reaktivasyonu sonucu ortaya çıkan ve sıklıkla ölümle sonuçlanan, nadir, demiyelinizan bir santral sinir sistemi hastalığıdır.
Hastalar, PML'ye işaret edebilecek yeni veya kötüleşen nörolojik, bilişsel veya davranışsal belirtiler ve semptomlar açısından yakından izlenmelidir. Tüm şüpheli PML olgularında ADCETRİS doz uygulamaları durdurulmalıdır. PML değerlendirmesi için öneriler nöroloji konsültasyonunu, beyine yönelik gadolinyum bazlı kontrast manyetik rezonans görüntüleme incelemesini ve polimeraz zincir reaksiyonu yoluyla beyin-omurilik sıvısında JCV DNA analizini ya da JCV kanıtı için beyin biyopsisini içermektedir. JCV PCR'nin negatif olması PML olasılığını ekarte etmez. Şayet alternatif tanı koyulamıyorsa ek izlem ve değerlendirme gerekebilir. PML tanısı doğrulandığı takdirde ADCETRİS dozları kesilmeli ve bir daha başlanmamalıdır.
Hekim, özellikle, PML'ye işaret eden ve hastanın fark edemeyebileceği semptomlar konusunda dikkatli olmalıdır (örn., bilişsel, nörolojik veya psikiyatrik semptomlar).
Pankreatit
ADCETRİS ile tedavi edilen hastalarda akut pankreatit gözlenmiştir. Ölümle sonuçlanan vakalar
bildirilmiştir.
Hastalar, akut pankreatite işaret edebilecek yeni veya kötüleşen abdominal ağrı açısından yakından izlenmelidir. Hastanın değerlendirmesi fizik muayene, serum amilaz ve serum lipaza yönelik laboratuvar incelemesi ve ultrason gibi abdominal görüntüleme yöntemlerini ve diğer uygun tanısal yöntemleri içerebilir. Tümşüpheli akut pankreatit olgularında ADCETRİS'e ara verilmelidir. Akut pankreatit tanısı doğrulandığı takdirde ADCETRİS kesilmelidir.
Pulmoner toksisite
ADCETRİS alan hastalarda, bazıları ölümle sonuçlanan pnömonit, interstisyel akciğer hastalığı ve akut solunum distres sendromunu(ARDS) içeren pulmoner toksisite vakaları bildirilmiştir.
Brentuximab ile bir nedensellik ilişkisi kurulamamış ise de pulmoner toksisite riski göz ardı edilemez. Yeni pulmoner semptomların ortaya çıkması veya var olan semptomların kötüleşmesi durumunda (örn: öksürük, dispne) derhal bir tanı değerlendirmesi gerçekleştirilmeli ve hastalar uygun şekilde tedavi edilmelidir. Değerlendirme sırasında ve semptomlar iyileşene kadar ADCETRİS uygulanmasına ara verilmesi değerlendirilmelidir.
Ciddi enfeksiyonlar ve fırsatçı enfeksiyonlar
ADCETRİS ile tedavi edilen hastalarda pnömoni, stafilokokal bakteriyemi, sepsis/septik şok (ölümle sonuçlanan vakalar dahil) ve herpes zoster, sitomegalovirus (CMV) (reaktivasyon) gibi ciddi enfeksiyonlar ile Pneumocystis jiroveci pnömonisi ve oral kandidiyaz gibi fırsatçı enfeksiyonlar bildirilmiştir. Hastalar tedavi süresince olası ciddi ve fırsatçı enfeksiyonların ortaya çıkması açısından dikkatle izlenmelidir.
İnfüzyona bağlı reaksiyonlar
Ani ve gecikmiş infüzyona bağlı reaksiyonlar (İBR) ve ayrıca anafilaktik reaksiyonlar bildirilmiştir.
Hastalar infüzyon sırasında ve sonrasında dikkatle izlenmelidir. Anafilaktik reaksiyon oluşması durumunda ADCETRİS uygulaması derhal ve bir daha başlanmamak üzere kesilmeli ve uygun tıbbi tedavi başlatılmalıdır.
Eğer infüzyona bağlı reaksiyon ortaya çıkarsa, infüzyona ara verilmeli ve uygun tıbbi tedavi başlatılmalıdır. Semptom giderildikten sonra infüzyona daha düşük bir hızda tekrar başlanabilir. Önceden infüzyona bağlı bir reaksiyon yaşamış olan hastalara, müteakip infüzyonlar için ön ilaç tedavisi uygulanmalıdır. Ön ilaç tedavisi parasetamol, bir antihistaminik ve bir kortikosteroid içerebilir.
ADCETRİS'e karşı antikorları olan hastalarda infüzyona bağlı reaksiyonlar daha sık ve daha şiddetlidir (bkz. bölüm 4.8).
Tümör lizis sendromu
ADCETRİS ile ilişkili tümör lizis sendromu (TLS) bildirilmiştir. Hızlı büyüyen tümörü ve yüksek tümör yükü olan hastalar, tümör lizis sendromu açısından daha yüksek risk altındadır. Bu hastalar yakından izlenmeli ve en iyi tıbbi uygulamalar doğrultusunda tedavi uygulanmalıdır. TLS tedavisi agresif hidratasyon, renal fonksiyon izlemi, elektrolit anormalliklerinin düzeltilmesini, anti- hiperürisemik tedaviyi ve destekleyici bakımı içerebilir.
Periferik nöropati
ADCETRİS tedavisi hem duyusal hem de motorperiferik nöropatiye neden olabilir. ADCETRİS ile indüklenen periferik nöropati tipik olarak bu tıbbi ürünün kümülatif maruziyetinin bir etkisi olup, çoğu durumda geri dönüşümlüdür.
Klinik çalışmalarda, hastaların çoğunda, hastalığın semptomlarında gerileme veya iyileşme gözlenmiştir (bkz. bölüm 4.8). Hastalar hipoestezi, hiperestezi, parestezi, rahatsızlık, yanma hissi, nöropatik ağrı veya güçsüzlük gibi nöropati semptomları açısından izlenmelidir. Yeni veya kötüleşen periferik nöropati yaşayan hastalarda ADCETRİS dozunda erteleme ve azaltma veya tedavinin bırakılması gerekebilir (bkz. bölüm4.2).
Hematolojik toksisiteler
ADCETRİS ile Derece 3 veya Derece 4 anemi, trombositopeni ve uzun süreli (≥1 hafta) Derece 3 veya Derece 4 nötropeni görülebilir. Her dozun uygulanmasından önce tam kan sayımı izlemi yapılmalıdır. Derece 3 veya Derece 4 nötropeni gelişmesi durumunda, bkz. bölüm 4.2. Febril nötropeni ADCETRİS ile tedavi sonucu febril nötropeni bildirilmiştir (klinik veya mikrobiyolojik olarak belgelenmiş enfeksiyon yokluğunda , nötrofil sayısı <1,0 x 109/L, ateş ≥38,5°C ile birlikte kökeni bilinmeyen ateş; ref. CTCAE v3). Bu tedavinin her bir dozunun uygulanmasından önce tam kan sayımı izlemi yapılmalıdır. Hastalar, ateş açısından yakından izlenmelidir ve febril nötropeni geliştiği takdirde en iyi tıbbi uygulamalar doğrultusunda tedavi uygulanmalıdır.
AVD veya CHP ile kombinasyon tedavisinde ileri yaş febril nötropeni için bir risk faktörüdür. ADCETRİS, AVD veya CHP ile kombine olarak verildiğinde ilk dozdan itibaren başlayacak şekilde yaşa bakılmaksızın tüm yetişkin hastalara G-CSF ile primer profilaksisi önerilmektedir.
Şiddetli kutanöz advers reaksiyonlar (SCAR'lar)
ADCETRİS ile Stevens-Johnson sendromu (SJS), toksik epidermal nekroliz (TEN) ve eozinofili ve sistemik semptomlu ilaç reaksiyonları (DRESS) dahil olmak üzere şiddetli kutanöz advers reaksiyonlar (SCAR'lar) bildirilmiştir. SJS ve TEN için ölümle sonuçlanan vakalar bildirilmiştir. SJS, TEN veya DRESS ortaya çıkarsa, ADCETRİS tedavisi kesilmeli ve uygun tıbbi tedavi uygulanmalıdır.
Gastrointestinal komplikasyonlar
ADCETRİS ile tedavi edilen hastalarda, bazıları ölümle sonuçlanan bağırsak tıkanması, ileus, enterokolit, nötropenik kolit, erozyon, ülser, perforasyon ve hemoraji içeren gastrointestinal komplikasyonlar rapor edilmiştir. Yeni gastrointestinal semptomların ortaya çıkması veya var olanların kötüleşmesi durumunda derhal tanı değerlendirmesi yapılıp uygun tedavi gerçekleştirilmelidir.
Hepatotoksisite
ADCETRİS ile alanin aminotransferaz (ALT) ve aspartat aminotransferaz (AST) yükselmesi şeklinde hepatotoksisite rapor edilmiştir. Bazıları ölümle sonuçlanan ciddi hepatotoksisite vakaları da meydana gelmiştir. Önceden var olan karaciğer hastalığı, komorbiditeler ve eşzamanlı olarak kullanılan ilaçlar da bu riski artırabilir. Tedavi başlatılmadan önce karaciğer fonksiyon testi yapılmalı ve ADCETRİS alan hastalarda rutin olarak izlenmelidir. Hepatotoksisite yaşayan hastalarda dozun geciktirilmesi veya değiştirilmesi ya da ADCETRİS'in kesilmesi gerekebilir.
Hiperglisemi
Klinik çalışmalar sırasında diyabet öyküsü olan veya olmayan, yüksek vücut kitle indekslerine (VKİ) sahip hastalarda hiperglisemi bildirilmiştir. Ancak, bir hiperglisemi olayı yaşayan tüm hastalar serum
glukoz düzeylerini yakından takip ettirmelidir. Gerekli durumlarda anti- diyabetik tedavi
uygulanmalıdır.
İnfüzyon bölgesi ektravazasyonu
İntravenöz infüzyon esnasında ekstravazasyon meydana gelmiştir. Ekstravazasyon ihtimaline karşı, ilacın uygulanması sırasında infüzyon bölgesinde infiltrasyon olup olmadığının yakından izlenmesi tavsiye edilir.
Böbrek ve karaciğer yetmezliği
Böbrek ve karaciğer yetmezliği olan hastalar ile sınırlı deneyim mevcuttur. Eldeki veriler MMAE klirensinin şiddetli böbrek yetmezliği, karaciğer yetmezliği ve düşük serum albümin konsantrasyonlardan etkilenebileceğine işaret etmektedir (bkz. bölüm 5.2)
CD30+ CTCL
Mikozis fungoides (MF) ve primer kutanöz anaplastik büyük hücreli lenfoma (pcALCL) hariç CD30+ CTCL alt tiplerinde tedavi etkisinin boyutu, yüksek dereceli klinik kanıt bulunmadığından dolayı açık değildir. ADCETRİS ile gerçekleştirilen iki adet tek kollu faz II çalışmasında, Sézary sendromu (SS), lenfomatoid papüloz (LyP) ve mikstCTCL histolojik alt tiplerinde hastalık aktivitesi gösterilmiştir. Bu veriler, etkililik ve güvenliliğin diğer CTCL CD30+ alt tiplerine uyarlanabileceğini öne sürmektedir. Bununla birlikte ADCETRİS, diğer CD30+ CTCL hastalarında bireye dayalı potansiyel yarar-risk oranının dikkatli değerlendirilmesinden sonra dikkatli şekilde kullanılmalıdır (bkz. bölüm 5.1).
Yardımcı maddeler
Bu tıbbi ürün her “dozâ€unda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında “sodyum içermezâ€.
Takip edilebilirlik
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
CYP3A4 yoluyla metabolize olan tıbbi ürünler ile etkileşim (CYP3A4 inhibitörleri/indükleyicileri)
ADCETRİS'in kuvvetli bir CYP3A4 ve P-gp inhibitörü olan ketokonazol ile birlikte uygulanması sonucunda antimikrotübül ajan MMAE'ye maruziyet yaklaşık %73 artmıştır ve ADCETRİS'e plazma maruziyeti etkilenmemiştir. Dolayısıyla, ADCETRİS'in kuvvetli CYP3A4 ve P-gp inhibitörleri ile bir arada uygulanması, nötropeni insidansını artırabilir. Nötropeni geliştiği takdirde Tablo 1 ve Tablo 2'de yer alan nötropeni için doz uygulaması önerilerine başvurunuz (bkz. bölüm 4.2).
ADCETRİS'in kuvvetli bir CYP3A4 indükleyicisi olan rifampisin ile birlikte uygulanması, ADCETRİS'e plazma maruziyetini etkilememiştir. Farmakokinetik veriler sınırlı da olsa, rifampisin
ile birlikte kullanımının, test edilebilen MMAE metabolitlerinin plazma konsantrasyonlarını düşürdüğü görülmüştür.
Bir CYP3A4 substratı olan midazolamın ADCETRİS ile birlikte uygulanması, midazolam metabolizmasını değiştirmemiştir; dolayısıyla, ADCETRİS'in, CYP3A4 enzimleri tarafından metabolize olan ilaçlara maruziyeti değiştirmesi beklenmez.
Doksorubisin, vinblastin ve dakarbazin (AVD)
Brentuximab vedotinin AVD ile kombinasyon şeklinde uygulanmasını takiben antikor ilaç konjugatı (ADC; antibody drug conjugate) ve MMAE'nin sırasıyla serum ve plazma farmakokinetik özellikleri monoterapinin farmakokinetik özelliklerine benzerdir.
Brentuximab vedotin ile eş zamanlı olarak verilmesi AVD'nin plazma seviyelerini etkilememiştir. Siklofosfamid, Doksorubisin ve Prednizon (CHP)
CHP ile birlikte brentuximab vedotinin uygulanmasını takiben, sırasıyla ADC ve MMAE'nin serum ve plazma farmakokinetik özellikleri, monoterapideki ile benzerdir.
Eş zamanlı brentuximab vedotin uygulamasının CHP maruziyetini etkilemesi beklenmemektedir.
Bleomisin
Brentuximab vedotin ve bleomisin (B) ile formal ilaç-ilaç etkileşim çalışmaları yapılmamıştır. Bir faz I doz belirleme ve güvenlilik çalışmasında (SGN35-009) brentuximab vedotin artı ABVD ile tedavi edilen 25 hastadan 11'inde (%44) kabul edilemez pulmoner toksisite (2 fatal olay dahil) gözlemlenmiştir. Brentuximab vedotin artı AVD ile pulmoner toksisite ya da fatal olay bildirilmemiştir. Dolayısıyla ADCETRİS ile bleomisinin eş zamanlı kullanılması kontrendikedir (bakınız bölüm 4.3).
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Gebe kalma potansiyeli olan kadınlar ADCETRİS tedavisi sırasında ve tedaviden sonra 6 aya kadar iki adet etkili kontraseptif yöntem kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda ADCETRİS kullanımına ilişkin veri bulunmamaktadır. Hayvanlar ile yürütülen çalışmalar üreme toksisitesi göstermiştir (bkz. bölüm 5.3).
ADCETRİS, anneye olan fayda fetüse olan potansiyel riske ağır basmadığı sürece gebelik süresince kullanılma malıdır. Eğer gebe bir kadının tedavi edilmesi gerekli ise, anne adayı fetüs üzerindeki potansiyel risk konusunda açıkça bilgilendirilmelidir.
ADCETRİS ile tedavi gören erkek partnerinden çocuk sahibi olmak isteyen kadınlara ilişkin tavsiyeler için aşağıdaki üreme yeteneği/fertilite bölümüne bakınız.
Laktasyon dönemi
ADCETRİS/metabolitlerinin hayvan veya insan sütüyle atılımına ilişkin yeterli bilgi
bulunmamaktadır.
Emzirilen bebekler için risk olasılık dışı bırakılamamaktadır.
Emzirmenin bebeğe olan potansiyel riski ve tedavinin anneye olan faydası göz önünde bulundurularak emzirmenin sona erdirilip erdirilmeyeceği veya ADCETRİS tedavisinin sona erdirilip erdirilmeyeceği/ tedaviden kaçınılıp kaçınılmayacağı yönünde bir karar verilmelidir.
Üreme yeteneği /Fertilite
Klinik dışı çalışmalara göre ADCETRİS tedavisi, testiküler toksisite ile sonuçlanabilir ve erkek fertilitesini değiştirebilir. MMAE'nin anöjenik özellikleri olduğu gösterilmiştir (bkz. bölüm 5.3). Bu nedenle, bu ilaç ile tedavi edilen erkeklerin tedaviden önce spermlerinin dondurulması ve saklanması önerilmektedir. Bu ilaç ile tedavi edilen erkeklerin tedavi süresinde ve son dozdan itibaren 6 aya kadar çocuk sahibi olmamaları tavsiye edilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
ADCETRİS'in araç ve makine kullanma becerisi üzerinde orta derecede etkileri olabilir (örn: baş dönmesi). Bkz: bölüm 4.8.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
ADCETRİS'in güvenlilik profili mevcut klinik çalışma verilerine, Tanımlı Hasta Programına (THP) ve günümüze kadar edinilmiş olan pazarlama sonrası deneyime dayanmaktadır. Aşağıda ve Tablo 5'te tanımlanan advers reaksiyonların sıklıkları, klinik çalışmalarda elde edilen verilere dayalı olarak belirlenmiştir.
Monoterapi
HL, sALCL ve CTCL çalışmalarında (SG035-0003, SG035-0004, SGN35-005, SGN35-006,
C25001, C25006 ve C25007, bkz. bölüm 5.1) monoterapi olarak ADCETRİS'in havuzlanmış veri
setinde en sık görülen advers olaylar (≥ %10) enfeksiyonlar, periferik duyusal nöropati, bulantı, bitkinlik, diyare, pireksi, nötropeni, üst solunum yolu enfeksiyonu, artralji, döküntü, öksürük, kusma, pirürit, periferik motor nöropati, infüzyona bağlı reaksiyonlar, konstipasyon, dispne, miyalji kilo kaybı ve abdominal ağrı olmuştur.
Ciddi advers reaksiyonlar hastaların %12'sinde gözlendi. Nadir görülen ciddi advers ilaç reaksiyonlarının sıklığı < %1'dir.
Advers olaylar ADCETRİS alan hastaların %24'ünün tedaviyi bırakmasına neden oldu.
ADCETRİS (SGN35-006, bkz. bölüm 5.1) ile tekrar tedavi edilen hastalardaki güvenlilik verileri, daha yüksek görülme sıklığına sahip (pivotal faz 2 çalışmalarında %28 vs. %9) ve esas olarak derece 2 olan periferik motor nöropati hariç kombine edilmiş pivotal faz 2 çalışmalarında gözlemlenenler ile tutarlı olmuştur. Ayrıca bu hastalarda artralji, derece 3 anemi ve sırt ağrısı, kombine edilmiş pivotal faz 2 çalışmalarda gözlenen hastalara kıyasla daha sık görülmüştür.
Önerilen doz olan üç haftada bir 1,8 mg/kg ile tedavi edilen, otolog kök hücre nakli yapılmamış nükseden veya tedaviye dirençli HL hastalarındaki güvenlik profili, tek kollu bir faz 4 çalışmada (n=60), faz 1 doz eskalasyon ve klinik farmakaloji çalışmalarında (n=15 hasta) ve Tanımlı Hasta Programında (THP) (n=26) (bkz. bölüm 5.1), pivotal klinik çalışmalardaki güvenlilik profili ile tutarlıdır.
Kombinasyon tedavisi
ADCETRİS ile kombine verilen kemoterapi ilaçları (doksorubisin, vinblastin ve dakarbazin (AVD) veya siklofosfamid, doksorubisin ve prednizon (CHP)) hakkında güvenlilik bilgileri için bu ürünlerin kısa ürün bilgilerine başvurunuz.
Daha önce tedavi edilmemiş ilerlemiş HL (C25003) görülen 662 hastada ve daha önce tedavi edilmemiş CD30+ PTCL (SGN35-014) görülen 223 hastada kombinasyon tedavisi olarak ADCETRİS'in uygulandığı çalışmalarda, en yaygın advers reaksiyonlar (≥% 10) şunlar olmuştur: enfeksiyonlar, nötropeni, periferik duyusal nöropati, bulantı, kabızlık, kusma, ishal, yorgunluk, pireksi, alopesi, anemi, kilo kaybı, stomatit, febril nötropeni, karın ağrısı, iştah azalması, insomnia, kemik ağrısı, döküntü, öksürük, dispne, artralji, miyalji, sırt ağrısı, periferik motor nöropati, üst solunum yolu enfeksiyonu ve baş dönmesi.
ADCETRİS kombinasyon tedavisi alan hastalarda ciddi advers reaksiyonlar hastaların %34'ünde gelişmiştir. Hastaların ≥ %3'ünde oluşan ciddi advers reaksiyonlar arasında febril nötropeni (%15), ateş (%5) ve nötropeni (%3) vardır.
Advers olaylar hastaların %10'unda tedavinin bırakılmasına neden olmuştur. Hastaların ≥%2'sinde tedavinin bırakılmasına yol açan advers olaylar arasında periferik duyusal nöropati ve periferik nöropati vardır.
Advers reaksiyonların tablo halinde listesi
ADCETRİS için advers reaksiyonlar MedDRA Sistem Organ Sınıflaması ve Tercih Edilen Terimler'e göre listelenmiştir. Her bir sistem organ sınıfı içerisinde advers reaksiyonlar sıklık kategorilerine göre listelenmiştir: Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila 1/100); seyrek (≥1/10.000 ila 1/1.000); çok seyrek (≤1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık grubundaki advers reaksiyonlar, en ciddiden en hafife doğru sıralanmıştır.
Tablo 5: ADCETRİS için advers reaksiyonlar
Sistem organ sınıfı | Advers reaksiyonlar (monoterapi) | Advers reaksiyonlar (kombinasyon tedavisi) |
Enfeksiyonlar ve enfestasyonlar |
| |
Çok yaygın: | Enfeksiyon, üst solunum yolu enfeksiyonu | Enfeksiyon, üst solunum yolu enfeksiyonu |
Yaygın: | Herpes zoster, pnömoni, herpes simplex, oralkandidiyaz | Pnömoni, oral kandidiyaz, sepsis/septik şok, herpes zoster |
Yaygın olmayan: | Pneumocystis jiroveci pnömonisi, stafilokokal bakteriyemi, sitomegalovirüs enfeksiyonu veya reaktivasyonu, sepsis/septik şok | Herpes simplex, Pneumocystis jiroveci pnömonisi |
Bilinmiyor: | Progresif multifokal lökoensefalopati |
|
Kan ve lenf sistemi hastalıkları | ||
Çok yaygın: | Nötropeni | Nötropeni, anemi, febril nötropeni |
Yaygın: | Anemi, trombositopeni | Trombositopeni |
Yaygın olmayan: | Febril nötropeni |
|
Bağışıklık sistemi hastalıkları | ||
Yaygın olmayan: | Anafilaktik reaksiyon | Anafilaktik reaksiyon |
Metabolizma ve beslenme bozuklukları | ||
Çok yaygın |
| İştahta azalma |
Yaygın | Hiperglisemi | Hiperglisemi |
Yaygın olmayan: | Tümör lizis sendromu | Tümör lizis sendromu |
Psikiyatrik hastalıklar | ||
Çok yaygın |
| İnsomnia |
Sinir sistemi hastalıkları | ||
Çok yaygın: | Periferik duyusal nöropati, periferik motor nöropatisi | Periferik duyusal nöropati, periferik motor nöropatisi, sersemlik |
Yaygın: | Sersemlik |
|
Yaygın olmayan: | Demiyelinizan polinöropati |
|
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | ||
Çok yaygın: | Öksürük, dispne | Öksürük, dispne |
Gastrointestinal hastalıklar |
|
|
Çok yaygın: | Bulantı, diyare, kusma, konstipasyon, abdominal ağrı | Bulantı, konstipasyon, kusma, diyare, abdominal ağrı, stomatit |
Yaygın olmayan: | Akut pankreatit | Akut pankreatit |
Hepatobiliyer hastalıklar | ||
Yaygın: | Alanin aminotransferaz/aspartat aminotransferaz (ALT/AST) artışı | Alanin aminotransferaz/aspartat aminotransferaz (ALT/AST) artışı |
Deri ve deri altı doku hastalıkları | ||
Çok yaygın: | Döküntü, pirürit | Alopesi, döküntü |
Yaygın: | Alopesi | Pirürit |
Yaygın olmayan: | Stevens-Johnson sendromu/toksik epidermal nekroliz | Stevens-Johnson sendromu |
Bilinmiyor: | Eozinofili ve sistemik semptomlu ilaç reaksiyonları (DRESS) |
|
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | ||
Çok yaygın: | Artralji, miyalji | Kemik ağrısı, artralji, miyalji, sırt ağrısı |
Yaygın: | Sırt ağrısı |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ||
Çok yaygın: | Yorgunluk, pireksi, infüzyona bağlı reaksiyonlara | Yorgunluk, pireksi |
Yaygın: | Titreme | İnfüzyona bağlı reaksiyonlara, titreme |
Bilinmiyor: | İnfüzyon bölgesi ekstravazasyonu |
|
Araştırmalar | ||
Çok yaygın: | Kilo kaybı | Kilo kaybı |
aOrtak tercih edilen terminolojiyi temsil eder.
bToksik epidermal nekroliz, kombinasyon tedavisinde rapor edilmemiştir.
c Ekstravazasyonla ilgili reaksiyonlara infüzyon bölgesinde deride kızarıklık, ağrı, şişme, kabarcıklanma, pul pul dökülme ve selülit dahildir.
Seçili advers olayların tanımı
Nötropeni ve febril nötropeni
Monoterapi
Klinik çalışmalarda, nötropeni hastaların %13'ünde doz ertelemelerine neden olmuştur. Derece 3 nötropeni hastalarının %13'ünde ve derece 4 nötropeni hastalarının %5'inde görülmüştür. 1 hastada dozun azaltılması ve 1 hastada nötropeni tedavisinin bırakılması gerekmiştir.
Bu tedavi ile şiddetli ve uzun süreli (≥1 hafta) nötropeni ortaya çıkabilir ve bu da hastalarda ciddi enfeksiyonların gelişme riskini artırır. Febril nötropeni hastaların <%1'inde rapor edilmiştir (bkz. bölüm 4.2).
Pivotal faz 2 popülasyonunda (SG035-0003 ve SG035-0004), Derece 3 veya Derece 4 nötropeninin medyan süresi sınırlıdır (1 hafta); hastaların %2'sinde ≥ 7 gün süren Derece 4 nötropeni görülmüştür. Pivotal faz 2 popülasyonunda Derece 3 veya Derece 4 nötropenisi olan hastaların yarısından azında zamansal ilişkili enfeksiyonlar belirtilmiş ve zamansal ilişkili enfeksiyonların büyük kısmı Derece 1 veya Derece 2 olmuştur.
Kombinasyon tedavisi
Kombinasyon tedavisi olarak ADCETRİS ile yapılan klinik çalışmalarda nötropeni, hastaların
%19'unda dozun verilmesinde gecikmelere yol açmıştır. Derece 3 nötropeni, hastaların %17'sinde bildirilirken Derece 4 nötropeni, hastaların %41'inde bildirilmiştir. Hastaların yüzde ikisinde dozun azaltılması gerekmiştir ve <%1'i nötropeni nedeniyle bir ya da daha fazla çalışma ilacını bırakmıştır.
Febril nötropeni G-CSF ile primer profilaksi almayan hastaların %20'sinde bildirilmiştir (bakınız bölüm 4.2). G-CSF ile primer profilaksi alan hastalarda febril nötropeni sıklığı %13 olarak bildirilmiştir.
Ciddi enfeksiyonlar ve fırsatçı enfeksiyonlar
Monoterapi
Klinik çalışmalarda hastaların %10'unda ciddi ve fırsatçı enfeksiyonlar görülmüştür, hastaların
%1'inden azında sepsis ve septik şok görülmüştür. En sık bildirilen fırsatçı enfeksiyonlar herpes zoster ve herpes simplex olmuştur.
Kombinasyon tedavisi
Kombinasyon tedavisi olarak ADCETRİS ile yapılan klinik çalışmalarda fırsatçı enfeksiyonlar dâhil ciddi enfeksiyonlar hastaların %15'inde görülmüştür; sepsis, nötropenik sepsis, septik şok ya da bakteriyemi hastaların %4'ünde görülmüştür. En sık bildirilen fırsatçı enfeksiyonlar Herpes virüs enfeksiyonlarıdır.
Periferik nöropati
Monoterapi
Klinik çalışmalarda popülasyonun %57'sinda tedavi sırasında gelişen nöropati ve %13'ünde periferik motor nöropati ortaya çıkmıştır. Periferik nöropati hastaların %15'inde tedaviyi bırakmaya, %15'inde
doz azaltılmasına ve %16'sınde doz ertelemesine neden olmuştur. Periferik nöropati görülen hastalarda periferik nöropatinin ilk başladığı tarihten itibaren geçen medyan süre 12 haftadır.Periferik nöropatiye bağlı olarak tedaviyi bırakan hastalar için medyan süre 11 siklus olarak rapor edilmiştir.
Pivotal faz 2 (SG035-0003 ve SG035-0004) çalışmalarında ve randomize faz 3 monoterapi çalışmalarında (SGN35-005 ve C25001) periferik nöropati deneyimleyen hastalar arasında tedavi sonu ile son değerlendirme arasındaki medyan süre yaklaşık 48,9 hafta ile 98 haftadır. Son değerlendirmenin yapıldığı zamanda periferik nöropati deneyimleyen hastaların çoğunda (%82-85) periferik nöropati semptomlarında iyileşme ya da düzelme olmuştur. Tüm olaylarda iyileşme ya da düzelmenin ilk başladığı tarihten itibaren geçen medyan süre 16 hafta ile 23,4 hafta arasındadır.
ADCETRİS ile yeniden tedavi gören, nükseden ve tedaviye dirençli klasik Hodgkin lenfoma ve sistemik anaplastik büyük hücreli lenfoma hastalarında (SGN35-006), son değerlendirmede hastaların çoğunluğunda (%80) periferik nöropati semptomlarında gerileme veya iyileşme gözlenmiştir.
Kombinasyon tedavisi
AVD ile kombinasyon tedavisi olarak ADCETRİS ile yapılan klinik çalışmada tedavi ile ortaya çıkan nöropati popülasyonun %67'sinde görülmüştür; periferik motor nöropati hastaların %11'inde gelişmiştir. Periferik nöropati hastaların %7'sinde tedavinin bırakılmasına, %21'inde dozun azaltılmasına ve hastaların %1'inde dozun ertelenmesine yol açmıştır. Periferik nöropati gelişen hastalarda periferik nöropatinin başlamasına kadar geçen ortanca süre 8 haftadır. Periferik nöropatiye bağlı olarak tedaviyi bırakan hastalar bir ya da daha fazla ilaç kesilmeden önce ortanca 8 doz ADCETRİS+AVD(A+AVD) almıştır.
Periferik nöropati gelişen hastalarda tedavinin sonlanmasında son değerlendirmeye kadar geçen ortanca takip süresi 91 haftadır. Son değerlendirme sırasında hastaların çoğunluğunda (%76) periferik nöropati düzelmiş ya da semptomlarında iyileşme olmuştur. Başlangıcından periferik nöropati olaylarının düzelmesine ya da iyileşme göstermesine kadar geçen medyan süre 10 hafta olmuştur (0 hafta ile 139 hafta arasında değişmiştir).
CHP ile kombinasyon tedavisi olarak ADCETRİS'in uygulandığı klinik çalışmada, popülasyonun
%52'sinde tedaviyle ortaya çıkan nöropati görülürken hastaların %9'unda periferik motor nöropati izlenmiştir. Periferik nöropati hastaların %1'inde tedavinin kesilmesine, hastaların %7'sinde dozun azaltılmasına ve hastaların <% 1'inde doz gecikmelerine yol açmıştır.
Periferik nöropati görülen hastalarda medyan başlangıç süresi 9,1 hafta olarak bulunmuştur. Periferik nöropati nedeniyle tedavinin kesildiği hastalar, bir veya daha fazla ajanın kesilmesinden önce medyan 5 doz ADCETRİS + CHP (A+CHP) almıştır.
Periferik nöropati görülen hastalar arasında tedavinin bitiminden son değerlendirmeye kadar medyan takip süresi yaklaşık 177 hafta olmuştur. Son değerlendirme sırasında, periferik nöropati görülen hastaların % 64'ünde periferik nöropati semptomları düzelmiş veya iyileşme göstermiştir. Periferik nöropati olaylarının başlangıcından olayların düzelmesine veya iyileşmesine kadar geçen medyan süre 19,0 hafta (0 hafta ile 205 hafta arasında değişmiştir) olmuştur.
İnfüzyona bağlı reaksiyonlar
Monoterapi
Hastaların %12'sinde baş ağrısı, döküntü, sırt ağrısı, kusma, titreme, bulantı, dispne, kaşıntı ve öksürük gibi infüzyona bağlı reaksiyonlar bildirilmiştir.
Anafilaktik reaksiyonlar bildirilmiştir (bkz. bölüm 4.4). Bir anafilaktik reaksiyonun semptomları, bunlarla sınırlı olmamak üzere ürtiker, anjiyoödem, hipotansiyon ve bronkospazmı içerir.
Kombinasyon tedavisi
Baş ağrısı, döküntü, sırt ağrısı, kusma, titremeler, bulantı, dispne, kaşıntı, öksürük, infüzyon yerinde ağrı ve ateş gibi IRR'ler hastaların %8'inde bildirilmiştir. Anafilaktik reaksiyonlar bildirilmiştir (bakınız bölüm 4.4). Anafilaktik reaksiyon semptomları arasında bunlarla kısıtlı olmamakla birlikte ürtiker, anjiyoödem, hipotansiyon ve bronkospazm vardır.
İmmünojenisite
Klinik çalışmalarda, hastalar periyodik olarak duyarlı bir elektrokemiluminesan immunoassay yöntemi kullanarak ADCETRİS antikorları açısından test edildi. Anlık olarak pozitif veya negatif test sonuçları elde edilen hastalarla kıyaslandığında ADCETRİS antikorları ile tedavi gören hastalarda infüzyona bağlı reaksiyonlarda yüksek insidans görülmüştür.
ADCETRİS antikorlarının varlığı, serum ADCETRİS düzeylerinde klinik açıdan anlamlı azalmalar ile korelasyon göstermemiştir ve ADCETRİS'in etkililiğinde azalmaya neden olmamıştır. ADCETRİS'e yönelik antikorların varlığı, kesin olarak bir infüzyona bağlı reaksiyonun gelişimini öngörmezken; geçici olarak pozitif anti ilaç antikorları (AİA) olan hastalarla ve hiçbir zaman AİA pozitif olmayan hastalarla karşılaştırıldığında , sürekli pozitif anti ilaç antikorları olan hastalarda infüzyona bağlı reaksiyonların insidansı daha yükse k olmuştur.
Monoterapi Çalışması C25002
AİA pozitif olduğu teyit edilen pediyatrik hastalarda ADCETRİS'in klirensinde artma trendi görülmüştür. 12 yaşından küçük hiçbir hastada (11 hastanın 0'ı) ve 12 yaş ve üzerinde olan hastaların 2'sinde (23 hastanın 2'si) AİA sürekli pozitif olmuştur.
Kombinasyon Kullanım Çalışması C25004
Çalışma C25004'de AİA pozitiflik oranı düşük olup; 59 hastadan (12 yaş ve üzeri) 4 hasta geçici olarak AİA pozitif olmuş ve hiçbir hasta kalıcı olarak AİA pozitif olmamıştır. Geçici AİA pozitif hastaların sayısının azlığı nedeniyle AİA'nın etkililik üzerindeki etkisi sonuçsuzdur.
Pediyatrik popülasyon
Monoterapi Çalışması C25002
Güvenlilik nükseden veya tedaviye dirençli Hodgkin lenfoma ve sALCL olan 7-17 yaş aralığındaki pediyatrik hastalarda (n=36) faz 1/2 çalışması ile değerlendirilmiştir (bkz. Bölüm 5.1.). Bu çalışmadaki 36 hastada herhangi bir yeni güvenlik şüphesi rapor edilmemiştir.
Kombinasyon Kullanım Çalışması C25004
Önceden tedavi edilmemiş ileri evre klasik CD30+ HL'lı 6-17 yaş arası 59 pediyatrik hastada
kemoterapi ile kombinasyon halinde açık etiketli, çok merkezli bir çalışmada güvenlilik değerlendirilmiştir (Bkz bölüm 5.1). Bu çalışmada herhangi bir yeni güvenlilik endişesi bildirilmemiştir. Bu çalışmada bildirilen en yaygın ciddi advers reaksiyon febril nötropenidir (%17). G-CSF profilaksisinin doktorun tercihine bağlı olduğu düşünülmüştür. Periferik nötropati olayları (Standardize MedDRA sorgusuna göre), bu çalışmadaki pediyatrik hastaların %24'ünde bildirilmiştir.
Geriyatrik popülasyon
Monoterapi
Yaşlı hastalardaki güvenlilik profili erişkin hastalardaki profille uyumludur. Ancak yaşlı hastalar pnömoni, nötropeni ve febril nötropeni gibi olaylara daha fazla duyarlı olabilir.
Kombinasyon tedavisi
Yaşlı hastalarda (≥ 60 yaş; n = 186 [%21]), advers olayların sıklığı tedavi kolları arasında benzerdir. Genel çalışma popülasyonu ile karşılaştırıldığında yaşlı hastalarda daha ciddi advers olaylar ve doz değişiklikleri (doz ertelemeleri, azaltmaları ve bırakılması dâhil) bildirilmiştir. İleri yaş her iki kolda febril nötropeni için bir risk faktörü olmuştur. G-CSF primer profilaksisi alan yaşlı hastalarda G- CSF primer profilaksisi almayanlara göre nötropeni ve febril nötropeni sıklığı daha düşük olmuştur.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenme sine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr ; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
ADCETRİS doz aşımı için bilinen bir antidot yoktur. Doz aşımı durumunda hastalar başta nötropeni olmak üzere advers reaksiyonlara karşı yakından izlenmelidir ve destekleyici tedavi uygulanmalıdır (bkz. bölüm 4.4).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar; monoklonal antikorlar ve antikor ilaç konjugatları ATC kodu: L01FX05
Etki mekanizması
ADCETRİS, bir antineoplastik ajan veren antikor ilaç konjügatıdır (ADC); bu antineoplastik ajan, CD30 eksprese eden tümör hücrelerinde selektif olarak apoptotik hücre ölümüne neden olur. Klinik dışı veriler, ADCETRİS'in biyolojik aktivitesinin çok adımlı bir süreçle meydana geldiğini göstermektedir. ADC'nin hücre yüzeyinde CD30'a bağlanması, ADC-CD30 kompleksinin internalizasyonunu başlatır, bu daha sonra lizozomal kompartmana iletilir. Hücre içinde tanımlanmış tek aktif parça olan MMAE, proteolitik ayrılma ile salınır. MMAE'nin tübüline bağlanması, hücre içindeki mikrotübül ağını bozar, hücre döngüsünün durmasını indükler ve CD30 eksprese eden tümör hücrelerin apoptotik hücre ölümüne neden olur.
Klasik Hodgkin lenfoma, sistemik anaplastik büyük hücreli lenfoma vekütanöz t hücreli lenfomaların alttürleri [Mikozis fungoides (MF) ve primer kutanöz anaplastik büyük hücreli lenfoma (pcALCL) dahil] CD30'u antijen olarak malign hücrelerinin yüzeyinde eksprese ederler. Bu ekspresyon hastalığın evresinden, tedavinin basamağından ve nakil durumundan bağımsızdır. Bu özellikler CD30'u terapötik müdahale için hedef kılar. CD30 hedefli etki mekanizması nedeniyle ADCETRİS, kemo-direnci aşabilir çünkü çoklu ajanlı kemoterapiye dirençli olan hastalarda CD30, önceki nakil durumu fark etmeksizin sürekli olarak eksprese olur. ADCETRİS'in CD30 hedefli mekanizması, klasik Hodgkin lenfoma, sistemik anaplastik büyük hücreli lenfoma ve CD30+ kütanöz T hücreli lenfomalarda CD30'un tutarlı ekspresyonu, tedavi spektrumları ve CD30 pozitif malignitelerdeki çoklu tedavi serilerini takip eden klinik bulgular, ADCETRİS'in otolog kök hücre transplantı olsun veya olmasın nükseden veya tedaviye dirençli klasik HL'de, sALCL'de ve CD30 + CTCL hastalarında en az 1 seri sistemik tedavi sonrası kullanımına yönelik biyolojik kanıt sağlar.
Etki mekanizmasına diğer antikorlarla ilişkili fonksiyonların katkısı dışlanmamıştır. Farmakodinamik etkiler
Kardiyak elektrofizyoloji
Faz 1, tek kollu, açık etiketli, çok merkezli kardiyak güvenlilik çalışması kapsamında 3 haftada bir 1,8 mg/kg ADCETRİS ile tedavi edilen 52 hastadan CD30 eksprese eden hematolojik maligniteleri olan kırk altı (46) hasta değerlendirilmiştir. Birincil amaç, ADCETRİS'in kardiyak ventriküler re- polarizasyon üzerindeki etkisi değerlendirmek olmuş ve önceden tanımlanmış olan birincil analiz, QTc değerinde başlangıçtan, 1. siklustaki çoklu zaman noktaları arasında değişikliği içermiştir.
QTc üzerindeki etkinin üst %90 güven aralığı (GA) Siklus 1 ve Siklus 3 başlangıç sonrası zaman noktalarının her biri için <10 milisaniye olmuştur. Bu veriler, CD30 eksprese eden maligniteleri olan hastalarda 3 haftada bir 1,8 mg/kg dozunda uygulanan ADCETRİS'e bağlı olarak klinik olarak anlamlı QT uzamasının olmadığına işaret etmektedir.
Klinik etkililik ve güvenlilik
Hodgkin lenfoma
Çalışma C25003
ADCETRİS'in kemoterapi ile kombinasyonunun (doksorubisin [A], vinblastin [V] ve dakarbazin [D] [AVD]) etkililiği ve güvenliliği daha önce tedavi görmemiş 1334 ileri evre HL hastasında randomize, açık etiketli, 2 kollu, çok merkezli bir çalışmada değerlendirilmiştir. Tüm hastalarda histolojik olarak doğrulanmış CD30 eksprese eden hastalık bulunmaktadır. Hastaların yüzde altmış ikisinde ekstranodal tutulum saptanmıştır. 1334 hastadan 664'ü ADCETRİS + AVD koluna ve 670 hasta ABVD (doksorubisin [A], bleomisin [B], vinblastin [V] ve dakarbazin [D]) koluna randomize edilmiş ve Uluslararası Prognostik Faktör Projesi (IPFP) risk faktörleri ve bölgeye göre katmanlara ayrılmıştı. Hastalar her 28 günlük kürün 1. ve 15. Gününde 30 dakikalık intravenöz infüzyonla 1,2 mg/kg ADCETRİS + doksorubisin 25 mg/m², vinblastin 6 mg/m²ve dakarbazin 375 mg/m²almıştır. Alınan ortanca kür sayısı altıdır (aralık: 1 - 6 kür). Tablo 6 başlangıçtaki hasta ve hastalık özelliklerini vermektedir. İki kol arasında hasta ve hastalık özellikleri açısından anlamlı farklar bulunmamaktadır.
Tablo 6: Faz 3 daha önce tedavi edilmemiş HL çalışmasında başlangıçtaki hasta ve hastalık özelliklerinin özeti
Hasta özellikleri | ADCETRİS + AVD n = 664 | ABVD n = 670 |
Ortanca yaş (aralık) | 35 yaş (18-82) | 37 yaş (18-83) |
≥ 65 yaş hastalar n (%) | 60 (9) | 62 (9) |
Cinsiyet, n (%) | 378E (57) 286K (43) | 398E (59) 272K (41) |
ECOG durumu, n (%) |
|
|
0 | 376 (57) | 378 (57) |
1 | 260 (39) | 263 (39) |
2 | 28 (4) | 27 (4) |
Eksik | 0 | 2 |
Hastalık Özellikleri |
|
|
HL tanısından ilk doza ortanca zaman (aralık) | 0,92 ay (0,1-21,4) | 0,89 ay (0,0-81.4) |
İlk HL tanısı konulduğu sırada hastalık evresi, n (%) |
|
|
III | 237 (36) | 246 (37) |
IV | 425 (64) | 421 (63) |
Geçerli değil | 1 (< 1) | 1 (< 1) |
Eksik | 0 | 2 (<1 ) |
Tanı konulduğu sırada ekstranodal tutulum, n (%) | 411 (62) | 416 (62) |
IPFPrisk faktörleri, n (%) |
|
|
0-1 | 141 (21) | 141 (21) |
2-3 | 354 (53) | 351 (52) |
4-7 | 169 (25) | 178 (27) |
Tanı konulduğu sırada ya da çalışmaya girişte kemik iliği tutulumu, n (%) | 147(22) | 151 (23) |
B semptomlarıa n (%) | 400 (60) | 381 (57) |
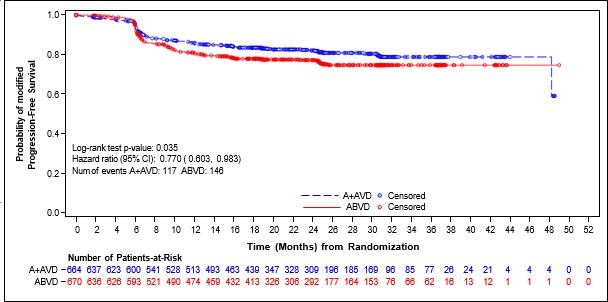
Randomizasyondan hastalık progresyonuna, ölüme ya da bağımsız inceleme kuruluşu(IRF) değerlendirmesine göre birinci basamak tedaviden sonra tam olmayan yanıt (TY dışı) bulgularına ve takip eden kanser tedavisine kadar geçen zaman olarak tanımlanan, modifiye PFS (mPFS) C25003 çalışmasında birincil sonlanım noktasıdır. Modifiye olayın zamanlaması birinci basamak tedavinin tamamlanmasından sonra Deauville skoru ≥3 olarak tanımlanan tam yanıtın (TY) yokluğunu gösteren ilk PET incelemesidir. IRF değerlendirmesine göre medyan modifiye PFS'ye iki kolda da ulaşılmamıştır. Tedavi amaçlanan popülasyondaki (ITT) bulgular ADCETRİS+AVD için modifiye PFS'de istatistiksel olarak anlamlı iyileşme olduğunu göstermiştir ve katmanlı tehlike oranı 0,770 (%95 GA, 0,603; 0,983, p = 0,035) olarak belirlenmiş olup ABVD ile karşılaştırıldığında
ADCETRİS+AVD için modifiye PFS olayları riskinde %23 azalma olduğunu göstermektedir.
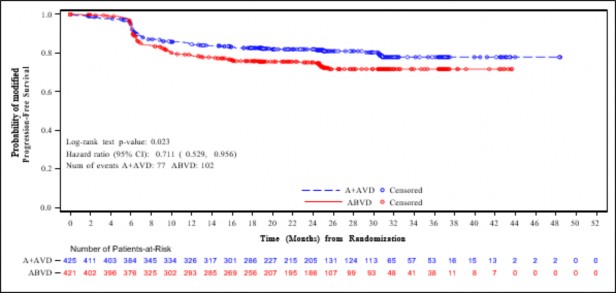
Hastalık evresine göre mPFS için yapılan önceden belirlenmiş bir alt grup analizi Evre IV hastalığı olan hastalarda etkinin ITT popülasyonuna göre daha fazla olduğunu göstermiştir ve katmanlı olmayan tehlike oranının 0,71 (%95 GA, 0,53; 0,96) olması ABVD ile karşılaştırıldığında ADCETRİS+AVD için modifiye PFS olayları riskinde %29 azalma olduğuna işaret etmektedir. ITT popülasyonunda 846 hastada (%64) Evre IV hastalık saptanmıştır.
Tablo 7 ITT popülasyonunda ve Evre IV hastalığı olan hastalarda modifiye PFS ve genel sağkalım (OS) için etkililik sonuçlarını vermektedir.
Tablo 7: 28 günlük bir kürün 1. ve 15. Gününde 1,2 mg/kg ADCETRİS + AVD ile tedavi edilen daha önce tedavi görmemis HL hastalarında etkililik sonuçları (ITT ve Evre IV)
| Tedavi Amaçlanan (ITT) Popülasyon | Evre IV Hastalığı Olan Hastalar | ||||
| ADCETRİS + AVD n = 664 | ABVD n = 670 | Katmanlı Tehlike Oranı ve p değeri | ADCETRİS + AVD n = 425 | ABVD n = 421 | Katmanlı Olmayan Tehlike Oranı ve |
p değeri | ||||||
Olay | 117 (18) | 146 (22) |
0,77 (%95 GA [0,60, 0,98]) p-değeri =0,035 | 77 (18) | 102 (24) |
|
sayısı (%) | 0,71 | |||||
2. yılda IRF'ye Göre Tahmini mPFS |
82,1 (%95 GA [78,8, 85,0]) |
77,2 (%95 GA [73,7, 80,4]) |
82,0 (%95 GA [77,8, 85,5]) |
75,3 (%95 GA [70,6, 79,3]) | (%95 GA [0,53, 0,96]) p-değeri =0,023 | |
(%) | ||||||
Genel |
28 (4) |
39 (6) | 0,73 |
14 (3) |
26 (6) | 0,51 |
SağkalımÖlüm | (%95 GA [0,45, 1,18]) | (%95 GA [0,27, | ||||
Sayısı (%) | p-değeri=0,199 | 0,97]) p-değeri =0,037 | ||||
Şekil 1: ITT popülasyonunda IRF'ye göre modifiye progresyonsuz sağkalım (ADCETRİS+ AVD ile ABVD karşılaştırması)
Şekil 2: Evre IV hastalığı olan hastalarda IRF'ye göre modifiye progresyonsuz sağkalım (ADCETRİS + AVD ile ABVD karşılaştırması)
Randomizasyon rejiminin sonunda CR oranı ve ORR, birinci basamak tedavinin sonunda CR oranı ve 2. Kürün sonunda PET negatifliği oranı, yanıt süresi (DOR), tam remisyon süresi (DOCR), hastalıksız sağkalım (DFS) ve olaysız sağkalım (EFS) dâhil diğer ikincil etkililik noktalarının hepsi hem ITT hem de Evre IV popülasyonunda ADCETRİS + AVD lehine eğilim göstermiştir.
IRF'ye göre modifiye PFS'nin önceden belirlenmiş yaş, bölge, başlangıçtaki kanser evresi, başlangıçtaki ekstranodal bölgeler, IPFP risk faktörlerinin sayısı, başlangıçtaki B semptomları, 2.siklustaki PET değerlendirmesi, 2.siklustaki PET Deauville skoru ve alternatif birinci basamak ilaç (AFM) alınması dâhil ITT alt grup analizleri yapılmıştır. Analizler alt grupların çoğunda tutarlı bir şekilde, ABVD ile karşılaştırıldığında ADCETRİS+AVD alan hastalar için yarar eğilimi
göstermiştir. Yaşlı hasta popülasyonunda ( ≥ 60 yaş [n = 186] [HR = 1,00, %95 GA (0,58, 1,72)]
ve ≥ 65 yaş [n = 122] [HR = 1,01, %95 GA (0,53, 1,94)]) ve ekstranodal tutulumu olmayan hastalarda (n = 445) (HR = 1,04, %95 GA [0,67, 1,62]) yapılan etkililik analizi iki kol arasında klinik olarak anlamlı fark olmadığını göstermiştir.
Evre IV hastalığı olan hastalar için IRF'ye göre modifiye PFS'nin yaş, bölge, başlangıçtaki ekstranodal bölgeler, IPFP risk faktörlerinin sayısı, başlangıçtaki B semptomları, başlangıçtaki ECOG durumu ve cinsiyet dahil post-hoc alt grup analizleri yapılmıştır. Analizler alt grupların çoğunda tutarlı bir şekilde ABVD ile karşılaştırıldığında ADCETRİS+AVD alan hastalar için yarar eğilimi göstermiştir. Ekstranodal hastalığın bildirildiği Evre IV hastalığı olan hastalarda ([n = 722] [HR = 0,69, %95 GA (0,50, 0,94)]) mPFS (IRF'ye göre) yararı gösterilmiştir. Ekstranodal hastalığın bildirilmediği Evre IV hastalığı olan hastalar için analizin yapıldığı zaman itibariyle yarar gösterilmemiştir ([n = 85] [HR = 1,49, %95 GA (0,51, 4,31)]). Ekstranodal hastalığı olmayan Evre IV HL hastalarındaki bu bulgunun anlamlılığı hasta sayısının az olması ve düşük olay oranları (14 olay) nedeniyle belirlenememiştir. A + AVD kolundaki (≥ 60 yaş [n = 118] [HR = 0,80, %95 GA (0,42, 1,53)] ve ≥ 65 yaş [n = 78] [HR = 0,78, %95 GA (0,36, 1,67) hastalar]) Evre IV hastalığı olan yaşlı hastalarda etkililik, ITT popülasyonundaki yaşlı hastalara oranla bu popülasyonda yararın daha büyük olduğunu ortaya koymuştur.
ITT popülasyonunda ADCETRİS+AVD ile tedavi edilen hastalar takip eden kurtarma kemoterapisi
ve yüksek doz kemoterapi ve nakil açısından ABVD ile tedavi edilenlerle karşılaştırıldıklarında %33 düşüş gözlenmiş olup ADCETRİS + AVD sonrası kurtarma kemoterapisi ya da yüksek doz kemoterapi ve nakil tedavisi alanların sayısı sırasıyla n= 66 ven= 36 iken ABVD ile sırasıyla n = 99 ve n = 54 olmuştur. Evre IV hastalarda ADCETRİS + AVD sonrası kurtarma kemoterapisi alanlar (n=45) ABVD sonrası kurtarma kemoterapisi alanlara (n=69) göre %35 daha düşüktür ve kemoterapi ve nakil tedavisi alanların sayısı ADCETRİS+AVD ile tedavi edilenlerde n=29 iken ABVD ile tedavi edilenlerde n=37 olup ADCETRİS + AVD ile tedavi edilenlerde %22 daha düşüktür.
Avrupa Kanser Araştırması ve Tedavisi Örgütü Yaşam Kalitesi 30 maddeli Anketi (EORTC- QLQ- C30) hem ITT hem de Evre IV popülasyonunda iki kol arasında klinik olarak anlamlı fark olmadığını göstermiştir.
Çalışma SGN35-005
ADCETRİS'in etkililiği ve güvenliliği ASCT'yi takiben relaps ya da progresyon riski altında olan 329 HL hastasında randomize, çift kör, plasebo-kontrollü, 2 kollu çok merkezli bir çalışmada değerlendirilmiştir. PML dahil bilinen serebral/meninjeal hastalığı olan hastalar çalışmadan dışlanmışlardır. Hasta özellikleri için Tablo 8'e bakınız. 329 hastadan 165 hasta tedavi koluna randomize edilirken 164 hasta plasebo koluna randomize edilmiştir. Çalışmada hastaların ASCT'yi takiben iyileştikten sonra (ASCT'yi takiben 30-45 gün arasında) ilk dozlarını almaları zorunlu tutulmuştur. Hastalar 16 küre kadar her 3 haftada bir 30 dakikada intravenöz olarak 1,8 mg/kg ADCETRİS ya da benzer görünümlü plasebo ile tedavi edilmiştir.
Çalışmaya alınmak için uygun hastaların aşağıda belirtilen risk faktörlerinden en az birine sahip olmaları gerekmiştir:
Birinci basamak tedaviye yanıtsız HL
5.2. Farmakokinetik özellikler
Genel özellikler
Monoterapi
ADCETRİS'in farmakokinetik özellikleri faz 1 çalışmalarda ve 314 hastanın verilerinin popülasyon farmakokinetiği analizinde değerlendirilmiştir. Tüm klinik çalışmalarda ADCETRİS, intravenöz infüzyon şeklinde uygulanmıştır.
ADCETRİS antikor ilaç konjugatının (AİK) maksimum konsantrasyonları tipik olarak infüzyonun sonunda veya infüzyonun sonuna en yakın örnek alma zamanı noktasında gözlemlenmiştir. AİK serum konsantrasyonlarında , yaklaşık 4 ila 6 günlük terminal yarı ömür ile çok üslü bir düşüş gözlenmiştir. Maruziyetlerin yaklaşık olarak dozla oransal olduğu görülmüştür. Tahmini terminal yarı ömür ile uyumlu olarak, üç haftada bir tedavi programında AİK birikiminin minimal olduğu ya da birikim olmadığı gözlenmiştir. Faz 1 çalışmada tek 1,8 mg/kg sonrasında AİK'nin tipik Cve EAA değerleri sırsıyla yaklaşık 31,98mcg/mLve 79,41mcg/mL x gün bulunmuştur.
MMAE, ADCETRİS'in ana metabolitidir. Faz 1 çalışmada AİK'nin tek 1,8 mg/kg'ı sonrasında MMAE'nin medyan C, EAA ve Tdeğerlerinin sırasıyla yaklaşık 4,97 ng/mL, 37,03 ng/mL x gün ve 2,09 gün olduğu belirlenmiştir. MMAE maruziyetleri çoklu ADCETRİS dozlarından sonra düşmüş olup sonraki dozlarda ilk dozun maruziyetinin yaklaşık %50 ila %80'i gözlenmiştir. MMAE daha ileri metabolize olarak büyük ölçüde eşit derecede güçlü bir metabolite dönüşür; ancak maruziyet derecesi MMAE'den daha düşük düzeydedir. Bu nedenle MMAE'nin sistemik etkilerine önemli bir katkısı olması beklenmez.
İlk siklustaki daha yüksek MMAE maruziyeti, nötrofil sayısındaki mutlak düşüş ile ilişkili olmuştur.
Kombinasyon tedavisi
ADCETRİS'in AVD ile kombine halde farmakokinetiği, 661 hastada tek bir çalışma ile değerlendirilmiştir. Popülasyon farmakokinetik analizi, ADCETRİS'in AVD ile kombine halde farmakokinetiğinin monoterapi ileuyumlu olduğunu göstermiştir.
İki haftada bir çoklu doz 1,2 mg/kg brentuximab vedotin intravenöz infüzyonunu takiben infüzyonun sonlarına doğru ADC'nin maksimum konsantrasyonuna erişilmiş ve eliminasyon multi- eksponansiyel bir azalma göstererek tyaklaşık 4-5 güne ulaşmıştır. İnfüzyonun bitmesinden yaklaşık 2 gün sonra 32 MMAE'lik maksimum plazma konsantrasyonlarına erişilmiş ve mono- eksponansiyel bir azalma göstererek tyaklaşık 3-4 güne ulaşmıştır.
İki haftada bir çoklu doz 1,2 mg/kg'lık brentuximab vedotin intravenöz infüzyonundan sonra 3. Siklusa kadar ADC ve MMAE kararlı durum vadi konsantrasyonuna ulaşılmıştır. Kararlı duruma ulaşıldıktan sonra, ADC'nin farmakokinetiği zamana bağlı değişim göstermemiştir. ADC akümülasyonu (1. ve 2. Sikluslar arasında AUCile hesaplanan) 1,27 kat olmuştur. MMAE (1. ve 3. Sikluslar arasında AUCile hesaplanan), zamanla %50'ye yakın azalma göstermiştir.
CHP ile kombinasyon halinde ADCETRİS'in farmakokinetiği, 223 hastada yapılan tek fazlı bir çalışmada değerlendirilmiştir (SGN35-014). Her 3 haftada bir 1,8 mg / kg ADCETRİS'in çoklu doz
IV infüzyonundan sonra, ADC ve MMAE'nin farmakokinetiği monoterapidekine benzer bulunmuştur.
Emilim
ADCETRİS intravenöz yolla uygulanır.
Dağılım
İn vitro ortamda MMAE'nin insan serum plazma proteinine bağlanma oranı %68-%82 aralığında değişmiştir. MMAE'nin yüksek oranda proteine bağlanan ilaçların yerini değiştirmesi ya da bu ilaçlar tarafından yerinin değiştirilmesi olası değildir. İn vitro koşullarda MMAE'nin klinik konsantrasyonlarda P-gp substratı olduğu ve P-gp inhibitörü olmadığı saptanmıştır.
İnsanda ortalama kararlı durum dağılım hacmi AİK için yaklaşık 6-10 L bulunmuştur. Popülasyon farmakokinetiği tahminlerine dayalı olarak, MMAE'nin tipik görünür santral dağılım hacmi 35,5 L'dir.
Biyotransformasyon
AİK'nin protein olarak katabolize olması, komponent amino asitlerin geri dönüşmesi ya da elimine olması beklenir.
Hayvanlar ve insanlardaki in vivo veriler, ADCETRİS'ten salınan MMAE'nin sadece küçük bir kısmının metabolize olduğunu göstermektedir. MMAE metabolitlerinin düzeyleri insan plazmasında ölçülmemiştir. İn vitro ortamda MMAE'nin en az bir metabolitinin aktif olduğu gösterilmiştir.
MMAE, CYP3A4'ün ve olasılıkla CYP2D6'nın substratıdır. İn vitro veriler MMAE metabolizmasının temelde CYP3A4/5 ile oksidasyon yoluyla oluştuğuna işaret etmektedir. İnsan karaciğeri mikrozomlarının kullanıldığı in vitro çalışmalar ise MMAE'nin CYP3A4/5'i sadece klinik uygulama sırasında elde edilmiş olan konsantrasyonların çok üzerinde ki konsantrasyonlarda inhibe ettiğini göstermektedir. MMAE diğer izoformları inhibe etmez.
MMAE, insan hepatositlerinin primer kültürlerinde başlıca CYP450 enzimlerinin herhangi birini indüklememiştir.
Eliminasyon
AİK katabolizma yoluyla ve sırasıyla 1,5 L/gün ve 4-6 günlük tipik olarak tahmini CL ve yarı ömür ile elimine olur.
MMAE'nin eliminasyonu, AİK'den salınma hızı ile sınırlanmıştır; MMAE'nin tipik görünür CL ve yarı ömür değerleri sırasıyla 19,99 L/gün ve 3-4 gün bulunmuştur.
1,8 mg/kg ADCETRİS dozu alan hastalarda bir ıtrah çalışması gerçekleştirilmiştir. ADCETRİS infüzyonu sırasında AİK içeriği olarak uygulanan toplam MMAE'nin yaklaşık %24'ü bir haftalık sürede hem idrar hem de feçeste tespit edilmiştir. Tespit edilen MMAE'nin yaklaşık %72'i feçeste bulunmuştur. İdrarda daha düşük miktarda MMAE (%28) atılmıştır.
Doğrusallık/Doğrusal olmayan durum Veri yoktur.
Özel Popülasyonlar
Popülasyon farmakokinetiği analizi, başlangıçtaki serum albümin konsantrasyonunun MMAE klirensi açısından önemli bir eşdeğişken olduğunu göstermiştir. Bu analiz, serum albümin konsantrasyonları normal aralık içerisinde olan hastalar ile karşılaştırıldığında serum albümin konsantrasyonları düşük (<3,0 g/dL) olanlarda MMAE klirensinin 2 kat daha düşük olduğuna işaret etmiştir.
Karaciğer yetmezliği:
Bir çalışmada hafif (Child-Pugh A; n=1), orta (Child-Pugh B; n=5) ve şiddetli (Child-Pugh C; n=1) karaciğer yetmezliği olan hastalara 1,2 mg/kg ADCETRİS uygulamasından sonra ADCETRİS ve MMAE'nin farmakokinetiği değerlendirilmiştir. Hepatik fonksiyonu norma l olan hastalar ile karşılaştırıldığında karaciğer yetmezliği olan hastalarda MMAE maruziyeti yaklaşık 2,3 kat yükselmiştir (%90 GA 1,27-4,12 kat).
Böbrek yetmezliği
Bir çalışmada hafif (n=4), orta (n=3) ve şiddetli (n=3) böbrek yetmezliği olan hastalara 1,2 mg/kg ADCETRİS uygulamasından sonra ADCETRİS ve MMAE'nin farmakokinetiği değerlendirilmiştir. Böbrek fonksiyonu normal olan hastalar ile karşılaştırıldığında şiddetli böbrek yetmezliği (kreatinin klirensi <30 mL/dk) olan hastalarda MMAE maruziyeti yaklaşık 1,9 kat yükselmiştir (%90 GA 0,85- 4,21 kat). Hafif veya orta dereceli böbrek yetmezliği olan hastalarda herhangi bir etki gözlenmemiştir.
Geriyatrik popülasyon:
ADCETRİS'in popülasyon farmakokinetiği; 87 yaşına kadar 380 hastadan alınan veriler dahil olmak üzere birçok çalışmada incelenmiştir (≥65-<75 yaşlarında 34 hasta ve ≥75 yaşlarında 17 hasta). Ayrıca, AVD ile kombinasyon halinde uygulanan brentuximab vedotinin popülasyon farmakokinetiği 82 yaşına kadar 661 hasta (≥65-<75 yaşlarında 42 hasta ve ≥75 yaşlarında 17 hasta) verisi üzerinden değerlendirilmiştir. Yaşın farmakokinetik üzerindeki etkisi her bir analizde incelenmiş ve önemli bir eşdeğişken faktör olmadığı bulunmuştur.
Pediyatrik popülasyon:
Monoterapi
C25002
Faz 1/2 çalışmasında, ADCETRİS'in antikor ilaç konjugatı (AİK) ve antimikrotübül ajan monometil auristatin E (MMAE) farmakokinetiği her 3 haftada bir uygulanan 30 dakikalık 1,4 mg/kg veya 1,8 mg/kg ADCETRİS infüzyonunu sonrasında 36 pediyatrik (7-17 yaşlarında) nükseden veya tedaviye dirençli HL ve sALCL hastasında (7-11 yaşlarında çocuk n=12 ve 12-17 yaşlarında adolesan n=24) değerlendirilmiştir (bkz. bölüm 5.1). AİK Ctipik olarak infüzyonun sonunda veya infüzyonun sonuna en yakın numune alma zamanında gözlenmiştir. AİK'nın serum konsantrasyonunda multi- eksponansiyonel düşüşünde terminal yarılanma ömrü yaklaşık olarak 4 veya 5. günde gözlenmiştir. Maruziyetlerin, çalışma popülasyonundaki düşük yaş /vücut ağırlığı olan hastaların AİK maruziyetleriyle yaklaşık olarak doz orantılı olduğu gözlenmiştir. Bu çalışmadaki çocuk ve ergenlerde medyan AİK EAA yetişkinlere göre yaklaşık olarak sırasıyla %14 ve %3 daha az olmuştur, bununla birlikte MMAE maruziyetleri sırasıyla yetişkinlere göre %53 daha az ve %13 daha fazla olmuştur. Tek doz 1,8 mg/kg dozu uygulaması sonrasında antikor ilaç konjugatı (AİK) için medyan C, EAA ve T12 yaşından küçük hastalarda sırasıyla 29,8 µg/ml ve 67,9
µg*gün/mL ve 12 yaş ve üzerinde olan hastalarda sırasıyla 34,4 µg/mLve 77,8 µg*gün/mL'dir. Tek doz 1,8 mg/kg dozu uygulaması sonrasında antimikrotübül ajan monometil auristatin E (MMAE) için medyan C, EAA ve T12 yaşından küçük hastalarda sırasıyla 3,73 µg/ml ve 1 7,3 µg*gün/mL ve 1,92 gün olup 12 yaş ve üzerinde olan hastalarda sırasıyla 6,33 µg/mLve 42,3 ng*gün/mL ve1,82 gün'dür. AİA pozitif olduğu etyit edilen pediyatrik hastalarda ADCETRİS'in klirensinde artma trendi görülmüştür. 12 yaşından küçük hastaların hiçbirinde (11 hastada 0 hasta) ve 12 yaşında ve daha büyük olan 2 hastada (23 hastada 2 hasta) anti ilaç antikoru (AİA) kalıcı olarak pozitif hale gelmiştir.
Kombinasyon tedavisi
C25004
Doksorubisin, vinblastin ve dakarbazin (AVD) ile kombinasyon halinde her 2 haftada bir 30 dakika boyunca 48 mg/m uygulanan BV'nin brentuximab vedotin ADC ve MMAE'nin farmakokinetiği, yeni teşhis edilmiş ileri evre CD30+ klasik Hodgkin lenfomalı 6-17 yaş arası 59 hastanın (6-11 yaş arası çocuklar n=11 ve 12-17 yaş arası adolesanlar n=48) yer aldığı faz 1/2 klinik çalışmada değerlendirildi.
İnfüzyonun sonlarına doğru serumda ADC'nin C'ı gerçekleşti ve yaklaşık 4 günlük yarılanma ömrü ile multi-eksponansiyel bir şekilde azaldı. BV uygulamasından yaklaşık 2 gün sonra plazmada MMAE'nin C'ı gerçekleşti ve yarılanma ömrü 2 güne yakın oldu.
Tek bir 48 mg/m dozdan sonra ADC'nin geometrik ortalama C'ı 22,5 µg/mL ve EEA'sı 46,7 µg*gün/mL idi. Tek bir 48 mg/m dozdan sonra MMAE'nin geometrik ortalama C'ı 4,9 ng/mL ve EEA'sı 27,2 ng*gün/mL idi. Pediyatrik yaş gruplarında (< 12 yaş, 12 – 16 yaş ve > 16 yaş) AVD ile kombinasyon halinde 48 mg/m BV'nin vücut alanına göre hesaplanan dozda verilmesinden sonra benzer ADC maruziyetleri elde edildi.
5.3. Klinik öncesi güvenlilik verileri
Bir in vivo sıçan kemik iliği mikronükleus çalışmasında MMAE'nin anöjenik özellikleri olduğu gösterilmiştir. Bu sonuçlar, hücrelerde MMAE'nin mitotik aparat üzerindeki farmakolojik etkisi (mikrotübül ağını bozma) ile uyumlu olmuştur.
ADCETRİS'in insanda erkek ve kadın fertilitesi üzerindeki etkileri çalışılmamıştır. Diğer yandan, sıçandaki tekrarlı doz toksisitesi çalışmalarının sonuçları ADCETRİS için erkekte üreme fonksiyonlarını ve fertiliteyi olumsuz etkileme potansiyeline işaret etmektedir. Testiküler atrofi ve dejenerasyon, 16 haftalık tedavisiz dönem sonrasında kısmen geri dönüşlü olmuştur.
ADCETRİS, gebe dişi sıçanlarda embriyo-fetal letaliteye neden olmuştur.
Klinik dışı çalışmalarda lenfoid deplesyonu ve timus ağırlığında azalma gözlenmiş olup bu bulgu, ADCETRİS kaynaklı MMAE'nin yol açtığı, mikrotübüllerdeki farmakolojik bozulma ile uyumludur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sitrik asit monohidrat (pH ayarlama amaçlı) Sodyum sitrat dihidrat (pH ayarlama amaçlı) α,α-Trehaloz dihidrat
Polisorbat 80
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından bu ürün, bölüm 6.6'da belirtilen dışında diğer tıbbi ürünler
ile karıştırılmamalıdır.
6.3. Raf ömrü
48 ay
Kullanıma hazırlama/sulandırma sonrasında mikrobiyolojik açıdan ürün hemen kullanılmalıdır. Bununla birlikte 2°C-8°C'de 24 saate kadar kimyasal ve fiziksel kullanım içi stabilite gösterilmiştir.
6.4. Saklamaya yönelik özel tedbirler
Saklamaya yönelik özel tedbirler tedbirler
Buzdolabında (2°C-8°C) saklayınız. Dondurmayınız.
Işıktan korumak için flakonu orijinal ambalajında saklayınız.
Tıbbi ürünün kullanıma hazırlanması ve seyreltilmesi sonrasındaki saklama koşulları için, bkz.
bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Bütil kauçuk tıpalı ve alüminyum/plastik geçme contalı, 50 mg toz içeren tip I cam flakon.
1 flakonluk ambalaj.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Genel önlemler
Anti-kanser ilaçlarının uygun saklanması ve imhasına ilişkin prosedürler göz önünde bulundurulmalıdır.
Bu tıbbi ürün ile tüm işlemler sırasında uygun aseptik teknik uygulanmalıdır. Kullanıma hazırlama talimatları
Her bir tek kullanımlık flakon 10,5 mL enjeksiyonluk su ile 5 mg/mL son konsantrasyona
seyreltilmelidir. Her bir flakonda, flakon başına 55 mg ADCETRİS ve toplam 11 mL sulandırılmış hacim sağlayan %10 fazlalık bulunur.
Akış doğrudan keke veya toza değil, flakonun çeperine yönlendirilir. Çözünmeye yardımcı olmak için hafifçe kendi çevresinde döndürülür. ÇALKALANMAMALIDIR.
Flakondaki sulandırılmış çözelti berrak ila hafif opak, renksiz çözelti olup son pH değeri 6,6'dır. Sulandırılmış çözelti yabancı partikül madde ve/veya renk bozukluğu açısından gözle incelenmelidir. Bunlardan herhangi biri gözleniyorsa , tıbbi ürün atılmalıdır.
İnfüzyon çözeltisinin hazırlanması
Uygun miktarda sulandırılmış ADCETRİS flakondan (flakonlardan) çekilmeli ve 0,4-1,2 mg/mL ADCETRİS son konsantrasyonu elde etmek üzere sodyum klorür 9 mg/mL (%0,9) enjeksiyonluk çözelti içeren bir infüzyon torbasına eklenmelidir. Önerilen seyrelti hacmi 150 mL'dir. Önceden sulandırılmış ADCETRİS ayrıca %5 enjeksiyonluk dekstroz veya enjeksiyonluk laktatlı Ringer ile seyreltilebilir.
ADCETRİS içeren çözeltinin karıştırılması için torba hafifçe ters çevrilir. ÇALKALANMAMALIDIR.
Seyreltilecek hacim çekildikten sonra flakonda kalmış kısım varsa, yerel gerekliliklere göre bertaraf edilmelidir.
Hazırlanan ADCETRİS infüzyon çözeltisine veya intravenöz infüzyon setine başka bir tıbbi ürün eklenmemelidir. Uygulama sonrasında infüzyon hattı sodyum klorür 9 mg/mL (%0,9) enjeksiyonluk çözelti, %5 enjeksiyonluk dekstroz veya enjeksiyonluk laktatlı Ringer ile yıkanmalıdır.
Seyreltildikten sonra ADCETRİS çözeltisi derhal, önerilen infüzyon hızıyla infüze edilir. Kullanıma hazırlama ile infüzyon arasında çözeltinin toplam saklama süresi 24 saati geçmemelidir.
Doz miktarının belirlenmesi:
Ek seyreltme yapılacak toplam ADCETRİS dozunun (mL) belirlenmesi için hesaplama (bkz. bölüm 4.2):
ADCETRİS dozu (mg/kg) x hastanın beden ağırlığı (kg) | = Daha fazla seyreltilecek toplam ADCETRİS dozu (mL) |
Sulandırılan flakon konsantrasyonu (5 mg/mL) |
Not: Eğer hastanın beden ağırlığı 100 kg'ın üzerinde ise doz hesaplamasında 100 kg kullanılmalıdır. Maksimum önerilen doz 180 mg'dır.
Gereken toplam ADCETRİS flakonu sayısının belirlenmesi için hesaplama:
![]()
Uygulanacak toplam ADCETRİS dozu (mL)
Flakon başına toplam hacim (10 mL/flakon)
= Gereken ADCETRİS flakon sayısı
Tablo 18: 60 kg-120 kg aralığındaki beden ağırlıkları için önerilen 1,8 mg/kg, 1,2 mg/kg veya 0,9 mg/kg ADCETRİS dozunu alan hastalarda örnek hesaplamalar
Tavsiye edilen doz | Hasta ağırlığı (kg) | Toplam doz = hasta ağırlığının önerilen doz ile çarpımı | Seyreltilecek toplam hacim = toplam dozun rekonstitüe flakon konsantrasyonuna [5 mg/mL] bölümü | Gereken flakon sayısı = seyreltilecek toplam hacmin, her bir flakon toplam hacmine [10 mL/flakon] bölümü |
1,8 mg/kg (maksimum 180 mg'a kadar) | 60 kg | 108 mg | 21.6 mL | 2.16 flakon |
80 kg | 144 mg | 28.8 mL | 2.88 flakon | |
100 kg | 180 mg | 36 mL | 3.6 flakon | |
120 kg | 180 mg | 36 mL | 3.6 flakon | |
1,2 mg/kg (maksimum 120 mg'a kadar) | 60 kg | 72 mg | 14.4 mL | 1.44 flakon |
80 kg | 96 mg | 19.2 mL | 1.92 flakon | |
100 kg | 120 mg | 24 mL | 2.4 flakon | |
120 kg | 120 mg | 24 mL | 2.4 flakon | |
0,9 mg/kg (maksimum 90 mg'a kadar) | 60 kg | 54 mg | 10.8 mL | 1.08 flakon |
80 kg | 72 mg | 14.4 mL | 1.44 flakon | |
100 kg | 90 mg | 18 mL | 1.8 flakon | |
120 kg | 90 mg | 18 mL | 1.8 flakon |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16640 |
| Satış Fiyatı | 69272.15 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 69272.15 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699456790058 |
| Etkin Madde | Brentuksimab Vedotin |
| ATC Kodu | L01XC12 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |