ADCETRIS 50 mg IV infüzyonluk çözelti konsantresi içeren flakon (1 flakon) Farmakolojik Özellikler
{ Brentuksimab Vedotin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar; monoklonal antikorlar ve antikor ilaç konjugatları ATC kodu: L01FX05
Etki mekanizması
ADCETRİS, bir antineoplastik ajan veren antikor ilaç konjügatıdır (ADC); bu antineoplastik ajan, CD30 eksprese eden tümör hücrelerinde selektif olarak apoptotik hücre ölümüne neden olur. Klinik dışı veriler, ADCETRİS'in biyolojik aktivitesinin çok adımlı bir süreçle meydana geldiğini göstermektedir. ADC'nin hücre yüzeyinde CD30'a bağlanması, ADC-CD30 kompleksinin internalizasyonunu başlatır, bu daha sonra lizozomal kompartmana iletilir. Hücre içinde tanımlanmış tek aktif parça olan MMAE, proteolitik ayrılma ile salınır. MMAE'nin tübüline bağlanması, hücre içindeki mikrotübül ağını bozar, hücre döngüsünün durmasını indükler ve CD30 eksprese eden tümör hücrelerin apoptotik hücre ölümüne neden olur.
Klasik Hodgkin lenfoma, sistemik anaplastik büyük hücreli lenfoma vekütanöz t hücreli lenfomaların alttürleri [Mikozis fungoides (MF) ve primer kutanöz anaplastik büyük hücreli lenfoma (pcALCL) dahil] CD30'u antijen olarak malign hücrelerinin yüzeyinde eksprese ederler. Bu ekspresyon hastalığın evresinden, tedavinin basamağından ve nakil durumundan bağımsızdır. Bu özellikler CD30'u terapötik müdahale için hedef kılar. CD30 hedefli etki mekanizması nedeniyle ADCETRİS, kemo-direnci aşabilir çünkü çoklu ajanlı kemoterapiye dirençli olan hastalarda CD30, önceki nakil durumu fark etmeksizin sürekli olarak eksprese olur. ADCETRİS'in CD30 hedefli mekanizması, klasik Hodgkin lenfoma, sistemik anaplastik büyük hücreli lenfoma ve CD30+ kütanöz T hücreli lenfomalarda CD30'un tutarlı ekspresyonu, tedavi spektrumları ve CD30 pozitif malignitelerdeki çoklu tedavi serilerini takip eden klinik bulgular, ADCETRİS'in otolog kök hücre transplantı olsun veya olmasın nükseden veya tedaviye dirençli klasik HL'de, sALCL'de ve CD30 + CTCL hastalarında en az 1 seri sistemik tedavi sonrası kullanımına yönelik biyolojik kanıt sağlar.
Etki mekanizmasına diğer antikorlarla ilişkili fonksiyonların katkısı dışlanmamıştır. Farmakodinamik etkiler
Kardiyak elektrofizyoloji
Faz 1, tek kollu, açık etiketli, çok merkezli kardiyak güvenlilik çalışması kapsamında 3 haftada bir 1,8 mg/kg ADCETRİS ile tedavi edilen 52 hastadan CD30 eksprese eden hematolojik maligniteleri olan kırk altı (46) hasta değerlendirilmiştir. Birincil amaç, ADCETRİS'in kardiyak ventriküler re- polarizasyon üzerindeki etkisi değerlendirmek olmuş ve önceden tanımlanmış olan birincil analiz, QTc değerinde başlangıçtan, 1. siklustaki çoklu zaman noktaları arasında değişikliği içermiştir.
QTc üzerindeki etkinin üst %90 güven aralığı (GA) Siklus 1 ve Siklus 3 başlangıç sonrası zaman noktalarının her biri için <10 milisaniye olmuştur. Bu veriler, CD30 eksprese eden maligniteleri olan hastalarda 3 haftada bir 1,8 mg/kg dozunda uygulanan ADCETRİS'e bağlı olarak klinik olarak anlamlı QT uzamasının olmadığına işaret etmektedir.
Klinik etkililik ve güvenlilik
Hodgkin lenfoma
Çalışma C25003
ADCETRİS'in kemoterapi ile kombinasyonunun (doksorubisin [A], vinblastin [V] ve dakarbazin [D] [AVD]) etkililiği ve güvenliliği daha önce tedavi görmemiş 1334 ileri evre HL hastasında randomize, açık etiketli, 2 kollu, çok merkezli bir çalışmada değerlendirilmiştir. Tüm hastalarda histolojik olarak doğrulanmış CD30 eksprese eden hastalık bulunmaktadır. Hastaların yüzde altmış ikisinde ekstranodal tutulum saptanmıştır. 1334 hastadan 664'ü ADCETRİS + AVD koluna ve 670 hasta ABVD (doksorubisin [A], bleomisin [B], vinblastin [V] ve dakarbazin [D]) koluna randomize edilmiş ve Uluslararası Prognostik Faktör Projesi (IPFP) risk faktörleri ve bölgeye göre katmanlara ayrılmıştı. Hastalar her 28 günlük kürün 1. ve 15. Gününde 30 dakikalık intravenöz infüzyonla 1,2 mg/kg ADCETRİS + doksorubisin 25 mg/m², vinblastin 6 mg/m²ve dakarbazin 375 mg/m²almıştır. Alınan ortanca kür sayısı altıdır (aralık: 1 - 6 kür). Tablo 6 başlangıçtaki hasta ve hastalık özelliklerini vermektedir. İki kol arasında hasta ve hastalık özellikleri açısından anlamlı farklar bulunmamaktadır.
Tablo 6: Faz 3 daha önce tedavi edilmemiş HL çalışmasında başlangıçtaki hasta ve hastalık özelliklerinin özeti
Hasta özellikleri | ADCETRİS + AVD n = 664 | ABVD n = 670 |
Ortanca yaş (aralık) | 35 yaş (18-82) | 37 yaş (18-83) |
≥ 65 yaş hastalar n (%) | 60 (9) | 62 (9) |
Cinsiyet, n (%) | 378E (57) 286K (43) | 398E (59) 272K (41) |
ECOG durumu, n (%) |
|
|
0 | 376 (57) | 378 (57) |
1 | 260 (39) | 263 (39) |
2 | 28 (4) | 27 (4) |
Eksik | 0 | 2 |
Hastalık Özellikleri |
|
|
HL tanısından ilk doza ortanca zaman (aralık) | 0,92 ay (0,1-21,4) | 0,89 ay (0,0-81.4) |
İlk HL tanısı konulduğu sırada hastalık evresi, n (%) |
|
|
III | 237 (36) | 246 (37) |
IV | 425 (64) | 421 (63) |
Geçerli değil | 1 (< 1) | 1 (< 1) |
Eksik | 0 | 2 (<1 ) |
Tanı konulduğu sırada ekstranodal tutulum, n (%) | 411 (62) | 416 (62) |
IPFPrisk faktörleri, n (%) |
|
|
0-1 | 141 (21) | 141 (21) |
2-3 | 354 (53) | 351 (52) |
4-7 | 169 (25) | 178 (27) |
Tanı konulduğu sırada ya da çalışmaya girişte kemik iliği tutulumu, n (%) | 147(22) | 151 (23) |
B semptomlarıa n (%) | 400 (60) | 381 (57) |
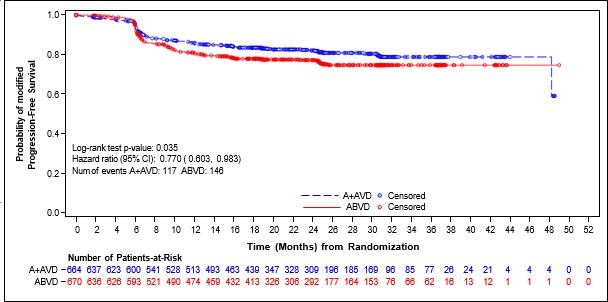
Randomizasyondan hastalık progresyonuna, ölüme ya da bağımsız inceleme kuruluşu(IRF) değerlendirmesine göre birinci basamak tedaviden sonra tam olmayan yanıt (TY dışı) bulgularına ve takip eden kanser tedavisine kadar geçen zaman olarak tanımlanan, modifiye PFS (mPFS) C25003 çalışmasında birincil sonlanım noktasıdır. Modifiye olayın zamanlaması birinci basamak tedavinin tamamlanmasından sonra Deauville skoru ≥3 olarak tanımlanan tam yanıtın (TY) yokluğunu gösteren ilk PET incelemesidir. IRF değerlendirmesine göre medyan modifiye PFS'ye iki kolda da ulaşılmamıştır. Tedavi amaçlanan popülasyondaki (ITT) bulgular ADCETRİS+AVD için modifiye PFS'de istatistiksel olarak anlamlı iyileşme olduğunu göstermiştir ve katmanlı tehlike oranı 0,770 (%95 GA, 0,603; 0,983, p = 0,035) olarak belirlenmiş olup ABVD ile karşılaştırıldığında
ADCETRİS+AVD için modifiye PFS olayları riskinde %23 azalma olduğunu göstermektedir.
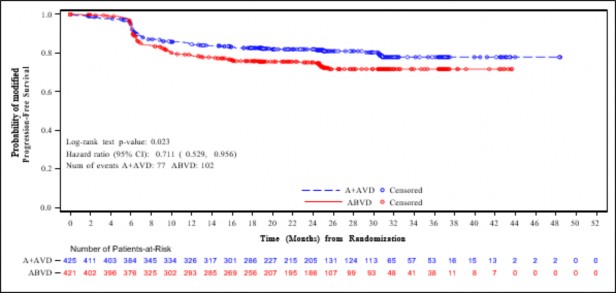
Hastalık evresine göre mPFS için yapılan önceden belirlenmiş bir alt grup analizi Evre IV hastalığı olan hastalarda etkinin ITT popülasyonuna göre daha fazla olduğunu göstermiştir ve katmanlı olmayan tehlike oranının 0,71 (%95 GA, 0,53; 0,96) olması ABVD ile karşılaştırıldığında ADCETRİS+AVD için modifiye PFS olayları riskinde %29 azalma olduğuna işaret etmektedir. ITT popülasyonunda 846 hastada (%64) Evre IV hastalık saptanmıştır.
Tablo 7 ITT popülasyonunda ve Evre IV hastalığı olan hastalarda modifiye PFS ve genel sağkalım (OS) için etkililik sonuçlarını vermektedir.
Tablo 7: 28 günlük bir kürün 1. ve 15. Gününde 1,2 mg/kg ADCETRİS + AVD ile tedavi edilen daha önce tedavi görmemis HL hastalarında etkililik sonuçları (ITT ve Evre IV)
| Tedavi Amaçlanan (ITT) Popülasyon | Evre IV Hastalığı Olan Hastalar | ||||
| ADCETRİS + AVD n = 664 | ABVD n = 670 | Katmanlı Tehlike Oranı ve p değeri | ADCETRİS + AVD n = 425 | ABVD n = 421 | Katmanlı Olmayan Tehlike Oranı ve |
p değeri | ||||||
Olay | 117 (18) | 146 (22) |
0,77 (%95 GA [0,60, 0,98]) p-değeri =0,035 | 77 (18) | 102 (24) |
|
sayısı (%) | 0,71 | |||||
2. yılda IRF'ye Göre Tahmini mPFS |
82,1 (%95 GA [78,8, 85,0]) |
77,2 (%95 GA [73,7, 80,4]) |
82,0 (%95 GA [77,8, 85,5]) |
75,3 (%95 GA [70,6, 79,3]) | (%95 GA [0,53, 0,96]) p-değeri =0,023 | |
(%) | ||||||
Genel |
28 (4) |
39 (6) | 0,73 |
14 (3) |
26 (6) | 0,51 |
SağkalımÖlüm | (%95 GA [0,45, 1,18]) | (%95 GA [0,27, | ||||
Sayısı (%) | p-değeri=0,199 | 0,97]) p-değeri =0,037 | ||||
Şekil 1: ITT popülasyonunda IRF'ye göre modifiye progresyonsuz sağkalım (ADCETRİS+ AVD ile ABVD karşılaştırması)
Şekil 2: Evre IV hastalığı olan hastalarda IRF'ye göre modifiye progresyonsuz sağkalım (ADCETRİS + AVD ile ABVD karşılaştırması)
Randomizasyon rejiminin sonunda CR oranı ve ORR, birinci basamak tedavinin sonunda CR oranı ve 2. Kürün sonunda PET negatifliği oranı, yanıt süresi (DOR), tam remisyon süresi (DOCR), hastalıksız sağkalım (DFS) ve olaysız sağkalım (EFS) dâhil diğer ikincil etkililik noktalarının hepsi hem ITT hem de Evre IV popülasyonunda ADCETRİS + AVD lehine eğilim göstermiştir.
IRF'ye göre modifiye PFS'nin önceden belirlenmiş yaş, bölge, başlangıçtaki kanser evresi, başlangıçtaki ekstranodal bölgeler, IPFP risk faktörlerinin sayısı, başlangıçtaki B semptomları, 2.siklustaki PET değerlendirmesi, 2.siklustaki PET Deauville skoru ve alternatif birinci basamak ilaç (AFM) alınması dâhil ITT alt grup analizleri yapılmıştır. Analizler alt grupların çoğunda tutarlı bir şekilde, ABVD ile karşılaştırıldığında ADCETRİS+AVD alan hastalar için yarar eğilimi
göstermiştir. Yaşlı hasta popülasyonunda ( ≥ 60 yaş [n = 186] [HR = 1,00, %95 GA (0,58, 1,72)]
ve ≥ 65 yaş [n = 122] [HR = 1,01, %95 GA (0,53, 1,94)]) ve ekstranodal tutulumu olmayan hastalarda (n = 445) (HR = 1,04, %95 GA [0,67, 1,62]) yapılan etkililik analizi iki kol arasında klinik olarak anlamlı fark olmadığını göstermiştir.
Evre IV hastalığı olan hastalar için IRF'ye göre modifiye PFS'nin yaş, bölge, başlangıçtaki ekstranodal bölgeler, IPFP risk faktörlerinin sayısı, başlangıçtaki B semptomları, başlangıçtaki ECOG durumu ve cinsiyet dahil post-hoc alt grup analizleri yapılmıştır. Analizler alt grupların çoğunda tutarlı bir şekilde ABVD ile karşılaştırıldığında ADCETRİS+AVD alan hastalar için yarar eğilimi göstermiştir. Ekstranodal hastalığın bildirildiği Evre IV hastalığı olan hastalarda ([n = 722] [HR = 0,69, %95 GA (0,50, 0,94)]) mPFS (IRF'ye göre) yararı gösterilmiştir. Ekstranodal hastalığın bildirilmediği Evre IV hastalığı olan hastalar için analizin yapıldığı zaman itibariyle yarar gösterilmemiştir ([n = 85] [HR = 1,49, %95 GA (0,51, 4,31)]). Ekstranodal hastalığı olmayan Evre IV HL hastalarındaki bu bulgunun anlamlılığı hasta sayısının az olması ve düşük olay oranları (14 olay) nedeniyle belirlenememiştir. A + AVD kolundaki (≥ 60 yaş [n = 118] [HR = 0,80, %95 GA (0,42, 1,53)] ve ≥ 65 yaş [n = 78] [HR = 0,78, %95 GA (0,36, 1,67) hastalar]) Evre IV hastalığı olan yaşlı hastalarda etkililik, ITT popülasyonundaki yaşlı hastalara oranla bu popülasyonda yararın daha büyük olduğunu ortaya koymuştur.
ITT popülasyonunda ADCETRİS+AVD ile tedavi edilen hastalar takip eden kurtarma kemoterapisi
ve yüksek doz kemoterapi ve nakil açısından ABVD ile tedavi edilenlerle karşılaştırıldıklarında %33 düşüş gözlenmiş olup ADCETRİS + AVD sonrası kurtarma kemoterapisi ya da yüksek doz kemoterapi ve nakil tedavisi alanların sayısı sırasıyla n= 66 ven= 36 iken ABVD ile sırasıyla n = 99 ve n = 54 olmuştur. Evre IV hastalarda ADCETRİS + AVD sonrası kurtarma kemoterapisi alanlar (n=45) ABVD sonrası kurtarma kemoterapisi alanlara (n=69) göre %35 daha düşüktür ve kemoterapi ve nakil tedavisi alanların sayısı ADCETRİS+AVD ile tedavi edilenlerde n=29 iken ABVD ile tedavi edilenlerde n=37 olup ADCETRİS + AVD ile tedavi edilenlerde %22 daha düşüktür.
Avrupa Kanser Araştırması ve Tedavisi Örgütü Yaşam Kalitesi 30 maddeli Anketi (EORTC- QLQ- C30) hem ITT hem de Evre IV popülasyonunda iki kol arasında klinik olarak anlamlı fark olmadığını göstermiştir.
Çalışma SGN35-005
ADCETRİS'in etkililiği ve güvenliliği ASCT'yi takiben relaps ya da progresyon riski altında olan 329 HL hastasında randomize, çift kör, plasebo-kontrollü, 2 kollu çok merkezli bir çalışmada değerlendirilmiştir. PML dahil bilinen serebral/meninjeal hastalığı olan hastalar çalışmadan dışlanmışlardır. Hasta özellikleri için Tablo 8'e bakınız. 329 hastadan 165 hasta tedavi koluna randomize edilirken 164 hasta plasebo koluna randomize edilmiştir. Çalışmada hastaların ASCT'yi takiben iyileştikten sonra (ASCT'yi takiben 30-45 gün arasında) ilk dozlarını almaları zorunlu tutulmuştur. Hastalar 16 küre kadar her 3 haftada bir 30 dakikada intravenöz olarak 1,8 mg/kg ADCETRİS ya da benzer görünümlü plasebo ile tedavi edilmiştir.
Çalışmaya alınmak için uygun hastaların aşağıda belirtilen risk faktörlerinden en az birine sahip olmaları gerekmiştir:
Birinci basamak tedaviye yanıtsız HL
5.2. Farmakokinetik özellikler
Genel özellikler
Monoterapi
ADCETRİS'in farmakokinetik özellikleri faz 1 çalışmalarda ve 314 hastanın verilerinin popülasyon farmakokinetiği analizinde değerlendirilmiştir. Tüm klinik çalışmalarda ADCETRİS, intravenöz infüzyon şeklinde uygulanmıştır.
ADCETRİS antikor ilaç konjugatının (AİK) maksimum konsantrasyonları tipik olarak infüzyonun sonunda veya infüzyonun sonuna en yakın örnek alma zamanı noktasında gözlemlenmiştir. AİK serum konsantrasyonlarında , yaklaşık 4 ila 6 günlük terminal yarı ömür ile çok üslü bir düşüş gözlenmiştir. Maruziyetlerin yaklaşık olarak dozla oransal olduğu görülmüştür. Tahmini terminal yarı ömür ile uyumlu olarak, üç haftada bir tedavi programında AİK birikiminin minimal olduğu ya da birikim olmadığı gözlenmiştir. Faz 1 çalışmada tek 1,8 mg/kg sonrasında AİK'nin tipik Cve EAA değerleri sırsıyla yaklaşık 31,98mcg/mLve 79,41mcg/mL x gün bulunmuştur.
MMAE, ADCETRİS'in ana metabolitidir. Faz 1 çalışmada AİK'nin tek 1,8 mg/kg'ı sonrasında MMAE'nin medyan C, EAA ve Tdeğerlerinin sırasıyla yaklaşık 4,97 ng/mL, 37,03 ng/mL x gün ve 2,09 gün olduğu belirlenmiştir. MMAE maruziyetleri çoklu ADCETRİS dozlarından sonra düşmüş olup sonraki dozlarda ilk dozun maruziyetinin yaklaşık %50 ila %80'i gözlenmiştir. MMAE daha ileri metabolize olarak büyük ölçüde eşit derecede güçlü bir metabolite dönüşür; ancak maruziyet derecesi MMAE'den daha düşük düzeydedir. Bu nedenle MMAE'nin sistemik etkilerine önemli bir katkısı olması beklenmez.
İlk siklustaki daha yüksek MMAE maruziyeti, nötrofil sayısındaki mutlak düşüş ile ilişkili olmuştur.
Kombinasyon tedavisi
ADCETRİS'in AVD ile kombine halde farmakokinetiği, 661 hastada tek bir çalışma ile değerlendirilmiştir. Popülasyon farmakokinetik analizi, ADCETRİS'in AVD ile kombine halde farmakokinetiğinin monoterapi ileuyumlu olduğunu göstermiştir.
İki haftada bir çoklu doz 1,2 mg/kg brentuximab vedotin intravenöz infüzyonunu takiben infüzyonun sonlarına doğru ADC'nin maksimum konsantrasyonuna erişilmiş ve eliminasyon multi- eksponansiyel bir azalma göstererek tyaklaşık 4-5 güne ulaşmıştır. İnfüzyonun bitmesinden yaklaşık 2 gün sonra 32 MMAE'lik maksimum plazma konsantrasyonlarına erişilmiş ve mono- eksponansiyel bir azalma göstererek tyaklaşık 3-4 güne ulaşmıştır.
İki haftada bir çoklu doz 1,2 mg/kg'lık brentuximab vedotin intravenöz infüzyonundan sonra 3. Siklusa kadar ADC ve MMAE kararlı durum vadi konsantrasyonuna ulaşılmıştır. Kararlı duruma ulaşıldıktan sonra, ADC'nin farmakokinetiği zamana bağlı değişim göstermemiştir. ADC akümülasyonu (1. ve 2. Sikluslar arasında AUCile hesaplanan) 1,27 kat olmuştur. MMAE (1. ve 3. Sikluslar arasında AUCile hesaplanan), zamanla %50'ye yakın azalma göstermiştir.
CHP ile kombinasyon halinde ADCETRİS'in farmakokinetiği, 223 hastada yapılan tek fazlı bir çalışmada değerlendirilmiştir (SGN35-014). Her 3 haftada bir 1,8 mg / kg ADCETRİS'in çoklu doz
IV infüzyonundan sonra, ADC ve MMAE'nin farmakokinetiği monoterapidekine benzer bulunmuştur.
Emilim
ADCETRİS intravenöz yolla uygulanır.
Dağılım
İn vitro ortamda MMAE'nin insan serum plazma proteinine bağlanma oranı %68-%82 aralığında değişmiştir. MMAE'nin yüksek oranda proteine bağlanan ilaçların yerini değiştirmesi ya da bu ilaçlar tarafından yerinin değiştirilmesi olası değildir. İn vitro koşullarda MMAE'nin klinik konsantrasyonlarda P-gp substratı olduğu ve P-gp inhibitörü olmadığı saptanmıştır.
İnsanda ortalama kararlı durum dağılım hacmi AİK için yaklaşık 6-10 L bulunmuştur. Popülasyon farmakokinetiği tahminlerine dayalı olarak, MMAE'nin tipik görünür santral dağılım hacmi 35,5 L'dir.
Biyotransformasyon
AİK'nin protein olarak katabolize olması, komponent amino asitlerin geri dönüşmesi ya da elimine olması beklenir.
Hayvanlar ve insanlardaki in vivo veriler, ADCETRİS'ten salınan MMAE'nin sadece küçük bir kısmının metabolize olduğunu göstermektedir. MMAE metabolitlerinin düzeyleri insan plazmasında ölçülmemiştir. İn vitro ortamda MMAE'nin en az bir metabolitinin aktif olduğu gösterilmiştir.
MMAE, CYP3A4'ün ve olasılıkla CYP2D6'nın substratıdır. İn vitro veriler MMAE metabolizmasının temelde CYP3A4/5 ile oksidasyon yoluyla oluştuğuna işaret etmektedir. İnsan karaciğeri mikrozomlarının kullanıldığı in vitro çalışmalar ise MMAE'nin CYP3A4/5'i sadece klinik uygulama sırasında elde edilmiş olan konsantrasyonların çok üzerinde ki konsantrasyonlarda inhibe ettiğini göstermektedir. MMAE diğer izoformları inhibe etmez.
MMAE, insan hepatositlerinin primer kültürlerinde başlıca CYP450 enzimlerinin herhangi birini indüklememiştir.
Eliminasyon
AİK katabolizma yoluyla ve sırasıyla 1,5 L/gün ve 4-6 günlük tipik olarak tahmini CL ve yarı ömür ile elimine olur.
MMAE'nin eliminasyonu, AİK'den salınma hızı ile sınırlanmıştır; MMAE'nin tipik görünür CL ve yarı ömür değerleri sırasıyla 19,99 L/gün ve 3-4 gün bulunmuştur.
1,8 mg/kg ADCETRİS dozu alan hastalarda bir ıtrah çalışması gerçekleştirilmiştir. ADCETRİS infüzyonu sırasında AİK içeriği olarak uygulanan toplam MMAE'nin yaklaşık %24'ü bir haftalık sürede hem idrar hem de feçeste tespit edilmiştir. Tespit edilen MMAE'nin yaklaşık %72'i feçeste bulunmuştur. İdrarda daha düşük miktarda MMAE (%28) atılmıştır.
Doğrusallık/Doğrusal olmayan durum Veri yoktur.
Özel Popülasyonlar
Popülasyon farmakokinetiği analizi, başlangıçtaki serum albümin konsantrasyonunun MMAE klirensi açısından önemli bir eşdeğişken olduğunu göstermiştir. Bu analiz, serum albümin konsantrasyonları normal aralık içerisinde olan hastalar ile karşılaştırıldığında serum albümin konsantrasyonları düşük (<3,0 g/dL) olanlarda MMAE klirensinin 2 kat daha düşük olduğuna işaret etmiştir.
Karaciğer yetmezliği:
Bir çalışmada hafif (Child-Pugh A; n=1), orta (Child-Pugh B; n=5) ve şiddetli (Child-Pugh C; n=1) karaciğer yetmezliği olan hastalara 1,2 mg/kg ADCETRİS uygulamasından sonra ADCETRİS ve MMAE'nin farmakokinetiği değerlendirilmiştir. Hepatik fonksiyonu norma l olan hastalar ile karşılaştırıldığında karaciğer yetmezliği olan hastalarda MMAE maruziyeti yaklaşık 2,3 kat yükselmiştir (%90 GA 1,27-4,12 kat).
Böbrek yetmezliği
Bir çalışmada hafif (n=4), orta (n=3) ve şiddetli (n=3) böbrek yetmezliği olan hastalara 1,2 mg/kg ADCETRİS uygulamasından sonra ADCETRİS ve MMAE'nin farmakokinetiği değerlendirilmiştir. Böbrek fonksiyonu normal olan hastalar ile karşılaştırıldığında şiddetli böbrek yetmezliği (kreatinin klirensi <30 mL/dk) olan hastalarda MMAE maruziyeti yaklaşık 1,9 kat yükselmiştir (%90 GA 0,85- 4,21 kat). Hafif veya orta dereceli böbrek yetmezliği olan hastalarda herhangi bir etki gözlenmemiştir.
Geriyatrik popülasyon:
ADCETRİS'in popülasyon farmakokinetiği; 87 yaşına kadar 380 hastadan alınan veriler dahil olmak üzere birçok çalışmada incelenmiştir (≥65-<75 yaşlarında 34 hasta ve ≥75 yaşlarında 17 hasta). Ayrıca, AVD ile kombinasyon halinde uygulanan brentuximab vedotinin popülasyon farmakokinetiği 82 yaşına kadar 661 hasta (≥65-<75 yaşlarında 42 hasta ve ≥75 yaşlarında 17 hasta) verisi üzerinden değerlendirilmiştir. Yaşın farmakokinetik üzerindeki etkisi her bir analizde incelenmiş ve önemli bir eşdeğişken faktör olmadığı bulunmuştur.
Pediyatrik popülasyon:
Monoterapi
C25002
Faz 1/2 çalışmasında, ADCETRİS'in antikor ilaç konjugatı (AİK) ve antimikrotübül ajan monometil auristatin E (MMAE) farmakokinetiği her 3 haftada bir uygulanan 30 dakikalık 1,4 mg/kg veya 1,8 mg/kg ADCETRİS infüzyonunu sonrasında 36 pediyatrik (7-17 yaşlarında) nükseden veya tedaviye dirençli HL ve sALCL hastasında (7-11 yaşlarında çocuk n=12 ve 12-17 yaşlarında adolesan n=24) değerlendirilmiştir (bkz. bölüm 5.1). AİK Ctipik olarak infüzyonun sonunda veya infüzyonun sonuna en yakın numune alma zamanında gözlenmiştir. AİK'nın serum konsantrasyonunda multi- eksponansiyonel düşüşünde terminal yarılanma ömrü yaklaşık olarak 4 veya 5. günde gözlenmiştir. Maruziyetlerin, çalışma popülasyonundaki düşük yaş /vücut ağırlığı olan hastaların AİK maruziyetleriyle yaklaşık olarak doz orantılı olduğu gözlenmiştir. Bu çalışmadaki çocuk ve ergenlerde medyan AİK EAA yetişkinlere göre yaklaşık olarak sırasıyla %14 ve %3 daha az olmuştur, bununla birlikte MMAE maruziyetleri sırasıyla yetişkinlere göre %53 daha az ve %13 daha fazla olmuştur. Tek doz 1,8 mg/kg dozu uygulaması sonrasında antikor ilaç konjugatı (AİK) için medyan C, EAA ve T12 yaşından küçük hastalarda sırasıyla 29,8 µg/ml ve 67,9
µg*gün/mL ve 12 yaş ve üzerinde olan hastalarda sırasıyla 34,4 µg/mLve 77,8 µg*gün/mL'dir. Tek doz 1,8 mg/kg dozu uygulaması sonrasında antimikrotübül ajan monometil auristatin E (MMAE) için medyan C, EAA ve T12 yaşından küçük hastalarda sırasıyla 3,73 µg/ml ve 1 7,3 µg*gün/mL ve 1,92 gün olup 12 yaş ve üzerinde olan hastalarda sırasıyla 6,33 µg/mLve 42,3 ng*gün/mL ve1,82 gün'dür. AİA pozitif olduğu etyit edilen pediyatrik hastalarda ADCETRİS'in klirensinde artma trendi görülmüştür. 12 yaşından küçük hastaların hiçbirinde (11 hastada 0 hasta) ve 12 yaşında ve daha büyük olan 2 hastada (23 hastada 2 hasta) anti ilaç antikoru (AİA) kalıcı olarak pozitif hale gelmiştir.
Kombinasyon tedavisi
C25004
Doksorubisin, vinblastin ve dakarbazin (AVD) ile kombinasyon halinde her 2 haftada bir 30 dakika boyunca 48 mg/m uygulanan BV'nin brentuximab vedotin ADC ve MMAE'nin farmakokinetiği, yeni teşhis edilmiş ileri evre CD30+ klasik Hodgkin lenfomalı 6-17 yaş arası 59 hastanın (6-11 yaş arası çocuklar n=11 ve 12-17 yaş arası adolesanlar n=48) yer aldığı faz 1/2 klinik çalışmada değerlendirildi.
İnfüzyonun sonlarına doğru serumda ADC'nin C'ı gerçekleşti ve yaklaşık 4 günlük yarılanma ömrü ile multi-eksponansiyel bir şekilde azaldı. BV uygulamasından yaklaşık 2 gün sonra plazmada MMAE'nin C'ı gerçekleşti ve yarılanma ömrü 2 güne yakın oldu.
Tek bir 48 mg/m dozdan sonra ADC'nin geometrik ortalama C'ı 22,5 µg/mL ve EEA'sı 46,7 µg*gün/mL idi. Tek bir 48 mg/m dozdan sonra MMAE'nin geometrik ortalama C'ı 4,9 ng/mL ve EEA'sı 27,2 ng*gün/mL idi. Pediyatrik yaş gruplarında (< 12 yaş, 12 â 16 yaş ve > 16 yaş) AVD ile kombinasyon halinde 48 mg/m BV'nin vücut alanına göre hesaplanan dozda verilmesinden sonra benzer ADC maruziyetleri elde edildi.
5.3. Klinik öncesi güvenlilik verileri
Bir in vivo sıçan kemik iliği mikronükleus çalışmasında MMAE'nin anöjenik özellikleri olduğu gösterilmiştir. Bu sonuçlar, hücrelerde MMAE'nin mitotik aparat üzerindeki farmakolojik etkisi (mikrotübül ağını bozma) ile uyumlu olmuştur.
ADCETRİS'in insanda erkek ve kadın fertilitesi üzerindeki etkileri çalışılmamıştır. Diğer yandan, sıçandaki tekrarlı doz toksisitesi çalışmalarının sonuçları ADCETRİS için erkekte üreme fonksiyonlarını ve fertiliteyi olumsuz etkileme potansiyeline işaret etmektedir. Testiküler atrofi ve dejenerasyon, 16 haftalık tedavisiz dönem sonrasında kısmen geri dönüşlü olmuştur.
ADCETRİS, gebe dişi sıçanlarda embriyo-fetal letaliteye neden olmuştur.
Klinik dışı çalışmalarda lenfoid deplesyonu ve timus ağırlığında azalma gözlenmiş olup bu bulgu, ADCETRİS kaynaklı MMAE'nin yol açtığı, mikrotübüllerdeki farmakolojik bozulma ile uyumludur.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16640 |
| Satış Fiyatı | 69272.15 TL [ 19 Nov 2024 ] |
| Önceki Satış Fiyatı | 69272.15 TL [ 8 Nov 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699456790058 |
| Etkin Madde | Brentuksimab Vedotin |
| ATC Kodu | L01XC12 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |