ADENURIC 80 mg 28 film kaplı tablet Farmakolojik Özellikler
{ Febuksostat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Gut hastalığına karşı ku lanılan ilaçlar, ürik asit üretimini inhibe eden preparatlar
ATC kodu: M04AA03
Etki mekanizması
Ürik asit, insanlarda purin metabolizmasının son ürünüdür ve hipoksantinï‚® ksantin ï‚® ürik asit kaskadında üretilmektedir. Yukarıda belirtilen transformasyonlardaki her iki adım da, ksantin oksidaz (XO) tarafından katalizlenmektedir. Febuksostat, terapötik etkisini (serumürik asit düzeyinin düşürülmesi) XO'yu selektif olarak inhibe etme yoluyla sağlayan bir 2- ariltia zol türevidir. Febuksostat, XO'nun potent, non-purin selektif bir inhibitörüdür (NP- SIXO) ve in vitro inhibisyon Ki değeri 1 nanomolardan küçüktür. Febuksostatın, XO'nun hem oksitlenmiş, hem de indirgenmiş formlarını potent olarak inhibe ettiği gösterilmişt ir. Febuksostat, terapötik konsantrasyonlarda, purin ya da pirimidin metabolizmasına katılan diğer enzimleri (guanin deaminaz, hipoksantin guanin fosforibosiltransferaz, orotat fosforibosiltransferaz, orotidin monofosfat dekarboksilaz ya da purin nükleosid fosforilaz) inhibe etmez.
Klinik etkililik ve güvenlilik
ADENURIC'in etkililiği, hiperürisemisi ve gut hastalığı olan 4101 hastada yürütülen üç adet Faz 3 pivotal çalışmada (iki pivotal APEX ve FACT çalışması ve ek CONFIRMS çalışmas ı (aşağıda tanımlanmıştır)) gösterilmiştir. Her bir faz 3 pivotal çalışmada, ADENURIC'in, serum ürik asit düzeylerini düşürme ve bu düzeylerde tutma yetisinin a lopurinole kıyasla üstün olduğu gösterilmiştir. APEX ve FACT çalışmalarında birincil etkililik sonlanım noktası, son 3 aylık serum ürik asit düzeyleri < 6,0 mg/dL (357 µmol/L) olan hastaların oranıdır. Bulgular ın ADENURIC için ruhsatının ilk kez verilmesinden sonra elde edildiği ek faz 3 CONFIRMS çalışmasında birincil etkililik son noktası, son vizitte serum ürat düzeyleri < 6,0 mg/dL olan hastaların oranıdır. Bu çalışmalara, organ transplant alıcısı olan hiçbir hasta dahil edilmemiş t ir (bkz. bölüm 4.2).
APEX Çalışması: Febuksostatın Allopurinol ve Plasebo Kontrollü Etkililik Çalışması (APEX), Faz 3, randomize, çift kör, çok merkezli, 28 haftalık bir çalışmadır. 1072 hasta randomize edilmiştir: plasebo (n=134), günlük olarak ADENURIC 80 mg (n=267), ADENURIC 120 mg (n=269), ADENURIC 240 mg (n=134) ya da a lopurinol (başlangıçtaki serum kreatinin düzeyi
ï‚£1,5 mg/dL olan hastalar için günde 300 mg [n=258] veya başlangıçtaki serum kreatinin düzeyi
>1,5 mg/dL ve ï‚£2,0 mg/dL olanhastalariçingünde100mg[n=10]). Güvenlilik değerlendir me
APEX çalışmasında, serum ürik asit (sUA) düzeylerinin 6 mg/dL'nin (357 µmol/L) altına
düşürülmesi açısından, hem günlük ADENURIC 80 mg, hem de günlük ADENURIC 120 mg tedavi kollarında, konvansiyonel olarak ku lanılan allopurinol dozları olan 300 mg (n = 258)
/100 mg (n = 10) tedavi koluna kıyasla istatistiksel olarak anlamlı üstünlük gösterilmiştir (bkz. Tablo 1 ve Şekil 1).
FACT Çalışması: Febuksostat Allopurinol Kontrollü Çalışması (FACT), Faz 3, randomize, çift kör, çok merkezli, 52 haftalık bir çalışmadır. 760 hasta randomize edilmiştir: günlük olarak ADENURIC 80 mg (n=256), ADENURIC 120 mg (n=251), ya da allopurinol 300 mg (n=253).
FACT çalışmasında, sUA düzeylerinin 6 mg/dL'nin (357 µmol/L) altına düşürülmesi ve bu düzeylerde tutulması açısından, hem ADENURIC 80 mg, hem de ADENURIC 120 mgtedavi kollarında, konvansiyonel olarak ku lanılan allopurinol dozu olan 300 mg tedavi koluna kıyasla istatistiksel olarak anlamlı üstünlük gösterilmiştir.
Birincil etkililik sonlanım noktası bulguları Tablo 1'de özetlenmiştir:
Tablo 1
Son Üç Aylık Vizitlerde Serum Ürik Asit Düzeyleri <6,0 mg/dL (357 µmol/L) Olan Hastaların Oranı
Çalışma |
ADENURIC 80 mg QD |
ADENURIC 120 mg QD | Allopurinol 300 / 100 mg QD |
APEX (28 hafta) | %48 (n=262) | %65 (n=269) | %22 (n=268) |
FACT | %53 | %62 | %21 |
(52 hafta) | (n=255) | (n=250) | (n=251) |
Birleşik | %51 | %63 | %22 |
Bulgular | (n=517) | (n=519) | (n=519) |
bulgular analizler için birleştirilmiştir. * a lopurinole karşı p < 0,001, 80 mg'a karşı p < 0,001 QD: Günlük doz | |||
ADENURIC'in serum ürik asit düzeylerini düşürme yetisi hızlı ve kalıcı olarak gerçekleşmiş t ir. Serum ürik asit düzeyinin 6,0 mg/dL'nin (357 µmol/L) altına düştüğü 2. hafta yapılan vizitte fark edilmiş ve bu düzeyler tedavi boyunca korunmuştur. İki pivotal Faz 3 çalışmada her bir tedavi grubu için zamana karşı ortalama serum ürik asit düzeyleri Şekil 1'de gösterilmiştir.
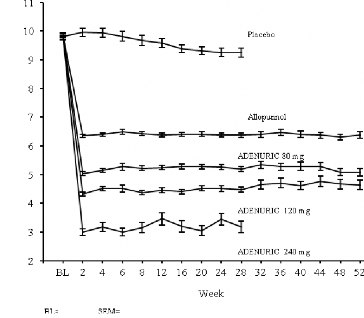
Şekil 1 Kombine Olarak Pivotal Faz 3 Çalışmalarındaki Ortalama Serum Ürik Asit Düzeyleri
Not: 509 hasta günlük allopurinol 300 mg almış; serum kreatinin düzeyi >1,5 ve < 2,0 mg/dL olan 10 hasta günlük 100 mg almıştır (APEX çalışmasındaki 268 hastanın 10'u).
Febuksostatın tavsiye edilen en yüksek dozun iki katı dozundaki güvenliliğini değerlendirmek için 240 mg febuksostat ku lanılmıştır.
CONFIRMS Çalışması: CONFIRMS çalışması, gut hastalığı ve hiperürisemisi olan hastalarda febuksostat 40 mg ve 80 mg'ın güvenliliğini ve etkililiğini allopurinol 300 mg ya da 200 mg ile karşılaştırmalı olarak değerlendirmek için yapılan Faz 3, randomize, kontrollü, 26 haftalık bir çalışmadır. 2269 hasta randomize edilmiştir: Günlük olarak ADENURIC 40 mg (n=757), ADENURIC 80 mg (n=756), ya da allopurinol 300/200 mg QD (n=756). Hastaların en az
%65'inde hafif-orta şiddette renal bozukluk bulunduğu bildirilmiştir (kreatinin klerensi 30- 89 mL/dak). 26 haftalık periyot boyunca gut alevlenmelerine karşı profilaksi uygulamas ı zorunlu tutulmuştur.
Son vizitte serum ürat düzeyleri < 6,0 mg/dL (357 µmol/L) olan hastaların oranı 40 mg febuksostat için %45, febuksostat 80 mg için %67 ve a lopurinol 300/200 mg için %42 olarak bulunmuştur.
Renal bozukluğu olan hasta alt grubunda birincil sonlanım noktası
APEX Çalışmasında, renal bozukluğu olan (yani başlangıçtaki serum kreatinin düzeyi >1,5 mg/dL ve ï‚£2,0 mg/dL) 40 hastada etkililik değerlendirmesi yapılmıştır. Renal bozukluğu olan ve a lopurinole randomize edilen gönüllüler için doz üst limiti günlük 100 mg olarak belirlenmiştir. ADENURIC, birincil etkililik sonlanım noktasına hastaların %44'ünde (günlük 80 mg), %45'inde (günlük 120 mg) ve %60'ında (günlük 240 mg) ulaşmış, günlük a lopur ino l 100 mg ve plasebo gruplarında ise bu oranlar %0 olmuştur.
Sağlıklı gönüllülerde, renal fonksiyondan bağımsız olarak, serum ürik asit konsantrasyonundaki yüzde azalma açısından klinikolarakanlamlıbir farklılıkgözlenmemiştir (renal fonksiyo nu
CONFIRMS çalışmasında, gut hastalığı ve renal bozukluğu olan hastalarda bir analiz prospektif olarak tanımlanmıştır ve febuksostatın gut hastalığı ve hafif veya orta şiddette renal bozukluğu olan hastalarda (çalışmadaki hastaların %65'i) serum ürat düzeylerini <6 mg/dL'ye düşürme açısından a lopurinol 300 mg/200 mg'a kıyasla anlamlı derecede daha etkili olduğunu göstermiştir.
sUA ≥ 10 mg/dL olan hasta alt grubunda birincil sonlanım noktası
Hastaların yaklaşık %40'ının (APEX ve FACT çalışmaları için kombine olarak) başlangıçtak i sUA değeri ≥ 10 mg/dL olarak bulunmuştur. Bu alt grupta ADENURIC, birincil sonlanım noktasına (son 3 vizitte sUA < 6,0 mg/dL), hastaların %41'inde (günlük 80 mg), %48'inde (günlük 120 mg) ve %66'sında (günlük 240 mg) ulaşmıştır; a lopurinol 300 mg/100 mg ve plasebo gruplarında ise bu oranlar sırasıyla %9 ve %0 olarak bulunmuştur.
CONFIRMS çalışmasında, başlangıçtaki serum ürat düzeyi ≥ 10 mg/dL olan ve birinc il sonlanım noktasına (son vizitte sUA < 6,0 mg/dL) ulaşan hastaların oranı, günlük febuksostat 40 mg uygulananlarda %27 (66/249), günlük febuksostat 80 mg uygulananlarda %49 (125/254) ve günlük a lopurinol 300 mg/200 mg uygulananlarda %31 (72/230) olmuştur.
Klinik Sonuçlar: gut alevlenmesi için tedaviye ihtiyaç duyan hastaların oranı
APEX çalışması: 8 haftalık profilaksi periyodu sırasında, febuksostat 120 mg tedavi grubunda gut alevlenmesi için tedaviye ihtiyaç duyan gönüllülerin oranı (%36), febuksostat 80 mg, allopurinol 300 mg ve plasebo grubundakilerden (sırasıyla %28, %23 ve %20) daha büyük olmuştur. Alevlenmeler profilaksi periyodunu takiben artmış ve zamanla kademeli olarak azalmıştır. Hafta 8 ila Hafta 28 arasında gut alevlenmeleri için gönüllülerin %46 ila %55'i tedavi almıştır. Çalışmanın son 4 haftası sırasında (Hafta 24-28) gönüllülerin %15'inde (febuksostat 80, 120 mg), %14'ünde (allopurinol 300 mg) ve %20'sinde (plasebo) gut alevlenmeleri gözlenmiştir.
FACT çalışması: 8 haftalık profilaksi periyodu sırasında, febuksostat 120 mg tedavi grubunda gut alevlenmesi için tedaviye ihtiyaç duyan gönüllülerin oranı (%36), febuksostat 80 mg ve a lopurinol 300 mg grubundakilerden (sırasıyla %22 ve %21) daha büyük olmuştur. 8 haftalık profilaksi periyodundan sonra alevlenmelerin insidansları artmış ve zamanla kademeli olarak azalmıştır (Hafta 8-52 arasında gönüllülerin %64'ünde ve %70'inde gut alevlenmeleri için
tedavi gerekmiştir). Çalışmanın son 4 haftası sırasında (Hafta 49-52) gönüllülerin %6-8'inde (febuksostat 80, 120 mg) ve %11'inde (a lopurinol 300 mg) gut alevlenmeleri gözlenmiştir.
Gut alevlenmeleri için tedaviye ihtiyaç duyan gönü lülerin oranı (APEX ve FACT Çalışmas ı), tedavi periyodunun son 32 haftasında (Hafta 20- 24 ila Hafta 49 - 52 aralıkları) ortalama başlangıç sonrası serum ürat düzeyinin <6,0 mg/dL, <5,0 mg/dL ya da <4,0 mg/dL'ye ulaştığı gruplarda, ortalama başlangıç sonrası serum ürat düzeyinin ≥6,0 mg/dL olduğu gruplara kıyasla sayısal olarak daha küçük olmuştur.
CONFIRMS çalışması sırasında, gut alevlenmeleri için tedaviye ihtiyaç duyan hastalar ın yüzdesi (Gün 1 ila Ay 6), febuksostat 80 mg ve a lopurinol grupları için sırasıyla %31 ve %25 olarak bulunmuştur. Gut alevlenmeleri için tedaviye ihtiyaç duyan hastaların oranı açısında n, febuksostat 80 mg grubu ile 40 mg grubu arasında farklılık gözlenmemiştir.
Uzun dönemli, açık etiketli uzatma çalışmaları
EXCEL Çalışması (C02-021): Excel çalışması, pivotal Faz 3 çalışmaları (APEX ya da FACT) tamamlayan hastalarda yapılan üç yı lık, Faz 3, açık etiketli, çok merkezli, randomize, allopurinol kontrollü bir güvenlilik uzatma çalışmasıdır. Çalışmaya toplam 1086 hasta kaydedilmiştir: günlük olarak ADENURIC 80 mg (n=649), günlük Adenuric 120 mg (n=292) ve günlük allopurinol 300/100 mg (n=145). Hastaların yaklaşık %69'unda, nihai stabil tedaviye ulaşmak için herhangi bir tedavi değişikliği gerekmemiştir. Üç ardışık sUA düzeyi
>6,0 mg/dL olan hastalar çalışmadan çıkarılmıştır.
Serum ürat düzeyleri zaman içerisinde korunmuştur (yani başlangıçta febuksostat 80 mg ve 120 mg ile tedavi edilmekte olan hastaların sırasıyla %91 ve %93'ünde Ay 36'da sUAdüzeyleri <6 mg/dL olarak bulunmuştur).
Üç yıllık verilerde gut alevlenmelerinin insidansında azalma görülmüştür; Ay 16-24'te ve Ay 30-36'da hastaların %4'ten azı alevlenme için tedaviye ihtiyaç duymuştur (yani hastaların
%96'dan fazlası alevlenme için tedaviye ihtiyaç duymamıştır).
Günlük Febuksostat 80 ya da 120 mg ile nihai stabil tedavi uygulanan hastaların sırasıyla
%46'sında ve %38'inde, başlangıçtan son vizite kadar primer palpabl tofüs tamamen ortadan kalkmıştır.
FOCUS Çalışması (TMX-01-005), çalışma TMX-00-004'te 4 haftalık, çift kör, febuksostat doz uygulamasını tamamlamış olan hastalarda yapılan 5 yıllık, Faz 2, açık etiketli, çokmerkezli bir güvenlilik uzatma çalışmasıdır. Çalışmaya 116 hasta kaydedilmiş ve başlangıçta günlük febuksostat 80 mg almıştır. Hastaların %62'sinde sUA <6 mg/dL düzeylerinin korunması için doz ayarlaması gerekli olmamış, %38'inde ise nihai stabil doza ulaşmak için doz ayarlamas ı gerekmiştir.
Son vizitte serum ürat düzeyleri <6,0 mg/dL (357 µmol/L) olan hastaların oranı, her bir febuksostat dozunda %80'den büyük olmuştur (%81-100).
Faz 3 klinik çalışmalar sırasında, febuksostat ile tedavi uygulanan hastalarda (%5,0) hafif karaciğer fonksiyon testi anormallikleri gözlenmiştir. Bu oranlar, allopurinol tedavisi sırasında rapor edilen oranlara (%4,2) benzerdir (bkz. bölüm 4.4). Uzun dönemli açık etiketli uzatma çalışmalarında, uzun dönemli febuksostat tedavisi almakta olan hastalarda (%5,5) ve allopurinol tedavisi almaktaolanhastalarda(%5,8)artmışTSH değerleri (>5,5 µIU/mL)
Pazarlama sonrası uzun dönem çalışmalar
CARES Çalışması, gut hastalığı olan ve miyokardiyal enfarktüs, kararsız anjina için hastaneye yatış, koroner veya serebral revaskülarizasyon prosedürü, inme, hastaneye yatırılmış geçici iskemik atak, periferik vasküler hastalık, ya da mikrovasküler veya makrovasküler hastalık kanıtı bulunan şeker hastalığı dahil majör kardiyovasküler hastalığı geçmişi olan hastalarda febuksostat ve a lopurinol ile kardiyovasküler sonuçları karşılaştıran çok merkezli, randomize, çift-kör, eşdeğerlik çalışmasıdır. 6 mg/dL'den az sUA seviyesine ulaşmak için; febuksostat dozu 40 mg'dan 80 mg'a kadar titre edilmiştir (böbrekfonksiyonuna bakılmaksızın) ve a lopurino l dozu normal böbrek fonksiyonuna sahip ve hafif böbrek yetmezliği olan hastalarda 100 mg'lik artışlarla 300'den 600 mg'a, orta derecede böbrek yetmezliği olan hastalarda 200 mg'dan 400 mg'a titre edilmiştir.
CARES'teki birincil sonlanım noktası; ölümcül olmayan miyokardiyal enfarktüs, ölümcül olmayan inme, kadiyovasküler ölüm ve kararsız anjina nedeniyle acil koroner revaskülarizasyonun bir bileşimi olan Majör Advers Kardiyovasküler Olayın (MACE) ilk meydana geldiği zamandır.
Sonlanım noktaları (birincil ve ikincil), randomize seçilmiş ve en az bir doz çift-kör çalışma ilacı almış gönüllülerin dahil olduğu tedavi amaçlı (ITT) analizlere göre incelenmiştir.
Tüm hastaların %56,6'sı erken dönemde deneme tedavisini bırakmıştır ve hastaların %45'i tüm deneme ziyaretlerini tamamlamamıştır.
Toplamda 6190 hasta ortalama 32 ay boyunca izlenmiştir ve ortalama maruz kalma süresi febuksostat grubundaki (n 3098) hastalar için 728 gün, a lopurinol grubundaki (n 3092) 719 gündür.
Birincil MACE sonlanım noktası, febuksostat ve allopurinol tedavi gruplarında benzer oranlarda meydana gelmiştir (sırasıyla hastaların %10,8'i ve %10,4'ü; tehlike oranı [HR] 1,03; iki taraflı tekrarlanan % 95 güven aralığı [CI] 0,89-1,21).
MACE'in tek tek bileşenlerinin analizinde, febuksostat ile kardiyovasküler ölümler in allopurinolden daha yüksek olduğu görülmüştür (hastaların %4,3'üne karşı %3,2; HR 1,34;
%95 CI 1,03-1,73). Diğer MACE olaylarının oranları febuksostat ve a lopurinol gruplarınd a benzerdir, örneğin ölümcül olmayan miyokardiyal enfarktüs (hastaların % 3,6'sına karşı % 3,8'i; HR 0,93; % 95 CI 0,72-1,21), ölümcül olmayan inme (% 2,3'e karşılık 2,3); HR 1,01; %
95 CI 0,73-1,41) ve kararsız anjina nedeniyle acil revaskülarizasyon (hastaların % 1,6'sı
%1,8'i; HR 0,86; % 95 CI 0,59-1,26). Tüm nedenlere bağlı ölüm oranı, esas olarak o gruptaki daha yüksek kardiyovasküler ölüm oranları nedeniyle, febuksostatta da allopurinol ile karşılaştırıldığında daha yüksektir (% 7,8'e karşılık % 6,4; HR 1,22; % 95 CI 1,01-1,47) (bkz. bölüm 4.4).
Kalp yetmezliği için hastaneye yatış, iskemiyle ilişkili olmayan aritmiler için hastane başvuruları, venöz tromboembolik olaylar ve geçici iskemik ataklar için hastaneye yatış oranları febuksostat ve a lopurinol için benzerdir.
FAST çalışması kronik hiperürisemi (ürat birikiminin halihazırda meydana geldiği koşu larda) ve KV risk faktörleri olan hastalarda (60 yaş ve üzeri ve en az bir başka KV risk faktörü olan hastalar) febuksostat ile a lopurinolün KV güvenlik profilini karşılaştıran prospektif, randomize, açık uçlu, kör sonlanımnoktalıbirçalışmadır.Uygun hastalar randomizas yon
pozolojiye göre gerektiğinde doz ayarlanmıştır. A lopurinol giriş fazının sonunda, sUA düzeyi
<0,36 mmol/L (<6 mg/dL) olan veya maksimum tolere edilen dozu veya maksimum lisans lı allopurinol dozunu alan hastalar ya febuksostat ya da a lopurinol tedavisi almak için
1:1 oranında randomize edilmiştir. FAST çalışmasının birincil sonlanım noktası, Antiplate le t Trialists' Collaborative (APTC) bileşik son noktasında yer alan herhangi bir olayın ilk meydana geldiği zamandı ve bu süre şunları içeriyordu: i) ölümcül olmayan MI/biyobelirteç pozitif akut koroner sendrom (ACS) için hastaneye yatış ; i) ölümcül olmayan felç; i) CV olayı nedeniyle ölüm. Birincil analiz, tedavi (OT) yaklaşımına dayanmaktadır.
Toplamda 3063'ü febuksostat ve 3065'i a lopurinol olmak üzere 6128 hasta randomize edildi.
Primer OT analizinde, ayarlanmış HR 0.85 (%95 GA: 0.70, 1.03), p<0.001 ile allopurinol alan 241(2,41/100 hasta yılı) hastaya kıyasla febuksostat alan 172 (1,72/100 hasta yılı) hastada meydana gelen primer sonlanım noktası insidansında febuksostat a lopurinolden daha aşağıda değildir. MI, inme veya AKS öyküsü olan hasta alt grubunda birincil son nokta için OT analizi, tedavi grupları arasında anlamlı bir fark göstermemiştir: febuksostat grubunda olay yaşayan 65 (%9,5) hasta ve . a lopurinol grubunda olay yaşayan 83 (%11,8); ayarlanmış HR 1.02 (%95
GA: 0.74-1.42); p=0.202.
Febuksostat ile tedavi, genel veya başlangıçta MI, inme, AKS öyküsü olan hasta alt grubunda. KV ölüm veya tüm nedenlere bağlı ölümde artış ile ilişkili değildir. Toplamda febuksostat grubunda (62 KV ölüm ve 108 tüm nedenlere bağlı ölüm), a lopurinol grubuna (82 KV ölüm ve 174 tüm nedenlere bağlı ölüm) göre daha az ölüm vardır.
A lopurinol tedavisine kıyasla febuksostat tedavisinde ürik asit düzeylerinde daha büyük bir düşüş olmuştur.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerSağlıklı gönüllülerde, febuksostatın maksimum plazma konsantrasyonları (C) ve plazma- konsantrasyon zaman eğrisi altındaki alan (AUC) değeri, tek ve çoklu dozlar olarak 10 mg ila 120 mg uygulanmasını takiben dozla orantılı olarak artmıştır. 120 mg ila 300 mg arasındaki dozlarda, febuksostat için AUC değerlerinde dozla orantılı artıştan daha yüksek bir artış gözlenmiştir. 10 mg ila 240 mg arası dozlar 24 saatte bir uygulandığında kayda değer bir birikme olmamıştır. Febuksostatın görünür ortalama terminal eliminasyon yarılanma ömrü (t1/2) yaklaşık 5 ila 8 saattir.
Hiperürisemisi ve gut hastalığı olan ve günlük ADENURIC 40-240 mg ile tedavi uygulanan 211 hastada popülasyon farmakokinetiği/farmakodinamiği analizleri yapılmıştır. Genel olarak, febuksostatın bu analizlerle tahmin edilen farmakokinetik parametreleri, sağlıklı gönüllülerd e elde edilenlerle uyumludur; bu da, sağlıklı gönüllülerin gut hastalığı olan hasta popülasyonundaki farmakokinetik/farmakodinamik değerlendirmeleri için temsil edici nitelikt e olduğunu göstermektedir.
Emilim
Febuksostat, hızla (t1,0-1,5 saat) ve iyi emilir (en az %84). Tek ya da çoklu olarak oral yolla günde bir kez 80 ve 120 mg dozlardan sonra, Csırasıyla yaklaşık 2,8-3,2 µg/mL ve 5,0-5,3 µg/mL olarak bulunmuştur. Febuksostat tablet formülasyonunun mutlak biyoyararlanımı araştırılmamıştır.
Günde bir kez çoklu oral 80 mg dozları ya da tek bir 120 mg dozu (yağ oranı yüksek bir öğünle
birlikte) takiben, Cdeğerinde sırasıyla %49 ve %38 azalma ve AUC değerinde
%18 ve %16 azalma gözlenmiştir. Ancak, test edildiği durumlarda, serum ürik asit konsantrasyonundaki yüzde azalmada klinik olarak anlamlı bir değişiklik olmamıştır (80 mg çoklu doz). Dolayısıyla, ADENURIC yemekle birlikte ya da ayrı olarak alınabilir.
Dağılım
Febuksostatın oral yolla uygulanan 10-300 mg dozlardan sonraki görünür kararlı durum dağılım hacmi (V/F), 29 ila 75 L aralığında yer almaktadır. Febuksostatın plazma proteinler ine bağlanma oranı yaklaşık %99,2'dir (esas olarak albümine) ve 80 ila 120 mg dozlarda ulaşıla n konsantrasyon aralığı boyunca sabittir. Aktif metabolitlerin plazma proteinlerine bağlanma oranı yaklaşık %82 ila %91 aralığında yer almaktadır.
Biyotransformasyon
Febuksostat, üridin difosfat glukuronosiltransferaz (UDPGT) enzim sistemi aracılığıyla konjugasyon yoluyla ve sitokrom P450 (CYP) sistemi aracılığıyla oksidasyon yoluyla yaygın olarak metabolize edilir. Farmakolojik olarak aktif dört hidroksil metaboliti tanımlanmışt ır ; bunların üçü insan plazmasında meydana gelmektedir. İnsan karaciğeri mikrozomlarıyla yapılan in vitro çalışmalar, bu oksidatif metabolitlerin esas olarak CYP1A1, CYP1A2, CYP2C8 ya da CYP2C9 tarafından, febuksostat glukronidin ise esas olarak UGT 1A1, 1A8ve 1A9 tarafından oluşturulduğunu göstermiştir.
Eliminasyon
Febuksostat, hem hepatik, hem de renal yolaklarla elimine edilir. Oral yolla uygulanan 80 mg C-işaretli febuksostat dozunu takiben, dozun yaklaşık %49'u, değişmemiş febuksostat olarak (%3), etkin maddenin açil glüküronidi olarak (%30), bilinen oksidatif metabolitleri ve bunların konjugatları olarak (%13) ve diğer bilinmeyen metabolitler olarak (%3) idrarda tespit edilmiş t ir. İdrarla atılıma ek olarak, dozun yaklaşık %45'i, değişmemiş febuksostat olarak (%12), etkin maddenin açil glüküronidi olarak (%1), bilinen oksidatif metabolitleri ve bunların konjugatları olarak (%25) ve diğer bilinmeyen metabolitler olarak (%7) dışkıda tespit edilmiştir.
Renal bozukluk
Hafif, orta ya da şiddetli renal bozukluğu olan hastalara çoklu dozlar olarak 80 mg ADENURIC uygulanmasını takiben febuksostatın Cdeğeri, renal fonksiyonu normal olan gönüllülere göre değişmemiştir. Febuksostatın ortalama toplam AUC değeri, şiddetli renal fonksiyon bozukluğu olan grupta, renal fonksiyonu normal olan gruptaki değerin (7,5 ïgsaat/mL) yaklaşık 1,8 katına çıkmıştır (13,2 ïg.saat/mL). Aktif metabolitlerin CveAUC değerleri sırasıyla 2 ve 4 kata kadar artmıştır. Bununla birlikte, hafif veya orta şiddette renal bozukluğu olan hastalarda doz ayarlaması gerekli değildir.
Hepatik bozukluk
Hafif (Child-Pugh Sınıf A) ya da orta şiddette (Child-Pugh Sınıf B) hepatik bozukluğu olan hastalarda, çoklu dozlar olarak 80 mg ADENURIC uygulanmasını takiben febuksostatın ve metabolitlerinin Cve AUC değerleri hepatik fonksiyonu normal olan gönüllülere kıyasla anlamlı derecede değişmemiştir. Şiddetli hepatik bozukluğu olan (Child-Pugh Sınıf C) hastalarda çalışma yapılmamıştır.
Yaş
Yaşlılarda, çoklu oral dozlar olarak ADENURIC uygulamasını takiben febuksostatın ya da metabolitlerinin AUC değerlerinde, daha genç sağlıklı gönüllülere kıyasla anlamlı değişiklik le r
gözlenmemiştir.
Cinsiyet
Çoklu oral dozlar olarak ADENURIC uygulamasını takiben Cve AUC değerleri kadınlarda erkeklerdekinden sırasıyla %24 ve %12 daha yüksek bulunmuştur. Ancak, ağırlığa göre düzeltilmiş Cve AUC değerleri cinsiyetler arasında benzer bulunmuştur. Cinsiyete göre doz ayarlaması gerekli değildir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı çalışmalardaki etkiler, genellikle insanlardaki maksimum maruziyeti aşan maruziyetlerde gözlenmiştir.
Sıçanlarda yapılan bir klinik öncesi çalışmadan elde edilen verilerin modellenmesi ve simülasyon analizi, febuksostat ile birlikte uygulanması durumunda merkaptopurin/azatiopr in dozunun önceden reçetelenmiş dozun % 20'sine veya altına düşürülmesi gerektiğini gösterir (bkz. bölüm 4.4 ve bölüm 4.5).
Karsinojenez, mutajenez, fertilite bozulması
Erkek sıçanlarda, mesane tümörlerinde (tranzisyonel hücreli papillom ve karsinom) istatistikse l olarak anlamlı artış, yalnızca yüksek doz grubunda, insanlardaki maruziyetin yaklaşık 11 katında, ksantin kalkü leriyle ilişkili olarak saptanmıştır. Erkek ya da dişi farelerde ya da sıçanlarda başka hiçbir tümör tipinde anlamlı bir artış olmamıştır. Bu bulguların, türe özgü purin metabolizmasının ve idrar bileşiminin bir sonucu olduğu ve klinik ku lanımla ilgili olmadığı düşünülmektedir.
Genotoksisite ile ilgili olarak yapılan testlerde, febuksostat için herhangi bir genotoksik etki saptanmamıştır.
48 mg/kg/gün'e kadar oral dozlardaki febuksostatın erkek ve dişi sıçanlarda fertilite ve üreme performansı üzerinde herhangi bir etki göstermediği saptanmıştır.
Febuksostattan kaynaklanan fertilite bozulmasına, teratojenik etkilere ya da fetüs üzerinde zararlara dair hiçbir kanıt saptanmamıştır. Sıçanlarda, insanlardaki maruziyetin yaklaşık 4,3 katında, sütten kesme indeksinde düşüşün ve yavrularda gelişim geriliğinin eşlik ettiği yüksek doz maternal toksisitesi saptanmıştır. Gebe sıçanlarda insanlardaki maruziyetin yaklaşık 4,3 katında ve gebe tavşanlarda insanlardaki maruziyetin yaklaşık 13 katında yapılan teratoloji çalışmaları, herhangi bir teratojenik etkiyi ortaya çıkarmamıştır.
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
İLAÇ GENEL BİLGİLERİ
MENARİNİ İlaç Sanayi ve Ticaret A.Ş
| Geri Ödeme Kodu | A16936 |
| Satış Fiyatı | 348.28 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 348.28 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699832090598 |
| Etkin Madde | Febuksostat |
| ATC Kodu | M04AA03 |
| Birim Miktar | 80 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Kas İskelet Sistemi > Gut İlaçları > Febuxostat |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |