ADENURIC 80 mg 28 film kaplı tablet Klinik Özellikler
{ Febuksostat }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ADENURIC, ürat depozisyonunun gerçekleşmiş olduğu durumlarda (tofüs ve/veya gut artriti öyküsü ya da varlığı dahil) kronik hiperüriseminin tedavisi için endikedir.
![]()
yanıt veren, a lopurinolü tolere edemeyen veya a lopurinol ile tedavinin önerilmediği hastalarda ku lanılmalıdır.
Daha önceden majör kardiyovasküler hastalıkları (örneğin, miyokard enfarktüsü, Sınıf III-IV kalp yetmezliği) olan hastalarda yalnızca maksimum titre edilmiş a lopurinol dozuna yetersiz
ADENURIC yetişkinlerde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/Uygulama sıklığı ve süresi:
ADENURIC'in tavsiye edilen oral dozu, yemekle birlikte ya da ayrı olarak günde bir kez 80 mg'dır. 2-4 hafta sonra serum ürik asit düzeyi > 6 mg/dL (357 µmol/L) ise, günde bir kez 120 mg ADENURIC uygulanması düşünülebilir.
ADENURIC, serum ürik asit düzeyinin 2 hafta sonra yeniden test edilmesine izin vermeye yetecek kadar hızlı etki gösterir. Terapötik hedef, serum ürik asit düzeyini 6 mg/dL'nin (357 μmol/L) altına düşürmek ve burada tutmaktır.
Gut alevlenme profilaksisi için en az 6 ay profilaksi uygulanması tavsiye edilir (bkz. bölüm 4.4).
Uygulama şekli:
Oral ku lanım içindir.
ADENURIC ağız yoluyla alınmalıdır ve yemekle birlikte ya da ayrı olarak alınabilir.
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:
Şiddetli renal bozukluğu olan hastalarda (kreatinin klerensi <30 mL/dak, bkz. bölüm 5.2) etkililik ve güvenlilik tam olarak değerlendirilmemiştir.
Hafif veya orta şiddette renal bozukluğu olan hastalarda doz ayarlaması gerekli değildir.
Karaciğer yetmezliği:
Şiddetli hepatik bozukluğu olan hastalarda (Child Pugh Sınıf C) febuksostatın etkililiği ve güvenliliği araştırılmamıştır.
Hafif hepatik bozukluğu olan hastalarda tavsiye edilen doz 80 mg'dır. Orta şiddette hepatik bozukluğu olan hastalarla ilgili olarak sınırlı bilgi mevcuttur.
Pediyatrik popülasyon:
ADENURIC'in 18 yaş altı çocuklardaki etkililiği ve güvenliliği belirlenmemiştir. Veri mevcut değildir.
Geriyatrik popülasyon:
Yaşlılarda doz ayarlaması gerekli değildir (bkz. bölüm 5.2).
4.3. Kontrendikasyonlar
ADENURIC, etkin maddeye ya da bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine aşırı duyarlılık durumunda kontrendikedir (ayrıca bkz. bölüm 4.8).
4.4. Özel kullanım uyarıları ve önlemleri
Kardiyovasküler bozukluklar
hastalarda a lopurinole kıyasla febuksostat ile daha fazla sayıda ölümcül kardiyovasküler olay
meydana geldiği gözlenmiştir.
Bununla birlikte, bu çalışmanın ardından yapılan ruhsatlandırma sonrası FAST çalışmasında, febuksostat hem ölümcül hem de ölümcül olmayan kardiyovasküler olayların insidansı açısından allopurinolden düşük değildir.
Bu hasta grubunun tedavisi dikkatli yapılmalı ve hasta grubu düzenli olarak izlenmelid ir. (Febuxostat'ın kardiyovasküler güvenliği ile ilgili daha fazla ayrıntı için bölüm 4.8 ve bölüm 5.1'e bakınız.)
Tıbbi ürüne alerji / aşırı duyarlılık
İlacın pazara verilmesi sonrasında, yaşamı tehdit edici Stevens-Johnson Sendromu, Toksik epidermal nekroliz ve akut anafilaktik reaksiyon/şok dahil olmak üzere ciddi alerjik/aş ır ı duyarlılık reaksiyonlarıyla ilgili nadir olan raporlar toplanmıştır. Çoğu olguda, bu reaksiyonla r febuksostat ile tedavinin ilk ayında meydana gelmiştir. Bu hastaların hepsi değilse de bazılar ı, renal bozukluk ve/veya daha önce allopurinole aşırı duyarlılık yaşadıklarını belirtmiştir. Bazı olgularda, şiddetli aşırı duyarlılık reaksiyonları, Eozinofili ve Sistemik Semptomlarla Seyreden İlaç Reaksiyonu (DRESS) da dahil olmak üzere, ateş, hematolojik, renal ya da hepatik tutulumla ilişkili bulunmuştur.
Hastalar, belirti ve semptomlar konusunda uyarılmalı ve alerjik reaksiyonlar/aşırı duyarlılık reaksiyonları açısından yakından izlenmelidir (bkz. bölüm 4.8). Stevens-Johnson Sendromu dahil olmak üzere ciddi alerjik reaksiyonlar/aşırı duyarlılık reaksiyonları meydana geldiği takdirde febuksostat tedavisi derhal durdurulmalıdır; çünkü ilacın erken kesilmesi daha iyi prognozla ilişkilidir. Stevens-Johnson Sendromu ve akut anafilaktik reaksiyon/şok dahil olmak üzere alerjik reaksiyonlar/aşırı duyarlılık reaksiyonları gelişen hastalarda febuksostat tedavisi hiçbir zaman yeniden başlatılmamalıdır.
Akut gut atakları (gut alevlenmesi)
Febuksostat tedavisi, akut gut atağı tamamen geçmeden başlatılmamalıdır. Gut alevlenmeler i, tedavinin başlatılması sırasında, serum ürik asit düzeylerinin değişmesi ve bunun sonucunda doku depozitlerinden ürat mobilizasyonunun gerçekleşmesi nedeniyle meydana gelebilir (bkz. bölüm 4.8 ve 5.1). Febuksostat tedavisinin başlangıcında, bir NSAİİ ya da kolşisin ile en az 6 ay alevlenme profilaksisinin uygulanması tavsiye edilmektedir (bkz. bölüm 4.2).
Febuksostat tedavisi sırasında gut alevlenmesi olursa ilaç kesilmemelidir. Gut alevlenmes i hasta için uygun olduğu şekilde eşzamanlı olarak yönetilmelidir. Febuksostat ile sürekli tedavi gut alevlenmelerinin sıklığını ve şiddetini azaltır.
Ksantin depozisyonu
Ürat oluşum hızının büyük ölçüde artmış olduğu hastalarda (örn. malign hastalık ve tedavisi, Lesch-Nyhan sendromu) ksantinin idrardaki mutlak konsantrasyonu nadir olgularda, idrar yolunda depozisyona olanak sağlamaya yetecek kadar artabilir. Febuksostat ile herhangi bir deneyim olmadığından, bu popülasyonlarda ku lanılması tavsiye edilmemektedir.
Merkaptopurin/azatioprin
Febuxostat tarafından ksantin oksidazın inhibe edilmesi gibi şiddetli toksisite ile sonuçlanabilecek artan merkaptopürin/azatioprin plazma konsantrasyonlarına neden olabileceğinden, merkaptopurin/azatioprin ile birlikte tedavi edilen hastalarda febuksostat ku lanımı önerilmez. İnsanlardaetkileşimçalışmasıyapılmamıştır. Kombinasyo nun
edilmektedir. Sıçanlarda yapılan bir klinik öncesi çalışmadan elde edilen veriler in
mode lenmesi ve simülasyon analizine dayanarak; olası hematolojik etkilerden kaçınmak için merkaptopurin/azatiyoprin dozu, febuksostat ile birlikte ku lanıldığında önceden reçetelenmiş dozun % 20'sine veya altına düşürülmelidir (bkz. bölüm 4.5 ve bölüm 5.3).
Hastalar yakından izlenmeli ve ardından merkaptopurin/azatioprin dozu terapötik yanıtın değerlendirilmesine ve olası toksik etkilerin başlangıcına dayanarak ayarlanmalıdır.
Organ transplant alıcıları
Organ transplant alıcılarında edinilen herhangi bir deneyim mevcut olmadığından, bu hastalarda febuksostat ku lanılması tavsiye edilmemektedir (bkz. bölüm 5.1).
Teofilin
Febuksostat 80 mg ile teofilin 400 mg (tek doz) sağlıklı gönüllülere birlikte uygulandığında hiçbir farmakokinetik etkileşim gözlenmemiştir (bkz. bölüm 4.5). Febuksostat 80 mg, eşzamanlı teofilin tedavisi uygulanan hastalarda, plazma teofilin düzeylerinin artma riski olmaksızın ku lanılabilir. Febuksostat 120 mg için veri mevcut değildir.
Karaciğer bozuklukları
Birleşik faz 3 çalışmaları sırasında, febuksostat ile tedavi uygulanan hastalarda (%5,0) hafif karaciğer fonksiyon testi anormallikleri gözlenmiştir. Febuksostat tedavisi başlatılmadan önce ve bunun ardından klinik hükme dayanılarak periyodik şekilde karaciğer fonksiyon testi yapılması tavsiye edilmektedir (bkz. bölüm 5.1).
Tiroid bozuklukları
Uzun dönemli açık uçlu uzatma çalışmalarında, uzun dönem febuksostat tedavisi uygulanan hastalarda artmış TSH değerleri (>5,5 µIU/mL) gözlenmiştir (%5,5). Tiroid fonksiyonunun değişiklik gösterdiği hastalarda febuksostat ku lanılırken dikkatli olunmalıdır (bkz. bölüm 5.1).
Laktoz
Febuksostat tabletleri laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz- galaktoz malabsorpsiyon problemi olan hastaların bu ilacı ku lanmamaları gerekir.
Sodyum
Bu tıbbi ürün her tabeltte 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Merkaptopurin/azatioprin
Febuksostatın ksantin oksidaz (XO) inhibisyonu üzerindeki etki mekanizmasına dayanılarak, eşzamanlı ku lanım tavsiye edilmemektedir. XO'nun febuksostat tarafından inhibisyonu, bu ilaçların plazma konsantrasyonlarının artarak toksisiteye yol açmasına neden olabilir (bkz. bölüm 4.4). Febuksostatın XO tarafından metabolize edilen ilaçlarla (teofilin hariç) ilaç etkileşimi çalışmaları insanlarda yapılmamıştır.
Sıçanlarda yapılan bir klinik öncesi çalışmadan elde edilen verilerin modellenmesi ve simülasyon analizi, febuksostatilebirlikteuygulanmasıdurumunda merkaptopurin/azatiopr in
(bkz. bölüm 4.5 ve bölüm 5.3).
Febuksostatın sitotoksik kemoterapi ile ilaç etkileşimi çalışmaları yapılmamıştır. Febuksostatın sitotoksik tedavi sırasındaki güvenliliği ile ilgili veri mevcut değildir.
Rosiglitazon/CYP2C8 substratları
Febuksostatın in vitro olarak CYP2C8'in zayıf bir inhibitörü olduğu gösterilmiştir. Sağlıklı gönüllülerde yapılan bir çalışmada, 4 mg tek oral dozda rosiglitazon ile birlikte günlük 120 mg febuksostat uygulamasının rosiglitazon ve metaboliti N-desmetil rosiglitazo nun farmakokinetiğini etkilememiştir; bu da, febuksostatın in vivo olarak bir CYP2C8 enzimi inhibitörü olmadığını göstermektedir. Dolayısıyla, febuksostatın rosiglitazon ya da diğer CYP2C8 substratları ile birlikte uygulanması durumunda, bu bileşikler için herhangi bir doz ayarlaması gerekmemektedir.
Teofilin
XO inhibisyonunun diğer XO inhibitörlerinde rapor edildiği şekilde, dolaşımdaki teofilin düzeylerinde artışa neden olup olmadığını değerlendirmek için, sağlıklı gönüllülerd e febuksostat ile bir etkileşim çalışması yapılmıştır. Çalışmanın bulguları, teofilin 400 mg tek doz uygulaması ile birlikte günlük febuksostat 80 mg uygulaması yapılmasının teofilini n farmakokinetiğini etkilemediğini göstermiştir. Dolayısıyla, febuksostat 80 mg ve teofilini n eşzamanlı olarak verilmesi konusunda özel bir uyarı belirtilmemektedir. Febuksostat 120 mg için veri mevcut değildir.
Naproksen ve diğer glukuronidasyon inhibitörleri
Febuksostatın metabolizması, Uridin Glukuronozil Transferaz (UGT) enzimlerine bağımlıd ır. NSAİİ'lar ve probenesid gibi glukuronidasyonu inhibe eden tıbbi ürünler, teorik olarak, febuksostatın eliminasyonunu etkileyebilir. Sağlıklı gönüllülerde febuksostat ile 250 mg naproksenin günde iki kez eşzamanlı ku lanımı, febuksostat maruziyetinde artış ile ilişkilendirilmiştir (C%28, AUC %41 ve t%26). Klinik çalışmalarda, naproksenin ya da diğer NSAİİ'ların/Cox-2 inhibitörlerinin ku lanılması advers olaylarda klinik olarak anlamlı bir artışla ilişkili olmamıştır.
Febuksostat, naproksen ile birlikte uygulanabilir ve febuksostat ya da naproksen için doz ayarlaması gerekmez.
Glukuronidasyon indükleyicileri
UGT enzimlerinin potent indükleyicileri, metabolizmada artışa ve febuksostat etkililiği nde azalmaya yol açabilir. Bu nedenle, potent bir glukuronidasyon indükleyicisi ile tedavinin başlatılmasından 1-2 hafta sonra serum ürik asit izlemi yapılması tavsiye edilmektedir. Bunun aksine, indükleyici ile uygulanan tedavinin kesilmesi, febuksostatın plazma düzeylerini n yükselmesine yol açabilir.
Kolşisin/indometasin/hidroklorotiazid/varfarin
Febuksostat, kolşisin ya da indometasin ile birlikte uygulanabilir ve febuksostat ya da birlikte uygulanan etkin madde için doz ayarlaması gerekmez.
Hidroklorotiazid ile birlikte uygulandığında febuksostat için doz ayarlaması gerekmez.
Febuksostat ile birlikte uygulandığında varfarin için doz ayarlaması gerekmez. Febuksostatın (80 mg ya da 120 mg, günde bir kez) varfarin ile birlikte uygulanması sağlıklı gönü lülerde
varfarinin farmakokinetiğini etkilememiştir. INR ve Faktör VII aktivitesi de febuksostat ile
birlikte uygulamadan etkilenmemiştir.
Desipramin/CYP2D6 substratları
Febuksostatın in vitro olarak CYP2D6'nın zayıf bir inhibitörü olduğu gösterilmiştir. Sağlıklı gönüllülerde yapılan bir çalışmada, günlük 120 mg ADENURIC, bir CYP2D6 substratı olan desipraminin AUC değerinde ortalama %22 artışa neden olmuştur; bu da febuksostatın in vivo olarak CYP2D6 enzimi üzerinde potansiyel zayıf inhibitör etkisinin olduğunu göstermektedir. Dolayısıyla, febuksostatın diğer CYP2D6 substratları ile birlikte uygulanması durumunda, bu bileşikler için herhangi bir doz ayarlaması gerektirmemektedir.
Antasitler
Magnezyum hidroksit ve alüminyum hidroksit içeren bir antasidin eşzamanlı olarak alınmasının febuksostatın emilimini geciktirdiği (yaklaşık 1 saat) ve C değerinde %32 azalmaya neden olduğu gösterilmiş; ancak AUC'de anlamlı bir değişiklik gözlenmemiştir. Dolayısıyla, febuksostat antasit kullanımına dikkat edilmeksizin alınabilir.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Gebelik sırasında insanlar için potansitel risk ve ayrıca febuksastatın insan sütüne geçip geçmediği ve insan fertilitesine olan etkileri bilinmediğinden, planlı bir hamilelikten önce daha uygun alternatif bir tedaviye geçilmelidir.
Çocuk doğurma potansiyeli bulunan kadınlar uygun bir doğum kontrolü uygulamalıdır.
Gebelik dönemi
Maruziyetin gerçekleştiği çok sınırlı sayıda gebede elde edilen veri, febuksostatın gebelik ya da fetüsün/yenidoğanın sağlığı üzerinde herhangi bir advers etkiye işaret etmemekted ir. Hayvanlarda yapılan çalışmalarda, gebelik, embriyonal/fetal gelişim ya da doğum açısından doğrudan ya da dolaylı herhangi bir zararlı etki saptanmamıştır (bkz. bölüm 5.3). İnsanlar için potansiyel risk bilinmemektedir. Febuksostat gebelik sırasında ku lanılmamalıdır.
Laktasyon dönemi
Febuksostatın insanlarda anne sütüne geçip geçmediği bilinmemektedir. Hayvanlarda yapılan çalışmalar febuksostatın anne sütüne geçtiğini ve emzirilen yavruların gelişiminde bozulma olduğunu göstermiştir. Emzirilen bebek açısından risk ihmal edilemez. Febuksostat emzir me sırasında ku lanılmamalıdır.
Üreme yeteneği/Fertilite
Hayvanlarda, 48 mg/kg/gün'e kadar dozlarda yapılan üreme çalışmalarında fertilite üzerinde doza bağımlı herhangi bir advers etki görülmemiştir (bkz. bölüm 5.3). ADENURIC'in insan fertilitesi üzerindeki etkisi bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.9. Doz aşımı ve tedavisi
Doz aşımı durumunda hastalara semptomatik ve destekleyici tedavi uygulanmalıdır.
Farmakoterapötik grup: Gut hastalığına karşı ku lanılan ilaçlar, ürik asit üretimini inhibe eden preparatlar
ATC kodu: M04AA03
Etki mekanizması
Ürik asit, insanlarda purin metabolizmasının son ürünüdür ve hipoksantinï® ksantin ï® ürik asit kaskadında üretilmektedir. Yukarıda belirtilen transformasyonlardaki her iki adım da, ksantin oksidaz (XO) tarafından katalizlenmektedir. Febuksostat, terapötik etkisini (serumürik asit düzeyinin düşürülmesi) XO'yu selektif olarak inhibe etme yoluyla sağlayan bir 2- ariltia zol türevidir. Febuksostat, XO'nun potent, non-purin selektif bir inhibitörüdür (NP- SIXO) ve in vitro inhibisyon Ki değeri 1 nanomolardan küçüktür. Febuksostatın, XO'nun hem oksitlenmiş, hem de indirgenmiş formlarını potent olarak inhibe ettiği gösterilmişt ir. Febuksostat, terapötik konsantrasyonlarda, purin ya da pirimidin metabolizmasına katılan diğer enzimleri (guanin deaminaz, hipoksantin guanin fosforibosiltransferaz, orotat fosforibosiltransferaz, orotidin monofosfat dekarboksilaz ya da purin nükleosid fosforilaz) inhibe etmez.
Klinik etkililik ve güvenlilik
ADENURIC'in etkililiği, hiperürisemisi ve gut hastalığı olan 4101 hastada yürütülen üç adet Faz 3 pivotal çalışmada (iki pivotal APEX ve FACT çalışması ve ek CONFIRMS çalışmas ı (aşağıda tanımlanmıştır)) gösterilmiştir. Her bir faz 3 pivotal çalışmada, ADENURIC'in, serum ürik asit düzeylerini düşürme ve bu düzeylerde tutma yetisinin a lopurinole kıyasla üstün olduğu gösterilmiştir. APEX ve FACT çalışmalarında birincil etkililik sonlanım noktası, son 3 aylık serum ürik asit düzeyleri < 6,0 mg/dL (357 µmol/L) olan hastaların oranıdır. Bulgular ın ADENURIC için ruhsatının ilk kez verilmesinden sonra elde edildiği ek faz 3 CONFIRMS çalışmasında birincil etkililik son noktası, son vizitte serum ürat düzeyleri < 6,0 mg/dL olan hastaların oranıdır. Bu çalışmalara, organ transplant alıcısı olan hiçbir hasta dahil edilmemiş t ir (bkz. bölüm 4.2).
APEX Çalışması: Febuksostatın Allopurinol ve Plasebo Kontrollü Etkililik Çalışması (APEX), Faz 3, randomize, çift kör, çok merkezli, 28 haftalık bir çalışmadır. 1072 hasta randomize edilmiştir: plasebo (n=134), günlük olarak ADENURIC 80 mg (n=267), ADENURIC 120 mg (n=269), ADENURIC 240 mg (n=134) ya da a lopurinol (başlangıçtaki serum kreatinin düzeyi
ï£1,5 mg/dL olan hastalar için günde 300 mg [n=258] veya başlangıçtaki serum kreatinin düzeyi
>1,5 mg/dL ve ï£2,0 mg/dL olanhastalariçingünde100mg[n=10]). Güvenlilik değerlendir me
APEX çalışmasında, serum ürik asit (sUA) düzeylerinin 6 mg/dL'nin (357 µmol/L) altına
düşürülmesi açısından, hem günlük ADENURIC 80 mg, hem de günlük ADENURIC 120 mg tedavi kollarında, konvansiyonel olarak ku lanılan allopurinol dozları olan 300 mg (n = 258)
/100 mg (n = 10) tedavi koluna kıyasla istatistiksel olarak anlamlı üstünlük gösterilmiştir (bkz. Tablo 1 ve Şekil 1).
FACT Çalışması: Febuksostat Allopurinol Kontrollü Çalışması (FACT), Faz 3, randomize, çift kör, çok merkezli, 52 haftalık bir çalışmadır. 760 hasta randomize edilmiştir: günlük olarak ADENURIC 80 mg (n=256), ADENURIC 120 mg (n=251), ya da allopurinol 300 mg (n=253).
FACT çalışmasında, sUA düzeylerinin 6 mg/dL'nin (357 µmol/L) altına düşürülmesi ve bu düzeylerde tutulması açısından, hem ADENURIC 80 mg, hem de ADENURIC 120 mgtedavi kollarında, konvansiyonel olarak ku lanılan allopurinol dozu olan 300 mg tedavi koluna kıyasla istatistiksel olarak anlamlı üstünlük gösterilmiştir.
Birincil etkililik sonlanım noktası bulguları Tablo 1'de özetlenmiştir:
Tablo 1
Son Üç Aylık Vizitlerde Serum Ürik Asit Düzeyleri <6,0 mg/dL (357 µmol/L) Olan Hastaların Oranı
Çalışma |
ADENURIC 80 mg QD |
ADENURIC 120 mg QD | Allopurinol 300 / 100 mg QD |
APEX (28 hafta) | %48 (n=262) | %65 (n=269) | %22 (n=268) |
FACT | %53 | %62 | %21 |
(52 hafta) | (n=255) | (n=250) | (n=251) |
Birleşik | %51 | %63 | %22 |
Bulgular | (n=517) | (n=519) | (n=519) |
bulgular analizler için birleştirilmiştir. * a lopurinole karşı p < 0,001, 80 mg'a karşı p < 0,001 QD: Günlük doz | |||
ADENURIC'in serum ürik asit düzeylerini düşürme yetisi hızlı ve kalıcı olarak gerçekleşmiş t ir. Serum ürik asit düzeyinin 6,0 mg/dL'nin (357 µmol/L) altına düştüğü 2. hafta yapılan vizitte fark edilmiş ve bu düzeyler tedavi boyunca korunmuştur. İki pivotal Faz 3 çalışmada her bir tedavi grubu için zamana karşı ortalama serum ürik asit düzeyleri Şekil 1'de gösterilmiştir.
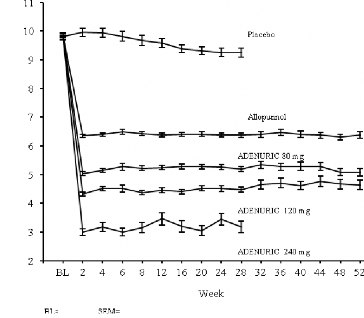
Şekil 1 Kombine Olarak Pivotal Faz 3 Çalışmalarındaki Ortalama Serum Ürik Asit Düzeyleri
Not: 509 hasta günlük allopurinol 300 mg almış; serum kreatinin düzeyi >1,5 ve < 2,0 mg/dL olan 10 hasta günlük 100 mg almıştır (APEX çalışmasındaki 268 hastanın 10'u).
Febuksostatın tavsiye edilen en yüksek dozun iki katı dozundaki güvenliliğini değerlendirmek için 240 mg febuksostat ku lanılmıştır.
CONFIRMS Çalışması: CONFIRMS çalışması, gut hastalığı ve hiperürisemisi olan hastalarda febuksostat 40 mg ve 80 mg'ın güvenliliğini ve etkililiğini allopurinol 300 mg ya da 200 mg ile karşılaştırmalı olarak değerlendirmek için yapılan Faz 3, randomize, kontrollü, 26 haftalık bir çalışmadır. 2269 hasta randomize edilmiştir: Günlük olarak ADENURIC 40 mg (n=757), ADENURIC 80 mg (n=756), ya da allopurinol 300/200 mg QD (n=756). Hastaların en az
%65'inde hafif-orta şiddette renal bozukluk bulunduğu bildirilmiştir (kreatinin klerensi 30- 89 mL/dak). 26 haftalık periyot boyunca gut alevlenmelerine karşı profilaksi uygulamas ı zorunlu tutulmuştur.
Son vizitte serum ürat düzeyleri < 6,0 mg/dL (357 µmol/L) olan hastaların oranı 40 mg febuksostat için %45, febuksostat 80 mg için %67 ve a lopurinol 300/200 mg için %42 olarak bulunmuştur.
Renal bozukluğu olan hasta alt grubunda birincil sonlanım noktası
APEX Çalışmasında, renal bozukluğu olan (yani başlangıçtaki serum kreatinin düzeyi >1,5 mg/dL ve ï£2,0 mg/dL) 40 hastada etkililik değerlendirmesi yapılmıştır. Renal bozukluğu olan ve a lopurinole randomize edilen gönüllüler için doz üst limiti günlük 100 mg olarak belirlenmiştir. ADENURIC, birincil etkililik sonlanım noktasına hastaların %44'ünde (günlük 80 mg), %45'inde (günlük 120 mg) ve %60'ında (günlük 240 mg) ulaşmış, günlük a lopur ino l 100 mg ve plasebo gruplarında ise bu oranlar %0 olmuştur.
Sağlıklı gönüllülerde, renal fonksiyondan bağımsız olarak, serum ürik asit konsantrasyonundaki yüzde azalma açısından klinikolarakanlamlıbir farklılıkgözlenmemiştir (renal fonksiyo nu
CONFIRMS çalışmasında, gut hastalığı ve renal bozukluğu olan hastalarda bir analiz prospektif olarak tanımlanmıştır ve febuksostatın gut hastalığı ve hafif veya orta şiddette renal bozukluğu olan hastalarda (çalışmadaki hastaların %65'i) serum ürat düzeylerini <6 mg/dL'ye düşürme açısından a lopurinol 300 mg/200 mg'a kıyasla anlamlı derecede daha etkili olduğunu göstermiştir.
sUA ≥ 10 mg/dL olan hasta alt grubunda birincil sonlanım noktası
Hastaların yaklaşık %40'ının (APEX ve FACT çalışmaları için kombine olarak) başlangıçtak i sUA değeri ≥ 10 mg/dL olarak bulunmuştur. Bu alt grupta ADENURIC, birincil sonlanım noktasına (son 3 vizitte sUA < 6,0 mg/dL), hastaların %41'inde (günlük 80 mg), %48'inde (günlük 120 mg) ve %66'sında (günlük 240 mg) ulaşmıştır; a lopurinol 300 mg/100 mg ve plasebo gruplarında ise bu oranlar sırasıyla %9 ve %0 olarak bulunmuştur.
CONFIRMS çalışmasında, başlangıçtaki serum ürat düzeyi ≥ 10 mg/dL olan ve birinc il sonlanım noktasına (son vizitte sUA < 6,0 mg/dL) ulaşan hastaların oranı, günlük febuksostat 40 mg uygulananlarda %27 (66/249), günlük febuksostat 80 mg uygulananlarda %49 (125/254) ve günlük a lopurinol 300 mg/200 mg uygulananlarda %31 (72/230) olmuştur.
Klinik Sonuçlar: gut alevlenmesi için tedaviye ihtiyaç duyan hastaların oranı
APEX çalışması: 8 haftalık profilaksi periyodu sırasında, febuksostat 120 mg tedavi grubunda gut alevlenmesi için tedaviye ihtiyaç duyan gönüllülerin oranı (%36), febuksostat 80 mg, allopurinol 300 mg ve plasebo grubundakilerden (sırasıyla %28, %23 ve %20) daha büyük olmuştur. Alevlenmeler profilaksi periyodunu takiben artmış ve zamanla kademeli olarak azalmıştır. Hafta 8 ila Hafta 28 arasında gut alevlenmeleri için gönüllülerin %46 ila %55'i tedavi almıştır. Çalışmanın son 4 haftası sırasında (Hafta 24-28) gönüllülerin %15'inde (febuksostat 80, 120 mg), %14'ünde (allopurinol 300 mg) ve %20'sinde (plasebo) gut alevlenmeleri gözlenmiştir.
FACT çalışması: 8 haftalık profilaksi periyodu sırasında, febuksostat 120 mg tedavi grubunda gut alevlenmesi için tedaviye ihtiyaç duyan gönüllülerin oranı (%36), febuksostat 80 mg ve a lopurinol 300 mg grubundakilerden (sırasıyla %22 ve %21) daha büyük olmuştur. 8 haftalık profilaksi periyodundan sonra alevlenmelerin insidansları artmış ve zamanla kademeli olarak azalmıştır (Hafta 8-52 arasında gönüllülerin %64'ünde ve %70'inde gut alevlenmeleri için
tedavi gerekmiştir). Çalışmanın son 4 haftası sırasında (Hafta 49-52) gönüllülerin %6-8'inde (febuksostat 80, 120 mg) ve %11'inde (a lopurinol 300 mg) gut alevlenmeleri gözlenmiştir.
Gut alevlenmeleri için tedaviye ihtiyaç duyan gönü lülerin oranı (APEX ve FACT Çalışmas ı), tedavi periyodunun son 32 haftasında (Hafta 20- 24 ila Hafta 49 - 52 aralıkları) ortalama başlangıç sonrası serum ürat düzeyinin <6,0 mg/dL, <5,0 mg/dL ya da <4,0 mg/dL'ye ulaştığı gruplarda, ortalama başlangıç sonrası serum ürat düzeyinin ≥6,0 mg/dL olduğu gruplara kıyasla sayısal olarak daha küçük olmuştur.
CONFIRMS çalışması sırasında, gut alevlenmeleri için tedaviye ihtiyaç duyan hastalar ın yüzdesi (Gün 1 ila Ay 6), febuksostat 80 mg ve a lopurinol grupları için sırasıyla %31 ve %25 olarak bulunmuştur. Gut alevlenmeleri için tedaviye ihtiyaç duyan hastaların oranı açısında n, febuksostat 80 mg grubu ile 40 mg grubu arasında farklılık gözlenmemiştir.
Uzun dönemli, açık etiketli uzatma çalışmaları
EXCEL Çalışması (C02-021): Excel çalışması, pivotal Faz 3 çalışmaları (APEX ya da FACT) tamamlayan hastalarda yapılan üç yı lık, Faz 3, açık etiketli, çok merkezli, randomize, allopurinol kontrollü bir güvenlilik uzatma çalışmasıdır. Çalışmaya toplam 1086 hasta kaydedilmiştir: günlük olarak ADENURIC 80 mg (n=649), günlük Adenuric 120 mg (n=292) ve günlük allopurinol 300/100 mg (n=145). Hastaların yaklaşık %69'unda, nihai stabil tedaviye ulaşmak için herhangi bir tedavi değişikliği gerekmemiştir. Üç ardışık sUA düzeyi
>6,0 mg/dL olan hastalar çalışmadan çıkarılmıştır.
Serum ürat düzeyleri zaman içerisinde korunmuştur (yani başlangıçta febuksostat 80 mg ve 120 mg ile tedavi edilmekte olan hastaların sırasıyla %91 ve %93'ünde Ay 36'da sUAdüzeyleri <6 mg/dL olarak bulunmuştur).
Üç yıllık verilerde gut alevlenmelerinin insidansında azalma görülmüştür; Ay 16-24'te ve Ay 30-36'da hastaların %4'ten azı alevlenme için tedaviye ihtiyaç duymuştur (yani hastaların
%96'dan fazlası alevlenme için tedaviye ihtiyaç duymamıştır).
Günlük Febuksostat 80 ya da 120 mg ile nihai stabil tedavi uygulanan hastaların sırasıyla
%46'sında ve %38'inde, başlangıçtan son vizite kadar primer palpabl tofüs tamamen ortadan kalkmıştır.
FOCUS Çalışması (TMX-01-005), çalışma TMX-00-004'te 4 haftalık, çift kör, febuksostat doz uygulamasını tamamlamış olan hastalarda yapılan 5 yıllık, Faz 2, açık etiketli, çokmerkezli bir güvenlilik uzatma çalışmasıdır. Çalışmaya 116 hasta kaydedilmiş ve başlangıçta günlük febuksostat 80 mg almıştır. Hastaların %62'sinde sUA <6 mg/dL düzeylerinin korunması için doz ayarlaması gerekli olmamış, %38'inde ise nihai stabil doza ulaşmak için doz ayarlamas ı gerekmiştir.
Son vizitte serum ürat düzeyleri <6,0 mg/dL (357 µmol/L) olan hastaların oranı, her bir febuksostat dozunda %80'den büyük olmuştur (%81-100).
Faz 3 klinik çalışmalar sırasında, febuksostat ile tedavi uygulanan hastalarda (%5,0) hafif karaciğer fonksiyon testi anormallikleri gözlenmiştir. Bu oranlar, allopurinol tedavisi sırasında rapor edilen oranlara (%4,2) benzerdir (bkz. bölüm 4.4). Uzun dönemli açık etiketli uzatma çalışmalarında, uzun dönemli febuksostat tedavisi almakta olan hastalarda (%5,5) ve allopurinol tedavisi almaktaolanhastalarda(%5,8)artmışTSH değerleri (>5,5 µIU/mL)
Pazarlama sonrası uzun dönem çalışmalar
CARES Çalışması, gut hastalığı olan ve miyokardiyal enfarktüs, kararsız anjina için hastaneye yatış, koroner veya serebral revaskülarizasyon prosedürü, inme, hastaneye yatırılmış geçici iskemik atak, periferik vasküler hastalık, ya da mikrovasküler veya makrovasküler hastalık kanıtı bulunan şeker hastalığı dahil majör kardiyovasküler hastalığı geçmişi olan hastalarda febuksostat ve a lopurinol ile kardiyovasküler sonuçları karşılaştıran çok merkezli, randomize, çift-kör, eşdeğerlik çalışmasıdır. 6 mg/dL'den az sUA seviyesine ulaşmak için; febuksostat dozu 40 mg'dan 80 mg'a kadar titre edilmiştir (böbrekfonksiyonuna bakılmaksızın) ve a lopurino l dozu normal böbrek fonksiyonuna sahip ve hafif böbrek yetmezliği olan hastalarda 100 mg'lik artışlarla 300'den 600 mg'a, orta derecede böbrek yetmezliği olan hastalarda 200 mg'dan 400 mg'a titre edilmiştir.
CARES'teki birincil sonlanım noktası; ölümcül olmayan miyokardiyal enfarktüs, ölümcül olmayan inme, kadiyovasküler ölüm ve kararsız anjina nedeniyle acil koroner revaskülarizasyonun bir bileşimi olan Majör Advers Kardiyovasküler Olayın (MACE) ilk meydana geldiği zamandır.
Sonlanım noktaları (birincil ve ikincil), randomize seçilmiş ve en az bir doz çift-kör çalışma ilacı almış gönüllülerin dahil olduğu tedavi amaçlı (ITT) analizlere göre incelenmiştir.
Tüm hastaların %56,6'sı erken dönemde deneme tedavisini bırakmıştır ve hastaların %45'i tüm deneme ziyaretlerini tamamlamamıştır.
Toplamda 6190 hasta ortalama 32 ay boyunca izlenmiştir ve ortalama maruz kalma süresi febuksostat grubundaki (n 3098) hastalar için 728 gün, a lopurinol grubundaki (n 3092) 719 gündür.
Birincil MACE sonlanım noktası, febuksostat ve allopurinol tedavi gruplarında benzer oranlarda meydana gelmiştir (sırasıyla hastaların %10,8'i ve %10,4'ü; tehlike oranı [HR] 1,03; iki taraflı tekrarlanan % 95 güven aralığı [CI] 0,89-1,21).
MACE'in tek tek bileşenlerinin analizinde, febuksostat ile kardiyovasküler ölümler in allopurinolden daha yüksek olduğu görülmüştür (hastaların %4,3'üne karşı %3,2; HR 1,34;
%95 CI 1,03-1,73). Diğer MACE olaylarının oranları febuksostat ve a lopurinol gruplarınd a benzerdir, örneğin ölümcül olmayan miyokardiyal enfarktüs (hastaların % 3,6'sına karşı % 3,8'i; HR 0,93; % 95 CI 0,72-1,21), ölümcül olmayan inme (% 2,3'e karşılık 2,3); HR 1,01; %
95 CI 0,73-1,41) ve kararsız anjina nedeniyle acil revaskülarizasyon (hastaların % 1,6'sı
%1,8'i; HR 0,86; % 95 CI 0,59-1,26). Tüm nedenlere bağlı ölüm oranı, esas olarak o gruptaki daha yüksek kardiyovasküler ölüm oranları nedeniyle, febuksostatta da allopurinol ile karşılaştırıldığında daha yüksektir (% 7,8'e karşılık % 6,4; HR 1,22; % 95 CI 1,01-1,47) (bkz. bölüm 4.4).
Kalp yetmezliği için hastaneye yatış, iskemiyle ilişkili olmayan aritmiler için hastane başvuruları, venöz tromboembolik olaylar ve geçici iskemik ataklar için hastaneye yatış oranları febuksostat ve a lopurinol için benzerdir.
FAST çalışması kronik hiperürisemi (ürat birikiminin halihazırda meydana geldiği koşu larda) ve KV risk faktörleri olan hastalarda (60 yaş ve üzeri ve en az bir başka KV risk faktörü olan hastalar) febuksostat ile a lopurinolün KV güvenlik profilini karşılaştıran prospektif, randomize, açık uçlu, kör sonlanımnoktalıbirçalışmadır.Uygun hastalar randomizas yon
pozolojiye göre gerektiğinde doz ayarlanmıştır. A lopurinol giriş fazının sonunda, sUA düzeyi
<0,36 mmol/L (<6 mg/dL) olan veya maksimum tolere edilen dozu veya maksimum lisans lı allopurinol dozunu alan hastalar ya febuksostat ya da a lopurinol tedavisi almak için
1:1 oranında randomize edilmiştir. FAST çalışmasının birincil sonlanım noktası, Antiplate le t Trialists' Collaborative (APTC) bileşik son noktasında yer alan herhangi bir olayın ilk meydana geldiği zamandı ve bu süre şunları içeriyordu: i) ölümcül olmayan MI/biyobelirteç pozitif akut koroner sendrom (ACS) için hastaneye yatış ; i) ölümcül olmayan felç; i) CV olayı nedeniyle ölüm. Birincil analiz, tedavi (OT) yaklaşımına dayanmaktadır.
Toplamda 3063'ü febuksostat ve 3065'i a lopurinol olmak üzere 6128 hasta randomize edildi.
Primer OT analizinde, ayarlanmış HR 0.85 (%95 GA: 0.70, 1.03), p<0.001 ile allopurinol alan 241(2,41/100 hasta yılı) hastaya kıyasla febuksostat alan 172 (1,72/100 hasta yılı) hastada meydana gelen primer sonlanım noktası insidansında febuksostat a lopurinolden daha aşağıda değildir. MI, inme veya AKS öyküsü olan hasta alt grubunda birincil son nokta için OT analizi, tedavi grupları arasında anlamlı bir fark göstermemiştir: febuksostat grubunda olay yaşayan 65 (%9,5) hasta ve . a lopurinol grubunda olay yaşayan 83 (%11,8); ayarlanmış HR 1.02 (%95
GA: 0.74-1.42); p=0.202.
Febuksostat ile tedavi, genel veya başlangıçta MI, inme, AKS öyküsü olan hasta alt grubunda. KV ölüm veya tüm nedenlere bağlı ölümde artış ile ilişkili değildir. Toplamda febuksostat grubunda (62 KV ölüm ve 108 tüm nedenlere bağlı ölüm), a lopurinol grubuna (82 KV ölüm ve 174 tüm nedenlere bağlı ölüm) göre daha az ölüm vardır.
A lopurinol tedavisine kıyasla febuksostat tedavisinde ürik asit düzeylerinde daha büyük bir düşüş olmuştur.
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
MENARİNİ İlaç Sanayi ve Ticaret A.Ş
| Geri Ödeme Kodu | A16936 |
| Satış Fiyatı | 348.28 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 348.28 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699832090598 |
| Etkin Madde | Febuksostat |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |