ADMIRAZ 2 mg film kaplı tablet (98 tablet) Kısa Ürün Bilgisi
{ Siponimod Fumarik Asit }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ADMİRAZ 2 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Siponimod fumarik asit 2,224 mg
(2 mg siponimoda karşılık gelmektedir)
Yardımcı maddeler
Laktoz monohidrat (sığır kaynaklı) 60,251 mg
Soya lesitin 0,092 mg
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Bir yüzünde logo ve diğer yüzünde âIIâ baskısı bulunan, yaklaşık 6,1 mm çapında, soluk sarı, yuvarlak, bikonveks, kenarları eğimli film kaplı tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ADMİRAZ, erişkinlerde, radyolojik veya klinik olarak aktif sekonder progresif multipl skleroz hastalarının tedavisi için endikedir.
4.2. Pozoloji ve uygulama şekli
Siponimod tedavisi, multipl skleroz tedavisinde deneyimli bir doktor tarafından başlatılmalı ve denetlenmelidir.
Tedaviye başlamadan önce hastalar, CYP2C9 metabolizör durumlarını belirlemek için CYP2C9 için genotiplenmelidir (bkz. Bölüm 4.4, 4.5 ve 5.2).
CYP2C9*3*3 genotipi olan hastalarda siponimod kullanılmamalıdır (bkz. Bölüm 4.3, 4.4 ve 5.2).
CYP2C9*2*3 veya *1*3 genotipi olan hastalarda, önerilen idame dozu günde bir kez alınan 1 mg'dır (0,25 mg'lık dört tablet) (bkz. Bölüm 4.4 ve 5.2).
Diğer tüm CYP2C9 genotip hastalarında önerilen siponimod idame dozu 2 mg'dır. ADMİRAZ, günde bir defa alınır.
Pozoloji:
Tedaviye başlama
Tedaviye 5 gün süren titrasyon paketi ile başlanmalıdır. Tedavi, 1. ve 2. günlerde günde bir kez 0,25 mg ile başlar, ardından 3. günde bir kez 0,5 mg, 4. günde 0,75 mg ve 5. günde 1,25 mg dozlarıyla devam edilir, ardından 6. günde başlayarak hastanın reçete edilen siponimod idame dozuna ulaşılır (bakınız Tablo 1).
Tedaviye başlandıktan sonraki ilk 6 günü boyunca, önerilen günlük doz günde bir kez sabah, aç veya tok karnına alınmalıdır.
Tablo 1 İdame dozuna ulaşmak için doz titrasyon rejimi
Titrasyon | Titrasyon dozu | Titrasyon rejimi | Doz |
Gün 1 | 0,25 mg | 1 x 0,25 mg |
Titrasyon |
Gün 2 | 0,25 mg | 1 x 0,25 mg | |
Gün 3 | 0,5 mg | 2 x 0,25 mg | |
Gün 4 | 0,75 mg | 3 x 0,25 mg | |
Gün 5 | 1,25 mg | 5 x 0,25 mg | |
Gün 6 | 2 mg | 1 x 2 mg | İdame |
Tedaviye başlama sırasında kaçırılan doz/dozlar
Tedavinin ilk 6 günü boyunca, bir titrasyon dozunun bir gün için kaçırılması durumunda, tedavinin yeni bir titrasyon paketi ile yeniden başlatılması gerekir.
6. günden sonra kaçırılan doz
Bir doz kaçırılırsa, reçete edilen doz bir sonraki planlanan zamanda alınmalıdır; bir sonraki doz iki katına çıkarılmamalıdır.
Tedaviye ara verildikten sonra idame tedavisinin yeniden başlatılması
İdame tedavisine 4 veya daha fazla günlük doz süresiyle ara verilirse, siponimodun yeni bir titrasyon paketi ile yeniden başlatılması gerekir.
Uygulama şekli:
Ağız yolu ile alınır.
Siponimod aç veya tok karına alınır. Film kaplı tabletler suyla birlikte bütün halde yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Klinik farmakoloji çalışmalarına dayanarak, böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2).
Karaciğer yetmezliği:
Siponimod, ciddi karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf C) kullanılmamalıdır (bkz. Bölüm 4.3). Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek olmamakla birlikte, bu hastalarda tedaviye başlarken dikkatli olunmalıdır (bkz. Bölüm 4.4 ve 5.2).
Pediyatrik popülasyon:
0 ila 18 yaş arası çocuklarda ve adölesanlarda siponimodun güvenliliği ve etkililiği henüz belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Siponimod 65 yaş ve üstü hastalarda çalışılmamıştır. Klinik çalışmalar 61 yaşına kadar olan hastaları içermektedir. Siponimod, güvenlilik ve etkililik hakkında yeterli veri bulunmadığından yaşlılarda dikkatle kullanılmalıdır (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Etkin madde
İmmün yetmezlik sendromu
Progresif multifokal lökoensefalopati veya kriptokokal menenjit öyküsü
Aktif maligniteler
Şiddetli karaciğer yetmezliği (Child-Pugh sınıf C)
Önceki 6 ayda miyokard enfarktüsü (MI), unstabil angina pektoris, inme/geçici iskemik atak (TIA), dekompanse kalp yetmezliği (yatarak tedavi gerektiren) veya New York Kalp Derneği (NYHA) sınıf III/IV kalp yetmezliği (bkz. bölüm 4.4) olan hastalar
Kalp pili kullanmıyorlarsa ikinci derece Mobitz tip II atriyoventriküler (AV) blok, üçüncü derece AV blok, sino-atriyal kalp bloğu veya hasta sinüs sendromu öyküsü olan hastalar (bkz. Bölüm 4.4)
CYP2C9*3 (CYP2C9*3*3) genotipi (zayıf metabolize edici) için homozigot olan hastalar
Gebelik sırasında ve etkili doğum kontrolü kullanmayan çocuk doğurma potansiyeli olan kadınlar (bkz. Bölüm 4.4 ve 4.6)
4.4. Özel kullanım uyarıları ve önlemleri
Enfeksiyonlar
Enfeksiyon riski
Siponimodun temel farmakodinamik etkisi, periferik lenfosit sayısını doza bağlı olarak başlangıç değerinin %20-30'una azaltmaktır. Bu, lenfoid dokulardaki lenfositlerin geri dönüşlü sekestrasyonundan kaynaklanmaktadır (bkz. Bölüm 5.1).
Siponimodun bağışıklık sistemi üzerindeki etkileri enfeksiyon riskini artırabilir (bkz. Bölüm 4.8).
Tedaviye başlamadan önce, yeni bir tam kan sayımı (CBC) (yani son 6 ay içinde veya önceki tedavinin kesilmesinden sonra) mevcut olmalıdır. CBC değerlendirmeleri tedavi sırasında periyodik olarak da önerilir. Klinik çalışmalarda mutlak lenfosit sayısı <0,2 x 10/l olan hastalarda siponimod dozu azaltıldığından, mutlak lenfosit sayılarının <0,2 x 10/l olarak ölçülmesi halinde, siponimod dozu 1 mg'a düşürülmelidir. Halihazırda siponimod 1 mg alan bir hastada doğrulanmış mutlak lenfosit sayısı <0,2 x 10/l ise 0,6 x 10/l'ye ulaşıncaya kadar siponimod tedavisi kesilmelidir. Lenfosit sayısı bu değere ulaştığında tedaviye tekrar başlanması düşünülebilir.
Şiddetli aktif enfeksiyonu olan hastalarda tedavinin başlatılması, bu durum düzelene kadar ertelenmelidir. Periferik lenfosit sayısı üzerindeki azaltıcı etkiler gibi rezidüel farmakodinamik etkiler, ilaç kesildikten sonra 3 ila 4 haftaya kadar sürebileceğinden, bu süre zarfında enfeksiyon için dikkatli olmaya devam edilmelidir (bkz. Aşağıda âSiponimod tedavisinin durdurulmasıâ bölümü).
Hastalara enfeksiyon belirtilerini derhal doktorlarına bildirmeleri söylenmelidir. Tedavi sırasında enfeksiyon semptomları olan hastalarda etkili tanı ve tedavi stratejileri uygulanmalıdır. Bir hastada ciddi bir enfeksiyon gelişirse, siponimod ile tedavinin askıya alınması düşünülmelidir.
Siponimod için kriptokokal menenjit (CM) vakaları bildirilmiştir. CM ile uyumlu semptom ve bulguları olan hastalara derhal tanısal değerlendirme yapılmalıdır. CM ekarte edilene kadar siponimod tedavisi askıya alınmalıdır. CM teşhisi konulursa, uygun tedavi başlatılmalıdır.
Geliştirme programında siponimod için progresif multifokal lökoensefalopati (PML) vakası bildirilmemiştir; bununla birlikte, başka bir S1P reseptör modülatörü için PML rapor edilmiştir. Doktorlar, PML'yi düşündürecek klinik semptomlar veya manyetik rezonans görüntüleme (MRG) bulguları konusunda dikkatli olmalıdır. PML'den şüpheleniliyorsa, PML ekarte edilinceye kadar siponimod tedavisi askıya alınmalıdır.
Herpes viral enfeksiyonu
Tedavi sırasında herhangi bir zamanda siponimod ile herpes viral enfeksiyonu vakaları (varicella zoster virüslerinin [VZV] neden olduğu menenjit veya meningoensefalit vakaları dahil) meydana gelmiştir. Herpes menenjit veya meningoensefalit meydana gelirse, siponimod kesilmeli ve ilgili enfeksiyon için uygun tedavi uygulanmalıdır. Hekim tarafından onaylanmış suçiçeği öyküsü olmayan veya VZV'ye karşı tam bir aşılama süreci belgelenmemiş hastalar siponimod başlamadan önce VZV antikorları açısından test edilmelidir (aşağıda âAşılamaâ bölümüne bakınız).
Aşılama
Siponimod ile tedaviye başlamadan önce antikor negatif hastalar için tam kür suçiçeği aşılaması önerilir; bunun ardından aşılamanın tam etkisinin ortaya çıkmasını beklemek üzere tedavinin başlatılması 1 ay ertelenmelidir (bkz. Bölüm 4.8).
Hastalar siponimod alırken ve tedaviyi bıraktıktan sonra 4 hafta boyunca canlı zayıflatılmış aşıların kullanımından kaçınılmalıdır (bkz. Bölüm 4.5).
Siponimod tedavisi sırasında aşılar daha az etkili olabilir. Planlı aşılamadan 1 hafta önce başlayarak 4 hafta sonrasına kadar tedavinin kesilmesi önerilir. Siponimod tedavisini aşılama
için durdururken, hastalık aktivitesinin olası geri dönüşü göz önünde bulundurulmalıdır
(aşağıda âSiponimod tedavisinin durdurulmasıâ bölümüne bakınız).
Anti-neoplastik, immünomodülatör veya immünosüpresif tedavilerle birlikte tedavi
Bu tür bir tedavi sırasında edinsel bağışıklık sistemi etkileri riski nedeniyle anti-neoplastik, immünomodülatör veya immünosüpresif tedaviler (kortikosteroidler dahil) bir arada dikkatle uygulanmalıdır (bkz. Bölüm 4.5).
Makula ödemi
Faz III klinik çalışmada görme semptomlarının eşlik ettiği veya etmediği makula ödemi, siponimod tedavisinde (%1,8) plaseboya (%0,2) kıyasla daha sık bildirilmiştir (bkz. Bölüm 4.8). Olguların çoğu tedavinin ilk 3-4 ayında meydana gelmiştir. Bu nedenle, tedavinin başlamasından 3-4 ay sonra oftalmolojik bir değerlendirme önerilir. Makula ödemi vakaları daha uzun süreli tedavide de meydana geldiğinden, hastalar siponimod tedavisi sırasında herhangi bir zamanda ortaya çıkabilecek görme bozukluklarını bildirmelidir ve makula da dahil olmak üzere fundusun değerlendirilmesi önerilir.
Makula ödemi olan hastalarda, bu durum düzelinceye kadar siponimod tedavisi başlatılmamalıdır.
Siponimod, makula ödemi riskinde potansiyel bir artış nedeniyle diyabet, üveit veya altta yatan/birlikte var olan retina hastalığı öyküsü olan hastalarda dikkatli kullanılmalıdır (bkz. Bölüm 4.8). Makula ödemini tespit etmek için bu hastaların tedaviye başlamadan önce ve siponimod tedavisi sırasında düzenli olarak oftalmolojik bir değerlendirmeye tabi tutulması önerilir.
Makula ödemi olan hastalarda siponimod tedavisinin devamı değerlendirilmemiştir. Bir hastada makula ödemi gelişirse siponimodun kesilmesi önerilir. Durumun düzelmesinin ardından siponimodun yeniden başlatılması gerekip gerekmediğine dair kararda, her hastadaki potansiyel faydalar ve riskler dikkate alınmalıdır.
Bradiaritmi
Kalp atım hızında azalma
Siponimod tedavisinin başlatılması kalp atım hızında geçici bir azalmaya neden olur (bkz. Bölüm 4.8 ve 5.1) ve bu nedenle tedavinin başlangıcında, 6. günde idame dozuna ulaşmak üzere, bir titrasyon şeması uygulanır (bakınız bölüm 4.2).
İlk titrasyon dozundan sonra, kalp atım hızının azalması bir saat içinde başlar ve 1. gündeki düşüş yaklaşık 3 ila 4 saatte maksimum seviyeye ulaşmıştır. Artırmalı titrasyon devam ettikçe, sonraki günlerde kalp atım hızındaki düşüşlerin daha fazla olduğu görülür ve 1. gündeki (başlangıç) değerden maksimum düşüşe 5 ila 6. günde ulaşılır. Mutlak saatlik ortalama kalp atım hızında en yüksek günlük doz sonrası azalma 1. günde görülür, nabız dakikada ortalama 5- 6 vuruş (bpm) azalır. Sonraki günlerde doz sonrası düşüşler daha az belirgindir. Dozlara devam edildikçe kalp atım hızı 6. günden sonra artmaya başlar ve tedavinin başlamasından sonraki 10 gün içinde plasebo düzeylerine ulaşır.
Dakikada 40 bpm'nin altındaki kalp atım hızları nadiren gözlenmiştir. Bradikardi yaşayan hastalar genellikle asemptomatik olmuştur. Birkaç hastada baş dönmesi ve kardiyak olmayan göğüs ağrısı dahil olmak üzere hafif ve orta şiddette semptomlar görülmüştür; bunlar müdahale olmadan 24 saat içinde düzelmiştir (bkz. Bölüm 4.8). Gerekirse, siponimodun neden olduğu kalp atım hızındaki azalma,parenteraldozlardaatropinveya izoprenalin ile tersine çevrilebilir.
Atriyoventriküler iletim
Siponimod tedavisinin başlatılması, doz titrasyonu sırasında kalp atım hızında gözlenen azalmaya benzer geçici bir patern izleyen geçici atriyoventriküler iletim gecikmeleri ile ilişkilendirilmiştir. Atriyoventriküler iletim gecikmeleri çoğu durumda birinci derece atriyoventriküler (AV) bloklar (elektrokardiyogramda uzamış PR aralığı) olarak kendini göstermiştir. Klinik çalışmalarda, tedavinin başlaması sırasında hastaların %1,7'sinden azında, genellikle Mobitz tip I (Wenckebach) olmak üzere ikinci derece AV blokları gözlenmiştir. İletim anormallikleri tipik olarak geçici ve asemptomatik olmuş, 24 saat içinde düzelmiş ve tedavinin kesilmesini gerektirmemiştir.
Önceden belirli kardiyak rahatsızlıkları olan hastalarda tedaviye başlama önerisi
Önlem olarak, aşağıdaki kardiyak rahatsızlıkları olan hastalar, ilk siponimod dozundan sonra 6 saat boyunca bradikardi belirtileri ve semptomları açısından izlenmelidir (ayrıca bkz. Bölüm 4.3):
sinüs bradikardisi (kalp atım hızı <55 bpm/dakika),
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Antineoplastik, bağışıklık modüle edici veya immünosüpresif tedaviler
Siponimod; antineoplastik, immünomodülatör veya immünosüpresif tedavilerle kombinasyon halinde çalışılmamıştır. Bu tür bir tedavi sırasında ve bu tıbbi ürünlerin herhangi birinin durdurulmasından sonraki haftalarda ek bağışıklık etkileri riski nedeniyle, birlikte uygulama sırasında dikkatli olunmalıdır (bkz. Bölüm 4.4).
Ürün bilgilerinde açıklanan alemtuzumab bağışıklık baskılayıcı etkilerinin özellikleri ve süresi nedeniyle, tedavinin yararları her bir hasta için risklerden açıkça daha ağır basmadıkça, alemtuzumab sonrası siponimod ile tedaviye başlanması önerilmez (bkz. Bölüm 4.4).
Anti-aritmik tıbbi ürünler, QT uzatan tıbbi ürünler, kalp atım hızını düşürebilecek tıbbi ürünler Tedavi başlangıcında sınıf Ia (örn., kinidin, prokainamid) veya sınıf III (örn. amiodaron, sotalol) anti-aritmik tıbbi ürünler, bilinen aritmojenik özelliklere sahip QT uzatan tıbbi ürünler, kalp atım hızını düşüren kalsiyum kanal blokerleri (verapamil veya diltiazem gibi) veya kalp atım hızını azaltabilecek diğer maddeler (örn. ivabradin veya digoksin) kullanmakta olan hastalarda, kalp atım hızı üzerindeki potansiyel ilave etkiler nedeniyle, siponimod eşzamanlı olarak kullanılmamalıdır (bkz. bölüm 4.4). Bu tıbbi ürünlerin siponimod ile birlikte kullanımı ile ilgili veri mevcut değildir. Tedaviye başlama sırasında bu maddelerin birlikte kullanılması ciddi bradikardi ve kalp bloğu ile ilişkili olabilir. Kalp atım hızı üzerindeki potansiyel katkı etkisi nedeniyle, siponimod tedavisi genellikle bu maddelerle eşzamanlı tedavi edilen hastalarda başlatılmamalıdır (bkz. Bölüm 4.4). Siponimod ile tedavi düşünülürse, kalp atım hızını düşürmeyen tıbbi ürünlere geçiş veya tedavinin başlatılması için uygun izlem ile ilgili olarak bir kardiyologdan tavsiye alınmalıdır.
Beta blokerler
Beta bloker alan hastalarda kalp atım hızını düşürme üzerine ilave etkiler nedeniyle siponimod başlatıldığında dikkatli olunmalıdır (bkz. Bölüm 4.4). Stabil dozlarda siponimod alan hastalarda beta-bloker tedavisi başlatılabilir.
Siponimod ve propranololün birlikte uygulanmasının olumsuz kronotropik etkisi, özel bir farmakodinamik/güvenlilik çalışmasında değerlendirilmiştir. Siponimod farmakokinetik/ farmakodinamik kararlı durum üzerine propranolol eklenmesi, propranolol farmakokinetik/farmakodinamik kararlı durumun üstüne siponimod eklenmesine kıyasla daha az belirgin negatif kronotropik etkilere (aditiften daha az) sahip olmuştur (aditif HR etkisi).
Aşılama
Canlı zayıflatılmış aşıların kullanımı enfeksiyon riski taşıyabilir ve bu nedenle siponimod tedavisi sırasında ve tedaviden sonra 4 haftaya kadar bunlar kullanılmamalıdır (bkz. Bölüm 4.4).
Siponimod ile tedavi sırasında ve tedaviden sonra 4 haftaya kadar aşılama daha az etkili olabilir. Siponimod tedavisi aşılamadan 1 hafta öncesinden 4 hafta sonrasına kadar duraklatılırsa, aşılamanın etkililiğinin tehlikeye girmediği kabul edilmektedir (bkz. Bölüm 4.4). Özel bir faz I sağlıklı gönüllü çalışmasında, grip aşılarıyla birlikte siponimod tedavisi veya daha kısa tedavi duraklaması (aşılamadan 10 gün ile 14 gün öncesi arası) plaseboya kıyasla daha düşük yanıt oranlarına (yaklaşık %15 ila %30 daha düşük) neden olmuş, diğer yandan bir PPV 23 aşısının etkililiği, eşzamanlı siponimod tedavisinden olumsuz etkilenmemiştir (bkz. bölüm 4.4).
![]()
Siponimod esas olarak sitokrom P450 2C9 (CYP2C9) (%79,3) ve daha az ölçüde sitokrom P450
3A4 (CYP3A4) (%18,5) tarafından metabolize edilir. CYP2C9 bir polimorfik enzimdir ve CYP3A veya CYP2C9 inhibitörlerinin veya indükleyicilerinin varlığında ilaç-ilaç etkileşimi (DDI) etkisinin CYP2C9 genotipine bağlı olduğu tahmin edilmektedir.
CYP2C9 ve CYP3A4 inhibitörleri
Siponimod ile orta derecede CYP2C9 ve orta veya güçlü CYP3A4 inhibisyonuna neden olan tıbbi ürünlerin birlikte kullanılması siponimod maruziyetinde önemli bir artış nedeniyle önerilmez. Bu eşzamanlı ilaç rejimi, ayrı bir orta veya güçlü CYP3A4 inhibitörü ile kombinasyon halinde orta derecede bir CYP2C9/CYP3A4 çift inhibitörünü (örn. flukonazol) veya orta bir CYP2C9 inhibitörünü içerebilir.
CYP2C9*1*1 genotipi olan sağlıklı gönüllülerde kararlı durumda 200 mg/gün flukonazol (orta CYP2C9/güçlü CYP3A4 inhibitörü) ile tek doz siponimod 4 mg'ın birlikte uygulanması, siponimodun eğri altındaki alanında (EAA) 2 kat artışa neden olmuştur. Fizyolojik temelli farmakokinetik (PBPK) modelleme kullanılarak yapılan bir ilaç etkileşim potansiyeli değerlendirilmesine göre, CYP2C9*2*2 genotipi olan hastalar dışında tüm genotipler genelinde herhangi bir CYP3A4 ve CYP2C9 inhibitörü tipiyle siponimodun EAA'sında maksimum 2 kat artış öngörülmektedir. CYP2C9*2*2 hastalarında, orta CYP2C9/CYP3A4 inhibitörlerinin varlığında siponimodun EAA'sında 2,7 kat artış beklenmektedir.
CYP2C9 ve CYP3A4 indükleyicileri
Siponimod, çoğu CYP2C9 ve CYP3A4 indükleyici tipi ile kombine edilebilir. Bununla birlikte, siponimod maruziyetinde beklenen bir azalma nedeniyle, siponimod kombine edildiğinde tedavinin uygunluğu ve olası yararı göz önünde bulundurulmalıdır:
genotipten bağımsız olarak tüm hastalarda güçlü CYP3A4/orta CYP2C9 ikili indükleyicileri (örn. karbamazepin) veya ayrı bir güçlü CYP3A4 indükleyicisi ile kombinasyon halinde orta derecede bir CYP2C9 indükleyicisi ile.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Siponimod, etkili doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeli olan kadınlarda kontrendikedir (bkz. Bölüm 4.3). Bu nedenle, çocuk doğurma potansiyeli olan kadınlarda tedaviye başlamadan önce gebelik testi sonucu negatif çıkmalı ve fetüs için ciddi risk konusunda danışmanlık sağlanmalıdır. Çocuk doğurma potansiyeli olan kadınlar, tedavi sırasında ve son siponimod dozunu takip eden en az on gün boyunca etkili bir doğum kontrol yöntemi kullanmalıdır (bkz. Bölüm 4.4).
Ayrıca Doktor Eğitim Paketinde özel önlemler de yer almaktadır. Siponimod kadın hastalara reçete edilmeden önce ve tedavi sırasında bu önlemler uygulanmalıdır.
Gebeliği planlamak için siponimod tedavisini durdururken, hastalık aktivitesinde olası bir geri dönüş göz önünde bulundurulmalıdır (bkz. Bölüm 4.4).
Gebelik dönemi
Gebe kadınlarda siponimod kullanımıyla ilgili veri bulunmamaktadır ya da sınırlı veri mevcuttur. Hayvan çalışmaları, günlük 2 mg dozda insan maruziyeti ile karşılaştırılabilir maruziyet düzeylerinde embriyo-fetal ölümler ve iskelet veya visseral malformasyonlar dahil olmak üzere sıçanlarda ve tavşanlarda siponimod kaynaklı embriyotoksisite ve fetotoksisite ve sıçanlarda teratojenisite göstermiştir (bkz. Bölüm 5.3). Ek olarak, başka bir sfingozin-1-fosfat reseptör modülatörü ile sahip olunan klinik deneyim, gebelik sırasında uygulandığında genel popülasyonda gözlenen orana kıyasla 2 kat daha fazla büyük konjenital malformasyon riski göstermiştir.
Sonuç olarak, siponimod gebelik sırasında kontrendikedir (bkz. Bölüm 4.3). Siponimod, gebelik planlanmadan en az 10 gün önce durdurulmalıdır (bkz. Bölüm 4.4). Bir kadın tedavi sırasında gebe kalırsa, siponimod kesilmelidir. Tedaviyle ilişkili fetüse zararlı etki riski konusunda tıbbi tavsiye verilmeli ve ultrasonografi muayeneleri yapılmalıdır.
Laktasyon dönemi
Siponimod veya ana metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Siponimod ve metabolitleri sıçanların sütüne geçer. Siponimod emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/Fertilite
Siponimodun insan fertilitesi üzerindeki etkisi değerlendirilmemiştir. Siponimodun sıçanlarda ve maymunlarda erkek üreme organları veya sıçanlarda fertilite parametreleri üzerinde hiçbir etkisi olmamıştır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Siponimodun araç ve makine kullanımı üzerinde hiçbir etkisi yoktur veya etkileri göz ardı edilebilir düzeydedir. Bununla birlikte, siponimod ile tedaviye başlarken bazen baş dönmesi meydana gelebilir. Bu nedenle, hastalar, siponimod tedavisine başlanan ilk gün boyunca araç veya makine kullanmamalıdır (bkz. Bölüm 4.4).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
En yaygın advers ilaç reaksiyonları baş ağrısı (%15) ve hipertansiyondur (%12,6).
Advers ilaç reaksiyonlarının tablo halinde özeti
Her sistem organ sınıfı içinde, advers ilaç reaksiyonları, en sık reaksiyonlar önce olacak şekilde sıklığa göre sıralanmaktadır. Ek olarak, her advers ilaç reaksiyonu için karşılık gelen sıklık kategorisi aşağıdaki sisteme dayanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila ≤1/10); yaygın olmayan (≥1/1.000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar | |
Yaygın | Herpes zoster |
Bilinmiyor | Kriptokokal menenjit |
İyi huylu, habis ve belirtilmemiş neoplazmalar (kistler ve polipler dahil) | |
Yaygın | Melanositik nevus Bazal hücreli karsinom |
Yaygın olmayan | Skuamöz hücreli karsinom |
Kan ve lenf sistemi hastalıkları | |
Yaygın | Lenfopeni |
Sinir sistemi hastalıkları | |
Çok yaygın | Baş ağrısı |
Yaygın | Baş Dönmesi |
Nöbet | |
Tremor | |
Göz hastalıkları | |
Yaygın | Makula ödemi |
Kalp hastalıkları | |
Yaygın | Bradikardi |
Atriyoventriküler blok (birinci ve ikinci derece) | |
Vasküler hastalıkları | |
Çok yaygın | Hipertansiyon |
Gastrointestinal hastalıklar | |
Yaygın | Bulantı |
İshal | |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | |
Yaygın | Ekstremitede ağrı |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |
Yaygın | Periferik ödem |
Asteni | |
Araştırmalar | |
Karaciğerfonksiyontestindeartış 3Q3NRZ1AxZmxXYnUyZ1Ax | |
Yaygın | Solunum fonksiyon testinde azalma |
Tablo 2 Advers reaksiyonların tablo halinde listesi
Seçilmiş advers reaksiyonların tanımı
Enfeksiyonlar
SPMS hastalarındaki Faz III klinik çalışmada, toplam enfeksiyon oranı, siponimod hastaları ile plasebo hastaları arasında karşılaştırılabilir olmuştur (sırasıyla %49,0'a karşılık %49,1). Bununla birlikte, plasebo (%0,7) ile karşılaştırıldığında siponimod (%2,5) tedavisinde herpes zoster enfeksiyonu oranında bir artış bildirilmiştir.
Tedavi sırasında herhangi bir zamanda siponimod ile varicella zoster virüslerinin neden olduğu menenjit veya meningoensefalit vakaları ortaya çıkmıştır. Siponimod için kriptokokal menenjit (CM) vakaları da bildirilmiştir (bkz. bölüm 4.4).
Makula ödemi
Makula ödemi siponimod alan hastalarda (%1,8) plasebo verilenlerden (%0,2) daha sık bildirilmiştir. Olguların çoğunluğu siponimodun başlamasından sonraki 3 ila 4 ay içinde meydana gelmiş olmakla birlikte, siponimod ile tedavi edilen hastalarda 6 aydan daha uzun bir süreyle vakalar bildirilmiştir (bkz. Bölüm 4.4). Bazı hastalar bulanık görme veya görme keskinliğinde azalma ile başvururken, bazıları asemptomatik olmuş ve rutin oftalmolojik muayenesinde tanı konmuştur. Tedavinin kesilmesinden sonra genellikle makula ödeminde düzelme olmuş veya kendiliğinden kaybolmuştur. Yeniden tedavi ile birlikte tekrarlama riski değerlendirilmemiştir.
Bradiaritmi
Siponimod tedavisinin başlatılması, kalp atım hızında geçici bir düşüşe neden olur ve ayrıca atriyoventriküler iletim gecikmeleriyle de ilişkili olabilir (bkz. Bölüm 4.4). Siponimod ile tedavi edilen hastaların %6,2'sinde bradikardi bildirilirken bu oran plasebo ile %3,1 olmuştur; AV blok ise siponimod ile tedavi edilen hastaların %1,7'sinde ve plasebo uygulanan hastaların
%0,7'sinde bildirilmiştir (bkz. Bölüm 4.4).
Kalp atım hızındaki maksimum düşüş, dozdan sonraki ilk 6 saatte görülür.
İlk dozlama aşamasında geçici, doza bağlı bir düşüş gözlenmiştir ve ≥ 5 mg'lık dozlarda bu etki plato yapmıştır. Bradiaritmik olaylar (AV blokları ve sinüs duraklamaları) siponimod tedavisi altında plaseboya kıyasla daha yüksek bir insidansla tespit edilmiştir.
Çoğu AV bloğu ve sinüs duraklaması, 2 mg'lık terapötik dozun üzerinde meydana gelmiştir ve doz titrasyonu yapılmamış koşullar altında doz titrasyon koşullarına kıyasla önemli ölçüde daha yüksek insidans göstermiştir.
Siponimodun neden olduğu kalp atım hızındaki azalma, atropin veya izoprenalin ile tersine çevrilebilmektedir.
Karaciğer fonksiyon testleri
Siponimod ile tedavi edilen MS hastalarında hepatik enzimlerde artış (çoğunlukla ALT yüksekliği) bildirilmiştir. SPMS hastalarında yapılan faz III çalışmada, özellikle karaciğer transaminaz (ALT/AST) ve GGT yükselmelerine bağlı olarak, plasebo (%3,1) hastaları ile karşılaştırıldığında siponimod hastalarında (%11,3) daha sık karaciğer fonksiyon testi artışları gözlenmiştir. Yüksekliklerin çoğu tedaviye başladıktan sonraki 6 ay içinde meydana gelmiştir. Siponimod kesildikten sonra yaklaşık 1 ay içinde ALT düzeyleri normale dönmüştür (bkz. Bölüm 4.4).
Kan basıncı
SPMS hastalarındaki faz III klinik çalışmada hipertansiyon, plasebo uygulanan hastalar (%9,0) ile karşılaştırıldığında siponimod kullanan hastalarda (%12,6) daha sık bildirilmiştir. Siponimod ile tedavi, tedavinin başlamasından kısa bir sonra başlayarak sistolik ve diyastolik kan basıncında bir artışla sonuçlanmış, bu etki yaklaşık 6 aylık tedaviden sonra maksimum düzeye ulaşmış (sistolik 3 mmHg, diyastolik 1,2 mmHg) ve sonrasında stabil kalmıştır. Devam eden tedavi ile bu etki de devam etmiştir.
Nöbetler
SPMS hastalarındaki faz III klinik çalışmada plasebodaki %0,4'lük oran ile karşılaştırıldığında, siponimod ile tedavi edilen hastaların %1,7'sinde nöbetler bildirilmiştir.
Solunum etkileri
Siponimod tedavisi ile 1 saniyede zorlu ekspiratuvar hacimde (FEV) ve akciğerin karbon monoksit (DLCO) değerleri için difüzyon kapasitesinde küçük düşüşler gözlenmiştir. SPMS hastalarındaki faz III klinik çalışmada tedavinin 3. ve 6. aylarında, siponimod grubunda FEV'de başlangıçtan ortalama değişiklikler, her bir zaman noktasında -0,1 L iken plasebo grubunda değişiklik olmamıştır. Bu gözlemler, siponimod ile tedavi edilen ve kronik obstruktif akciğer hastalığı (KOAH) veya astım gibi solunum bozuklukları olan hastalarda biraz daha yüksek olmuştur (FEV'de başlangıçtan yaklaşık 0,15 L ortalama değişiklik). Kronik tedavide bu azalma klinik olarak anlamlı advers olaylara dönüşmemiştir ve öksürük veya dispne raporlarındaki artışla ilişkili değildir (bkz. Bölüm 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Sağlıklı olgularda 75 mg'lık tek dozlardan sonra semptomatik bradikardi oluşumuna bağlı olarak maksimum tolere edilen tek dozun 25 mg olduğu belirlenmiştir. Birkaç olgu, 3 ila 4 gün boyunca kasıtsız olarak günde 200 mg'a kadar dozlar almıştır ve karaciğer fonksiyon testlerinde asemptomatik hafif ila orta derecede geçici artışlar yaşamışlardır.
84 mg siponimod alan bir hastada (depresyon öyküsü olan) karaciğer transaminazlarında hafif bir yükselme görülmüştür.
Doz aşımı eğer siponimoda ilk maruziyet ise veya siponimodun doz titrasyon fazı sırasında meydana gelirse, gece boyunca gözlemi de içerebilecek şekilde bradikardinin belirti ve semptomlarını gözlemlemek önemlidir. Kalp atım hızı ve kan basıncının düzenli olarak ölçülmesi gerekir ve elektrokardiyogramlar çekilmelidir (bkz. Bölüm 4.2 ve 4.4).
Siponimod için spesifik bir antidot yoktur. Diyaliz ya da plazma değişimi siponimodun vücuttan anlamlı bir şekilde uzaklaştırılmasına neden olmaz.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, seçici immünosupresanlar ATC kodu: L04AA42
Etki mekanizması
Siponimod, bir sfingozin-1-fosfat (S1P) reseptör modülatörüdür. Siponimod, S1P için beş G- protein bağlı reseptörden (GPCR) ikisine (yani S1P1 ve S1P5) seçici olarak bağlanır. Siponimod, lenfositler üzerindeki S1P1 reseptörleri üzerinde fonksiyonel bir antagonist olarak hareket ederek lenf düğümlerinden çıkışı önler. Bu, T hücrelerinin santral sinir sistemine (SSS) yeniden dolaşımını azaltarak merkezi enflamasyonu sınırlandırır.
Farmakodinamik etkiler
Periferik kan lenfositlerinde azalma
Siponimod, lenfoid dokularda geri dönüşlü lenfosit sekestrasyonu nedeniyle, ilk dozdan sonraki 6 saat içinde periferik kan lenfosit sayısında doza bağlı bir azalmaya neden olur.
Devam eden günlük dozlama ile birlikte lenfosit sayısı azalmaya devam ederek tipik bir CYP2C9*1*1 SPMS hastasında veya *1*2 Japon olmayan SPMS hastasında yaklaşık %0,560 (0,271-1,08) hücre/nL lenfosit sayısı şeklindeki dip medyan (%90 GA) değerine ulaşır (başlangıç değerinin %20-30'una karşılık gelir). Günlük dozlama ile düşük lenfosit sayıları korunur.
SPMS hastalarının büyük çoğunluğunda (%90), tedaviyi bıraktıktan sonraki 10 gün içinde lenfosit sayıları normal aralığa döner. Siponimod tedavisini durdurduktan sonra periferik lenfosit sayısı üzerindeki rezidüel düşürücü etkiler son dozdan sonra 3-4 haftaya kadar devam edebilir.
Kalp atım hızı ve ritmi
Siponimod, tedavi başlangıcında, kalp atım hızı ve atriyoventriküler iletimde geçici bir azalmaya neden olur (bkz. Bölüm 4.4 ve 4.8); bu etki, mekanik olarak, hücresel hiperpolarizasyona ve azaltılmış uyarılabilirliğe yol açan, G-protein kenetli içe rektifiye potasyum (GIRK) kanallarının aktivasyonu ile ilişkilidir. S1P1 reseptörlerindeki fonksiyonel antagonizmi nedeniyle, siponimodun ilk titrasyonu, idame dozu elde edilene kadar GIRK kanallarını ardışık olarak duyarsızlaştırır.
QT aralığını uzatma potansiyeli
Siponimodun terapötik (2 mg) ve supraterapötik (10 mg) dozlarının kardiyak repolarizasyon üzerindeki etkileri ayrıntılı bir QT çalışmasında araştırılmıştır. Sonuçlar siponimod ile QT uzaması ile ilişkili bir aritmojenik potansiyel ortaya koymamıştır. Siponimod, doz sonrası 3 saat sonra plaseboya göre düzeltilmiş başlangıca ayarlı ortalama QTcF'yi (ÎÎQTcF) 5 ms'den fazla artırmıştır ve maksimum ortalama etki sırasıyla 7,8 ms (2 mg) ve 7,2 ms (10 mg) olmuştur. Bütün zaman noktalarında ÎÎQTcF için tek taraflı %95 güven aralığının üst sınırı 10 ms'nin altında kalmıştır. Kategorik analiz, tedaviden kaynaklanan 480 ms'nin üzerinde QTc değerleri olmadığını, başlangıca kıyasla 60 ms'den daha fazla QTc artışı olmadığını ve düzeltilmiş veya düzeltilmemiş QT/QTc değerinin 500 ms'yi aşmadığını ortaya koymuştur.
Pulmoner fonksiyon
28 gün boyunca tek veya çoklu dozlarla siponimod tedavisi, zorlu vital kapasitenin %25 ila 75'inin (FEF %25-75) ekspirasyonu sırasında 1 saniyede zorlu ekspiratuvar hacim (FEV) ve zorlu ekspiratuvar akış (FEF) ile ölçüldüğü üzere, havayolu direncinde klinik olarak anlamlı artışlarla ilişkili değildir. Terapötik olmayan tekli dozlarda (> 10 mg) hafif bir azaltılmış FEV eğilimi tespit edilmiştir. Birden fazla siponimod dozu, %FEV ve FEF'te, doza ve gündüz saatlerine bağımlı olmayan ve artmış hava yolu direncine dair herhangi bir klinik bulgu ile ilişkili olmayan hafif ila orta değişiklikler ile ilişkilendirilmiştir.
Klinik etkililik ve güvenlilik
Siponimodun etkililiği, SPMS hastalarında günde bir kez 2 mg'lık dozların değerlendirildiği bir faz III çalışmasında araştırılmıştır.
SPMS'de A2304 (EXPAND) çalışması
Çalışma A2304, relapsların yokluğunda veya relapslardan bağımsız olarak önceki 2 yıl içinde belgelenmiş progresyon kanıtı olan, çalışmaya kayıt öncesindeki 3 ay içinde relaps kanıtı bulunmayan ve çalışmaya girdiği tarihte ortanca Genişletilmiş Özürlülük Durum Ölçeği (EDSS) skoru 3,0 ila 6,5 olan SPMS hastalarıyla yürütülen randomize, çift kör, plasebo kontrollü, olay ve takip süresi güdümlü, bir faz III bir çalışmasıdır. Başlangıçta ortalama EDSS 6,0'dır. 61 yaş üstü hastalar dahil edilmemiştir. Hastalık aktivitesi ile ilgili olarak, SPMS'de enflamatuvar aktivitenin karakteristik özellikleri relaps veya görüntülemeyle ilişkili olabilir (yani Gd tutan T1 lezyonları veya aktif [yeni veya genişleyen] T2 lezyonları).
Hastalar, günde bir kez siponimod 2 mg veya plasebo almak üzere 2:1 oranında randomize edilmiştir. Taramada ve her 3 ayda bir ve relaps zamanında klinik değerlendirmeler gerçekleştirilmiştir. MRG değerlendirmeleri taramada ve 12 ayda bir yürütülmüştür.
Çalışmanın birincil sonlanım noktası, EDSS'de 3 ay boyunca devam eden başlangıçtan en az 1 puanlık artış (başlangıç EDSS'si ≥ 5,5 olan hastalar için 0,5 puanlık artış) olarak tanımlanan 3 aylık doğrulanmış özürlülük progresyonunun (CDP) zamanı olmuştur. Başlıca ikincil sonlanım noktaları, zamanlı 25-adım yürüme testinde (T25W) 3 ayda doğrulanmış başlangıca kıyasla en az %20 kötüleşme ve T2 lezyon hacminde başlangıca kıyasla değişim olmuştur. Ek ikincil sonlanım noktaları arasında, 6 aylık CDP'ye kadar geçen süre, beyin hacminde yüzde değişim ve enflamatuvar hastalık aktivitesi (yıllık nüks oranı, MRG lezyonları) ölçümleri yer almıştır. Sembol Sayı Modalite Testi skorundaki bilişsel işlem hızındaki değişim keşifsel bir sonlanım nokta olarak olmuştur.
Çalışma süresi her hasta için değişken olmuştur (ortanca çalışma süresi 21 ay, dağılım: 1 gün ila 37 ay).
Çalışma, 1.651 hastanın siponimod 2 mg (N = 1.105) veya plaseboya (N = 546) randomize edilmesini içermiştir; siponimod ile tedavi edilen hastaların %82'si ve plasebo ile tedavi edilen hastaların %78'i çalışmayı tamamlamıştır. Başlangıçta ortanca yaş 49, ortanca hastalık süresi 16 yıl ve ortanca EDSS skoru 6,0 olmuştur. Hastaların %64'ünde çalışma girişinden önceki 2 yıl içinde relaps görülmemiştir ve %76'sında başlangıç MRG taramasında gadolinyum (Gd) tutan lezyon yoktur. Hastaların %78'i daha önce MS'leri için bir tedavi görmüştür.
3 aylık ve 6 aylık CDP'nin başlama zamanı, siponimod için anlamlı olarak daha geç olmuş, 3 aylık CDP riskinde plasebo ile karşılaştırıldığında %21 azalma (tehlike oranı [HR] 0,79, p = 0,0134) ve 6 aylık CDP riskinde plasebo ile karşılaştırıldığında %26'lık azalma (HR 0,74, p = 0,0058) izlenmiştir.
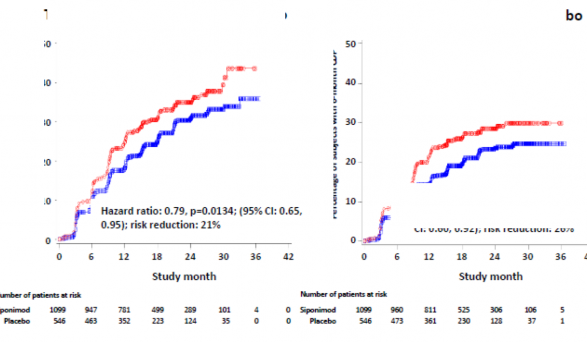
Plasebo karşısında 3 aylık CDP'ye kadar geçen süre
Plasebo karşısında 6 aylık CDP'ye kadar geçen süre
Riskli hasta sayısı
Riskli hasta sayısı
Çalışma ayı
Çalışma ayı
Şekil 1 EDSS-Kaplan-Meier eğrilerine dayalı 3 aylık ve 6 aylık CDP'li hastalar (tam analiz seti, çalışma A2304)
Tablo 3 A2304 çalışmasının klinik ve MRG sonuçları
Sonlanım noktaları | A2304 (EXPAND) | |
Siponimod 2 mg (n=1.099) | Plasebo (n=546) | |
Klinik sonlanım noktaları | ||
Birincil etkililik sonlanım noktası: 3 aylık doğrulanmış özürlülük progresyonu olan hastaların oranı (birincil sonlanım noktası) | %26,3 | %31,7 |
Risk azalması | %21 (p=0,0134) | |
Zamanlı 25 adım yürüme testinde 3 aylık doğrulanmış %20 artışı olan hastaların oranı | %39,7 | %41,4 |
Risk azalması | %6 (p=0,4398) | |
6 aylık doğrulanmış özürlülük progresyonu olan hastaların oranı | %19,9 | %25,5 |
Risk azalması | %26 [(p=0,0058)]6 | |
Yıllık relaps oranı (ARR) | 0,071 | 0,152 |
Oran azalması | %55 [(p<0,0001)]6 | |
MRG sonlanım noktaları | ||
T2 lezyon hacminde başlangıca göre değişim (mm) | +184 mm | +879 mm |
T2 lezyon hacmi değişimindeki fark | -695 mm (p<0,0001) | |
Başlangıca göre beyin hacmi değişim yüzdesi (%95 GA) | -%0,497 | -%0,649 |
Beyin hacmi değişimindeki yüzde fark | 0.152%[(p=0,0002)]6 | |
Gd tutan T1 ağırlıklı lezyonların ortalama kümülatif sayısı (%95 GA) | 0,081 | 0,596 |
Oran azalması | 86%[(p<0,0001)]6 | |
Sembol Sayı Modalite Testinde 4 puan kötüleşme olan hastaların oranı | %16,0 | %20,9 |
Risk azalması | %25 [(p=0,0163)]6 | |
Çalışmadan elde edilen sonuçlar, 3 aylık ve 6 aylık CDP'ye kadar geçen sürede, cinsiyet, yaş, çalışma öncesi relaps aktivitesi, başlangıç MRG hastalık aktivitesi, hastalık süresi ve başlangıçta özürlülük düzeylerine dayalı tanımlı alt gruplarda siponimod ile değişken fakat istikrarlı bir risk azalması göstermiştir.
Aktif hastalığı olan hasta alt grubunda (n = 779) (çalışmadan önceki 2 yıl içinde relapsı olan hastalar ve/veya başlangıçta Gd tutan T1 lezyonlarının varlığı olarak tanımlanır) tedavi başlangıcındaki özellikler genel popülasyona benzer olmuştur. Ortanca yaş 47, ortanca hastalık süresi 15 yıl ve başlangıçtaki ortanca EDSS skoru 6,0'dır.
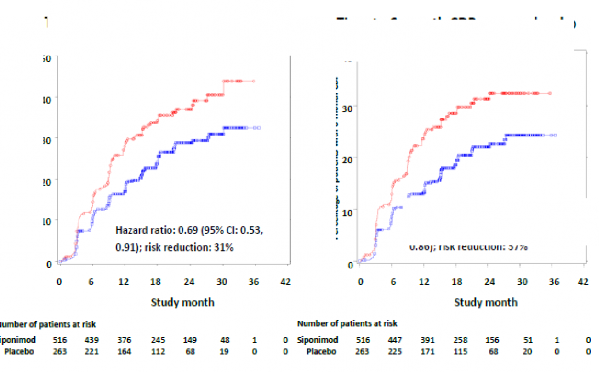
Siponimod ile tedavi edilen aktif hastalıklı hastalarda 3 aylık ve 6 aylık CDP'nin başlama zamanı, plaseboya kıyasla sırasıyla %31 (tehlike oranı [HR] 0,69; %95 GA: 0,53, 0,91) ve %37
(HR 0,63; %95 Cl: 0,47, 0,86) oranlarında daha geç olmuştur. ARR (doğrulanmış relapslar)
plasebo ile karşılaştırıldığında %46 azalmıştır (ARR oranı 0,54; %95 GA: 0,39, 0,77). 24 ay boyunca Gd tutan T1 ağırlıklı lezyonların kümülatif sayısında bağıl oran azalması, plaseboya kıyasla %85 olmuştur (vuku oranı 0,155; %95 GA: 0,104, 0,231). T2 lezyon hacmi değişimi ve beyin hacmi değişim yüzdesindeki (12 ve 24 aylık ortalamalar) plaseboya kıyasla farklar sırasıyla -1163 mm (%95 GA: -1484, -843 mm) ve %0,141 (%95 GA: 0,020, %0,261)
bulunmuştur.
Şekil 2 EDSS-Kaplan-Meier eğrilerine dayalı 3 aylık ve 6 aylık CDP'li hastalar - Aktif
Riskli hasta sayısı
Riskli hasta sayısı
Çalışma ayı
Çalışma ayı
SPMS'li alt grup (tam analiz seti, çalışma A2304)
Plasebo karşısında 3 aylık CDP'ye kadar
geçen süre (birincil sonlanım noktası)
Plasebo karşısında 6 aylık CDP'ye kadar geçen süre
Hastalık aktivitesi belirtileri ve semptomları olmayan (çalışmadan önceki 2 yıl içinde relapsı olmayan hastalar ve/veya başlangıçta Gd tutan T1 lezyonları olmayan hastalar olarak tanımlanır) hasta alt grubunda (n = 827), 3 aylık ve 6 aylık CDP üzerindeki etkiler küçük olmuştur (risk azalmaları sırasıyla %7 ve %13).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Siponimodun çoklu oral uygulamasından sonra maksimum plazma konsantrasyonlarına
(Cmaks) ulaşma süresi yaklaşık 4 saattir (aralık: 2 ila 12 saat). Siponimod emilimi geniştir (≥
%70, idrarla atılan radyoaktivite miktarına ve dışkıdaki sonsuzluğa ekstrapole edilen metabolit
miktarına bağlı olarak). Siponimodun mutlak oral biyoyararlanımı yaklaşık %84'tür. 10 gün
boyunca günde bir kez verilen 2 mg siponimod için, 10. günde ortalama 30,4 ng/ml C ve ortalama 558 h*ng/ml EAA değerleri gözlenmiştir. Siponimodun günde bir kez çoklu uygulamalarından sonra kararlı duruma yaklaşık 6 gün sonra ulaşılmıştır.
T'ta tek bir dozdan sonra 8 saatlik bir gecikmeye rağmen, gıda alımının siponimodun sistemik maruziyeti (C ve EAA) üzerinde hiçbir etkisi olmamıştır, bu nedenle siponimod yemeklerden bağımsız olarak alınabilir (bkz. Bölüm 4.2).
Dağılım:
Siponimod vücut dokularına ortalama 124 litre dağılım hacmi ile dağıtılır. Plazmada bulunan siponimod fraksiyonu insanlarda %68'dir. Siponimod kan-beyin bariyerini kolaylıkla geçer. Siponimodun proteinlere bağlanması sağlıklı kişilerde ve karaciğer veya böbrek yetmezliği olan hastalarda >%99,9'dur.
Biyotransformasyon:
Siponimod, esas olarak sitokrom P450 2C9 (CYP2C9) (%79,3) ve daha az bir ölçüde sitokrom P450 3A4 (CYP3A4) (%18,5) tarafından geniş ölçüde metabolize edilir.
Ana metabolitler M3 ve M17'nin farmakolojik aktivitesinin, insanlarda siponimodun klinik etkisine ve güvenliliğine katkıda bulunması beklenmemektedir.
In vitro araştırmalar, siponimod ve onun ana sistemik metabolitleri M3 ve M17'nin, araştırılan tüm CYP enzimleri ve taşıyıcıları için günde bir kez 2 mg'lık terapötik dozda klinik olarak anlamlı herhangi bir ilaç-ilaç etkileşim potansiyeli göstermediğini ve klinik araştırma gerektirmediğini göstermiştir.
CYP2C9 polimorfiktir ve genotip, iki oksidatif metabolizma yolunun genel eliminasyona fraksiyonel katkılarını etkiler. PBPK modellemesi, CYP2C9 genotipine bağımlı diferansiyel bir inhibisyon ve CYP3A4 yolaklarının indüksiyonunu göstermektedir. İlgili genotiplerde CYP2C9 metabolik aktivitesi daha az olduğundan, CYP3A4 ile etkileşen maddelerin siponimod maruziyeti üzerinde daha büyük bir etkisinin olması beklenmektedir (bkz. Bölüm 4.5).
Eliminasyon:
MS hastalarında 3,11 l/saatlik görünür bir sistemik klirens (CL/F) hesaplanmıştır. Siponimodun görünen eliminasyon yarılanma ömrü yaklaşık 30 saattir.
Siponimod, esas olarak metabolizma ve daha sonra safra/feçal atılım yoluyla sistemik dolaşımdan elimine edilir. İdrarda değişmemiş siponimod saptanmamıştır.
Doğrusallık / doğrusal olmayan durum:
Siponimod konsantrasyonu, 0,3 mg ila 20 mg/gün arasındaki çoklu siponimod dozlarından sonra dozla orantılı bir şekilde artar.
6 gün süreyle günde bir kez doz uygulamasından sonra kararlı durum plazma konsantrasyonlarına ulaşılır ve kararlı durum düzeyleri başlangıç dozundan yaklaşık 2 ila 3 kat daha yüksektir. 6 gün sonra 2 mg siponimod klinik terapötik dozuna ulaşmak için bir titrasyon rejimi kullanılır ve kararlı durum plazma konsantrasyonlarına ulaşmak için 4 gün daha dozlama gerekir.
Belirli gruplardaki veya özel popülasyonlardaki hastalardaki karakteristik özellikler
CYP2C9 genotipi
CYP2C9 genotipi siponimod CL/F'yi etkiler. İki popülasyon farmakokinetik analizi CYP2C9*1*1 ve*1*2 olgularının büyük ölçüde metabolize edici,*2*2 ve*1*3 olgularının orta düzeyde metabolize edici ve *2*3 ve*3*3 olgularının zayıf metabolize edici olarak davrandığını göstermiştir. CYP2C9*1*1 olgularıyla karşılaştırıldığında, CYP2C9*2*2,*1*3,*2*3 ve*3*3 genotipleri olan bireylerde CL/F değerleri sırasıyla %20, %35-38, %45-48 ve %74 daha düşüktür. Dolayısıyla siponimod maruziyeti, CYP2C9*2*2,*1*3,*2*3 ve*3*3 olgularda sırasıyla %25, %61, %91 ve %284 daha yüksektir. (bkz. Tablo 4) (bkz. bölüm 4.2 ve 4.4).
CYP2C9 için daha az sıklıkta meydana gelen başka polimorfizmler de vardır. Siponimodun farmakokinetiği bu tür olgularda değerlendirilmemiştir. *5, *6, *8 ve *11 gibi bazı polimorfizmler, enzim fonksiyonunun azalması veya kaybı ile ilişkilidir. CYP2C9 *5, *6, *8 ve *11 allellerinin Afrika kökenli popülasyonlarda yaklaşık %10, Latinler/Hispaniklerde %2 ve Beyazlar ve Asyalılarda <%0.4 birleşik sıklığa sahip olduğu tahmin edilmektedir.
Tablo 4 Siponimod CL/F ve sistemik maruziyet üzerinde CYP2C9 genotipetkisi
CYP2C9 genotipi | Beyaz olgularda sıklık |
Tahmini CL/F (L/h) |
CYP2C9*1*1 CL/F %'si | CYP2C9*1*1 karşısında maruziyet artışı %'si |
Büyük ölçüde metabolize edici | ||||
CYP2C9*1*1 | 62-65 | 3,1-3,3 | 100 | - |
CYP2C9*1*2 | 20-24 | 3,1-3,3 | 99-100 | - |
Orta düzeyde metabolize edici | ||||
CYP2C9*2*2 | 1-2 | 2,5-2,6 | 80 | 25 |
CYP2C9*1*3 | 9-12 | 1,9-2,1 | 62-65 | 61 |
Zayıf metabolize edici | ||||
CYP2C9*2*3 | 1,4-1,7 | 1,6-1,8 | 52-55 | 91 |
CYP2C9*3*3 | 0,3-0,4 | 0,9 | 26 | 284 |
Yaşlı hastalar
Popülasyon farmakokinetiğinin sonuçları, yaşlı hastalarda (65 yaş ve üstü) doz ayarlamasının gerekli olmadığını göstermektedir. Klinik çalışmalara 61 yaşın üzerindeki hasta dahil edilmemiştir. Siponimod yaşlılarda dikkatli kullanılmalıdır (bkz. Bölüm 4.2).
Cinsiyet
Popülasyon farmakokinetiğinin sonuçları, cinsiyete dayalı doz ayarlamasının gerekli olmadığını göstermektedir.
Irk/etnik köken
Tek doz farmakokinetik parametreler, sağlıklı Japon ve Beyaz bireyler arasında farklılık göstermemiştir ki bu dasiponimodunfarmakokinetiğiüzerinde etnik duyarlılığın olmadığını
Böbrek yetmezliği
Hafif, orta veya şiddetli böbrek yetmezliği olan hastalarda siponimod doz ayarlamasına gerek yoktur. Ortalama siponimod yarılanma ömrü ve C (toplam ve plazma proteinlerine bağlanmamış), ciddi böbrek yetmezliği olan hastalar ile sağlıklı kişiler arasında benzer olmuştur. Toplam ve bağlanmamış EAA'lar sağlıklı olgulara kıyasla sadece biraz artmıştır (%23-33). Son dönem böbrek yetmezliği veya hemodiyalizin siponimodun farmakokinetiği üzerindeki etkileri araştırılmamıştır. Siponimodun yüksek plazma protein bağlanmasına (>%99,9) bağlı olarak, hemodiyalizin toplam ve bağlanmamış siponimod konsantrasyonunu değiştirmesi beklenmez ve bu hususlara dayanarak herhangi bir doz ayarlaması öngörülmez.
Karaciğer yetmezliği
Siponimod, ciddi karaciğer yetmezliği olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.3). Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda siponimod için doz ayarlamasına gerek yoktur. Bağlanmamış siponimod farmakokinetiği (EAA), incelenen 0,25 mg tek doz için sağlıklı olgulara kıyasla, orta ve şiddetli karaciğer yetmezliği olanlarda sırasıyla %15 ve %50 daha yüksektir. Siponimodun ortalama yarı ömrü karaciğer yetmezliğinde değişmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Farelerde, sıçanlarda ve maymunlarda tekrarlı doz toksisite çalışmalarında, siponimod, lenfoid sistemi (lenfopeni, lenfoid atrofi ve azaltılmış antikor tepkisi) belirgin şekilde etkilemiş olup bu, S1P1 reseptörlerindeki birincil farmakolojik aktivitesi ile tutarlıdır (bkz. Bölüm 5.1).
Hayvan türlerindeki doz sınırlayıcı toksisiteler, farelerde nefrotoksisite, sıçanlarda vücut ağırlığı gelişimi ve maymunlarda advers SSS ve gastrointestinal etkiler olmuştur. Kemirgenlerdeki toksisitenin ana hedef organları akciğer, karaciğer, tiroid, böbrek ve rahim/vajinadır. Maymunlarda ayrıca kas ve cilt üzerindeki etkiler gözlenmiştir. Bu toksisiteler, 2 mg/gün idame dozunda EAA bazında insan maruziyetinden 30 kat daha yüksek sistemik siponimod düzeylerinde gelişmiştir.
Siponimod herhangi bir fototoksik veya bağımlılık potansiyeli göstermemiştir ve in vitro ve in vivo koşullarda genotoksik etki sergilememiştir.
Karsinojenite
Karsinojenite araştırmalarında, siponimod, farelerde lenfoma, hemanjiyom ve hemanjiyosarkomu indüklerken erkek sıçanlarda foliküler adenom ve tiroid bezinin karsinomu saptanmıştır. Bu tümör bulguları ya fareye özgü olarak kabul edilmiştir ya da özellikle hassas olan sıçan türlerinde metabolik karaciğer adaptasyonlarına atfedilebilirdir ve insanlar açısından ilgisi şüphelidir.
Fertilite ve üreme toksisitesi
Siponimod, günlük 2 mg dozda insan sistemik maruziyetine (EAA) dayalı olarak yaklaşık 19 kat güvenlilik marjına karşılık gelen, test edilen en yüksek doza kadar sıçanlarda erkek ve dişi doğurganlığını etkilememiştir.
Siponimoddan etkilenen reseptörün (sfenosin-1-fosfat reseptörü) embriyogenez sırasında vasküler oluşumda rol oynadığı bilinmektedir.
artmıştır. Sıçanlarda dış, iskelet ve iç organ malformasyonları olan (örn. yarık damak ve şekilsiz
klaviküller, kardiyomegali ve ödem) daha fazla sayıda fetüs kaydedilirken, tavşan fetüslerinde ağırlıklı olarak iskelet ve iç organ varyasyonları gözlenmiştir.
Sıçanlarda yapılan prenatal ve postnatal gelişim çalışmasında, daha yüksek ölü yavru (ölü doğan veya doğum sonrası 4. günden önce ölü bulunan) ve malforme yavru (ürogenital malformasyonları ve/veya artmış anogenital mesafeli olan erkek yavrular; her iki cinsiyetten ödemli, şişmiş yumuşak kafataslı veya bükülmüş arka ayaklı yavrular) sayısı gözlenmiştir.
Embriyofetal (sıçanlar ve tavşanlar) ve pre/postnatal (sıçanlar) gelişim için ilgili NOAEL'lerde maruziyet düzeyleri (EAA), günlük 2 mg'lık bir dozda insan sistemik maruziyetinin (EAA) altında olmuştur ve dolayısıyla herhangi bir güvenlik payı bulunmamaktadır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır kaynaklı) Mikrokristalin selüloz Krospovidon (Tip A)
Gliserol dibehenat Kolloidal susuz silika
Polivinil alkol (kısmen hidrolize) Titanyum dioksit (E171)
Kırmızı demir oksit (E172) Sarı demir oksit (E172) Talk
Soya lesitini (E322) Ksantan sakızı
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
Ürün açılmamış olarak buzdolabında (2-8°C'de) saklanmak koşulu ile 24 ay raf ömrüne sahiptir. Ürün açıldıktan sonra 25°C'nin altındaki oda sıcaklığında 3 ay saklanabilir.
6.4. Saklamaya yönelik özel tedbirler
2 ºC â 8 ºC arasında buzdolabında muhafaza ediniz.
Ürün açıldıktan sonra 25°C'nin altındaki oda sıcaklığında 3 ay saklanabilir.
6.5. Ambalajın niteliği ve içeriği
14, 28 ve 98 film kaplı tablet içeren PA/alu/PVC/alu blister ambalajlarda paketler.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 179769.29 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 179769.29 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699074091032 |
| Etkin Madde | Siponimod Fumarik Asit |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |