ADMIRAZ 2 mg film kaplı tablet (98 tablet) Farmakolojik Özellikler
{ Siponimod Fumarik Asit }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, seçici immünosupresanlar ATC kodu: L04AA42
Etki mekanizması
Siponimod, bir sfingozin-1-fosfat (S1P) reseptör modülatörüdür. Siponimod, S1P için beş G- protein bağlı reseptörden (GPCR) ikisine (yani S1P1 ve S1P5) seçici olarak bağlanır. Siponimod, lenfositler üzerindeki S1P1 reseptörleri üzerinde fonksiyonel bir antagonist olarak hareket ederek lenf düğümlerinden çıkışı önler. Bu, T hücrelerinin santral sinir sistemine (SSS) yeniden dolaşımını azaltarak merkezi enflamasyonu sınırlandırır.
Farmakodinamik etkiler
Periferik kan lenfositlerinde azalma
Siponimod, lenfoid dokularda geri dönüşlü lenfosit sekestrasyonu nedeniyle, ilk dozdan sonraki 6 saat içinde periferik kan lenfosit sayısında doza bağlı bir azalmaya neden olur.
Devam eden günlük dozlama ile birlikte lenfosit sayısı azalmaya devam ederek tipik bir CYP2C9*1*1 SPMS hastasında veya *1*2 Japon olmayan SPMS hastasında yaklaşık %0,560 (0,271-1,08) hücre/nL lenfosit sayısı şeklindeki dip medyan (%90 GA) değerine ulaşır (başlangıç değerinin %20-30'una karşılık gelir). Günlük dozlama ile düşük lenfosit sayıları korunur.
SPMS hastalarının büyük çoğunluğunda (%90), tedaviyi bıraktıktan sonraki 10 gün içinde lenfosit sayıları normal aralığa döner. Siponimod tedavisini durdurduktan sonra periferik lenfosit sayısı üzerindeki rezidüel düşürücü etkiler son dozdan sonra 3-4 haftaya kadar devam edebilir.
Kalp atım hızı ve ritmi
Siponimod, tedavi başlangıcında, kalp atım hızı ve atriyoventriküler iletimde geçici bir azalmaya neden olur (bkz. Bölüm 4.4 ve 4.8); bu etki, mekanik olarak, hücresel hiperpolarizasyona ve azaltılmış uyarılabilirliğe yol açan, G-protein kenetli içe rektifiye potasyum (GIRK) kanallarının aktivasyonu ile ilişkilidir. S1P1 reseptörlerindeki fonksiyonel antagonizmi nedeniyle, siponimodun ilk titrasyonu, idame dozu elde edilene kadar GIRK kanallarını ardışık olarak duyarsızlaştırır.
QT aralığını uzatma potansiyeli
Siponimodun terapötik (2 mg) ve supraterapötik (10 mg) dozlarının kardiyak repolarizasyon üzerindeki etkileri ayrıntılı bir QT çalışmasında araştırılmıştır. Sonuçlar siponimod ile QT uzaması ile ilişkili bir aritmojenik potansiyel ortaya koymamıştır. Siponimod, doz sonrası 3 saat sonra plaseboya göre düzeltilmiş başlangıca ayarlı ortalama QTcF'yi (ÎÎQTcF) 5 ms'den fazla artırmıştır ve maksimum ortalama etki sırasıyla 7,8 ms (2 mg) ve 7,2 ms (10 mg) olmuştur. Bütün zaman noktalarında ÎÎQTcF için tek taraflı %95 güven aralığının üst sınırı 10 ms'nin altında kalmıştır. Kategorik analiz, tedaviden kaynaklanan 480 ms'nin üzerinde QTc değerleri olmadığını, başlangıca kıyasla 60 ms'den daha fazla QTc artışı olmadığını ve düzeltilmiş veya düzeltilmemiş QT/QTc değerinin 500 ms'yi aşmadığını ortaya koymuştur.
Pulmoner fonksiyon
28 gün boyunca tek veya çoklu dozlarla siponimod tedavisi, zorlu vital kapasitenin %25 ila 75'inin (FEF %25-75) ekspirasyonu sırasında 1 saniyede zorlu ekspiratuvar hacim (FEV) ve zorlu ekspiratuvar akış (FEF) ile ölçüldüğü üzere, havayolu direncinde klinik olarak anlamlı artışlarla ilişkili değildir. Terapötik olmayan tekli dozlarda (> 10 mg) hafif bir azaltılmış FEV eğilimi tespit edilmiştir. Birden fazla siponimod dozu, %FEV ve FEF'te, doza ve gündüz saatlerine bağımlı olmayan ve artmış hava yolu direncine dair herhangi bir klinik bulgu ile ilişkili olmayan hafif ila orta değişiklikler ile ilişkilendirilmiştir.
Klinik etkililik ve güvenlilik
Siponimodun etkililiği, SPMS hastalarında günde bir kez 2 mg'lık dozların değerlendirildiği bir faz III çalışmasında araştırılmıştır.
SPMS'de A2304 (EXPAND) çalışması
Çalışma A2304, relapsların yokluğunda veya relapslardan bağımsız olarak önceki 2 yıl içinde belgelenmiş progresyon kanıtı olan, çalışmaya kayıt öncesindeki 3 ay içinde relaps kanıtı bulunmayan ve çalışmaya girdiği tarihte ortanca Genişletilmiş Özürlülük Durum Ölçeği (EDSS) skoru 3,0 ila 6,5 olan SPMS hastalarıyla yürütülen randomize, çift kör, plasebo kontrollü, olay ve takip süresi güdümlü, bir faz III bir çalışmasıdır. Başlangıçta ortalama EDSS 6,0'dır. 61 yaş üstü hastalar dahil edilmemiştir. Hastalık aktivitesi ile ilgili olarak, SPMS'de enflamatuvar aktivitenin karakteristik özellikleri relaps veya görüntülemeyle ilişkili olabilir (yani Gd tutan T1 lezyonları veya aktif [yeni veya genişleyen] T2 lezyonları).
Hastalar, günde bir kez siponimod 2 mg veya plasebo almak üzere 2:1 oranında randomize edilmiştir. Taramada ve her 3 ayda bir ve relaps zamanında klinik değerlendirmeler gerçekleştirilmiştir. MRG değerlendirmeleri taramada ve 12 ayda bir yürütülmüştür.
Çalışmanın birincil sonlanım noktası, EDSS'de 3 ay boyunca devam eden başlangıçtan en az 1 puanlık artış (başlangıç EDSS'si ≥ 5,5 olan hastalar için 0,5 puanlık artış) olarak tanımlanan 3 aylık doğrulanmış özürlülük progresyonunun (CDP) zamanı olmuştur. Başlıca ikincil sonlanım noktaları, zamanlı 25-adım yürüme testinde (T25W) 3 ayda doğrulanmış başlangıca kıyasla en az %20 kötüleşme ve T2 lezyon hacminde başlangıca kıyasla değişim olmuştur. Ek ikincil sonlanım noktaları arasında, 6 aylık CDP'ye kadar geçen süre, beyin hacminde yüzde değişim ve enflamatuvar hastalık aktivitesi (yıllık nüks oranı, MRG lezyonları) ölçümleri yer almıştır. Sembol Sayı Modalite Testi skorundaki bilişsel işlem hızındaki değişim keşifsel bir sonlanım nokta olarak olmuştur.
Çalışma süresi her hasta için değişken olmuştur (ortanca çalışma süresi 21 ay, dağılım: 1 gün ila 37 ay).
Çalışma, 1.651 hastanın siponimod 2 mg (N = 1.105) veya plaseboya (N = 546) randomize edilmesini içermiştir; siponimod ile tedavi edilen hastaların %82'si ve plasebo ile tedavi edilen hastaların %78'i çalışmayı tamamlamıştır. Başlangıçta ortanca yaş 49, ortanca hastalık süresi 16 yıl ve ortanca EDSS skoru 6,0 olmuştur. Hastaların %64'ünde çalışma girişinden önceki 2 yıl içinde relaps görülmemiştir ve %76'sında başlangıç MRG taramasında gadolinyum (Gd) tutan lezyon yoktur. Hastaların %78'i daha önce MS'leri için bir tedavi görmüştür.
3 aylık ve 6 aylık CDP'nin başlama zamanı, siponimod için anlamlı olarak daha geç olmuş, 3 aylık CDP riskinde plasebo ile karşılaştırıldığında %21 azalma (tehlike oranı [HR] 0,79, p = 0,0134) ve 6 aylık CDP riskinde plasebo ile karşılaştırıldığında %26'lık azalma (HR 0,74, p = 0,0058) izlenmiştir.
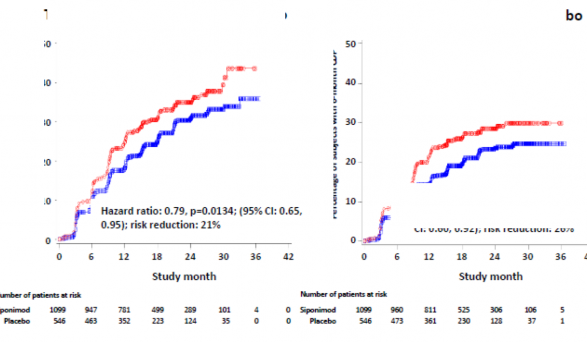
Plasebo karşısında 3 aylık CDP'ye kadar geçen süre
Plasebo karşısında 6 aylık CDP'ye kadar geçen süre
Riskli hasta sayısı
Riskli hasta sayısı
Çalışma ayı
Çalışma ayı
Şekil 1 EDSS-Kaplan-Meier eğrilerine dayalı 3 aylık ve 6 aylık CDP'li hastalar (tam analiz seti, çalışma A2304)
Tablo 3 A2304 çalışmasının klinik ve MRG sonuçları
Sonlanım noktaları | A2304 (EXPAND) | |
Siponimod 2 mg (n=1.099) | Plasebo (n=546) | |
Klinik sonlanım noktaları | ||
Birincil etkililik sonlanım noktası: 3 aylık doğrulanmış özürlülük progresyonu olan hastaların oranı (birincil sonlanım noktası) | %26,3 | %31,7 |
Risk azalması | %21 (p=0,0134) | |
Zamanlı 25 adım yürüme testinde 3 aylık doğrulanmış %20 artışı olan hastaların oranı | %39,7 | %41,4 |
Risk azalması | %6 (p=0,4398) | |
6 aylık doğrulanmış özürlülük progresyonu olan hastaların oranı | %19,9 | %25,5 |
Risk azalması | %26 [(p=0,0058)]6 | |
Yıllık relaps oranı (ARR) | 0,071 | 0,152 |
Oran azalması | %55 [(p<0,0001)]6 | |
MRG sonlanım noktaları | ||
T2 lezyon hacminde başlangıca göre değişim (mm) | +184 mm | +879 mm |
T2 lezyon hacmi değişimindeki fark | -695 mm (p<0,0001) | |
Başlangıca göre beyin hacmi değişim yüzdesi (%95 GA) | -%0,497 | -%0,649 |
Beyin hacmi değişimindeki yüzde fark | 0.152%[(p=0,0002)]6 | |
Gd tutan T1 ağırlıklı lezyonların ortalama kümülatif sayısı (%95 GA) | 0,081 | 0,596 |
Oran azalması | 86%[(p<0,0001)]6 | |
Sembol Sayı Modalite Testinde 4 puan kötüleşme olan hastaların oranı | %16,0 | %20,9 |
Risk azalması | %25 [(p=0,0163)]6 | |
Çalışmadan elde edilen sonuçlar, 3 aylık ve 6 aylık CDP'ye kadar geçen sürede, cinsiyet, yaş, çalışma öncesi relaps aktivitesi, başlangıç MRG hastalık aktivitesi, hastalık süresi ve başlangıçta özürlülük düzeylerine dayalı tanımlı alt gruplarda siponimod ile değişken fakat istikrarlı bir risk azalması göstermiştir.
Aktif hastalığı olan hasta alt grubunda (n = 779) (çalışmadan önceki 2 yıl içinde relapsı olan hastalar ve/veya başlangıçta Gd tutan T1 lezyonlarının varlığı olarak tanımlanır) tedavi başlangıcındaki özellikler genel popülasyona benzer olmuştur. Ortanca yaş 47, ortanca hastalık süresi 15 yıl ve başlangıçtaki ortanca EDSS skoru 6,0'dır.
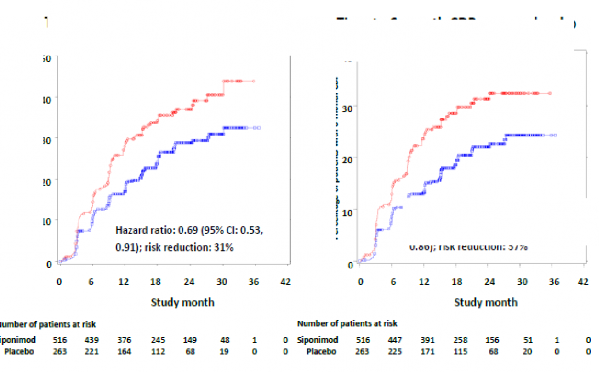
Siponimod ile tedavi edilen aktif hastalıklı hastalarda 3 aylık ve 6 aylık CDP'nin başlama zamanı, plaseboya kıyasla sırasıyla %31 (tehlike oranı [HR] 0,69; %95 GA: 0,53, 0,91) ve %37
(HR 0,63; %95 Cl: 0,47, 0,86) oranlarında daha geç olmuştur. ARR (doğrulanmış relapslar)
plasebo ile karşılaştırıldığında %46 azalmıştır (ARR oranı 0,54; %95 GA: 0,39, 0,77). 24 ay boyunca Gd tutan T1 ağırlıklı lezyonların kümülatif sayısında bağıl oran azalması, plaseboya kıyasla %85 olmuştur (vuku oranı 0,155; %95 GA: 0,104, 0,231). T2 lezyon hacmi değişimi ve beyin hacmi değişim yüzdesindeki (12 ve 24 aylık ortalamalar) plaseboya kıyasla farklar sırasıyla -1163 mm (%95 GA: -1484, -843 mm) ve %0,141 (%95 GA: 0,020, %0,261)
bulunmuştur.
Şekil 2 EDSS-Kaplan-Meier eğrilerine dayalı 3 aylık ve 6 aylık CDP'li hastalar - Aktif
Riskli hasta sayısı
Riskli hasta sayısı
Çalışma ayı
Çalışma ayı
SPMS'li alt grup (tam analiz seti, çalışma A2304)
Plasebo karşısında 3 aylık CDP'ye kadar
geçen süre (birincil sonlanım noktası)
Plasebo karşısında 6 aylık CDP'ye kadar geçen süre
Hastalık aktivitesi belirtileri ve semptomları olmayan (çalışmadan önceki 2 yıl içinde relapsı olmayan hastalar ve/veya başlangıçta Gd tutan T1 lezyonları olmayan hastalar olarak tanımlanır) hasta alt grubunda (n = 827), 3 aylık ve 6 aylık CDP üzerindeki etkiler küçük olmuştur (risk azalmaları sırasıyla %7 ve %13).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Siponimodun çoklu oral uygulamasından sonra maksimum plazma konsantrasyonlarına
(Cmaks) ulaşma süresi yaklaşık 4 saattir (aralık: 2 ila 12 saat). Siponimod emilimi geniştir (≥
%70, idrarla atılan radyoaktivite miktarına ve dışkıdaki sonsuzluğa ekstrapole edilen metabolit
miktarına bağlı olarak). Siponimodun mutlak oral biyoyararlanımı yaklaşık %84'tür. 10 gün
boyunca günde bir kez verilen 2 mg siponimod için, 10. günde ortalama 30,4 ng/ml C ve ortalama 558 h*ng/ml EAA değerleri gözlenmiştir. Siponimodun günde bir kez çoklu uygulamalarından sonra kararlı duruma yaklaşık 6 gün sonra ulaşılmıştır.
T'ta tek bir dozdan sonra 8 saatlik bir gecikmeye rağmen, gıda alımının siponimodun sistemik maruziyeti (C ve EAA) üzerinde hiçbir etkisi olmamıştır, bu nedenle siponimod yemeklerden bağımsız olarak alınabilir (bkz. Bölüm 4.2).
Dağılım:
Siponimod vücut dokularına ortalama 124 litre dağılım hacmi ile dağıtılır. Plazmada bulunan siponimod fraksiyonu insanlarda %68'dir. Siponimod kan-beyin bariyerini kolaylıkla geçer. Siponimodun proteinlere bağlanması sağlıklı kişilerde ve karaciğer veya böbrek yetmezliği olan hastalarda >%99,9'dur.
Biyotransformasyon:
Siponimod, esas olarak sitokrom P450 2C9 (CYP2C9) (%79,3) ve daha az bir ölçüde sitokrom P450 3A4 (CYP3A4) (%18,5) tarafından geniş ölçüde metabolize edilir.
Ana metabolitler M3 ve M17'nin farmakolojik aktivitesinin, insanlarda siponimodun klinik etkisine ve güvenliliğine katkıda bulunması beklenmemektedir.
In vitro araştırmalar, siponimod ve onun ana sistemik metabolitleri M3 ve M17'nin, araştırılan tüm CYP enzimleri ve taşıyıcıları için günde bir kez 2 mg'lık terapötik dozda klinik olarak anlamlı herhangi bir ilaç-ilaç etkileşim potansiyeli göstermediğini ve klinik araştırma gerektirmediğini göstermiştir.
CYP2C9 polimorfiktir ve genotip, iki oksidatif metabolizma yolunun genel eliminasyona fraksiyonel katkılarını etkiler. PBPK modellemesi, CYP2C9 genotipine bağımlı diferansiyel bir inhibisyon ve CYP3A4 yolaklarının indüksiyonunu göstermektedir. İlgili genotiplerde CYP2C9 metabolik aktivitesi daha az olduğundan, CYP3A4 ile etkileşen maddelerin siponimod maruziyeti üzerinde daha büyük bir etkisinin olması beklenmektedir (bkz. Bölüm 4.5).
Eliminasyon:
MS hastalarında 3,11 l/saatlik görünür bir sistemik klirens (CL/F) hesaplanmıştır. Siponimodun görünen eliminasyon yarılanma ömrü yaklaşık 30 saattir.
Siponimod, esas olarak metabolizma ve daha sonra safra/feçal atılım yoluyla sistemik dolaşımdan elimine edilir. İdrarda değişmemiş siponimod saptanmamıştır.
Doğrusallık / doğrusal olmayan durum:
Siponimod konsantrasyonu, 0,3 mg ila 20 mg/gün arasındaki çoklu siponimod dozlarından sonra dozla orantılı bir şekilde artar.
6 gün süreyle günde bir kez doz uygulamasından sonra kararlı durum plazma konsantrasyonlarına ulaşılır ve kararlı durum düzeyleri başlangıç dozundan yaklaşık 2 ila 3 kat daha yüksektir. 6 gün sonra 2 mg siponimod klinik terapötik dozuna ulaşmak için bir titrasyon rejimi kullanılır ve kararlı durum plazma konsantrasyonlarına ulaşmak için 4 gün daha dozlama gerekir.
Belirli gruplardaki veya özel popülasyonlardaki hastalardaki karakteristik özellikler
CYP2C9 genotipi
CYP2C9 genotipi siponimod CL/F'yi etkiler. İki popülasyon farmakokinetik analizi CYP2C9*1*1 ve*1*2 olgularının büyük ölçüde metabolize edici,*2*2 ve*1*3 olgularının orta düzeyde metabolize edici ve *2*3 ve*3*3 olgularının zayıf metabolize edici olarak davrandığını göstermiştir. CYP2C9*1*1 olgularıyla karşılaştırıldığında, CYP2C9*2*2,*1*3,*2*3 ve*3*3 genotipleri olan bireylerde CL/F değerleri sırasıyla %20, %35-38, %45-48 ve %74 daha düşüktür. Dolayısıyla siponimod maruziyeti, CYP2C9*2*2,*1*3,*2*3 ve*3*3 olgularda sırasıyla %25, %61, %91 ve %284 daha yüksektir. (bkz. Tablo 4) (bkz. bölüm 4.2 ve 4.4).
CYP2C9 için daha az sıklıkta meydana gelen başka polimorfizmler de vardır. Siponimodun farmakokinetiği bu tür olgularda değerlendirilmemiştir. *5, *6, *8 ve *11 gibi bazı polimorfizmler, enzim fonksiyonunun azalması veya kaybı ile ilişkilidir. CYP2C9 *5, *6, *8 ve *11 allellerinin Afrika kökenli popülasyonlarda yaklaşık %10, Latinler/Hispaniklerde %2 ve Beyazlar ve Asyalılarda <%0.4 birleşik sıklığa sahip olduğu tahmin edilmektedir.
Tablo 4 Siponimod CL/F ve sistemik maruziyet üzerinde CYP2C9 genotipetkisi
CYP2C9 genotipi | Beyaz olgularda sıklık |
Tahmini CL/F (L/h) |
CYP2C9*1*1 CL/F %'si | CYP2C9*1*1 karşısında maruziyet artışı %'si |
Büyük ölçüde metabolize edici | ||||
CYP2C9*1*1 | 62-65 | 3,1-3,3 | 100 | - |
CYP2C9*1*2 | 20-24 | 3,1-3,3 | 99-100 | - |
Orta düzeyde metabolize edici | ||||
CYP2C9*2*2 | 1-2 | 2,5-2,6 | 80 | 25 |
CYP2C9*1*3 | 9-12 | 1,9-2,1 | 62-65 | 61 |
Zayıf metabolize edici | ||||
CYP2C9*2*3 | 1,4-1,7 | 1,6-1,8 | 52-55 | 91 |
CYP2C9*3*3 | 0,3-0,4 | 0,9 | 26 | 284 |
Yaşlı hastalar
Popülasyon farmakokinetiğinin sonuçları, yaşlı hastalarda (65 yaş ve üstü) doz ayarlamasının gerekli olmadığını göstermektedir. Klinik çalışmalara 61 yaşın üzerindeki hasta dahil edilmemiştir. Siponimod yaşlılarda dikkatli kullanılmalıdır (bkz. Bölüm 4.2).
Cinsiyet
Popülasyon farmakokinetiğinin sonuçları, cinsiyete dayalı doz ayarlamasının gerekli olmadığını göstermektedir.
Irk/etnik köken
Tek doz farmakokinetik parametreler, sağlıklı Japon ve Beyaz bireyler arasında farklılık göstermemiştir ki bu dasiponimodunfarmakokinetiğiüzerinde etnik duyarlılığın olmadığını
Böbrek yetmezliği
Hafif, orta veya şiddetli böbrek yetmezliği olan hastalarda siponimod doz ayarlamasına gerek yoktur. Ortalama siponimod yarılanma ömrü ve C (toplam ve plazma proteinlerine bağlanmamış), ciddi böbrek yetmezliği olan hastalar ile sağlıklı kişiler arasında benzer olmuştur. Toplam ve bağlanmamış EAA'lar sağlıklı olgulara kıyasla sadece biraz artmıştır (%23-33). Son dönem böbrek yetmezliği veya hemodiyalizin siponimodun farmakokinetiği üzerindeki etkileri araştırılmamıştır. Siponimodun yüksek plazma protein bağlanmasına (>%99,9) bağlı olarak, hemodiyalizin toplam ve bağlanmamış siponimod konsantrasyonunu değiştirmesi beklenmez ve bu hususlara dayanarak herhangi bir doz ayarlaması öngörülmez.
Karaciğer yetmezliği
Siponimod, ciddi karaciğer yetmezliği olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.3). Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda siponimod için doz ayarlamasına gerek yoktur. Bağlanmamış siponimod farmakokinetiği (EAA), incelenen 0,25 mg tek doz için sağlıklı olgulara kıyasla, orta ve şiddetli karaciğer yetmezliği olanlarda sırasıyla %15 ve %50 daha yüksektir. Siponimodun ortalama yarı ömrü karaciğer yetmezliğinde değişmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Farelerde, sıçanlarda ve maymunlarda tekrarlı doz toksisite çalışmalarında, siponimod, lenfoid sistemi (lenfopeni, lenfoid atrofi ve azaltılmış antikor tepkisi) belirgin şekilde etkilemiş olup bu, S1P1 reseptörlerindeki birincil farmakolojik aktivitesi ile tutarlıdır (bkz. Bölüm 5.1).
Hayvan türlerindeki doz sınırlayıcı toksisiteler, farelerde nefrotoksisite, sıçanlarda vücut ağırlığı gelişimi ve maymunlarda advers SSS ve gastrointestinal etkiler olmuştur. Kemirgenlerdeki toksisitenin ana hedef organları akciğer, karaciğer, tiroid, böbrek ve rahim/vajinadır. Maymunlarda ayrıca kas ve cilt üzerindeki etkiler gözlenmiştir. Bu toksisiteler, 2 mg/gün idame dozunda EAA bazında insan maruziyetinden 30 kat daha yüksek sistemik siponimod düzeylerinde gelişmiştir.
Siponimod herhangi bir fototoksik veya bağımlılık potansiyeli göstermemiştir ve in vitro ve in vivo koşullarda genotoksik etki sergilememiştir.
Karsinojenite
Karsinojenite araştırmalarında, siponimod, farelerde lenfoma, hemanjiyom ve hemanjiyosarkomu indüklerken erkek sıçanlarda foliküler adenom ve tiroid bezinin karsinomu saptanmıştır. Bu tümör bulguları ya fareye özgü olarak kabul edilmiştir ya da özellikle hassas olan sıçan türlerinde metabolik karaciğer adaptasyonlarına atfedilebilirdir ve insanlar açısından ilgisi şüphelidir.
Fertilite ve üreme toksisitesi
Siponimod, günlük 2 mg dozda insan sistemik maruziyetine (EAA) dayalı olarak yaklaşık 19 kat güvenlilik marjına karşılık gelen, test edilen en yüksek doza kadar sıçanlarda erkek ve dişi doğurganlığını etkilememiştir.
Siponimoddan etkilenen reseptörün (sfenosin-1-fosfat reseptörü) embriyogenez sırasında vasküler oluşumda rol oynadığı bilinmektedir.
artmıştır. Sıçanlarda dış, iskelet ve iç organ malformasyonları olan (örn. yarık damak ve şekilsiz
klaviküller, kardiyomegali ve ödem) daha fazla sayıda fetüs kaydedilirken, tavşan fetüslerinde ağırlıklı olarak iskelet ve iç organ varyasyonları gözlenmiştir.
Sıçanlarda yapılan prenatal ve postnatal gelişim çalışmasında, daha yüksek ölü yavru (ölü doğan veya doğum sonrası 4. günden önce ölü bulunan) ve malforme yavru (ürogenital malformasyonları ve/veya artmış anogenital mesafeli olan erkek yavrular; her iki cinsiyetten ödemli, şişmiş yumuşak kafataslı veya bükülmüş arka ayaklı yavrular) sayısı gözlenmiştir.
Embriyofetal (sıçanlar ve tavşanlar) ve pre/postnatal (sıçanlar) gelişim için ilgili NOAEL'lerde maruziyet düzeyleri (EAA), günlük 2 mg'lık bir dozda insan sistemik maruziyetinin (EAA) altında olmuştur ve dolayısıyla herhangi bir güvenlik payı bulunmamaktadır.
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 179769.29 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 179769.29 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699074091032 |
| Etkin Madde | Siponimod Fumarik Asit |
| ATC Kodu | L04AA42 |
| Birim Miktar | 2 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 98 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |