ADVATE 250 IU/5 ml IV enjeksiyon için liyofilize toz içeren flakon { Eczacibasi-Baxalta } Saklanması
{ Oktokog Alfa (insan Koagulasyon Faktoru VIII) }
Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Koagülasyon Faktörü 8 Takeda İlaçları ve Ticaret Ltd.Şti. | Güncelleme : 5 April 2016ADVATE'in saklanması
ADVATE'i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
Her bir ambalaj, kapalı bir blisterde bir kullanıma hazır BAXJECT III sistemi (sulandırma için sistem ile önceden birleştirilmiş toz flakonu ve 5 mL çözücü içeren flakon) uygulama seti kapsamında kelebek iğneli infüzyon seti ve tek kullanımlık enjektör içerir.
ADVATE'i son kullanma tarihinden sonra kullanmayınız. Son kullanma tarihi belirtilmiş ayın son günüdür.
ADVATE'i buzdolabında (2°C ila 8°C arasında sıcaklıkta) saklayınız. Dondurmayınız.
Ürün içeren blister raf ömrü boyunca 6 aylık bir süreyle 25°C'a kadar oda sıcaklığında saklanabilir. Bu durumda, bu ilacın kullanımı, bu 6 aylık periyodun sonunda veya ürün üzerinde yazılı olan son kullanım tarihinden hangisi önceyse ona göre sona erer. Lütfen oda sıcaklığına çıkartıldığı tarihi ürün ambalajı üzerine kaydediniz. Ürün bir kez oda sıcaklığında saklanmaya başlandıktan sonra yeniden buzdolabına konulmamalıdır.
Işıktan korumak için ürün içeren blisteri orijinal ambalajı içinde saklayınız.
Bu ilaç yalnızca tek kullanımlıktır. Kullanılmayan çözeltiyi uygun bir şekilde atınız.
Toz tamamen çözündüğünde ürünü hemen kullanınız.
Rekonstitüye edildikten sonra 25°C altında saklanmak koşuluyla 3 saat içerisinde kullanılmalıdır.
Rekonstitüye edildikten sonra buzdolabında saklamayınız.
Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilik ve İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz.
Son kullanma tarihiyle uyumlu olarak kullanınız.
Ambalajdaki son kullanma tarihinden sonra ADVATE'i kullanmayınız.
Ruhsat sahibi: Takeda İlaç Sağlık Sanayi Ticaret Limited Şirketi Levent-Şişli/İSTANBUL
Üretim Yeri: Baxalta Manufacturing Sarl, Neuchatel /İSVİÇRE
Bu kullanma talimatı en son tarihinde onaylanmıştır.
![]()
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
ADVATE başka ilaç ya da çözücülerle karıştırılmamalıdır.
Her ADVATE uygulamasında, ürünün adı ve parti numarasının kaydedilmesi önerilir.
Sulandırma için talimatlar:
Ambalajdaki son kullanma tarihinden sonra ADVATE'i kullanmayınız.
Blister üzerindeki kapak tamamen kapatılmamışsa kullanmayınız.
Sulandırma sonrasında çözeltiyi buzdolabına koymayınız.
Ürün hala soğutucuda saklanıyorsa, kapalı blisteri (sulandırma sistemi ile önceden birleştirilmiş toz ve çözücü şişeleri içeren) buzdolabından alın ve oda sıcaklığına (15C ile 25°C arasında) ulaşmasını sağlayınız.
Ellerinizi sabun ve ılık su ile iyice yıkayınız.
Etiketi soyarak ADVATE ambalajını açın. BAXJECT III sistemini blisterden çıkarınız.
ADVATE'i, seyreltici flakonu üstte olacak şekilde düz bir yüzeye yerleştiriniz (Şekil 1). Seyreltici flakonunun mavi bir şeridi vardır. Mavi bir kapağı daha sonraki bir adımda talimat verilinceye kadar çıkarmayınız.
Bir eliniz BAXJECT III sistemindeki ADVATE'yi tutarken, sistem tamamen çökene ve seyreltici ADVATE flakonunun içine akana kadar diğer elinizle seyreltici flakonu üzerine sıkıca bastırınız (Şekil 2). Aktarım tamamlanana kadar sistemi eğmeyiniz.
Seyreltici aktarımının tamamlandığını doğrulayınız. Tüm materyal çözünene kadar yavaşça döndürünüz. ADVATE tozunun tamamen çözündüğünden emin olunuz, aksi halde sulandırılan çözeltilerin tümü cihaz filtresinden geçmeyecektir. Ürün hızlı bir şekilde çözünür (genellikle 1 dakikadan az). Sulandırıldıktan sonra çözelti berrak, renksiz ve yabancı partikül içermiyor olmalıdır.
Şekil 1 Şekil 2 Şekil 3
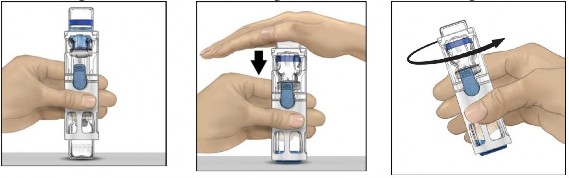
Enjeksiyon için talimatlar:
Uygulama sırasında aseptik (her türlü mikroptan arındırılmış) teknik gereklidir.
Uygulama için luer kilitli bir enjektör gerekmektedir.
Önemli not:
Doktorunuz ya da hemşireniz tarafından bu iş için özel eğitim almamışsanız kendi kendinize enjeksiyon uygulamayınız.
Uygulama öncesinde hazırlanmış çözeltinin herhangi bir parçacık içerip içermediği ya da renk değişikliği olup olmadığını gözle kontrol ediniz (çözelti berrak, renksiz olmalı ve yabancı parçacıklar içermemelidir). Çözelti tam olarak berrak değilse ya da tümüyle çözülmediyse ADVATE'i kullanmayınız.
Mavi kapağı BAXJECT III cihazından ayırınız. ENJEKTÖRE HAVA ÇEKMEYİNİZ. Enjektörü BAXJECT III cihazına bağlayınız.
Sistemi ters çeviriniz (sulandırılmış çözeltinin bulunduğu flakon üstte olmalıdır). Pistonu yavaşça geri çekerek enjektöre sulandırılmış çözeltiyi çekiniz.
Enjektörü ayırınız.
Enjektöre kelebek iğne takınız ve sulandırılmış çözeltiyi damar içine enjekte ediniz. Çözelti hastanın konfor seviyesine göre, dakikada 10 mL seviyesini geçmeyecek şekilde, yavaşça uygulanmalıdır. ADVATE uygulaması öncesinde ve sonrasında nabız ölçülmelidir. Önemli bir artış meydana gelirse uygulama hızının düşürülmesi veya enjeksiyona geçici olarak ara verilmesi genellikle semptomların hızlıca giderilmesini sağlamaktadır (bkz. Bölüm 2. ADVATE'i aşağıdaki durumlarda DİKKATLİ KULLANINIZ ve 4. Olası yan etkiler nelerdir?).
Kullanılmamış herhangi çözeltiyi uygun şekilde bertaraf ediniz.
Pozoloji/uygulama sıklığı ve süresi:
Kanadıkça tedavi
Faktör VIII (FVIII) dozu, faktör VIII ürünleri için geçerli WHO standardına uygun olarak Uluslararası Birimlerde (IU) ifade edilmektedir. Plazmada Faktör VIII dozu yüzde (normal insan plazmasına göre) veya IU (plazmada faktör VIII için uluslararası standart) olarak ifade edilmektedir.
Bir IU faktör VIII aktivitesi bir ml normal insan plazmasındaki faktör VIII miktarına karşılık gelmektedir. Gerekli faktör VIII dozunun hesaplaması bir kilo vücut ağırlığı başına 1 IU faktör VIII'ün plazma faktör VIII aktivitesini 2 IU/dL arttırdığı yönündeki gözlemsel bulguya dayanmaktadır. Doz aşağıdaki formüle göre belirlenir:
Gerekli doz (IU) = vücut ağırlığı (kg) x istenen faktör VIII artışı (%) x 0.5
Aşağıdaki hemorajik olayların gerçekleşmesi durumunda, faktör VIII aktivitesi ilgili dönemde belirtilen plazma aktivitesi seviyesinin (normal seviyenin %'si veya IU/dl) altına düşmemelidir. Aşağıda sunulan Tablo, kanama episodları ve cerrahide dozaj belirlenmesinde kullanılabilir:
Tablo Kanama episodları ve cerrahide dozaj kılavuzu | ||
Hemoraji derecesi/cerrahi prosedür tipi | Gerekli Faktör VIII seviyesi (% veya IU/dL) | Doz sıklığı (saat)/ terapi süresi (gün) |
Hemoraji |
|
|
Erken dönem hemartroz, kas içi kanama ya da ağız içi kanama | 20 – 40 | Ağrıyla beliren kanama episodu bitene veya iyileşme sağlanana kadar en az 1 gün boyunca her 12-24 saatte bir enjeksiyonları tekrar edin (6 yaşından küçük hastalar için 8-24 saatte bir) |
Daha yaygın hemartroz, kas içi kanama ya da hematom | 30 – 60 | 3-4 gün veya daha uzun süre boyunca veya ağrı ve akut disabilite kaybolana kadar her 12-24 saatte bir enjeksiyonları tekrar edin (6 yaşından küçük hastalar için 8-24 saat). |
Hayatı tehdit eden kanama | 60 – 100 | Tehlike ortadan kaybolana kadar her 8-24 saatte bir enjeksiyonları tekrar edin (6 yaşından küçük hastalar için 6-12 saat). |
Cerrahi |
|
|
Minör Diş çekimi dahil | 30 – 60 | En az bir gün boyunca, iyileşme sağlanana kadar her 24 saatte bir enjeksiyonları tekrar edin (6 yaşından küçük hastalar için 12-24 saat). |
Majör | 80 – 100 (cerrahi işlem öncesi ve sonrası) | Yaranın yeterince iyileşmesi sağlanana kadar her 8-24 saatte bir enjeksiyonları tekrar edin (6 yaşından küçük hastalar için 6-24 saatte bir), sonra faktör VIII aktivitesini %30-%60 (IU/dl) seviyesinde korumak için 7 gün daha tedaviye devam edin. |
 Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
 Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ADYNOVATE | 8681429550509 | 9,253.64TL |
| BERIATE | 8699738980436 | |
| BERIATE-P | 8699738980481 | |
| ELOCTA | 8683125910038 | 16,467.72TL |
| EMOCLOT | 8680972009038 | 10,581.91TL |
| ESPEROCT | 8699676791194 | 13,663.79TL |
| FACTANE | 8699538983552 | |
| FACTOR | 8699743980025 | |
| FAKTOR | 8697507980144 | 5,466.74TL |
| FANHDI | 8699769980078 | 9,787.08TL |
| Diğer Eşdeğer İlaçlar |
 En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
 Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
 Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A14680 |
| Satış Fiyatı | 4420.07 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 4420.07 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8681429550004 |
| Etkin Madde | Oktokog Alfa (insan Koagulasyon Faktoru VIII) |
| ATC Kodu | B02BD02 |
| Birim Miktar | 250+5 |
| Birim Cinsi | IU/ML |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Koagülasyon Faktörü 8 |
| İthal ve Beşeri bir ilaçdır. |
İLAÇ FİYATLARI
| Tarihi | İlaç Fiyatı |
|---|---|
| 14 Apr 2025 | 4,420.07 TL |
| 7 Apr 2025 | 4,420.07 TL |
| 24 Mar 2025 | 4,420.07 TL |
| 17 Mar 2025 | 4,420.07 TL |
| 7 Mar 2025 | 4,420.07 TL |
| 28 Feb 2025 | 4,420.07 TL |
| 21 Feb 2025 | 4,420.07 TL |
| 14 Feb 2025 | 4,420.07 TL |
| 2025 / 2008 İlaç Fiyatları |