ADYNOVATE 1000 IU/2ml IV enjeksiyonluk çözelti hazırlamak için liyofilize toz ve çözücü (1 flakon) Kısa Ürün Bilgisi
{ Rurioktokog Alfa Pegol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ADYNOVATE 1000 IU/2 ml IV enjeksiyonluk çözelti hazırlamak için liyofilize toz ve çözücü Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir flakon, 2 mL çözücü ile sulandırıldıktan sonra 500 IU/mL konsantrasyona karşılık gelen, nominal olarak 1000 IU insan koagülasyon faktör VIII (rDNA), rurioktokog alfa pegol içerir.
Potensi [Uluslararası Ünite (IU)] kromojenik ölçüm yöntemiyle belirlenmiştir. ADYNOVATE'in spesifik etkinliği yaklaşık 3.800-6.000 IU/mg protein'dir.
Rurioctocog alfa pegol (PEG'lenmiş insan koagülasyon faktörü VIII (rDNA)) 20 kDa PEG- polimeri ile konjuge edilmiş moleküler ağırlığı yaklaşık 280 kDa polietilen glikol (PEG) olan,
2.332 amino asitli bir proteindir. Çin Hamster Overi (CHO) hücre serisinde rekombinant DNA teknolojisiyle üretilmiştir.
Yardımcı maddeler
Her bir flakon 26,3 mg sodyum klorür içerir.
Diğer yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyon çözeltisi için toz ve çözücü (enjeksiyon çözeltisi için toz). Toz: Beyaz ila beyazımsı gevrek toz
Çözücü: Berrak ve renksiz çözelti
Sulandırıldıktan sonra, çözelti pH değeri 6,7 – 7,3'tür. Osmolalite ≥ 380 mOsmol/kg'dır.
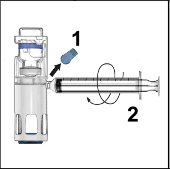
Kapağı soyarak ADYNOVATE blisterini açınız. BAXJECT III sistemini blisterden çıkarınız.
Enjektörü çıkarınız; kit içerisinde yer alan kelebek iğneyi takınız ve damardan enjekte ediniz. Bir hasta birden fazla ADYNOVATE flakonu alacaksa, birden fazla flakon içeriği aynı enjektörün içine çekilebilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Antihemofilik Faktör (Rekombinant), PEGile ADYNOVATE, hemofili A (konjenital faktör VIII eksikliği) olan çocuklar ve yetişkinlerde:
Kanama epizodlarının gereksinime bağlı tedavisi ve kontrolü
4.2. Pozoloji ve uygulama şekli
Tedavi, hemofili tedavisinde deneyimli hekim gözetiminde yapılmalıdır.
Pozoloji/uygulama sıklığı ve süresi:
Her bir ADYNOVATE flakon etiketi, uluslararası birimlerdeki gerçek faktör VIII potensini belirtir. Bu, nominal flakon potensinden/içeriğinden daha fazla ya da az olabilir. Bir uluslararası birim, bir mililitre normal insan plazmasında bulunan faktör VIII'in aktivitesine karşılık gelir.
Dozaj ve tedavi süresi faktör VIII eksikliğinin şiddetine, kanamanın yeri ve boyutuna ve hastanın klinik durumuna bağlıdır. Ciddi veya hayati tehlike taşıyan kanama epizodlarında replasman tedavisinin dikkatli bir şekilde izlenmesi gerekir.
Potens belirleme, tek aşamalı bir pıhtılaşma tahlili kullanılarak kararlaştırılır. Plazma faktör VIII seviyeleri, tek aşamalı bir pıhtılaşma tahlili kullanılarak klinik olarak izlenebilir.
Kg vücut ağırlığı başına bir uluslararası ADYNOVATE ünitesinin plazma faktör VIII seviyesini plazma dL başına 2 IU artırdığı ampirik bulgusuna dayanarak ADYNOVATE dozunu hesaplayın. dL başına IU (veya normalin %'si) olarak ifade edilen faktör VIII seviyesinde beklenen in vivo pik artışını ve faktör VIII seviyesinde istenen in vivo pik artışa ulaşacak dozu tahmin etmek için aşağıdaki formülü kullanın:
FVIII'in tahmini artışı (IU/dL veya normalin %‘si) = [Toplam doz (IU)/ vücut ağırlığı (kg)] x 2 (IU/kg başına IU/dL)
Doz (IU) = Vücut ağırlığı (kg) x istenen FVIII artışı (IU/dL veya normalin %‘si) x 0,5 (IU/dL başına IU/kg)
Hastalar farmakokinetiklerinde (örneğin, klirens, yarılanma ömrü, in vivo düzelme) ve klinik yanıtlarında çeşitlilik gösterir. Bireysel klinik yanıt konusunda ADYNOVATE dozu ve sıklığı temel alınır.
Kanama epizodlarının gereksinime bağlı tedavisi ve kontrolü
Kanama epizodlarının gereksinime bağlı tedavisi ve kontrolü için ADYNOVATE dozajı için bir kılavuz Tablo l'de verilmiştir. Plazma faktör VIII aktivitesi, tanımlanan plazma aktivitesi seviyesinde veya üstünde tutulur (dL başına IU cinsinden veya normalin %'si).
Tablo 1: Kanama Epizodlarının Gereksinime Bağlı Tedavisi ve Kontrolü için Dozaj
Kanama Türü | Hedef Faktör VIII Seviyesi (IU/dL veya normalin %'si) |
Doz(IU/kg) |
Dozaj sıklığı (saat) |
Tedavi Süresi |
Minör Erken hemartroz, hafif kas kanaması veya ağızda hafif kanama epizodu |
20-40 |
10-20 |
12-24 | Kanama düzelinceye kadar. |
Orta dereceli Kas kanaması, ağız boşluğunda orta dereceli kanama, kesin hemartroz ve bilinen travma. |
30-60 |
15-30 |
12-24 |
Kanama düzelinceye kadar. |
Majör Anlamlı gastrointestinal kanama, intrakraniyal, intraabdominal veya intratorasik kanama, merkezi sinir sistemi kanaması, retrofarengeal veya retroperitoneal boşluklarda veya |
60-100
|
30-50
|
8-24
|
Kanama düzelinceye kadar.
|
iliopsoas kılıfında kanama, kırıklar, kafa travması. |
|
|
|
|
Perioperatif Tedavi
Ameliyat sırasında ADYNOVATE dozajı (perioperatif tedavi) için bir kılavuz Tablo 2'de verilmiştir. Bir faktör VIII aktivitesinin hedef aralıkta veya üstünde korunması için özen gösterilmelidir.
Tablo 2: Perioperatif Tedavi için Dozaj
Ameliyat Türü | Gerekli Faktör VIII Seviyesi (normalin %'si veya IU/dL) |
Doz (IU/kg) |
Doz Sıklığı (saat) |
Tedavi Süresi |
Minör Diş çekimi dahil |
60-100 |
30-50 | Ameliyattan bir saat önce. Gerekirse 24 saat sonra tekrarlayın. | Tek doz veya kanama düzelinceye kadar gerektiği şekilde tekrarlayın. |
Majör İntrakraniyal, intraabdominal veya intratorasik cerrahi, eklem replasman cerrahisi |
80-120 (pre ve postoperatif) |
40-60 | %100 aktivite elde etmek için operasyondan bir saat önce. FVIII aktivitesini hedef aralıkta içinde korumak için her 8 ila 24 saatte (<12 yaş hastalar için 6 ila 24 saatte) bir tekrarlayın |
Yeterli yara iyileşmesine kadar |
Rutin Profilaksi
Yetişkin ve adolesanlarda (12 yaş ve üstü) kg vücut ağırlığı başına haftada iki kez 40-50 IU
uygulanır.
Çocuklarda (<12 yaş), kg başına maksimum 70 IU olacak şekilde, kg vücut ağırlığı başına haftada iki kez 55 IU uygulanır.
Doz ve doz aralıkları hastanın klinik yanıtına göre ayarlanır.
Uygulama şekli:
ADYNOVATE sadece sulandırıldıktan sonra intravenöz kullanım içindir.
Uygulama hızı dakikada 10 mL'yi geçmeyecek şekilde hastanın rahat edeceği bir hızda olmalıdır.
Uygulamadan önce tıbbi ürünün sulandırılması ile ilgili talimatlar için bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Özel kullanımı yoktur.
Pediyatrik popülasyon:
ADYNOVATE'in rutin profilakside ve kanama epizodlarının tedavisindeki güvenliliği ve etkililiği, çocuklar ve yetişkinler arasında benzerdir (Bkz Bölüm 5.1).
Geriyatrik popülasyon:
Özel kullanımı yoktur.
4.3. Kontrendikasyonlar
Etkin madde
maddelerden herhangi birine karşı aşırı duyarlılık.
Fare veya hamster proteinine karşı bilinen alerjik reaksiyon.
4.4. Özel kullanım uyarıları ve önlemleri
Takip edilebilirlik
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve
seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Aşırı duyarlılık reaksiyonları
ADYNOVATE ile alerjik tipte aşırı duyarlılık reaksiyonları mümkündür. Tıbbi ürün, fare ve
durumunda, hastalara derhal tıbbi ürünü kullanmayı bırakmaları ve doktora başvurmaları önerilmelidir. Hastalar, kurdeşen, yaygın ürtiker, göğüste sıkışma hissi, hırıltılı solunum, hipotansiyon ve anafilaksi dahil olmak üzere erken duyarlılık reaksiyonları belirtileri hakkında bilgilendirilmelidir.
Şok durumunda, şok için standart tıbbi tedavi uygulanmalıdır.
İnhibitörler
Faktör VIII'e karşı nötralize edici antikor (inhibitörler) oluşumu, hemofili A hastalarının tedavisinde bilinen bir komplikasyondur. Bu inhibitörler genellikle faktör VIII prokoagülan aktiviteye yönelik olan IgG immünoglobülinleridir ve modifiye tetkik kullanılarak her mL plazmada Bethesda Ünitesi (BU) olarak ölçülür. İnhibitör gelişme riski, faktör VIII'e maruziyetin yanı sıra hastalığın şiddeti ile ilişkilidir ve bu risk ilk 50 maruziyet gününde en yüksek seviyededir; ancak risk yaygın görülmemesine rağmen yaşam boyu devam eder.
İnhibitör gelişiminin klinik önemi inhibitör titremesine bağlı olacaktır; düşük titrenin teşkil ettiği yetersiz klinik yanıt riski, yüksek titreli inhibitörlere kıyasla daha az olacaktır.
Genel olarak, koagülasyon faktörü VIII ürünleri ile tedavi edilen tüm hastalar, uygun klinik gözlem ve laboratuvar testleri ile inhibitörlerin gelişimi açısından dikkatle izlenmelidir. Eğer beklenen faktör VIII aktivitesinin plazma düzeylerine ulaşılamazsa veya yeterli doz ile kanama kontrol altına alınamazsa faktör VIII inhibitörü varlığı açısından test yapılmalıdır. İnhibitör düzeyleri yüksek olan hastalarda faktör VIII tedavisi etkili olmayabilir ve diğer tedavi seçenekleri dikkate alınmalıdır. Böyle hastaların tedavisi hemofili ve faktör VIII inhibitörleri tedavisi konusunda deneyimli hekimler tarafından yönlendirilmelidir.
İmmün tolerans indüksiyonu (ITI)
ADYNOVATE kullanımı için ITI'de klinik veri mevcut değildir.
Kardiyovasküler olaylar
Kardiyovasküler risk faktörleri varolan hastalarda, faktör VIII ile ikame tedavisi kardiyovasküler riski artırabilir.
Tedavide kateterle ilişkili komplikasyonlar
Santral venöz erişim cihazı (SVEC) gerekliyse, lokal enfeksiyonlar, bakteriyemi ve kateter bölgesinde trombozis dahil olmak üzere SVEC ile ilişkili komplikasyon riski göz önünde bulundurulmalıdır.
ADYNOVATE'in bazı yardımcı maddeleri hakkında önemli bilgiler
Bu tıbbi ürün, her flakonda 12,42 mg'a kadar sodyum içerir; bu, Dünya Sağlık Örgütü'nün bir yetişkin için tavsiye ettiği günlük maksimum 2 g sodyum alımının %0,62'sine eşdeğerdir. Vücut ağırlığına ve pozolojiye bağlı olarak hasta birden fazla flakon alabilir. Bu, kontrollü sodyum diyeti uygulayan hastalar tarafından dikkate alınmalıdır.
ADYNOVATE bir hastaya her uygulandığında, hasta ile tıbbi ürün serisi arasındaki bağlantıyı sürdürmek için ürünün adı ve parti numarasının kaydedilmesi önemle tavsiye edilir.
Pediyatrik popülasyon:
Yukarıda sıralanan uyarılar ve önlemler hem yetişkinler hem de çocuklar için geçerlidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İnsan koagülan faktör VIII (rDNA) ürünlerinin diğer tıbbi ürünler ile hiçbir etkileşimi bildirilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C.
Faktör VIII ile hayvan üreme çalışmaları yapılmamıştır. Hemofili A kadınlarda nadir görüldüğünden, gebelikte faktör VIII kullanımı konusunda deneyim mevcut değildir. Bu nedenle, faktör VIII gebelikte yalnızca çok gerekliyse kullanılmalıdır.
Çocuk doğurma potansiyeli olan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Herhangi bir çalışma yürütülmemiştir. Dolayısıyla, üreme yeteneği/fertilite üzerindeki etkisi
bilinmemektir.
Gebelik dönemi
ADYNOVATE'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
ADYNOVATE gerekli olmadıkça (başka bir tedavi seçeneği yoksa) gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Hemofili A'nın kadınlarda nadir görülmesine bağlı olarak, emzirme döneminde faktör VIII kullanımı konusunda deneyim mevcut değildir. Bu nedenle, faktör VIII laktasyon döneminde yalnızca çok gerekliyse kullanılmalıdır.
Üreme yeteneği/Fertilite
Üreme yeteneği/Fertilite üzerindeki etkisi bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
ADYNOVATE'in araç veya makine kullanma yeteneği üzerine herhangi bir etkisi
bulunmamaktadır veya göz ardı edilebilir etkiye sahiptir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Aşırı duyarlılık ya da alerjik reaksiyonlar (bunlar arasında anjiyoödem, infüzyon bölgesinde yanma ve batma, titreme, sıcak basması, yaygın ürtiker, baş ağrısı, kurdeşen, kan basıncında düşme, letarji, bulantı, huzursuzluk, taşikardi, göğüste sıkışma hissi, karıncalanma, kusma, hırıltılı solunum yer alabilir) nadiren gözlenmiştir ve bazı olgularda şiddetli anafilaksiye kadar ilerleyebilir (şok dahil).
İlgili aşırı duyarlılık reaksiyonları ile birlikte, fare veya hamster proteinine karşı antikor gelişimi çok nadiren gözlenmiştir.
ADYNOVATE da dahil olmak üzere faktör VIII ile tedavi edilmiş hemofili A hastalarında nötralize edici antikorlar (inhibitörler) gelişebilir(bkz. bölüm 5.1). Bu tür inhibitörler oluşursa, durum, yetersiz klinik yanıt şeklinde kendini gösterebilir. Bu gibi durumlarda uzman hemofili merkezleriyle bağlantı kurulması önerilmektedir.
Advers reaksiyonların tablo halinde listesi
ADYNOVATE'in güvenliliği, çok merkezli, prospektif, açık etiketli tamamlanmış 6 klinik çalışma ve devam etmekte olan 1 klinik çalışmada en az bir doz ADYNOVATE almış, daha önce tedavi edilen 365 şiddetli hemofili A (normalin % 1'inden daha az faktör VIII) hastasında değerlendirilmiştir.
Aşağıdaki veriler, MedDRA sistem organ sınıflandırmasına (SOC ve Tercihli Terim Düzeyi)
uygundur.
Görülme sıklıkları şu yaklaşıma göre değerlendirilmiştir: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Advers reaksiyonlar her bir sıklık grubunda azalan ciddiyet sırasına göre verilmiştir.
Kan ve lenf sistemi hastalıkları:
Çok yaygın: Faktör VIII inhibisyonu (HTGH'ler)* Yaygın olmayan: Faktör VIII inhibisyonu (TGH'ler)*
Bağışıklık sistemi hastalıkları:
Yaygın olmayan: Aşırı duyarlılık
Sinir sistemi hastalıkları:
Çok yaygın: Baş ağrısı Yaygın: Baş dönmesi
Göz hastalıkları:
Yaygın olmayan: Oküler hiperemi
Vasküler hastalıkları:
Yaygın olmayan: Kızarma
Gastrointestinal hastalıkları:
Yaygın: İshal, bulantı
Deri ve deri altı doku hastalıkları:
Yaygın: Döküntü, ürtiker
Yaygın olmayan: Kaşıntılı döküntü
Araştırmalar:
Yaygın olmayan: Eozinofil sayısında artış
Yaralanma, zehirlenme ve prosedürle ilgili komplikasyonlar:
Yaygın olmayan: İnfüzyon ile ilgili reaksiyon
*Sıklık, şiddetli hemofili A hastalarının yer aldığı, tüm FVIII ürünleri ile yapılmış çalışmalara dayanmaktadır.
TGH'ler = daha önce tedavi görmüş hastalar, HTGH'ler = daha önce tedavi görmemiş hastalar Sunulan sıklıklar, ilgili ve ilgisiz tüm advers olaylar kullanılarak hesaplanmıştır.
Seçilmiş advers reaksiyonların açıklaması Aşırı duyarlılık:
Gözlenen aşırı duyarlılık olayı, ADYNOVATE tedavisi sırasında daha önce döküntü geliştiren 2 yaşındaki bir hastada meydana gelen hafif, geçici, ciddi olmayan bir döküntüydü.
Pediyatrik popülasyon:
Çocuklarda advers reaksiyonların sıklığı, tipi ve şiddetinin yetişkinlerle aynı olması beklenmektedir. ADYNOVATE'in güvenliliği, sırasıyla toplam 2880 maruziyet günü (ED) ve 2975 ED biriktirmiş, <6 yaş 38 denekte ve 6 ila <12 yaş 34 denekte değerlendirilmiştir.
Ortalama (SD) yaş, sırasıyla 3,3 (1,55) ve 8,1 (1,92) idi.
Pediyatrik kullanım: 12 Yaş altı çocuklarda yüksek klirens, kısalmış yarı ömür ve daha yavaş FVIII dönüşüm hızının görüldüğü bildirilmiştir. Bu grupta vücut ağırlığına (kg başı) göre doz ayarlaması veya daha yakın dozlama takibinin yapılması gerekir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Rekombinant koagülan faktör VIII ile doz aşımı semptomları bildirilmemiştir.
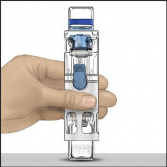
Toz flakonunu, çözücü flakon üstte olacak şekilde düz bir yüzeye yerleştiriniz (Şekil 1). Çözücü flakonunun mavi bir şeridi vardır. Mavi bir kapağı daha sonraki bir adımda talimat verilinceye kadar çıkarmayınız.
Beş dakikaya kadar olan bir süre boyunca uygulayınız (maksimum infüzyon hızı
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antihemorajikler, kan koagülasyon faktör VIII ATC kodu: B02BD02
Etki mekanizması
Faktör VIII/von Willebrand faktör kompleksi, farklı fizyolojik fonksiyonlara sahip iki molekülden (faktör VIII ve von Willebrand faktörü) oluşur. Hemofili hastasına verildiğinde, faktör VIII, hastanın dolaşımındaki von Willebrand faktörüne bağlanır. Aktive faktör VIII, aktive faktör IX için bir kofaktör olarak görev yapar ve faktör X'un aktive faktör X'a dönüşümünü hızlandırır. Aktive faktör X, protrombini trombine dönüştürür. Trombin daha sonra fibrinojeni fibrine dönüştürür ve bir pıhtı oluşabilir. Hemofili A, faktör VIII: C'nin seviyelerinin azalmasına bağlı olarak cinsiyete bağlı herediter bir kan pıhtılaşma hastalığıdır ve spontan veya kazara ya da cerrahi travmanın sonucu olarak eklemlerde, kaslarda veya iç organlarda yoğun kanama ile sonuçlanmaktadır. Replasman tedavisi ile faktör VIII'in plazma seviyeleri artar, böylece faktör eksikliğinin geçici olarak düzeltilmesi ve kanama eğilimlerinin düzeltilmesi sağlanır.
Rurioktokog alfa pegol, yarılanma ömrü uzatılmış, pegile bir rekombinant insan faktörü VIII'dir. Rurioktokog alfa pegol, polietilen glikol (PEG) reaktifi (MW 20 kDa) ile 2.332 amino asitten oluşan, oktokog alfanın bir kovalent konjugatıdır. Rurioktokog alfa pegolün terapötik etkinliği, Çinli bir hamster over hücre dizisinden rekombinant DNA teknolojisi ile üretilen
oktokog alfadan türetilir. Oktokog alfa daha sonra PEG reaktifiyle kovalent olarak birleşir. PEG
Klinik etkililik ve güvenlilik
ADYNOVATE'in güvenliliği, etkililiği ve farmakokinetiği, haftada iki kez profilaktik bir tedavi rejimini gereksinime bağlı tedaviyle karşılaştıran ve kanama epizodlarının tedavisinde hemostatik etkililiği saptayan pivotal çok merkezli, açık etiketli, prospektif bir klinik çalışmada değerlendirilmiştir. Şiddetli hemofili A hastası olan toplam 137 erkek PTP (12 ila 65 yaş) en az bir infüzyon ADYNOVATE almıştır. Yüz otuz yedi denekten 25'i adolesandı (12 ila <18 yaş). Daha önce tedavi görmüş, rutin profilaksi, kanama epizodlarının gereksinime bağlı tedavisi veya periyodik tedavinin bir parçası olarak en az bir doz ADYNOVATE almış yaşları 1 ila <18 yaş arasında olan 91 pediyatrik hastada güvenlilik ve etkililik çalışmaları yapılmıştır. Yaşları
12 ila <18 olan adolesan denekler (n=25), yetişkin ve adolesan güvenlilik ve etkililik çalışmasına alınmış ve <12 yaş denekler (n=66), pediatrik bir çalışmaya alınmıştır. ADYNOVATE'in rutin profilakside ve kanama epizodlarının tedavisindeki güvenliliği ve etkililiği, çocuklar ve yetişkinler arasında benzerdir.
Çocuklarda farmakokinetik çalışmalar (<12 yaş) yetişkinlere kıyasla daha yüksek klirens, daha kısa yarılanma ömrü ve daha düşük artımlı faktör VIII düzelmesi göstermiştir. Klirensin (kg vücut ağırlığına göre) çocuklarda (<12 yaş) daha yüksek olduğu gösterilmiş olduğundan, bu popülasyonda kg vücut ağırlığına göre doz ayarlanması veya daha sık dozlama yapmak gerekebilir.
İmmünojenisite
Daha önce tedavi edilmiş hastalarda (PTP'ler) tamamlanmış 6 klinik çalışmanın bir veya daha fazlasına katılan deneklerin hiçbiri, FVIII ≥ 0,6 BU/mL'ye karşı (Bethesda miktar tayininin Nijmegen modifikasyonuna dayalı olarak) kalıcı nötralize edici (inhibitör) antikorlar geliştirmemiştir. Bir hastada, %8-12'lik bir FVIII seviyesi hedeflenen kişiye özel profilaksi sırasında en düşük pozitiflik sınırında (0,6 BU) geçici bir FVIII inhibitörü gelişmiştir.
Daha önce tedavi görmemiş, şiddetli hemofili A'sı olan < 6 yaş hastalarda devam eden bir çalışmadan, ADYNOVATE tedavisiyle ilişkili 9 FVIII inhibitörü gelişimi vakasına dair ön raporlar alınmıştır.
Profilaktik tedavi
Denekler, 6 aylık dönem boyunca haftada iki kez kg başına 40-50 IU dozunda ADYNOVATE
bağlı tedavi (n=17) almıştır. Medyan dozaj aralığı 3,6 gündü ve ortalama doz (SD), 48,7 (4,4) IU/kg idi. Yüz yirmi profilaksi deneğin 118'i (%98), doz ayarlaması yapılmadan önerilen başlangıç rejiminde kaldı ve 2 denek, hedef eklemlerde kanama nedeniyle profilaksi sırasında dozlarını 60 IU/kg'a çıkardı.
Protokol başına popülasyonda, yani protokole spesifik dozaj gereksinimlerine göre dozlanan profilaksi kolunda toplam 101 denek haftada iki kez rejim aldı ve gereksinime bağlı kolda 17 denek epizodik olarak tedavi edildi. Gereksinime bağlı tedavi kolundaki medyan yıllık kanama oranı (ABR), haftada iki kez profilaksi rejimindeki 1,9'a kıyasla 41,5 idi. Gereksinime bağlı koldaki medyan eklem ABR (Q1; Q3), profilaksideyken 0 (0; 2)'a kıyasla 38,1 (24,5; 44,6) idi ve medyan spontan ABR, profilaksideyken 0 (0; 2)'a kıyasla gereksinime bağlı kolda 21,6 (11,2; 33,2) idi. Tam analiz popülasyonunun sonuçları, protokol başına popülasyonun sonuçlarına benzerdi. Not olarak, ABR farklı faktör konsantrasyonları arasında ve farklı klinik çalışmalar arasında karşılaştırılabilir değildir.
Profilaksi kolunda 101 denekten 40'ı (%40) kanama epizodu geçirmedi, 101 denekten 58'i (%57) eklem kanama epizodu geçirmedi ve 101 denekten 58'i (%57) spontan kanama epizodu geçirmedi. Gereksinime bağlı koldaki tüm denekler, eklem veya spontan kanama epizodu dahil olmak üzere kanama epizodu geçirdi.
Pediyatrik Deneklerde (<12 yaş) Rutin Profilaksi Klinik Çalışması
ADYNOVATE'in güvenliliği ve etkililiği, toplam 73 pediyatrik PTP'de değerlendirildi, bunlardan 66 deneğe (<6 yaş 32 denek ve 6 ila <12 yaş arası 34 denek) ayrı bir pediyatrik klinik çalışmada doz verildi. Profilaktik rejim, ortalama (SD) doz 51,1 IU/kg ile haftada iki kez 40-60 IU/kg ADYNOVATE idi (5,5). Medyan [ortalama] toplam ABR, tedavi edilen popülasyondaki 66 denek için 2 [3,61] idi ve spontan ve eklem kanama epizodları için medyan [ortalama] ABR'ler her ikisi için de 0 [sırasıyla 1,18 ve 1,12] idi. Profilaktik olarak tedavi edilen 66 denekten 25'inde (%38) kanama epizodu görülmedi, 44'ünde (%67) spontan kanama epizotu yoktu ve 48'inde (%73) eklem kanama epizodu yoktu.
Pediyatrik çalışma sırasında gözlemlenen 70 kanama epizodunun %82,9'u 1 infüzyon ile
kontrol edildi, % 91,4'ü 1 veya 2 infüzyon ile kontrol edildi. Kanama kontrolü 70 kanama epizodunun 63'ünde (%90) mükemmel (tek bir infüzyondan sonra ağrının tamamen giderildiği
hafiflemesi ve/veya kanama belirtilerinde iyileşme) olarak derecelendirildi. Pediyatrik klinik çalışmada mükemmel veya iyi tanımlamalar, adolesan ve yetişkin deneklerde önceden yapılan profilaksi klinik çalışmasına kıyasla değişmedi.
Yetişkin ve pediyatrik hastalarda yapılan bir uzatma çalışmasında, daha önce tedavi görmüş şiddetli hemofili A'sı olan 216 hastada profilaktik tedavi rejiminin güvenliliğini ve etkililiğini değerlendirilmiştir. Büyük çoğunluğu yetişkin ve adolesan çalışmasını veya pediyatrik çalışmayı tamamlamıştır. Bu uzatma çalışmasında da benzer etkililik kaydedilmiştir.
Kanama epizodlarının tedavisi
Protokol başına popülasyonda toplam 518 kanama epizodu ADYNOVATE ile tedavi edildi. Bunlardan, gereksinime bağlı kolda 361 kanama epizodu (n=17 denek) oluştu ve profilaksi kolunda 157 kanama epizodu (n=61 denek) meydana geldi. Protokol başına popülasyondaki tüm kanama epizodlarını tedavi etmek için infüzyon başına medyan doz, kg başına 32 (Çeyrekler Arası Aralık (Interquartile Range) (IQR): 21,5) IU idi. Genel olarak, kanama epizodlarının %95,9'u 1 ila 2 infüzyonla kontrol edildi, %85,5'i ise sadece 1 infüzyonla kontrol edildi. 518 kanama epizodunun %96,1'i, ADYNOVATE tedavisine yanıtlarında mükemmel (tek bir infüzyondan sonra ağrının tamamen giderildiği ve objektif kanama belirtilerinin kesildiği) veya iyi (tek bir infüzyondan sonra kesin ağrı hafiflemesi ve/veya kanama belirtilerinde iyileşme) olarak derecelendirildi.
Perioperatif tedavi (cerrahi profilaksi)
Cerrahi çalışmasında 21 özgün denekte toplam 21 majör cerrahi işlem ve 5 ek minör ameliyat yapıldı ve değerlendirildi. Majör ameliyatlar için preoperatif yükleme dozu 36 IU/kg-109 IU/kg (medyan: 63 IU/kg) arasında; ve postoperatif toplam doz 186 IU/kg-1320 IU/kg (medyan: 490 IU/kg) arasında değişmiştir. Majör ameliyatlar için medyan toplam doz 553 IU/kg (aralık: 248- 1394 IU/kg) idi ve minör ameliyatların medyan toplam dozu 106 IU/kg (aralık: 76-132 IU/kg) idi.
Perioperatif hemostatik etkililik, tüm 26 (21 majör, 5 minör) işlem için mükemmel (hemofilik olmayan bir hastada gerçekleştirilen aynı tür işlem için beklenenden az veya buna eşit kan kaybı ve hemofilik olmayan bir popülasyonda beklenenden az veya benzer kan bileşenleri
transfüzyonları gerektiren) olarak derecelendirildi. Medyan (IQR) gözlemlenen intraoperatif
kan kaybı (n=14), majör ortopedik ameliyatlar için öngörülen ortalama 150 (140) mL kan
kaybına (n=14) kıyasla 10 (20) mL idi.
Avrupa İlaç Kurumu, konjenital faktör VIII yetmezliği tedavisinde, pediyatrik popülasyonun bir veya daha fazla alt grubunda ADYNOVATE ile yapılan çalışmaların sonuçlarını gönderme yükümlülüğünü ertelemiştir. Pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2.
Pediyatrik ve yetişkin deneklerde uzun süreli profilaksi tedavisi
ADYNOVATE'in kanama epizodlarının profilaksisi ve tedavisinde uzun süreli güvenliliği ve etkililiği, daha önce diğer ADYNOVATE çalışmalarına katılmış veya daha önce ADYNOVATE kullanmamış şiddetli hemofili A'sı olan 216 pediyatrik ve yetişkin PTP'lerde değerlendirilmiştir. Tedavi edilen popülasyonda, denekler, 12 yaş ve üzerinde ise 40 ila 50 IU/kg veya 12 yaşından küçükse ise 40 ila 60 IU/kg haftada iki kez sabit doz rejimi almıştır. FVIII çukur seviyelerini > %1'de tutmak için gerekirse doz haftada iki kez 80 IU/kg'a ayarlanmıştır. Kişiye özel (farmakokinetik olarak uyarlanmış) bir profilaktik rejimi seçen denekler, haftada en az iki kez ≥ %3'lük FVIII çukur seviyelerini hedefleyen infüzyon başına 80 IU/kg'a kadar dozlar almıştır. Profilaktik rejime, kanama bölgesi ve etiyolojisine göre ABR Tablo 3'te sunulmuştur.
Tablo 3: Profilaktik rejime göre yıllık kanama hızı (ABR) (ITT popülasyonu)
Kanama Bölgesi Etiyolojisi | Haftada İki Kez (N=186) | 5 Günde Bir (N=56) | 7 Günde Bir (N=15) | PK - uyarlanmış (N=25) |
Ortalama [Nokta Tahmini - %95 Güven Aralığı] | ||||
Genel | 2,2 [1,85 – 2,69] | 2,1 [1,54 – 2,86] | 2,7 [1,44 -5,2] | 2,6 [1,7 – 4,08] |
Eklem | 1,2 [0,96 – 1,58] | 1,1 [0,81 – 1,55] | 2 [0,9 – 4,62] | 1,4 [0,91 – 2,17] |
Spontan | 1,2 [0,92 – 1,56] | 1,3 [0,87 – 2,01] | 1,8 [0,78- 4,06] | 1 [0,54 – 1,71] |
ABR, farklı faktör konsantreleri ve farklı klinik çalışmalar arasında benzer değildir.
Uzun süreli hemostatik etkililik, ADYNOVATE ile tedavi edilen 910 kanama epizodunda değerlendirilmiştir ve kanama epizodlarının %88,5'i mükemmel veya iyi olarak derecelendirilmiştir. Yaş kategorileri arasında ve hem sabit doz hem de PK'ye özel doz rejimi
için kanama tedavilerinin >%85'i mükemmel veya iyi olarak derecelendirilmiştir. Kanama
epizodlarının çoğu bir (%74) veya iki (%15,4) infüzyonla tedavi edilmiştir.
Adolesan ve yetişkin deneklerde kişiselleştirilmiş profilaksi PROPEL klinik araştırması ADYNOVATE'in güvenliliği ve etkililiği, 12 aylık bir tedavi süresi boyunca şiddetli hemofili A'sı olan 121 (115 randomize) adolesan (12-18 yaş) ve yetişkin PTP'lerde yapılan prospektif, randomize, açık etiketli çok merkezli bir çalışmada değerlendirilmiştir. Çalışma, haftada iki kez uygulanan %1-3 (N=57) veya gün aşırı uygulanan %8-12 (N=58) Faktör VIII çukur seviyelerini hedefleyen ADYNOVATE'in PK'ya bağlı profilaktik 2 doz rejimini, ikinci 6 aylık çalışma döneminde toplam ABR'si 0 olan deneklerin oranlarını değerlendirerek karşılaştırmıştır.
% 1-3 ve % 8-12 çukur kollarında uygulanan ortalama profilaktik dozlar, sırasıyla yılda 3866,1 IU/kg [ortalama (SD) infüzyonlar/hafta = 2,3 (0,58)] ve yılda 7532,8 IU/kg [(ortalama (SD) infüzyonlar/hafta = 3,6 (1,18)] idi. Profilaksinin ilk 6 aylık döneminde doz ayarlamasından sonra, ikinci 6 aylık dönemde medyan çukur seviyeleri (tek aşamalı pıhtılaşma testine göre ve planlanan infüzyon aralığının sonunda hesaplanan), %1-3 çukur seviye kolunda 2,1 IU/dL ila 3 IU/dL arasında ve %8-12 çukur seviye kolunda 10,7 IU/dL ila 11,7 IU/dL arasında değişerek, 2 profilaksi rejiminde dozlamanın, istenen FVIII çukur seviyelerini elde etmek ve sürdürmek için genellikle yeterli olduğunu göstermiştir.
Çalışmanın primer sonlanım noktası olarak ikinci 6 aylık dönemde toplam ABR'si 0 olan deneklerin oranına, ITT hasta popülasyonunda (p= 0,0545) ulaşılamazken, protokol başına popülasyonda ulaşılmıştır (p = 0.0154). İkinci 6 aylık çalışma döneminde toplam ABR'ler, spontan ABR'ler ve spontan yıllık eklem kanama oranları (AJBR'ler) 0 olan randomize deneklerin oranları Tablo 4'te sunulmuştur.
Tablo 4: Yıllık kanama oranı (ABR) 0, ikinci 6 aylık çalışma dönemi
| 6 Ayda Kanama Olmayan Deneklerin Oranı [Nokta Tahmini - %95 Güven Aralığı] | |
%1-3 Çukur Seviye (N=57) | %8-12 Çukur Seviye (N=58) | |
Toplam ABR 0 | 0,421 [0,292; 0,549] | 0,621[0,491; 0,75] |
Spontan ABR 0 | 0,596 [0,469; 0,724] | 0,76 [0,645; 0,875] |
Spontan AJBR 0 | 0,649 [0,525; 0,773] | 0,85 [0,753; 0,947] |
| 6 Ayda Kanama Olmayan Deneklerin Oranı [Nokta Tahmini - %95 Güven Aralığı] | |
| %1-3 Çukur Seviye (N=52) | %8-12 Çukur Seviye (N=43) |
Toplam ABR 0 | 0404 [0,27; 0,549] | 0,674 [0,515; 0,809] |
Spontan ABR 0 | 0,596 [0,451; 0,73] | 0,814 [0,666; 0,916] |
Spontan AJBR 0 | 0,654 [0,509; 0,78] | 0,907 [0,779; 0,974] |
ABR, farklı faktör konsantreleri ve farklı klinik çalışmalar arasında benzer değildir.
İkinci 6 aylık çalışma döneminde toplam ABR'ler, spontan ABR'ler ve spontan AJBR'ler Tablo 5'te sunulmuştur.
Tablo 5: Yıllık kanama oranı (ABR) ikinci 6 aylık çalışma dönemi
| (ITT Popülasyonu) | |||
%1-3 Çukur Seviye (N=57) | %8-12 Çukur Seviye (N=53) | |||
Medyan | Ortalama (SD) | Medyan | Ortalama (SD) | |
Toplam ABR | 2 | 3,6 (7,5) | 0 | 1,6 (3,4) |
Spontan ABR | 0 | 2,5 (6,6) | 0 | 0,7 (1,7) |
Spıntan AJBR | 0 | 2 (6,4) | 0 | 0,5 (1,7) |
| Protokol Başına Popülasyon | |||
%1-3 Çukur Seviye (N=52) | %8-12 Çukur Seviye (N=43) | |||
Medyan | Ortalama (SD) | Medyan | Ortalama (SD) | |
Toplam ABR | 2 | 2,4 (3,2) | 0 | 2,1 (4,2) |
Spontan ABR | 0 | 1,6 (2,6) | 0 | 0,8 (2,4) |
Spontan AJBR | 0 | 1 (1,8) | 0 | 0,7 (2,2) |
% 1-3 çukur seviye kolunda 40 denekte 155 kanama ve % 8-12 çukur seviye kolunda 26 denekte 87 kanama olmak üzere 66 denekte toplam 242 kanama epizodu ADYNOVATE ile tedavi edilmiştir. Kanamaların çoğu (%86, 208/242), 1 veya 2 infüzyonla tedavi edilmiştir ve kanama epizodunun çözülmesinde kanama tedavisi, kanamaların %84,7'sinde (205/242) mükemmel veya iyi olarak derecelendirilmiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerADYNOVATE'in farmakokinetiği (FK), ADYNOVATE ile 6 aylık bir tedaviden sonra 26 denekte (18 yetişkin ve 8 adolesan) ve 22 denekte (16 yetişkin ve 6 adolesan) oktokog alfa ile yapılan çapraz çalışmada değerlendirildi. Plazma faktör VIII aktivitesi, tek aşamalı pıhtılaşma
tayini ve kromojenik tayin ile ölçüldü.
Emilim:
ADYNOVATE'e ilişkin değişik yaş gruplarında (küçük ve büyük çocuklar, adolesanlar ve
erişkinler) hastalar için emilim sonuçları Tablo 6'da verilmektedir.
Dağılım:
ADYNOVATE'e ilişkin değişik yaş gruplarında (küçük ve büyük çocuklar, adolesanlar ve
erişkinler) hastalar için dağılım hacimlerinin bir özeti Tablo 6'da verilmektedir.
Biyotransformasyon:
Uygulanabilir değildir.
Eliminasyon:
ADYNOVATE, tek aşamalı pıhtılaşma ve kromojenik tayinlere dayanarak belirlendiği gibi, sırasıyla adolesan ve yetişkin popülasyondaki rekombinant insan pıhtılaşma faktörü VIII'e (oktokog alfa) kıyasla 1,4 ila 1,5 kat uzatılmış bir yarılanma ömrüne sahiptir. Ana molekül oktokog alfaya kıyasla Eğri Altındaki Alanda (EAA) bir artış ve klirenste de bir azalma gözlemlenmiştir. Artımlı düzelme, her iki ürünle de karşılaştırılabilirdi. FK parametrelerindeki değişim hem yetişkin hem de adolesan popülasyonlarında ve tek aşamalı pıhtılaşma ve kromojenik substrat tayinleri arasında benzerdi.
Doğrusallık / doğrusal olmayan durum:
Bilinmemektedir.
FK Parametreleri |
ADYNOVATE Yetişkin (18 yaş ve üzeri) N=18 Doz: 45 ± 5IU/kg |
ADYNOVATE Adolesan (12 ila <18 yaş) N=8 Doz: 45 ± 5 IU/kg |
ADYNOVATE Pediyatrik (6 ila <12 yaş) N=17 Doz: 50 ± 10 IU/kg |
ADYNOVATE Pediyatrik (<6 yaş) N=14 Doz: 50 ± 10 IU/kg |
Tablo 6: Kromojenik test kullanılan farmakokinetik parametreler (Aritmetik ortalama ± SS)
Dizayn | Tam örnekleme ile bireysel FK | Seyrek örnekleme ile bireysel FK | ||
Terminal yarılanma ömrü [saat] |
15,01 ± 3,89 |
13,80 ± 4,01 |
11,93 ± 2,58 |
12,99 ± 8,75 |
MRT [saat] | 19,70 ± 5,05 | 17,73 ± 5,44 | 17,24 ± 3,73 | 18,74 ± 12,60 |
KL [mL/(kg·saat)] |
2,16 ± 0,75 |
2,58 ± 0,84 |
2,80 ± 0,67 |
3,49 ± 1,21 |
Artımlı Düzelme [(IU/dL)/(IU/kg)] | 2,87 ± 0,61 | 2,34 ± 0,62 | na (2,19± 0,40) | na (1,90 ± 0,27) |
EAA [IU·saat/dL] |
2589 ± 848 |
1900 ± 841 |
2259 ± 514 |
2190 ± 1593 |
Vss [dL/kg] | 0,40 ± 0,09 | 0,54 ± 0,22 | 0,46 ± 0,04 | 0,54 ± 0,03 |
C[IU/dL] | 145 ± 29 | 117 ± 28 | na (130 ± 24) | na (117 ± 16) |
Kısaltmalar: C: maksimum gözlemlenen aktivite; EAA: eğri altındaki alan; MRT: ortalama kalış süresi; KL: klirens; V: kararlı durumda vücut ağırlığı ayarlı dağılım hacmi;
12 infüzyon sonrası örnekten oluşan bireysel PK
5.3. Klinik öncesi güvenlilik verileri
Sinomolgus maymunda yapılan tekrarlanan doz toksisite çalışmasında, iki hayvan orta doz grubunda (350 IU/kg) böbrekte vakuol (boşluk) oluşumu gösterdi. Vakuol oluşumları 2 hafta sonra geçmedi. Preklinik çalışmada gözlemlenen böbrek vakuol oluşumunun insanla ilişkisi bilinmemektedir.
Klinik olmayan veriler 1 aylık maruziyet ile sınırlıdır ve ADYNOVATE ile jüvenil hayvanlarda hiçbir çalışma yapılmamıştır. Bu nedenle, pediyatrik popülasyonda ADYNOVATE'in kronik kullanımıyla alakalı çeşitli dokularda/organlarda PEG birikiminin potansiyel riskleri üzerine karar vermek mümkün olmamıştır. ADYNOVATE ile genotoksisite, karsinojenisite veya üreme toksisitesi ile ilgili hiçbir çalışma yapılmamıştır.
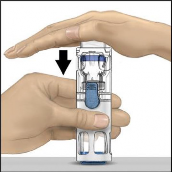
Bir eliniz BAXJECT III sistemindeki toz flakonu tutarken, sistem tamamen çökene ve çözücü toz flakonun içine akana kadar çözücü flakonun üzerine diğer elinizle sıkıca bastırınız (Şekil 2). Aktarım tamamlanana kadar sistemi eğmeyiniz.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Toz
Mannitol (E421) Trehaloz dihidrat Histidin Glutatyon Sodyum klorür
Kalsiyum klorür dihidrat (E509) Tris (hidroksimetil) aminometan Polisorbat 80 (E433)
Çözücü Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimsizlik çalışmaları bulunmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon
24 ay.
Tıbbi ürün açılmadan önce oda sıcaklığında (30°C'ye kadar) 3 aya kadar bir sürede saklanabilir. Oda sıcaklığında 3 aylık saklamanın son günü ürün kartonuna kaydedilmelidir. Bu tarih, başlangıçta dış karton kutuda belirtilen tarihi asla geçmemelidir. Bu sürenin sonunda, ürün buzdolabına geri konmamalı, kullanılmalı veya atılmalıdır.
Sulandırıldıktan sonra
Kimyasal ve fiziksel kullanımda stabilite, 30°C'nin üzerinde olmayan bir sıcaklıkta 3 saat boyunca gösterilmiştir. Mikrobiyolojik açıdan bakıldığında, sulandırma metodu mikrobiyal kontaminasyon riskini engellemediği sürece ürün derhal kullanılmalıdır. Hemen kullanılmadığında, kullanımda saklama süreleri ve koşulları kullanıcının sorumluluğundadır. Dondurulmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
tedbirler Buzdolabında saklayınız (2°C ila 8°C arasında). Dondurmayınız.BAXJECT III sistemin içeresindeki ADYNOVATE: Işıktan korumak için kapalı blisteri dış karton kutunun içinde muhafaza ediniz.
Tıbbi ürünün sulandırılmasından sonraki saklama koşulları için, bkz bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
1000 IU toz içeren, klorobütil kauçuk tıpa ile kapatılmış Tip I cam flakon.
2 mL enjeksiyonluk su içeren, klorobütil veya bromobütil kauçuk tıpa ile kapatılmış Tip I cam flakon.
- BAXJECT III sistemi içerisindeki ADYNOVATE: Her pakette, kapalı bir blisterde kullanıma hazır bir BAXJECT III sistemi, sulandırma için önceden birleştirilmiş toz flakon ve çözücü flakon ile birlikte uygulama seti kapsamında kelebek iğneli infüzyon seti ve tek kullanımlık enjektör bulunur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Sulandırılmış tıbbi ürün uygulanmadan önce partiküler madde ve renk değişikliği için görsel olarak kontrol edilmelidir. Çözelti berrak veya hafif bulanık olmalıdır. Dumanlı veya birikintili olan çözeltiler kullanılmamalıdır.Sulandırıldıktan sonra, çözelti pH değeri 6,7 – 7,3'tür. Osmolalite ≥ 380 mOsmol/kg'dır.
BAXJECT III sistemiyle sulandırma
Kapak blister üzerinde tamamen kapatılmamışsa kullanmayınız.
Ürün hala buzdolabında saklanıyorsa, kapalı blisteri (sulandırmak için sistemle önceden monte edilmiş toz ve çözücü flakonları içerir) buzdolabından alınız ve oda sıcaklığına (15°C ile 25°C arasında) ulaşmasını sağlayınız.
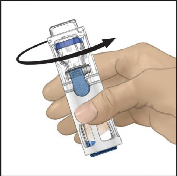
Çözücünün aktarımının tamamlandığını doğrulayınız. Tüm materyal eriyene kadar yavaşça döndürünüz (Şekil 3). Tozun tamamen çözündüğünden emin olunuz, aksi halde sulandırılan çözeltilerin tümü cihaz filtresinden geçmeyecektir. Ürün hızlı bir şekilde çözünür (genellikle 1 dakikadan az). Sulandırıldıktan sonra çözelti berrak, renksiz ve parçacıklardan arındırılmış olmalıdır.
Şekil 1 Şekil 2 Şekil 3
Şekil 4 Şekil 5
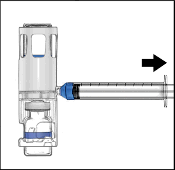
Uygulama
Kullanımdan önce sulandırılmış çözeltiyi partiküler madde ve renk değişikliği açısından görsel olarak inceleyiniz.
Sulandırılmış çözeltinin görünümü berrak ve renksizdir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ADYNOVATE | 8681429550509 | 9,253.64TL |
| BERIATE | 8699738980436 | |
| BERIATE-P | 8699738980481 | |
| ELOCTA | 8683125910038 | 16,467.72TL |
| EMOCLOT | 8680972009038 | 10,581.91TL |
| Diğer Eşdeğer İlaçlar |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Satış Fiyatı | 9253.64 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 9253.64 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8681429550509 |
| Etkin Madde | Rurioktokog Alfa Pegol |
| ATC Kodu | B02BD02 |
| Birim Miktar | 1000 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Koagülasyon Faktörü 8 |
| İthal ( ref. ülke : İtalya ) ve Beşeri bir ilaçdır. |