AFINITOR 5 mg 30 tablet Farmakolojik Özellikler
{ Everolimus }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar, protein kinaz inhibitörleri, mTOR inhibitörleri
ATC kodu: L01EG02
Etki mekanizması
Everolimus, seçici bir mTOR (rapamisinin memeli hedefi) inhibitörüdür. mTOR, aktivitesi insanlarda görülen çok sayıda kanserde arttığı bilinen önemli bir serin treonin kinazdır. Everolimus, intraselüler bir protein olan FKBP-12'ye bağlanıp, mTOR kompleksi-1 (mTORC1) aktivitesini inhibe eden bir kompleks oluşturur. mTORC1 sinyal yolağının inhibisyonu, hücre büyümesinin düzenlenmesinde görev alan S6 ribozomal protein kinazın (S6K1) aktivitesini azaltmak suretiyle ve hücre döngüsü, anjiyogenez ve glikoliz ile alakalı olan proteinleri düzenleyen ökaryotik uzatma faktörü 4E bağlayıcı proteinin (4EBP-1) aktivitesini azaltarak proteinlerin translasyonunu ve sentezini engeller. Everolimus, tümörün angiogenik süreçlerini potansiyalize eden vasküler endotelyal büyüme faktörü (VEGF) düzeylerini azaltır. Everolimus, tümör hücreleri, endotelyal hücreler, fibroblastlar ve vasküler
düz kas hücrelerinin büyümesi ve proliferasyonunun potent bir inhibitörüdür ve solid tümörlerde in vitro ve in vivo glikolizi azalttığı gösterilmiştir.
Klinik etkililik ve güvenlilik
Hormon reseptörü pozitif meme kanseri
BOLERO-2 (CRAD001Y2301), önceki letrozol veya anastrozol ile tedavi sonrası nüks veya progresyonlu östrojen reseptörü pozitif, HER 2-neu/ amplifiye olmayan ilerlemiş meme kanseri olan postmenopozal kadınlarda plasebo + eksemestan karşısında AFINITOR + eksemestana ilişkin randomize, çift kör, çok merkezli faz III çalışmadır. Hastalar, açık etiketli eksemestana (25 mg/gün) ek olarak everolimus (10 mg/gün) veya plasebo için 2:1 oranında randomize edilmiş. Önceki hormonal tedaviye hassasiyet (var/ yok) ve iç organ metastazı varlığına (var/ yok) göre katmanlama yapılmıştır. Önceki hormonal tedaviye hassasiyet (1) ilerlemiş koşullarda önceki en az bir hormonal tedaviden sonra belgelenmiş klinik fayda (tam yanıt [CR], kısmi yanıt [PR], ≥24 hafta stabil hastalık) veya (2) nüks öncesi en az 24 ay adjuvan hormonal tedavidir.
Birincil sonlanımı araştırmacı lokal radyoloji değerlendirmesine göre Solid Tümörlerde Yanıt Değerlendirme Kriterlerine (RECIST) göre progresyonsuz sağkalım (PFS) olarak belirlenmiş, Destekleyici PFS analizleri, bağımsız merkezi radyoloji değerlendirmesine dayanmıştır.
İkincil sonlanımı genel sağkalım (OS), Genel Yanıt Oranı (ORR), Klinik Fayda Oranı (CBR), Güvenlilik, Yaşam Kalitesi (QoL) değişikliği ve ECOG PS bozulmasına kadar geçen süredir. Diğerleri 6 ve 12. hafta kemik döngü değişiklikleridir.
Ek olarak 724 hasta 2:1 everolimus (10 mg/gün) + eksemestan (25 mg/gün) kombinasyonu (n= 485) veya plasebo + eksemestana (25 mg/gün) (n = 239) randomize edilmiştir. Nihai OS analizi zamanında, medyan everolimus tedavisi süresi 24 haftadır (aralık 1-199,1 hafta). Medyan eksemestan tedavisi süresi everolimus + eksemestan grubunda 29,5 hafta (1-199,1) iken, plasebo + eksemestan grubunda 14,1 haftadır (1-156).
Birincil etkililik sonlanım noktası için etkililik bulguları nihai PFS analizinden elde edilmiştir (bkz. Tablo 3 ve Şekil 1). Plasebo + eksemestan kolundaki hastalar progresyon zamanında everolimusa çapraz geçiş yapmamıştır.
Tablo 3. BOLERO-2 etkililik bulguları
Analiz | AFINITORn=485 | Plasebon=239 | Tehlike oranı | p değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Araştırıcı radyolojik incelemesi | 7,8 (6,9 ila 8,5) | 3,2 (2,8 ila 4,1) | 0,45 (0,38 ila 0,54) | <0,0001 |
Bağımsız radyolojik inceleme | 11 (9,7 ila 15) | 4,1 (2,9 ila 5,6) | 0,38 (0,31 ila 0,48) | <0,0001 |
Medyan genel sağkalım (ay) (%95 GA) | ||||
Medyan genel sağkalım | 31 (28 – 34,6) | 26,6 (22,6 – 33,1) | 0,89 (0,73 – 1,1) | 0,1426 |
En iyi genel sağkalım (ay) (%95 GA) | ||||
Objektif yanıt oranı | %12,6 (9,8 ila 15,9) | %1,7 (0,5 ila 4,2) | n/a | <0,0001 |
|
|
|
|
|
Klinik fayda oranı | %51,3 (46,8 ila 55,9) | %26,4 (20,9 ila 32,4) | n/a | <0,0001 |
Şekil 1 BOLERO-2 Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırıcı radyolojik incelemesi)
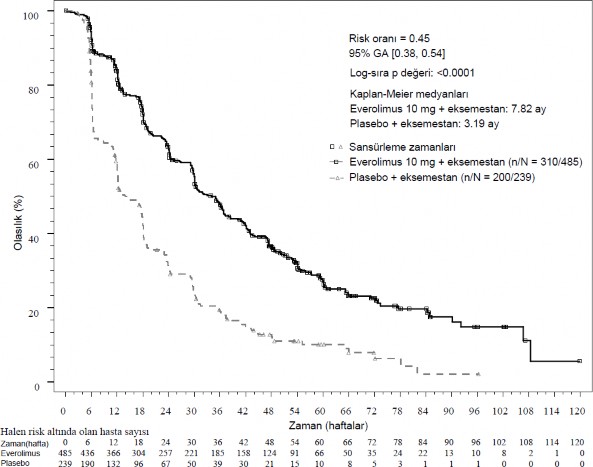
Hesaplanmış PFS tedavisi etkisi araştırıcı değerlendirmesine göre planlanmış PFS alt grup analizi ile desteklenmiştir. Analiz edilen tüm alt gruplar için (yaş, önceki hormonal tedaviye duyarlılık, tutulan organ sayısı, başlangıçta sadece kemik lezyonları durumu ve viseral metastaz varlığı ve majör demografik ve prognostik alt gruplar arasında), plasebo + eksemestana karşı 0,25 ila 0,6 arasında değişen bir hesaplanmış tehlike oranı (HR) ile everolimus + eksemestan ile pozitif bir tedavi etkisi görülmüştür.
QLQ-C30'un genel ve fonksiyonel alt birim skorlarında ≥%5 bozulmaya kadar geçen süre açısında iki kol arasında bir fark gözlenmemiştir.
BOLERO-6 (Çalışma CRAD001Y2201), östrojen reseptörü pozitif, HER2/neu negatif, lokal ilerlemiş, tekrarlayan veya önceki letrozol veya anastrozol tedavisi sırasında rekürrens veya progresyon sonrası metastatik meme kanseri olan menopoz sonrası kadınların tedavisinde eksemestan ile kombinasyon karşısında tek başına everolimusun incelendiği üç kollu, randomize, açık etiketli bir faz II everolimus çalışmasıdır
Çalışmanın birincil amacı, yalnızca everolimusa karşı everolimus + eksemestan için PFS'nin HR'sini tahmin etmektir. Temel ikincil amaç, everolimus + eksemestan için kapesitabine karşı PFS'nin HR'sini tahmin etmektir.
Diğer ikincil amaçlar arasında OS değerlendirmesi, objektif yanıt oranı, klinik fayda oranı, güvenlilik, ECOG performansında bozulmaya kadar geçen zaman, yaşam kalitesinde bozulmaya kadar geçen zaman ve tedavi memnuniyeti (TSQM) yer almıştır. Resmi istatistiksel karşılaştırma planlanmamıştır.
Toplam 309 hasta, 1: 1: 1 oranında everolimus (günde 10 mg) + eksemestan (günde 25 mg) kombinasyonuna (n = 104), tek başına everolimus (günde 10 mg) (n = 103) veya kapesitabin (2 hafta boyunca günde iki kez 1250 mg/m2 doz, ardından bir haftalık dinlenme, 3 haftalık döngü) (n = 102) kollarına randomize edilmiştir. Verilerin kesilmesi sırasında everolimus + eksemestan kolunda ortalama tedavi süresi 27,5 hafta (aralık 2-165.7), everolimus kolunda 20 hafta (1.3-145) ve kapesitabin kolunda 26,7 hafta (1.4-177.1) olmuştur.
Yerel araştırmacı değerlendirmesine göre gözlenen 154 PFS olayı ile son PFS analizinin sonucu, everolimus koluna göre everolimus + eksemestan kolu lehine tahmini 0,74 HR (%90 GA: 0.57, 0.97) göstermiştir. Ortalama PFS sırasıyla 6,8 ay (%90 GA: 5.5, 7.2) ve 8,4 ay
(%90 GA: 6.6, 9.7) olmuştur.
Şekil 2 BOLERO-6 Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırmacının radyolojik incelemesi)
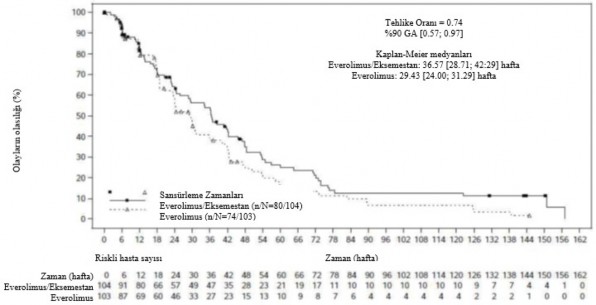
Ana ikincil sonlanım noktası PFS için tahmini HR, gözlemlenen toplam 148 PFS olayına dayanarak, everolimus + eksemestan kombinasyon koluna kıyasla kapesitabin lehine 1,26 (%90 GA: 0.96, 1.66) olmuştur.
İkincil sonlanım noktası OS sonuçları, birincil sonlanım noktası PFS ile tutarlı olmamış, tek başına everolimus kolu lehine bir eğilim gözlenmiştir. Everolimus + eksemestan koluna göre tek başına everolimus kolundaki OS'nin karşılaştırılması için tahmini HR değeri, 1,27 (%90
GA: 0.95, 1.70) bulunmuştur. Kapesitabin koluna göre everolimus + eksemestan kombinasyon kolunda OS karşılaştırması için tahmini HR 1.33'tür (%90 GA: 0.99, 1.79).
Pankreas orijinli ilerlemiş nöroendokrin tümörlerin tedavisi
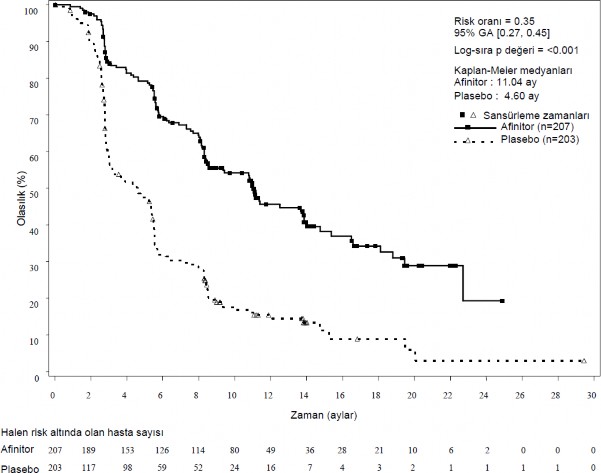
RADIANT-3 (CRAD001C2324 - ilerlemiş pankreatik nöroendokrin tümör (pNET) hastalarında plasebo artı en iyi destek tedaviye (BSC) karşı AFINITOR artı BSC ilişkin randomize, çift kör, çok merkezli faz III çalışma) , medyan PFS'de %65 risk azalması (HR 0,35; %95 GA (GA: Güven aralığı): 0,27; 0,45; p<0,0001) ve 2,4 katlık bir uzama (4,6 aya karşı 11,04 ay) ile plaseboya karşı AFINITOR'un istatistiksel olarak anlamlı klinik faydasını göstermiştir (bkz. Tablo 4 ve Şekil 3).
RADIANT-3, hastalığı önceki 12 ay içinde progrese olan, iyi ve orta derecede farklılaşmış ilerlemiş pNET'li hastaları içermektedir. BSC içinde Somatostatin analoglarına izin verilmiştir.
Birincil sonlanım araştırıcı radyolojik incelemesine göre RECIST'e göre PFS'dir. Radyolojik progresyon sonrası hastalar araştırıcı tarafından körlenmiş, plaseboya randomize olanlar daha sonra açık etiketli AFINITOR kullanabilmiştir.
İkincil sonlanım noktaları güvenlilik, ORR (CR veya PR), yanıt süresi ve OS'yi içermektedir.
Toplam 410 hasta AFINITOR 10 mg/gün (n=207) veya plaseboya (n=203) 1:1 oranda randomize edilmiş, demografikler iyi dengelenmiştir (medyan yaş 58, %55 erkek, %78,5 beyaz). Her iki koldaki hastaların %53'ü daha önce sistemik tedavi almıştır. Körlenmiş tedavinin medyan süresi, everolimus alan hastalar için 37,8 hafta (1,1 ile 129,9 hafta arasında) ve plasebo alanlar için 16,1 haftadır (0,4 ile 147 hafta arasında).
Hastalık progresyonunun ardından veya çalışmanın körlüğü kaldırıldıktan sonra, başlangıçta plaseboya randomize edilen 203 hastanın 172'si (%84,7) açık etiketli AFINITOR'a çapraz geçiş yapmıştır. Açık etiketli tedavinin medyan süresi, tüm hastalarda 47,7 hafta olarak belirlenmiştir: Everolimus'a randomize edilen ve daha sonra açık etiketli everolimusa geçiş yapan 53 hastada 67,1 hafta ve plaseboya randomize edilen ve daha sonra açık etiketli everolimusa geçiş yapan 172 hastada 44,1 haftadır.
Tablo 4. RADIANT-3 – etkililik bulguları
Popülasyon | AFINITOR n=207 | Plasebo n=203 | Tehlike oranı (%95 GA) | p-değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Araştırıcı radyolojik incelemesi | 11,04 (8,41; 13,86) | 4,6 (3,06; 5,39) | 0,35 (0,27; 0,45) | <0,0001 |
Bağımsız radyolojik inceleme | 13,67 (11,17; 18,79) | 5,68 (5,39; 8,31) | 0,38 (0,28; 0,51) | <0,0001 |
Medyan genel sağkalım (ay) (%95 GA) | ||||
Medyan genel sağkalım | 44,02 (35,61; 51,75) | 37,68 (29,14; 45,77) | 0,94 (0,73; 1,2) | 0,3 |
Şekil 3 RADIANT-3 – Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırıcı radyolojik incelemesi)
Gastrointestinal veya akciğer kökenli ilerlemiş nöroendokrin tümörlerinin tedavisi
Plasebo ile birlikte en iyi destek tedavisi (BSC) karşısında AFINITOR artı BSC'nin değerlendirildiği randomize, çift kör, çok merkezli bir faz III çalışma olan RADIANT-4 (çalışma CRAD001T2302) ilerlemiş, iyi diferansiye (Derece 1 ya da 2) fonksiyonel olmayan, gastrointestinal veya akciğer kökenli nöroendokrin tümörleri olan, karsinoid sendrom öyküsü ya da karsinoid sendrom ile ilişkili aktif semptomları olmayan hastalar ile yürütülmüştür.
Çalışmanın birincil sonlanma noktası, bağımsız radyoloji değerlendirmesine dayalı Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) ile değerlendirilen progresyonsuz sağkalım (PFS) olmuştur. Destekleyici PFS analizi, yerel araştırmacı incelemesine dayanmıştır. İkincil sonlanma noktaları genel sağkalım (OS), genel yanıt oranı, hastalık kontrol oranı, güvenlilik, Yaşam Kalitesinde değişiklik (FACT-G) ve Dünya Sağlık Örgütü performans durumu (WHO PS) bozulmasına kadar geçen süreyi içermiştir.
Toplam 302 hasta 2:1 oranında everolimus (günlük 10 mg) (n=205) ya da plasebo (n=97) almak üzere randomize edilmiştir. İki tedavi grubu çalışma başlangıcındaki demografik özellikler, hastalık karakteristikleri ve önceli somatostatin analoğu (SSA) kullanımı öyküsü bakımından genel olarak dengeli olmuştur. Hastaların medyan yaşı 63 (aralık: 22-86) olup hastaların %76'sı beyaz ırk mensubudur. Körlenmiş tedavinin medyan süresi AFINITOR alan hastalarda 40,4 hafta ve plasebo alan hastalarda 19,6 hafta olmuştur. Birincil PFS analizinden sonra, plasebo kolundan 6 hasta açık etiketli everolimusa geçmiştir.
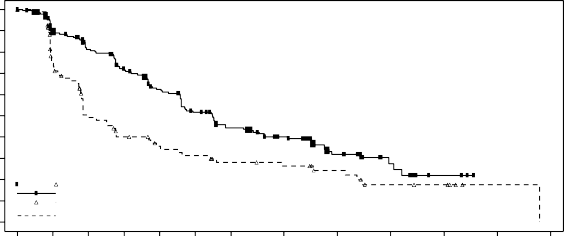
Birincil sonlanım noktası PFS (bağımsız radyolojik inceleme) için etkililik sonuçları, nihai PFS analizinden elde edilmiştir (bkz. Tablo 5 ve Şekil 4). PFS (araştırmacı radyolojik incelemesi) için etkililik sonuçları, son OS analizinden elde edilmiştir (bkz. Tablo 5).
Tablo 5. RADIANT-4 – Progresyonsuz sağkalım sonuçları
Popülasyon | AFINITOR n=205 | Plasebo n=97 | Tehlike oranı (%95 GA) | p-değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Bağımsız radyolojik inceleme | 11,01 (9,2; 13,3) | 3,91 (3,6; 7,4) | 0,48 (0,35; 0,67) | <0,001 |
Araştırıcı radyolojik incelemesi | 14,39 (11,24; 17,97) | 5,45 (3,71; 7,39) | 0,4 (0,29; 0,55) | <0,001 |
Şekil 4 RADIANT-4 – Kaplan-Meier progresyonsuz sağkalım eğrileri (bağımsız radyolojik inceleme)
Olasılık (%)
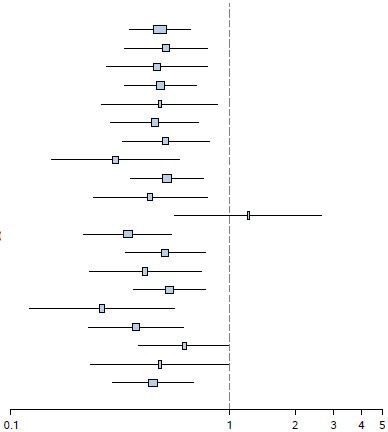
Destekleyici analizlerde, tümör kaynaklı birincil bölge olan ileum hastalarının alt grubu hariç, tüm alt gruplarda pozitif tedavi etkisi gözlenmiştir (İleum: HR= 1,22 [%95 GA: 0,56 ila 2,65], İleum olmayan: HR= 0,34 [%95 GA: 0,22 ila 0,54] Akciğer: HR= 0,43 [%95 GA: 0,24 ila
0,79]) (bkz. Şekil 5).
Şekil 5 RADIANT-4 – Daha önceden belirlenen hasta alt grubunda pogresyonsuz sağkalım sonuçları (bağımsız radyolojik inceleme)
Yaş WHO PS
SSA öncesi
Kemoterapi öncesi
Birincil tümor yeri
Tümor derecesi
Karaciğer tümor yükü
CgA referans değeri
NSE referans değeri
Hepsi (N=302)
![]()
<65 yaş (N=159)
≥65 yaş (N=143)
0 (N=216)
1 (N=86) Evet (N=157)
Hayır (N=145) Evet (N=77)
No (N=225)
Akciğer (N=90) İleum (N=71)
Derece 2 (N=107)
≤10% (N=228)
>10% (N=72)
>2xULN (N=139)
≤2xULN (N=138)
>ULN (N=87)
≤ULN (N=188)
Everolimus + BSC Plasebo + BSC
* İleum olmayan: mide, kolon, rektum, apandis, kör bağırsak, onikiparmak bağırsağı, jejunum, primer kökenli ve diğer gastrointestinal kökenli olmayan karsinom
ULN: Normal üst sınır CgA: Kromogranin A NSE: Nörona özgü enolaz
Tabakalı Cox modelinden gelen tehlike oranı (%95 GA)
Final genel sağkalım (OS) analizi, çalışmanın kör döneminde AFINITOR veya plasebo alan hastalar arasında istatistiksel olarak anlamlı bir fark göstermemiştir (HR = 0,9 [% 95 GA: 0,66-1,22]).
İki kol arasında WHO PS'de kesin bozulmaya kadar geçen süre (HR=1.02; [%95 CI: 0.65, 1.61]) ile yaşam kalitesinde kesin bozulmaya kadar geçen süre (FACT-G toplam puanı HR=0.74; [%95 CI:0.50, 1.10]) arasında fark gözlemlenmemiştir.
Renal hücreli kanser hastalarının tedavisi
Daha önce uygulanan VEGFR-TKI (vasküler endotelyal büyüme faktörü reseptörü tirozin kinaz inhibitörü) tedavisine (sunitinib, sorafenib, ya da sunitinib ve sorafenib birlikte) rağmen ilerleyen, metastatik renal hücreli karsinom hastalarında, BSC ile birlikte 10 mg/gün AFINITOR ve plasebonun karşılaştırıldığı, faz III, uluslararası, çok merkezli, randomize çift kör çalışmada, bevacizumab ve interferon-alfa ile ön tedaviye izin verilmiş, hastalar, Memorial Sloan-Kettering Kanser Merkezi (MSKCC) prognostik puanına (olumlu-, orta-,
kötü-risk grupları) ve daha önce uygulanan antikanser tedaviye göre (daha önce 1'e karşılık 2 VEGFR-TKI) sınıflandırılmıştır.
RECIST kullanılarak belgelenen ve körlenmiş, bağımsız merkezi gözden geçirmeyle değerlendirilen ilerlemenin olmadığı sağkalım birincil sonlanımdır. İkincil sonlanım, güvenlilik, objektif tümör yanıt oranı, OS, hastalıkla bağlantılı semptomlar ve yaşam kalitesini kapsar. Radyolojik ilerleme belgelendikten sonra, araştırıcı tarafından körlük kaldırılabilir: plaseboya randomize edilen hastalara açık etiketli AFINITOR 10 mg/gün uygulanabilir. Bağımsız Veri İzleme Komitesi, ikinci ara analizde, birincil sonlanıma ulaşıldığına karar vermiş ve çalışmanın sonlandırılmasını önermiştir.
416 hasta 2:1 AFINITOR (n=277) veya plasebo (n=139) alacak şekilde randomize edilmiş, demografik veriler oldukça dengelidir (Medyan yaş [61; 27 - 85], %78 erkek, %88 beyaz,
önceki VEGFR-TKI terapi sayısı [1 tedavi: %74, 2 tedavi: %26]). AFINITOR alanlarda
medyan kör tedavisüresi 141 (19 – 451) gün iken, plaseboda 60 (21 – 295) gündür. AFINITOR, birincil sonlanım noktası olan progresyonsuz sağkalımda plaseboya göre daha iyi sonuç vererek progresyon veya ölüm riskinde %67 oranında istatistiksel olarak anlamlı bir azalma sağlamıştır (bkz. Tablo 6 ve Şekil 6).
Tablo 6 RECORD-1 – Progresyonsuz sağkalım sonuçları
Popülasyon | n | AFINITOR n=277 | Plasebo n=139 | Tehlike oranı (%95 GA) | p-değeri |
|
| Medyan progresyonsuz sağkalım (ay) (%95 GA) |
|
| |
Primer analiz | |||||
Hepsi (bağımsız kör | 416 | 4,9 | 1,9 | 0,33 | <0,0001 |
merkezi |
| (4-5,5) | (1,8-1,9) | (0,25-0,43) |
|
değerlendirme) |
|
|
|
|
|
Destekleyici/hassas analizler | |||||
Hepsi (araştırmacı | 416 | 5,5 | 1,9 | 0,32 | <0,0001 |
tarafından yerel |
| (4,6-5,8) | (1,8-2,2) | (0,25-0,41) |
|
değerlendirme) |
|
|
|
|
|
MSKCC prognostik skoru (bağımsız kör merkezi değerlendirme) | |||||
İyi risk | 120 | 5,8 | 1,9 | 0,31 | <0,0001 |
|
| (4-7,4) | (1,9-2,8) | (0,19-0,5) |
|
Orta risk | 235 | 4,5 | 1,8 | 0,32 | <0,0001 |
|
| (3,8-5,5) | (1,8-1,9) | (0,22-0,44) |
|
Kötü risk | 61 | 3,6 | 1,8 | 0,44 | 0,007 |
|
| (1,9-4,6) | (1,8-3,6) | (0,22-0,85) |
|
Şekil 6 RECORD 1 – Kaplan-Meier progresyonsuz sağkalım eğrileri (bağımsız merkezi inceleme)
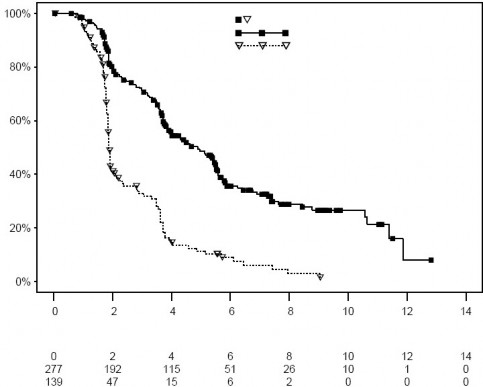
Altı aylık PFS plasebo ile %9'a kıyasla AFINITOR ile %36'dır.
AFINITOR hastalarının 5'inde (%2) doğrulanmış objektif tümör yanıtları gözlenmiş; plaseboda hiçbirisinde bu gözlenmemiştir. Bu nedenle ilerlemenin olmadığı sağkalım avantajı temelde, hastalık stabilizasyonu olan popülasyonu temsil etmektedir (AFINITOR ile tedavi edilenlerin %67'sine tekabül eder).
Genel sağkalım açısından tedaviyle ilişkili istatistiksel olarak anlamlı farklılık bildirilmemiştir (risk oranı 0,87; güven aralığı: 0,65 – 1,17; p = 0,177). Plaseboya randomize edilen hastaların hastalık progresyonu nedeniyle açık etiketli AFINITOR'a çapraz geçiş yapması, genel sağkalım açısından tedaviyle ilişkili farklılığın tespit edilmesi konusunda karışıklığa neden olmuştur.
Diğer çalışmalar
Stomatit, AFINITOR ile tedavi edilen hastalarda en sık bildirilen advers reaksiyondur (bkz. Bölüm Özel kullanım uyarıları ve önlemleri ve Bölüm İstenmeyen etkiler). Postmenopozal meme kanseri kadınlarda (N=92) yapılan pazarlama sonrası tek kollu bir çalışmada, stomatit insidansını ve ciddiyetini azaltmak için, deksametazon 0,5mg/5ml alkolsüz oral solüsyonü ile topikal tedavi, gargara olarak (tedavinin ilk 8 haftasında günde 4 kez) AFINITOR (everolimus, 10mg/gün) artı eksemestan (25mg/gün) ile tedavi edilen hastalara uygulanmıştır. 8. haftada derece ≥2 stomatit insidansı %2,4'tür (n=2/85 değerlendirilebilir hasta) ve bu rakam geçmişte bildirilenlerden daha düşüktür. Derece 1 stomatit insidansı %18,8'dir (n=16/85) ve derece 3 veya 4 stomatit vakası bildirilmemiştir. Bu çalışmadaki genel güvenlilik profili, hastaların %2,2'sinde (n=2/92) rapor edilen oral kandidiyazın hafifçe artan sıklığı dışında, onkoloji ve TSC düzleminde everolimus için belirlenen güvenlilik profili ile tutarlıdır.
Pediatrik popülasyon
Avrupa İlaç Ajansı, pankreas kaynaklı nöroendokrin tümörlerde, torasik nöroendokrin tümörlerde ve renal hücreli karsinomda pediatrik popülasyonun tüm alt gruplarında AFINITOR ile yapılan çalışmaların sonuçlarını sunma zorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bkz. Bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özelliklerEverolimus, doğal ürün rapamisinden kimyasal modifikasyonla türetilen bir makrolitik laktondur. Everolimusun farmakokinetik özellikleri aşağıda ayrıntılı olarak belirtilmektedir:
Emilim:
İlerlemiş solid tümorlü hastalarda AFINITOR alımından sonra doruk everolimus konsantrasyonlarına (C) açlık durumunda ya da hafif, yağ içermeyen bir öğün ile birlikte, günlük 5 ve 10 mg everolimus uygulamasından sonra 1 saatte ulaşılır. C, 5 ve 10 mg'lık günlük dozlamada dozla orantılıdır. Everolimus bir PgP substratı ve orta derecede potent inhibitörüdür.
Besinlerin etkisi:
Sağlıklı gönüllülerde yüksek yağlı öğünler AFINITOR 10 mg'a sistemik maruziyeti (EAA ile ölçülen) %22 oranında ve doruk plazma konsantrasyonu Cdeğerini %54 oranında azaltmıştır. Düşük yağlı öğünler EAA'yi %32 ve Cdeğerini %42 azaltmıştır. Ancak besinler emilim sonrası faz konsantrasyonu-zaman profili üzerinde belirgin bir etkiye sahip olmamıştır.
Dağılım:
5 ila 5000 ng/mL aralığında konsantrasyona bağlı olan everolimusun kan-plazma oranı %17 ile %73 arasındadır. 10 mg/gün AFINITOR verilen kanser hastalarında, plazmada bulunan everolimus oranı, kan konsantrasyonunun yaklaşık %20'si olmuştur. Plazma proteinine bağlanma oranı sağlıklı gönüllülerde ve orta şiddette karaciğer yetmezliği olanlarda yaklaşık
%74'tür. İlerlemiş solid tümörleri olan hastalarda dağılım hacmi (Vd), sanal merkezi kompartıman için 191L ve sanal periferik kompartıman için 517L olarak saptanmıştır.
Biyotransformasyon:
Everolimus bir CYP3A4 ve PgP substratıdır. Oral uygulamayı takiben, everolimus insan dolaşımındaki temel bileşen olmaktadır. İnsanlarda altı temel metabolit belirlenmiştir; bunlar üç tane monohidroksile metabolit, iki hidrolitik açık halkalı ürün ve everolimusun fosfatidilkolin konjugatıdır. Bu metabolitler toksisite çalışmalarında kullanılan hayvan türlerinde de tanımlanmıştır ve aktiviteleri, ana bileşenden 100 kat daha düşüktür. Bu nedenle, everolimusun genel farmakolojik aktivitesine en büyük katkıyı ana ilacın yaptığı düşünülmektedir.
Eliminasyon:
Everolimusun ilerlemiş solid tümörleri olan hastalardaki 10 mg'lık günlük dozundan sonraki ortalama Kl/F (oral klerens) değeri 24,5 L/saattir. Everolimusun ortalama eliminasyon yarılanma ömrü yaklaşık olarak 30 saattir.
Kanser hastalarında spesifik atılım çalışmaları gerçekleştirilmemiştir; organ nakli ile ilgili yapılan çalışmalardan elde edilen veriler mevcuttur. Siklosporin ile birlikte tek doz radyoaktif işaretli everolimus uygulamasını takiben, radyoaktivitenin %80'i dışkı ile %5'i idrar ile atılmıştır. Ana ilaç dışkı ya da idrarda belirlenmemiştir.
Kararlı durum farmakokinetiği:
İlerlemiş solid tümörleri olan hastalarda everolimus uygulamasından sonra, kararlı durum EAAdeğeri, günlük uygulama için 5-10 mg doz aralığında olmuştur. Kararlı durum koşullarına, günlük doz rejimi ile 2 haftada ulaşılmaktadır. C5 ve 10 mg arasında dozla orantılıdır. tdeğerine doz uygulamasından 1 ila 2 saat sonra ulaşılmıştır. Kararlı durumda EAAve doz öncesi çukur konsantrasyon arasında anlamlı bir korelasyon gözlenmiştir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği olan hastalar: Everolimusun güvenliliği, tolere edilebilirliği ve farmakokinetiği, AFINITOR tabletlerin iki ayrı tek oral doz çalışmasında, karaciğer fonksiyonu normal olan gönüllülere kıyasla karaciğer fonksiyon bozukluğu olan 8 ve 34 gönüllüde değerlendirilmiştir.
İlk çalışmada, orta derecede karaciğer yetmezliği (Child-Pugh B) olan 8 gönüllüde everolimusun ortalama EAA'sı, normal karaciğer fonksiyonuna sahip 8 gönüllüde bulunanın iki katı olmuştur.
Normal gönüllülere kıyasla farklı şiddetlerde karaciğer fonksiyon bozukluğu olan 34 gönüllüden oluşan ikinci çalışmada, hafif (Child-Pugh A), orta (Child-Pugh B) ve şiddetli (Child-Pugh C) karaciğer yetmezliği olan gönüllülerde maruziyette (yani EAA) sırasıyla 1,6 kat, 3,3 kat ve 3,6 kat artış olmuştur.
Çoklu doz farmakokinetiği simülasyonları, karaciğer yetmezliği olan hastalarda Child-Pugh durumlarına dayalı doz önerilerini desteklemektedir.
İki çalışmanın sonuçlarına dayanarak, karaciğer yetmezliği olan hastalarda doz ayarlaması önerilmektedir (bkz. Bölüm 4.2 ve 4.4).
Böbrek yetmezliği olan hastalar: İlerlemiş kanseri olan 170 hasta üzerinde gerçekleştirilen bir popülasyon farmakokinetiği çalışmasında, kreatinin klerensinin (25 - 178 mL/dak) everolimusun oral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir. Nakil sonrası böbrek yetmezliği (kreatinin klerensi aralık 11 - 107 mL/dak) nakil hastalarında everolimusun farmakokinetiğini etkilememiştir.
Pediyatrik hastalar: Pediatrik kanser popülasyonunda AFINITOR kullanılması ile ilgili bir endikasyon yoktur (bkz. Bölüm 4.2).
Yaşlı hastalar: Kanser hastaları üzerinde yapılan bir popülasyon farmakokinetiği değerlendirmesinde, yaşın (27 ila 85) everolimusun oral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir.
Irk: Benzer karaciğer fonksiyonlarına sahip Japon ve Batılı kanser hastalarında oral klerens değerleri benzer olmuştur. Popülasyon farmakokinetiği analizlerine dayalı olarak, siyah ırktan transplantasyon hastalarında oral klerens değerinin ortalama %20 daha yüksek olduğu görülmüştür.
5.3. Klinik öncesi güvenlilik verileri
Everolimusun klinik öncesi güvenlilik profili sıçanlarda, farelerde, mini-domuzlarda, maymunlarda ve tavşanlarda değerlendirilmiştir. Temel hedef organlar şunlardır: Birçok türde erkek ve dişi üreme sistemleri (testiküler tübüler bozulma, epididimiste sperm içeriğinin azalması ve uterus atrofisi), sıçanlarda ve farelerde akciğerler (alveolar makrofajlarda artış), maymun ve mini-domuzlarda pankreas (ekzokrin hücresinin sırasıyla degranülasyon ve vaküolasyonu ve maymunda adacık hücrelerinin dejenerasyonu), yalnızca sıçanlarda gözler (lentiküler ön sütür çizgisi opasiteleri). Sıçanların (tübüler epitelde yaşa bağlı lipofusin artışı ve hidronefrozda artışlar) ve farelerin (altta yatan lezyonların alevlenmesi) böbreklerinde küçük
değişiklikler gözlenmiştir. Maymunlarda veya mini-domuzlarda, böbrek toksisitesine rastlanmamıştır.
Arka plandaki hastalıkların (sıçanlarda kronik miyokardit, maymunların plazmasında ve kalbinde coxsackie virüs infeksiyonu, mini-domuzların gastrointestinal kanalında koksidiyozis, farelerde ve maymunlarda deri lezyonları), everolimus tedavisiyle alevlendiği gözlenmiştir. Bu bulgular genellikle terapötik maruziyet aralığının içindeki ya da üstündeki sistemik maruziyet düzeylerinde gözlenmiştir; buna tek istisna, yüksek doku dağılımının gözlendiği sıçanlardır; sıçanlarda bu durum terapötik maruziyet aralığının altında bir düzeyde meydana gelmiştir.
Erkek sıçanlarda yapılan bir fertilite çalışmasında, 0,5 mg/kg ve daha yüksek everolimus dozları testis morfolojisinde değişikliğe neden olmuş, 5 mg/kg everolimus, sperm motilitesini, sperm sayısını ve plazma testosteron düzeylerini azaltarak erkek fertilitesinde azalmaya yol açmıştır. Bu etkinin geri dönüşümlü olduğu yolunda kanıtlar bulunmuştur.
Hayvan üreme çalışmalarında dişi fertilitesi etkilenmemiştir. Ancak dişi sıçanlarda ≥0,1 mg/kg düzeyinde oral everolimus dozları (günde 10 mg'lık dozu alan hastalarda EAAdüzeyinin yaklaşık %4'ü) implantasyon öncesindeki kaybın artmasıyla sonuçlanmıştır.
Everolimus, plasentadan geçerek fötusta toksik etki göstermiştir. Everolimus sıçanlarda, terapötik düzeyin altındaki sistemik maruziyet düzeylerinde, embriyo/ fetotoksisiteye neden olmuştur. Bu mortalite olarak belirtilmektedir ve fetal ağırlığı düşürmektedir. 0,3-0,9 mg/kg arasındaki dozlarda iskelet değişikliklerinin ve malformasyonların (örneğin sternal yarık) insidansı artmıştır. Tavşanlarda geç dönem emilimin artmasına bağlı olarak embriyotoksisite kaçınılmaz olmuştur.
İlgili genotoksisite sonlanım noktalarını kapsayan genotoksisite çalışmaları, klastojenik veya mutajenik aktiviteye dair herhangi bir kanıt göstermemiştir. Everolimusun 2 yıla kadar uygulanması, farelerde ve sıçanlarda, tahmini klinik maruziyetin sırasıyla 3,9 ve 0,2 katına karşılık gelen en yüksek dozlara kadar herhangi bir onkojenik potansiyel göstermemiştir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A12544 |
| Satış Fiyatı | 19573.39 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 19573.39 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504011456 |
| Etkin Madde | Everolimus |
| ATC Kodu | L01EG02 |
| Birim Miktar | 5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |