AIMAFIX-D 500 IU 1 flakon Kullanma Talimatı
{ Anti Hemofilik Faktor Ix }
Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > İnsan Faktör IX Konsantresi Onko Koçsel İlaç San. Tic. A.ş | Güncelleme : 30 December 1899AIMAFIX 500 IU/ 10 mL IV infüzyon için liyofilize toz içeren flakon Steril, apirojen
Damar içine (intravenöz) uygulanır.
Etken Madde
500 IU İnsan plazma kaynaklı yüksek saflıkta pıhtılaşma Faktör IX Yardımcı madde(ler) :Sodyum klorür, sodyum sitrat, glisin, heparin sodyum (domuz bağırsak mukozası), antitrombin III, enjeksiyonluk su.Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz.
• Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız.
• Bu ilaç kişisel olarak sizin için reçete edilmiştir, başkalarına vermeyiniz.
• Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde doktorunuza bu ilacı kullandığınızı söyleyiniz.
• Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışında yüksek veya düşük doz kullanmayınız.
Bu Kullanma Talimatında:
1. AIMAFIX-D nedir ve ne için kullanılır?
2. AIMAFIX-D’i kullanmadan önce dikkat edilmesi gerekenler
3. AIMAFIX-D nasıl kullanılır?
4. Olası yan etkiler nelerdir?
5. AIMAFIX-D’in saklanması
Başlıkları yer almaktadır.
2.AIMAFIX-D nedir ve ne için kullanılır?
• AIMAFIX, kanamayı önleyici/durdurucu etkisi (antihemorajik) sınıfa dahil insan kanından elde edilmiş Faktör IX içeren bir üründür.
• AIMAFIX, toz içeren kauçuk tip I elastomer tıpa ile beraber tip I cam flakon; çözücü içeren tip I elastomer tıpa ile beraber tip I cam flakon; rekonstitüsyon (sulandırma) için pirojenik olmayan, steril, tıbbi cihaz (mix2vial), enjeksiyon için şırınga ve PVC tüp ile beraber kelebek iğnesi içermektedir.
• AIMAFIX, Hemofili B (Konjenital Faktör IX yetmezliği), Edinilmiş Faktör IX yetmezliğinde, kanamanın tedavisi veya korunmasında (profılaksisinde) kullanılır.
2.AIMAFIX-D kullanmadan önce dikkat edilmesi gerekenler
AIMAFIX-D'i aşağıdaki durumlarda KULLANMAYINIZ
AIMAFIX-D'i aşağıdaki durumlarda DİKKATLİ KULLANINIZ
Eğer;
• Herhangi bir damar içi (intravenöz) protein ürününe karşı alerjik türde aşırı duyarlılığınız varsa,
• Daha önce alerjik reaksiyon geçirdiyşeniz.
AIMAFIX, faktör IX haricinde eser miktarda insan proteinleri içerir.
Eğer bu ilacın uygulanması sırasında aşağıda listelenen semptomlardan herhangi birini fark ederseniz, ilacın kullanımını derhal kesiniz ve doktorunuzla iletişime geçiniz. Busemptımlar bir alerjik reaksiyonun erken belirtileri olabilir.
Aşağıdaki semptomlar meydana gelebilir:
• Kurdeşen,
• Tüm vücutta döküntü ( generalize ürtiker),
• Göğüste sıkışma hissi,
• Hırıltılı solunum,
• Hipotansiyon (kan basıncında düşüklük).
Şok durumunda, doktorunuz şok için standart medikal tedaviyi uygulayacaktır.
Eğer heparine bağlı olarak geçirilmiş bir alerjik reaksiyon hikayeniz varsa, heparin içeren ürünlerin kullanımından kaçınmalısınız.
İnsan plazma koagülasyon Faktör IX ürünleri ile tekrarlanan tedavilerden sonra, nötralize edici antikorlar (inhibitörler) gelişmesi ihtimaline karşı hastaların takibi yapılmalıdır.
Literatürde, faktör IX’u nötralize eden antikorların (inhibitörler) oluşumu ile alerjik reaksiyonlar arasında bir ilişki olduğunu gösteren raporlar yer almaktadır. Bu nedenle, aleıjik reaksiyon yaşayan hastalar bir inhibitör bulundurmaları açısından değerlendirilmelidir. Faktör IX inhibitörleri olan hastaların, daha sonra faktör IX’a karşı oluşabilecek anafılaksiler (şiddetli ve hızlı aleıjik reaksiyon) açısından artmış bir risk altında olabileceği göz önünde bulundurulmalıdır.
Faktör IX ürünlerine karşı gelişebilecek alerjik reaksiyon riski nedeniyle, faktör IX’un ilk uygulaması, tedaviyi uygulayan hekimin değerlendirmesine göre, alerjik reaksiyonlara karşı uygun bir tıbbi bakımın sunulabileceği bir yerde, tıbbi gözetim altında gerçekleştirilmelidir.
Tromboembolizm
Faktör IX konsantrelerinin kullanımı, geçmişte tromboembolik komplikasyonların (kan pıhtılarının anormal üretimine bağlı komplikasyonlar) gelişimi ile ilişkili bulunmuştur. Ddüşük saflıktaki preparatlarda bu risk daha yüksek olmuştur. Bu nedenle, Faktör IX içeren ürünlerin kullanımı, yaygın damar içi pıhtılaşmak (edinilmiş trombohemorajik sendrom) hastalar ve fıbrinoliz ( fibrin pıhtılarının kanamaya sebep olabilecek şekilde anormal çözünmesi) belirtileri olan hastalarda potansiyel olarak riskli olabilir. Potansiyel trombotik komplikasyon riski sebebiyle, karaciğer hastalığı olan hastalara, ameliyat sonrası hastalara ya da trombotik fenomen ya da yaygın damar içi pıhtılaşması riski olan hastalara uygulandığında, trombotik ve tüketim (konsumptif) koagülapatisinin erken belirtileri için klinik takibi uygun biyolojik testlerle yapılmalıdır. Bu durumların her birinde, AIMAFIX ile tedavinin yararı bu komplikasyonların riskine karşı değerlendirilmelidir.
Pedivatrik popülasvon
Mevcut veriler AIMAFIX’in 6 yaşından küçük çocuklarda kullanımının önerilmesi için yeterli değildir. Bu bölümde listelenen kullanım oyanları ve önlemler hem yetişkin hem de pediyatrik popülasyon için geçerlidir.
Bu uyanlar geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız.
AIMAFIX-D'in yiyecek ve içecek ile kullanılması
AEMAFIX uygulanmaları aç veya tok karnına yapılabilir.
Hamilelik
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX enjeksiyonu hamilelik döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınız.
Emzirme
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX, emzirme döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Araç ve makina kullanımı
AIM AFIX’in araç ve makine kullanımına hiçbir etkisi gözlenmemiştir.
AIMAFIX-D'in içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgiler
AIMAFIX 1,8 mmol (41 mg) sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
AIMAFIX, 100 IU’ya kadar heparin sodyum içermektedir. Alerjik reaksiyonlara ve kanın pıhtılaşma sistemini etkileyebilecek olan kan hücre sayısında düşmelere neden olabilir. Geçmişinde heparinle indüklenmiş alerjik reaksiyonu olan hastaların heparin ihtiva eden ilaçlan kullanmaktan kaçınmalan gerekir.
Diğer ilaçlar ile birlikte kullanımı
İnsan plazma koagülasyon Faktör IX konsantratının diğer ilaçlarla herhangi bir etkileşimi bugüne kadar bilinmemektedir. Ancak AIMAFIX diğer ilaçlarla kanştınlmamalıdır.
3.AIMAFIX-D nasıl kullanılır ?
Bu ilacı tam olarak doktorunuzun söylediği şekilde kullanınız. Emin değilseniz, doktorunuza veya eczacınıza danışınız.
Eğer ilacı kendi kendinize uygulayacaksanız, AIMAFIX’i her zaman tam olarak "Uygun kullanım için talimatlar" bölümünde yer alan talimatlara uygun olarak kullanınız.
İnsan plazma koagülasyon faktör IX, bazı infüzyon ekipmanlarının iç yüzeylerine adsorbe olabileceğinden sonuç olarak tedavi başarısızlığı meydana gelebilir, bu nedenle yalnızca ambalajın içinden çıkan enjeksiyon/infüzyon setlerini kullanınız.
Şüpheleriniz varsa doktorunuza danışınız.
Tedavi, hemofili tedavisi konusunda deneyimli bir doktorun gözetimi altında başlatılmalıdır.
Doktorunuz faktör IX yetmezliğinizin şiddetine, kanamanın yeri ve miktarına ve klinik durumunuza bağlı olarak tedaviniz için uygun dozu ve tedavi süresini belirleyecektir. Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre yönlendirilmelidir.
Faktör IX ürünlerinin nadiren günde birden fazla uygulanması gerekir.
Tedavi süresince, uygulanacak doz ve tekrarlanan infüzyonların sıklığına yol göstermesi için, Faktör IX seviyelerinin uygun bir şekilde belirlenmesi önerilir. Özellikle majör ameliyat durumlarında, koagülasyon analizi (plazma Faktör IX aktivitesi) yoluyla yerine koyma tedavisinin titizlikle takibi gereklidir.
Farklı in vivo geri kazanım seviyeleri ve farklı yarılanma zamanı göstermeleri nedeniyle her bir hastanın faktör IX’a karşı cevabı değişebilir.
Bu kullanma talimatının sonunda sağlık personeline yönelik hazırlanmış olan bölümde dozaj
ve tedavi süresine ilişkin daha fazla bilgi yer almaktadır.
Kanama Profılaksisi
Şiddetli Hemofili B hastalarında kanamaya karşı uzun dönem profılaksi (korunma) için, alışılmış dozlar 3-4 günlük aralıklarla vücut ağırlığının kg başına 20-40 IU Faktör IX’dur. Bazı vakalarda, özellikle genç hastalarda, daha kısa doz aralıkları ya da daha yüksek dozlar gerekebilir.
Hastaların izlenmesi
Hastalar Faktör IX inhibitörlerinin gelişimi açısından takip edilmelidir. Eğer beklenen Faktör IX aktivite plazma seviyelerine ulaşılamazsa, ya da kanama uygun bir doz ile kontrol edilemezse, Faktör IX inhibitörü olup olmadığı bir tahlil yapılarak belirlenmelidir. Yüksek seviyelerde inhibitörlü hastalarda Faktör IX tedavisi etkili olmayabilir ve diğer terapötik seçenekler dikkate alınmalıdır. Bu gibi hastaların tedavisi hemofili hastaların tedavisi konusunda uzman kişiler tarafından yapılmalıdır.
Uygulama yolu ve metodu
İntravenöz (damar içi) kullanım içindir.
Damar içine (intravenöz) yavaş olarak enjekte edilir ya da infüzyonla verilir.
Vücut ağırlığına göre günde 100 IU/kg’dan daha fazla doz uygulanması tavsiye edilmez. İnfüzyon hızı her hastaya göre bireysel olarak değerlendirilmelidir.
Uygun kullanım için talimatlar
Tozun çözücü ile rekonstitüe edilmesi (sulandırılması)
1. Toz halde etken madde içeren flakon ve çözücü flakonu oda sıcaklığına getiriniz;
2. Bu sıcaklık, tüm rekonstitüsyon (sulandırma) işlemi süresince ( maksimum 10 dakika) korunmalıdır;
3. Toz etken madde içeren flakon ve çözücü flakonun koruyucu kaplarını çıkarınız;
4. İki flakon tıpasının yüzeyini alkol ile temizleyiniz;
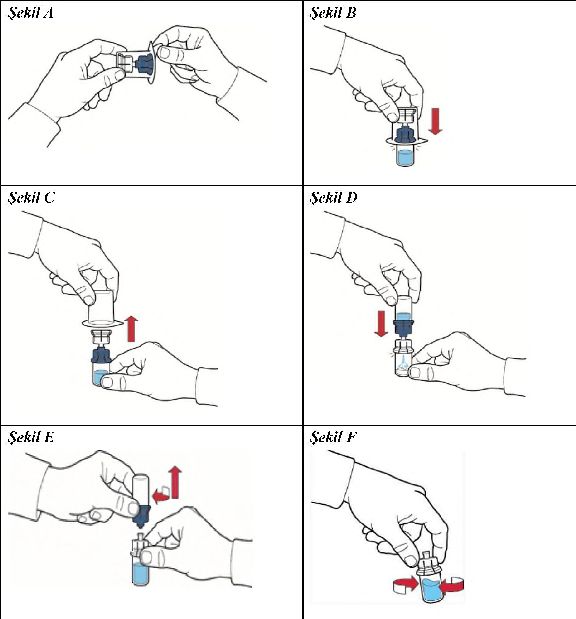
5. Üst başlığı sıyırarak aparatın ambalajını açınız; iç kısma dokunmamaya dikkat ediniz (Şekil A);
6. Aparatı ambalajından çıkarmayınız;
7. Aparat kutusunu baş aşağı çeviriniz ve çözücü flakon tıpasına doğru plastik sivri ucu yerleştiriniz, böylece aparatın mavi kısmı çözücü flakona bağlanmış olur ( Şekil B);
8. Aparat kutusunun kenarını tutunuz ve aparata dokunmadan dışarı çıkarınız ( Şekil C);
9. Toz flakonun güvenli bir yüzeye yerleştirildiğinden emin olunuz, sistemi baş aşağı çeviriniz böylece çözücü flakon aparatın üstünde olur; toz flakon tıpasının üzerindeki şeffaf adaptöre bastırınız, böylece plastik sivri uç toz flakon tıpanın içinden geçer; çözücü, toz flakonun içine otomatik olarak çekilecektir ( Şekil D);
10. Çözücünün transferinden sonra, transfer sisteminde çözücü flakonunun bağlı olduğu mavi kısmı gevşetiniz ve çıkarınız ( Şekil E);
11. Toz etkin madde tamamen çözününceye kadar flakonu yavaşça çalkalayınız. Köpürmeyi önlemek amacıyla, flakonu kuvvetlice çalkalamayınız (Şekil F);
Tozun tam em en çözündüğünden emin olunuz, aksi taktirde ürünün akti vitesinde kayıp olacaktır.
Çözeltinin uygulanması
Uygulamadan önce, rekonstitüe edilmiş (sulandırılmış) ürün partikül olup olmadığı ve renk değişimini saptamak için, görsel olarak incelenmelidir. Çözelti berrak ve hafif opelesan olmalıdır. Bulanık veya tortulu çözeltileri kullanmayınız.
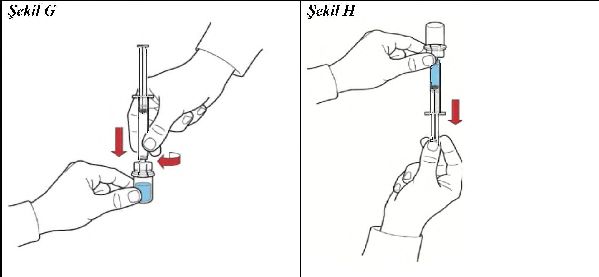
1. Şırıngayı hava ile doldurunuz, pistonu geri çekiniz, aparata tutturunuz ve havayı rekonstitüe edilmiş (sulandırılmış) çözeltiyi içeren toz flakonun içine enjekte ediniz (Şekil G);
2. Pistonu bırakınız, sistemi baş aşağı çeviriniz böylece, rekonstitüe edilmiş (sulandırılmış) çözeltiyi içeren toz flakon aparatın üstünde olacaktır ve piston yavaşça geri çekerek konsantreyi şırınganın içine çekiniz (Şekil H);
3. Şırıngayı saat yönünün tersine çevirerek ayırınız;
4. Şırınganın içindeki çözeltiyi görsel olarak inceleyiniz, partikülsüz, berrak veya hafif opelesan olmalıdır;
5. Kelebek iğnesini şırıngaya takınız ve intravenöz olarak infüzyon veya yavaşça enjeksiyon yoluyla uygulayınız.
Flakonlar bir kere açıldıktan sonra, içerik derhal kullanılmalıdır.
Rekonstitüe edilmiş (sulandırılmış) ve şırınganın içine transfer edilmiş çözelti derhal kullanılmalıdır.
Flakon içeriği tek bir uygulama içindir.
Etikette yer alan son kullanma tarihinden sonra bu ürünü kullanmayınız.
Kullanılmayan ürün veya atık materyal yerel şartlara uygun olarak imha edilmelidir.
Tüm kullanılmayan ürün ve atık maddeler "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri” ne uygun olarak imha edilmelidir.
Değişik yaş grupları
Çocuklarda kullanımı
6 yaşından küçük çocuklarda AEVLAFIK’in güvenlilik ve etkililiğine ilişkin yeterli veri yoktur.
Yaşlılarda kullanımı
Yaşlı popülasyonda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Özel kullanım durumları
Böbrek/ Karaciğer yetmezliği:
Böbrek/karaciğer yetmezliği olan hastalarda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Eğer AIMAFIX’irı etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.
Kullanmanız gerekenden daha fazla AIMAFIX-D kullanırsanız
İnsan plazma koagülasyon faktör IX’un aşırı dozda kullanımına ilişkin semptomlar raporlanmamıştır.
AIM AFIX’in kullanımına ilişkin bir şüpheniz varsa dpktorunuza veya eczacınıza danışınız. AIMAFIX’den kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.
AIMAFIX-D'i kullanmayı unuttuysanız
Unutulan dozları dengelemek için çift doz almayınız.
AIMAFIX-D ile tedavi sonlandırıldığında oluşabilecek etkiler
 Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
 Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AIMAFIX-D | 8699650982006 | |
| ALPROLIX | 8683125910090 | 27,790.76TL |
| BENEFIX | 8681308274465 | 19,686.75TL |
| BERININ-P | 8681624980033 | |
| BETAFACT | 8699538983620 | |
| HAEMONINE | 8682109319898 | |
| IMMUNINE | 8699556981011 | |
| NONAFACT | 8699823980082 | |
| OCTANINE | 8699686980151 | 18,957.44TL |
| REBLENINE | 8699743980049 | |
| Diğer Eşdeğer İlaçlar |
 Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
 Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
 Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
İLAÇ GENEL BİLGİLERİ
Onko Koçsel İlaç San. Tic. A.ş
| Geri Ödeme Kodu | A00437 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8699650982006 |
| Etkin Madde | Anti Hemofilik Faktor Ix |
| ATC Kodu | B02BD04 |
| Birim Miktar | 500 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > İnsan Faktör IX Konsantresi |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |