AIRPLUS 25/250 mcg inhilasyon için ölçülü dozlu aerosol 120 doz { Neutec Toplam Kalite } Kısa Ürün Bilgisi
{ Flutikazon + Salmeterol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AİRPLUS 25/250 mcg inhalasyon için aerosol2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin maddeler:
Salmeterol ksinafoat t>6,25 mcg
Flutikazon propiyonat 250,00 mcg
25 mcg Salmeterol’e eşdeğer
Yardımcı maddeler için 6.1.’e bakınız.
Yardımcı maddeler için 6.1.’e bakınız.
3. FARMASÖTİK FORMU
İnhalasyon için aerosol.
Alüminyum inhaler kab, içinde basmçl, propellant gaz ile doldurulmuş homojen süspansiyon. Alüminyum konteynere bir dozajlama valf eklidir.
4.1. Terapötik endikasyonlar
Ası,m semptomlar,nm düzeltilmesi ve kontrol altma ahnmas, amae.yla kullaml.r Ast,m
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
AİRPLUS sadece inhalasyon yolu ile uygulanır.
Hastalara semptomların görülmediği zamanlar da dahil olmak üzere, AİRPLUS’.n optimum yarar sağlamak üzere günlük olarak kullanılması gerektiği yönünde bilgi verilmelidir.
Hastalar düzenli olarak bir doktor taraf,ndan değerlendirilmeli, ald.klar, AİRPLUS dozunun optimum düzeyde kalması sağlanmalı ve doz sadeee doktor önerisi ile değiştirilmelidir.
Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde iki kez uygulanan
en düşük kombinasyon dozajıyla semptomların kontrolü sağlandığında, bir sonraki adımda inhale kortıkosteroidin tek başına kullanımı test edilmelidir.
Alternatif olarak, uzun sura etkili beta2 agonistlerinin kullan,Imas, gereken hastalar, reçete eden
hekimin görüşüne göre hastalık kontrolünü sağlamakta yeterli olacağı düşünülüyorsa, günde bir
kez AİRPLUS alacak şekilde de titre edilebilirler. Hastada gece görülen semptom öyküsü varsa
ve günde bir kez dozlama uygulanıyorsa, doz geceleri verilmeli; hastada genellikle gündüz görülen semptom öyküsü varsa, doz sabahları verilmelidir.
Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren AİRPLUS verilmelidir.
Not: AİRPLUS 25 mikrogram/50 mikrogram dozu şiddetli astımı olan erişkinlerde ve çocuklarda kullanıma uygun değildir. Reçete eden hekim, ast,mİ, hastalarda flutikazon propiyonat,n mikrogram emsinden günlük dozun yaklaşık yansı kadar dozda diğer inhale steroidler kadar etkin olduğunun bilincinde olmalıdırlar, örneğin, 100 mikrogram flutikazon propiyonat yaklaşık 200 mikrogram beklometazon dipropiyonata (CFC içeren) veya budesonide eşdeğerdir. Bireysel olarak bir hastada önerilen rejimin dışında dozajların gerekmesi durumunda, uygun beta agonisti ve/veya kortikosteroid dozları reçete edilmelidir.
Tavsiye edilen dozlar:
Astım
Erişkinler ve 12 yaş ve üstündeki adolesanlar:
Günde ıkı kez ıkı inhalasyon halinde 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonat.
Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 125 mikrogram flutikazon propiyonat.
Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat.
Astımın hızlı şekilde kontrol edilmesi gereken, orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve orta ila şiddetli hava yolu sınırlamasına göre tanımlanır), kısa süreli bir AİRPLUS denemesi başlangıç tedavisi olarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez iki inhalasyon olarak 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonattır. Astım kontrolü sağlandığında, tedavi tekrar gözden geçirilmeli ve hastaların tek başına inhale kortikosteroid alacak şekilde dozlarının azaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenli olarak incelenmesi önemlidir.
Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhale ^ kortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devam etmektedir. AİRPLUS ın hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. AİRPLUS 25 mikrogram/50 mikrogram dozları, şiddetli astım, olan çocuklarda ve erişkinlerde kullanıma uygun değildir; şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önce uygun inhale kortikosteroid dozunun gösterilmesi önemlidir.
Kronik Obstrüktif Akciğer Hastalığı (KOAH)
Yetişkinler
Yetişkin hastalar için tavsiye edilen doz günde 2 kez 2 inhalasyon 25/125 mikrogram - 25/250 mikrogram salmeterol/flutikazon propiyonattır. Günde iki kez alman toplam 50/500 mıkrogramlık maksimum salmeterol/flutikazon kombinasyon dozunun tüm nedenlere bağlı ölümleri azalttığı gösterilmiştir (Bkz. 5.1 Klinik Çalışmalar).
Kullanımı:
Hastalara inhalasyon için aerosolü nasıl kullanacakları ve bakımını nasıl yapacaklar, konusunda
bilgi verilmeli ve inhale ilacın akciğerlere optimum dağıtımını sağlamak üzere kullanım
tekniklen kontrol edilmelidir. Hasta inhalasyon için aerosolü kullanmada sıkıntı yaşarsa, bir
spacer cıhaz, kullanabilir. Spacer cihazlarının değiştirilmesi akciğerlere giden doz miktarında
değişiklik meydana getirebileceğinden, hastalar ayn, tip spacer cihazını kullanmaya devam etmelidirler.
Bir spacer cihaz, kullanılmaya başlandığında veya cihaz değiştirildiğinde daima tekrar en düşük doz titrasyonu gerçekleştirilmelidir.
Uygulama şekli:
AİRPLUS, sadece inhalasyon yolu ile uygulanır.
Inhalasyon için aerosolün doğra kullan,m, doktor veya eczacı taraf,ndan hastaya gösterilmelidir.
inhalasyon sıras.nda hastalar tercihen oturmalı veya ayakta durmalıdır, inhalasyon için aerosol dik konumda kullanım için tasarlanmıştır.
Olas, bir kandida enfeksiyonu riskini azaltmak için her uygulamadan sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir. Aynca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir.
Kullanıma ilişkin detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon için aerosolün doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz.
İnhalasyon için aerosolün kullanım talimatı
İnhalasyon için aerosolün test edilmesi:
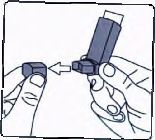
ilk kez kullanımdan önce hastalar ağızlık kapağım, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon için aerosolü iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon için aerosolün tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır, inhalasyon için aerosol her sıkımdan önce sallanmalıdır.
İnhalasyon için aerosol bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı ve inhalasyon için aerosol ile boşluğa iki kez sıkım yapmalıdır.
İnhalasyon için aerosolü kullanacağınız zaman oturunuz veya ayakta dik durunuz.
1. İlk resimde gösterildiği gibi agrzhk kapagrm çrkanmz. Agrzhğrn remiz olduğundan emin olmak için içini ve dışını kontrol ediniz.
2. İnhalasyon için aerosolü her kullanımdan önce iyice çalkalayınız.
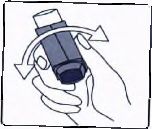
3. İnhalasyon için aerosolü baş parmağınız ağızlığın altında, inhalasyon için aerosolün tabanında olacak şekilde dik tutunuz.
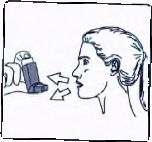
4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
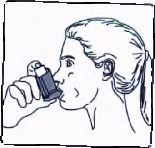
5. Ağzınızdan yavaş ve derin nefes alınız ve ayn, anda bir puf doz boşaltmak için inhalasyon için aerosolün üst kısmına basınız.
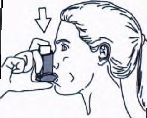
6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon için aerosolün üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.
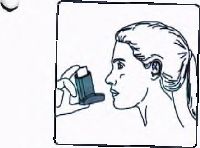
7. Her bir puf ilaç alımı arasında yaklaşık yanm dakika bekleyiniz ve sonra 2-6. basamakları
tekrarlayınız.
8. Daha sonra, ağzınızı su ile çalkalayınız ve tükürünüz. Bunu yapmanız ağzınızda pamukçuk oluşumunun ve ses kısıklığının önlenmesine yardımcı olmak için önemlidir.
9. Kullanımdan sonra tozdan korumak için ağızlığın kapağın, hemen kapatınız. Ağızhk kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız.
Hastalar 4, 5 ve 6. basamaklar, hızl, bir şekilde yapmamalıdır. Hastalann inhalasyon için aerosolü etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon için aerosolün üstünden veya ağızlarının yanından buhar geldiğini görürse, 2.
basamaktan itibaren uygulamaya tekrar başlamalıdırlar.
inhalasyon için aerosolün temizlenmesi
İnhalasyon için aeorolü haftada en az bir kez temizleyiniz.
1. Ağızlık kapağını çıkarınız.
2. Tüpü plastik gövdeden çıkarmayınız.
3. Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz.
4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda AİRPLUS kullanımına ilişkin bilgi yoktur.
Pediyatrik popülasyon:
4-12 yaş arasj çocuklarda:
Günde ıkı kez ıkı inhalasyon halinde 25 mikrogram salmeterol Ve 50 mikrogram flutikazon propiyonat.
Çocuklarda AİRPLUS inhalasyon için aerosol ile verilen maksimum onaylı flutikazon propiyonat dozu, günde iki kez 100 mikrogram’dır.
4 yaşından kuçuk çocuklarda AİRPLUS inhalasyon için aerosol kullanımına ilişkin veri yoktur.
Geriyatrik popülasyon:
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
- Astım tedavisinde normalde kademeli bir program izlenmeli ve hasta yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir.
- AİRPLUS hızlı ve kısa etkili bir bronkodilatörün gerektiği akut astım semptomlarının
tedavisinde kullanılmamalıdır. Hastalara her zaman bir akut astım atağ, durumunda
semptomların hafifletilmesinde kullanılmak üzere ilaçlarını yanlarında bulundurmalar, söylenmelidir.
- Hastalarda bir alevlenme sırasında veya anlamlı şekilde kötüleşen veya akut şekilde şiddetlenen astım hastalıkları varsa AİRPLUS tedavisi başlatılmamalıdır.
- AİRPLUS ile tedavi sırasında ciddi astım kaynaklı yan etkiler ve alevlenmeler meydana
gelebilir. AİRPLUS tedavisine başlandıktan sonra astım semptomları kontrol edilmezse veya
kötüleşirse hastalara tedaviye devam etmeleri, ancak doktorlarına danışmalar, gerektiği söylenmelidir.
- Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en k.sa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır.
- Astım semptomlarının hafifletilmesi için kısa etkili bronkodilatörlerin artan kullanım, ast.m kontrolünün kötüleştiğini göstermektedir ve hasta, bir hekim tarafından incelenmelidir..
- Astım kontrolündeki ani ve progresif bir kötüleşme potansiyel anlamda yaşamı tehdit edicidir
ve hastalar acil tıbbi yardım almalıdır. Kortikosteroid tedavisi dozunun arttırılması
düşünülmelidir. Hasta ayrıca mevcut AİRPLUS dozunun yeterli astım kontrolü
sağlayamadığı durumlarda tıbbi açıdan incelenmelidir. Ek kortikosteroid tedavilerinin kullanımı düşünülmelidir.
- Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır.
- Astım semptomlar, kontrol edildiğinde AİRPLUS dozunun kademeli şekilde azaltılması
düşünülmelidir. Tedavi dozu azaltılırken hastaların düzenli şekilde incelenmesi önemlidir.
AİRPLUS’m en düşük etkin dozu kullanılmalıdır. AİRPLUS ile tedavi aniden kesilmemelidir.
- Tüm inhale ilaç içeren kortikosteroidlerde olduğu gibi AİRPLUS, pulmoner tüberkülozlu hastalarda dikkatli şekilde kullanılmalıdır.
- Seyrek şekilde AİRPLUS yüksek terapötik dozlarda kardiyak aritmi (örn, supraventriküler taşikardi, ekstrasistol ve atrial fibrilasyon) ve serum potasyumunda hafif geçici bir düşmeye
neden olabilir. Bu nedenle AİRPLUS şiddetli kardiyovasküler bozukluk, kalp ritim anomalileri, diabetes mellitus, tirotoksikoz, düzeltilmemiş hipokalemi veya düşük serum potasyum düzeylerine eğilimli olan hastalarda dikkatli şekilde kullanılmalıdır.
- Seyrek şekilde kan glukoz düzeylerinde artışlar bildirilmiş olup, Diabetes mellitus öyküsü olan hastalara bu ilaç reçete edilirken bu dikkate alınmalıdır.
- Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltıda hızlı bir artışla paradoksıkal bronkospazm meydana gelebilir. AİRPLUS derhal kesilmeli, hasta değerlendirilmeli ve gerektiğinde alternatif tedaviye başlanmalıdır.
- Özellikle adrenal fonksiyonun önceki sistemik steroid tedavisi nedeniyle bozulduğunun
düşünülmesi için herhangi bir gerekçe mevcutsa, hastalar AİRPLUS tedavisine geçirilirken dikkatli olunmalıdır.
- Özellikle uzun süreli periyotlarda önerilenden yüksek dozlarda olmak üzere tüm inhale kortikosteroid ilaçlarla sistemik etkiler meydana gelebilir. Bu etkiler oral kortikosteroidlere kıyasla çok daha seyrek meydana gelmektedir. Olası sistemik etkiler Cushing sendromu, Cushmg benzen özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, katarakt ve glokomu içermektedir. Bu nedenle hastaların düzenli şekilde incelenmesi ve inhale kortikosteroid dozunun astımın etkinlik kontrolünün sürdürüldüğü en düşük doza indirilmesi önemlidir.
- İnhale kortıkosteroidlerin yüksek dozlarıyla hastalarda uzun süreli tedavi adrenal süpresyon ve akut adrenal krize neden olabilir. Yüksek flutikazon dozu (tipik olarak >1000 mcg/gün) kullanan çocuklar ve <16 yaşındaki adolesanlar özellikle riskli olabilir. Çok seyrek vakalarda ayrıca 500 ila <1000 mcg arasındaki flutikazon propiyonat dozlarıyla adrenal süpresyon ve akut adrenal kriz tanımlanmıştır. Akut adrenal krizi tetikleme potansiyeli olan durumlar travma, cerrahı, enfeksiyon veya dozdaki herhangi bir hızlı azalmayı içermektedir. Görülen semptomlar tipik olarak belirsizdir ve anoreksi, karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, azalan bilinç düzeyi, hipoglisemi ve nöbetleri içerebilir. Stres veya elektıf cerrahi periyotlarında ek sistemik kortikosteroid kullanımı düşünülmelidir. Salmeterol ve flutikazon propiyonatın sistemik emilimi büyük ölçüde akciğerlerde gerçekleşmektedir. Bir ölçülü doz inhaler ile bir spacer cihazının kullanımı akciğerlere ilaç salıverilmesini arttırabildiğinden, bunun sistemik yan etki riskinde bir artışa neden olma potansiyeli olduğu göz önünde bulundurulmalıdır. Tek doz farmakokinetik veriler,
salmeterol/flutikazon propiyonat kombinasyonunun ölçülü doz inhalerinin Volumatik spacer cihaz, ile kullanımının AeroChamber Plus spacer cihaz, ile kullanımına kıyasla salmeterol ve flutikazon propiyonat sistemik maruziyetini iki kat arttırabilirle ihtimalini göstermiştir.
- İnhale flutikazon propiyonat tedavisinin yararlar, oral steroid ihtiyacını minimize edecektir,
ancak oral steroıdlerden bu ilaçla tedaviye geçirilen hastalarda uzun bir süre adrenal rezervde
azalma riski devam edebilir. Daha önce yüksek doz acil kortikosteroid tedavisine ihtiyaç
duyan hastalar da riskli olabilir. Strese neden olması muhtemel acil ve elektif durumlarda
daima rezidüel yetmezlik olasılığı göz önünde bulundurulmalı ve uygun kortikosteroid
tedavisi düşünülmelidir. Adrenal yetmezlik boyutu, elektif prosedürlerden önce uzman önerisi
gerektirebilir. Ritonavir plazmadaki flutikazon propiyonat konsantrasyonunu ciddi şekilde
arttırabilir. Bu nedenle, hasta için potansiyel yararı sistemik kortikosteroid yan etkileri
riskinden daha yüksek olmadığı sürece eşzamanlı kullanımdan kaçınılmalıdır. Ayrıca
flutikazon propiyonat ile diğer potent CYP3A inhibitörleri birlikte kullanıldığında sistemik yan etki riski artmaktadır.
- Plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu alan Kronik Obstrüktif Akciğer Hastalığı (KOAH) bulunan hastalarda 3 yıllık bir çalışmada alt solunum yolu enfeksiyonları (özellikle pnömoni ve bronşit) daha sık bildirilmiştir. Üç yıllık KOAH çalışmasında yaşlı hastalar, daha düşük vücut kitle endeksi olan (< 25 kg/m2) hastalar ve çok şiddetli hastalığı (FEVİ beklenenin <%30’u) bulunan hastalarda, tedaviden bağımsız şekilde pnömoni gelişme riski en yüksek düzeydedir. Bu enfeksiyonların klinik özellikleri ve alevlenme sıklıkla aynı anda meydana geldiğinden, hekimler KOAH hastalarında pnömoni ve diğer alt solunum yolu enfeksiyonlarının olası gelişimi konusunda dikkatli olmalıdır. Şiddetli KOAH bulunan hastada pnömoni gelişirse, AİRPLUS ile tedavi yeniden değerlendirilmelidir.
- Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.
- Büyük ölçekli bir klinik çalışmada (Salmeterol Çok Merkezli Astım Araştırma Çalışması -S MART) veriler Afro-Amerikalı hastalarda, plaseboya kıyasla salmeterol kullanımı sırasında solunum ile ilişkili ciddi olay veya ölüm riskinin daha yüksek olduğunu düşündürmüştür. Bu artışın farmakogenetiğe veya diğer faktörlere bağlı olup olmadığı bilinmemektedir. Bu nedenle siyah Afrikalı veya Afro-Karayip kökenli hastalara, AİRPLUS tedavisi sırasında
astım semptomları kontrol edilmezse veya kötüleşirse tedaviye devam etmeleri gerektiği, ancak doktorlarına danışmaları gerektiği söylenmelidir.
- Eşzamanlı sistemik ketokonazol kullanımı, salmeterol maruziyetini anlamlı şekilde arttırmaktadır. Bu sistemik etki insidans.nda (öm, QTc aralığında uzama ve palpitasyonlar) bir artışa neden olabilir. Dolayısıyla, salmeterol tedavisinin yararları potansiyel anlamda artan sistemik yan etki riskinden daha fazla olmadığı sürece ketokonazol veya diğer potent CYP3A4 inhibitörleri ile eşzamanlı tedaviden kaçınılmalıdır.
- İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altında almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir.
4.5. Diğer tıbbı ürünler ile etkileşimler ve diğer etkileşim şekilleri
Selektif ve selektif olmayan beta blokerler, kullanımlar, için güçlü gerekçeler olmad.ğ. sürece astım hastalarında kullanılmamalıdır.
Diğer beta adrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Flutikazon Propiyonat
Normal şartlar altında, bağırsak ve karaciğerde sitokrom P450 3A4 enziminin aracılık ettiği yoğun ilk geçiş metabolizması ve yüksek sistemik klirens nedeniyle inhale dozlamadan sonra flutikazon propiyonatm düşük plazma konsantrasyonları elde edilmektedir. Bu nedenle flutikazon propiyonat aracılı klinik açıdan anlamlı ilaç etkileşimleri muhtemel değildir.
Sağlıklı deneklerde intranazal flutikazon propiyonat ile yapılan bir etkileşim çalışmasında, günde iki kez ritonavir (oldukça potent bir sitokrom P450 3A4 inibitörü) 100 mg dozu flutikazon propiyonat plazma konsantrasyonların, yüzlerce kat arttırmış ve serum kortizol konsantrasyonlarının belirgin şekilde azalmasına neden olmuştur. Bu etkileşime ilişkin bilgiler inhale flutikazon propiyonat için mevcut değildir, ancak flutikazon propiyonat plazma düzeyinde belirgin bir artış beklenmektedir. Cushing sendromu ve adrenal süpresyon vakalar, bildirilmiştir. Yararlan, artan sistemik kortikosteroid yan etkiler riskinden daha yüksek olmadığı sürece bu kombinasyondan kaçınılmalıdır.
Sağlıklı gönüllülerde yap,lan küçük ölçekli bir çalışmada daha düşük potenşe sahip bir CYP3A
inhibitörü olan ketokonazol, tek inhalasyondan sonra flutikazon propiyonat maruziyetini %I50
arttırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma kortizol düzeyinde daha
fazla düşüşe neden olmuştur, itrakonazol gibi diğer potent CYP3A inhibitörleri ile birlikte
tedavinin de, sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini arttırması
beklenmektedir. Dikkatli olunmas, ve bu ilaçlarla uzun süreli tedaviden mümkünse kaçmılmas, önerilmektedir.
Salmeterol
Potent CYP3A4 inhibitörleri 15 sağlıklı denekte 7 gün süreyle birlikte salmeterol (inhalasyon
yoluyla günde iki kez 50 mikrogram) ve ketokonazol (oral yolla günde bir kez 400 mg)
^ uygulanan,, plazma salmeterol maruziyetinde anlamlı bir artışa neden olmuştur (C_k! 1.4 kat ve
EAA 15 kat). Bu etki tek başına salmeterol ve ketokonazol tedavisine kıyasla salmeterol
tedavisinin diğer sistemik yan etki insidansında (öm, QTc aralığında uzama ve palpitasyonlar) bir artışa neden olabilir.
Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı, salmeterol eliminasyon yarı ömrünü veya tekrarlı dozlamayla salmeterol birikimini arttırmamıştır.
Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (öm, itrakonazol, telitromisin, ritonavir).
W
Orta düzeyde CYP 3A4 inhibitörleri
15 sağlıklı denekte 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50
mikrogram) ve eritromisin (oral yolla günde bir kez 500 mg) uygulanın,,, salmeterol
maruziyetinde küçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (CmJk,
1.4 kat ve EAA 1.2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
inhale kortikosleroid ile uzun süreli tedavi gören çocukların boyunun düzenli şekilde izlenmesi
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
AİRPLUS inhalasyon için aerosolün doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır.
Gebelik dönemi
Salmeterol/flutikazon propiyonat kombinasyonunun gebelikte kullanım, ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisi,esinin bulunduğunu göstermiştir (Bkz. Kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan üreme toksisite çalışmaları, güçlü bir beta 2 adrenoreseptör agonistinin ve glukokortikosteroidin aşır, sistemik maruzıyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır.
İlaç kullanım, ancak anneye sağlaması beklenen yararı fetusa olan olas, bir riskten fazla ise
düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla
ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatm ne de flutikazon
propiyonat,n genetik toksisite potansiyeline sahip olduğu gösterilmiştir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Salmeterol ksinafoat ve flutikazon propiyonat,n gebelik ve emzirme döneminde kullanım, ile ilgili deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Salmeterol süte geçer. Terapötik dozlarda inhale edilen salmeterol ve flutikazon propiyonat,n plazma düzeyleri çok düşüktür ve buna bağlı olarak anne sütündeki konsantrasyonların düşük olması muhtemeldir.
13
Bu, sütünde düşük ilaç konsantrasyonları ölçülen emziren hayvanlar üzerinde yapılan çalışmalarla desteklenmiştir.
Üreme yeteneği/Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
AİRPLUS salmeterol ve flutikazon propiyonat içerdiğinden, bileşiklerden her biriyle ilişkilendirilen tipte ve şiddette yan etkiler beklenebilir, iki bileşiğin eşzamanlı uygulanmasın, takiben ek yan etki insidansı söz konusu değildir. Salmeterol/flutikazon propiyonat ile ilişkilendirilen yan etkiler aşağıda organ sistemi sınıfına ve görülme sıklığına göre liste halinde sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır:
Çok yaygın (il/IO), yaygın (>1/100 ila <1/10). yaygın olmayan (>1/1.000 ila <1/100), seyrek
(>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Çok yaygın, yaygın ve yaygın olmayan olaylar klinik çalışma verilerinden elde edilmiştir.
Plasebo insidansı dikkate alınmamıştır. Çok seyrek olaylar pazarlama sonrası spontan verilerden elde edilmiştir.
Enfeksiyonlar ve enfestasyonlar
Yaygın: Ağız ve boğazda kandidiyazis, pnömoni, bronşit
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Kütanöz duyarlılık reaksiyonları
Çok seyrek: Anjiyoödem (temelde yüzde ve orofarinksde ödem), solunum semptomları (dispne ve/veya bronkospazm), anafılaktik şok dahil, anafılaktik reaksiyonlar
Çok seyrek: Cushing sendromu, Cushing benzeri özellikler, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, katarakt, glokom
Metabolizma ve beslenme hastalıkları
Yaygın: Hipokalemi Çok seyrek: Hiperglisemi
Psikiyatrik hastalıklar
Çok seyrek: Anksiyete, uyku bozukluklar, ve hiperaktivite ve iritabilite (temelde çocuklarda) dahil davranış değişiklikleri
Bilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda)
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı Yaygın: Tremor
Kardiyak hastalıklar
Yaygın: Palpitasyon Yaygın olmayan: Taşikardi
Çok seyrek: Kardiyak aritmi (atrial flbrilasyon, supraventriküler taşikardi ve ekstrasistol dahil)
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın: Nazofarenjit
Yaygın. Boğaz ırrıtasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH’lı hastalarda)
Çok seyrek: Paradoksikal bronkospazm
Deri ve deri altı doku hastalıkları
Yaygın: Kontüzyonlar
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Kas krampları, travmatik kırıklar Çok seyrek: Artralji, miyalji
AİRPLUS ile doz aşımına ilişkin klinik çalışmalardan elde edilmiş veri yoktur, ancak her iki madde ile doz aşımına yönelik veriler aşağıda sunulmaktadır:
Salmeterol doz aşımının belirti ve semptomlar, tremor, baş ağrısı ve taşikardidir. Tercih edilen antıdotlar, bronkospazm öyküsü olan hastalarda dikkatli şekilde kullanılması gereken kardiyoselektif beta bloker maddelerdir. AİRPLUS tedavisi ilacın beta agonist bileşeni nedeniyle kesilirse, uygun replasman steroid tedavisinin sağlanması düşünülmelidir. Buna ek olarak hıpokalemı meydana gelebilir ve potasyum replasmam düşünülmelidir.
Akut: Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal fonksiyonunda geçici süpresyona neden olabilir. Adrenal fonksiyonu plazma kortizol ölçümleri ile doğrulandığı gibi birkaç günde normale döndüğünden bu doz acil tedavi gerektirmemektedir, inhale flutikazon propiyonat ile kronik doz aşım, adrenal süpresyon riskini doğurmaktadır. Adrenal rezervin izlenmesi gerekli olabilir. Flutikazon propiyonat ile doz aşımı vakalarında semptom kontrolü için uygun dozda AİRPLUS tedavisine yine de devam edilebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapotık grup: Selektif Beta 2 adrenerjik reseptör agonistleri (inhale)
Kortikosteroidler (inhale)
ATC kodu: R03AK06
Salmeterol/flutikazon propiyonat kombinasyonu astım klinik çalışmaları Uzun süreli astımlı 3416 erişkin ve adolesanda 12 aylık bir çalışmada (Optimal Astım
Kontrolünün Sağlanması, OAKS) ast.m tedavisi hedeflerinin erişilebilir olup olmadığının
belirlenmesi için, tek başına inhale kortikosteroidler (Flutikazon Propiyonat) ile
salmeterol/flutikazon propiyonat kombinasyonunun etkinlik ve güvenilirliği karşılaştırılmıştır.
Tedavi dozu **Toplam kontrol sağlanana veya çalışma ilacının en yüksek dozuna erişilene kadar 12 haftada bir arttırılmıştır. OAKS, salmeterol/flutikazon propiyonat kombinasyonu verilen daha fazla hastada, tek başına inhale kortikosteroid (İKS) verilen hastalara kıyasla astım kontrolü sağlandığı ve bu kontrolün daha düşük kortikosteroid dozunda elde edildiğini göstermiştir.
İyi kontrol altına alınmış ast.m, tek başına İKS’ye kıyasla, salmeterol/flutikazon propiyonat kombinasyonu ile daha hızlı şekilde elde edilmiştir. İlk bireysel iyi kontrol altına alınmış haftanın elde edilmesi için deneklerin %50’sindeki tedavi süresi salmeterol/flutikazon propiyonat kombinasyonu için 16 gün ve İKS grubunda 37 gündü. Daha önce steroid tedavisi görmeyen bir hasta alt grubunda bireysel iyi kontrol altına alınmış haftaya kadar geçen süre salmeterol/flutikazon propionat kombinasyonu ile 16 gün olurken, İKS ile 23 gündü.
Genel çalışma bulgulan aşağıdakileri göstermiştir:
12 Ayda Iyı Kontrol Altına Alınmış (WC) ve **Tam Olarak Kontrol Altına Alınmamış (TC) Astım Sağlanan Hastalann Oranı ~ , ------ | ||||
V^iışma Uncesı Tedavi | Salmeterol/FP | FP | ||
WC | TC | WC | TC | |
İKS yok (tek başına kısa etki süreli beta agonisti (KESBA)) | %78 | %50 | %70 | %40 |
Düşük doz İKS (< 500 mcg beklometazon dipropiyonat (BDP) veya eşdeğer/gün) | %75 | %44 | %60 | %28 |
Orta doz İKS (>500-1000 mcg beklometazon dipropiyonat (BDP) veya eşdeğer/gün) | %62 | %29 | %47 | %16 |
3 tedavi düzeyinde birleştirilmiş bulgular *lvi kontml | %7] 1 | %41 | %59 | %28 1 |
beklenen akciğer fonksiyonunun %80’inden
azı veya gece uyanmaları görülmemesi, alevlenme
ıırnı veya
ve tedavide bir değişikliği gerektiren yan etkiler yok.
"Toplam astım kontrolü; semptom yok, KESBA kullanım, yok, beklenen akciğer
fonksiyonunun >%80’i veya gece uyanmaları yok, alevlenme ve tedavide bir değişikliği gerektiren yan etkiler yok.
Bu çalışmadaki bulgular günde iki kez salmeterol/flutikazon propiyonat 50/100 mikrogram dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilk idame tedavisi olarak değerlendirilebileceğini düşündürmektedir.
>18 yaşındaki dirençli astım hastası 318 kişide yapılan bir çift kör, randomize, paralel gruplu
çalışmada iki haftalık sürede günde iki kez iki inhalasyonla (çift doz) salmeterol/flutikazon
propiyonat kombinasyonu kullanımının güvenilirlik ve tolerabilitesi değerlendirilmiştir. Bu
çalışma 14 güne kadar her salmeterol/flutikazon propiyonat kombinasyon dozu inhalasyonunun
iki katma çıkarılmasının, günde iki kez tek inhalasyona kıyasla beta agonist ile ilişkili yan
etkilerde küçük bir artışa (tremor; O’a karşı I hasta [%l], palpitasyon; I hastaya [<%]] karşı 6
[%3], kas kramplar,; 1 [<%1
] hastaya karşı 6 [%3]) ve inhale kortikosteroid ile ilişkili yan
etkilerde benzer bir insidansa neden olduğunu göstermiştir (öm, oral kandidiyazis; 16 hastaya
[%8] karş, 6 [%6], ses kısıklığı; 4 hastaya [%2] karş, 2 [%2]). Salmeterol/flutikazon propiyonat
kombinasyon dozunun ek kısa süreli (14 güne kadar) inhale kortikosteroid tedavisine ihtiyaç
duyulan erişkin hastalarda iki katma çıkarılması düşünülürse, beta agonist ile ilişkili yan etkilerdeki küçük artış dikkate alınmalıdır.
Çok Merkezli Salmeterol Astım Araştırma Çalışması (SMART)
S MART çok merkezli, randomize, çift kör, plasebo kontrollü, paralel gruplu 28 haftalık bir çalışma olup ABD’de yapılan, hastanın normal astım tedavisinde ek olarak 13.176 hastanın salmeterol (günde iki kez 50 pg) ve 13.179 hastanın plasebo grubuna atandığ, bir çalışmaydı. > 12 yaşında olan, astım tanış, konulan ve astım ilacı kullanmakta olan (ancak bir UESBA değil) hastalar çalışmaya dahil edilmiştir. Çalışmaya girişte başlangıçta İKS kullanım, kaydedilmiş, ancak çalışmada buna gerek duyulmamıştır. SMART çalışmasında primer sonlanma noktası, solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombine sayısıydı.
SMART Çalışmasındaki Temel Bulgular: Primer Sonlanma Noktası
Hasta grubu | Primer sonlanma olayı sayısı/hasta sayısı | Bağıl Risk (%95 güven aralığı) | |
Salmeterol | Plasebo | ||
1 um hastalar | 50/13,176 | 36/13,179 | 1.40 (0.91,2.14) |
inhale steroid kullanan hastalar | 23/6,127 | 19/6,138 | 1.21 (0.66,2.23) |
| İnhale steroid kullanmayan hastalar | 27/7,049 | 17/7,041 | 1.60 (0.87,2.93) |
Alro-Amerikalı hastalar I---------- _ı | 20/2,366 1 | 5/2,319 | 4.10 (1.54,10.90) |
(Koyu karakterle yazılan risk %95 düzeyinde istatistiksel olarak anlamltdır.)
SMART Çalışmasında Başlangıçta İnhale S.eroidlerle ilişkili Temel Bulgular: Sekonder Sonlanma Noktaları
Sekonder sonlanma olayı sayısı/hasta sayısı | Bağıl risk (%95 güven aralıeı’l | ||
L ’ r . 1 ........... | Salmeterol | Plasebo | |
çulunum ne ilişkili mortalite ----------- 1 i . , .—T------- | |||
mnaıe steroid Kullanan hastalar | 10/6127 | 5/6138 | 2.01 (0.69, 5.86) |
İnhale steroid kullanmayan hastalar \y ı • . | 14/7049 | 6/7041 | 2.28 (0.88, 5.94) |
ı-uıııuuiL asımı kaynaklı munalıte veya yaşamı tehdit eden deneyim * • • ..... ..... | |||
Jiıuaıe sıeroıa kullanan hastalar | 16/6127 | 13/6138 | 1.24 (0.60,2.58) |
mnaıe steroid kullanmayan hastalar | 21/7049 | 9/7041 | 2.39 (1.10, 5.22) |
aslimi ne ilişkili mortalite --1 » 1 « .... —----- | |||
ınnaıe sıeroıa kullanan hastalar | 4/6127 | 3/6138 | 1.35 (0.30, 6.04) |
inhale steroid kullanmayan hastalar ---1__ .... ... . . . | 9/704Q | 0/7041 | * 1 |
(•-plasebo grubunda hiç olay bulunmadığından hesaplanamamıştır. Koyu rakamla yazılan risk %95 düzeyinde istatistiksel olarak anlamlıdır. Yukarıdaki tablodaki sekonder sonlanma noktalar, tüm popülasyonda istatistiksel anlamlılığa erişmiştir). Kombine tüm nedenlere bağlı mortalite
veya yaşamı tehdit edici deneyim, tüm nedenlere bağlı mortalite veya tüm nedenlere bağlı
hastaneye yatma sekonder sonlanma noktaları, tüm popülasyonda istatistiksel anlamlılığa erişmemiştir.
KOAH
Kısa etkili beta 2 agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları:
Alt, ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500
mıkrogram’lık salmeterol/flutikazon propiyonat kombinasyonunun düzenli kullanımının akciğer
fonksiyonunu h.zl, ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlat,c, ilaç kullan,mm,
anlaml, derecede azaltt.ğm, göstermiştir. Ayn, zamanda hastalann sağlık durumunda da anlamlı derecede düzelme olmuştur.
Kısa etkili beta 2 agonistlerine % 10’dan daha az reversibilite gösteren semptomatik KOAH hastaları:
6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonunun düzenli kullan,m,nın akciğer fonksiyonunu h.zh ve anlamh derecede düzelttiğini, nefes darlığın, ve rahatlatıcı ilaç kullanımın, anlaml, derecede azalttığın, göstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamh derecede azalmışı,r. Ayn, zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur.
50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonu hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAH alevlenme riskini azaltmada etkili bulunmuştur.
TORCH çalışması (TOwards a Revolution in COPD Health; KOAH’ta devrime doğru):
TORCH, KOAH hastalar,nda, günde 2 kez 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonu kuru toz inhaleri/inhalasyon için aerosolü, günde 2 kez 50 mikrogram salmeterol kuru toz ınhalerı/ınhalasyon için aerosolü, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) kuru toz inhaleri/ inhalasyon için aerosolü veya plasebo ile yapılan tedavinin tüm nedenlere bağl, ölümler üzerindeki etkisini değerlendirmek için yapılan 3 y.lhk bir çalışmadır. Başlangıç (bronkodilatörden önce) FEVİ’İ beklenen normal değerin % 60’ından az olan orta-
şiddetli ve şiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayatta kalma durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Başlıca sonlanma noktası, plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır (Tablo I).
Tablo 1
Plasebo N= 1524 | Salmeterol 50 N = 1521 | FP 500 N = 1534 | Salmeterol/flutikazon propiyonat kombinasyonu 50/500 N = 1533 | |
j ynua lum nedenlere bağlı ölüm | ||||
Ulum sayısı (%) | 231 (% 15.2) | 205 (% 13.5) | 246 (% 16.0) | 193 (% 12.6) |
Plaseboya karşı risk oranı (GA) p değeri | Geçerli değil | 0.879 (0.73, 1.06) 0.180 | 1.060 (0.89, 1.27) 0.525 | 0.825 (0.68, 1.00) 0.0521 |
Risk oranı, komponentlerine karşı salmeterol/flutikazon propiyonat kombinasyonu 50/500 GA p değeri | Geçerli değil 1 1 | 0.932 (0.77, 1.13) 0.481 | 0.774 (0.64, 0.93) 0.007 - [ | Geçerli değil 1 |
gruplandırılmış bir log-rank analizi için ayarlanmış P değeri,
"7T- ;-1- 1---------------[__________|
birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu açısından
Salmeterol/flutikazon propiyonat kombinasyonu, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda olum riskim % 17.5 oranında azaltmıştır (Risk Oranı 0.825 (% 95 GA 0.68, 1.00, p = 0.052; tümü ara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi
bir zamanda herhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile % 12 azalma (p = 0.180) ve FP ile % 6 artış (p = 0.525) olmuştur (Tablo 1).
Cox’un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl
içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren salmeterol/flutikazon
propiyonat kombinasyonu için 0.811’lik (% 95 GA 0.670, 0.982, p - 0.031) bir risk oranı
olduğunu göstermiştir. Model önemli faktörler (sigara içme durumu, yaş, cinsiyet, bölge,
başlangıç FEVİ ve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur (Tablo 1).
Üç yıl içinde KOAH’a bağlı nedenlerden dolay, ölen hastaların yüzdesi plasebo için % 6.0,
salmeterol ıçm % 6.1, FP için % 6.9 ve salmeterol/flutikazon propiyonat kombinasyonu için % 4.7’dir (Tablo 1).
Plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p < 0.001) oranında azaltmıştır. Salmeterol/flutikazon propiyonat kombinasyonu alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p = 0.002), FP ile karşılaştırıldığında da /o 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p < 0.001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p < 0.001) oranında azaltmıştır.
St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla
^ tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca salmeterol/flutikazon propiyonat
kombinasyonu ile sağlanan ortalama düzelme plaseboya kıyasla - 3.1 birim (% 95 GA: - 4.1 ve
- 2.1 arasında; p < 0.001), salmeterole kıyasla - 2.2 birim (p < 0.001) ve FP’ye kıyasla - 1.2 birimdir (p = 0.017).
ÜÇ yıllık tedavi süresi boyunca, FEVİ değerleri salmeterol/flutikazon propiyonat kombinasyonu ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 mİ, % 95 GA: 75 - 108 mİ; p < 0.001). FEVl’i düzeltmede salmeterol/flutikazon propiyonat kombinasyonu salmeterolden veya FP’den daha etkilidir (salmeterol için ortalama fark 50 mi, p < 0.001 ve FP için 44 mL’dir, p < 0.001).
Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3,
salmeterol için % 13.3, FP için % 18.3 ve salmeterol/flutikazon propiyonat kombinasyonu için
% 19.6’dır (salmeterol/flutikazon propiyonat kombinasyonunun plaseboya karşı risk oranı: 1.64,
% 95 GA: 1.33 ve 2.01 arasında, p < 0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştır;’
tedavi sırasında birincil olarak pnömoniye bağlı olduklar, düşünülen ölümler plasebo için 7,
salmeterol için 9, FP için 13 ve salmeterol/flutikazon propiyonat kombinasyonu için 8 olarak
tespit edilmiştir. Kemik kırılma olasılığında anlaml. farklılık yoktur (plasebo % 5.1, salmeterol
% 5.1, FP % 5.4 ve salmeterol/flutikazon propiyonat kombinasyonu % 6.3; plaseboya karş,
salmeterol/flutikazon propiyonat kombinasyonu için risk oranı: 1.22, % 95 GA: 0.87 ve 1 72
arasında, p = 0.248). Göz bozuklukları, kemik bozukluklar, ve hipotalamus-hipofiz-adrenal eksen
bozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler arasında farklılık
gözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur.
Etki mekanizması:
AİRPLUS, farklı etki şekline sahip salmeterol ve flutikazon propiyonat içermektedir. İki etkin maddenin ilgili etki mekanizmaları aşağıdaki tartışılmaktadır. .
Salmeterol:
Salmeterol reseptörün sekonder bağlanma bölgesine bağlanan uzun bir yan zincire sahip selektif
uzun etkili (12 saat) bir beta 2 adrenoseptör agonisttir. Salmeterol klasik kısa etkili beta 2
agonistlerin önerilen dozlarına kıyasla, en az 12 saat süren daha uzun süreli bronkodilatasyon sağlamaktadır.
Flutikazon propiyonat:
Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat, akciğerlerde bir
glukokortıkoıd antıenflamatuvar etkiye sahiptir ve bu etki, kortikosteroidler sistemik yolla
5.2. Farmakokinetik özellikler
Genel özellikler
Salmeterol ve flutikazon propiyonat inhalasyon yoluyla kombinasyon halinde uygulananda her bileşenin farmakokinetiği, ilaçlar ayr, ayr, uygulandığında gözlenene benzerdi. Bu nedenle farmakokinetik açıdan her bileşik ayrı ayrı ele alınabilir.
Salmeterol:
Emilim:
Salmeterol akc,gende lokal olarak etki eder, bu nedenle plazma düzeyleri terapötik etkinin bir
belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma
konsantrasyonlar, gösterdiği için (yaklaşık 200 pg/ml veya daha az), plazmadaki ilaç miktarının
tayın, teknık olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sıntrl, veriler
bulunmaktadır. Salmeterol ksinafoatın düzenli kullanımın, takiben, hidroksinaftoik asit sistemik
dolaşımda tayın edilebilir ve karart, durum konsantrasyonlar, yaklaşık 100 ng/ml’ye ulaşır Bu
konsantrasyonlar, toksisite çalışmalarında gözlenen kararlı durum konsantrasyonlarından 1000
kez daha düşüktür. Hava yolu Okan,kİ,ğ, olan hastalarda uzun süreli düzenli kullan,m,nda (12 aydan fazla) herhangi bir zararlı etki görülmemiştir.
Dağılım:
Salmeterolün plazma proteinlerine bağlanma oranı % 96’dır.
Biyotransformasvon:
In vitro bir çalışma salmeterolün sitokrom P450 (CYP3A4) tarafından büyük oranda a-hıdroksısalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir.
Eliminasyon-
Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterol %60 dtşk, ile %25 idrar ile itrah edilir.
Doğrusallık/Doğrusal olmavan dnmm-Veri bulunmamaktadır.
Flutikazon propiyonat:
Emilim:
Sağlıklı deneklerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanım., kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11’i arasında değişmektedir. Ast,mİ, hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşük bir düzeyi gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup, ilk başta hızh ve sonrasında uzun sürelidir, inhale dozun kalan, yu,alabilir ancak düşük suda çözünürlük ve presıstemık metabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oral biyoyararlanımınm %1’den az olmasını sağlar.
Dağılım:
Flutikazon propiyonat kinetiği yüksek plazma klirensi (1150 mL/dak), kararlı durumda yüksek dağılım hacmi (yaklaşık 300 L) ve yaklaşık 8 saatlik terminal yarı ömürle karakterizedir.
Plazma proteinine bağlanma oranı %91’dir.
Biyotransformasvon •
Flutikazon propiyonat sistemik dolaşımdan çok hızlı elimine edilmektedir. Temel yolak, sitokrom P450 enzim CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolizasyondur. Ayrıca feçeste tanımlanmamış diğer metabolitler tespit edilmektedir.
Eliminasyon:
Flutikazon propiyonatın renal klirensi önemsiz düzeydedir. Dozun %5’inden daha azı idrarda
temelde metabolitler olarak at,intaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemiş ilaç olarak atılmaktadır.
Doğrusallık/Doğrusal olmayan
durum:
5.3. Klinik öncesi güvenlilik verileri
Hayvanlarda ayr, ayr, verilen salmeterol ksinafoa, ve flutikazon propiyonat çalışmalannda görülen insanlarda kullanıma yönelik tek güvenilirlik sorunu, aşırı farmakolojik etkilerle ilişkilendırılmıştir. Hayvan üreme çalışmalarında glukokortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonlart) neden olduğu gösterilmiştir. Bununla birlikte bu hayvan
deneylerinin önerilen dozlar,n verildiği insanlar için anlaml, olduğu düşünülmemektedir.
Salmeterol ksinafoat ile yap,lan hayvan çalışmalar, sadece yüksek maruziyet düzeylerinde
embriyofetal toksisile göstermiştir. Birlikte uygulan,m, takiben bilinen glukokortikoid kaynakl,
anomalilerle ilişkilendirilen dozlarda, s,çanlarda artan transpoze umblikal arter ve ossipital
kemikte eksik osifikasyon insidansı tespit edilmiştir. Kloroflorokarbon (CFC) olmayan itici
norf]uranın iki y,ll,k periyotlarda günlük maruziyet uygulanan çok çeşitli hayvan türlerinde
hastalann bulunmas, muhtemel düzeylerden çok daha yüksek buhar konsan,rasyonlarmda toksik etki sergilemediği gösterilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
6.2. Geçimsizlikler
Bilinen geçimsizliği yoktur.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
AIRPLUS 25/250 mcg inhalasyon için aerosol, 120 dozluk aerosol tüplerde karton kutuda, kullanma talimatı ile beraber ambalajlanır.
6.6. Beşeri ttbbi üründen arta kalan maddelerin in,has ve diğer özel önlemler
Kullanılmamış olan ürünler ya da at.k materyaller “Ttbbi Attkların Kontrolü Yönetmeliği” ve “Ambalaj ve Ambalaj Atıklanmn Kontrolü Yönetmeliklerime uygun olarak imha edilmelidir.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AIRPLUS | 8680741520283 | |
| AIRPUFF | 8680741521129 | 334.38TL |
| AIRTIDE | 8680760150294 | 582.17TL |
| ASTER | 8699724550018 | |
| BELHALER | 8699540043770 | 499.99TL |
| Diğer Eşdeğer İlaçlar |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A13745 |
| Satış Fiyatı | 466.33 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 466.33 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681094520357 |
| Etkin Madde | Flutikazon + Salmeterol |
| Yerli ve Beşeri bir ilaçdır. |