ALLOPRE 5 G infüzyonluk çözelti hazırlamak için toz (5 flakon) Kısa Ürün Bilgisi
{ Treosulfan }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ALLOPRE 5 g infüzyonluk çözelti hazırlamak için toz
Steril, Sitotoksik
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir flakon 5 g treosulfan içerir.
Sulandırıldıktan sonra 1 ml çözelti 50 mg treosulfan içerir.
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti hazırlamak için tozBeyaz, kristalimsi topak veya toz.
Uygun koruyucu gözlük, maske ve giysiler kullanılmalıdır.
Çift uçlu kanülün bir ucu su şişesinin kauçuk tıpasına yerleştirilir. Daha sonra ALLOPRE şişesi altı üste gelecek şekilde kanülün diğer ucuna takılır. Tüm düzenek ters çevrilir ve suyun alttaki şişeye girmesi sağlanır; bu sırada şişe yavaşça çalkalanır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ALLOPRE, aktif tedavi seçeneklerini tüketmiş relaps veya metastatik epitelyal over kanser hastalarında endikedir.
Erişkinlerin malign ve nonmalign hastalıklarında, 1 aydan büyük pediyatrik hastaların malign hastalıklarında allojenik kök hücre nakli öncesi fludarabin ile kombine olarak hazırlık rejiminde kullanımı endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji:
Over kanseri
Monoterapi olarak kullanıldığında treosulfanın dozajı 5-8 g/m²'dir.
Daha önce miyelosupresif ajanlarla tedavi veya radyoterapi ve azalmış performans durumu gibi risk faktörlerinin mevcut olduğu hastalarda doz 6 g/m²'ye veya daha düşük bir doza indirilmelidir.
Tedavi 3-4 haftada bir tekrarlanmalıdır.
Sisplatin ile kombinasyonda treosulfan 5 g/m² dozunda uygulanmalı ve tedavi kürleri 3-4
haftada bir tekrarlanmalıdır.
Tedavi süresi
Genellikle treosulfan ile 6 tedavi kürü verilmektedir.
Progresif hastalık durumunda ve/veya tolere edilemeyen advers olayların varlığında tedavi durdurulmalıdır.
Doz değişikliği
Eğer treosulfan uygulandıktan sonra beyaz kan hücre sayısı 1,000/μl'nin altına düşerse ve/veya trombosit sayısı 25,000/μl'nin altına düşerse sonraki doz 1 g/m² azaltılmalıdır.
Üç hafta sonra beyaz kan hücre sayısı 3,500/μl'den az ise veya trombosit sayısı 100,000/μl'den düşükse tedavi verilmemelidir. Bir hafta sonra kan sayımı tekrarlanmalıdır ve hematolojik parametreler tatminkar ise tedavi yeniden başlatılabilir.
Eğer bundan sonra değerlerde hala bir değişiklik olmazsa treosulfan dozu monoterapi durumunda 6 g/m²'ye ve sisplatin ile kombinasyonda 3 g/m²'ye düşürülmelidir.
Eğer tedavi sırasında beyaz kan hücre sayısı 3,500/μl'nin altına düşmezse ve/veya trombosit sayısı 100,000/μl'nin altına inmezse, sonraki tedavi küründe doz 1 g/m² arttırılabilir.
Allojenik kök hücre nakli öncesi hazırlık rejimi
Treosulfan, hazırlayıcı tedavi ve takiben allojenik HKHT (hematopoetik kök hücre transplantasyonu) konusunda deneyimli bir hekim gözetiminde uygulanmalıdır.
Malign hastalığı olan yetişkinler
Treosulfan, fludarabin ile kombinasyon halinde verilir. Tavsiye edilen uygulama dozu ve planı şöyledir:
Treosulfan günde 10 g/m² vücut yüzey alanı (VYA) kök hücre infüzyonundan (0.gün) önce peşpeşe üç gün (-4, -3, -2.günler) iki saatlik intravenöz infüzyon şeklinde verilir. Toplam treosulfan dozu 30 g/m²'dir;
4.3. Kontrendikasyonlar
Etkin madde
Şiddetli ve devam eden kemik iliği depresyonu. Emzirme
Kontrol altında olmayan aktif enfeksiyon hastalığı
Ağır eş zamanlı kalp, akciğer, karaciğer ve böbrek hastalığı Fanconi anemisi ve diğer DNA kırığı onarım bozuklukları Hamilelik (bkz. Bölüm 4.6)
Canlı aşı uygulanması
4.4. Özel kullanım uyarıları ve önlemleri
Over kanseri
Enfeksiyon riski
Enfeksiyonların (mikotik, viral, bakteriyel) riski artar.
Hematolojik etkiler ve kan sayımı takibi
Treosulfanın doz sınırlayıcı yan etkisi, genellikle geri dönüşlü olan miyelosupresyondur. Miyelosupresyon lökositlerde ve trombositlerde düşüş ve hemoglobinde azalma ile kendini gösterir. Lökositler ve trombositler genellikle 28 gün sonra başlangıç düzeylerine geri döner.
Kemik iliği fonksiyonunun inhibisyonu kümülatif olduğundan, kan sayımı üçüncü tedavi küründen itibaren daha kısa aralıklarla takip edilmelidir.
Treosulfan kemik iliği fonksiyonunu baskılayan diğer tedavi formlarıyla (örn., radyoterapi) kombine kullanılırsa bu özellikle önemlidir.
Malignite riski
Oral treosulfan dozlarıyla uzun dönemli tedavi sırasında sekiz hastada (553 hastanın %1.4'ü) akut non-lenfositik lösemi gelişmiştir. Risk treosulfanın kümülatif dozuna bağlı olarak
değişmiştir. İlave olarak miyelom, miyeloproliferatif bozukluk ve miyelodisplastik sendromun tekil vakaları raporlanmıştır.
Kardiyak toksisite
Bir kardiyomiyopati vakasının treosulfan ile ilişkili olduğu tamamen dışlanamamaktadır.
Pulmoner toksisite
Eğer alerjik alveolit veya pulmoner fibroz gelişirse treosulfan kalıcı olarak kesilmelidir.
Sistit riski
Muhtemel hemorajik sistit gelişimi nedeniyle hastalara intravenöz infüzyondan sonra 24 saate kadar daha fazla sıvı tüketmeleri söylenmelidir.
Böbrek fonksiyon bozukluğu
Treosulfan böbrekler yoluyla atıldığından, kan sayımları böbrek fonksiyon bozukluğu olan hastalarda dikkatle izlenmeli ve doz uygun şekilde ayarlanmalıdır (bkz. Bölüm 4.2).
Canlı aşılar ile birlikte kullanım
Sitostatik tedavi canlı aşıların kullanıldığı bağışıklamadan sonra yaygın enfeksiyon riskini arttırabilir. Bu nedenle, treosulfan alan hastalarda canlı aşılar kullanılmamalıdır.
Ekstravazasyon
İnfüzyon sırasında hatasız bir teknik kullanılmasına dikkat edilmelidir çünkü treosulfan çözeltisinin civardaki dokuya ekstravazasyonu sonucunda ağrılı enflamatuvar reaksiyonlar meydana gelebilir.
Gebeliğin önlenmesi
Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresince ve tedaviden sonraki ilk 6 ay boyunca etkili bir doğum-kontrol yöntemi kullanmalıdır (bkz. Bölüm 4.6).
Allojenik kök hücre nakli öncesi hazırlık rejimi
Miyelosupresyon
Pansitopeni ile birlikte derin miyelosupresyon treosulfana dayalı hazırlık rejiminin istenen tedavi etkisidir ve tüm hastalarda görülür. Bu nedenle, hematopoetik sistem toparlanıncaya kadar kan hücre sayılarının sık aralıklarla izlenmesi önerilir.
Şiddetli nötropeni fazları sırasında (nötropenik periyodun medyan süresi yetişkinlerde 14- 17.5 gün ve pediyatrik hastalarda 21-24 gündür) enfeksiyon riski artar. Dolayısıyla profilaktik veya ampirik antienfektif tedavi (bakteriyel, viral, fungal) düşünülmelidir. Büyüme faktörleri (G-CSF, GM-CSF), trombosit ve/veya kırmızı kan hücresi desteği endike olan şekilde verilmelidir.
Sekonder maligniteler
Sekonder maligniteler allojenik HKHT'den sonra uzun süre hayatta kalan hastalarda iyi bilinen komplikasyonlardır. Treosulfanın bunların ortaya çıkmasına ne derece katkıda bulunduğu bilinmemektedir. Olası bir ikinci bir malignite oluşması riski hastaya açıklanmalıdır. İnsan verileri esas alınarak treosulfan Uluslararası Kanser Araştırmaları Ajansı (IARC) tarafından bir insan karsinojeni olarak sınıflandırılmıştır.
Mukozit
Oral mukozit (yüksek şiddet derecesi dahil) treosulfana dayalı hazırlık ve takiben allojenik HKHT'den sonra çok yaygın bir istenmeyen etkidir (bkz. Bölüm 4.8). Mukozit profilaksisinin kullanımı (örn., topikal antimikrobiyaller, bariyer koruyucular, buz ve yeterli ağız hijyeni) önerilir.
Aşılar
Canlı zayıflatılmış aşılarının eş zamanlı kullanımı önerilmez. Fertilite
Treosulfan fertiliteyi olumsuz etkileyebilir. Dolayısıyla, treosulfan tedavisi alan erkeklere tedavi sırasında ve tedaviden 6 ay sonrasına kadar baba olmamaları ve treosulfan tedavisine bağlı geri dönüşsüz infertilite olasılığı nedeniyle tedaviden önce spermlerinin dondurularak saklanması konusunda hekim tavsiyesi almaları önerilir.
Premenopozal hastalarda over supresyonu ve amenore ile birlikte menopoz semptomları yaygın biçimde görülmektedir (bkz. Bölüm 4.6).
Pediyatrik popülasyon
Nöbetler
Primer immün yetmezlikleri olan bebeklerde (≤ 4 aylık) fludarabin veya siklofosfamid ile kombine olarak treosulfan ile hazırlık tedavisinden sonra nöbetlere dair tekil raporlar alınmıştır. Bu nedenle, 4 aylık veya daha büyük bebekler nörolojik advers reaksiyon belirtileri açısından izlenmelidir. Bunların nedeninin treosulfan olduğu kanıtlanamamışsa da, 1 yaşından küçük çocuklarda klonazepam profilaksisi düşünülebilir.
Solunum, göğüs ve mediastin hastalıkları
Treosulfana dayalı hazırlık tedavisi alan pediyatrik hastalarda yaş ile solunum toksisitesi arasında anlamlı bir ilişki saptanmıştır.
Bir yaşından küçük çocuklarda (esas olarak malign olmayan hastalıklar, özellikle immün yetmezlikleri olanlar) III/IV. derece solunum toksisitesi daha fazla ortaya çıkmıştır; bunun muhtemel nedeni hazırlık tedavisine başlanmadan önce mevcut olan akciğer enfeksiyonlarıdır.
Bebek bezi dermatiti
Treosulfanın idrarla atılması nedeniyle küçük çocuklarda bebek bezi dermatiti görülebilir. Bu nedenle her bir treosulfan infüzyonundan sonra bebek bezleri sık sık, 6â8 saatte bir değiştirilmelidir.
Ekstravazasyon
Treosulfan tahriş edici madde olarak kabul edilir. İntravenöz uygulama güvenli bir teknik kullanılarak yapılmalıdır. Ekstravazasyondan şüphelenilmesi halinde genel güvenlik tedbirleri uygulanmalıdır. Hiçbir spesifik önlemin önerilebilir nitelikte olduğu kanıtlanmamıştır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Bir hastada ibuprofen/klorokinin etkisi eş zamanlı treosulfan uygulandığında azalmıştır.
Yüksek doz kemoterapide treosulfanın hiçbir etkileşimi gözlenmemiştir.
Detaylı in vitro çalışmalar treosulfanın yüksek plazma konsantrasyonları ile CYP3A4, CYP2C19 veya P-gp substratları arasında potansiyel etkileşimleri tamamen dışlamamıştır. Bu nedenle, terapötik indeksi dar CYP3A4, CYP2C19 veya P-gp substratları olan tıbbi ürünler treosulfan tedavisi sırasında verilmemelidir.
Treosulfanın fludarabinin farmakokinetiği üzerindeki etkisi bilinmemektedir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik Kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan cinsel aktif kadınlar ve erkekler tedavi süresince ve tedavinin ardından 6 aya kadar etkili doğum kontrolü uygulamak zorundadırlar.
Gebelik dönemi
Treosulfanın gebe kadınlarda kullanımına ilişkin hiçbir veri yoktur. Hayvan çalışmaları üreme toksisitesi açısından yetersizdir (bkz. Bölüm 5.3). Treosulfan gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir. ALLOPRE gebelik döneminde kontrendikedir (bkz. Bölüm 4.3). İnsanlarda Treosulfan ile elde edilen deneyime göre, tüm alkilleyici ajanlar mutajenik potansiyele sahiptir. Eğer tedavi sırasında veya sonrasında gebelik meydana gelirse, genetik danışmanlık olasılığı düşünülmelidir.
Laktasyon dönemi
Treosulfanın anne sütüne geçip geçmediği bilinmemektedir. Bu ürün emziren kadınlarda kullanılmamalıdır.
Üreme yeteneği/ Fertilite
Treosulfan kadınlarda ve erkeklerde fertiliteyi olumsuz etkileyebilir. Geri dönüşsüz infertilite olasılığı nedeniyle erkekler tedaviden önce spermlerinin dondurularak saklanması konusunda hekim tavsiyesi almalıdır.
Hazırlık rejimlerinde kullanılan diğer alkilleyici ajanlar için de bilindiği gibi, treosulfan premenopozal kadınlarda over supresyonu ve amenore ile birlikte menopoz semptomlarına yol açabilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Treosulfan araç ve makine kullanma becerisi üzerinde orta derecede etkiye sahiptir. Treosulfanın bulantı, kusma veya baş dönmesi gibi belirli advers reaksiyonlarının bu işlevleri etkileme olasılığı vardır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Over kanseri
En sık bildirilen istenmeyen etkiler miyelosupresyon ve gastrointestinal şikayetlerdir. Bu olaylar genellikle hafiftir ve treosulfan tedavisinden sonra düzelir. Kemik iliği supresyonu treosulfanın doz sınırlayıcı etkisidir.
Allojenik kök hücre nakli öncesi hazırlık rejimi
Derin miyelosupresyon/pansitopeni hazırlık rejiminin istenen tedavi etkisidir ve tüm hastalarda görülür. Kan hücre sayıları HKHT'den sonra genellikle normale döner.
Treosulfana dayalı hazırlık rejimini takiben allojenik HKHT sonrasında en yaygın biçimde gözlenen advers reaksiyonlar (yetişkinler/pediyatrik hastalar) enfeksiyonlar (%13.1/%11.4), gastrointestinal bozukluklar (bulantı [%39.5/%30.7], stomatit [%36.0/%69.3], kusma [22.5%/43.2%], diyare [%15.6/%33.0], abdominal ağrı [%10.4/%17]), yorgunluk (%15.1/%2.3), febril nötropeni (%11.3/%1.1), ödem (%7.8/%0), döküntü (%7.2/%12.5) ve alanin transaminaz (ALT [%5.1/%9.1]), aspartat transaminaz (AST [%4.4/%8.0]), gama- glutamil transferaz (γGT [%3.7/%2.3]) ve bilirübin (%18.8/%5.7) yükselmelerini içerir.
Advers etkiler tablosu Sıklık
Çok yaygın (≥ 1/10), yaygın (≥ 1/100 ila <1/10), yaygın olmayan (≥ 1/1,000 ila <1/100), seyrek (≥ 1/10,000 ila < 1/1,000), çok seyrek (< 1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Over kanseri
Her bir sıklık gruplamasında, istenmeyen etkiler azalan ciddiyet sırasına göre sunulmaktadır.
Organ Sınıfı | Sıklık |
Enfeksiyonlar ve enfestasyonlar | Yaygın: Enfeksiyonlar (mikotik, viral, bakteriyel)
Çok seyrek: Sepsis |
Neoplazmlar, benign, malign ve tanımlanmamış (kistler ve polipler dahil) | Yaygın olmayan: Tedaviye bağlı sekonder maligniteler (akut non- lenfositik lösemi, miyelodisplastik sendrom, miyelom, miyeloproliferatif bozukluk) |
Kan ve lenf sistemi hastalıkları | Çok yaygın: Miyelosupresyon (lökositopeni, trombositopeni, anemi)
Seyrek: Pansitopeni |
Bağışıklık sistemi hastalıkları | Seyrek: Alerjik reaksiyonlar |
Endokrin hastalıklar | Çok seyrek: Addison hastalığı |
Metabolizma ve beslenme bozuklukları | Çok seyrek: Hipoglisemi |
Sinir sistemi hastalıkları | Çok seyrek: Parestezi |
Kardiyak hastalıklar | Çok seyrek: Kardiyomiyopati |
Solunum, göğüs ve mediastin hastalıkları | Çok seyrek: Pulmoner fibroz, alveolit, pnömoni |
Gastrointestinal hastalıklar | Çok yaygın: Kusma, bulantı |
Deri ve deri altı doku hastalıkları | Çok yaygın: Saç dökülmesi (genellikle hafif), bronz deri pigmentasyonu
Çok seyrek: Skleroderma, psoriazisin tetiklenmesi, eritem, ürtiker |
Böbrek ve idrar yolu hastalıkları | Çok seyrek: Hemorajik sistit |
Genel rahatsızlıklar ve uygulama yerindeki durumlar | Çok seyrek: Grip benzeri şikayetler, lokal ağrılı enflamatuvar reaksiyonlar (ekstravazasyon durumunda) |
Allojenik kök hücre nakli öncesi hazırlık rejimi
Yetişkinler
Advers reaksiyonların tablolaştırılmış listesi
Aşağıdaki tabloda sunulan advers reaksiyonların sıklıkları treosulfan ile fludarabin kombinasyonunun yetişkin hastalarda allojenik HKHT'den önce hazırlık tedavisi olarak araştırıldığı 5 klinik çalışmadan (toplam 564 hastayı içeren) alınmıştır. Treosulfan arka arkaya 3 gün 10-14 g/m² VYA doz aralığında uygulanmıştır.
Sistem Organ Sınıfı (SOC) | Tüm Advers Reaksiyonlar /Sıklık | Derece 3-4 Advers Reaksiyonlar / Sıklık |
Enfeksiyonlar ve enfestasyonlar* | Çok yaygın Enfeksiyonlar (bakteriyel, viral, fungal) Yaygın Sepsis Bilinmiyor Septik şok | Yaygın Enfeksiyonlar (bakteriyel, viral, fungal), sepsis Bilinmiyor Septik şok |
Neoplazmlar, benign, malign ve | Bilinmiyor Tedaviyle ilişkili ikinci malignite | Bilinmiyor Tedaviyle ilişkili ikinci |
tanımlanmamış (kistler ve polipler dahil)* |
| malignite |
Kan ve lenf sistemi hastalıkları* | Çok yaygın Miyelosupresyon, pansitopeni, febril nötropeni | Çok yaygın Miyelosupresyon, pansitopeni, febril nötropeni |
Bağışıklık sistemi hastalıkları* | Yaygın Aşırı duyarlılık |
|
Metabolizma ve beslenme bozuklukları | Yaygın İştah azalması Yaygın olmayan Hiperglisemi Bilinmiyor Asidoz, glukoz tolerans bozukluğu, elektrolit dengesizliği | Yaygın İştah azalması Yaygın olmayan Hiperglisemi Bilinmiyor Asidoz, glukoz tolerans bozukluğu, elektrolit dengesizliği |
Psikiyatrik bozukluklar | Yaygın Uykusuzluk Yaygın olmayan Konfüzyon hali Bilinmiyor Ajitasyon | Seyrek Konfüzyon hali |
Sinir sistemi hastalıkları | Yaygın Baş ağrısı, baş dönmesi Yaygın olmayan Periferik duysal nöropati Bilinmiyor Ensefalopati, intrakranyal kanama, ekstrapiramidal bozukluk, senkop, parestezi | Seyrek Baş ağrısı, Periferik duysal nöropati Bilinmiyor Ensefalopati, intrakranyal kanama, senkop |
Göz hastalıkları | Bilinmiyor Göz kuruluğu |
|
Kardiyak hastalıklar* | Yaygın Kardiyak aritmiler (örn., atriyal fibrilasyon, sinüs aritmisi) Bilinmiyor Kardiyak arrest, kalp yetmezliği, miyokard enfarktüsü, perikardiyal efüzyon | Yaygın olmayan Kardiyak aritmiler (örn., atriyal fibrilasyon, sinüs aritmisi) Bilinmiyor Kardiyak arrest, miyokard enfarktüsü |
Vasküler hastalıklar | Yaygın Hipertansiyon, yüz ve boyunda kızarıklık, kızarma Yaygın olmayan Hematom, hipotansiyon Bilinmiyor Emboli, kanama | Yaygın olmayan Hipertansiyon Bilinmiyor Emboli, kanama |
Solunum, göğüs ve mediastin hastalıkları | Yaygın Dispne, burun kanaması | Yaygın olmayan Dispne, plevra efüzyonu, |
| Yaygın olmayan Pnömonit, plevra efüzyonu, farenks veya larenks enflamasyonu, öksürük, laringeal ağrı, hıçkırık Bilinmiyor Orofaringeal ağrı, hipoksi, disfoni | farenks veya larenks enflamasyonu Seyrek Burun kanaması, pnömonit Bilinmiyor Hipoksi |
Gastrointestinal bozukluklar* | Çok yaygın Stomatit/mukozit, diyare, bulantı, kusma, abdominal ağrı Yaygın Ağız bölgesinde ağrı, gastrit, dispepsi, konstipasyon, disfaji Yaygın olmayan Ağızda kanama, abdominal distansiyon, özofageal veya gastrointestinal ağrı, ağız kuruluğu Bilinmiyor Gastrointestinal kanama, nötropenik kolit, özofajit, anal enflamasyon, ağızda ülserleşme | Yaygın Stomatit/mukozit, diyare, bulantı, abdominal ağrı Yaygın olmayan Kusma, ağız bölgesinde ağrı, disfaji, ağızda kanama, özofageal veya gastrointestinal ağrı Bilinmiyor Gastrointestinal kanama, nötropenik kolit |
Hepatobiliyer hastalıklar* | Yaygın olmayan Veno-oklüzif karaciğer hastalığı, hepatotoksisite Bilinmiyor Karaciğer yetmezliği, hepatomegali, hepatik ağrı | Seyrek Veno-oklüzif karaciğer hastalığı, hepatotoksisite Bilinmiyor Karaciğer yetmezliği |
Deri ve deri altı doku hastalıkları | Yaygın Makulo-papüler döküntü, purpura, eritem, palmar-plantar eritrodisestezi sendromu, kaşıntı, saç dökülmesi Yaygın olmayan Eritema multiforme, akneiform dermatitis, döküntü, aşırı terleme Bilinmiyor Yaygın eritem, dermatit, deri nekrozu veya ülseri, deride hiperpigmentasyon, cilt kuruluğu | Yaygın olmayan Makulo-papüler döküntü, purpura, eritem Bilinmiyor Deri nekrozu |
Kas-iskelet sistemi ve bağ dokusu hastalıkları | Yaygın Ekstremitelerde ağrı, sırt ağrısı, kemik ağrısı, eklem ağrısı, kas ağrısı Bilinmiyor Kas güçsüzlüğü | Seyrek Ekstremitelerde ağrı, kemik ağrısı |
Böbrek ve üriner sistem hastalıkları | Yaygın Akut böbrek hasarı, hematüri Bilinmiyor Böbrek yetmezliği, sistit, dizüri | Yaygın olmayan Akut böbrek hasarı, hematüri |
Genel rahatsızlıklar ve uygulama yerindeki | Çok yaygın Astenik durumlar (yorgunluk, asteni, | Yaygın Yorgunluk |
durumlar | letarji) Yaygın Ödem, pireksi, üşüme Yaygın olmayan Kalple ilişkili olmayan göğüs ağrısı, ağrı Bilinmiyor Enjeksiyon bölgesinde reaksiyon, üşüme hissi | Seyrek Kalple ilişkili olmayan göğüs ağrısı, ödem, pireksi |
Araştırmalar | Çok yaygın | Yaygın |
| Bilirübin artışı | Bilirübin artışı, |
| Yaygın | transaminazlarda (ALT/AST) |
| Transaminazlarda (ALT/AST) | yükselme, γGT artışı |
| yükselme, γGT artışı, kanda alkalin | Yaygın olmayan |
| fosfataz artışı, C-reaktif protein | Kanda alkalin fosfataz artışı, |
| artışı, kilo kaybı, kilo artışı | C-reaktif protein artışı |
| Bilinmiyor | Bilinmiyor |
| Kanda kreatinin düzeyinde artış, | Kanda LDH artışı |
| kanda laktat dehidrojenaz (LDH) |
|
| düzeyinde artış |
|
* Aşağıdaki detaylı bölümlere bakınız
Seçili advers reaksiyonların tarifi Enfeksiyonlar
Enfeksiyonların toplam insidansı %13.1'di (74/564). En sık görülen enfeksiyon türü akciğer enfeksiyonuydu (12/74 [%16.2]). Patojenler bakterileri (örn., Staphylococcus, Enterococcus, Corynebacterium), virüsleri (örn., sitomegalovirüs [CMV], Epstein-Barr virüsü [EBV], herpes) ve mantarları (örn., Candida) içermiştir. Enfeksiyon oranı -4. günden -2.güne kadar günde 10 g/m² treosulfan doz rejimiyle tedavi edilen hastalarda en düşüktü (%7.7).
Benign, malign ve tanımlanmamış neoplazmlar (kistler ve polipler dahil)
564 yetişkin hastadan 1'inde (%0.2) ikinci bir malignite (meme kanseri) gelişmiştir. Treosulfana dayalı hazırlık rejiminden sonra az sayıda ikinci malignite vakası başka araştırmacılar tarafından raporlanmıştır. Solid tümörleri olan hastalarda oral treosulfanın klasik dozlarıyla uzun süreli tedaviden sonra 553 hastanın %1.4'ünde akut miyeloid lösemi gözlenmiştir.
Kan ve lenf sistemi hastalıkları
Kan hastalıkları 564 yetişkin hastadan 67'sinde (%11.9) gözlenmiştir. En sık görülen advers reaksiyon febril nötropeniydi (%11.3). En düşük insidans -4.günden -2.güne kadar uygulanan günde 10 g/m² doz rejimiyle kaydedilmiştir (%4.1).
Medyan (%25/%75 persentiller) nötropeni süresi 10 g/m² treosulfan dozuyla 14 (12, 20) gün
ve 14 g/m² treosulfan dozuyla 17.5 (14, 21) gündü.
Kardiyak hastalıklar
25 hastada (%4.4) kardiyak hastalıklar gözlenmiştir. En sık raporlanan advers reaksiyonlar atriyal fibrilasyon (%1.2), sinüs taşikardisi (%0.9), supraventriküler taşikardi (%0.4) ve ventriküler ekstrasistolü (%0.4) içeren kardiyak aritmilerdi. Kardiyak arrest, kalp yetmezliği ve miyokard enfarktüsünün tekli vakaları bildirilmiştir. Kardiyak hastalıkların en düşük sıklığı
-4.günden -2.güne kadar uygulanan günde 10 g/m² doz rejimiyle gözlenmiştir (%2.7).
Gastrointestinal bozukluklar
Gastrointestinal hastalıklar 357 hastada (%63.3) gözlenmiştir. En sık bildirilen advers reaksiyonlar bulantı (%39.5), stomatit (%36), kusma (%22.5), diyare (%15.6) ve abdominal ağrıydı (%10.4). Bu advers reaksiyonların en düşük sıklıkları -4.günden -2.güne kadar uygulanan günde 10 g/m² doz rejimiyle görülmüştür (sırasıyla %20.4, %30.3, %13.1, %5.0 ve
%5.5).
Hepatobiliyer hastalıklar
Veno-oklüzif karaciğer hastalığının (VOH) toplam insidansı %0.9'du (5/564). VOH yalnızca günde 14 g/m² doz rejimiyle meydana gelmiştir. Bu vakaların hiçbiri ölümle sonuçlanmamış veya hayati tehlikeye yol açmamıştır.
Pediyatrik popülasyon
Advers reaksiyonların tablolaştırılmış listesi
Aşağıdaki tabloda sunulan advers reaksiyonlar malign veya non-malign hastalıkları olan pediyatrik hastalara treosulfanın fludarabin ile birlikte (ve çoğunlukla ilave olarak tiyotepa ile) allojenik HKHT'den önce hazırlık tedavisi olarak uygulandığı toplam 88 hastayı içeren iki klinik çalışmadan elde edilmiştir (medyan yaş 8 [aralık 0â17 yaş]). Treosulfan arka arkaya üç gün 10-14 g/m² VYA doz aralığında uygulanmıştır.
Sistem Organ Sınıfı (SOC) | Tüm Advers Reaksiyonlar /Sıklık | Derece 3-4 Advers Reaksiyonlar / Sıklık |
Enfeksiyonlar ve enfestasyonlar* | Çok yaygın Enfeksiyonlar (bakteriyel, viral, fungal) | Yaygın Enfeksiyonlar (bakteriyel, viral, fungal) |
Neoplazmlar, benign, malign ve tanımlanmamış (kistler ve polipler dahil)* | Bilinmiyor Tedaviyle ilişkili ikinci malignite | Bilinmiyor Tedaviyle ilişkili ikinci malignite |
Kan ve lenf sistemi hastalıkları* | Çok yaygın Miyelosupresyon, pansitopeni Bilinmiyor Febril nötropeni | Çok yaygın Miyelosupresyon, pansitopeni Bilinmiyor |
|
| Febril nötropeni |
Metabolizma ve beslenme bozuklukları | Bilinmiyor Alkaloz, elektrolit dengesizliği, hipomagnezemi | Bilinmiyor Alkaloz |
Sinir sistemi hastalıkları* | Bilinmiyor Baş ağrısı, parestezi, nöbet | Bilinmiyor Parestezi |
Göz hastalıkları | Bilinmiyor Konjunktiva kanaması, göz kuruluğu |
|
Vasküler hastalıklar | Bilinmiyor Kapiler sızıntı sendromu, hipertansiyon, hipotansiyon | Bilinmiyor Kapiler sızıntı sendromu, hipertansiyon, hipotansiyon |
Solunum, göğüs ve mediastin hastalıkları | Yaygın Orofaringeal ağrı, burun kanaması Bilinmiyor Hipoksi | Bilinmiyor Hipoksi |
Gastrointestinal hastalıklar* | Çok yaygın Stomatit/mukozit, diyare, bulantı, kusma, abdominal ağrı Yaygın Disfaji, ağız bölgesinde ağrı Bilinmiyor Nötropenik kolit, anal enflamasyon, dispepsi, proktit, gastrointestinal ağrı, konstipasyon | Çok yaygın Stomatit/mukozit, bulantı Yaygın Disfaji, diyare, kusma, abdominal ağrı Bilinmiyor Nötropenik kolit |
Hepatobiliyer hastalıklar | Bilinmiyor Veno-oklüzif karaciğer hastalığı, hepatomegali, hepatotoksisite | Bilinmiyor Veno-oklüzif karaciğer hastalığı |
Deri ve deri altı doku hastalıkları | Çok yaygın Kaşıntı Yaygın Eksfoliyatif dermatit, makulo- papuler döküntü, döküntü, eritem, cilt ağrısı, deride hiperpigmentasyon, saç dökülmesi Bilinmiyor Deri ülseri, eritema multiforme, ürtiker, büllöz dermatit, akneiform dermatit, palmar-plantar eritrodisestezi sendromu, bebek bezi dermatiti | Yaygın Eksfoliyatif dermatit, makulo-papuler döküntü, eritem |
Kas-iskelet sistemi ve bağ dokusu hastalıkları | Bilinmiyor Ekstremitelerde ağrı |
|
Böbrek ve üriner sistem hastalıkları | Bilinmiyor Akut böbrek hasarı, böbrek yetmezliği, nonenfektif sistit | Bilinmiyor Akut böbrek hasarı, böbrek yetmezliği |
Üreme sistemi ve meme hastalıkları | Bilinmiyor Skrotal eritem |
|
Genel rahatsızlıklar ve uygulama yerindeki durumlar | Çok yaygın Pireksi Bilinmiyor Üşüme, yorgunluk, ağrı |
|
Tetkikler | Yaygın Transaminazlarda (ALT/AST) yükselme, bilirübin artışı Bilinmiyor γGT artışı | Yaygın Bilirübin artışı Yaygın olmayan Transaminazlarda (ALT/AST) yükselme Bilinmiyor γGT artışı |
* Aşağıdaki detaylı bölümlere bakınız
Seçili advers reaksiyonların tarifi Enfeksiyonlar
88 pediyatrik hastada enfeksiyonların toplam insidansı %11.4'dü (10/88) ve yetişkin hastalardaki insidans ile benzerdi. Enfeksiyon sıklığı 12â17 yaş arası pediyatrik yaş grubunda (6/35 [%17.1]) daha küçük çocuklara kıyasla daha yüksekti (4/53 [%7.5]).
Benign, malign ve tanımlanmamış neoplazmlar (kistler ve polipler dahil)
Treosulfana dayalı hazırlık tedavisinden sonra ikinci bir maligniteye ilişkin beş vaka (miyelodisplastik sendrom, akut lenfoblastik lösemi, Ewing sarkomu) başka araştırmacılar tarafından raporlanmıştır. Beş pediyatrik hastanın tümü primer immün yetmezlikler yani neoplazi riski zaten artmış olan hastalıklar için allojenik HKHT almıştır.
Kan ve lenf sistemi hastalıkları
Medyan (%25/%75 persentiller) nötropeni süresi malign hastalıkları olan pediyatrik
hastalarda 21 (16, 26) gün ve non-malign hastalıkları olan hastalarda 24 (17, 26) gündü.
Sinir sistemi hastalıkları
88 pediyatrik hastadan 1'inde ensefalit enfeksiyonu kapsamında nöbet bildirilmiştir. Primer immün yetmezlikleri olan çocuklarda yürütülen, araştırmacı tarafından başlatılan bir çalışmadan alınan bir rapor treosulfana dayalı diğer hazırlık rejimlerinden sonra meydana gelen 4 nöbet vakasını listelemektedir (bkz. Bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Treosulfanın esas toksik etkisi derin miyeloablasyon ve pansitopenidir. Ek olarak asidoz, deri toksisitesi, bulantı, kusma ve gastrit ortaya çıkabilir. Hematopoetik kök hücre transplantasyonu yokluğunda, önerilen treosulfan dozu doz aşımı teşkil edecektir. Treosulfan doz aşımının spesifik hiçbir antidotu bilinmemektedir. Hematolojik durum yakından izlenmeli ve yoğun destekleyici önlemler tıbben endike olan şekilde alınmalıdır.
Uzun süreli veya aşırı terapötik dozlar, nadiren geri dönüşü olmayan kemik iliği depresyonu ile sonuçlanabilir. Tıbbi ürün geri çekilmeli ve kan transfüzyonu ile birlikte genel destekleyici önlemler uygulanmalıdır.
Tıbbi ürünün kazayla gözlerle temas etmesini önlemek için tedbirler alınmalıdır. Çözeltinin ciltle veya gözlerle temas etmesi halinde, etkilenen bölge bol miktarda su veya normal serum fizyolojik ile yıkanmalıdır. Ciltteki geçici batma hissini yatıştırmak için tahriş etmeyen bir krem kullanılabilir. Gözler etkilenirse bir hekime başvurulmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, alkilleyici ajanlar, alkil sülfonatlar
ATC kodu: L01 AB02
Etki mekanizması
Treosulfan hematopoetik öncül hücrelerde sitotoksik aktiviteye sahip çift fonksiyonlu bir alkilleyici ajanın bir ön ilacıdır. Treosulfanın aktivitesi bir monoepoksit ara maddesine ve L- diepoksibütana spontan dönüşüme bağlıdır (bkz. Bölüm 5.2).
Oluşan epoksitler deoksiribonükleik asidin (DNA) nükleofilik merkezlerini alkiller ve kök hücrelerin tüketiminden ve antineoplastik etkilerden sorumlu olduğu düşünülen DNA çapraz bağlarını indükler.
İlk önce oluşan monoepoksidin in vivo koşullarda DNA'nın nükleofilik bir merkezini alkilleyebildiği önemlidir. Bu alkilasyon ikinci epoksit halkası oluşmadan önce bileşiği kimyasal reaksiyonla bu merkeze sabitler.
Farmakodinamik etkiler
Treosulfan geniş kapsamlı antineoplastik ve antilösemik aktiviteye sahiptir. Antineoplastik aktivite transplantasyon yapılmış fare ve sıçanlarda lenfomalar/lösemiler, sarkomalar ve hepatomlar, insan tümör zenograftları, insan tümör biyopsileri ve hücre dizilerine karşı gösterilmiştir. Treosulfan intraperitoneal, intravenöz ve ayrıca oral yolla uygulandığında in vivo etkilidir.
Treosülfanın immünosupresif etkileri, ilkel ve kararlı progenitör hücrelere, T ve NK hücrelerine karşı toksisitesine, primer ve sekonder lenfatik organların hücreselliğinin azalmasına ve Graft-versus-Host-Hastalığı'nın (GvHD) gelişiminden önce gelen ve ilgili olan 'sitokin fırtınası' üzerindeki önleyici etkisine bağlanır ve venooklusif hastalığın patogenezinde yer alır.
Klinik etkinlik ve güvenlilik
Over Kanseri
Sisplatin ile kombinasyonda treosulfanın klinik etkinliği büyük bir randomize klinik çalışmada over kanserli hastalarda gösterilmiştir. Toplam 519 hasta sisplatin (70 mg/m²) ile birlikte treosulfan (5 g/m²; PT rejimi) veya siklofosfamid (1 g/m²; PC rejimi) almak üzere randomize edilmiştir.
Her iki rejim 4 haftalık aralıklarla verilmiştir. Medyan 5 yıl takipten sonra, 366 hasta (PC: 179; PT: 187) etkinlik ve 290 hasta (PC: 135; PT: 155) güvenlilik yönünden değerlendirilebilmiştir.
Progresyona kadar geçen medyan süre (primer sonlanım noktası) sisplatin/treosulfan kombinasyonuyla daha uzun olmuştur (20.6 aya karşı 15.1 ay); ancak bu fark istatistiksel olarak anlamlı değildi (P = 0.3).
Her iki tedavi rejimi arasında yanıt oranları bakımından farklar saptanmamıştır.
Genel sağkalım tedavi kolları arasında farklı bulunmamıştır (29.4 aya karşı 33.5 ay; P = 0.8). PC kolunda anlamlı olarak daha fazla saç dökülmesi gözlenirken (P = 0.0001), PT kolunda daha fazla lökositopeni gözlenmiştir (P = 0.01). Treosulfan içeren rejimle tedavi edilen hastalarda yaşam kalitesi daha iyiydi.
Treosulfan monoterapisinin (5 - 7 g/m²; 4 haftada bir) intravenöz uygulanmasının etkinliği ilerlemiş over kanseri olan, daha önce tedavi almış 88 hastada (etkinlik yönünden 80'i değerlendirilebilmiştir) yürütülen bir faz II çalışmada gösterilmiştir. İki tam yanıt ve 13 kısmi yanıt saptanmış ve objektif yanıt oranı %19 bulunmuştur. Yanıt veren hastalarda medyan sağkalım süresi 41 aydı. Hastaların %34'ünde hastalık stabildi ve medyan sağkalım süresi 18 aydı.
Primer tedaviden sonraki 12 ayda progresif hastalık sergileyen 48 kadında %19'luk yanıt oranı ve %31'inde stabil hastalığa ulaşılabilmiştir. Toksik yan etkiler seyrek görülmüş ve orta şiddette olmuştur. Yaşamı tehdit eden miyelosupresyon, tedaviye dirençli emezis ve saç dökülmesi gözlenmemiştir.
Allojenik kök hücre nakli öncesi hazırlık rejimi
Referans niteliğindeki faz III çalışmada, akut miyeloid lösemi (AML) veya miyelodisplastik sendromu (MDS) olan ve daha ileri yaş (≥ 50 yaş) veya komorbiditeler (hematopoetik hücre transplantasyonu komorbidite indeksi [HCT-CI] skoru >2) nedeniyle standart hazırlık tedavileri için artmış risk taşıyan yetişkin hastalar 3 à 10 g/m² treosulfan ile birlikte fludarabin (FT; n = 220) içeren bir hazırlık rejimi veya intravenöz busulfan (toplam dozSaklamaya yönelik özel tedbirler tedbirler mg/kg) ile birlikte fludarabin (FB2; n = 240) rejimini takiben allojenik HKHT almak üzere randomize edilmiştir. Hastaların %64'ünde AML ve %36'sında MDS mevcuttu. Hastaların medyan yaşı 60'dı (aralık 31â70 yaş); hastaların %25'i 65 yaş üzeriydi.
Bu çalışmanın birincil sonlanım noktası 2 yıl sonra olaysız sağkalımdı (EFS). Olaylar hastalık relapsı, greft yetmezliği veya ölüm (hangisi önce gerçekleşirse) olarak tanımlanmıştır. FTrejiminin referans FB2'den daha geride olmadığı (non-inferiorite) istatistiksel olarak kanıtlanmıştır (Şekil 1).
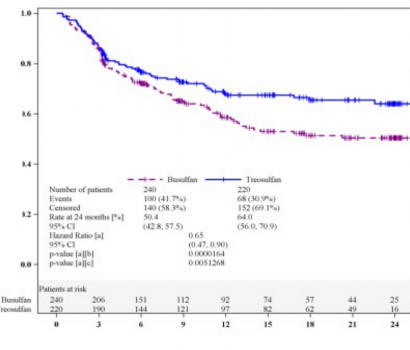
Risk altındaki hastalar
Zaman (aylar)
Olaysız sağkalım oranı
Şekil 1: Olaysız sağkalıma ilişkin Kaplan-Meier tahminleri (Tam Analiz Seti)
Önceden tanımlanmış çeşitli alt gruplarda (donör tipi, risk grubu, hastalık, yaş grubu, HCT-CI skoru, çalışmaya girişte remisyon durumu ve bu parametrelerin çeşitli kombinasyonları)
2.yılda yapılan EFS analizleri sadece bir istisnayla (MDS hastalarının oluşurduğu risk grubu I; HR 1.14 [%95 GA 0.48, 2.63]) her zaman treosulfan rejiminin lehine bulunmuştur (FB2'ye göre FTtehlike oranı [HR] <1),.
Detaylı sonuçlar Tablo 1'de sunulmaktadır.
Tablo 1: 24.aydaki tedavi sonuçları (Tam analiz seti)
Parametre | Treosulfan | Busulfan | Tehlike oranı (%95 GA) | P değeri |
Hasta sayısı | 220 | 240 |
|
|
Genel sağkalım; % (%95 GA) | 71.3 (63.6, 77.6) | 5Saklamaya yönelik özel tedbirler tedbirler (48.4, 63.6) | 0.61 (0.42, 0.88) | 0.0082 |
Kümülatif relaps/progressyon insidansı; % (%95 GA) | 24.6 (17.8, 31.3) | 23.3 (17.6, 29.0) | 0.87 (0.59, 1.30) | 0.5017 |
Nakille ilişkili mortalitenin kümülatif insidansı; % (%95 GA) |
12.1 (8.1, 17.7) |
28.2 (21.4, 36.5) |
0.54 (0.32, 0.91) |
0.0201 |
GvHD sonuçları Tablo 2'de gösterilmektedir.
Tablo 2: Kümülatif GvHD insidansı (Tam analiz seti)
Parametre | Treosulfan | Busulfan | P değeri |
Hasta sayısı | 220 | 240 |
|
Akut GvHD, tüm Dereceler; % (%95 GA) | 52.1 (45.5, 58.7) | 58.8 (52.5, 65.0) | 0.1276 |
Akut GvHD, Derece III/IV; % (%95 GA) | 6.4. Saklamaya yönelik özel tedbirler(3.2, 9.6) | 9.6 (5.9, 13.3) | 0.2099 |
Kronik GvHD; % (%95 GA) | 60.1 (49.8, 70.3) | 60.7 (53.1, 68.4) | 0.5236 |
Yaygın kronik GvHD; % (%95 GA) | 18.4 (12.0, 24.8) | 26.1 (19.2, 33.1) | 0.1099 |
Non-malign hastalıkları (NMH) olan yetişkin hastalarda treosulfana dayalı hazırlık rejimine (FTrejimi ± tiyotepa; bkz. Bölüm 4.2) ilişkin sınırlı bilgi mevcuttur. NMH'li yetişkin hastalarda treosulfan hazırlık rejimiyle allojenik HKHT için ana endikasyonlar hemoglobinopatilerdir (örn., orak hücre hastalığı, talasemi major [TM]), primer immün yetmezlik, hemofagositik bozukluk, immün regülasyon bozukluğu ve kemik iliği yetmezliği).
Bir çalışmada NMH'li 31 hasta FTrejimi ve anti-timosit globulin ile tedavi edilmiştir. Hastaların yaşı 0.4 ile 30.5 arasında değişiyordu ve %29'unun HCT-CI skorları > 2'ydi. Tüm hastalara greftleme yapılmıştı ve nötrofil greftlemesine kadar geçen medyan süre 21 gündü (aralık, 12â46). Öngörülen iki yıllık genel sağkalım oranı %90'dı. Klinik semptomlar ve laboratuvar tetkikleriyle ölçülen tam hastalık yanıtları 28 hastada (%90) gözlenmiştir (Burroughs LM et al., Biology of Blood and Marrow Transplantation 2014; 20(12):1996- 2003).
İtalya'daki bir grup araştırmacı 60 TM hastasını (yaş aralığı 1-37; 12 yetişkin dahil) FTve
tiyotepa rejimiyle tedavi etmiştir. Bir hasta hariç tüm hastalara greftleme yapılmış ve bu hasta
+11.gün ölmüştür; nötrofil ve trombositlerin toparlanmasına kadar geçen medyan süre 20 gündü. Medyan 36 aylık takip süresiyle (aralık, 4-73), 5 yıllık genel sağkalım olasılığı %93 (%95 GA %83-97) bulunmuştur. Çocuklar ve yetişkinler arasında sonuç bakımından hiçbir fark gözlenmemiştir (Bernardo ME et al.; Blood 2012; 120(2):473-6).
Yetişkin hastalarda treosulfana dayalı hazırlık rejimini (n = 16) busulfana dayalı hazırlık rejimiyle (n = 81) karşılaştıran geriye dönük bir çalışma oldukça benzer sağkalım oranlarını ortaya koymuştur (%70.3 ± 15.1'e karşı %69.3 ± 5.5); bununla birlikte akut GvHD riski treosulfan grubunda daha düşüktü (olasılık oranı 0.28; %95 GA 0.12-0.67; P = 0.004) (Caocci G et al.; American Journal of Hematology 2017; 92(12):1303-1310).
Pediyatrik popülasyon
Treosulfana dayalı hazırlık rejiminin etkinliği ve güvenliliği tiyotepa ile birlikte (n = 65) veya tiyotepa olmaksızın (n = 5) treosulfan ve fludarabin içeren bir hazırlık rejimi alan akut lenfoblastik lösemi (ALL), AML, MDS veya juvenil miyelomonositik lösemisi (JMML) olan
70 hastada değerlendirilmiştir (bkz. Bölüm 4.2). Toplam 37 hasta (%52.9) 12 yaşından
küçüktü.
Hiçbir hasta primer greft yetmezliği yaşamamış ancak ALL'li bir hastada sekonder greft yetmezliği gelişmiştir. Tam donör tipi kimerizm insidansı +28.gündeki vizitte %94.2 (%90
GA %87.2-98.0), +100.gündeki vizitte %91.3 (%90 GA %83.6-96.1) ve 12.aydaki vizitte
%91.2 (%90 GA %82.4-96.5) olarak saptanmıştır.
12.ayda genel sağkalım %91.4'dür (%90 GA %83.9-95.5). 70 hastadan toplam 7'si (%10.0) ölmüştür; ölüm nedeni iki hastada relaps/progresyon, üç hastada transplantasyonla ilişkili bir neden ve geri kalan iki hastada başka nedenlerdi. HKHT'den sonra +100.güne kadar nakille ilişkili mortalite yokluğu (birincil sonlanım noktası) oranı %98.6'dır (%90 GA %93.4â99.7) çünkü 70 hastadan biri HKHT'den sonra +100.güne kadar nakil/tedaviyle ilişkili bir nedenle ölmüştür. 12.ayda nakille ilişkili mortalite oranı %2.9'dur (%90 GA %0.9 â8.9). 11 hasta relaps/progresyon yaşamıştır. Kümülatif relaps/progresyon insidansı +12.ayda %15.7'dir (%90 GA %8.6-22.9).
5.2. Farmakokinetik özellikler
Genel özelliklerTreosulfan fizyolojik koşullarda (pH 7.4; 37 °C) bir monoepoksit ara maddesine ve L- diepoksibütana kendiliğinden dönüşen ve yarı ömrü 2.2 saat olan bir ön ilaçtır.
Emilim:
Treosulfanın oral emilimi mükemmeldir ve biyoyararlanımı %100'e yakındır.
İntravenöz uygulamadan sonra, pik plazma düzeylerine infüzyon süresinin sonunda ulaşılır. Yetişkin hastalarda 10, 12 veya 14 g/m² treosulfan 2 saatlik infüzyonla verildikten sonra maksimum plazma düzeyleri (ortalama ± SD) sırasıyla 306 ± 94 µg/mL, 461 ± 102 µg/mL ve 494 ± 126 µg/mL'ydi.
Dağılım:
İntravenöz uygulamadan sonra treosulfan vücutta hızla dağılır; ancak treosulfanın kan-beyin bariyerinden geçişi oldukça sınırlıdır (bkz. Bölüm 5.3). Yetişkin hastalarda dağılım hacmi yaklaşık 20â30 litredir. Arka arkaya üç gün boyunca önerilen günlük tedaviyle doz birikimi gözlenmemiştir. Treosulfan plazma proteinlerine bağlanmaz.
Biyotransformasyon:
Fizyolojik koşullarda (pH 7.4, sıcaklık 37 °C), treosulfanın farmakolojik yönden inaktif treosulfan aktif monoepoksit ara maddesine (S,S-EBDM = (2S,3S)-1,2-epoksibütan-3,4-diol- 4-metan sülfonat) ve son olarak da L-diepoksibütana (S,S-DEB = (2S,3S)-1,2:3,4- diepoksibütan) spontan olarak (enzimatik olmayan biçimde) dönüşür.
100 µM'ye kadar konsantrasyonlarda, treosulfan CYP1A2, 2C9, 2C19, 2D6 veya 3A4'ün aktiviteleri üzerinde in vitro hiçbir kesin etkiye sahip değildir. Dolayısıyla treosulfanın in vivo koşullarda CYP450 aracılı potansiyel etkileşimlere katılması veya katkıda bulunması olasılığı yoktur.
Eliminasyon:
Over kanseri
İntravenöz yolla uygulanan treosulfanın (8 g/m²) ortalama (± SD) terminal yarı-ömrü (t1/2Ã)
1.94 ± 0.99 saattir ve değişmemiş treosulfanın kümülatif renal eliminasyonu yaklaşık %25'dir (aralık, %5-%49).
Allojenik kök hücre nakli öncesi hazırlık rejimi
Treosulfanın plazma konsantrasyonları üssel biçimde katlanarak azalır ve iki kompartmanlı modele uyan, birinci dereceden eliminasyon süreciyle en iyi şekilde tarif edilir.
İntravenöz yolla uygulanan treosulfanın (47 g/m²'ye kadar) terminal yarı ömrü (T) yaklaşık 2 saattir. Treosulfan dozunun yaklaşık %25â40'ı 24 saat içinde idrarla değişmeden atılır ve yaklaşık %90'ı uygulamadan sonraki ilk 6 saatte atılır.
Doğrusallık/doğrusal olmayan durum
Treosulfan dozuna karşı işaretlenen grafikte eğri altında kalan alanın (EAA) regresyon analizi doğrusal bir korelasyonu göstermiştir.
Böbrek ve karaciğer fonksiyon bozukluğu
Ağır böbrek veya karaciğer yetmezliği olan hastalarda treosulfan ile hiçbir farmakokinetik çalışması yapılmamıştır çünkü bu tür hastalara genellikle allojenik HKHT uygulanmaz. Treosulfanın yaklaşık %25â40'ı idrarla atılır; bununla birlikte treosulfanın böbrek klirensi üzerinde böbrek fonksiyonunun bir etkisi gözlenmemiştir.
Pediyatrik popülasyon
Basitçe VYA'ya dayanan klasik doz hesaplamaları ergenler veya yetişkinlere kıyasla düşük VYA'lı bebekler ve küçük yaştaki çocuklarda anlamlı olarak daha yüksek maruz kalıma (EAA) yol açar. Bu nedenle, pediyatrik hastalarda treosulfan dozajının VYA'ya göre ayarlanması gerekir (bkz. Bölüm 4.2).
Treosulfanın ortalama belirgin terminal yarı ömrü farklı yaş grupları arasında benzer bulunmuş ve 1.3 - 1.6 saat arasında değişmiştir.
5.3. Klinik öncesi güvenlilik verileri
Alkilleyici etki mekanizması nedeniyle treosulfan, kanserojen potansiyele sahip genotoksik bir bileşik olarak karakterize edilir. Hayvanlarda treosulfan üzerinde spesifik üreme ve gelişimsel toksisite çalışmaları yapılmamıştır. Bununla birlikte, sıçanlarda yapılan kronik toksisite testleri sırasında spermatogenez ve yumurtalık fonksiyonu önemli ölçüde etkilenmiştir. Yayınlanmış literatür verileri, puberte öncesi ve puberte erkek ve dişi farelerde treosulfanın gonadotoksisitesini raporlar.
Fare ve sıçanların L-diepoksibütan (treosulfanın alkilleyici transformasyon ürünü) ile tedavisine ilişkin yayınlanmış veriler, doğurganlık, rahim-yumurtalık ve sperm gelişiminde bozulma olduğunu ortaya çıkarmıştır.
Jüvenil hayvan çalışmaları
Jüvenil sıçan toksisite çalışmalarında treosulfan, fiziksel gelişmede hafif bir gecikmeye ve dişilerde biraz gecikmeli bir vajinal açılma zaman noktasına neden olmuştur. Sıçanlarda treosulfan tarafından çok düşük bir kan-beyin bariyeri penetrasyonu gözlenmiştir. Beyin dokusundaki treosulfan konsantrasyonları plazmadakinden %95-98 daha düşük olmuştur. Bununla birlikte, genç sıçanların beyin dokusunda genç yetişkinlere kıyasla yaklaşık 3 kat daha yüksek maruziyet bulunmuştur.
Akut toksisite
Farelerde oral LDvücut ağırlığının kg'ı başına 3360 mg treosulfandır ve intravenöz LD
vücut ağırlığının kg'ı başına >2500 mg treosulfandır.
Sıçanlarda oral LDvücut ağırlığının kg'ı başına 2575 mg treosulfan ve intraperitoneal LDvücut ağırlığının kg'ı başına > 2860 mg treosulfandır.
Subakut toksisite
Subakut bir doz (56-111 mg/kg/gün) alan maymunlarda hematopoetik sistem hasar görmüştür. Daha yüksek dozlarda (222-445 mg/kg/gün) diyare, anoreksi ve belirgin vücut ağırlığı kaybı da kaydedilmiştir.
Kronik toksisite
Treosulfanın sıçanlara yedi ay boyunca uygulanması erkek sıçanlarda spermiyogenezde azalmaya ve dişi sıçanlarda menstrüel siklus bozukluklarına yol açmıştır. Diğer tüm organlarda hiçbir değişiklik olmamıştır.
Tümörijenik ve mutajenik potansiyel
Oral treosulfan dozlarıyla uzun süreli tedavide hastaların %1.4'ünde akut non-lenfositik lösemi gözlenmiştir. Alkilleyici özellikler taşıyan diğer sitostatik ajanlarda olduğu gibi treosulfan da mutajenik potansiyele sahiptir. Bu nedenle çocuk sahibi olma potansiyeli bulunan kadın hastaların tedavi süresince etkili kontrasepsiyon uygulamaları zorunludur.
Üreme toksisitesi
Treosulfan hayvan çalışmalarında üreme toksisitesi yönünden test edilmemiştir. Bununla birlikte, sıçanlarda kronik toksisite testleri sırasında gecikmiş spermiyogenez ve korpora lutea ve folikül yokluğu saptanmıştır.
Sitotoksik preparatlar gebe olabilecek personel tarafından hazırlanmamalıdır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Yok
6.2. Geçimsizlikler
Bu tıbbi ürün Bölüm 6.6'da belirtilenler dışında diğer tıbbi ürünler ile karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
Sulandırılmış çözeltiler
Çökelti oluşumuna neden olabileceğinden, sulandırılmış ürünü buzdolabında saklamayınız (2
- 8°C). Çökelti belirtileri gösteren çözeltiler kullanılmamalıdır. Buzdolabında saklamayınız.
Kullanım sırasında kimyasal ve fiziksel stabilite 30°C'de 12 saat için gösterilmiştir. Mikrobiyolojik açıdan, hazırlama yöntemi mikrobiyolojik kontaminasyon riskini ortadan kaldırmıyorsa ürün hemen kullanılmalıdır. Hemen kullanılmaması halinde kullanım anındaki saklama süreleri ve koşulları kullanıcının sorumluluğundadır.
6.4. Saklamaya yönelik özel tedbirler
(3.2, 9.6)
25°C altındaki oda sıcaklığında saklayınız.
Tıbbi ürün sulandırıldıktan sonraki saklama koşulları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
20 mm geçmeli kapaklı, 20 mm bromobütil kauçuk tıpayla kapatılmış kalıplanmış, liyofilize
edilmiş, renksiz 100 ml Tip-I cam flakon.
Flakonlar plastik shrink sleeve/taban (destek) ile giydirilmiş olabilir veya olmayabilir. Bu plastik kaplama müstahzar ile temas etmez ve sevkiyat sırasında ilave koruma sağlama amacını taşır. Bu, tıbbi ürünün hem sağlık mesleği mensupları hem de ilaç personeli tarafından güvenli uygulanmasını arttırır.
ALLOPRE 1 veya 5 flakon içeren karton kutularda takdim edilmektedir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
ALLOPRE 100 ml enjeksiyonluk suda çözdürüldükten sonra intravenöz infüzyon için kullanılır.
Sulandırılan çözelti berrak, renksiz bir çözeltidir.
Kullanımdan önce çözeltiyi gözle kontrol ediniz. Yalnızca içerisinde partiküller bulunmayan berrak çözeltiler kullanılmalıdır.
Çökelti belirtileri gösteren sulandırılmış çözeltiler kullanılmamalı ve tehlikeli atıkların bertaraf edilmesine ilişkin yasal zorunluluklara uygun şekilde imha edilmelidir (bkz. aşağı).
Tek kullanımlıktır; kullanılmayan flakon içeriğini atınız.
âSitotoksik ve sitostatik beşeri tıbbi ürünlerin kullanımları sonucu boşalan iç ambalajlarının atıkları TEHLİKELİ ATIKTIR ve bu atıkların yönetimi 2/4/2015 tarihli ve 29314 sayılı Resmî Gazetede yayımlanan Atık Yönetimi Yönetmeliğine göre yapılırâ
Tüm sitotoksik maddeler için olduğu gibi, ALLOPRE'nin hazırlanması sırasında uygun önlemler alınmalıdır.
Antineoplastik ajanların güvenli hazırlanmasına dair talimatlar:
Tıbbi ürünü eğitimli personel hazırlamalıdır.
Sitotoksik ilaçların hazırlanmasında kullanılan araç-gereçlerin (enjektörler, iğneler vb.) bertaraf edilmesinde uygun önlemler alınmalı ve dikkatli olunmalıdır.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Ideogen İlaç Sanayi A.Ş
| Satış Fiyatı | 45712.01 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 45712.01 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680952000062 |
| Etkin Madde | Treosulfan |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |