ALLOPRE 5 G infüzyonluk çözelti hazırlamak için toz (5 flakon) Farmakolojik Özellikler
{ Treosulfan }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, alkilleyici ajanlar, alkil sülfonatlar
ATC kodu: L01 AB02
Etki mekanizması
Treosulfan hematopoetik öncül hücrelerde sitotoksik aktiviteye sahip çift fonksiyonlu bir alkilleyici ajanın bir ön ilacıdır. Treosulfanın aktivitesi bir monoepoksit ara maddesine ve L- diepoksibütana spontan dönüşüme bağlıdır (bkz. Bölüm 5.2).
Oluşan epoksitler deoksiribonükleik asidin (DNA) nükleofilik merkezlerini alkiller ve kök hücrelerin tüketiminden ve antineoplastik etkilerden sorumlu olduğu düşünülen DNA çapraz bağlarını indükler.
İlk önce oluşan monoepoksidin in vivo koşullarda DNA'nın nükleofilik bir merkezini alkilleyebildiği önemlidir. Bu alkilasyon ikinci epoksit halkası oluşmadan önce bileşiği kimyasal reaksiyonla bu merkeze sabitler.
Farmakodinamik etkiler
Treosulfan geniş kapsamlı antineoplastik ve antilösemik aktiviteye sahiptir. Antineoplastik aktivite transplantasyon yapılmış fare ve sıçanlarda lenfomalar/lösemiler, sarkomalar ve hepatomlar, insan tümör zenograftları, insan tümör biyopsileri ve hücre dizilerine karşı gösterilmiştir. Treosulfan intraperitoneal, intravenöz ve ayrıca oral yolla uygulandığında in vivo etkilidir.
Treosülfanın immünosupresif etkileri, ilkel ve kararlı progenitör hücrelere, T ve NK hücrelerine karşı toksisitesine, primer ve sekonder lenfatik organların hücreselliğinin azalmasına ve Graft-versus-Host-Hastalığı'nın (GvHD) gelişiminden önce gelen ve ilgili olan 'sitokin fırtınası' üzerindeki önleyici etkisine bağlanır ve venooklusif hastalığın patogenezinde yer alır.
Klinik etkinlik ve güvenlilik
Over Kanseri
Sisplatin ile kombinasyonda treosulfanın klinik etkinliği büyük bir randomize klinik çalışmada over kanserli hastalarda gösterilmiştir. Toplam 519 hasta sisplatin (70 mg/m²) ile birlikte treosulfan (5 g/m²; PT rejimi) veya siklofosfamid (1 g/m²; PC rejimi) almak üzere randomize edilmiştir.
Her iki rejim 4 haftalık aralıklarla verilmiştir. Medyan 5 yıl takipten sonra, 366 hasta (PC: 179; PT: 187) etkinlik ve 290 hasta (PC: 135; PT: 155) güvenlilik yönünden değerlendirilebilmiştir.
Progresyona kadar geçen medyan süre (primer sonlanım noktası) sisplatin/treosulfan kombinasyonuyla daha uzun olmuştur (20.6 aya karşı 15.1 ay); ancak bu fark istatistiksel olarak anlamlı değildi (P = 0.3).
Her iki tedavi rejimi arasında yanıt oranları bakımından farklar saptanmamıştır.
Genel sağkalım tedavi kolları arasında farklı bulunmamıştır (29.4 aya karşı 33.5 ay; P = 0.8). PC kolunda anlamlı olarak daha fazla saç dökülmesi gözlenirken (P = 0.0001), PT kolunda daha fazla lökositopeni gözlenmiştir (P = 0.01). Treosulfan içeren rejimle tedavi edilen hastalarda yaşam kalitesi daha iyiydi.
Treosulfan monoterapisinin (5 - 7 g/m²; 4 haftada bir) intravenöz uygulanmasının etkinliği ilerlemiş over kanseri olan, daha önce tedavi almış 88 hastada (etkinlik yönünden 80'i değerlendirilebilmiştir) yürütülen bir faz II çalışmada gösterilmiştir. İki tam yanıt ve 13 kısmi yanıt saptanmış ve objektif yanıt oranı %19 bulunmuştur. Yanıt veren hastalarda medyan sağkalım süresi 41 aydı. Hastaların %34'ünde hastalık stabildi ve medyan sağkalım süresi 18 aydı.
Primer tedaviden sonraki 12 ayda progresif hastalık sergileyen 48 kadında %19'luk yanıt oranı ve %31'inde stabil hastalığa ulaşılabilmiştir. Toksik yan etkiler seyrek görülmüş ve orta şiddette olmuştur. Yaşamı tehdit eden miyelosupresyon, tedaviye dirençli emezis ve saç dökülmesi gözlenmemiştir.
Allojenik kök hücre nakli öncesi hazırlık rejimi
Referans niteliğindeki faz III çalışmada, akut miyeloid lösemi (AML) veya miyelodisplastik sendromu (MDS) olan ve daha ileri yaş (≥ 50 yaş) veya komorbiditeler (hematopoetik hücre transplantasyonu komorbidite indeksi [HCT-CI] skoru >2) nedeniyle standart hazırlık tedavileri için artmış risk taşıyan yetişkin hastalar 3 à 10 g/m² treosulfan ile birlikte fludarabin (FT; n = 220) içeren bir hazırlık rejimi veya intravenöz busulfan (toplam dozSaklamaya yönelik özel tedbirler tedbirler mg/kg) ile birlikte fludarabin (FB2; n = 240) rejimini takiben allojenik HKHT almak üzere randomize edilmiştir. Hastaların %64'ünde AML ve %36'sında MDS mevcuttu. Hastaların medyan yaşı 60'dı (aralık 31â70 yaş); hastaların %25'i 65 yaş üzeriydi.
Bu çalışmanın birincil sonlanım noktası 2 yıl sonra olaysız sağkalımdı (EFS). Olaylar hastalık relapsı, greft yetmezliği veya ölüm (hangisi önce gerçekleşirse) olarak tanımlanmıştır. FTrejiminin referans FB2'den daha geride olmadığı (non-inferiorite) istatistiksel olarak kanıtlanmıştır (Şekil 1).
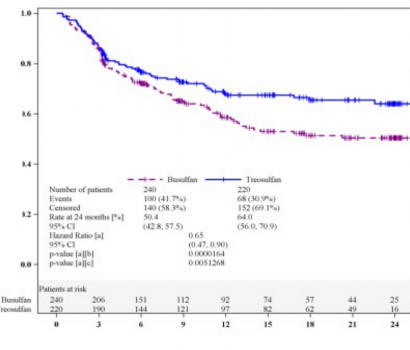
Risk altındaki hastalar
Zaman (aylar)
Olaysız sağkalım oranı
Şekil 1: Olaysız sağkalıma ilişkin Kaplan-Meier tahminleri (Tam Analiz Seti)
Önceden tanımlanmış çeşitli alt gruplarda (donör tipi, risk grubu, hastalık, yaş grubu, HCT-CI skoru, çalışmaya girişte remisyon durumu ve bu parametrelerin çeşitli kombinasyonları)
2.yılda yapılan EFS analizleri sadece bir istisnayla (MDS hastalarının oluşurduğu risk grubu I; HR 1.14 [%95 GA 0.48, 2.63]) her zaman treosulfan rejiminin lehine bulunmuştur (FB2'ye göre FTtehlike oranı [HR] <1),.
Detaylı sonuçlar Tablo 1'de sunulmaktadır.
Tablo 1: 24.aydaki tedavi sonuçları (Tam analiz seti)
Parametre | Treosulfan | Busulfan | Tehlike oranı (%95 GA) | P değeri |
Hasta sayısı | 220 | 240 |
|
|
Genel sağkalım; % (%95 GA) | 71.3 (63.6, 77.6) | 5Saklamaya yönelik özel tedbirler tedbirler (48.4, 63.6) | 0.61 (0.42, 0.88) | 0.0082 |
Kümülatif relaps/progressyon insidansı; % (%95 GA) | 24.6 (17.8, 31.3) | 23.3 (17.6, 29.0) | 0.87 (0.59, 1.30) | 0.5017 |
Nakille ilişkili mortalitenin kümülatif insidansı; % (%95 GA) |
12.1 (8.1, 17.7) |
28.2 (21.4, 36.5) |
0.54 (0.32, 0.91) |
0.0201 |
GvHD sonuçları Tablo 2'de gösterilmektedir.
Tablo 2: Kümülatif GvHD insidansı (Tam analiz seti)
Parametre | Treosulfan | Busulfan | P değeri |
Hasta sayısı | 220 | 240 |
|
Akut GvHD, tüm Dereceler; % (%95 GA) | 52.1 (45.5, 58.7) | 58.8 (52.5, 65.0) | 0.1276 |
Akut GvHD, Derece III/IV; % (%95 GA) | 9.6 (5.9, 13.3) | 0.2099 | |
Kronik GvHD; % (%95 GA) | 60.1 (49.8, 70.3) | 60.7 (53.1, 68.4) | 0.5236 |
Yaygın kronik GvHD; % (%95 GA) | 18.4 (12.0, 24.8) | 26.1 (19.2, 33.1) | 0.1099 |
Non-malign hastalıkları (NMH) olan yetişkin hastalarda treosulfana dayalı hazırlık rejimine (FTrejimi ± tiyotepa; bkz. Bölüm 4.2) ilişkin sınırlı bilgi mevcuttur. NMH'li yetişkin hastalarda treosulfan hazırlık rejimiyle allojenik HKHT için ana endikasyonlar hemoglobinopatilerdir (örn., orak hücre hastalığı, talasemi major [TM]), primer immün yetmezlik, hemofagositik bozukluk, immün regülasyon bozukluğu ve kemik iliği yetmezliği).
Bir çalışmada NMH'li 31 hasta FTrejimi ve anti-timosit globulin ile tedavi edilmiştir. Hastaların yaşı 0.4 ile 30.5 arasında değişiyordu ve %29'unun HCT-CI skorları > 2'ydi. Tüm hastalara greftleme yapılmıştı ve nötrofil greftlemesine kadar geçen medyan süre 21 gündü (aralık, 12â46). Öngörülen iki yıllık genel sağkalım oranı %90'dı. Klinik semptomlar ve laboratuvar tetkikleriyle ölçülen tam hastalık yanıtları 28 hastada (%90) gözlenmiştir (Burroughs LM et al., Biology of Blood and Marrow Transplantation 2014; 20(12):1996- 2003).
İtalya'daki bir grup araştırmacı 60 TM hastasını (yaş aralığı 1-37; 12 yetişkin dahil) FTve
tiyotepa rejimiyle tedavi etmiştir. Bir hasta hariç tüm hastalara greftleme yapılmış ve bu hasta
+11.gün ölmüştür; nötrofil ve trombositlerin toparlanmasına kadar geçen medyan süre 20 gündü. Medyan 36 aylık takip süresiyle (aralık, 4-73), 5 yıllık genel sağkalım olasılığı %93 (%95 GA %83-97) bulunmuştur. Çocuklar ve yetişkinler arasında sonuç bakımından hiçbir fark gözlenmemiştir (Bernardo ME et al.; Blood 2012; 120(2):473-6).
Yetişkin hastalarda treosulfana dayalı hazırlık rejimini (n = 16) busulfana dayalı hazırlık rejimiyle (n = 81) karşılaştıran geriye dönük bir çalışma oldukça benzer sağkalım oranlarını ortaya koymuştur (%70.3 ± 15.1'e karşı %69.3 ± 5.5); bununla birlikte akut GvHD riski treosulfan grubunda daha düşüktü (olasılık oranı 0.28; %95 GA 0.12-0.67; P = 0.004) (Caocci G et al.; American Journal of Hematology 2017; 92(12):1303-1310).
Pediyatrik popülasyon
Treosulfana dayalı hazırlık rejiminin etkinliği ve güvenliliği tiyotepa ile birlikte (n = 65) veya tiyotepa olmaksızın (n = 5) treosulfan ve fludarabin içeren bir hazırlık rejimi alan akut lenfoblastik lösemi (ALL), AML, MDS veya juvenil miyelomonositik lösemisi (JMML) olan
70 hastada değerlendirilmiştir (bkz. Bölüm 4.2). Toplam 37 hasta (%52.9) 12 yaşından
küçüktü.
Hiçbir hasta primer greft yetmezliği yaşamamış ancak ALL'li bir hastada sekonder greft yetmezliği gelişmiştir. Tam donör tipi kimerizm insidansı +28.gündeki vizitte %94.2 (%90
GA %87.2-98.0), +100.gündeki vizitte %91.3 (%90 GA %83.6-96.1) ve 12.aydaki vizitte
%91.2 (%90 GA %82.4-96.5) olarak saptanmıştır.
12.ayda genel sağkalım %91.4'dür (%90 GA %83.9-95.5). 70 hastadan toplam 7'si (%10.0) ölmüştür; ölüm nedeni iki hastada relaps/progresyon, üç hastada transplantasyonla ilişkili bir neden ve geri kalan iki hastada başka nedenlerdi. HKHT'den sonra +100.güne kadar nakille ilişkili mortalite yokluğu (birincil sonlanım noktası) oranı %98.6'dır (%90 GA %93.4â99.7) çünkü 70 hastadan biri HKHT'den sonra +100.güne kadar nakil/tedaviyle ilişkili bir nedenle ölmüştür. 12.ayda nakille ilişkili mortalite oranı %2.9'dur (%90 GA %0.9 â8.9). 11 hasta relaps/progresyon yaşamıştır. Kümülatif relaps/progresyon insidansı +12.ayda %15.7'dir (%90 GA %8.6-22.9).
5.2. Farmakokinetik özellikler
Genel özelliklerTreosulfan fizyolojik koşullarda (pH 7.4; 37 °C) bir monoepoksit ara maddesine ve L- diepoksibütana kendiliğinden dönüşen ve yarı ömrü 2.2 saat olan bir ön ilaçtır.
Emilim:
Treosulfanın oral emilimi mükemmeldir ve biyoyararlanımı %100'e yakındır.
İntravenöz uygulamadan sonra, pik plazma düzeylerine infüzyon süresinin sonunda ulaşılır. Yetişkin hastalarda 10, 12 veya 14 g/m² treosulfan 2 saatlik infüzyonla verildikten sonra maksimum plazma düzeyleri (ortalama ± SD) sırasıyla 306 ± 94 µg/mL, 461 ± 102 µg/mL ve 494 ± 126 µg/mL'ydi.
Dağılım:
İntravenöz uygulamadan sonra treosulfan vücutta hızla dağılır; ancak treosulfanın kan-beyin bariyerinden geçişi oldukça sınırlıdır (bkz. Bölüm 5.3). Yetişkin hastalarda dağılım hacmi yaklaşık 20â30 litredir. Arka arkaya üç gün boyunca önerilen günlük tedaviyle doz birikimi gözlenmemiştir. Treosulfan plazma proteinlerine bağlanmaz.
Biyotransformasyon:
Fizyolojik koşullarda (pH 7.4, sıcaklık 37 °C), treosulfanın farmakolojik yönden inaktif treosulfan aktif monoepoksit ara maddesine (S,S-EBDM = (2S,3S)-1,2-epoksibütan-3,4-diol- 4-metan sülfonat) ve son olarak da L-diepoksibütana (S,S-DEB = (2S,3S)-1,2:3,4- diepoksibütan) spontan olarak (enzimatik olmayan biçimde) dönüşür.
100 µM'ye kadar konsantrasyonlarda, treosulfan CYP1A2, 2C9, 2C19, 2D6 veya 3A4'ün aktiviteleri üzerinde in vitro hiçbir kesin etkiye sahip değildir. Dolayısıyla treosulfanın in vivo koşullarda CYP450 aracılı potansiyel etkileşimlere katılması veya katkıda bulunması olasılığı yoktur.
Eliminasyon:
Over kanseri
İntravenöz yolla uygulanan treosulfanın (8 g/m²) ortalama (± SD) terminal yarı-ömrü (t1/2Ã)
1.94 ± 0.99 saattir ve değişmemiş treosulfanın kümülatif renal eliminasyonu yaklaşık %25'dir (aralık, %5-%49).
Allojenik kök hücre nakli öncesi hazırlık rejimi
Treosulfanın plazma konsantrasyonları üssel biçimde katlanarak azalır ve iki kompartmanlı modele uyan, birinci dereceden eliminasyon süreciyle en iyi şekilde tarif edilir.
İntravenöz yolla uygulanan treosulfanın (47 g/m²'ye kadar) terminal yarı ömrü (T) yaklaşık 2 saattir. Treosulfan dozunun yaklaşık %25â40'ı 24 saat içinde idrarla değişmeden atılır ve yaklaşık %90'ı uygulamadan sonraki ilk 6 saatte atılır.
Doğrusallık/doğrusal olmayan durum
Treosulfan dozuna karşı işaretlenen grafikte eğri altında kalan alanın (EAA) regresyon analizi doğrusal bir korelasyonu göstermiştir.
Böbrek ve karaciğer fonksiyon bozukluğu
Ağır böbrek veya karaciğer yetmezliği olan hastalarda treosulfan ile hiçbir farmakokinetik çalışması yapılmamıştır çünkü bu tür hastalara genellikle allojenik HKHT uygulanmaz. Treosulfanın yaklaşık %25â40'ı idrarla atılır; bununla birlikte treosulfanın böbrek klirensi üzerinde böbrek fonksiyonunun bir etkisi gözlenmemiştir.
Pediyatrik popülasyon
Basitçe VYA'ya dayanan klasik doz hesaplamaları ergenler veya yetişkinlere kıyasla düşük VYA'lı bebekler ve küçük yaştaki çocuklarda anlamlı olarak daha yüksek maruz kalıma (EAA) yol açar. Bu nedenle, pediyatrik hastalarda treosulfan dozajının VYA'ya göre ayarlanması gerekir (bkz. Bölüm 4.2).
Treosulfanın ortalama belirgin terminal yarı ömrü farklı yaş grupları arasında benzer bulunmuş ve 1.3 - 1.6 saat arasında değişmiştir.
5.3. Klinik öncesi güvenlilik verileri
Alkilleyici etki mekanizması nedeniyle treosulfan, kanserojen potansiyele sahip genotoksik bir bileşik olarak karakterize edilir. Hayvanlarda treosulfan üzerinde spesifik üreme ve gelişimsel toksisite çalışmaları yapılmamıştır. Bununla birlikte, sıçanlarda yapılan kronik toksisite testleri sırasında spermatogenez ve yumurtalık fonksiyonu önemli ölçüde etkilenmiştir. Yayınlanmış literatür verileri, puberte öncesi ve puberte erkek ve dişi farelerde treosulfanın gonadotoksisitesini raporlar.
Fare ve sıçanların L-diepoksibütan (treosulfanın alkilleyici transformasyon ürünü) ile tedavisine ilişkin yayınlanmış veriler, doğurganlık, rahim-yumurtalık ve sperm gelişiminde bozulma olduğunu ortaya çıkarmıştır.
Jüvenil hayvan çalışmaları
Jüvenil sıçan toksisite çalışmalarında treosulfan, fiziksel gelişmede hafif bir gecikmeye ve dişilerde biraz gecikmeli bir vajinal açılma zaman noktasına neden olmuştur. Sıçanlarda treosulfan tarafından çok düşük bir kan-beyin bariyeri penetrasyonu gözlenmiştir. Beyin dokusundaki treosulfan konsantrasyonları plazmadakinden %95-98 daha düşük olmuştur. Bununla birlikte, genç sıçanların beyin dokusunda genç yetişkinlere kıyasla yaklaşık 3 kat daha yüksek maruziyet bulunmuştur.
Akut toksisite
Farelerde oral LDvücut ağırlığının kg'ı başına 3360 mg treosulfandır ve intravenöz LD
vücut ağırlığının kg'ı başına >2500 mg treosulfandır.
Sıçanlarda oral LDvücut ağırlığının kg'ı başına 2575 mg treosulfan ve intraperitoneal LDvücut ağırlığının kg'ı başına > 2860 mg treosulfandır.
Subakut toksisite
Subakut bir doz (56-111 mg/kg/gün) alan maymunlarda hematopoetik sistem hasar görmüştür. Daha yüksek dozlarda (222-445 mg/kg/gün) diyare, anoreksi ve belirgin vücut ağırlığı kaybı da kaydedilmiştir.
Kronik toksisite
Treosulfanın sıçanlara yedi ay boyunca uygulanması erkek sıçanlarda spermiyogenezde azalmaya ve dişi sıçanlarda menstrüel siklus bozukluklarına yol açmıştır. Diğer tüm organlarda hiçbir değişiklik olmamıştır.
Tümörijenik ve mutajenik potansiyel
Oral treosulfan dozlarıyla uzun süreli tedavide hastaların %1.4'ünde akut non-lenfositik lösemi gözlenmiştir. Alkilleyici özellikler taşıyan diğer sitostatik ajanlarda olduğu gibi treosulfan da mutajenik potansiyele sahiptir. Bu nedenle çocuk sahibi olma potansiyeli bulunan kadın hastaların tedavi süresince etkili kontrasepsiyon uygulamaları zorunludur.
Üreme toksisitesi
Treosulfan hayvan çalışmalarında üreme toksisitesi yönünden test edilmemiştir. Bununla birlikte, sıçanlarda kronik toksisite testleri sırasında gecikmiş spermiyogenez ve korpora lutea ve folikül yokluğu saptanmıştır.
Sitotoksik preparatlar gebe olabilecek personel tarafından hazırlanmamalıdır.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Ideogen İlaç Sanayi A.Ş
| Satış Fiyatı | 45712.01 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 45712.01 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680952000062 |
| Etkin Madde | Treosulfan |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |