AMPAHO 5 mg 30 film kaplı tablet Farmakolojik Özellikler
{ Ambrisentan }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Pulmoner arteriyel hipertansiyon için antihipertansifler
ATC kodu: C02KX02
Etki mekanizması:
Ambrisentan; oral uygulamaya yönelik, endotelin A (ET) reseptörü için selektif bir propanoik
asit sınıfı ERA'dır. Endotelin, PAH patofizyolojisinde önemli bir role sahiptir.
Ambrisentan güçlü (Ki 0,016 nM) ve yüksek oranda seçici bir ETA antagonistidir (ETB ile karşılaştırıldığında ETA seçiciliği yaklaşık 4.000 kat daha fazladır).
Ambrisentan, temelde vasküler düz kas hücreleri ve kalp kası hücrelerinde bulunan ETA reseptör alt tipini bloke etmektedir. Bu blokaj, vazokonstriksiyon ve düz kas hücre proliferasyonuna neden olan ikinci haberci sistemlerin endotelin aracılı aktivasyonunu önler.
Ambrisentanın ET'ye kıyasla ET reseptörü selektivitesinin ET reseptörü aracılı vazodilatör nitrik oksit ve prostasiklin üretimini koruması beklenmektedir.
Klinik etkililik ve güvenlik:
İki randomize, çift kör, çok merkezli, plasebo kontrollü Faz 3 pivotal çalışma (ARIES-1 ve 2) yapılmıştır. ARIES-1 çalışmasında 201 hasta yer almış ve ambrisentan 5 mg ve 10 mg ile plasebo karşılaştırılmıştır. ARIES-2 çalışmasında 192 hasta yer almış ve ambrisentan 2,5 mg ve 5 mg ile plasebo karşılaştırılmıştır. Her iki çalışmada ambrisentan hastaların digoksin, antikoagülanlar, diüretikler, oksijen ve vazodilatörler (kalsiyum kanal blokerleri, ACE inhibitörleri) kombinasyonunu içerebilen destekleyici/temel ilaca eklenmiştir. Dahil edilen hastalarda bağ doku hastalıkları ile ilişkili PAH veya İPAH mevcuttur (PAH-CTD). Hastaların çoğunda WHO fonksiyonel sınıf II (% 38,4) veya sınıf III (% 55) semptomları mevcuttur. Önceden mevcut karaciğer hastalığı (siroz veya klinik açıdan anlamlı şekilde artan aminotransferaz) ve PAH için diğer hedefe yönelik tedavilerin (örneğin, prostanoidler) kullanıldığı hastalar çalışmaya dahil edilmemiştir. Bu çalışmalarda hemodinamik parametreler değerlendirilmemiştir.
Faz 3 çalışmalar için tanımlanan primer sonlanma noktası, başlangıca göre 6 dakikalık yürüme mesafesinde (6DYM) 12. haftada görülen değişiklik ile değerlendirilen egzersiz kapasitesindeki düzelme olmuştur. Her iki çalışma da ambrisentan tedavisi tüm ambrisentan dozları için 6DYM'de anlamlı düzelme sağlamıştır.
düzelme 51,4 m olmuştur (% 95 GA: 26,6 ila 76,2; p <0,001).
Faz 3 çalışmaların önceden tanımlanmış bir birleşik analizi (ARIES-C) yapılmıştır. 6DYM'de plaseboya göre ayarlanmış ortalama düzelme 5 mg dozu için 44,6 m (% 95 GA: 24,3 ile 64,9; p<0,001) ve 10 mg dozu için 52,5 m olmuştur (% 95 GA: 28,8 ila 76,2; p<0,001).
ARIES-2 çalışmasında; ambrisentan tedavisi (kombine doz grubu), plasebo ile karşılaştırıldığında, PAH'ın klinik kötüleşmesini anlamlı şekilde geciktirmiştir (p<0,001) ve risk oranı (HR) %80'lik düşüş olduğunu göstermiştir (%95 GA; %47 ila 92). Ölçüm kriterleri; ölüm, akciğer transplantasyonu, PAH nedeniyle hospitalizasyon, atriyal septostomi, PAH tedavisinde kullanılan diğer ajanların tedaviye eklenmesi ve tedaviyi erken bırakma kriterlerini içermiştir. Plasebo ile karşılaştırıldığında, kombine doz tedavi grubunda SF-36 Sağlık Anketinin fiziksel fonksiyon ölçeğinde istatistiksel olarak anlamlı şekilde yükselme ortaya çıktığı gözlenmiştir (-0,20±8,14'e karşılık 3,41±6,96, p=0,005). Ambrisentan tedavisi ile 12. haftada Borg Dispne İndeksinde (BDI) istatistiksel olarak anlamlı şekilde iyileşme ortaya çıkmıştır (plaseboya göre düzeltilmiş BDI; -1,1 [%95 GA: -1,8 ila -0,4; p=0,019; kombine doz grubu]).
Uzun süreli veriler:
ARIES 1 ve 2 çalışmalarına dahil edilen hastalar, bu çalışmaları takip eden uzun süreli, açık etiketli bir uzatma çalışmasına (ARIES- E) devam etmek üzere uygun bulunmuştur (n=383).
Kombine ortalama maruziyet 145 ± 80 hafta ve maksimum maruziyet yaklaşık 295 haftaolmuştur. Bu çalışmanın temel birincil sonlanma noktaları, serum LFT'leri de dahil olmak üzere uzun süreli ambrisentan maruziyeti ile ilişkili advers olayların insidansı ve şiddeti olmuştur. Uzun vadeli ambrisentan maruziyeti ile gözlemlenen güvenlilik bulguları, genellikle 12 haftalık plasebo kontrollü çalışmalarda gözlemlenenlerle uyumlu olmuştur.
Ambrisentan kullanan deneklerde gözlenen sağkalım oranları (kombine ambrisentan dozu
grubu) bir yıllık sürede % 93, iki yıllık sürede % 85 ve 3. Yıllık sürede ise %79 olmuştur.
Açık bir çalışmada (AMB222), ambrisentan aminotransferaz anomalileri nedeniyle daha önce diğer ERA tedavisinin kesildiği hastalarda, serum aminotransferaz konsantrasyonlarında artışın insidansının değerlendirilmesi için 36 hastada incelenmiştir. Ambrisentan ile ortalama 53 haftalık tedavi sırasında dahil edilen hastaların hiçbirisinde tedavinin kesilmesini gerektirecek derecede doğrulanmış serum ALT>3xULN bulgusu gözlenmemiştir. Bu süre zarfında hastaların % 50'sinde 5 mg ambrisentan dozunun 10 mg dozuna arttırılması gerekmiştir.
Tüm Faz 2 ve 3 çalışmalarda (ilgili açık ek çalışmalar dahil) >3xULN serum aminotransferaz anomalisinin kümülatif insidansı ortalama 79,5 haftalık maruziyet süresinde 17/483 gönüllü olmuştur. Bu, ambrisentan için 100 hasta yılı başına 2,3 olay oranına karşılık gelmektedir. Açık etiketli uzun süreli ARIES-E uzatma çalışmasında, ambrisentan ile tedavi edilen hastalarda
>3xULN serum aminotransferaz yükselmesi oluşumunun 2 yıllık riski %3,9 olmuştur.
Diğer klinik bilgiler:
Bir Faz 2 çalışmada (n=29) (AMB220), PAH hastalarında 12 hafta sonra hemodinamik parametrelerde bir düzelme gözlenmiştir. Ambrisentan tedavisi ortalama kardiyak endekste bir artışa, ortalama pulmoner arter basıncında bir düşüşe ve ortalama pulmoner vasküler dirençte bir düşüşe neden olmuştur.
hafta süreli plasebo kontrollü klinik çalışmalarda, başlangıçtan tedavinin sonuna kadar sistolik ve diyastolik kan basınçlarındaki ortalama azalma sırasıyla 3 mm Hg ve 4,2 mm Hg olmuştur. Sistolik ve diyastolik kan basınçlarındaki ortalama azalmalar, uzun vadeli açık etiketli ARIES- E çalışmasında, ambrisentan ile tedavide 4 yıla kadar devam etmiştir.
Sağlıklı gönüllülerde gerçekleştirilmiş olan bir ilaç-ilaç etkileşimi çalışmasında, ambrisentan ya da sildenafilin farmakokinetik özelliklerinde klinik olarak anlamlı bir değişiklik olmadığı ve kombinasyon tedavisinin iyi tolere edildiği gözlenmiştir. ARIES-E çalışmasında 22 hasta (%5,7), AMB222 çalışmasında ise 17 hasta (%47) ambrisentan ile birlikte sildenafil kullanmıştır. Bu hasta popülasyonunda güvenliliğe dair ek kaygılar ortaya çıkmamıştır.
Tadalafil ile kombinasyon halinde klinik etkililik:
Ambrisentan ve tadalafil başlangıç kombinasyonunun tek başına ambrisentan veya tadalafil monoterapisine karşı etkililiğini değerlendirmek üzere daha önce tedavi görmemiş, sırasıyla 2:1:1 oranında randomize edilmiş 500 PAH hastasında çok merkezli, çift kör, aktif komparatörlü, olay yönlendirmeli bir Faz 3 sonuç çalışması (AMB112565/AMBITION) yürütülmüştür. Hiçbir hasta tek başına plasebo kullanmamıştır. Birincil analiz birleştirilmiş monoterapi gruplarına karşı kombinasyon grubudur. Ayrı ayrı monoterapi gruplarına karşı kombinasyon tedavisi grubuna ilişkin destekleyici karşılaştırmalar da yapılmıştır. Ciddi anemi, sıvı tutulumu veya seyrek retinal hastalıkları olan hastalar araştırıcı kriterlerine göre hariç tutulmuştur. Başlangıçta ALT ve AST değerleri >2xULN olan hastalar da hariç tutulmuştur.
Başlangıçta, hastaların %96'sı daha önce PAH'a özgü tedavi görmemiş olup, tanıdan çalışmaya girişe kadar geçen medyan süre 22 gündür. Hastalar ambrisentan 5 mg ve tadalafil 20 mg dozuna başlatılmış ve tolerabilite sorunları yaşamadıkları sürece 4. haftada 40 mg tadalafil ve
8. haftada 10 mg ambrisentana titre edilmiştir. Kombinasyon tedavisi için medyan çift kör
tedavi süresi 1,5 yıldan fazla olmuştur.
Birincil sonlanım noktası aşağıdaki şekilde tanımlanan ilk klinik başarısızlık olayına kadar
geçen süre olmuştur:
Ölüm veya
PAH'da kötüleşme nedeniyle hastaneye yatırılma,
Hastalık progresyonu,
Tatmin edici olmayan uzun vadeli klinik yanıt.
Tüm hastalar için ortalama yaş 54 olmuştur (SD 15; aralık 18-75 yaş). Başlangıçta hastaların WHO FC değeri II (%31) ve FC III (%69) olmuştur. İdiyopatik veya kalıtımsal PAH çalışma popülasyonundaki en yaygın etiyoloji olup (%56), bunu bağ dokusu bozukluklarına bağlı PAH (%37), ilaçlar ve toksinler ile ilişkili PAH (%3), düzeltilmiş basit konjenital kalp hastalığı ile ilişkili PAH (%2) ve HIV ile ilişkili PAH (%2)izlemiştir. WHO FC II ve III durumuna sahip hastalar başlangıçta ortalama 353 metrelik 6DYM'ye sahip olmuştur.
Sonuç sonlanım noktaları
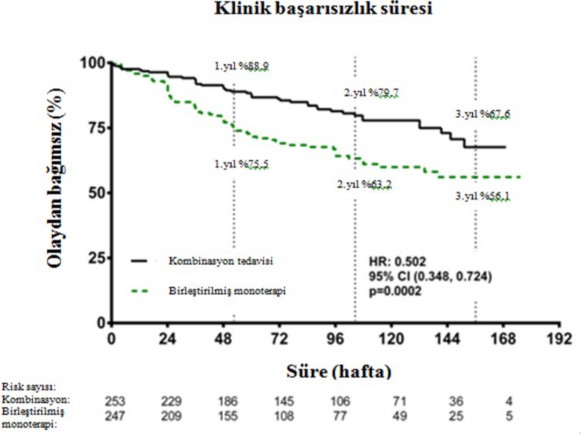
Kombinasyon tedavisi ile tedavi, birleştirilmiş monoterapi grubuna kıyasla, nihai değerlendirme vizitine kadar bileşik klinik başarısızlık sonlanım noktasında %50 risk azalması (tehlike oranı [HR] 0,502; %95 GA: 0,348 ila 0,724; p=0,0002) ile sonuçlanmıştır (Şekil 1 ve
Tablo 1). Tedavi etkisi kombinasyontedavisindehastaneye
yatırılmalarda %63 azalmadan
sonlanım noktası üzerindeki etkililiği her bir monoterapiye kıyasla ve yaş, etnik köken, coğrafik bölge, etiyoloji (iPAH/hPAH ve PAH-CTD) alt grupları arasında tutarlı olmuştur. Etki hem FC II hem de FC III hastaları için anlamlı olmuştur.
Şekil 1
Tablo 1
| Ambrisentan + Tadalafil (N=253) | Monoterapi Birleştirilmiş (N=247) | Ambrisentan monoterapi (N=126) | Tadalafil monoterapi (N=121) |
İlk Klinik Başarısızlık Olayına Kadar Geçen Süre (Karara Bağlanmış) | ||||
Klinik başarısızlık, sayı (%) | 46 (%18) | 77 (%31) | 43 (34) | 34 (28) |
Tehlike oranı (%95 GA) |
| 0,502 (0,348, 0,724) | 0,477 (0,314, 0,723) | 0,528 (0,338, 0,827) |
P-değeri, Log-sıra testi |
| 0,0002 | 0,0004 | 0,0045 |
İlk Klinik Başarısızlık Olayı Olarak Bileşen (Karara Bağlanmış) | ||||
Ölüm (tüm nedenler) | 9 (%4) | 8 (%3) | 2 (2) | 6 (5) |
Ağırlaşan PAH nedeniyle hastaneye yatış | 10 (%4) | 30 (%12) | 18 (14) | 12 (10) |
Hastalık progresyonu | 10 (%4) | 16 (%6) | 12 (10) | 4 (3) |
Tatmin edici olmayan uzun vadeli klinik yanıt | 17 (%7) | 23 (%9) | 11 (9) | 12 (10) |
oğrulama Kodu: 1ZW56M0FyZmxXRG83Q3NRRG83ZmxXQ3NR | ||||
İlk hastaneye yatış, sayı (%) | 19 (%8) | 44 (%18) | 27 (%21) | 17 (%14) |
Tehlike oranı (%95 GA) |
| 0,372 | 0,323 | 0,442 |
P-değeri, Log-sıra testi |
| 0,0002 | < 0,0001 | 0,0124 |
İkincil sonlanım noktaları
İkincil sonlanım noktaları test edilmiştir:
Tablo 2
İkincil sonlanım noktaları (başlangıçtan 24. haftaya kadar değişim | Ambrisentan + Tadalafil | Monoterapi Birleştirilmiş | Farklılık ve Güven Aralığı | p değeri |
NT-proBNP (% azalma) | -67,2 | -50,4 | % farklılık -33,8: %95 GA: -44,8, -20,7 | p<0,0001 |
24. haftada tatmin edici bir klinik yanıta ulaşan gönüllülerin %'si | 39 | 29 | Olasılıklar oranı 1,56; %95 GA: 1,05, 2,32 | p= 0,026 |
6DYM (metre, medyan değişim | 49 | 23,8 | 22,75 m; %95 GA: 12,00, 33,50 | p<0,0001 |
İdiyopatik pulmoner fibroz:
%11'inde sekonder pulmoner hipertansiyon (WHO grup 3) bulunan 492 idiyopatik pulmoner fibroz (IPF) hastası (ambrisentan N=329, plasebo N=163) ile yapılan çalışma, primer etkililik sonlanım noktasına ulaşılamayacağı belirlendiğinden, çalışma erken sonlandırılmıştır (ARTEMIS-IPF çalışması).
Ambrisentan grubunda 90 (%27), plasebo grubunda 28 (%17) IPF progesyonu (solunum nedenli hastaneye yatış dahil) ya da ölüm vakası gözlenmiştir. Bu nedenle ambrisentan sekonder pulmoner hipertansiyon olsun ya da olmasın IPF hastalarında kontrendikedir (bkz. Bölüm 4.3).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Ambrisentan insanlarda hızlı bir şekilde emilmektedir. Oral uygulamadan sonra ambrisentanın maksimum plazma konsantrasyonları (C) tipik şekilde açlık ve tokluk koşullarında dozlamadan yaklaşık 1,5 saat sonra meydana gelmektedir. C ve plazma konsantrasyonu zaman eğrisi altındaki alan (EAA) terapötik doz aralığında doza orantısal olarak artmaktadır. Kararlı duruma genelde 4 günlük tekrarlı dozlama sonunda erişilmektedir.
Sağlıklı gönüllülere açlık koşullarında ve yüksek oranda yağ içeren bir öğünle ambrisentan uygulanımını içeren bir gıda etkisi çalışması C değerinin % 12 düşerken EAA'nın değişmediğini göstermiştir. Pik konsantrasyondaki bu düşüş klinik açıdan anlamlı olmadığından ambrisentan aç veya tok karnına alınabilir.
Dağılım:
Ambrisentan plazma proteinine yüksek oranda bağlanmaktadır. Ambrisentanın in vitro plazma proteinine bağlanma oranı ortalama % 98,8 olup, 0,2 - 20 mikrogram/ml aralığında konsantrasyondan bağımsızdır. Ambrisentan temelde albümine (%96,5) ve daha düşük düzeyde alfa-asit glikoproteine bağlanmaktadır.
Ambrisentanın eritrositlere dağılımı düşük olup ortalama kan:plazma oranı erkekler ve kadınlarda sırasıyla 0,57 ve 0,61'dir.
Biyotransformasyon:
Ambrisentan, bir non-sülfonamid (propionik asit) ERA'dır.
Ambrisentan, birçok UGT izoenzim (UGT1A9S, UGT2B7S ve UGT1A3S) aracılığıyla ambrisentan glukuronidi (%13) oluşturmak üzere glukuronizayona maruz kalmaktadır. Ambrisentan ayrıca başta CYP3A4 ve daha düşük düzeyde CYP3A5 ve CYP2C19 aracılığı ile 4-hidroksimetil ambrisentan (%21) oluşturmak üzere oksidatif metabolizmaya maruz kalmakta ve bu ürün ilave glukuronizasyon sonucu 4-hidroksimetil ambrisentan glukuronide (%5) dönüşmektedir. 4-hidroksimetil ambrisentanın insan endotelin reseptörü için bağlanma afinitesi ambrisentandan 65 kat daha düşüktür. Bu nedenle, plazmada gözlenen konsantrasyonlarda (ana bileşik ambrisentana göre yaklaşık %4) 4-hidroksimetil ambrisentanın ambrsisentanın farmakolojik aktivitesine katkıda bulunması beklenmemektedir.
İn vitro veriler, 300 µM konsantrasyona kadar ambrisentanın UGT1A1, UGT1A6, UGT1A9, UGT2B7 veya sitokrom P450 enzimleri 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ve 3A4'ü belirgin olarak inhibe etmediğini göstermiştir. Ek olarak, insan taşıyıcı genleri ile transfekte edilmiş hücre dizilerinin kullanıldığı in vitro çalışmalar 100 µM konsantrasyona kadar ambrisentanın P-glikoproteini (Pgp), meme kanseri reseptör protein (BCRP), çoklu-ilaç direnç protein isoform-2 (MRP2) ya da safra tuzu dışa atım pompasını (BSEP) inhibe etmediğini göstermiştir. Ambrisentan in vitro olarak OATP1B1, OATP1B3 ve NTCP'yi sırasıyla 47 µM, 45 µM, ve yaklaşık olarak 100 µM IC50 değerleri ile zayıf olarak inhibe etmiştir. Sıçan ve insan hepatositlerinde yapılan in vitro çalışmalarda NTCP, OATP, BSEP ve MRP2'nin ambrisentan inhibisyonuna yönelik bir kanıt görülmemiştir. Ayrıca ambrisentan, sıçan hepatositlerinde MRP2, Pgp veya BSEP protein ekspresyonunu indüklememiştir. İn vitro verilere dayanarak, ambrisentanın klinik olarak uygun konsantrasyonlarda BSEP, BCRP, Pgp, MRP2, OATP1B1/3 veya NTCP yolu ile taşıma veya sitokrom P450 enzimleri 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ve 3A4 veya UGT1A1, UGT1A6, UGT1A9, UGT2B7 üzerinde bir etkisinin olması beklenmemektedir..
Kararlı durumda ambrisentanın (günde bir kez 10 mg) PT ve INR ile ölçülen tek doz varfarinin (25 mg) farmakokinetiği ve farmakodinamiği üzerindeki etkileri 20 sağlıklı gönüllüde araştırılmıştır. Ambrisentan, varfarinin farmakokinetiği veya farmakodinamiğinde klinik açıdan anlamlı etki göstermemiştir. Benzer şekilde varfarin ile birlikte uygulanması ambrisentanın farmakokinetiğini etkilememiştir (bkz. Bölüm 4.5).Yedi günlük sildenafil dozajının (günde üç kez 20 mg) tek doz ambrisentanın farmakokinetiği ve yedi günlük ambrisentan dozajının (günde bir kez 10 mg) tek doz sildenafilin farmakokinetiği üzerindeki etkisi 19 sağlıklı gönüllüde araştırılmıştır. Ambrisentan ile birlikteuygulanmasını takiben sildenafil C değerindeki %13'lük artış dışında sildenafil, N-desmetil-sildenafil ve
Kararlı durumda ambrisentanın (günde bir kez 10 mg) tek doz tadalafil farmakokinetiği üzerinde ve kararlı durumda tadalafilin (günde bir kez 40 mg) tek doz ambrisentan farmakokinetiği üzerindeki etkileri 23 sağlıklı gönüllüde araştırılmıştır. Tadalafil farmakokinetiği üzerinde ambrisentanın klinik açıdan anlamlı etkisi olmamıştır. Benzer olarak, tadalafilin birlikte uygulanması ambrisentan farmakokinetiğini etkilememiştir (bkz. Bölüm 4.5)
Tekrarlı doz ketokonazol (günde bir kez 400 mg) uygulanmasının tek doz 10 mg ambrisentanın farmakokinetiği üzerindeki etkileri 16 sağlıklı gönüllüde araştırılmıştır. EAA(0-inf) ve Cmaks ile ölçülen ambrisentan maruziyeti sırasıyla %35 ve %20 artmıştır. Maruziyetteki bu değişikliğin klinik açıdan anlamlı olmadığı düşünüldüğünden AMPAHO ile birlikte ketokonazol uygulanabilir.
Tekrarlı doz siklosporin A (günde iki kez 100-150 mg) uygulamasının ambrisentanın (günde bir kez 5 mg) kararlı durum farmakokinetiği üzerine etkisi ve tekrarlı doz ambrisentan (günde bir kez 5 mg) uygulamasının siklosporin A'nın (günde iki kez 100-150 mg) kararlı durum farmakokinetiği üzerine etkisi sağlıklı gönüllülerde araştırılmıştır. Çoklu doz siklosporin A varlığında ambrisentanın Cmaks ve EAA(0-á´)'sı artmıştır (sırasıyla %48 ve %121). Bu değişiklikler nedeniyle, siklosporin A ile birlikte uygulandığında ambrisentanın dozu günde bir kez 5 mg ile sınırlandırılmalıdır (bkz. Bölüm 4.2). Buna karşın, ambrisentanın çoklu doz uygulamasının siklosporin A maruziyeti üzerinde klinik açıdan anlamlı bir etkisi olmamıştır ve bu nedenle siklosporin A'nın dozunun ayarlanmasına gerek yoktur.
Akut ve tekrarlı doz rifampisin (günde bir kez 600 mg) uygulamasının ambrisentanın (günde bir kez 10 mg) kararlı durum farmakokinetiği üzerine etkisi sağlıklı gönüllülerde araştırılmıştır. Rifampisinin ilk dozlarını takiben, ambrisentan EAA(0-á´)'sında geçici artış (rifampisinin birinci ve ikinci dozunu takiben sırasıyla %121 ve %116) gözlemlenmiştir; bunun nedeni muhtemelen rifampisinle ilgili OATP inhibisyonudur. Buna karşın, çoklu doz rifampisin uygulamasını takiben 8. günde ambrisentan maruziyetinde klinik olarak anlamlı bir etki olmamıştır. Ambrisentan tedavisi alan hastalarda rifampisin tedavisi başlandığında yakından takip gereklidir (bkz. Bölüm 4.4 ve 4.5).
Tekrarlı doz şeklinde uygulanan ambrisentan (10 mg) uygulanmasının tek doz şeklinde uygulanan digoksinin farmakokinetiği üzerindeki etkileri 15 sağlıklı gönüllüde araştırılmıştır. Çoklu doz ambrisentan digoksin EAA ve en düşük konsantrasyonlarda hafif bir artışa ve digoksin C değerinde %29 artışa neden olmuştur. Digoksin maruziyetinde çoklu doz ambrisentan varlığında gözlenen artış klinik açıdan anlamlı olarak değerlendirilmemiş olup, digoksin dozunda ayarlama gerekli değildir (bkz. Bölüm 4.5).
12 gün boyunca ambrisentan (günde bir kez 10 mg) uygulamasının etinil estradiol (35 mikrogram) ve noretindron (1 mg) içeren oral kontraseptiflerin tek dozunun farmakokinetiği üzerine etkisi sağlıklı kadın gönüllülerde araştırılmıştır. Cmaks ve EAA0-â, etinil estradiol için hafif azalmış (sırasıyla %8 ve %4), noretindron için hafif artmıştır (sırasıyla %13 ve %14). Etinil estradiol ve noretindron maruziyet değişiklikleri küçük olmuştur ve klinik olarak anlamlı olmaları beklenmemektedir (bkz. Bölüm 4.5).
Eliminasyon:
Ambrisentan ve metabolitleri, hepatik ve/veya ekstrahepatik metabolizmayı takiben primer olarak safrada eliminde edilmektedir.Uygulanandozunyaklaşık %22'si oral uygulamadan
İnsanlarda plazma eliminasyon yarılanma ömrü yaklaşık 13,6 ila 16,5 saattir.
Özel popülasyonlar:
Sağlıklı gönüllüler ve PAH hastalarında yapılan bir popülasyon farmakokinetiği analizinden elde edilen bulgulara göre, ambrisentanın farmakokinetiği cinsiyet veya yaştan etkilenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği
Ambrisentan, anlamlı renal metabolizma veya renal klirense (atılım) maruz kalmamaktadır. Bir popülasyon farmakokinetiği analizinde, kreatinin klirensinin oral ambrisentan klirensini etkileyen istatistiksel açıdan anlamlı bir değişken olduğu belirlenmiştir. Oral klirensteki azalmanın boyutu, orta şiddette böbrek yetmezliği olan hastalarda orta düzeyde (%20-40) olduğundan bu düşüşün klinik açıdan anlamlı olması beklenmemektedir. Bununla birlikte, şiddetli böbrek yetmezliği olan hastalarda dikkatli olunması gereklidir (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Ambrisentanın temel metabolizma yolu glukuronidasyon ve oksidasyon ile daha sonra safrada meydana gelen eliminasyon olduğundan karaciğer yetmezliğinin ambrisentan maruziyetinde (C ve EAA) bir artışa neden olması beklenebilir. Bir popülasyon farmakokinetiği analizinde, oral klirensin artan bilirubin düzeylerinin bir fonksiyonu olarak azaldığı gösterilmiştir. Bununla birlikte, bilirubinin etkisi orta düzeydedir (bilirubin düzeyi 0,6 mg/dl olan tipik bir hastaya kıyasla, bilirubin düzeyi artarak 4,5 mg/dl olan bir hastada oral ambrisentan klirensi yaklaşık %30 daha düşük olacaktır). Şiddetli karaciğer yetmezliği (siroz ile veya siroz olmadan) olan hastalarda ambrisentanın farmakokinetiği araştırılmamıştır. Bu nedenle, ambrisentan şiddetli karaciğer yetmezliği veya klinik açıdan anlamlı şekilde yüksek hepatik aminotransferaz değerleri (>3xULN) olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.3 ve 4.4).
5.3. Klinik öncesi güvenlilik verileri
Sınıfa özgü primer farmakolojik etki nedeniyle, yüksek tek doz ambrisentan (doz aşımı) uygulanması arteriyel basıncı düşürebilmiştir ve hipotansiyona ve vazodilatasyon ile ilişkili semptomlara neden olma potansiyeline sahiptir.
Ambrisentanın safra asidi taşıyıcısının bir inhibitörü olduğu veya aşırı hepatotoksisiteye neden
olduğu gösterilmemiştir.
İnsanlardaki terapötik düzeylerin altındaki maruziyetlerde kronik uygulamadan sonra kemirgenlerde nazal kavite epitelyumunda enflamasyon ve değişiklikler görülmüştür. Köpeklerde, hastalarda gözlenenin 20 katından daha yüksek maruziyetlerde kronik yüksek doz ambrisentan uygulanmasını takiben hafif enflamatuvar yanıtlar gözlenmiştir.
Klinik EAA'nın 3 katı maruziyet düzeylerinde ambrisentan uygulanan sıçanların nazal kavitesinde etmoid konkada nazal kemik hiperplazisi gözlenmiştir. Nazal kemik hiperplazisi fare veya köpeklerde ambrisentan ile gözlenmemiştir. Sıçanlarda, diğer bileşiklerle edinilen deneyime göre, nazal konkalarda kemikteki hiperplazi nazal enflamasyona karşı bilinen bir yanıttır.
Ambrisentan memeli hücrelerinde in vitro yüksek konsantrasyonlarda test edildiğinde
klastojenik özellik göstermiştir. Bakterilerdeveyaiki invivo kemirgen çalışmasında
ambrisentan için mutajenik veya genotoksik etki kanıtı saptanmamıştır.
Sıçan ve farelerde 2 yıllık oral dozaj çalışmalarında karsinojenik potansiyele dair bir kanıt saptanmamıştır. Yalnızca en yüksek dozda erkek sıçanlarda selim meme fibroadenomunda (bir benign tümör) hafif artış gözlenmiştir. Bu dozda erkek sıçanların sistemik ambrisentan maruziyeti (kararlı durum EAA'ya göre) 10 mg/gün klinik dozuyla erişilenin 6 katı olmuştur.
Erkek sıçanlar ve farelerde güvenlilik marjı olmaksızın yapılan oral tekrarlı doz toksisite ve fertilite çalışmalarında bazen aspermi ile ilişkilendirilen testiküler tübüler atrofi gözlenmiştir. Testiküler değişiklikler, doz uygulanmayan periyotta değerlendirildiğinde tam olarak düzeltilebilir olmamıştır. Bununla birlikte 39 haftaya kadarki çalışmalarda EAA'ya göre, insanlarda görülenden 35 kat yüksek bir maruziyette köpeklerde testiküler değişiklik gözlenmemiştir. Erkek sıçanlarda, (300mg/kg/gün'e kadar olan) test edilen hiçbir dozda ambrisentanın sperm motilitesine etkisi görülmemiştir. 300mg/kg/gün dozunda morfolojik olarak normal spermlerin yüzdesinde küçük bir azalma (%10'dan daha az) gözlemlenmiştir, ancak bu 100 mg/kg/gün dozunda (10 mg/gün klinik dozunun 9 katından fazla olan klinik maruziyet) gözlemlenmemiştir. Ambrisentanın erkeklerde fertilite üzerindeki etkisi bilinmemektedir.
Ambrisentanın tavşan ve sıçanlarda teratojenik olduğu gösterilmiştir. Test edilen tüm dozlarda alt çene, dil ve/veya damak anomalileri görülmüştür. Buna ek olarak sıçanlarda yapılan çalışmada interventriküler septal defektler, gövde damarlarında damar defektleri, tiroid ve timus anomalileri, sfenoid kemik tabanında osifikasyon ve umblikal arterin mesanenin sağ tarafında değil sol tarafında yer alması insidansında artış görülmüştür. Teratojenisitenin ERA maddelerinin bir sınıf etkisi olduğundan şüphelenilmektedir.
Geç gebelik ile laktasyon döneminde dişi sıçanlara insanlarda önerilen maksimum dozda EAA'nın 3 katı maruziyette ambrisentan uygulanması maternal davranışlarda yan etkilere neden olmuş, yavru hayatta kalımını azaltmış ve yavruların üreme yeteneğinde bozulmaya (nekropside küçük testis bulgusu ile) neden olmuştur.
Postnatal 7. günden 26., 36. veya 62. güne kadar günde bir defa oral olarak ambrisentan uygulanan jüvenil sıçanlarda; nefes alma sesleri, apne ve hipoksi görülmesinden sonra morfolojik veya nörodavranışsal değişiklik olmaksızın beyin ağırlığında azalma (-%3 ila -%8) görülmüştür. Bunlar, EAA'ya göre 10 mg'daki insan pediyatrik maruziyetlerinin (9 ila 15 yaş) yaklaşık 1,8 ila 7 katı maruziyetlerde gerçekleşmiştir. Bu bulgunun pediyatrik popülasyon için klinik açıdan önemi henüz bilinmemektedir.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Geri Ödeme Kodu | A16665 |
| Satış Fiyatı | 33175.6 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 33175.6 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699502094574 |
| Etkin Madde | Ambrisentan |
| ATC Kodu | C02KX02 |
| Birim Miktar | 5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Kalp Damar Sistemi > Diğer Antihipertansifler > Ambrisentan |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |