ANORO ELLIPTA 62.5/25 mcg kullanıma hazır inhilasyon tozu. 30 doz Kısa Ürün Bilgisi
{ Umeklidinyum Bromur + Vilanteral }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ANORO ELLIPTA 62,5 mcg + 25 mcg kullanıma hazır inhalasyon tozu
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Uygulanan her bir doz (Ellipta İnhaler'in ağızlığından çıkan doz) 55 mikrogram umeklidinyuma eşdeğer 65 mikrogram umeklidinyum bromür ve 22 mikrogram vilanterol (trifenatat olarak) içermektedir. Bu, kullanıma hazır 62,5 mikrogram umeklidinyuma eşdeğer 74,2 mikrogram umeklidinyum bromür ve 25 mikrogram vilanterole eşdeğer 40 mikrogram vilanterol trifenatat dozuna karşılık gelmektedir.
Yardımcı maddeler
Her bir doz yaklaşık olarak 25 mg laktoz (monohidrat olarak) içerir (inek sütünden elde edilir). Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kullanıma hazır inhalasyon tozu.
Kırmızı inhaler kapağı ve dahili bir doz sayacı olan açık gri inhaler. ANORO ELLIPTA, her biri beyaz bir toz içeren 30 dozluk iki adet blister şerit içermektedir. Blister şeritlerden biri her dozda 62,5 mikrogram umeklidinyum, diğeri her dozda 25 mikrogram vilanterol içerir.
1-24. haftada günde ortalama püskürtme sayısındaki fark
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ANORO ELLIPTA, erişkin kronik obstrüktif akciğer hastalarında (KOAH) görülen semptomların giderilmesine yönelik kontrol edici bir bronkodilatör tedavidir.
4.2. Pozoloji ve uygulama şekli
Yetişkinler:
Önerilen doz günde bir defa ANORO ELLIPTA 62,5/25 mikrogram inhalasyondur.
ANORO ELLIPTA, bronkodilatasyonu muhafaza etmek için her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. Maksimum doz, günde bir defa ANORO ELLIPTA 62,5/25 mikrogram inhalasyondur.
Uygulama şekli:
ANORO ELLIPTA sadece inhalasyon yoluyla kullanılır.
ANORO ELLIPTA her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. ANORO ELLIPTA tek dozluk kullanıma hazır inhalasyondur.
1
Kullanma Talimatı
ANORO ELLIPTA ilk kez kullanılmaya başlanıldığında düzgün çalıştığının kontrol edilmesi ve özel bir yöntemle kullanıma hazırlanması gerekmemektedir. Sadece aşağıdaki talimatlara uyulmalıdır.
ANORO ELLIPTA ambalajı aşağıdaki içeriklerden oluşur:
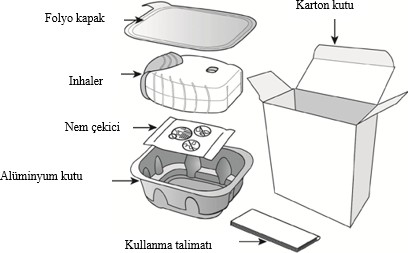
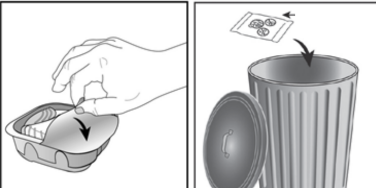
İnhaler, nemi azaltmak için nem çekici bir paket içeren alüminyum kutuda paketlenmiştir. Alüminyum kutunun kapağı açıldıktan sonra nem çekici paket atılmalıdır. Nem çekici paket açılmamalı, yutulmamalı veya teneffüs edilmemelidir. Dozu almaya hazır olana kadar alüminyum kutunun kapağı açılmamalıdır.
İnhaler alüminyum kutudan çıkarıldığında, “kapalı†pozisyonda olacaktır. İnhalerin son kullanma tarihi etiketindeki boşluğa yazılmalıdır. İnhalerin son kullanma tarihi alüminyum kutunun açılmasından sonra 6 haftadır. Son kullanma tarihinden sonra inhaler kullanılmamalıdır. Folyo kapak açıldıktan sonra atılabilir.
İnhaler kullanılmaya başlamadan önce aşağıdaki talimatlar okunmalıdır.
Eğer ilaç inhale edilmeden, inhaler kapağı açılıp kapatılırsa, bir doz harcanmış olur.
Harcanan doz inhalerin içerisinde güvenle tutulur fakat artık kullanılamaz. Bir inhalasyonda
yanlışlıkla ilave ilaç veya çift doz almak mümkün değildir.
Doz sayacı
Bu sayaç, inhaler içinde kaç doz ilaç kaldığını gösterir.
4.3. Kontrendikasyonlar
ANORO ELLIPTA,
Şiddetli süt proteini alerjisi bulunan hastalarda,
4.4. Özel kullanım uyarıları ve önlemleri
Astım
Umeklidinyum/vilanterolün astımlı hastalarda kullanımına ait çalışma bulunmadığından bu
hasta popülasyonunda kullanılmamalıdır.
Paradoksal bronkospazm
Umeklidinyum/vilanterolün uygulanması, yaşamı tehdit edebilecek paradoksal bronkospazma yol açabilir. Paradoksal bronkospazm oluşması halinde umeklidinyum/vilanterol ile tedavi derhal kesilmelidir ve gerekirse alternatif tedavi başlatılmalıdır.
Akut kullanım için değildir.
Umeklidinyum/vilanterol bronkospazmın akut ataklarının tedavisi için endike değildir.
Hastalığın kötüleşmesi
Semptomları rahatlatmak için artan kısa etkili bronkodilatör kullanımı, kontrolün bozulduğunu göstermektedir. Umeklidinyum/vilanterol ile tedavi sırasında KOAH'ın kötüleşmesi durumunda, hastanın ve KOAH tedavi rejiminin yeniden değerlendirmesi yapılmalıdır.
Kardiyovasküler etkiler
Umeklidinyum/vilanterol dahil muskarinik reseptör antagonistleri ve sempatomimetik ajanların uygulanmasından sonra kardiyak aritmiler (ör. atriyal fibrilasyon ve taşikardi) gibi kardiyovasküler etkiler görülebilir. Klinik olarak anlamlı kontrolsüz kardiyovasküler hastalığı olan hastalar klinik çalışmalardan çıkarılmıştır. Dolayısıyla, umeklidinyum/vilanterol şiddetli kardiyovasküler hastalığı olan hastalarda dikkatle kullanılmalıdır.
Antimuskarinik aktivite
Antimuskarinik aktivitesine bağlı olarak umeklidinyum/vilanterol, üriner retansiyonu veya dar açılı glokomu olan hastalarda dikkatli kullanılmalıdır.
Hipokalemi
Betaadrenerjik agonistler, bazı hastalarda istenmeyen kardiyovasküler etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyumundaki azalma genellikle geçicidir, takviye gerektirmez.
Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda hipokaleminin klinik olarak anlamlı etkisi görülmemiştir. Umeklidinyum/vilanterol, hipokalemiye neden olma potansiyeli olan diğer ilaçlarla birlikte kullanıldığında dikkatli olunmalıdır (bkz. Bölüm 4.5).
Hiperglisemi
Betaadrenerjik agonistler bazı hastalarda geçici hiperglisemiye neden olabilir.
Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda plazma glukozu üzerinde klinik olarak anlamlı etki görülmemiştir. Umeklidinyum/vilanterol ile tedaviye başlandığında plazma glukozu diyabetik hastalarda daha yakından takip edilmelidir.
Eşlik eden koşullar
Umeklidinyum/vilanterol, konvülsif bozuklukları veya tirotoksikozu olan hastalarda ve beta
adrenerjik agonistlere karşı alışılmadık duyarlılığı olan hastalarda dikkatli kullanılmalıdır.
Yardımcı maddeler
Bu tıbbi ürün laktoz içermektedir. Galaktoz intoleransı, Lapp laktaz eksikliği ve glukoz- galaktoz malabsorpsiyonu gibi nadir kalıtımsal sorunları olan hastalar bu ilacı kullanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Beta blokörler ile etkileşim:
Beta adrenerjik blokörler, vilanterol gibi betaadrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilirler. Kullanılmasını zorunlu kılan sebepler olmadıkça selektif veya selektif olmayan beta adrenerjik blokörlerin eşzamanlı kullanımından kaçınılmalıdır.
Metabolik ve taşıyıcı bazlı etkileşimler
Vilanterol, sitokrom P450 3A4'ün (CYP3A4) bir substratıdır. Güçlü CYP3A4 inhibitörlerinin (ör. ketokonazol, klaritromisin, itrakonazol, ritonavir, telitromisin) eş zamanlı uygulaması, vilanterolün metabolizmasını inhibe edebilir ve vilanterole sistemik maruziyeti arttırabilir. Ketokonazol (400 mg) ile birlikte uygulanması, ortalama vilanterol EAAve C'ı sırasıyla
%65 ve %22 oranında arttırmıştır. Vilanterol maruziyetindeki artış; kalp hızı, kan potasyumu veya QT aralığı (Fridericia yöntemi kullanılarak düzeltilmiş olan) üzerindeki beta adrenerjik agonist ile ilgili sistemik etkiler ile ilişkilendirilmemiştir. Umeklidinyum/vilanterolü, ketokonazol ve bilinen diğer güçlü CYP3A4 inhibitörleri ile birlikte uygularken dikkatli olunması tavsiye edilmektedir, çünkü vilanterole sistemik maruziyetin artma potansiyeli bulunmaktadır, bu da istenmeyen etkilerin artışına sebep olabilir. Orta güçte bir CYP3A4 inhibitörü olan verapamil, vilanterolün farmakokinetiğini anlamlı bir şekilde etkilememiştir.
Umeklidinyum, sitokrom P450 2D6'nın (CYP2D6) bir substratıdır. Umeklidinyumun kararlı durum farmakokinetiği, CYP2D6 eksikliği olan (zayıf metabolize edenler) sağlıklı gönüllülerde değerlendirilmiştir. 8 kat yüksek dozda, umeklidinyum EAA veya Cüzerinde herhangi bir etki gözlenmemiştir. 16 kat yüksek dozda, umeklidinyum EAA'da 1,3 kat artış gözlenmiştir ve umeklidinyum C'ı üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak, umeklidinyum/vilanterol CYP2D6 inhibitörleri ile birlikte veya CYP2D6 eksikliği bulunan hastalara (zayıf metabolize edenler) uygulandığında klinik olarak anlamlı bir ilaç etkileşimi beklenmemektedir.
Hem umeklidinyum hem de vilanterol, P-glikoprotein taşıyıcısının (P-gp) substratlarıdır. Orta güçte P-gp inhibitörü verapamilin (günde bir kez 240 mg), umeklidinyum ve vilanterolün kararlı durum farmakokinetiği üzerindeki etkisi sağlıklı gönüllülerde değerlendirilmiştir. Verapamilin, umeklidinyum veya vilanterol C'ları üzerinde herhangi bir etkisi gözlenmemiştir. Umeklidinyum EAA'da yaklaşık 1,4 kat artış gözlenmiş olup vilanterol EAA değeri üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak, umeklidinyum/vilanterol, P-gp inhibitörleri ile birlikte uygulandığında klinik olarak anlamlı bir ilaç etkileşimi beklenmemektedir.
Diğer antimuskarinikler ve sempatomimetikler
agonistlerin istenmeyen etkilerini artırabileceğinden tavsiye edilmemektedir (bkz. Bölüm 4.4 ve 4.9).
Hipokalemi
Metilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretikler ile eş zamanlı hipokalemik tedavi betaadrenerjik agonistlerin olası hipokalemik etkilerini artırabileceğinden dikkatle kullanılmalıdır (bkz. Bölüm 4.4).
KOAH için kullanılan diğer tıbbi ürünler
Resmi in vivo ilaç etkileşim çalışmaları yapılmamış olmasına karşın, inhale umeklidinyum/vilanterol, kısa etkili sempatomimetik bronkodilatörler ve inhale kortikosteroidler de dahil olmak üzere diğer KOAH tıbbi ilaçları ile eş zamanlı olarak kullanılmış olup klinik ilaç etkileşimi gözlenmemiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlarda herhangi bir etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyonda herhangi bir etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon)
uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
Gebelik dönemi
Umeklidinyum/vilanterolün gebe kadınlarda kullanımına ilişkin veri bulunmamaktadır. Hayvanlarda yapılan çalışmalar, vilanterolün uygulanmasından sonra üreme toksisitesi göstermiştir (bkz. Bölüm 5.3). Umeklidinyum/vilanterol gebelik döneminde, sadece anne için beklenen yararları fetüs için olası risklerden fazla olduğunda kullanılmalıdır.
Laktasyon dönemi
Umeklidinyum veya vilanterolün anne sütüne geçip geçmediği bilinmemektedir. Ancak, anne sütünde diğer betaadrenerjik agonistler tespit edilmiştir. Yeni doğana/bebeklere yönelik risk dışlanamaz. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmenin kesilmesi veya ANORO ELLIPTA tedavisinin kesilmesinden hangisinin yapılması gerektiği konusunda bir karara varılmalıdır.
Üreme yeteneği/Fertilite
Umeklidinyum/vilanterolün insanlarda fertilite üzerindeki etkilerine ilişkin herhangi bir veri yoktur. Hayvan çalışmaları umeklidinyum veya vilanterolün fertilite üzerinde hiçbir etkisi olmadığını göstermektedir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Umeklidinyum/vilanterol'ün araç ve makine kullanımı üzerine herhangi bir etkisi yoktur veya
ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Umeklidinyum/vilanterol ile en sık rapor edilen istenmeyen etki nazofarenjit olmuştur (%9).
4.8. İstenmeyen etkiler
ANORO ELLIPTA'nın güvenlilik profili, KOAH'lı 6855 hastanın dahil olduğu klinik geliştirme programında, umeklidinyum/vilanterol ve bileşenlerin her biriyle elde edilmiş güvenlilik deneyimine ve spontan raporlamaya dayanmaktadır.
Klinik geliştirme programı 24 hafta veya daha uzun süren Faz III klinik çalışmada günde bir kez umeklidinyum/vilanterol almış olan 2354 hasta; 24 haftalık çalışmada 55/22 mcg'lık önerilen dozu almış olan 1296 hasta, 24 haftalık bir çalışmada 113/22 mcg'lık yüksek dozu almış olan 832 hasta ve 12 aylık bir çalışmada 113/22 mcg dozunu almış 226 hastayı içermektedir.
Aşağıda verilen yan etkilere atanan frekanslar 24-haftalık beş çalışmanın entegrasyonundan ve 12 aylık güvenlilik çalışmasından gözlemlenen ham sıklık oranlarını içermektedir.
Aşağıda istenmeyen etkiler MedDRA vücut organ sistem sınıflandırması ve sıklığa göre liste halinde sunulmaktadır. İstenmeyen etkilerin sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: İdrar yolu enfeksiyonu, sinüzit, nazofarenjit, farenjit, üst solunum yolu enfeksiyonu
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Döküntüyü içeren hipersensitivite reaksiyonları
Seyrek: Anaflaksi, anjiyoödem ve ürtikeri içeren hipersensitivite reaksiyonları
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı Yaygın olmayan: Tremor, disguzi Bilinmiyor: Baş dönmesi
Göz hastalıkları
Seyrek: Glokom, bulanık görme, intraoküler basınç artışı, göz ağrısı
Kardiyak hastalıklar
Yaygın olmayan: Atriyal fibrilasyon, supraventriküler taşikardi, idioventriküler ritim, taşikardi, supraventriküler ekstrasistoller, çarpıntı
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Öksürük, orofarenjiyal ağrı Yaygın olmayan: Disfoni
Seyrek: Paradoksalbronkospazm
Gastrointestinal hastalıklar
Yaygın: Kabızlık, ağız kuruluğu
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Döküntü
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın olmayan: Kas spazmları
Böbrek ve idrar yolu hastalıkları
Seyrek: Üriner retansiyon, disüri, mesane çıkışı obstrüksiyonu
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Umeklidinyum/vilanterolün doz aşımında muhtemelen bireysel bileşenlerin etkilerinden kaynaklanan, bilinen inhale muskarinik antagonist istenmeyen etkiler (ör: ağız kuruluğu, görme bozuklukları ve taşikardi) ve diğer betaadrenerjik agonistlerde doz aşımında görülen istenmeyen etkiler (ör. aritmiler, tremor, baş ağrısı, palpitasyonlar, bulantı, hiperglisemi ve hipokalemi) ile tutarlı belirti ve semptomlar görülecektir.
Tedavi
Eğer doz aşımı meydana gelirse, hastaya gerektiği şekilde uygun takip ile destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif hava yolu hastalıkları için ilaçlar, kortikosteroidlerle birlikte üçlü kombinasyon dahil antikolinerjikler ile kombinasyon halinde adrenerjikler
ATC kodu: R03AL03
Etki mekanizması:
Umeklidinyum/vilanterol uzun etkili bir muskarinik reseptör antagonisti/uzun etkili betaadrenerjik agonistinin (LAMA/LABA) inhalasyona yönelik bir kombinasyonudur. İnhalasyonu takiben, her iki bileşen, solunum yollarına lokal olarak etki eder ve farklı mekanizmalarla bronkodilatasyon yaratır.
Umeklidinyum
doğrudan uygulandığında, in vitro insan M3 muskarinik reseptör alttüründe yavaş reversibilite
ve in vivo uzun etki süresi gösterir.
Vilanterol
Vilanterol, selektif, uzun etkili bir betaadrenerjik reseptör agonistidir (betaadrenerjik agonisti). Vilanterol de dahil olmak üzere betaadrenerjik agonist ilaçların farmakolojik etkileri, en azından kısmen de olsa adenozin trifosfatın (ATP) siklik 3′,5′-adonezin monofosfata (siklik AMP) dönüşmesinde katalizör görevi gören enzim olan intrasellüler adenilat siklazın stimülasyonu ile ilişkilendirilebilir. Artan siklik AMP düzeyleri bronşiyal düz kasın gevşemesine ve özellikle mast hücreler olmak üzere hücrelerden ani aşırı duyarlılık aracılarının salınmasının inhibe edilmesine neden olmaktadır.
Farmakodinamik etkiler
Faz III, 6 aylık çalışmalarda plaseboya kıyasla umeklidinyum/vilanterol, günde bir kez uygulamayı takiben 24 saatte akciğer fonksiyonunda (1 saniyedeki zorlu ekspiratuar hacim [FEV] ile ölçüldüğü üzere), ilk dozun uygulanmasından sonra 15. dakikada belirginleşen (plaseboya kıyasla 112 ml iyileşme (p<0,001*)) klinik anlamlı iyileşmeler sağlamıştır. Plaseboya kıyasla doz uygulamasını takip eden ilk 6 saat içinde FEV'deki ortalama pik iyileşmeleri 24. haftada 224 ml'dir (p<0,001*). ANORO ELLIPTA etkisinde zaman içerisinde taşifilaksi kanıtına rastlanmamıştır.
Kardiyak elektrofizyoloji
Umeklidinyum/vilanterolün QT aralığı üzerindeki etkisi 103 sağlıklı gönüllüde 10 gün boyunca günde bir kez 113/22 mikrogram veya 500/100 mikrogram (önerilen dozun sekiz katı umeklidinyum ve önerilen dozun dört katı vilanterol ile tek doz) umeklidinyum/vilanterol uygulamasını içeren plasebo ve aktif (moksifloksasin) kontrollü QT çalışmasında değerlendirilmiştir. QT aralığı uzamalarında başlangıca göre düzeltme sonrasında plaseboya göre maksimum ortalama fark (Fridericia yöntemi kullanılarak düzeltilmiş, QTF) umeklidinyum/vilanterol 113/22 mikrogram ile uygulamadan 10 dakika sonra 4,3 (%90 GA=2,2 ila 6,4) milisaniye ve umeklidinyum/vilanterol 500/100 mikrogram ile uygulamadan 30 dakika sonra 8,2 (%90 GA=6,2 ila 10,2) milisaniyedir. Bu nedenle umeklidinyum/vilanterol 113/22 mikrogram ile QT aralığı uzamaları ile ilişkili klinik ilgiye sahip pro-aritmik potansiyel gözlenmemiştir.
Kalp hızında doza bağımlı bir artış da gözlenmiştir. Kalp hızında başlangıca göre düzeltme sonrasında plaseboya kıyasla maksimum ortalama fark umeklidinyum/vilanterol 113/22 mikrogram ve 500/1000 mikrogram uygulamasından 10 dakika sonra sırasıyla 8,4 (%90 GA = 7 ila 9,8) atım/dakika ve 20,3 (%90 GA = 18,9 ila 21,7) atım/dakikadır.
Ayrıca, 6 aylık bir çalışmada günde bir kez umeklidinyum/vilanterol 55/22 mikrogram ile tedavi edilen KOAH'lı 53 hastada veya 6 aylık bir başka çalışmada günde bir kez umeklidinyum/vilanterol 113/22 mikrogram alan ilave 55 hastada ve 12 aylık bir çalışmada günde bir kez 113/22 mikrogram alan 226 hastada 24 saatlik Holter takibinde kardiyak ritim üzerinde klinik olarak anlamlı etkiler gözlenmemiştir.
*Bu çalışmada geriye doğru adımlamatestikullanılmıştırvebukarşılaştırma, istatistiksel anlamlılığa ulaşmayan
Klinik etkililik ve güvenlilik
Günde bir kez uygulanan umeklidinyum/vilanterolün klinik etkililiği klinik KOAH tanısı almış 6.835 yetişkin hastada yürütülen sekiz Faz III klinik çalışmada değerlendirilmiştir; 6 aylık çalışmalardan 5.618 hasta (iki plasebo kontrollü ve üç aktif [tiotropium]-komparatör kontrollü), iki 3 aylık egzersiz dayanımı/akciğer fonksiyonu çalışmalarından 655 hasta ve 12 aylık destekleyici bir çalışmadan 562 hasta.
Akciğer fonksiyonu üzerindeki etkiler
ANORO ELLIPTA çeşitli çalışmalarda akciğer fonksiyonunda iyileşmeler (dip FEV'de başlangıca göre değişiklik olarak tanımlanan) göstermiştir. 6 aylık bir Faz III çalışmasında, ANORO ELLIPTA 24. haftada plaseboya ve her bir monoterapi bileşeni tedavi koluna kıyasla dip FEV'de istatistiksel olarak anlamlı iyileşmeler göstermiştir.
Ayrıca, ANORO ELLIPTA üç adet 6 aylık aktif kontrollü çalışmanın ikisinde dip FEV'de tiotropiyuma kıyasla klinik olarak önemli ve istatistiksel olarak anlamlı iyileşmeler ve üçüncü aktif komparatörlü çalışmada tiotropiuma kıyasla sayısal olarak daha fazla iyileşmeler göstermiştir (bkz. Tablo 1). Bronkodilatör etkisinde zaman içerisinde bir azalma görülmemiştir.
Semptomatik sonuçlar
Nefes darlığı:
ANORO ELLIPTA plaseboya kıyasla 24. haftada TDI fokal skorunda (kritik ikincil sonlanım noktası) artış ile değerlendirilen nefes darlığında istatistiksel olarak ve klinik olarak anlamlı azalma göstermiştir (bkz. Tablo 1). Her bir monoterapi bileşeni ve tiotropiuma kıyasla TDI fokal skorundaki iyileşmeler istatistiksel olarak anlamlı değildir (bkz. Tablo 1).
24. haftada TDI fokal skorunda en az 1 ünitelik minimum klinik önemli fark (MCID) ile yanıt veren hasta oranı plaseboya (%41) ve her bir monoterapi bileşenine (umeklidinyum için %53 ve vilanterol için %51) kıyasla ANORO ELLIPTA için daha yüksektir (%58).
Sağlıkla bağlantılı yaşam kalitesi:
ANORO ELLIPTA aynı zamanda St. George Solunum Anketi (SGRQ) kullanılarak ölçülen sağlıkla bağlantılı yaşam kalitesinde plasebo ve her bir monoterapi bileşenine kıyasla 24. haftada SGRQ toplam skorundaki azalma ile kanıtlanan bir iyileşme göstermiştir (bkz., Tablo 1). ANORO ELLIPTA üç aktif kontrollü çalışmanın birinde tiotropiuma kıyasla SGRQ toplam skorunda istatistiksel olarak anlamlı bir azalma göstermiştir (bkz. Tablo 1).
24. haftada SGRQ skorunda en az MCID (başlangıca göre 4 birimlik bir azalma olarak tanımlanan) ile yanıt veren hasta oranı plasebo (%34) ve her bir monoterapi bileşenine (umeklidinyum için %44 ve vilanterol için %48) kıyasla ANORO ELLIPTA için daha yüksektir (%49). Bir aktif komparatör çalışmasında, ANORO ELLIPTA kullanan daha yüksek bir hasta yüzdesi tiotropiuma (%46) kıyasla 24. haftada SGRQ skorunda klinik olarak anlamlı bir iyileşme (%53) ile yanıt vermiştir. Diğer iki aktif komparatörlü çalışmada, benzer bir hasta oranı ANORO ELLIPTA ve tiotropium ile en az MCID elde edilmiştir; ANORO ELLIPTA 62,5/25 mikrogram için %49 ve %54 ve tiotropium için %52 ve %55.
Kurtarıcı ilaç kullanımı
ANORO ELLIPTA, plasebo ve umeklidinyuma kıyasla salbutamol ile kurtarıcı ilaç kullanımını 1-24 hafta boyunca azaltmıştır (bkz. Tablo 1) ve başlangıca göre kurtarıcı ilaç kullanımının gerekmediği gün oranında artış sağlamıştır (ortalama %11,1); plaseboda ise bu oranda başlangıca göre azalma gözlenmiştir(ortalama%0,9).
Üç adet 6 aylık aktif komparatör kontrollü çalışmada, ANORO ELLIPTA tiotropiuma kıyasla salbutamol ile kurtarıcı ilaç kullanımını azaltmıştır ve çalışmaların ikisinde bu azalmalar istatistiksel olarak anlamlıdır (bkz. Tablo 1). ANORO ELLIPTA aynı zamanda üç çalışmanın tümünde kurtarıcı ilaç kullanımının gerekmediği gün oranında tiotropiuma kıyasla (ortalama
%11,7 ila %13,4 aralığı içinde) başlangıca göre yüksek bir artış göstermiştir (ortalama %17,6 ila %21,5 aralığı içinde).
Tablo 1. 24. haftada akciğer fonksiyonu, semptomatik ve sağlıkla bağlantılı yaşam kalitesi bulguları
ANORO ELLIPTA 62,5/25 mcg ile tedavi kıyaslamaları | Tedavi farkı(%95 güven aralıkları, p-değeri) | |||
Dip FEV(ml) | TDI Fokal Skoru | SGRQ Toplam Skoru | Kurtarıcı ilaç kullanımı | |
ANORO ELLIPTA (N = | 167 | 1,2 | -5,51 | -0,8 |
413) | (128, 207) | (0,7,1,7) | (-7,88, -3,13) | (-1,3,-0,3) |
karşısında plasebo (N = 280) | <0,001 | <0,001 | <0,001 | 0,001 |
ANORO ELLIPTA (N = 413) karışışında umeklidinyum 62,5 mcg (N = 418) | 52 (17, 87) 0,004 | 0,3 (-0,2, 0,7) 0,244 | -0,82 (-2,9, 1,27) 0,441 | -0,6 (-1, -0,1) 0,014 |
ANORO ELLIPTA (N = | 95 (60, 130) <0,001 | 0,4 (-0,1, 0,8) 0,117 | -0,32 (-2,41, 1,78) 0,767 | 0,1 (-0,3, 0,5) 0,675 |
413) | ||||
karşısında vilanterol 25 mcg | ||||
(N = 421) | ||||
ANORO ELLIPTA (N = 454) karşısında tiotropium 18 mcg (N = 451) (Çalışma ZEP117115) |
112 (81, 144) <0,001 |
n/e |
-2,10 (-3,61, -0,59) 0,006 |
-0,5 (-0,7, -0,2) <0,001 |
ANORO ELLIPTA |
90 (39, 141) <0,001 |
|
0,75 (-2,12, 3,63) 0,607 |
-0,7 (-1,2, -0,1) 0,022 |
(N = 207) |
| |||
karşısında |
| |||
tiotropium 18 mcg |
| |||
(N = 203) (Çalışma DB2113360) | 0,1 (-0,4, 0,5) 0,817 | |||
ANORO ELLIPTA (N = 217) karşısında tiotropium 18 mcg (N = 215) |
60 (10, 109) 0,018 |
-0,17 (-2,85, 2,52) 0,904 |
-0,6 (-1,2, 0,0) 0,069 | |
(Çalışma DB2113374) |
|
|
|
|
*Bu çalışmada geriye doğru adımlama testi kullanılmıştır ve bu karşılaştırma, istatistiksel anlamlılığa ulaşmayan bir karşılaştırmanın altındadır. Bu nedenle, bu karşılaştırmadan istatistiksel bir anlama varmak olası değildir.
N = Tedavi amaçlı popülasyon cinsinden sayı
mcg = mikrogram
n/e = değerlendirilmemiştir
En küçük kareler ortalaması
5.2. Farmakokinetik özellikler
Genel özelliklerUmeklidinyum ve vilanterol inhalasyon yoluyla birlikte uygulandığında, her bir bileşenin farmakokinetiği her bir etkin madde ayrı ayrı uygulandığında gözlenene benzerdi. Dolayısıyla, farmakokinetik amaçlar için her bir bileşen bağımsız olarak düşünülebilir.
Emilim
Umeklidinyum
Umeklidinyumun sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, C5-15 dakikada oluşmuştur. İnhale umeklidinyumun mutlak biyoyararlanımı, oral emilimden gelen önemsiz düzeyde katkı ile dozun ortalama %13'üdür. İnhale umeklidinyumun yinelenen dozlamını takiben, kararlı durum, 1,5-1,8 katı birikim ile 7-10 gün arasında elde edilmiştir.
Vilanterol
Vilanterolün sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, C5-15 dakikada oluşmuştur. İnhale vilanterolün mutlak biyoyararlanımı oral emilimden gelen önemsiz düzeyde katkı ile %27'dir. İnhale vilanterolün yinelenen dozlarını takiben, kararlı durum, 2,4 katı birikim ile 6 gün içinde elde edilmiştir.
Dağılım
Umeklidinyum
Sağlıklı gönüllülere intravenöz uygulamayı takiben, ortalama dağılım hacmi 86 litredir. İnsan plazmasındaki in vitro plazma proteinine bağlanma oranı ortalama %89'dur.
Vilanterol
Sağlıklı gönüllülere yapılan intravenöz uygulamayı takiben, kararlı durumda ortalama dağılım hacmi 165 litredir. İnsan plazmasındaki in vitro plazma proteinine bağlanma oranı ortalama
%94'tür.
Biyotranformasyon
Umeklidinyum
İn vitro çalışmalar, umeklidinyumun daha çok sitokrom P450 2D6 (CYP2D6) tarafından metabolize edildiğini ve P-glikoprotein (P-gp) transporteri için bir substrat olduğunu göstermiştir. Umeklidinyum için primer metabolik yollar, oksidatif (hidroksilasyon, O- dealkilasyon) ve bunu takiben konjugasyonu (glukuronidasyon vb.) olup, düşük farmakolojik aktivite içeren ya da farmakolojik aktivitesi olmayan bir dizi metabolitle sonuçlanmıştır. Sistemik metabolit maruziyeti düşüktür.
Vilanterol
In vitro çalışmalar, vilanterolün daha çok sitokrom P450 3A4 (CYP3A4) tarafından metabolize edildiğini ve P-gp transporteri için bir substrat olduğunu göstermiştir. Primer metabolik yollar, anlamlı olarak düşük betave betaadrenerjik agonist aktivitesi olan bir dizi metabolite O- dealkilasyondur. İnsanlarda radyoaktif işaretli madde ile yapılan oral vilanterol uygulamasını takiben plazma metabolik profilleri, yüksek ilk geçiş metabolizması ile tutarlıdır. Sistemik metabolit maruziyeti düşüktür.
Eliminasyon
Umeklidinyum
İntravenöz uygulamayı takiben plazma klirensi 151 litre/saattir. İntravenöz uygulamayı takiben, uygulanan radyoaktif işaretli dozun yaklaşık %58'i (ya da geri kazanılan radyoaktivitenin
%73'ü) doz sonrası 192 saatte dışkı ile atılmıştır. Üriner eliminasyon, 168. saatte uygulanan radyoaktif işaretli dozun %22'sine (geri kazanılan radyoaktivitenin %27'si) karşılık gelmektedir. İntravenöz dozlamı takiben ilaçla ilgili maddelerin dışkı ile atılması, safraya salımı göstermiştir. Sağlıklı erkek gönüllülerde oral uygulamayı takiben, toplam radyoaktivite, doz sonrası 168 saatte daha çok dışkı ile atılmıştır (uygulanan radyoaktif işaretli dozun yaklaşık
%92'si ya da geri kazanılan radyoaktivitenin %99'u). Oral olarak uygulanan dozun %1'inden azı (geri kazanılan radyoaktivitenin %1'i) idrarla atılmıştır ve bu da oral uygulamayı takiben önemsiz düzeyde emilim olduğunu göstermiştir. 10 gün boyunca uygulanan inhale dozlamı takiben umeklidinyum plazma eliminasyon yarı ömrü ortalama 19 saat olup ilacın %3'ü ila
%4'ü kararlı durumda idrarda değişmeden atılmıştır.
Vilanterol
İntravenöz uygulamayı takiben vilanterolün plazma klirensi 108 litre/saattir. Radyoaktif işaretli
vilanterolün oral uygulamasını takiben, kütle dengesi, radyoaktif işaretin %70'inin idrarda ve
%30'unun dışkıda olduğunu göstermiştir. Vilanterolün primer eliminasyonu, metabolizmayı takiben idrar ve dışkıda metabolitelerin atılımı ile gerçekleştirilmiştir. 10 gün boyunca inhale dozlamı takiben vilanterol plazma eliminasyon yarı ömrü ortalama 11 saattir.
Doğrusallık/Doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Yapılan bir popülasyon farmakokinetik analizi, umeklidinyum ve vilanterol farmakokinetiğinin 65 yaş ve üzeri ve 65 yaşın altındaki KOAH hastaları arasında benzer olduğunu göstermiştir.
Böbrek yetmezliği:
Şiddetli böbrek yetmezliği bulunan hastalarda, önerilen dozun iki katı umeklidinyum ve önerilen dozda vilanterol içeren umeklidinyum/vilanterol uygulamasından sonra sistemik umeklidinyum ya da vilanterol maruziyetinde herhangi bir artış olduğuna (Cve EAA) ve şiddetli böbrek yetmezliği bulunan hastalar ve sağlıklı gönüllüler arasında değişen protein bağlanma profili görüldüğüne dair herhangi bir kanıt mevcut değildir.
Karaciğer yetmezliği:
Orta düzeyde karaciğer yetmezliği (Child-Pugh Class B) bulunan hastalarda, önerilen dozun iki katı umeklidinyum ve önerilen dozda vilanterol içeren umeklidinyum/vilanterol uygulamasından sonra sistemik umeklidinyum ya da vilanterol maruziyetinde herhangi bir artış olduğuna (Cve EAA) ve orta düzeyde karaciğer yetmezliği bulunan hastalar ve sağlıklı gönüllüler arasında değişen protein bağlanma profili görüldüğüne dair herhangi bir kanıt mevcut değildir. Umeklidinyum/vilanterol, şiddetli karaciğer yetmezliği bulunan hastalarda değerlendirilmemiştir.
Diğer özel popülasyonlar:
Yapılan bir popülasyon farmakokinetik analizi, yaş, ırk, cinsiyet, inhale kortikosteroid kullanımı ya da vücut ağırlığının etkisi dikkate alınarak umeklidinyum ya da vilanterol için herhangi bir doz ayarlaması gerekmediğini göstermiştir. Zayıf CYP2D6 metabolize edicilere ilişkin bir çalışma, sistemik umeklidinyum maruziyeti üzerinde CYP2D6 genetik polimorfizminin klinik olarak anlamlı herhangi bir etki oluşturmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Tek başlarına ve kombinasyon halinde umeklidinyum ve vilanterol ile yapılan klinik dışı çalışmalarda, bulgular tipik olarak, sırasıyla muskarinik reseptör antagonisti ya da betaadrenerjik agonistlerin primer farmakolojisi ve/veya lokal tahriş ile ilişkilendirilmiştir. Aşağıdaki ifadeler her bir bileşene ilişkin gerçekleştirilmiş olan çalışmaları yansıtmaktadır.
Genotoksisite ve karsinojenisite:
Umeklidinyum standart çalışmalarda genotoksik değilken EAA'ya göre, umeklidinyum 55 mikrogramın insan klinik maruziyetinin sırasıyla 26 ya da 22 katı maruziyet düzeylerinde farelerde ya da sıçanlarda gerçekleştirilen yaşam boyu inhalasyon çalışmalarında da karsinojenik olmadığı görülmüştür.
Genetik toksisite çalışmalarında vilanterol (alfa-fenilsinnamat olarak) ve trifenilasetik asit genotoksik değildi ve bu da vilanterolün insanlar için genotoksik bir risk oluşturmadığını göstermektedir. Diğer betaadrenerjik agonistlere yönelik bulgularla tutarlı olarak, yaşam boyu inhalasyon çalışmalarında vilanterol, dişi sıçan ve fare üreme yolunda ve sıçan hipofiz bezinde proliferatif etkilere yol açmıştır. EAA'ya dayanarak, vilanterol 22 mikrogramın insan klinik maruziyetinin sırasıyla 0,5 ya da 13 katı maruziyet düzeylerinde sıçanlarda ya da farelerde görülen tümör insidansında herhangi bir artış olmamıştır.
Üreme toksisitesi:
Umeklidinyum sıçanlar veya tavşanlarda teratojenik olmamıştır. 180 mikrogram/kg/gün (EAA'ya göre insanın 55 mikrogram umeklidinyuma klinik maruziyetinin yaklaşık 80 katı) dozu verilen annelerde yapılan bir pre ve post natal çalışmada, sıçanlara yapılan subkütan umeklidinyum uygulaması, annede daha düşük vücut ağırlığı artışı ve besin tüketimi ile sonuçlanmıştır ve yavrunun vücut ağırlığını sütten kesmeden önce hafifçe azaltmıştır.
Vilanterol, sıçanlarda teratojenik özellik göstermemiştir. Tavşanlarda yapılan inhalasyon çalışmalarında, vilanterol, EAA'ya göre klinik insan maruziyetinin 6 katında diğer betaadrenerjik agonistler ile görülenlere benzer etkiler yaratmıştır (yarık damak, göz kapağında açılma, sternebral füzyon ve ekstremite fleksürü/malrotasyon). Vilanterol 22 mikrogram subkütan olarak verildiğinde, EAA'ya dayalı klinik insan maruziyetinin 36 katında hiçbir etki görülmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (inek sütünden elde edilir.) Magnezyum stearat
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
Alüminyum kutu açıldıktan sonraki raf ömrü: İçinde bulunduğu alüminyum kutudan
çıkarıldıktan sonra 30ºC'nin altındaki oda sıcaklığında 6 hafta.
İnhaler alüminyum kutudan çıkarılır çıkarılmaz etiketi üzerinde bulunan boşluğa inhalerin son kullanma tarihi yazılır.
6.4. Saklamaya yönelik özel tedbirler
30ºC altındaki oda sıcaklığında ve kuru bir yerde muhafaza ediniz.
İnhaleri nemden korumak için kapalı alüminyum kutu içinde muhafaza ediniz ve ancak ilk kez kullanmaya başlayacağınız zaman alüminyum kutuyu açıp inhalerinizi içinden çıkarınız.
Alüminyum kutu açıldıktan sonra inhaler en fazla 6 hafta kullanılabilir. İnhaler alüminyum kutudan çıkarılır çıkarılmaz etiketi üzerinde bulunan boşluğa inhalerin son kullanma tarihi yazılır. İnhalerin son kullanma tarihi alüminyum kutunun açılmasından sonra 6 haftadır. Etiket üzerine yazılan son kullanma tarihinden sonra inhaler kullanılmamalıdır. Folyo, alüminyum kutu açıldıktan sonra atılabilir.
6.5. Ambalajın niteliği ve içeriği
Plastik inhaler, nem çekici paket içeren bir alüminyum kutu içerisinde paketlenmiş olan açık gri renkli bir gövde, kırmızı renkli inhaler kapağı ve bir doz sayacından oluşmaktadır. Alüminyum kutu, sıyrılabilen bir folyo kapak ile kapatılmıştır. İnhalerde 30 dozluk kullanıma hazır blisterden oluşan, her biri beyaz bir toz içeren iki alüminyum folyo şerit bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeğiâ€ne uygun olarak imha edilmelidir.
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A16378 |
| Satış Fiyatı | 1023.22 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 1023.22 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522557660 |
| Etkin Madde | Umeklidinyum Bromur + Vilanteral |
| ATC Kodu | R03AL03 |
| Birim Miktar | 62,5+25 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| İthal ( ref. ülke : Ingiltere ) ve Beşeri bir ilaçdır. |