ANORO ELLIPTA 62.5/25 mcg kullanıma hazır inhilasyon tozu. 30 doz Klinik Özellikler
{ Umeklidinyum Bromur + Vilanteral }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ANORO ELLIPTA, erişkin kronik obstrüktif akciğer hastalarında (KOAH) görülen semptomların giderilmesine yönelik kontrol edici bir bronkodilatör tedavidir.
4.2. Pozoloji ve uygulama şekli
Yetişkinler:
Önerilen doz günde bir defa ANORO ELLIPTA 62,5/25 mikrogram inhalasyondur.
ANORO ELLIPTA, bronkodilatasyonu muhafaza etmek için her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. Maksimum doz, günde bir defa ANORO ELLIPTA 62,5/25 mikrogram inhalasyondur.
Uygulama şekli:
ANORO ELLIPTA sadece inhalasyon yoluyla kullanılır.
ANORO ELLIPTA her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. ANORO ELLIPTA tek dozluk kullanıma hazır inhalasyondur.
1
Kullanma Talimatı
ANORO ELLIPTA ilk kez kullanılmaya başlanıldığında düzgün çalıştığının kontrol edilmesi ve özel bir yöntemle kullanıma hazırlanması gerekmemektedir. Sadece aşağıdaki talimatlara uyulmalıdır.
ANORO ELLIPTA ambalajı aşağıdaki içeriklerden oluşur:
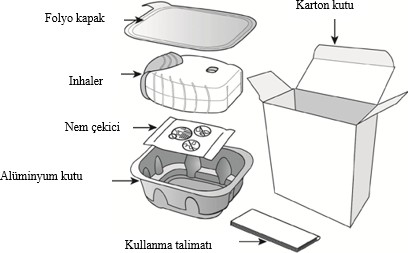
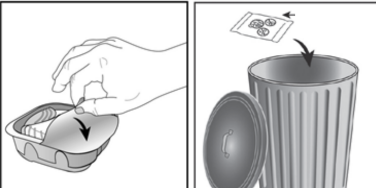
İnhaler, nemi azaltmak için nem çekici bir paket içeren alüminyum kutuda paketlenmiştir. Alüminyum kutunun kapağı açıldıktan sonra nem çekici paket atılmalıdır. Nem çekici paket açılmamalı, yutulmamalı veya teneffüs edilmemelidir. Dozu almaya hazır olana kadar alüminyum kutunun kapağı açılmamalıdır.
İnhaler alüminyum kutudan çıkarıldığında, “kapalı†pozisyonda olacaktır. İnhalerin son kullanma tarihi etiketindeki boşluğa yazılmalıdır. İnhalerin son kullanma tarihi alüminyum kutunun açılmasından sonra 6 haftadır. Son kullanma tarihinden sonra inhaler kullanılmamalıdır. Folyo kapak açıldıktan sonra atılabilir.
İnhaler kullanılmaya başlamadan önce aşağıdaki talimatlar okunmalıdır.
Eğer ilaç inhale edilmeden, inhaler kapağı açılıp kapatılırsa, bir doz harcanmış olur.
Harcanan doz inhalerin içerisinde güvenle tutulur fakat artık kullanılamaz. Bir inhalasyonda
yanlışlıkla ilave ilaç veya çift doz almak mümkün değildir.
Doz sayacı
Bu sayaç, inhaler içinde kaç doz ilaç kaldığını gösterir.
4.3. Kontrendikasyonlar
ANORO ELLIPTA,
Şiddetli süt proteini alerjisi bulunan hastalarda,
4.4. Özel kullanım uyarıları ve önlemleri
Astım
Umeklidinyum/vilanterolün astımlı hastalarda kullanımına ait çalışma bulunmadığından bu
hasta popülasyonunda kullanılmamalıdır.
Paradoksal bronkospazm
Umeklidinyum/vilanterolün uygulanması, yaşamı tehdit edebilecek paradoksal bronkospazma yol açabilir. Paradoksal bronkospazm oluşması halinde umeklidinyum/vilanterol ile tedavi derhal kesilmelidir ve gerekirse alternatif tedavi başlatılmalıdır.
Akut kullanım için değildir.
Umeklidinyum/vilanterol bronkospazmın akut ataklarının tedavisi için endike değildir.
Hastalığın kötüleşmesi
Semptomları rahatlatmak için artan kısa etkili bronkodilatör kullanımı, kontrolün bozulduğunu göstermektedir. Umeklidinyum/vilanterol ile tedavi sırasında KOAH'ın kötüleşmesi durumunda, hastanın ve KOAH tedavi rejiminin yeniden değerlendirmesi yapılmalıdır.
Kardiyovasküler etkiler
Umeklidinyum/vilanterol dahil muskarinik reseptör antagonistleri ve sempatomimetik ajanların uygulanmasından sonra kardiyak aritmiler (ör. atriyal fibrilasyon ve taşikardi) gibi kardiyovasküler etkiler görülebilir. Klinik olarak anlamlı kontrolsüz kardiyovasküler hastalığı olan hastalar klinik çalışmalardan çıkarılmıştır. Dolayısıyla, umeklidinyum/vilanterol şiddetli kardiyovasküler hastalığı olan hastalarda dikkatle kullanılmalıdır.
Antimuskarinik aktivite
Antimuskarinik aktivitesine bağlı olarak umeklidinyum/vilanterol, üriner retansiyonu veya dar açılı glokomu olan hastalarda dikkatli kullanılmalıdır.
Hipokalemi
Betaadrenerjik agonistler, bazı hastalarda istenmeyen kardiyovasküler etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyumundaki azalma genellikle geçicidir, takviye gerektirmez.
Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda hipokaleminin klinik olarak anlamlı etkisi görülmemiştir. Umeklidinyum/vilanterol, hipokalemiye neden olma potansiyeli olan diğer ilaçlarla birlikte kullanıldığında dikkatli olunmalıdır (bkz. Bölüm 4.5).
Hiperglisemi
Betaadrenerjik agonistler bazı hastalarda geçici hiperglisemiye neden olabilir.
Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda plazma glukozu üzerinde klinik olarak anlamlı etki görülmemiştir. Umeklidinyum/vilanterol ile tedaviye başlandığında plazma glukozu diyabetik hastalarda daha yakından takip edilmelidir.
Eşlik eden koşullar
Umeklidinyum/vilanterol, konvülsif bozuklukları veya tirotoksikozu olan hastalarda ve beta
adrenerjik agonistlere karşı alışılmadık duyarlılığı olan hastalarda dikkatli kullanılmalıdır.
Bu tıbbi ürün laktoz içermektedir. Galaktoz intoleransı, Lapp laktaz eksikliği ve glukoz- galaktoz malabsorpsiyonu gibi nadir kalıtımsal sorunları olan hastalar bu ilacı kullanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Beta blokörler ile etkileşim:
Beta adrenerjik blokörler, vilanterol gibi betaadrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilirler. Kullanılmasını zorunlu kılan sebepler olmadıkça selektif veya selektif olmayan beta adrenerjik blokörlerin eşzamanlı kullanımından kaçınılmalıdır.
Metabolik ve taşıyıcı bazlı etkileşimler
Vilanterol, sitokrom P450 3A4'ün (CYP3A4) bir substratıdır. Güçlü CYP3A4 inhibitörlerinin (ör. ketokonazol, klaritromisin, itrakonazol, ritonavir, telitromisin) eş zamanlı uygulaması, vilanterolün metabolizmasını inhibe edebilir ve vilanterole sistemik maruziyeti arttırabilir. Ketokonazol (400 mg) ile birlikte uygulanması, ortalama vilanterol EAAve C'ı sırasıyla
%65 ve %22 oranında arttırmıştır. Vilanterol maruziyetindeki artış; kalp hızı, kan potasyumu veya QT aralığı (Fridericia yöntemi kullanılarak düzeltilmiş olan) üzerindeki beta adrenerjik agonist ile ilgili sistemik etkiler ile ilişkilendirilmemiştir. Umeklidinyum/vilanterolü, ketokonazol ve bilinen diğer güçlü CYP3A4 inhibitörleri ile birlikte uygularken dikkatli olunması tavsiye edilmektedir, çünkü vilanterole sistemik maruziyetin artma potansiyeli bulunmaktadır, bu da istenmeyen etkilerin artışına sebep olabilir. Orta güçte bir CYP3A4 inhibitörü olan verapamil, vilanterolün farmakokinetiğini anlamlı bir şekilde etkilememiştir.
Umeklidinyum, sitokrom P450 2D6'nın (CYP2D6) bir substratıdır. Umeklidinyumun kararlı durum farmakokinetiği, CYP2D6 eksikliği olan (zayıf metabolize edenler) sağlıklı gönüllülerde değerlendirilmiştir. 8 kat yüksek dozda, umeklidinyum EAA veya Cüzerinde herhangi bir etki gözlenmemiştir. 16 kat yüksek dozda, umeklidinyum EAA'da 1,3 kat artış gözlenmiştir ve umeklidinyum C'ı üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak, umeklidinyum/vilanterol CYP2D6 inhibitörleri ile birlikte veya CYP2D6 eksikliği bulunan hastalara (zayıf metabolize edenler) uygulandığında klinik olarak anlamlı bir ilaç etkileşimi beklenmemektedir.
Hem umeklidinyum hem de vilanterol, P-glikoprotein taşıyıcısının (P-gp) substratlarıdır. Orta güçte P-gp inhibitörü verapamilin (günde bir kez 240 mg), umeklidinyum ve vilanterolün kararlı durum farmakokinetiği üzerindeki etkisi sağlıklı gönüllülerde değerlendirilmiştir. Verapamilin, umeklidinyum veya vilanterol C'ları üzerinde herhangi bir etkisi gözlenmemiştir. Umeklidinyum EAA'da yaklaşık 1,4 kat artış gözlenmiş olup vilanterol EAA değeri üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak, umeklidinyum/vilanterol, P-gp inhibitörleri ile birlikte uygulandığında klinik olarak anlamlı bir ilaç etkileşimi beklenmemektedir.
Diğer antimuskarinikler ve sempatomimetikler
agonistlerin istenmeyen etkilerini artırabileceğinden tavsiye edilmemektedir (bkz. Bölüm 4.4 ve 4.9).
Hipokalemi
Metilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretikler ile eş zamanlı hipokalemik tedavi betaadrenerjik agonistlerin olası hipokalemik etkilerini artırabileceğinden dikkatle kullanılmalıdır (bkz. Bölüm 4.4).
KOAH için kullanılan diğer tıbbi ürünler
Resmi in vivo ilaç etkileşim çalışmaları yapılmamış olmasına karşın, inhale umeklidinyum/vilanterol, kısa etkili sempatomimetik bronkodilatörler ve inhale kortikosteroidler de dahil olmak üzere diğer KOAH tıbbi ilaçları ile eş zamanlı olarak kullanılmış olup klinik ilaç etkileşimi gözlenmemiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlarda herhangi bir etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyonda herhangi bir etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon)
uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
Gebelik dönemi
Umeklidinyum/vilanterolün gebe kadınlarda kullanımına ilişkin veri bulunmamaktadır. Hayvanlarda yapılan çalışmalar, vilanterolün uygulanmasından sonra üreme toksisitesi göstermiştir (bkz. Bölüm 5.3). Umeklidinyum/vilanterol gebelik döneminde, sadece anne için beklenen yararları fetüs için olası risklerden fazla olduğunda kullanılmalıdır.
Laktasyon dönemi
Umeklidinyum veya vilanterolün anne sütüne geçip geçmediği bilinmemektedir. Ancak, anne sütünde diğer betaadrenerjik agonistler tespit edilmiştir. Yeni doğana/bebeklere yönelik risk dışlanamaz. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmenin kesilmesi veya ANORO ELLIPTA tedavisinin kesilmesinden hangisinin yapılması gerektiği konusunda bir karara varılmalıdır.
Üreme yeteneği/Fertilite
Umeklidinyum/vilanterolün insanlarda fertilite üzerindeki etkilerine ilişkin herhangi bir veri yoktur. Hayvan çalışmaları umeklidinyum veya vilanterolün fertilite üzerinde hiçbir etkisi olmadığını göstermektedir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Umeklidinyum/vilanterol'ün araç ve makine kullanımı üzerine herhangi bir etkisi yoktur veya
ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Umeklidinyum/vilanterol ile en sık rapor edilen istenmeyen etki nazofarenjit olmuştur (%9).
4.8. İstenmeyen etkiler
ANORO ELLIPTA'nın güvenlilik profili, KOAH'lı 6855 hastanın dahil olduğu klinik geliştirme programında, umeklidinyum/vilanterol ve bileşenlerin her biriyle elde edilmiş güvenlilik deneyimine ve spontan raporlamaya dayanmaktadır.
Klinik geliştirme programı 24 hafta veya daha uzun süren Faz III klinik çalışmada günde bir kez umeklidinyum/vilanterol almış olan 2354 hasta; 24 haftalık çalışmada 55/22 mcg'lık önerilen dozu almış olan 1296 hasta, 24 haftalık bir çalışmada 113/22 mcg'lık yüksek dozu almış olan 832 hasta ve 12 aylık bir çalışmada 113/22 mcg dozunu almış 226 hastayı içermektedir.
Aşağıda verilen yan etkilere atanan frekanslar 24-haftalık beş çalışmanın entegrasyonundan ve 12 aylık güvenlilik çalışmasından gözlemlenen ham sıklık oranlarını içermektedir.
Aşağıda istenmeyen etkiler MedDRA vücut organ sistem sınıflandırması ve sıklığa göre liste halinde sunulmaktadır. İstenmeyen etkilerin sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: İdrar yolu enfeksiyonu, sinüzit, nazofarenjit, farenjit, üst solunum yolu enfeksiyonu
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Döküntüyü içeren hipersensitivite reaksiyonları
Seyrek: Anaflaksi, anjiyoödem ve ürtikeri içeren hipersensitivite reaksiyonları
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı Yaygın olmayan: Tremor, disguzi Bilinmiyor: Baş dönmesi
Göz hastalıkları
Seyrek: Glokom, bulanık görme, intraoküler basınç artışı, göz ağrısı
Kardiyak hastalıklar
Yaygın olmayan: Atriyal fibrilasyon, supraventriküler taşikardi, idioventriküler ritim, taşikardi, supraventriküler ekstrasistoller, çarpıntı
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Öksürük, orofarenjiyal ağrı Yaygın olmayan: Disfoni
Seyrek: Paradoksalbronkospazm
Gastrointestinal hastalıklar
Yaygın: Kabızlık, ağız kuruluğu
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Döküntü
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın olmayan: Kas spazmları
Böbrek ve idrar yolu hastalıkları
Seyrek: Üriner retansiyon, disüri, mesane çıkışı obstrüksiyonu
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Umeklidinyum/vilanterolün doz aşımında muhtemelen bireysel bileşenlerin etkilerinden kaynaklanan, bilinen inhale muskarinik antagonist istenmeyen etkiler (ör: ağız kuruluğu, görme bozuklukları ve taşikardi) ve diğer betaadrenerjik agonistlerde doz aşımında görülen istenmeyen etkiler (ör. aritmiler, tremor, baş ağrısı, palpitasyonlar, bulantı, hiperglisemi ve hipokalemi) ile tutarlı belirti ve semptomlar görülecektir.
Tedavi
Eğer doz aşımı meydana gelirse, hastaya gerektiği şekilde uygun takip ile destekleyici tedavi uygulanmalıdır.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A16378 |
| Satış Fiyatı | 1023.22 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 1023.22 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522557660 |
| Etkin Madde | Umeklidinyum Bromur + Vilanteral |
| ATC Kodu | R03AL03 |
| Birim Miktar | 62,5+25 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| İthal ( ref. ülke : Ingiltere ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |