AVAMYS 27.5 mcg 120 doz burun spreyi Kısa Ürün Bilgisi
{ Flutikazon Furoate }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AVAMYS 27,5 mikrogram burun spreyi, süspansiyon
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Flutikazon furoat 27,5 mikrogram
Yardımcı maddeler
Benzalkonyum klorür 8,25 mikrogram
Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Burun spreyi, süspansiyon.
Beyaz renkli, homojen dağılımlı bir süspansiyondur.
Baş öne doğru biraz eğilir. Sprey dik olarak tutulup uç parçası burun deliklerinden birine yerleştirilir. Uç parçası, burnun dış duvarına doğru tutulur (Bkz. Şekil 3).
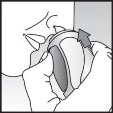
Şekil 3
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yetişkinler ve 12 yaşından büyük ergenlerde:
Mevsimsel alerjik rinitin nazal ve oküler belirtilerinin tedavisinde endikedir. Yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir.
Çocuklar (2 - 11 yaş):
Mevsimsel ve yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji:Yetişkinlerde ve 12 yaşından büyük ergenlerde:
Önerilen başlangıç dozu, her burun deliğine günde bir kez uygulanan iki spreydir (her spreyde 27,5 mikrogram flutikazon furoat, günlük toplam doz 110 mikrogram). Belirtiler yeterince kontrol altına alındıktan sonra her burun deliğine günde bir kez uygulanan birer sprey (toplam günlük doz 55 mikrogram), idame tedavisinde etkilidir.
Uygulama sıklığı ve süresi:
Tedavi süresi hekim tarafından belirlenmelidir.
Tam terapötik fayda sağlanması için, düzenli kullanım önerilir. Etkisi, başlangıçtaki uygulamayı izleyen 8. saat gibi erken bir dönemde gözlenmiştir. En üst düzeyde fayda sağlayabilmek için, daha uzun süreli tedavi gerekmektedir. Düzenli kullanım ile belirtilerin düzeleceği konusunda hasta bilgilendirilmelidir. Tedavi süresi alerjene maruz kalınan süre ile sınırlı olmalıdır.
Uygulama şekli:
AVAMYS Burun Spreyi, sadece intranazal uygulama içindir.
Cihaz kullanıma hazırlandığında (ince bir duman çıkıncaya kadar yaklaşık 6 kez aktive edildiğinde) her sprey, 27,5 mikrogram etkin madde (flutikazon furoat) verir. Kapak, kullanım sonrası kapatılmalıdır.
AVAMYS spreyin test edilmesi:
Eğer AVAMYS ilk kez kullanılacaksa, sprey cihazının hatasız çalışıp çalışmadığı test edilmelidir.
Uç parçasının kapağı üzerindeyken, burun spreyi çalkalanmalıdır. Kapak, baş ve işaret parmaklarla yanlarından hafifçe bastırıp çekerek yerinden çıkarılmalıdır. Kapak çıkarılırken yan taraftaki düğmeye basmamaya dikkat edilmelidir (Bkz. Şekil 1).
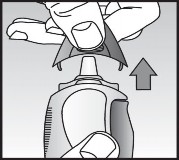
Şekil 1
Burundan soluk alınırken, düğmeye bir kez basılarak ilacın buruna püskürmesi sağlanır (Bkz. Şekil 4). Uç parçası burundan çıkarılır ve ağızdan soluk verilir.

Şekil 4
4.3. Kontrendikasyonlar
AVAMYS içeriğindeki etkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Sistemik kortikosteroid etkileri
Özellikle uzun periyotlarda ve yüksek dozlarda reçete edilen nazal kortikosteroidlerle sistemik etkiler meydana gelebilir. Oral kortikosteroidlerle kıyaslandığında bu etkilerin meydana gelme ihtimali çok daha düşüktür ve bu etkiler her hastada ve çeşitli kortikosteroid preparatları arasında değişiklik gösterebilir. Potansiyel sistemik etkiler Cushing sendromu, Cushingoid özellikler, adrenal supresyon, çocuklarda ve ergenlerde büyüme geriliği, katarakt, glokom ve daha seyrek olarak psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon veya agresyon (özellikle çocuklarda) içeren bir dizi psikolojik veya davranışsal etkileri içerebilir. Önerilenden daha yüksek dozlarda kullanılan nazal kortikosteroidler klinik olarak anlamlı adrenal supresyon ile sonuçlanabilir. Önerilenden yüksek dozların kullanıldığına dair bir kanıt varsa, stres veya elektif ameliyat dönemlerinde ilave sistemik kortikosteroid ile takviye düşünülmelidir. Günde bir kez flutikazon furoat 110 mikrogram yetişkin, ergen veya pediyatrik gönüllülerde hipotalamus-hipofiz-böbreküstü (HPA) aksı baskılanması ile ilişkilendirilmemiştir. Bununla birlikte intranazal flutikazon furoat dozu rinit semptomlarının etkili kontrolünün korunduğu en düşük doza azaltılmalıdır. Tüm intranazal kortikosteroidler ile olduğu gibi, eşzamanlı olarak diğer kortikosteroid tedavisi formlarının reçete edildiği her seferinde kortikosteroidlerin toplam sistemik yükü dikkate alınmalıdır.
Böbreküstü bezi fonksiyonunun bozulduğundan şüphe etmek için bir neden varsa, hastalar sistemik steroid tedavisinden flutikazon furoata geçirilirken dikkatli olunmalıdır.
Görme bozukluğu
Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Bir hasta bulanık görme veya diğer görme bozuklukları gibi semptomlarla başvurursa, hastanın sistemik ve topikal kortikosteroidlerin kullanımından sonra bildirilmiş katarakt, glokom veya santral seröz koryoretinopati (CSCR) gibi nadir hastalıkları içerebilecek olası nedenlerin değerlendirilmesi için bir oftalmoloji uzmanına sevki düşünülmelidir.
Büyüme geriliği
Ruhsatlı dozlarda nazal kortikosteroid alan çocuklarda büyüme geriliği bildirilmiştir. Bir yıl boyunca günde bir kez 110 mikrogram flutikazon furoat ile tedavi edilen çocuklarda büyüme hızında bir azalma gözlenmiştir (Bkz. Bölüm 4.8 ve 5.1). Bu nedenle çocuklar yeterli semptom kontrolü sağlayan en düşük olası etkili dozda idame ettirilmelidir (Bkz. Bölüm 4.2). Nazal kortikosteroidlerle uzun süreli tedavi alan çocukların büyümesinin düzenli olarak izlenmesi önerilir. Büyüme yavaşlarsa, mümkün olduğunda nazal kortikosteroid dozunun semptomların etkili kontrolünün sürdürüldüğü en düşük doza azaltılması amacıyla tedavi gözden geçirilmelidir. Buna ilaveten, hastanın bir pediyatri uzmanına sevk edilmesi düşünülmelidir (Bkz. Bölüm 5.1).
Ritonavir kullanan hastalar
Artmış sistemik flutikazon furoat maruziyeti riskinden dolayı ritonavir ile eşzamanlı uygulama önerilmemektedir (Bkz. Bölüm 4.5).
Yardımcı maddeler
AVAMYS benzalkonyum klorür içerir. Uzun süreli kullanımı nazal mukozada ödeme sebep olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
CYP3A inhibitörleri ile etkileşim
Flutikazon furoat, karaciğerdeki sitokrom P450 3A4 izoenzimi ile gerçekleştirilen ilk geçiş metabolizmasıyla dolaşımdan hızla temizlenir.
CYP3A4 yoluyla metabolize olan başka bir glukokortikoidden (flutikazon propionat) elde edilen verilere dayalı olarak, ritonavir ile eşzamanlı uygulama, flutikazon furoata artmış sistemik maruziyet riski nedeniyle önerilmemektedir.
Sistemik yan etki riskinde bir artış beklendiğinden, flutikazon furoatın, kobisistat içeren ürünler dahil olmak üzere potent CYP3A inhibitörleri ile eşzamanlı uygulanması sırasında dikkatli olunması önerilmektedir. Fayda, sistemik kortikosteroid yan etkileri riskindeki artıştan daha ağır basmadıkça eşzamanlı uygulamadan kaçınılmalıdır; eşzamanlı uygulama durumunda hastalar sistemik kortikosteroid yan etkileri açısından takip edilmelidir. İntranazal flutikazon furoat ile potent CYP3A4 inhibitörü ketokonazolün incelendiği bir ilaç etkileşimi çalışmasında, plasebo (20 gönüllünün 1'inde) ile karşılaştırıldığında ketokonazol grubunda (20 gönüllünün 6'sında) ölçülebilir flutikazon furoat konsantrasyonlarının olduğu gönüllü sayısı daha fazla olmuştur. Maruziyetteki bu küçük artış, iki grup arasında 24 saatlik serum kortizol düzeylerinde istatistiksel olarak anlamlı bir farklılığa yol açmamıştır.
Enzim inhibisyonu ve indüksiyonu verilerine göre klinikte kullanılan dozlarda flutikazon furoat ile diğer bileşiklerin sitokrom P450 enzimleri tarafından gerçekleştirilen metabolizmaları arasında teorik olarak ilaç-ilaç etkileşimi beklenmez. Bu nedenle flutikazon furoatın diğer ilaçlar üzerindeki etkilerini araştırmak için klinik çalışmalar yürütülmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Bu yaş grubunda herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
Bu yaş grubunda herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik Kategorisi C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Veri bulunmamaktadır.
Gebelik dönemi:
AVAMYS'in gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.
Flutikazon furoatın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvan çalışmalarında glukokortikoidlerin yarık damak ve intrauterin büyüme geriliği dahil malformasyonları indüklediği gösterilmiştir. Bu durum, minimum sistemik maruziyetle sonuçlanan önerilen nazal dozlar verilen insanlar için ilişkili değildir (Bkz. Bölüm 5.2). Flutikazon furoat hamilelik sırasında yalnızca anne adayında elde edilmesi beklenen faydalar, fetusun karşılaşabileceği risklerden fazlaysa kullanılmalıdır.
AVAMYS gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi:
Nazal olarak uygulanan flutikazon furoatın insan sütüne geçip geçmediği bilinmemektedir.
Emziren kadınlarda flutikazon furoat kullanımı, yalnızca annede elde edilmesi beklenen fayda çocukta oluşturduğu herhangi bir olası risklerden fazla olduğunda düşünülmelidir.
Üreme yeteneği / Fertilite
İnsanlarda fertilite verisi bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
AVAMYS'in araç veya makine kullanma yeteneği üzerinde bir etkisi yoktur ya da önemsiz düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Flutikazon furoat tedavisi sırasında en yaygın bildirilen advers reaksiyonlar epistaksis, nazal ülserasyon ve baş ağrısıdır. En ciddi istenmeyen etkiler seyrek olarak bildirilen anafilaksi dahil aşırı duyarlılık reaksiyonlarıdır (1000 hastada 1 vakadan daha az).
Advers reaksiyonların listesi
Flutikazon furoatın güvenlilik ve etkililik çalışmalarında mevsimsel ve pereniyal alerjik rinit için tedavi gören 2700'den fazla hasta yer almıştır. Flutikazon furoatın güvenlilik ve etkililik çalışmalarında mevsimsel ve pereniyal alerjik rinitte pediyatrik maruziyet, 12 ila <18 yaşta 243 hasta, 6 ila <12 yaşta 790 hasta ve 2 ila <6 yaşta 241 hasta olmuştur.
Advers reaksiyonların sıklığını belirlemek amacıyla, büyük klinik çalışmalarda elde edilen veriler kullanılmıştır. Advers olay sıklığı, aşağıdaki gibi değerlendirilmiştir:
Çok yaygın (1/10), yaygın (1/100, <1/10), yaygın olmayan (1/1000, <1/100), seyrek (1/10.000, <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Seyrek: Anaflaksi, anjiyoödem, deri döküntüsü ve ürtikeri de kapsayan aşırı duyarlılık reaksiyonları
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Göz hastalıkları
Bilinmiyor: Gözle ilgili geçici değişiklikler (Bkz. Bölüm 5.1), bulanık görme (Bkz.
Bölüm 4.4)
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın: Burun kanaması*
Yaygın: Nazal ülserasyon, dispne**
Yaygın olmayan: Rinalji, burun rahatsızlıkları (burunda yanma, burunda tahriş ve burunda ağrı gibi), burun kuruluğu.
Çok seyrek: Nazal septal perforasyon Bilinmiyor: Bronkospazm
*Burun kanaması, genellikle hafif-orta şiddette olmuştur. Burun kanamasının yetişkinlerdeki ve ergenlerdeki insidansı uzun süreli (>6 hafta) kullanımda, kısa süreli (≤6 hafta) kullanıma kıyasla daha yüksek olmuştur. Pediyatrik hastalarda yapılan süresi 12 haftaya varan çalışmalardaki burun kanaması insidansı, flutikazon furoat veya plasebo kullanan hastalarda birbirine yakın bulunmuştur.
**Flutikazon furoat ile yapılan klinik çalışmalar sırasında hastaların %1'inden fazlasında dispne vakaları bildirilmiştir; benzer oranlar plasebo gruplarında da gözlenmiştir.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Bilinmiyor: Çocuklarda büyüme geriliği*** (Bkz. Bölüm 5.1)
***Puberte öncesi günde bir kez 110 mikrogram flutikazon furoat kullanan çocuklarda büyümeyi değerlendiren bir yıllık klinik çalışmada, plasebo ile karşılaştırıldığında ortalama yıllık büyüme hızı farkı -0,27 cm olarak gözlenmiştir (Bkz. Bölüm 5.1).
Pediyatrik popülasyon
6 yaşın altındaki çocuklarda güvenlilik tam olarak belirlenmemiştir. Pediyatrik popülasyonda gözlemlenen advers reaksiyonların sıklığı, tipi ve ciddiyeti yetişkin popülasyondakilere benzerdir.
Sistemik etkiler
Nazal kortikosteroidlerin sistemik etkileri özellikle uzun periyotlarda yüksek dozlarda reçete edildiğinde meydana gelebilir (Bkz. Bölüm 4.4). Nazal kortikosteroidleri alan çocuklarda büyüme geriliği bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye
Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Bir biyoyararlanım çalışmasında, günde 2640 mikrograma varan intranazal dozların 3 gün boyunca kullanılmasına eşlik eden hiçbir advers sistemik etki gözlenmemiştir (Bkz. Bölüm 5.2). Akut doz aşımı, hastanın gözlem altında tutulmasının dışında genellikle herhangi bir tedavi gerektirmez.
Eğer 2 püskürtme yapılması gerekliyse, 3'üncü ve 4'üncü basamaklar tekrarlanır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Nazal preparatlar, dekonjestanlar ve topikal kullanılan diğer nazal preparatlar, kortikosteroidler
ATC kodu: R01AD12
Flutikazon furoat; glukokortikoid reseptör affinitesi ileri derecede yüksek, güçlü anti- inflamatuvar etkilere sahip, sentetik, triflorlu bir kortikosteroiddir.
Klinik etkililik ve güvenlilik:
Yetişkinlerde ve ergenlerde mevsimsel alerjik rinit:
Plaseboya kıyasla günde bir kez 110 mikrogram flutikazon furoat burun spreyi 4 çalışmanın tümünde nazal semptomları (rinore, nazal konjesyon, hapşırmak, nazal kaşıntı) ve oküler semptomları (kaşıntı/yanma, gözde yaşlanma/sulanma ve gözlerde kızarma) anlamlı olarak iyileştirmiştir. Etkililik günde bir kez uygulama ile 24 saatlik doz uygulama periyodu boyunca korunmuştur.
Terapötik etki başlangıcı ilk uygulama sonrası 8 saat gibi erken bir dönemde görülmüş ve bunu izleyen birkaç günde ilave iyileşme gözlenmiştir.
Flutikazon furoat burun spreyi 4 çalışmanın tümünde hastaların tedaviye genel yanıt algısını ve hastaların hastalıkla bağlantılı yaşam kalitesini (Rinokonjonktivit yaşam kalitesi anketi- RQLQ) anlamlı olarak iyileştirmiştir.
Yetişkinler ve ergenlerde kronik ya da uzun süreli devam eden alerjik rinit:
Günde bir kez 110 mikrogram flutikazon furoat burun spreyi üç çalışmada plaseboya kıyasla nazal semptomları ve hastaların tedaviye genel yanıt algısını anlamlı olarak iyileştirmiştir.
Günde bir kez 110 mikrogram flutikazon furoat burun spreyi bir çalışmada plaseboya kıyasla oküler semptomları ve hastaların hastalıkla bağlantılı yaşam kalitesini (RQLQ) anlamlı olarak iyileştirmiştir.
Etkililik günde bir kez uygulama ile 24 saatlik periyot boyunca korunmuştur.
Flutikazon furoatın (günde bir kez 110 mikrogram intranazal sprey) oküler güvenliliğini değerlendirmek üzere tasarlanmış iki yıllık çalışmada, pereniyal alerjik riniti olan yetişkinler ve ergenler ya flutikazon furoat (n=367) ya da plasebo (n=181) kullanmıştır.
Birincil sonuçlar [posterior subkapsüler opasitede artışa kadar geçen süre (Lens Opasiteleri Sınıflama Sistemi (LOSS), Versiyon III'de başlangıca göre ≥0,3 (LOSS III derece)) ve intraoküler basınç (İOB) artışına kadar geçen süre (başlangıca göre ≥7 mmHg)] iki grup
arasında istatistiksel olarak anlamlı değildir. Posterior subkapsüler opasitedeki artışlar (başlangıca göre ≥0,3) 110 mikrogram flutikazon furoat ile tedavi edilen kişilerde [14 (%4)] plaseboya kıyasla [4 (%2)] daha sık olmuş ve flutikazon furoat grubundan on kişide ve plasebo grubundan iki kişide yapısal olarak geçici bulunmuştur. İOB artışları (başlangıca göre
≥7 mmHg) 110 mikrogram flutikazon furoat ile tedavi edilen kişilerde daha sık olmuştur: günde bir kez 110 mikrogram flutikazon furoat için 7 (%2) ve plasebo için 1 (<%1). Bu olaylar flutikazon furoat grubundan altı kişi ve plasebo grubundan bir kişide yapısal olarak geçici olmuştur.
52 ve 104. haftalarda her iki tedavi grubundan hastaların %95'inde her bir gözde posterior subkapsüler opasite değerleri başlangıç değerinin ± 0,1'i içinde olmuştur, 104. haftada her iki tedavi grubundan hastaların ≤%1'inde posterior subkapsüler opasitede başlangıca göre ≥0,3 artış olmuştur. 52 ve 104. haftalarda hastaların çoğunda (>%95) İOB değerleri başlangıç değerinin ± 5mmHg içinde olmuştur. Posterior subkapsüler opasite ya da İOB artışlarına katarakt ya da glokom gibi herhangi bir advers olay eşlik etmemiştir.
Pediyatrik popülasyon:
Çocuklarda mevsimsel ve kronik ya da uzun süreli devam eden alerjik rinit:
Pediyatrik pozolojide çocuklarda alerjik rinit popülasyonundan etkililik verilerinin değerlendirilmesi temel alınır.
Mevsimsel alerjik rinitte, günde bir kez 110 mikrogram flutikazon furoat burun spreyi etkili olmakla birlikte, günde bir kez 55 mikrogram flutikazon furoat burun spreyi ve plasebo arasında hiçbir sonlanım noktasında anlamlı farklar gözlenmemiştir.
Perennial alerjik rinitte, günde bir kez 55 mikrogram flutikazon furoat burun spreyi 4 haftalık tedavi boyunca günde bir kez 110 mikrogram flutikazon furoat burun spreyinden daha tutarlı bir etkililik profili ortaya koymuştur. Aynı çalışmada 6 ve 12 hafta boyunca ve 6 haftalık HPA ekseni güvenlilik çalışmasında yürütülen post-hoc analiz günde bir kez 110 mikrogram flutikazon furoat burun spreyinin etkililiğini desteklemiştir.
Günde bir kez 110 mikrogram flutikazon furoat burun spreyinin 2 ila 11 yaşındaki çocuklarda adrenal fonksiyon üzerindeki etkisinin değerlendirildiği 6 haftalık bir çalışma, plaseboya kıyasla 24 saatlik serum kortizolü üzerinde anlamlı bir etkinin söz konusu olmadığını göstermiştir.
Randomize, çift kör, paralel gruplu, çok merkezli, bir yıllık plasebo kontrollü bir klinik büyüme çalışmasında ergenlik öncesi çağda 474 çocukta (kızlar için 5 ila 7,5 yaş ve erkekler için 5 ila 8,5 yaş) stadiometri ile günde bir kez 110 mikrogram flutikazon furoat burun spreyinin büyüme hızı üzerindeki etkisi değerlendirilmiştir. 52 haftalık tedavi periyodunda ortalama büyüme hızı plaseboya (5,46 cm/yıl) kıyasla flutikazon furoat (5,19 cm/yıl) kullanan hastalarda daha düşüktür. Ortalama tedavi farkı yılda -0,27 cm'dir [%95 CI -0,48 ila -0,06].
Çocuklarda mevsimsel ve kronik ya da uzun sureli devam eden alerjik rinit (6 yaş altı):
Hem mevsimsel hem de pereniyal alerjik rinitte 2 ila 5 yaşındaki, 176'sı flutikazon furoata maruz kalmış toplamda 271 hastada güvenlilik ve etkililik çalışmaları yürütülmüştür. Bu grupta güvenlilik ve etkililik iyi bilinmemektedir.
5.2. Farmakokinetik özellikler
:Genel özellikler
Emilim:
Flutikazon furoat karaciğer ve bağırsakta tam olarak emilmez ve kapsamlı birinci geçiş metabolizmasına uğrar; bu da ihmal edilebilir sistemik maruziyet ile sonuçlanır. Günde bir kez 110 mikrogram intranazal doz uygulaması tipik olarak ölçülebilir plazma konsantrasyonları (<10 pg/ml) ile sonuçlanmaz. İntranazal flutikazon furoat için mutlak biyoyararlanım %0,50 olup, 110 mikrogramın uygulanmasından sonra sistemik olarak 1 mikrogramdan az flutikazon furoat tespit edilir (Bkz. Bölüm 4.9).
Dağılım:
Flutikazon furoatın plazma proteinlerine bağlanma oranı %99'dan fazladır. Flutikazon furoat vücutta yaygın olarak dağılır ve kararlı plazma düzeylerindeki ortalama dağılım hacmi 608 litredir.
Biyotransformasyon:
Flutikazon furoat sistemik dolaşımdan, başlıca hepatik metabolizma aracılığıyla sitokrom P450 enzimi CYP3A4 ile (toplam plazma klerensi 58,7 L/s) inaktif 17β-karboksilik metabolitine (GW694301X) dönüştürülerek hızla temizlenir. Başlıca metabolizma yolu S- florometil karbotioat fonksiyonunun17β-karboksilik metaboliti oluşturmak üzere hidrolizidir. In vivo çalışmalarda furoat kısmının flutikazon oluşturmak üzere parçalandığına dair bir kanıta rastlanmamıştır.
Eliminasyon:
Oral veya intravenöz flutikazon furoatın esas olarak dışkı yoluyla eliminasyonu, bu kortikosteroidin ve metabolitlerinin safra yoluyla atıldığını göstermektedir. İntravenöz kullanımı izleyen eliminasyon fazı yarı-ömrü 15,1 saattir. Oral ve intravenöz dozların sırasıyla %1'i ve %2'si, böbrekler yoluyla vücuttan atılır.
Hastalardaki karakteristik özellikler
Böbrek bozukluğu:
Sağlıklı gönüllülerde intranazal uygulama sonrası flutikazon furoat, idrarda ölçülebilen düzeylerde değildir. Dozla ilişkili materyalin %1'inden daha küçük bir bölümü idrarla atıldığından böbrek bozukluğunun, flutikazon furoat farmakokinetiğini etkilemesi beklenmemektedir.
Karaciğer bozukluğu:
Karaciğer bozukluğu olan hastalarda intranazal flutikazon furoat ile yapılmış bir çalışma bulunmamaktadır. Karaciğer bozukluğu olan hastalara flutikazon furoatın inhale uygulamasından sonra (flutikazon furoat ya da flutikazon furoat/vilanterol şeklinde), elde edilen veriler intranazal uygulama için de geçerlidir. Tek doz oral inhale 400 mikrogramlık flutikazon furoatla ilgili bir çalışmada, orta derecede karaciğer yetmezliği (Child Pugh B) olan hastalarda sağlıklı deneklere kıyasla, artan C(%42) ve EAA(%172) ile orta düzeyde kortizol düzeylerinde azalma (ortalama olarak %23) ile sonuçlanmıştır. Oral inhale flutikazon furoat/vilanterolun 7 gün süreyle tekrarlı dozlarından sonra orta dereceli ila şiddetli karaciğer bozukluğu (Child-Pugh B - C) olan hastalarda, sağlıklı gönüllüler ile karşılaştırıldığında, flutikazon furoat sistemik maruziyetinde artış olmuştur (EAAile ölçüldüğünde ortalama iki kat). Flutikazon furoat sistemik maruziyetinde orta dereceli karaciğer bozukluğu olan hastalardaki artış (flutikazon furoat/vilanterol 200/25 mikrogram), sağlıklı gönüllüler ile karşılaştırıldığında serum kortizol düzeyinde ortalama %34'lük bir düşüş ile
ilişkilendirilmiştir. Şiddetli karaciğer bozukluğu olan hastalarda serum kortizol üzerinde herhangi bir etki olmamıştır (flutikazon furoat/vilanterol 100/12,5 mikrogram). Bu bulgulara dayanılarak, 110 mikrogram intranazal flutikazon furoatın orta derecede şiddetli karaciğer bozukluğu (Child-Pugh B) olan hastalardaki öngörülen ortalama maruziyetinin, kortizol supresyonu ile sonuçlanması beklenmez.
Pediyatrik popülasyon:
Hastaların çoğunda, günde bir kez 110 mikrogram dozunda verilen flutikazon furoat tipik olarak plazmada ölçülemeyecek düzeylerdedir (<10 pikogram/mL). Pediyatrik hastaların
%15,1'inde günde bir kez 110 mikrogram intranazal flutikazon furoatı takiben ve yalnızca
%6,8'sinde günde bir kez 55 mikrogram intranazal flutikazon furoatı takiben ölçülebilir düzeyler tespit edilmiştir. Daha küçük çocuklarda (6 yaşın altındaki çocuklar) flutikazon furoatın ölçülebilir düzeylerinin daha yüksek insidansına dair bir kanıt yoktur. 55 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama flutikazon furoat konsantrasyonu 2-5 yaş ve 6-11 yaş için sırasıyla 18,4 pikogram/mL ve 18,9 pikogram/mL'dir. 110 mikrogramda ölçülebilir düzeylere sahip olan deneklerde ortalama flutikazon furoat konsantrasyonu 2-5 yaş ve 6-11 yaş için sırasıyla 14,3 pikogram/mL ve 14,4 pikogram/mL'dir. Sonuçlar 12 yaş üzeri ergenlerde görülen sonuçlar ile benzerdir (55 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama konsantrasyon 15,4 pikogram/mL,
110 mikrogramda ölçülebilir düzeye sahip deneklerde ortalama konsantrasyon 21,8 pikogram/mL).
Geriyatrik popülasyon:
Bu yaş grubuna ait farmakokinetik veriler yalnızca az sayıda (≥ 65 yaş, n=23/872; %2,6) hastadan elde edilmiştir. Plazmada ölçülebilen flutikazon furoat konsantrasyonları insidansının ileri yaşlardaki hastalarda, gençlerdekinden daha yüksek olduğunu gösteren hiçbir kanıt yoktur.
5.3. Klinik öncesi güvenlilik verileri
Genel toksikoloji çalışmalarından elde edilen bulgular, diğer glukortikoidlerle gözlemlenenlere benzer olup, aşırı farmakolojik aktivite ile ilişkilidir. Önerilen nazal dozların minimum sistemik maruziyetle sonuçlandığı göz önünde bulundurulduğunda, bu bulguların insanlar için geçerli olması muhtemel değildir. Konvansiyonel genotoksisite testlerinde flutikazon furoat ile genotoksik etki gözlemlenmemiştir. Ayrıca, sıçanlar ve farelerde yürütülen iki yıllık inhalasyon çalışmalarında tümör insidansında tedaviyle ilişkili artış olmamıştır.
Uygulama diğer burun deliğine de tekrarlanır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Glukoz (susuz)
Süspanse olabilen selüloz Polisorbat 80 Benzalkonyum klorür Disodyum edetat
Saf su
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklanmalıdır. Buzdolabında saklamamalı veya dondurulmamalıdır.
6.5. Ambalajın niteliği ve içeriği
AVAMYS Burun Spreyi; doz göstergesi penceresi, yan tarafta aktive edilme kolu ve tıpalı kapağı bulunan plastik cihaz içinde ölçülü atomize sprey pompalı amber renkli cam şişededir. Bir şişe burun spreyinde 120 püskürtmelik ürün bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi atıkların kontrolü yönetmeliği†ve “Ambalaj atıklarının kontrolü yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| FIXFLOW | 8699514540069 | 93.91TL |
| FIXRIVA | 8697936544610 | 93.85TL |
| FLUTEL-F | 8680199540680 | 93.85TL |
| ODESTAMED | 8680030190241 | 93.85TL |
| REDULAN | 8680352000716 | 93.85TL |
| Diğer Eşdeğer İlaçlar |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A11195 |
| Satış Fiyatı | 99.99 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 99.99 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522541379 |
| Etkin Madde | Flutikazon Furoate |
| ATC Kodu | R01AD12 |
| Birim Miktar | 27.5 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 120 |
| Solunum Sistemi > Topikal Dekonjestanlar ve Diğer Nazal İlaçlar > Flucticasone furoate |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |