AZAVIX 100 mg SC enjeksiyonluk süspansiyon için toz içeren 1 flakon Farmakolojik Özellikler
{ Azacitidine }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik maddeler. Pirimidin analogları. ATC kodu: L01BC07
Etki mekanizması:
Azasitidinin antineoplastik etkilerini, kemik iliğindeki anormal hematopoietik hücreler üzerinde sitotoksisite ve DNA'nın hipometilasyonu da dahil olmak üzere çoklu mekanizmalar ile gösterdiğine inanılmaktadır. Azasitidinin sitotoksik etkileri şu mekanizmalardan kaynaklanıyor olabilir: DNA, RNA ve protein sentezinin inhibisyonu, RNA ve DNA'yla birleşme ve DNA yıkım yolaklarının aktivasyonu. Non-proliferatif hücreler azasitidine göreceli olarak dirençlidir. Azasitidinin DNA'ya katılımı DNA metiltransferazlarının inaktivasyonu ve DNA'nın hipometilasyonu ile sonuçlanır. Normal hücre siklusu kontrolü, diferansiyasyonu ve ölüm yolaklarında görev alan anormal derecede metillenmiş genlerin DNA hipometilasyonu, genlerin yeniden ekspresyonu ve kanser-baskılayıcı fonksiyonların tamiri ile sonuç lanabilir. DNA hipometilasyonu ile azasitidinin sitotoksik veya diğer aktivitelerinin klinik sonuçlar üzerindeki göreceli önemleri henüz bilinmemektedir.
Klinik etkililik ve güvenlilik:
MDS, KMML ve kemik iliğinde %20-30 blast olan AML tanılı yetişkinlerde
Azasitidinnin etkililiği ve güvenliliği uluslararası, çok merkezli, kontrollü, açık-uçlu, randomize, paralel gruplu, Faz 3 karşılaştırmalı araştırmada (AZA PH GL 2003 CL 001) incelenmiştir. Araştırmaya Uluslararası Prognostik Skorlama Sistemine (UPSS) göre intermediate-2 ile yüksek riskli MDS ve Fransız Amerikan İngiliz (FAB) sınıflandırma sistemine göre ise RAEB, RAEB-T (%21-30 blast) ile mKMML olan MDS hastaları dahil edilmiş, sekonder MDS'si olan hastalar araştırmaya dahil edilmemiştir. Azasitidin (n=179) konvansiyonel tedavi rejimleri (n=l79) ile karşılaştırılmıştır. Konvansiyonel tedavi rejimleri, tek başına destek tedavi (n=105), düşük doz sitarabin ve beraberinde destek tedavi (n=49) veya standart indüksiyon kemoterapi ile destek tedaviden (n=25) oluşmuştur. Hastalar randomizasyondan önce doktorları tarafından 3 konvansiyonel tedavi rejiminden bir tanesine seçilmişlerdir. Hasta Azasitidin grubuna randomize olmamışsa, bu önceden seçilen rejimi almıştır. Hastanın araştırmaya dahil edilmesi için gereken kriterlerden bir tanesi de âEastern Cooperative Oncology Groupâ (ECOG) performansının 0-2 arasında olmasıdır. Sekonder MDS'si olan hastalar araştırmaya dahil edilmemiştir. Araştırmanın
aralığında) ve ortalama 10,2 siklus olacak şekilde 7 gün boyunca günlük 75 mg/m subkutan dozda uygulanmış ve 21 gün ara verilmiştir (28 günden oluşan tedavi siklusu). Tedavi Amaçlı Popülasyonda (ITT) yaş ortalaması 69'dur (38-88 yaş arası).
358 hasta (179 azasitidin ve 179 konvansiyonel tedavi rejimleri üzerinde yapılan ITT analizinde, azasitidin ile medyan 24,46 aylık bir sağ kalıma karşı, konvansiyonel tedavi rejimi tedavisinde 15,02 aylık sağ kalım olduğu saptanmıştır. Aradaki fark 9,4 aydır. (p<0,0001). Azasitidin kullanan hastalarda iki yıllık sağ kalım oranı %50,8 iken, konvansiyonel tedavi rejimi hastalarında % 26,2'dir (p<0,0001)
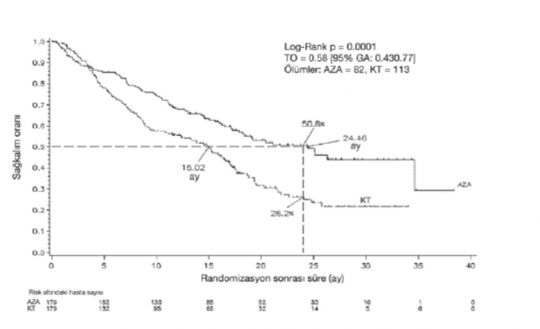
ANAHTAR: AZA= azasitidin; KT= konvansiyonel tedavi; GA= güvenlilik aralığı; TO= tehlike oranı
Azasitidinin sağkalım faydaları, kontrol kolunda kullanılan konvansiyonel tedavi rejimi seçeneğinden (tek başına en iyi destek tedavi, düşük doz sitarabin ve beraberinde en iyi destek tedavi veya standart indüksiyon kemoterapisi ve beraberinde en iyi destek tedavi) bağımsız olarak tutarlıdır.
UPSS (Uluslararası Prognostik Skorlama Sistemi) sitogenetik alt grup analiz edildiğinde, tüm gruplarda (iyi, orta, kötü sitogenetikli, monozomi 7 dahil) medyan genel sağ kalım açısından benzer sonuçlar. Yaş alt grupları analiz edildiğinde, tüm gruplarda medyan genel sağ kalımda bir artış
gözlendi (<65 yaş, ≥65 yaş ve≥75yaş).
Azasitidin grubunda ölüm veya AML'ye dönüşüm için geçen medyan süre 13 ay iken; bu süre konvansiyonel rejim tedavisi alan grupta 7,6 aydır. Azasitidin 5,4 aylık avantaj sağlamış olup, p- değeri 0,0025'dir. Ayrıca, azasitidin tedavisi sitopeni ve semptomlarında azalma ile birliktelik göstermiştir. Azasitidin tedavisi, kırmızı kan hücresi (KKH) ve trombosit transfüzyonlarına olan ihtiyacın azalmasına yol açmaktadır. Başlangıçta KKH transfüzyonuna bağımlı olan azasitidin grubundaki hastaların %45'i tedavi süresi boyunca KKH transfüzyonundan bağımsız hale gelirken, kombine CCR gruplarındaki ((%33,6 (%95 GA: 22,4, 44,6) istatistiksel olarak anlamlı (p < 0,0001) fark)) hastaların %11,4'ünde fark %33,6'dır. Başlangıçta KKH transfüzyonuna bağımlı olan ve bağımsız hale gelen hastalarda, azasitidin grubunda KKH transfüzyon bağımsız hale gelme medyan süresi 13 aydır.
Azasitidin grubunda elde edilen toplam yanıt (tam remisyon [TR] + parsiyel remisyon [PR]) %29 iken konvansiyonel tedavi rejimleri grubunda ise %12'dir (p= 0,0001). Bağımsız İnceleme Komitesi'nin AZA PH GL 2003 CL1 çalışmasında elde ettiği genel yanıt (TR + PR), azasitidin grubunda %7 (12/179) olup bu oran kombine konvansiyonel tedavi gruplarında %1 (2/179)'dur (p=0,0113). Bağımsız İnceleme Komitesi ve araştırmacı değerlendirmeleri yanıtları arasındaki farklar periferik kan sayımlarının iyileştirilmesini ve en az 56 gün bu iyileştirmenin idamesini gerektiren Uluslararası Çalışma Grubu (IWG) kriterlerinin bir sonucudur. Azasitidin tedavisini takiben TR ve PR elde edilemeyen hastalarda da sağ kalımda avantaj gözlenmiştir. Bağımsız İnceleme Komitesinin yaptığı değerlendirmeye göre azasitidin alan hastaların %49'unda hematolojik iyileşme (major veya minör) tespit edilmiş olup bu oran kombine konvansiyonel tedavi rejimleri ile tedavi edilen hastalarda %29'dur (p< 0,0001).
Başlangıçta bir veya daha fazla sitogenetik anormalliği olan hastalarda, major sitogenetik yanıt görülen hastaların oranı azasitidin ve kombine konvansiyonel tedavi rejimi gruplarında birbirine benzerdir. Minör sitogenetik yanıt, kombine konvansiyonel tedavi rejimi grubu ile karşılaştırıldığında (%10), azasitidin grubunda (%34) istatistiksel olarak anlamlı düzeyde daha yüksektir (P= 0,0015).
% 30'dan fazla kemik iliği blastı olan 65 yaş ve üstü akut miyeloid lösemi (AML) hastaları
AZA-AML-001 klinik araştırmasında yer alan tedavi amaçlı hasta popülasyonuna ait sonuçlar aşağıda sunulmuştur (Bkz. 4.1- Terapötik Endikasyonlar).
Azasitidinin etkililik ve güvenliliği hematopoietik kök hücre transplantasyonuna uygun olmayan, Dünya Sağlık Örgütü sınıflandırmasına göre 65 yaş ve üstü yeni teşhiş konmuş veya % 30'dan fazla kemik iliği blastlı ikincil AML'si olan hastalarda uluslararası, çok merkezli, kontrollü, açık-uçlu, paralel grup Faz 3 çalışması yapılmıştır. Azasitidin ile birlikte en iyi destek tedavileri (n=241) konvansiyonel tedavi rejimleri ile karşılaştırılmıştır. Konvansiyonel tedavi rejimleri, tek başına destek tedavileri (n=45), düşük doz sitarabin ve beraberinde destek tedavileri (n=158) veya sitarabin ve antrasiklin ile birlikte standart yoğunlaştırılmış kemoterapi ile beraber destek tedaviden (n=44) oluşmaktadır. Randomizasyondan önce konvansiyonel tedavi rejimi alan 3 hastadan 1'i doktorları tarafından seçilmişlerdir. Hastalar eğer azasitidin grubuna randomize edilmediyse önceden seçilmiş tedavi rejimini almaya devam etmiştir. Çalışmaya alınma kriterleri, hastaların ECOG performans durumlarının 0 ila 2 arasında olması ve orta dereceli veya düşük riskli sitogenetik anormalliği olmasıydı. Çalışmanın birincil sonlanım noktası genel sağkalım olarak belirlenmiştir.
Azasitidin alanlar için, 21 gün dinlenme periyodunu takiben 7 gün boyunca (28 günlük tedavi siklusu) 75 mg/m2 subkutan medyan 6 siklus (1-28 siklus) olacak şekilde uygulanırken, sadece en iyi destek tedavisi alanlarda medyan 3 siklus (1-20 siklus), düşük doz sitarabin alanlarda medyan 4 siklus (1-25 siklus) ve standart yoğunlaştırılmış kemoterapi alanlarda medyan 2 siklus (1-3 indüksiyon siklusu artı 1 veya 2 konsolidasyon siklusu) olacak şekilde uygulanmıştır.
Bireysel başlangıç parametreleri açısından azasitidin ile konvansiyonel tedavi rejimindeki gruplar karşılaştırılabilirdir. Hastalardaki medyan yaş 75'tir (64 ile 91 yaş aralığı). % 75,2'si beyaz ırktan, % 59'u erkek hastalardan oluşmaktadır. Dünya Sağlık Örgütü sınıflandırmasına göre başlangıçta hastaların % 60,7'si tek başına AML, %32,4'ü miylodisplaziye bağlı değişiklikler ile AML, %4,1'i terapiye bağlı miyeloid neoplazma ve % 2,9'u tekrar eden genetik anormallikleri ile birlikte AML olarak kategorize edilmiştir.
488 hastanın ITT analizinde (241 hasta Azasitidin ve 247 hasta konvansiyonel tedavi rejimi ile tedavi edilmiştir.), azasitidin tedavisi alan hastalar ile konvansiyonel tedavi rejimi alan hastalar da medyan sağkalım oranı sırasıyla 10,4 ay ve 6,5 aydır. Aradaki fark 3,8 aydır (p=0,1009). Tedavi etkisinin risk oranı 0,85'tir (%95 Cl=0,69, 1,03). Bir yıllık sağkalım oranları azasitidin alan hastalarda % 46,5, konvansiyonel tedavi rejimi alan hastalarda % 34,3'tür.
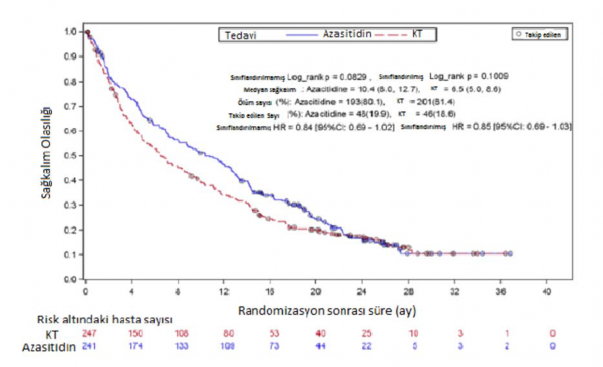
Önceden tanımlanmış başlangıçtaki prognostik faktörler için Cox PH modele uyarlanarak Azasitidin'in konvansiyonel tedavi rejimleri karşılaştırması için risk oranı 0,8 (%95 Cl=0,66; 0,99; p0,0355) olarak belirlenmiştir.
Buna ek olarak, azasitidin ile önceden seçilmiş konvansiyonel tedavi rejimi alan hastalar karşılaştırıldığında çalışma istatistiksel olarak belirli bir fark göstermemesine rağmen, azasitidin kullanan hastaların sağkalım oranı konvansiyonel tedavi rejimi seçeneklerinden destek tedavisi ve düşük doz sitarabin artı destek tedavisi alan hastalardan daha uzundur. Yoğun kemoterapi ile destek tedavisi alan hastalar ile karşılaştırıldığında ise sağkalım oranı benzerlik göstermektedir.
Azasitidinin lehine toplam sağkalım yararı yönünden, bütün önceden seçilmiş alt gruplarda yaş [75 yaş altı ve 75 yaş ve üstü], cinsiyet, ırk, ECOG performans durumu [0 veya 1 ve 2], temel sitogenetik risk (orta veya düşük), coğrafik bölge, AML'nin DSÖ sınıflandırması (miyelodisplaziye bağlı değişiklikler ile birlikte AML'yi de içeren), başlangıçtaki lökosit sayısı [ ≤ 5 x10/L ve >5 x10/L], başlangıçtaki kemik iliği blastı [ % 50 ve daha az ve > % 50'den çok], önceki MDS geçmişi] bir eğilim bulunmaktadır. Yalnızca çok küçük bir grupta toplam sağkalım risk oranı istatiksel anlamlılığa ulaşmıştır. Bu gruplar arasında zayıf sitogenetik riski olan hastalar, miyelodisplaziye bağlı değişiklikler olan AML hastaları, 75 yaş altı hastalar, kadın hastalar ve beyaz ırktan hastalar yer almaktadır.
Hematolojik ve sitogenetik cevaplar araştırmacılar ve IRC tarafından benzer sonuçlar ile değerlendirilmişlerdir. IRC tarafından tam yanıtların oranı (tam remisyon [CR] ve kan sayımı düzelmesiz tam remisyon [CRi]) azasitidin grubu için % 28,7, ve birleştirilmiş konvansiyonel tedavi rejimi için % 25,1 olarak belirlenmiştir (p=0,5384). CR ve Cri'ye ulaşan hastalarda, remisyon için medyan süre Azasitidin kullanan hastalarda 10,4 ay (% 95 CI =7,5, 15,2) olup, konvansiyonel tedavi rejimi alan hastalarda ise 12,3 aydır (% 95 CI = 9, 17). Azasitidin ile tedavi edilen ve tam yanıt sağlanamayan hastalarda konvansiyonel tedavi rejimlerine göre sağ kalım avantajı gösterilmiştir.
Azasitidin tedavisi periferik kan değerlerini iyileştirmiş ve eritrosit ve trombosit transfüzyonu ihtiyacını azaltmıştır. Eğer hasta sırasıyla 56 gün (8 hafta) boyunca veya randomizasyon öncesi bir veya daha fazla eritrosit veya trombosit transfüzyonu almışsa, başlangıçta eritrosit veya trombosit transfüzyonuna bağımlı kabul edilmiştir. Eğer hasta sırasıyla tedavi süresi boyunca ve raporlama periyodunda ardışık gelen herhangi 56 gün boyunca eritrosit veya trombosit transfüzyonu almıyorsa, eritrosit veya trobosit transfüzyonuna bağımlı olmadığı düşünülmektedir.
Başlangıçta eritrosit transfüzyonuna bağımlı olan azasitidin grubundaki hastalardan % 38,5'inin (% 95 Cl=31,1, 46,2) tedavi periyodu süresince eritrosit transfüzyonuna bağımlılığı kalmamıştır. Birleştirilmiş konvansiyonel tedavi rejimi alan hastalarda bu oran %27,6'dır (%95 GA=20,9, 35,1). Başlangıçta eritrosit transfüzyonuna bağımlı olan ve tedavi ile transfüzyona bağımsız hale gelen hastalar için, transfüzyona bağımsız hale gelmek için geçen medyan süre azasitidin grubunda 13,9 ay iken konvansiyonel tedavi rejimi alan hastalarda ise bu süreye ulaşılamamıştır.
Çalışma başlangıcında trombosit transfüzyonuna bağımlı olan Azasitidin grubundaki hastalardan %40,6'sının (% 95 GA=30,9, 50,8) tedavi periyodu süresince trombosit transfüzyonuna bağımlılığı kalmamıştır. Birleştirilmiş konvansiyonel tedavi rejimi alan hastalarda bu oran %29,3'tür (% 95 GA=19,7, 40,4). Başlangıçta trombosit transfüzyonuna bağımlı olan ve tedavi ile transfüzyona bağımsız hale gelen hastalar için, transfüzyona bağımsız hale gelmek için geçen medyan süre azasitidin grubunda 10,8 ay iken konvansiyonel tedavi rejimi alan hastalarda ise bu süre 19,2 aydır.
Sağlığa Bağlı Yaşam Kalitesi (HRQoL), Avrupa Organizasyonu Kanser Araştırma ve Tedavi Çekirdek Yaşam Kalitesi (EORTC QLQ-C30) anketi kullanılarak belirlenmiştir. HRQoL verileri test çalışmasındaki bütün popülasyonun alt kümesi için analiz edilebilir. Analizde bazı sınırlamalar
olmasına rağmen, elde bulunan veriler azasitidin tedavisi sırasında hastaların yaşam kalitesinde anlamlı bir kayıp yaşamadıklarını göstermektedir.
Pediyatrik popülasyon
AZA-JMML-001 çalışması, yeni tanı almış ileri MDS veya JMML'li pediyatrik hastalarda HSCT'den önce azasitidinin farmakokinetiğini, farmakodinamiğini, güvenliğini ve aktivitesini değerlendirmek için gerçekleştirilmiş; Faz 2, uluslararası, çok merkezli, açık etiketli bir çalışmadır. Klinik çalışmanın birincil amacı azasitidinin 3. siklus, 28. günde yanıt oranı üzerindeki etkisini değerlendirmektir.
Hastalar (MDS, n = 10; JMML, n = 18, 3 aylık â 15 yaş arası; %71 erkek), minimum 3 siklus ve maksimum 6 siklus boyunca 28 günlük bir siklusun ilk 7 günü boyunca, günlük 75 mg/m intravenöz azasitidin dozu ile tedavi edilmiştir.
MDS koluna hasta alımı, 10 MDS hastasından sonra etkililik gözlenmemesi nedeniyle durdurulmuştur: bu 10 hastada doğrulanmış yanıt kaydedilmemiştir.
JMML çalışma kolunda, 18 hasta (13 PTPN11, 3 NRAS, 1 KRAS somatik mutasyonu ve 1 nörofibromatozis tip 1 klinik tanılı [NF 1]) kaydedildi. On altı hasta 3 siklus, 5 hasta 6 siklus tedaviyi tamamladı. Toplam 11 JMML hastasında, 3. siklusun 28. gününde klinik yanıt alınmıştır. Bu 11 hastanın 9'unda (%50) doğrulanmış bir klinik yanıt gözlenmiştir (3 hastada cCR - doğrulanmış tam yanıt ve 6 hastada cPR â doğrulanmış kısmi yanıt). Azasitidin ile tedavi edilen hasta kohortunda, 7 (%43,8) hastada sürekli trombosit yanıtı (sayımlar ≥ 100 Ã 109/L) gözlenmiş ve HSCT'de 7 (%43,8) hasta transfüzyona ihtiyaç duymuştur. 18 hastadan 17'si HSCT'ye geçmiştir.
Çalışma tasarımı nedeniyle (az hasta sayısı ve karışıklığa neden olan çeşitli faktörler), bu klinik çalışmadan HSCT öncesi azasitidinin JMML hastalarında sağkalımı arttırdığı veya arttırmadığı sonucu çıkarılamaz.
AZA-AML-004 çalışması, ilk tam remisyondan sonraki moleküler relaps gelişen AML tanılı pediyatrik hastalarda ve moleküler relapstaki AML'li çocuklarda ve genç erişkinlerde anti-kanser tedavisine kıyasla azasitidinin güvenliğini, farmakodinamiğini ve etkinliğini değerlendirmek için bir Faz 2, çok merkezli, açık etiketli bir çalışmadır.
Azasitidin, 7 hastada (yaşları 2 ila 12 arasında, ortanca 6, 7 yıl ve %71,4'ü erkek olan), her 28 günlük siklusun, ilk 7 gününde 100 mg/m2 olacak şekilde en fazla 3 siklus kullanılmıştır.
84. günde, 5 hastada minimal rezidüel hastalık (MRH) değerlendirmesi yapıldı ve 4 hastada ya (n=3) moleküler stabilizasyon ya da (n = 1) moleküler iyileşme tespit edildi ve bir hastada ise klinik nüks görüldü. Azasitidin ile tedavi edilen 7 hastanın altısına (%90 [%95 GA = 0,4; 1]) HKHN uygulandı. Bu küçük örneklem büyüklüğü nedeniyle, azasitidinin pediyatrik AML'deki etkililiği belirlenemez. Güvenlilik bilgileri için bkz. Bölüm 4.8.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Azasitidin tek 75 mg/m subkutan doz uygulamasından sonra, azasitidin 0,5 saatte oluşan (ilk numune alma noktası) 750±403 ng/mL'lik doruk plazma konsantrasyonlarıyla hızla absorbe edilmiştir.
Eğri altındaki alana (EAA) dayanarak subkutan uygulama sonrası azasitidinin I.V. azasitidine (tek 75 mg/m doz) göre biyoyararlanımı eğri altındaki alan (EAA) olarak yaklaşık %89'dur.
Azasitidinin subkutan uygulamasının eğri altındaki alanı ve maksimum plazma konsantrasyonu (C) yaklaşık 25-100 mg/m doz aralığı içinde orantılıdır.
Dağılım:
IV uygulamanın ardından ortalama dağılım hacmi 76±26 L ve sistemik klirensi 147±47 L/saattir.
Biyotransformasyon:
İn vitro verilere göre sitokrom P450 izoenzimleri (CYPler), UDP-glukuronoziltransferazlar (UGTler), sulfotransferazlar (SULTlar) ve glutatyon transferazların (GSTler) azasitidin metabolizmasında yer almadığı görülmektedir.
Azasitidin metabolizması, sitidin deaminaz aracılığı ile oluşan deaminasyon ve spontan olarak gelişen hidroliz ile gerçekleşmektedir. İnsan karaciğeri S9 fraksiyonlarında metabolit oluşumunun NADPH'dan bağımsız olduğu gözlenmiştir, bu durum metabolik basamakların sitozolik enzimler tarafından katalizlendiğine işaret etmektedir. İnsan hepatosit kültürleri üzerinde yapılan in vitro
konsantrasyonlardan yaklaşık 30 kat daha yüksek konsantrasyonlarda) sitokrom P450 izoenzimleri (CYP) olan â1A2, 2C19 veya 3A4 veya 3A5'i" indüklemediğini göstermektedir. 100 µM azasitidin ile inkübe edilen bir seri P450 izoenziminde (CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ve 3A4) inhibisyon oluşturmamıştır. Bu nedenle klinik olarak elde edilebilir azasitidin plazma konsantrasyonlarında enzim inhibisyonu olasılığı düşünülmemektedir.
Eliminasyon:
Azasitidin s.c. uygulamadan sonra 41±8 dakikalık ortalama eliminasyon yarılanma ömrü tile hızlı bir şekilde plazmadan atılır. Günde 1 defa 7 gün boyunca subkutan 75 mg/m azasitidin uygulamasından sonra herhangi bir birikme oluşmaz.
Azasitidin ve/veya metabolitleri başlıca idrarla atılır.
Hastalardaki karakteristik özellikler
Özel popülasyonlar:
Karaciğer yetmezliğinin (bkz Bölüm 4.2), cinsiyetin, yaşın veya ırkın azasitidinin farmakokinetiği üzerine olan etkileri incelenmemiştir.
Pediyatrik popülasyon
AZA-JMML-001 çalışmasında, Farmakokinetik analiz, 1. siklusun 7. gününde 10 MDS ve 18 JMML pediatrik hasta üzerinden gerçekleştirilmiştir. (Bkz. Bölüm 5.1). Ortalama yaş MDS hastaları için 13,3 (yaş aralığı 1,9-15) ve JMML hastaları için de 2,1 (yaş aralığı 0,2-6,9) idi.
75 mg/ m2 'lik bir dozun intravenöz uygulanmasını takiben azasitidin, hem MDS hem de JMML popülasyonlarında 0,083 saat içinde Cmax değerine hızlı bir şekilde ulaşmıştır. MDS ve JMML hastaları için Cmax'ın geometrik ortalaması sırasıyla 1797,5 ve 1066,3 ng/mL iken AUC0-â'ın geometrik ortalaması ise 606,9 ve 240,2 ng saat/mL'dir. MDS ve JMML hastalarında geometrik ortalama dağılım hacmi sırasıyla 103,9 ve 61,1 L'dir. Azasitidinin toplam plazma maruziyetinin MDS hastalarında daha yüksek olduğu görülmüş; bununla birlikte hem AUC hem de Cmax değerleri için hastalar arasında orta ila yüksek değerli değişkenlik kaydedilmiştir.
MDS ve JMML için t½'nin geometrik ortalaması sırasıyla 0,4 ve 0,3 saat ve klerenslerin geometrik ortalaması ise sırasıyla 166,4 ve 148,3 L/saat'tir.
AZA-JMML-001 çalışmasından elde edilen farmakokinetik veriler birlikte toplanmış ve AZA- 2002-BA-002 çalışmasında intravenöz yolla 75 mg/m2 dozluk azasitidin uygulanan MDS'li 6 yetişkin hastadan alınan farmakokinetik verilerle karşılaştırılmıştır. Azasitidinin Cmax ve AUC0- t'nin ortalaması, intravenöz uygulamadan sonra yetişkin hastalar ve pediatrik hastalar arasında benzerdir (sırasıyla, 2.750 ng/mL'ye karşı 2.841 ng/mL ve 1.025 ngâsaat/mL'ye karşılık 882,1 ngâsaat/mL).
AZA-AML-004 Çalışmasında farmakokinetik analiz, yedi hastanın doz sonrası en az bir ölçülebilir farmakokinetik konsantrasyon saptanabilmiş altısının verileriyle yapılmıştır. (bkz. Bölüm 5.1). AML hastalarının medyan yaşı 6,7 ve yaş aralığı ise 2-12 idi.
100 mg/m2 'lik çoklu dozun bir çok kez verilmesi sonrasında 1.siklusun 7. günü Cmax ve AUC0- tau geometrik ortalamaları sırasıyla 1.557 ng/mL ve 899,6 ng-saat/mL olmuştur. Hastalar arası Cmax ve AUC0-tau değerlerinde yüksek değişkenlik olduğu gözlenmiştir (CV yüzdesi Cmax ve AUC0-tau için sırasıyla %201,6 ve %87,8 olmuştur). Azasitidin, intravenöz uygulamadan sonra ortalama 0,09 saatlik bir medyan sürede hızla Cmax'a ulaşmış ve 0,38 saatlik bir geometrik ortalama yarılanma ömrü (t1/2) ile azalmıştır. Klirens ve dağılma hacmi için geometrik ortalama sırasıyla 127,2 L/sa ve 70,2 L'dir.
AML'li çocuklarda ilk tam remisyon (CR1)'dan sonra moleküler relapsda gözlenen farmakokinetik (azasitidin) maruziyet, MDS'li 10 çocuk ve JMML'li 18 çocuğun havuzlanmış verilerinden elde edilen maruziyet ile karşılaştırılabilir ve ayrıca MDS'li yetişkinlerdeki azasitidin maruziyeti ile karşılaştırılabilir seviyededir.
Böbrek yetmezliği
Böbrek yetmezliğinin, tek ve çoklu subkutan uygulamalardan sonra azasitidinin farmakokinetik maruziyetinde herhangi bir önemli etkisi yoktur. Tek 75 mg/m subkutan doz uygulamasından sonra, normal böbrek fonksiyonu olan hastalara kıyasla hafif, orta ve ciddi böbrek yetmezliği olan hastaların ortalama maruziyet değerleri (EAA ve C), sırasıyla %11-21, %15-27 ve %41-66
oranında artmıştır. Bununla birlikte, maruziyet, normal böbrek fonksiyonu olan hastalar için
atıldığı için böbrek yetmezliği olan hastaların yakından izlenmesi koşulu ile, azasitidin, başlangıç doz ayarlaması olmaksızın böbrek yetmezliği olan hastalara uygulanabilir.
Farmakogenomikler:
Azasitidin metabolizması üzerinde bilinen sitidin deaminaz polimorfizmlerinin etkisi incelenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Azasitidin in vitro bakteriyel ve memeli hücre sistemlerinde hem gen mutasyonlarını hem de kromozomal anomalileri indükler. Azasitidinin potansiyel karsinojenitesi farelerde ve sıçanlarda incelenmiştir. Azasitidin 52 hafta boyunca haftada 3 defa intraperitonal (i.p.) uygulandığında, dişi farelerde hematopoetik sistem tümörlerini indüklemiştir. 50 hafta süreyle i.p. olarak uygulanan azasitidin ile tedavi edilen farelerde lenforetiküler sistem, akciğer, süt bezi ve deri tümörlerinin insidansının arttığı görülmüştür. Sıçanlarda bir tümör oluşturma çalışmasında testiküler tümörlerin insidansı artmıştır.
Farelerde yapılan ilk embriyotoksisite çalışmalarında, organogenezis sırasında azasitidinin tek bir
i.p. enjeksiyonundan sonra, intrauterin embriyonal ölüm %44 sıklıkta (artan rezorpsiyon) görülmüştür.
Azasitidin verilen farelerde, sert damağın kapanması sırasında veya kapanmasından önce beyinde gelişimsel anormallikler görülmüştür. Sıçanlara preimplantasyon sürecinde verildiğinde, azasitidin herhangi bir advers etki göstermemiştir; fakat organogenezis sırasında verildiğinde açıkça embriyotoksiktir. Organogenezis sırasında sıçanlarda meydana gelen fetal anomaliler şunlardır: MSS anomalileri (eksensefali, ensefalosel), kol-bacak anomalileri (mikromeli, yumru ayak, sindaktili, oligodaktili) ve diğerleri (mikroftalmi, mikognazi. Gastroşizis, ödem ve kaburga anormallikleri).
Azasitidinin, tedavi edilmemiş dişi fare ile çiftleşmeden önce erkek fareye uygulanması, fertilite azalması ve embriyonik ve postnatal gelişim sırasında yavrunun kaybı ile sonuçlanmıştır. Erkek sıçanlara verilmesi, testis ve epididimislerin ağırlığının azalması, sperm sayısının azalması, gebelik oranlarının azalması, çiftleşen dişilerde embriyoların kaybı ve anormal embriyo artışı ile sonuçlanmıştır (bkz. Bölüm 4.4).
Azasitidin flakonunun plastik kapağı temizlenmeli ve yeni bir şırınga batırılmalıdır. Flakon ters döndürülmeli, iğne ucunun sıvı seviyesinin altında olduğundan emin olunmalıdır. Şırınganın pistonu çekilerek doz için gerekli miktarda ilaç çekilmeli ve şırıngada hava olmamasına dikkat edilmelidir. Daha sonra şırınga ve iğnesi flakondan çıkarılmalı ve şıranganın iğnesi atılmaldır.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
TEVA İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A16288 |
| Satış Fiyatı | 3680.98 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 3680.98 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699638795260 |
| Etkin Madde | Azacitidine |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |