BAVENCIO 200 mg/10ml IV infüzyonluk çözelti hazırlamak için konsantre Farmakolojik Özellikler
{ Avelumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01FF04.
Etki mekanizması
BAVENCIO, programlanmış ölüm ligandı 1'e (PD-L1) yönelik bir insan immünoglobülin G1 (IgGl) monoklonal antikorudur. BAVENCIO, PD-L1'e bağlanır ve PD-L1 ile programlanmış ölüm 1 (PD-1) ve B7.1 reseptörleri arasındaki etkileşimi bloke eder. Böylece PD-L1'in sitotoksik CD8+ T hücreleri üzerindeki süpresif etkileri ortadan kalkar ve anti-tumör T-hücre yanıtları geri kazanılır.
BAVENCIO'nun ayrıca antikor bağımlı hücre aracılı sitotoksisite (ADCC) aracılığıyla doğal katil (NK) hücre aracılı direkt tümör hücresi lizisini indüklediği gösterilmiştir.
Klinik etkililik ve güvenlilik
Merkel hücreli karsinom (çalışma EMR100070-003)
BAVENCIO etkililiği ve güvenliliği, EMR100070-003 çalışmasında iki bölüm halinde araştırılmıştır. Bölüm A, histolojik olarak metastatik MHK bulunduğu doğrulanmış, uzak metastatik hastalık için uygulanan kemoterapi sırasında veya ondan sonra hastalığı ilerleme göstermiş olan, yaşam beklentisi 3 aydan uzun hastalarda yapılan, tek kollu, çok merkezli bir çalışmadır. Bölüm B'ye daha önce metastatik hastalık için sistemik tedavi görmemiş, histolojik olarak doğrulanmış metastatik MHK'lı hastalar dahil edilmiştir.
Aktif merkezi sinir sistemi (MSS) metastazı veya merkezi sinir sistemi (MSS) metastazı öyküsü; aktif otoimmün hastalık veya otoimmün hastalık öyküsü; son 5 yıl içinde başka malignite öyküsü; organ nakli; terapötik immün süpresyonu gerektiren tıbbi durumlar veya aktif HIV enfeksiyonu veya hepatit B veya C olan hastalar, çalışma dışı bırakılmıştır.
Hastalara hastalık progresyonuna veya kabul edilemez toksisiteye kadar 2 haftada bir 10 mg/kg dozunda BAVENCIO verilmiştir. Anlamlı klinik kötüleşme ile ilişkili olmayan ancak radyolojik olarak hastalık progresyonu görülen durumlarda hastalar tedaviye devam edebilir. Bu durumlar, yeni belirti oluşmaması veya varolan belirtilerin kötüleşmemesi, iki haftadan uzun süren performans statüsünde değişiklik olmaması ve ek tedaviye ihtiyaç duyulmaması olarak tanımlanmıştır.
Tümör yanıt değerlendirmeleri, Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) v1.1 kullanılarak 6 haftada bir Bağımsız Sonlanım Noktası İnceleme Komitesi (IERC) tarafından değerlendirilerek gerçekleştirilmiştir.
Çalışma 003 Bölüm A- önceden tedavi edilmiş hastalar
Ana etkililik sonuç ölçüsü, doğrulanmış en iyi genel yanıt (BOR); sekonder etkililik sonuç
ölçüsü ise yanıt süresi (DOR), progresyonsuz sağkalımdır (PFS) ve genel sağkalımdır (OS).
En az 36 aylık takip süresinden sonra 88 hastanın tümünde etkililik analizi yapılmıştır. Hastalar medyan 7 doz BAVENCIO (aralık: 1 doz - 95 doz) almıştır, medyan tedavi süresi 17 haftadır (aralık: 2 hafta - 208 hafta).
88 hastanın 65'i (%74) erkektir, medyan yaş 73'tür (aralık: 33-88 yaş), 81'i (%92) beyaz ırktır ve Eastern Cooperative Oncology Group (ECOG) performans statüsü 49 (%56) hastada 0 ve 39 (%44) hastada 1'dir.
Genel olarak, 52 (%59) hastanın MHK için daha önce kansere yönelik olarak 1 sıra tedavi aldığı, 26 (%30) hastanın daha önce 2 sıra tedavi aldığı ve 10 (%11) hastanın daha önce 3 veya daha fazla sıra tedavi aldığı bildirilmiştir. Olguların 47'sinde (%53) organ metastazı mevcuttur.
En az 36 aylık takip süresi ile EMR100070-003, Bölüm A çalışması için, önerilen dozda BAVENCIO uygulanan hastalarda etkililik sonlanım noktaları Tablo 2'de özet halinde gösterilmektedir. Genel sağ kalım en az 44 aylık takip süresi ile bir analizde değerlendirilmiştir. Medyan OS 12,6 ay'dır (%95 GA 7,5, 17,1)
Tablo 2: Çalışma EMR100070-003'te (Bölüm A)* metastatik MHK'lı hastalarda 2 haftada bir BAVENCIO 10 mg/kg uygulamasına verilen yanıt
Etkililik sonlanım noktaları (Bölüm A) (RECIST v1.1, IERC uyarınca) | Bulgular (N=88) |
Objektif yanıt oranı (ORR) Yanıt oranı, CR+PR** n (%) (%95 GA) |
29 (%33.0) (23,3, 43,8) |
Doğrulanan en iyi genel yanıt (BOR) Tam yanıt (CR)** n (%) Kısmi yanıt (PR)** n (%) |
10 (%11,4) 19 (%21,6) |
Yanıt süresi (DOR) Medyan (aylar) (%95 GA) Minimum, maksimum (aylar) K-M ile ≥6 ay, (%95 GA) K-M ile ≥12 ay, (%95 GA) K-M ile ≥24 ay, (%95 GA) K-M ile ≥36 ay, (%95 GA) |
40,5 (18, hesaplanabilir değil) 2,8, 41,5+ %93 (75, 98) %71 (51, 85) %67 (47, 82) %52 (26, 73) |
Progresyonsuz sağkalım (PFS) Medyan PFS (aylar) (%95 GA) K-M ile 6 aylık PFS oranı, (%95 GA) K-M ile 12 aylık PFS oranı, (%95 GA) K-M ile 24 aylık PFS oranı, (%95 GA) K-M ile 36 aylık PFS oranı, (%95 GA) |
2,7 (1,4, 6,9) %40 (29, 50) %29 (19, 39) %26 (17, 36) %21 (12, 32) |
GA: Güven aralığı; RECIST: Solid Tümörlerde Yanıt Değerlendirme Kriterleri; IERC: Bağımsız Sonlanım Noktası İnceleme Komitesi; K-M: Kaplan-Meier; +sensörlü değeri gösterir
*En az 36 aylık takip ile oluşturulmuş etkililik verisi (veri kesim tarihi 14 Eylül 2018)
** CR veya PR, müteakip tümör değerlendirmesinde doğrulandı.
a Yanıtı doğrulanmış (CR veya PR) hasta sayısına göre
BAVENCIO ilk dozundan sonra yanıt alınana kadar geçen medyan süre 6 haftadır (aralık: 6 hafta - 36 hafta). 29 hastanın 22'sinde (%76) yanıtın ilk BAVENCIO dozundan sonraki 7 hafta içinde alınmış olduğu bildirilmiştir.
Metastatik MHK'lı 88 hastada (Bölüm A) Kaplan-Meier PFS tahminleri Şekil 1'de
gösterilmektedir.
Şekil 1: RECIST v1.1, IERC uyarınca (Bölüm A, en az 36 aylık takip) progresyonsuz
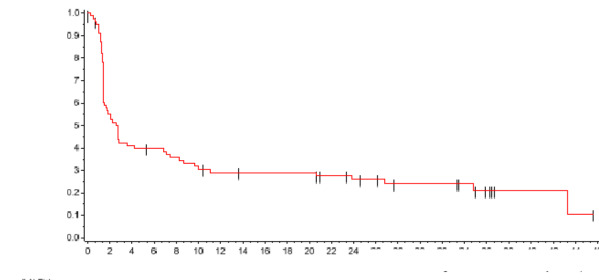
sağkalımın (PFS) Kaplan-Meier tahminleri
Tümör numuneleri, bir araştırma immünohistokimya (IHK) analizi kullanılarak, PD-L1 tümör hücresi ekspresyonu ve Merkel hücreli polyomavirüs (MHV) yönünden değerlendirilmiştir. Çalışma EMR100070-003'te (Bölüm A) metastatik MHK'lı hastaların PD-L1 ekspresyonu ve MHV statüsü Tablo 3'te özet halinde gösterilmektedir.
Tablo 3: Çalışma EMR100070-003'te (Bölüm A) metastatik MHK'lı hastalarda PD-L1
ekspresyonu ve MHV statüsüne göre objektif yanıt oranları
| BAVENCIO ORR (%95 GA)* |
PD-L1: ≥ %1 | N=74 |
Pozitif (n=58) | %36,2 (24,0, 49,9) |
Negatif (n=16) | %18,8 (4,0, 45,6) |
IHK-MCV tümör statüsü | N=77 |
Pozitif (n=46) | %28,3 (16,0, 43,5) |
Negatif (n=31) | %35,5 (19,2, 54,6) |
IHK:İmmünohistokimya; MHV Merkel hücreli polyomavirüs; ORR:Objektif yanıt oranı
*ORR (veri kesim tarihi 14 Eylül 2018)
a PD-L1 için değerlendirilebilir statüdeki hastalardan alınan verilere dayanır
b İmmünohistokimya (IHK) ile MHK için değerlendirilebilir statüdeki hastalardan
elde edilen verilere göre
Çalışma 003 Bölüm B - metastatik ortamda sistemik tedavi almamış hastalar
Ana etkililik sonuç ölçüsü, en az 6 aylık bir süre ile objektif yanıt (tam yanıt (CR) veya kısmi yanıt (PR)) olarak tanımlanan kalıcı yanıt olmuştur. İkincil sonuç ölçütleri BOR, DOR, PFS ve OS'yi içermiştir.
Bölüm B için primer analiz, veri işlemlerinin sonlandığı tarihte (2 Mayıs 2019'da) en az 15 aylık takip süresi ile en az bir doz avelumab alan 116 hastayı içermiştir.
116 hastanın 81'i (%70) erkek ve ortalama yaş 74 (aralık: 41 ila 93 yaş) idi;. 75'i (%65) beyaz
ırktan idi;. 72 hastanın (%62) ve 44 hastanın (%38) ECOG performans durumu sırasıyla 0 ve 1
idi.
Tablo 4'de EMR100070-003, Bölüm B çalışması için önerilen dozda BAVENCIO alan hastalarda DOR ve PFS için Kaplan-Meier ile hesaplanan 24 aylık oranları içeren etkililik sonlanım noktalarının primer analizi özetlenmiştir.
Tablo 4: Çalışma EMR100070-003'te (Bölüm B)* metastatik MHK'lı hastalarda 2 haftada bir BAVENCIO 10 mg/kg uygulamasına verilen yanıtın primer analizi
Etkililik sonlanım noktaları (Bölüm B) (RECIST v1.1, IERC uyarınca) | Bulgular (N=116) |
Kalıcı yanıt ≥ 6 ay (%95 GA) |
%30,2 (22, 39,4) |
Objektif yanıt oranı (ORR) Yanıt oranı, CR+PR** n (%) (%95 GA) |
46 (%39,7) (30,7, 49,2) |
Doğrulanan en iyi genel yanıt (BOR) Tam yanıt (CR)** n (%) Kısmi yanıt (PR)** n (%) |
19 (%16,4) 27 (%23,3) |
Yanıt süresi (DOR) Medyan (aylar) (%95 GA) Minimum, maksimum (aylar) K-M ile ≥3 ay, (%95 GA) K-M ile ≥6 ay, (%95 GA) K-M ile ≥12 ay, (%95 GA) K-M ile ≥18 ay, (%95 GA) K-M ile ≥24 ay, (%95 GA) |
18,2 (11,3 hesaplanabilir değil) 1,2, 28,3 %89 (75, 95) %78 (63, 87) %66 (50, 78) %52 (34, 67) %45 (25, 63) |
Progresyonsuz sağkalım (PFS) Medyan PFS (aylar) (%95 GA) K-M ile 3 aylık PFS oranı, (%95 GA) K-M ile 6 aylık PFS oranı, (%95 GA) K-M ile 12 aylık PFS oranı, (%95 GA) K-M ile 24 aylık PFS oranı, (%95 GA) |
4,1 (1,4, 6,1) %51 (42, 60) %41 (32, 50) %31 (23, 40) %20 (12, 30) |
GA: Güven aralığı; RECIST: Solid Tümörlerde Yanıt Değerlendirme Kriterleri; IERC: Bağımsız Sonlanım Noktası İnceleme Komitesi; K-M: Kaplan-Meier
* En az 15 aylık takip süresi ile etkililik verisi (veri kesim tarihi 02 Mayıs 2019)
** CR veya PR, müteakip tümör değerlendirmesinde doğrulanmıştır.
a Yanıtı doğrulanmış (CR veya PR) hasta sayısına göre
Şekil 2'de Bölüm B'ye kaydedilen, en az 15 aylık bir takip süresi olan 116 hastanın primer analizinden elde edilen PFS için Kaplan-Meier tahminleri gösterilmiştir.
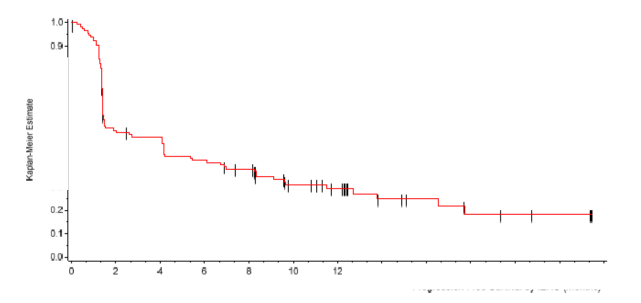
Şekil 2: RECIST v1.1, IERC tarafından (Bölüm B, N=116) progresyonsuz sağkalımın (PFS) Kaplan-Meier değerlendirmesi
Tümör örnekleri, PD-L1 tümör hücresi ekspresyonu için ve araştırma amaçlı IHC tayini kullanılarak MCV için değerlendirilmiştir. Tablo 5, EMR100070-003 çalışmasında (Bölüm B) metastatik MHK'lı hastaların PD-L1 ekspresyonu ve MHV durumuna göre objektif yanıt oranlarını özetlemektedir.
Tablo 5: EMR100070-003 çalışmasında (Bölüm B) metastatik MHK'li hastalarda PD-L1 ekspresyonu ve MHV tümör durumuna göre objektif yanıt oranları
| Avelumab ORR (95% GA)* |
PD-L1: ≥ %1 | N=108 |
Pozitif (n=21) | %61,9 (38,4, 81,9) |
Negatif (n=87) | %33,3 (23,6, 44,3) |
IHC-MCV tümör durumu | N=107 |
Pozitif (n=70) | %34,3 (23,3, 46,6) |
Negatif (n=37) | %48,6 (31,9, 65,6) |
IHK:İmmünohistokimya; MHV Merkel hücreli polyomavirüs; ORR:Objektif yanıt oranı
* ORR (veri kesim tarihi 02 Mayıs 2019)
a PD-L1 için değerlendirilebilir hastalardan alınan verilere dayanmaktadır.
b IHC ile MHV için değerlendirilebilen hastalardan elde edilen verilere
dayanmaktadır.
Lokal ileri evre veya metastatik ürotelyal karsinom (B9991001 çalışması)
Avelumab'ın etkililiği ve güvenliliği, 4-6 siklusluk birinci basamak platin bazlı indüksiyon kemoterapisi ile hastalığı progrese olmamış, rezeke edilemeyen, lokal ileri veya metastatik ürotelyal karsinomalı 700 hastada yürütülen randomize, çok merkezli, açık etiketli bir çalışma olan B9991001 çalışmasında gösterilmiştir. Otoimmün hastalığı olan veya immünosupresyon gerektiren tıbbi rahatsızlığı olan hastalar çalışmaya dahil edilmemiştir.
Randomizasyon, birinci basamak indüksiyon kemoterapisinin başlatıldığı sırada kemoterapiye verilen en iyi yanıta (CR/PR'ye karşın stabil hastalık [SD]) ve metastaz bölgesine (viserale karşın viseral olmayan) göre gruplandırılmıştır. Hastalar, 2 haftada bir 10 mg/kg avelumab intravenöz infüzyon ile en iyi destekleyici bakım (BSC) veya tek başına BSC alacak şekilde randomize edilmiştir (1:1).
Avelumab ile tedavi, Körleştirilmiş Bağımsız Merkezi İnceleme (BICR) değerlendirmesine göre Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) v1.1 tanımlı hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam etmiştir. Hastanın klinik olarak stabil olması durumunda ve araştırmacı tarafından klinik fayda sağlandığı düşünüldüğü takdirde, avelumab uygulamasına RECIST tanımlı hastalık progresyonunun sonrasında da izin verilmiştir. Tümör durumunun değerlendirilmesi, başlangıçta, randomizasyondan 8 hafta sonra, ardından randomizasyondan sonra 12 aya kadar 8 haftada bir ve daha sonrasında RECIST v1.1'e göre BICR değerlendirmesine dayalı olarak doğrulanmış hastalık progresyonu belgelenene kadar 12 haftada bir gerçekleştirilmiştir.
Demografik özellikler ve başlangıç özellikleri genellikle avelumab ile BSC ve tek başına BSC kolu arasında iyi dengelenmiştir. Başlangıç özellikleri, medyan yaş 69 yıl (aralık: 32 - 90), hastaların %66'sı 65 yaş veya üzeri,%77'si erkek, %67'si beyaz ırktan ve ECOG Performans Skoru her iki kol için 0 (%61) veya 1 (%39) olmuştur.
Birinci basamak indüksiyon kemoterapisi için, hastaların %56'sı sisplatin artı gemsitabin, hastaların %38'i karboplatin artı gemsitabin ve hastaların %6'sı sisplatin artı gemsitabin ve karboplatin artı gemsitabin (yani, bu hastalar her kombinasyondan bir veya daha fazla siklus almıştır) almıştır. Birinci basamak indüksiyon kemoterapisine verilen en iyi yanıt, CR veya PR (%72) veya SD (%28) olmuştur. Kemoterapi öncesi metastaz bölgeleri viseral (%55) veya viseral olmayan (%45) şeklinde olmuştur. Hastaların yüzde elli birinde PD-L1 pozitif tümörler saptanmıştır. Avelumab artı BSC kolundaki hastaların yüzde altısı ve tek başına BSC kolundaki hastaların % 44'ü, tedavinin sonlandırılmasından sonra başka bir PD-1/PD-L1 kontrol noktası inhibitörü almıştır.
Birincil etkililik sonuç/sonlanım ölçüsü, tüm randomize hastalarda ve PD-L1-pozitif tümörleri olan hastalarda genel sağ kalım (OS) olmuştur. RECIST v1.1'e göre BICR değerlendirmesine dayalı progresyonsuz sağ kalım (PFS), ek bir etkililik sonuç ölçüsüdür. Etkililik sonuçları, randomizasyondan itibaren 4 - 6 siklusluk platin bazlı indüksiyon kemoterapisinden sonra ölçülmüştür.
Tümörün PD-L1 durumu, Ventana PD-L1 (SP263) testi kullanılarak değerlendirilmiştir. PD- L1- pozitifliği, PD-L1 için boyanan tümör hücrelerinin ≥%25'i olarak veya tümör alanının
>%1'i bağışıklık hücreleri içerirse, PD-L1 için boyanan bağışıklık hücrelerinin ≥ % 25'i olarak veya tümör alanının %1'i bağışıklık hücreleri içerirse, PD-L1 için boyanan bağışıklık hücrelerinin %100'ü olarak tanımlanmıştır.
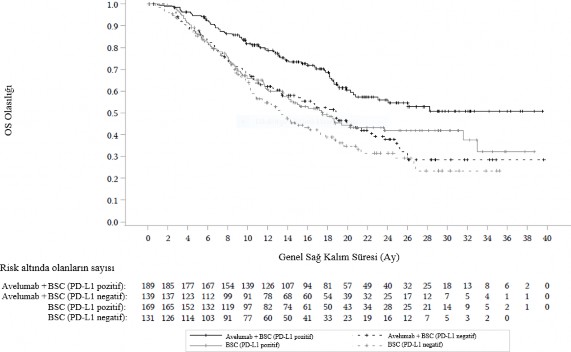
Önceden belirlenmiş ara analizde (veri kesim tarihi 21 Ekim 2019), B9991001 çalışması, her iki eş-primer popülasyonda OS için primer sonlanım noktasını karşılamıştır: medyan OS 21,4 ay olan (%95 GA: 18,9, 26,1; HR 0,69, %95 GA: 0,556, 0,863) avelumab artı BSC kolunda ve medyan OS 14,3 ay olan (%95 GA: 12,9, 17,8) tek başına BSC kolunda olacak şekilde tüm randomize hastalarda. PD-L1 pozitif tümörü olan hastalar için, avelumab artı BSC kolunda medyan OS'ye ulaşılmamıştır (%95 GA: 20,3, ulaşılmamıştır; HR 0,56, %95 GA: 0,404, 0,787) ve tek başına BSC kolunda medyan OS 17,1 ay (%95 GA: 13,5, 23,7) olmuştur. Veri işlemlerinin sonlandığı 19 Ocak 2020 tarihi itibarıyla güncellenmiş OS sonuçları ve veri
işlemlerinin sonlandığı 21 Ekim 2019 tarihi itibarıyla PFS verileri, aşağıda yer alan Tablo 6 ile
Şekil 3'te ve Şekil 4'te sunulmaktadır.
Tablo 6: B9991001 çalışmasında PD-L1 ekspresyonuna göre etkililik sonuçları
Etkililik sonlanım noktaları | Avelumab artı BSC (N=350) | BSC
(N=350) | Avelumab artı BSC (N=189) | BSC
(N=169) | Avelumab artı BSC (N=139) | BSC
(N=131) | |
Tüm randomize hastalar | PD-L1-pozitif tümörler | PD-L1-negatif tümörler | |||||
Genel sağ kalım (OS) |
|
|
| ||||
Olaylar (%) | 156 (44,6) | 190 (54,3) | 68 (36,0) | 85 (50,3) | 80 (57,6) | 80 (61,1) | |
Medyan, ay | 22,1 | 14,6 | NE | 17.5 | 18,9 | 13,4 | |
(%95 GA) | (19,0, 26,1) | (12,8, 17,8) | (20,6, NE) | (13,5, 31,6) | (13,3, 22,1) | (10,4, 17,3) | |
Tehlike oranı | 0,70 | 0,60 | 0,83 | ||||
(%95 GA) | (0,564, 0,862) | (0,439, 0,833) | (0,603, 1,131) | ||||
2-taraflı p-değeri | 0,0008 | 0,0019 |
| - |
| ||
Olaylar (%) | 225 (64,3) |
260 (74,3) | 109 (57,7) |
130 (76,9) | 103 (74,1) |
99 (75,6) | |
Medyan, ay | 3,7 | 2,0 | 5,7 | 2,1 | 3,0 | 1,9 | |
(%95 GA) | (3,5, 5,5) | (1,9, 2,7) | (3,7, 7,4) | (1,9, 3,5) | (2,0, 3,7) | (1,9, 2,1) | |
Tehlike oranı | 0,62 | 0,56 | 0,63 | ||||
(%95 GA) | (0,519, 0,751) | (0,431, 0,728) | (0,474, 0,847) | ||||
2-taraflı p-değeri | < 0,0001 | < 0,0001 |
| - |
| ||
GA: Güven aralığı; K-M: Kaplan-Meier, NE: Tahmin edilebilir değildir.
Not: 72 hastada (avelumab artı BSC kolunda 22 hasta ve tek başına BSC kolunda 50 hasta) bilinmeyen PD-L1 durumu olan tümör saptanmıştır.
a OS için veri kesim tarihi 19 Ocak 2020'dir.
b PFS için veri kesim tarihi 21 Ekim 2019'dur.
c PD-L1-negatif popülasyon analizleri keşifsel nitelikte olmuştur ve resmi test yapılmamıştır.
d Gruplandırılmış log-sırasına dayalı p-değeri.
e RECIST v1.1'e göre BICR değerlendirmesine dayalı
f PFS sansürleme nedenleri sıralı şekilde hiyerarşiyi takip eder: Yeterli başlangıç değerlendirmesinin olmaması, yeni anti-kanser tedavisinin başlaması, 2 veya daha fazla eksik değerlendirmeden sonraki olay, olurun geri çekilmesi, takip dışı kalınması, yeterli başlangıç sonrası tümör değerlendirmesinin olmaması, olaysız devam etmesi
Şekil 3: PD-L1 ekspresyonu ile Genel sağ kalım (OS) için Kaplan-Meier tahminleri (veri
kesim tarihi 19 Ocak 2020) - Tam analiz seti
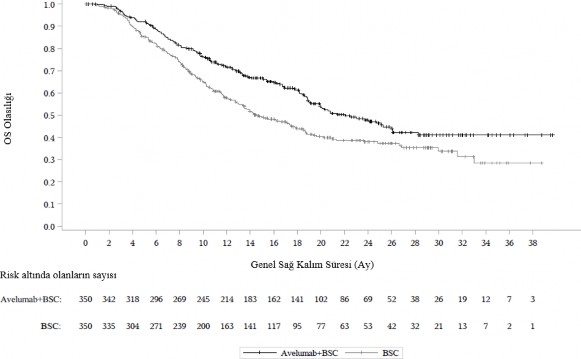
: Tüm Randomize hastalar
5.2. Farmakokinetik özellikler
BAVENCIO monoterapisi ve BAVENCIO'nun aksitinible kombinasyonu için avelumab
farmakokinetikleri bir popülasyon PK yaklaşımı kullanılarak değerlendirildi.
Monoterapi olarak avelumab ve aksitinible kombinasyonundaki popülasyon PK analizine göre avelumab maruziyetinde her 2 haftada bir 800 mg veya 10 mg/kg'lık uygulamalar arasında klinik olarak beklenen anlamlı bir fark oluşmamıştır.
Emilim
Avelumab intravenöz infüzyon yoluyla uygulanır ve bu nedenle anında ve tamamen biyolojik olarak kullanılabilir.
Dağılım
BAVENCIO'nun sistemik dolaşımda ve daha az oranda hücre dışı boşlukta dağılım göstermesi beklenmektedir. Kararlı durum dağılım hacmi 4,72 L'dir.
Sınırlı bir ekstravasküler dağılımla uyumlu olarak, BAVENCIO'nun kararlı durumdaki dağılım hacmi küçüktür. Bir antikordan beklendiği gibi BAVENCIO, plazma proteinlerine spesifik bağlanmaz.
Biyotransformasyon
Avelumabın birincil eliminasyon mekanizması proteolitik bozunmadır.
Eliminasyon
1,629 hastadan elde edilen bir popülasyon farmakokinetiği analizine göre, total sistemik klirens değeri 0,59 L/gün'dür. Ek analizde, BAVENCIO klirensi'nin zamanla azaldığı tespit edilmiştir; farklı tümör tipleri ile başlangıç değerine kıyasla en büyük ortalama maksimal azalma (varyasyon katsayısı [CV%]) yaklaşık %32,1'dir (CV %36,2).
BAVENCIO'nun kararlı durum konsantrasyonlarına yaklaşık 4-6 hafta boyunca (2-3 döngü) 2 haftada bir 10 mg/kg'lık tekrarlı dozlama yapıldıktan sonra ulaşılmıştır ve sistemik birikim yaklaşık 1,25 kat olmuştur.
Önerilen dozda eliminasyon yarı ömrü (t½), popülasyon PK analizine göre 6,1 gündür.
Doğrusallık/Doğrusal olmayan durum
BAVENCIO maruziyeti, 2 haftada bir 10 mg/kg ila 20 mg/kg doz aralığında doz orantılı olarak artmıştır.
10 mg/kg avelumabın 5 mg aksitinible kombinasyon halinde kullanımında, avelumab ve aksitinib maruziyetlerinin tek ajanlara kıyasla değişmediği görülmüştür. İleri evre RHK'si olan hastalarda zamanla klinik olarak anlamlı avelumab klirensi değişikliğinin görülebileceğine dair bir kanıt yoktur.
Hastalardaki karakteristik özellikler
Popülasyon farmakokinetik analizi, BAVENCIO'nun total sistemik klirensinde yaş, cinsiyet, ırk, PD-L1 statüsü, tümör yükü, böbrek fonksiyon bozukluğu ve hafif veya orta şiddetli karaciğer fonksiyon bozukluğu zemininde fark olmadığını göstermiştir.
Total sistemik klirens, vücut ağırlığı ile birlikte artmaktadır. Kararlı durum maruziyeti, vücut ağırlığına göre normalize edilmiş dozlama için geniş bir vücut ağırlığı (30-204 kg) aralığında hemen hemen benzer olarak izlenmiştir.
Böbrek yetmezliği
Hafif şiddetli (glomerüler filtrasyon hızı (GFR) 60-89 mL/dak, Cockcroft-Gault Kreatinin Klirensi (KrKL); n=623), orta şiddetli (GFR 30-59 mL/dak, n=320) böbrek fonksiyon bozukluğu olan hastalar ile normal (GFR ≥90 mL/dak, n=671) böbrek fonksiyonlu hastalar arasında BAVENCIO klirensi açısından klinik olarak önemli farklılıklara rastlanmamıştır.
BAVENCIO'nun şiddetli böbrek fonksiyon bozukluğu olan hastalardaki etkileri (GFR 15-29 mL/dak) incelenmemiştir.
Karaciğer yetmezliği
Popülasyon PK analizinde, hafif karaciğer fonksiyon bozukluğu olan hastalar (bilirubin ≤ULN ve AST>ULN veya ULN'nin 1-1,5 katı bilirubin, n=217) ile normal karaciğer fonksiyonlu (bilirubin ve AST≤ULN, n=1,388) hastalar arasında BAVENCIO klirensi açısından klinik olarak önemli farklılıklara rastlanmamıştır. Karaciğer fonksiyon bozukluğu, Ulusal Kanser Enstitüsü (NCI) karaciğer fonksiyon bozukluğu kriterlerine göre tanımlanmıştır.
BAVENCIO, orta şiddetli karaciğer fonksiyon bozukluğu (bilirubin, ULN'nin 1,5-3 katı) veya şiddetli karaciğer fonksiyon bozukluğu (bilirubin, ULN'nin >3 katı) olan hastalarda incelenmemiştir.
Pediyatrik popülasyon
Avelumabın farmakokinetik özellikleri, doğrulanan progresyon, ölüm veya kabul edilemez toksisiteye kadar 2 haftada bir intravenöz olarak 10 mg/kg (N=6) veya 20 mg/kg (N=15) avelumab alan, yaşları 3 - 17 arasında değişen 21 çocukta ve ergende değerlendirilmiştir.
Pediyatrik PK parametreleri ve tüm hastalar için karşılık gelen PK profilleri, doz alımına göre değerlendirilmiştir ve vücut ağırlığına göre sınıflandırılmıştır.
20 mg/kg avelumab alan pediyatrik hastalarda maruziyet, 10 mg/kg veya 800 mg avelumab alan yetişkinlerdekine benzer veya daha yüksek olmuştur. 10 mg/kg avelumab alan pediyatrik hastalarda maruziyet yetişkinlere kıyasla daha düşük olmuştur.
5.3. Klinik öncesi güvenlilik verileri
1 ay ve 3 ay boyunca haftada bir kez 20, 60 veya 140 mg/kg intravenöz doz uygulanan, 3 aylık dozlama periyodundan sonra 2 aylık iyileşme periyodu bırakılan Cynomolgus maymunlarında yapılan konvansiyonel tekrarlı doz toksisitesi çalışmalarından elde edinilen klinik dışı verilere göre insanlar için özel bir tehlike olmadığını ortaya koymuştur. BAVENCIO'nun ≥20 mg/kg dozunda 3 ay süresince uygulandığı maymunların beyninde ve omuriliğinde perivasküler alanın mononükleer hücrelerce sarıldığı gözlenmiştir. Açık bir doz-yanıt ilişkisi olmasa da, bu bulgunun BAVENCIO uygulamasıyla ilişkili olması dışlanamaz.
BAVENCIO ile hayvan üreme çalışmaları yapılmamıştır. PD-1/PD-L1 yolağının gebelik boyunca fetüse toleransın korunmasında rol oynadığı düşünülmektedir. Fare gebelik modellerinde, PD-L1 sinyali bloke edildiğinde, fetusa toleransın bozulduğu ve fetus kaybının arttığı gösterilmiştir. Bu bulgular, gebelik sırasında BAVENCIO uygulamasının düşük veya ölü doğum oranlarında artış da dahil olmak üzere fetusa zarar verebileceğine dair potansiyel bir risk göstermektedir.
BAVENCIO'nın karsinojenisite veya genotoksisite potansiyelinin değerlendirilmesi için herhangi bir çalışma yapılmamıştır.
BAVENCIO ile fertilite çalışmaları yapılmamıştır. Maymunlarda yapılan 1 ve 3 aylık tekrarlı doz toksikoloji çalışmalarında dişi üreme organlarında göze çarpan bir etki görülmemiştir. Bu çalışmalarda kullanılan erkek maymunların çoğu cinsel olarak olgunlaşmamıştır ve bu nedenle erkek üreme organları üzerindeki etkilere ilişkin net yorumlar yapılamamaktadır.
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
Merck İlaç Ecza ve Kimya Ticaret AŞ
| Satış Fiyatı | 18182.71 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 18182.71 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699808770134 |
| Etkin Madde | Avelumab |
| ATC Kodu | L01FF04 |
| Birim Miktar | 200/10 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |