BERININ-P FAKTOR IX 600 IU 1 flakon Saklanması
{ Anti Hemofilik Faktor Ix }
Farma-Tek İlaç Sanayi ve Ticaret A.Ş. | Güncelleme : 30 December 18995.BERININ-P FAKTOR IX'in saklanması
BERININ P' i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
BERİNİN P, 25 °C' nin altındaki oda sıcaklığında saklayınız. Dondurmayınız! Donmuş ürünü çözüp kullanmayınız.
BERİNİN P kapalı karton kutusu içinde muhafaza edilmelidir. Isı ve ışıktan korunmalıdır. Sulandırıldıktan sonra derhal kullanılmalıdır. Eğer hemen uygulanmayacaksa, sulandırılan
solüsyon, sterilitesi sağlandığı takdirde, 25 °C'de oda sıcaklığında 8 saat bekletilebilir. Kullanılmayan çözeltiler uygun bir biçimde atılmalıdır.
Son kullanma tarihiyle uyumlu olarak kullanınız
Ambalajdaki son kullanma tarihinden sonra BERININ-P FAKTOR IX'i kullanmayınız.
Eğer üründe ve/veya ambalajında bozukluklar fark ederseniz BERININ-P FAKTOR IX'i kullanmayınız.
Çevreyi korumak amacıyla kullanmadığınız BERINİN P' i şehir suyuna veya çöpe atmayınız. Bu konuda eczacınıza danışınız.
Ruhsat Sahibi:
Farma-Tek İlaç San. ve Tic. Ltd. Şti. Şerifali Mah.Bayraktar Bulvarı.Beyan Sok. No:12 Ümraniye/İstanbul
Üretim yeri: CSL Behring GmbH
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR. Pozoloji:
Uygulama süresi ve dozu hastanın Faktör IX eksikliğine, kanamanın yerine, miktarına ve hastanın klinik durumuna bağlıdır.
Uygulama miktarı ve uygulama sıklığı her bir bireyin klinik etkinlik düzeyine göre belirlenir.Faktör IX ilaçları nadir olarak günde birden fazla kullanımı gerektirir.
Aşağıdaki hemorajik olgularda faktör IX düzeyi o döneme ait plazma aktivitesi düzeyinin (normalin %' si ya da IU/dL olarak) altına düşmemelidir.
Aşağıdaki tablo ameliyatlardaki ve kanamalı olgularda kullanılacak dozun miktarını belirleyebilmek için kullanılabilir:
Hemoraji derecesi/ Cerrahi müdahalenin tipi | Gerekli Faktör IX seviyesi (% ya da IU/dL) | Doz sıklığı (saat) /Tedavinin süresi (gün) |
Hemoraji | ||
Erken hemartroz Kas içi kanama, Ağız boşluğunda kanama | 20 - 40 | Her 24 saat de bir kanama duruncaya veya iyileşme sağlanıncaya kadar infüzyon tekrarlanır. |
Daha yoğun hemartroz, Kas içi kanama, hematom | 30 - 60 | Acısı ve kanamanın şiddeti azalıncaya kadar 3 -4 gün boyunca infüzyon her 24 saat de bir tekrar edilir. |
Hayatı tehdit eden hemoraji | 60 - 100 | iyileşme gerçekleşinceye kadar 8 ila 24 saatte de bir infüzyon tekrar edilir. |
Cerrahi müdahale | ||
Diş çekilmesi gibi küçük müdahaleler. | 30 - 60 | Her 24 saat de bir en az 1 gün boyunca iyileşme gerçekleşinceye kadar infüzyon tekrar edilir. |
Büyük cerrahi müdahalelerde | 80 - 100 (preoperatif ve postoperatif) | Yara kafi derecede iyileşene dek infüzyon 8 ila 24 saat de, tedavinin devam ettiği 7 gün boyunca Faktör IX aktivitesi % 30 - 60 (IU/dL) olacak şekilde ayarlanır. |
Tedavinin devam ettiği sırada tekrarlanan infüzyon periyodu ve uygun görülen faktör IX seviyesi belirtilmelidir. Özellikle majör cerrahi girişim olgularında, yerine koyma tedavisinin koagülasyon analiziyle (plazma faktörü IX aktivitesi) titiz olarak izlenmesi zorunludur. Faktör IX' a cevap verme durumu bireylerde farklılık gösterebilir.
Ciddi hemofili B hastalığı olanlarda kanamaya karşı uzun süreli profilaksi için 3 ila 4 günlük aralıklarla, vücut ağırlığının her kg. için 20 ila 40 IU faktör IX verilmelidir. Eğer gerekiyorsa başka tedavi önlemleri de alınmalıdır.
Bazı durumlarda özellikle genç hastalarda dozaj aralıklarını kısaltmak yada yüksek doz uygulamak gerekebilir.
Hastalar, faktör IX inhibitörlerinin gelişimi açısından izlenmelidir. Eğer beklenen faktör IX aktivite plazma seviyesi elde edilemezse ya da uygun doz ile kanama kontrol altına alınmazsa faktör IX inhibitörlerinin varlığına karar vermek için analiz yürütülmelidir. Hastada yüksek seviyede inhibitör varlığında, faktör IX tedavisi etkisiz olabilir ve diğer tedavi yöntemleri göz önünde bulundurulmalıdır. Bazı hastaların tedavisi hemofili ile ilgili deneyimleri çok olan doktorlar tarafından yürütülmelidir.
Uygulama şekli:
Genel talimatlar:
Çözelti berrak veya hafif opak olmalıdır. Uygulama öncesi filtre edildikten/çekildikten sonra (aşağıya bakınız) hazırlanmış ürün çökelti maddesi veya renk bozulmasına karşı incelenmelidir. Kalıntı/parçacık içeren veya berrak olmayan çözeltileri kullanmayınız. Mix2Vial setini içeren filtreler artık içeren kalıntı ya da parçacıkları tamamiyle söker. Filtrasyon dozaj hesaplarım etkilemez. Çözeltiyi filtrasyondan sonra da toz parçacıkları yada partiküller içeriyorsa kullanmayınız.
Hazırlanma ve enjektöre çekilme aseptik şartlarda gerçekleştirilmelidir.
Uygulama sonrası kullanılmayan ürün veya atık madde, yerel gerekliliklere uygun şekilde bertaraf edilmelidir.
Hazırlanması:
Çözücüyü oda sıcaklığına getiriniz. Toz ve çözücü flakonlannın kapaklarının çıkarıldığından ve stoperlerin aseptik bir solüsyonla silinerek Mix2Vial paketinin açılmasından önce kendiliğinden kuruduğundan emin olunuz.
1
2
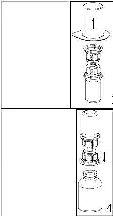
1.Kapağı soyarak Mix2Vial paketini açınız. Mix2Vial' i blister paketinden çıkarmayınız.
2.Seti paketten çıkarınız, her iki uçtaki çentiklere dokunmamaya özen gösteriniz. Çözücü flakonu düz ve temiz bir yüzeye yerleştiriniz ve flakonu sıkıca tutunuz. Blister paketi ile birlikte aldığınız Mix2Vial setinin mavi ucunu çözücü flakonun stoperinin üzerine yerleştiriniz.
3.Mix2Vial setinden blister paketi kenarından tutarak dikkatlice sökünüz. Mix2Vial setini değilde sadece blister paketi çıkardığınızdan emin olunuz.
4.Toz flakonunu bir yüzeyde sıkıca tutarak, setin iliştirildiği çözücü flakonunu ters çevirin ve transparan adaptörü toz flakonunun stoperinin üzerine yerleştirin. Çözücü otomatik olarak toz flakonunun içine geçecektir.
5.Bir elle Mix2Vial setinin kenarından diğer ellede seyrelticinin kenarından ürünü kavrayarak iki parça içerisindeki seti vidalarından cevirerek açınız ve ürün çözülürken aşırı köpük oluşumundan kaçınınız. Mavi Mix2Vial adaptörüne bağlanmış olan seyreltici flakonu çıkarınız.
Ç | W | 6.Tozun tam olarak çözündüğünden emin olmak için transparan adaptörlü ürün flakonunu nazikçe döndürerek çalkalayınız. Flakonu sallamayınız. Boş ve steril bir şırıngaya hava çekiniz. Toz flakonu yukarıya doğru dururken şırıngayı Mix2Vial setine bağlayınız. Havayı toz flakonunun içine enjekte ediniz. | |
İP7 | 7.Şırınganın pistonunu basılı tutarak sistemi baş aşağı çeviriniz ve konsantreyi, pistonu yavaşça geriye çekerek şırıngaya alınız. | ||
oo | 8.Konsantre, şırınganın içerisine dolduktan sonra, şırıngayı sıkıca tutarak (şırınganın pistonu halen aşağı bakacak şekilde) Mix2Vial setini şırıngadan ayırınız. |
Ürün dolu şırangaya kanın girmediğinden emin olunuz.
Hazırlanan çözelti hastaya rahat edebileceği bir yerde yavaş intravenöz oranda infüzyon ya da damar içerisine enjeksiyon şeklinde uygulayınız. Enjeksiyon yada infüzyon oranının dakikada 2 mL' i geçmemesine dikkat edilmelidir.
Vücut ağırlığının kg' ı başına 100 IU' den daha fazla uygulanmaması önerilmektedir. Ürünle dolu olan flakon ve kaplara hiç kan girmemesine dikkat edilmelidir.
Hasta oluşabilecek herhangi bir reaksiyona karşı izlenmelidir. BERİNİN P ile ilgili bir reaksiyon oluşması halinde infüzyon oranı hastanın klinik durumuna göre azaltılmalı yada durdurulmalıdır (bkz. Bölüm 4.4).
 Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
 Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BERININ-P | 8681624980033 | |
| BETAFACT | 8699538983620 | |
| IMMUNINE | 8699556980083 | |
| OCTANINE | 8699686980151 | 18,957.44TL |
| Diğer Eşdeğer İlaçlar |
 Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
 En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
 Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
İLAÇ GENEL BİLGİLERİ
Farma-Tek İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A01263 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8699738980559 |
| Etkin Madde | Anti Hemofilik Faktor Ix |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |