BERODUAL inhilasyon için ölçülü dozlu aerosol 200 doz Kısa Ürün Bilgisi
{ Ipratropium Bromur + Fenoterol Hidrobromur }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BERODUAL® inhalasyon için ölçülü dozlu aerosol2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde:
Her ölçülü doz (puf) içeriği;
20 mikrogram ipratropium bromür anhidre eşdeğer, 21 mikrogram (8r)-3a-hidroksi-8-izopropil-laH,5aH-tropanyum bromür (±)-tropat monohidrat (= ipratropium bromür)
50 mikrogram l-(3,5-dihidroksi-fenil)-2-[[l-(4-hidroksi-benzil)-etil]-amino]-etanol hidrobromür (= fenoterol hidrobromür)
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
İnhalasyon için ölçülü dozlu aerosol (10 mİ = 200 ölçülü doz)
4.1. Terapötik endikasyonlar
4.2. Pozoloji ve uygulama şekli
Pozoloji, uygulama sıklığı ve süresi:
Dozaj bireysel gereksinim doğrultusunda ayarlanmalıdır. Başka türlü reçete edilmediği takdirde, erişkinler ve 6 yaşından büyük çocuklar için aşağıdaki dozlar önerilir:
Çoğu durumda semptomların hızla düzelmesi için 2 ölçülü doz (puf) yeterlidir. Daha ağır durumlarda, eğer 5 dakika sonra solumada belirgin bir düzelme yoksa, 2 puf daha alınabilir.
Eğer atak 4 puf ile düzelmediyse, daha fazla pufa ihtiyaç olabilir. Böyle durumlarda hastalar derhal doktorlarına ya da en yakın hastaneye başvurmalıdır.
Aralıklı ve uzun dönemli tedavi:
BERODUAL* astımda yalnızca ihtiyaç duyulan zaman temelinde kullanılmalıdır.
Her uygulamada 1-2 puf olmak üzere, günde en fazla 8 pufa kadar (ortalama günde 3 kez 1-2 puf).
BERODUAL® çocuklarda sadece doktor tavsiyesiyle ve bir erişkinin gözetimi altında kullanılmalıdır.
Tedavinin başarıyla uygulanabilmesi için, hastalara ölçülü doz aerosolün doğru bir şekilde nasıl kullanılacağı öğretilmelidir (Kullanım talimatına bakınız).
Uygulama şekli:
Ağızdan inhalasyon yoluyla uygulanır.
Kullanım Talimatı
Ölçülü doz aerosolü ük kullanımdan önce aşağıdaki kurallar izlenmelidir:
Koruyucu kapağı çıkarınız ve valfe iki kez basınız.
Ölçülü doz aerosolü her kullanım öncesinde aşağıdaki kurallar izlenmelidir:
1. Koruyucu kapağı çıkarınız.
(Ölçülü aerosol üç günden daha uzun süre kullamlınadıysa, valfe bir kez basılması gereklidir.)
2. Soluğunuzu tam olarak veriniz.
3. İnhalatörü Şekil lde görüldüğü gibi tutunuz ve ağızlık parçasını dudaklarınızın arasına yerleştiriniz. Ok işareti ve tüpün tabanı yukarıya bakıyor olmalıdır.
(Şekil 1)
4. Mümkün olduğu kadar derin bir soluk alırken, aynı anda aerosol tüpünün tabanına sıkıca bastırınız, bu hareket bir ölçülü doz ilacın serbest bırakılmasını sağlar. Soluğunuzu birkaç saniye tuttuktan sonra, ağızlık parçasını ağzınızdan çıkarınız ve soluğunuzu veriniz.
İkinci bir inhalasyon için, aynı işlemler tekrarlanmalıdır.
5. Kullandıktan sonra, koruyucu kapağı yerine takınız.
Aerosol tüpü şeffaf değildir. Bu nedenle ne zaman boşaldığını görmek mümkün değildir. İnhalatör 200 doz (püskürtme) içerir. Bunların tamamı kullanıldığında, aerosol tüpünün halen daha içinde küçük bir miktar sıvı bulunduğu görülür. Ancak, aerosol tüpünün değiştirilmesi gerekir, çünkü ilacı doğru miktarda alamayabilirsiniz.
Aerosol tüpünüzdeki yaklaşık ilaç miktarı aşağıdaki şekilde kontrol edilebilir:
- Aerosol tüpünüzün çalkalanması içerisinde sıvı kalıp kalmadığını gösterecektir.
- Alternatif olarak aerosol tüpünü plastik ağızlık parçasından ayırınız ve su dolu bir kaba koyunuz. Aerosol tüpünün içeriği, suyun içindeki pozisyonu gözlenerek tahmin edilebilir.
(Şekil 2)
İnhalatörünüzü en az haftada bir kez temizleyiniz.
İnhalatörünüzün ağızlık parçasını temiz tutmanız önem taşımaktadır. Böylelikle ilaç birikerek spreyi bloke etmeyecektir.
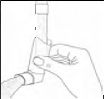
Temizlik için, önce toz kapağını çıkarınız ve inhalatörden aerosol tüpünü ayırınız. Herhangi bir ilaç birikimi ve/veya kir görünmeyinceye kadar inhalatörün içini ılık su ile yıkayınız.
(Şekil 3)
Temizlikten sonra inhalatörü sallayınız ve herhangi bir ısıtıcı sistem
kullanmaksızın havada kurumaya bırakınız. Ağızlık parçası kuruduktan sonra, aerosol tüpünü ve toz kapağını takınız.
(Şekil 4)
UYARI:
Plastik ağızlık parçası, her zaman için doğru miktarda ilaç almanızı sağlamak için, özel olarak BERODUAL® ile birlikte kullanılmak üzere tasarlanmıştır. Ağızlık parçası kesinlikle başka bir ölçülü doz aerosol ile kullanılmamalıdır. Aynı şekilde BERODUAL® ölçülü doz aerosol de, ürün ile birlikte gelenin dışında, başka bir ağızlık parçasıyla kullanılmamalıdır.
Aerosol tüpünün içinde basınç söz konusudur. Bu nedenle hiçbir şekilde zorlayarak açılmamalı ve 50 °Cnin üstünde sıcaklıklara maruz bırakılmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği: Geçerli değil.
4.3. Kontrendikasyonlar
BERODUAL® aşağıdaki durumlarda kontrendikedir:
İpratropium bromür, fenoterol hidrobromür ya da atropin benzeri maddelere karşı veya ilacın herhangi başka bir bileşenine karşı aşırı duyarlı olduğu bilinen hastalar,
4.4. Özel kullanım uyarıları ve önlemleri
Akut, hızla kötüleşen dispne (solunum zorluğu) durumunda hemen bir doktora danışılması gereklidir.
Uzun süreli kullanım:
Bronşiyal asümlı hastalarda BERODUAL® yalnızca "ihtiyaç duyulan zaman temelinde kullanılmalıdır. Hafif KOAH hastalannda ihtiyaca göre (semptomlara bağlı) tedavi, düzenli kullanıma tercih edilebilir.
Bronşiyal astım ve steroide duyarlı KOAH hastalarında, havayollarındaki enflamasyonu kontrol altına almak ve hastalığın ağırlaşmasını önlemek için, antienflamatuar tedavi eklenmesi ya da bunun arttınlması düşünülmelidir.
Bronşiyal obstrüksiyon semptomlarını kontrol altına almak için, BERODUAL® gibi beta2-agonist içeren ürünlerin düzenli bir şekilde giderek artan miktarlarda kullanılması, hastalık kontrolünün azalmakta olduğuna işaret edebilir. Eğer bronşiyal obstrüksiyon ağırlaşıyorsa, tek önlem olarak, BERODUAL® gibi beta2-agonist içeren ürünlerin önerilen dozun üzerinde uzun süreler boyunca kullanılmasının arttırılması uygun değildir ve muhtemelen zararlıdır. Bu durumda, hastalık kontrolünde yaşamı tehdit edici nitelikte olası bir ağırlaşmanın engellenmesi amacıyla, hastanın tedavi planı ve özellikle de inhale kortikosteroidlerle antienflamatuar tedavinin uygunluğu yeniden gözden geçirilmelidir.
Diğer sempatomimetik bronkodilatörler, BERODUAL® ile birlikte ancak tıbbi gözetim altında kullanılmalıdır.
BERODUAL® aşağıdaki durumlarda, özellikle önerilenden daha yüksek dozların uygulanması söz konusu olduğunda, yalnızca dikkatli bir risk/yarar değerlendirilmesi yapıldıktan sonra kullanılmalıdır: Yeterince kontrol altında olmayan diabetes mellitus, yakınlarda geçirilmiş miyokard enfarktüsü, miyokardit, şiddetli organik kalp veya damar hastalıkları, hipertiroidizm, feokromositoma.
BERODUAL® dahil, sempatomimetik ilaçlarla kardiyovasküler etkiler görülebilir. Pazarlama sonrası dönem verilerinde ve yayınlanmış literatürde ender olgular halinde, beta agonistlerle ilişkili miyokard iskemisi olayları vardır. BERODUAL® almakta olan ve altta yatan ağır kalp hastalığı (örn. iskemik kalp hastalığı, aritmi, ya da şiddetli kalp yetmezliği) olan hastalar, göğüs ağrısı veya ağırlaşan kalp hastalığının başka semptomları ortaya çıktığında doktora başvurmaları konusunda uyarılmalıdır. Dispne ve göğüs ağrısı gibi semptomların değerlendirilmesinde dikkatli olunmalıdır, çünkü bunların her ikisi de hem respiratuar hem de kardiyak kökenli olabilirler.
Beta2-agonist tedavisi, potansiyel olarak ağır bir hipokalemi ile sonuçlanabilir.
BERODUAL®, dar-açılı glokoma karşı predispoze olan ya da önceden üriner kanal çıkış obstrüksiyonu (örn. prostat hiperplazisi veya mesane boynu obstrüksiyonu) bulunan hastalarda dikkatle kullanılmalıdır.
Aerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta2-agonist ile birlikte göze temas ettiğinde oküler komplikasyonlar (midriyazis, göz içi basıncında yükselme, dar-açılı glokom, göz ağrısı) geliştiği bildirilen izole raporlar vardır. Bu nedenle hastalara, BERODUAL® in doğru bir şekilde nasıl kullanılacağı öğretilmelidir. İlacın göze kaçmaması için dikkatli olunmalıdır.
Konjonktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde görülürse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır.
Kistik fıbrozlu hastalar, gastrointestinal motilite bozuklukları gelişmesine daha meyilli olabilirler.
BERODUAL® uygulamasından sonra ani aşırı duyarlılık reaksiyonlan oluşabilir; bu şekilde nadiren ürtiker, anjiyo-ödem, deri döküntüleri, bronkospazm, orofarenjiyal ödem ve anafılaksi vakaları görülmüştür. Böyle bir durumda ilaca son verilmeli ve derhal bir doktora başvurulmalıdır.
BERODUAL® kullanımı, klinik dışı madde kötüye kullanımı için yapılan testlerde, örn. atletik performansın yükseltilmesi (doping) kapsamında, fenoterol için pozitif sonuçlara yol açabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer beta-adreneıjikler ve antikolinerjikler ve ksantin türevleri (teofilin gibi), bronkodilatör etkiyi arttırabilir. Diğer beta-mimetiklerin, sistemik dolaşıma geçen antikolinerj iki erin ve ksantin türevlerinin birlikte uygulanması (örn. teofilin) advers reaksiyonları arttırabilir.
Beta-blokerler ile birlikte eş-zamanlı uygulama esnasında, bronkodilatör etkide potansiyel olarak ciddi bir azalma ortaya çıkabilir.
Beta-agonistlerin indüklediği hipokalemi, ksantin türevleri, kortikosteroidler ve diüretikler ile yapılan eş-zamanlı tedavi ile artabilir. Bu durum özellikle şiddetli havayolu obstrüksiyonu olan hastalarda dikkate alınmalıdır.
Hipokalemi, digoksin verilen hastalarda aritmilere karşı duyarlılığı arttırabilir. Ayrıca hipoksi, hipokaleminin kalp ritmi üzerindeki etkilerini şiddetlendirebilir. Bu gibi durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilmektedir.
Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile tedavi edilmekte olan hastalarda beta2-agonist içeren tıbbi ürünler dikkatle uygulanmalıdır, çünkü beta-adrenerjik agonistlerin aktiviteleri artabilir.
Hal otan, trikloroetilen ve enfiuran gibi hal oj enli hidrokarbon anestetiklerinin inhalasyonu, beta-agonistlerin kardiyovasküler etkilerine karşı duyarlılığı arttırabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel veri bulunmamaktadır.
Pediyatrik popülasyon:
4.6. Gebelik ve laktasyon
Genel tavsiye: Gebelik kategorisi Cdir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi: Klinik öncesi verilerde ve insanlardaki deneyimlerde, fenoterol ya da iprotropium için gebelikte advers etki gösterdikleri yönünde bir bilgi bulunmamaktadır. İpratropium bromür ve fenoterol hidrobromürün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Özellikle ilk üç ay içerisinde, gebelikte ilaç kullanımıyla ilgili olağan önlemlere uyulmalıdır. İnsanlara yönelik potansiyel risk bilinmemektedir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Fenoterolün uterus kontraksiyonları üzerindeki inhibitör etkisi dikkate alınmalıdır.
Laktasyon dönemi: Klinik öncesi çalışmalarda fenoterol hidrobromürün süte geçtiği gösterilmiştir. İpratropiumun süte geçip geçmediği bilinmemektedir, ama ipratropiumun, özellikle de inhalasyon yoluyla alındığında, bebekte önemli düzeylere ulaşabilme olasılığı çok uzaktır. Hayvanlar üzerinde yapılan çalışmalar doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Bebeğini emziren bir anneye BERODUAL® verilirken dikkatli olunması gerekir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamışür.
4.8. İstenmeyen etkiler
Listelenen istenmeyen etkilerin birçoğu BERODUAL®in antikolinerjik ve beta-adrenerjik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, BERODUAL® lokal irritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonları, klinik araştırmalarda ve ilacın onay sonrası kullanım dönemindeki farmakovijilans çalışmalarında elde edilen verilerden tanımlanmıştır.
Klinik araştırmalarda en sık bildirilen yan etkiler öksürük, ağız kuruluğu, baş ağrısı, tremor, farenjit, bulantı, baş dönmesi, disfoni, taşikardi, palpitasyonlar, kusma, sistolik kan basıncında yükselme ve sinirlilik haliydi.
Listelenen yan etkilerin sıklık oranları aşağıdaki gibidir:
Çok yaygın Y aygın
Yaygın olmayan
Seyrek
Çok seyrek
> 1/10 > 1/100 ilâ < 1/10 > 1/1,000 ilâ < 1/100 > 1/10,000 ilâ < 1/1,000 < 1/10,000
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Bağışıklık sistemi hastalıkları
Seyrek: Anaflaktik reaksiyon*, aşırı duyarlılık*
Metabolizma ve beslenme hastalıkları
Seyrek: Hipokalemi1
Psikiyatrik hastalıklar
Yaygın olmayan: Sinirlilik
Seyrek: Ajitasyon, mental bozukluk
Sinir sistemi hastalıkları
Yaygın olmayan: Baş ağrısı, tremor, baş dönmesi
Göz hastalıkları
Seyrek: Glokom*, göz içi basıncında artış*, akomodasyon bozukluğu*,
midriyazis*, bulanık görme*, göz ağrısı*, kornea ödemi*, konjonktival
hiperemi*, haleler görme*
Kardiyak hastalıklar
Yaygın olmayan: Taşikardi (kalp hızında artış), palpitasyonlar
Seyrek: Aritmi, atriyal fibrilasyon, supraventriküler taşikardi*, miyokard iskemisi*
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar
Yaygın: Öksürük
Yaygın olmayan: Farenjit, disfoni
Seyrek: Bronkospazm, boğazda irritasyon, farenjiyal ödem, laringospazm*,
paradoks bronkospazm*, boğaz kuruluğu
Gastrointestinal hastalıklar
Yaygın olmayan: Kusma, bulantı, ağız kuruluğu
Seyrek: Stomatit, glossit, gastrointestinal motilite bozukluğu, diyare,
konstipasyon*, ağızda ödem*
Deri ve derialtı dokusu hastalıkları
Seyrek: Ürtiker, döküntü, pruritus, anjiyoödem*, hiperhidroz*
Kas-iskelet ve bağ dokusu hastalıklan
Seyrek: Kaslarda zayıflık, kas spazmları, miyalji
Böbrek ve idrar hastalıklan
Seyrek: İdrar retansiyonu
Araştırmalar
Yaygın olmayan: Sistolik kan basıncında artış
Seyrek: Diyastolik kan basıncında azalma
Doz aşımının oluşturduğu etkilerin öncelikle fenoterole bağlı olması beklenmektedir.
Doz aşımında beklenen semptomlar, aşırı beta-adreneıjik uyarının yol açtığı semptomlardır; en belirgin olanları taşikardi, palpitasyon, tremor, hipertansiyon, hipotansiyon, nabız basıncının genişlemesi, anjinal ağrı, aritmiler ve yüz-boyun bölgesinde kızarıklıktır.
İpratropium bromür doz aşımından beklenen semptomlar (ağız kuruluğu, görsel akomodasyon bozukluğu gibi), inhale iprotropiumun sistemik temasının çok düşük olması nedeniyle hafif niteliktedir.
Sedatifler ve trankilizanlar verilir; ağır vakalarda yoğun bakım tedavisi uygulanır.
Beta-reseptor blokerleri, tercihen betaı-selektif olanları, spesifik antidotlar olarak uygundurlar; ancak, bronşiyal obstrüksiyonda muhtemel bir artış dikkate alınmalıdır ve doz, bronşiyal astımı veya KOAHı olan hastalarda dikkatle uyarlanmalıdır; çünkü fatal olabilen ağır bir bronkospazmı presipite etme riski söz konusudur.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Fenoterol ve obstrüktif akciğer hastalığı için diğer tıbbi ürünler
ATC kodu: R03 AK03
Astımlı çocuklar ile erişkin astım ve KOAH hastalan üzerinde yürütülen, HFA formülasyonu ile CFC formülasyonunun karşılaştırıldığı, 3 aya kadar tedavi süresi olan araştırmalarda, iki formülasyonun terapötik olarak eşdeğer olduğu gösterilmiştir.
BERODUAL® iki etkin bronkodilatör bileşen içermektedir; antikolineıjik etki gösteren ipratropium bromür ve bir beta adrenerjik ajan olan fenoterol hidrobromür.
İpratropium bromür, antikolinerjik (parasempatolitik) özellikleri olan bir kuatemer amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen transmitter ajan olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe etmiştir. Antikolinerjikler, asetilkolinin bronş düz kaslarındaki muskarinik reseptörlerle etkileşimi sonucu meydana gelen hücre içi Ca++ artışlarını önlerler. Ca++ salıverilmesine, IP3 (inozitol trifosfat) ve DAG (diaçilgliserol)den oluşan ikinci ulak sistemi aracılık etmektedir.
İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve bölgeye özgü bir etkidir ve sistemik yapıda değildir.
Klinik öncesi ve klinik çalışmalarda elde edilen veriler ipratropium bromürün, havayolları mukus sekresyonu, mukosiliyer klerens ya da gaz alış verişi üzerinde hiçbir zararlı etkisi olmadığını göstermektedir.
Fenoterol hidrobromür, terapötik doz aralığında beta2 reseptörleri seçici olarak stimüle eden, direkt etkili bir sempatomimetik ajandır. Betaı reseptörlerin stimülasyonu, daha yüksek bir doz aralığında gerçekleşir (örn. tokoliz işleminde uygulanan gibi). Beta2 reseptörlerin bağlanması, uyarıcı bir Gs proteini aracılığıyla adenil siklazı aktive eder.
Siklik AMPdeki artış protein kinaz Ayı aktive eder ve bu madde daha sonra düz kas hücrelerindeki hedef proteinleri fosforile eder. Bu olay sırasıyla, miyozin hafif zincirli kina/ın fosforilasyonuna, fosfoinozitid hidrolizinin inhibisyonuna ve geniş bantlı, kalsiyum aktivasyonlu potasyum kanallarının açılmasına öncülük eder.
Fenoterol hidrobromür bronşiyal ve vasküler düz kası gevşetir ve histamin, metakolin, soğuk hava ve allerjen (erken yanıt) gibi bronkokonstriksiyon yapıcı uyanlara karşı korur. Akut uygulamadan sonra, mast hücrelerinden bronkokonstriktör ve proinflamatuar mediyatörlerin salınımı inhibe edilir. Ayrıca fenoterol dozları (0.6 mg) uygulamasından sonra mukosiliyer klerenste artış olduğu da gösterilmiştir.
Daha sık olarak oral yolla, bundan da daha sık olarak intravenöz yolla elde edilen yüksek plazma konsantrasyonlannda uterus motilitesini inhibe eder. Yüksek dozlarda aynı zamanda metabolik etkiler de gözlenir; lipoliz, glikojenoliz, hiperglisemi ve hipokalemi. Hipokalemiye, esas olarak iskelet kası içine K+ aliminin artışı neden olmaktadır.
Kalp hızı ve kontraktilitesinde artış gibi, kalp üzerindeki beta adreneıjik etkilere, fenoterol ün vasküler etkileri, kardiyak beta2 reseptörlerin stimülasyonu ve supraterapötik dozlarda betaı reseptörlerin stimülasyonu yol açmaktadır. Diğer beta adrenerjik ajanlarla olduğu gibi, QTc uzamaları bildirilmiştir. Fenoterol ölçülü doz inhalatör için bu etkiler diğerlerine göre çok daha belirgin olmuş ve önerilenden daha yüksek dozlarda gözlenmiştir. Ancak nebülizatörler ile uygulamadan sonra (tek dozluk flakonlar, inhalasyon solüsyonu) sistemik temas, önerilen ölçülü doz inhalatör dozlarıyla olandan daha fazla olabilir. Bu durumun klinikteki önemi belirlenmemiştir. Tremor beta agonistlerin daha sık gözlenen bir etkisidir. Bronş düz kası üzerindeki etkilerinden farklı olarak, beta agonistlerin sistemik etkilerine karşı tolerans gelişmesi söz konusudur.
Bu iki etkin bileşenin birlikte kullanılması, farklı farmakolojik mekanizma bölgelerini etkileyerek bronşlan dilate eder. Böylelikle bu iki etkin madde, bronş kasları üzerindeki spazmolitik etkilerini gösterirken birbirlerini bütünlerler ve solunum yolunda konstriksiyon ile seyreden bronkopulmoner hastalıklar alanında geniş bir kullanım imkanı sağlarlar. Bu bütünleyici etki, arzu edilen aktivitenin elde edilmesi için, sadece çok küçük bir oranda beta adreneıjik bileşene ihtiyaç duyulmasını sağlar; böylelikle her hastaya uygun, advers etkilerin minimum olduğu bireysel dozaj uygulamasını kolaylaştırır.
Astım ve KOAH hastalarında yürütülen çalışmalarda, ipratropium ya da fenoterol bileşenlerine kıyasla daha iyi etkinlik gösterdiği ortaya konulmuştur. Kümülatif doz-yanıt çalışmalarında BERODUAL®in, ipratropium olmaksızın uygulanan fenoterol dozunun iki katı ölçüsünde etkili olduğu ve daha iyi tolere edildiği, iki çalışma ile (biri astim hastalannda diğeri KOAH hastalannda) gösterilmiştir.
5.2. Farmakokinetik özellikler
Genel özellikler
İpratropium bromür ve fenoterol hidrobromür kombinasyonunun terapötik etkisi, hava yollan içinde bir lokal aktivite sonucunda ortaya çıkar. Bu nedenle, bronkodilatasyonun farmakodinamisi, ürünün etkin bileşenlerinin farmakokinetik özellikleriyle ilişkili değildir.
İnhalasyondan sonra, formülasyona, inhalasyon tekniğine ve cihaza bağh olarak, dozun %10 ile 39u genellikle akciğerlerde tutulur; alınan dozun geri kalan bölümü ise ağızlık parçası, ağız ve solunum yolunun üst tarafında (orofarinks) tutulur. HFA 134a ya da CFC propellanı ile ölçülü doz aerosol inhalasyonundan sonra, solunum yolunda benzer miktarlarda doz tutulmaktadır. Özellikle sulu solüsyonun RESPIMAT® inhalatörüyle inhalasyonundan sonra, ölçülü doz aerosol inhalatöre kıyasla iki katın üzerinde bir akciğer tutulumunun olduğu deneysel olarak gözlenmiştir. RESPIMAT® inhalatörüyle orofarenjiyal tutulum da, ölçülü doz aerosol inhalatöre kıyasla, karşılık gelen ölçüde azalır ve anlamlı olarak daha küçüktür. Akciğerlerde tutulan doz bölümü hızla dolaşıma katılır (dakikalar içinde). Orofarinkste tutulan etkin madde yavaşça yutulur ve gastrointestinal kanala geçer. Bu nedenle sistemik temas, hem oral hem de akciğerdeki biyoyararlanımın bir fonksiyonudur.
İpratropium bromür ve fenoterol hidrobromürün HFA 134a ya da CFC propellanı ile inhalasyonundan sonra her iki etkin bileşen için 24 saat boyunca benzer bir kümülatif renal ekskresyon belirlenmiştir. HFA 134a ve klasik CFC formülasyonu biyoeşdeğer kabul edilebilir.
Her iki bileşenin de kombinasyon halindeki farmakokinetikl erinin, tekil maddelerin farmakokinetik özelliklerinden daha farklı olduğu yönünde bir veri bulunmamaktadır.
Fenoterol hidrobromür
Emilim:
İntravenöz uygulamadan sonra, serbest fenoterol ve konjuge fenoterol, kümülatif 24 saatlik idrarda, uygulanan dozun yaklaşık %15 ve %27si civarındadır. BERODUAL® ölçülü doz inhalatör yoluyla inhalasy ondan sonra, 24 saatlik idrarda inhale edilen dozun yaklaşık %1i bulunur. Bu veriler temelinde, inhale edilen fenoterol hidrobromür dozlarının sistemik biyoyararlanımının %7 olduğu tahmin edilmektedir.
Dağılım:
Fenoterolün dispozisyonunu açıklayan kinetik parametreler, i.v. uygulamadan sonraki plazma konsantrasyonlarından hesaplanmıştır. İntravenöz uygulamadan sonra, plazma konsantrasyon-zaman profilleri, terminal yarı-ömrün yaklaşık 3 saat olduğu, 3 kompartmanlı bir model ile açıklanabilir. Bu 3 kompartmanlı modelde, kararlı durumdaki fenoterolün görünür dağılım hacmi (Vdss) yaklaşık 189 Ldir (-2.1 L/kg).
İlacın %40 civarı plazma proteinlerine bağlıdır.
Sıçanlardaki klinik öncesi çalışmalarda fenoterol ve metabolitlerinin kan-beyin bariyerini geçmedikleri açığa çıkarılmıştır.
Biv otransformasv on:
Yutulan bölüm başlıca sülfat konjügatlarına metabolize olur. Oral uygulama sonrasındaki mutlak biyoyararlanım düşüktür (%1.5 dolayında).
Eliminasyon:
Fenoterolün total klerensi 1.8 L/dk ve renal klerensi 0.27 L/dkdır.
Bir ekskresyon balans çalışmasında intravenöz uygulamadan sonra, ilaca bağh radyoaktivitenin (ana bileşikler ve bütün metabolitler dahil olmak üzere) kümülatif renal ekskresyonu (2 gün) dozun %65ini oluşturmuştur, ve feçes ile atılan total radyoaktivite dozun %14.8ini oluşturmuştur. Oral uygulamadan sonra 48 saat içerisinde idrarla atılan total radyoaktivite dozun yaklaşık %39u ve feçes ile atılan total radyoaktivite dozun %40.2si olmuştur.
Doğrusallık/Doğrusal olmayan durum:
Özel veri bulunmamaktadır.
İpratropium bromür Emilim:
İpratropiumun (ana bileşik) kümülatif renal ekskresyonu (0-24 saat), intravenöz uygulanan dozun yaklaşık %46sı, oral verilen dozun %1inden azı, ve BERODUAL® ölçülü doz inhalatör yoluyla inhale edilen dozun yaklaşık %3 ile 13ü olmuştur. Bu veriler temelinde, oral ve inhale ipratropium bromür dozlarının sistemik biyoyararlanımlarının, sırasıyla %2 ve %7-28 olduğu tahmin edilmektedir. Bu durum dikkate alındığında, ipratropium bromür dozunun yutulan bölümü sistemik temasa önemli bir katkıda bulunmamaktadır.
Dağılım:
İpratropiumun dispozisyonunu açıklayan kinetik parametreler, i.v. uygulamadan sonraki plazma konsantrasyonlarından hesaplanmıştır. Plazma konsantrasyonlarında hızlı bir bifazik azalma gözlenir. Kararlı durumdaki görünür dağılım hacmi (Vdss) yaklaşık 176 Ldir (-2.4 L/kg). İlacın plazma proteinlerine bağlanması minimaldir (%20den düşük). Sıçanlar ve köpeklerdeki klinik öncesi çalışmalarda katemer amin ipratropiumun kan-beyin bariyerini geçmediği açığa çıkarılmıştır.
Biv otransformasv on:
İntravenöz uygulamadan sonra dozun yaklaşık %60ı, muhtemelen başlıca karaciğerde olmak üzere, oksidasyon yoluyla metabolize olmaktadır.
Eliminasyon:
Terminal eliminasyon fazındaki yan-ömür yaklaşık 1.6 saattir.
İpratropiumun total klerensi 2.3 L/dk ve renal klerensi 0.9 L/dkdır.
Bir ekskresyon balans çalışmasında, ilaca bağh radyoaktivitenin (ana bileşikler ve bütün metabolitler dahil olmak üzere) kümülatif renal ekskresyonu (6 gün), intravenöz uygulamadan sonra %72.1, oral uygulamadan sonra %9.3 ve inhalasy ondan sonra %3.2 olmuştur. Feçes ile atılan total radyoaktivite, intravenöz uygulamadan sonra %6.3, oral uygulamadan sonra %88.5 ve inhalasyondan sonra %69.4 olmuştur. İntravenöz uygulamadan sonra ilaca bağh radyoaktivitenin ekskresyonuyla ilgili olarak, ekskresyon başlıca böbrek yoluyla olmaktadır. İlaca bağh radyoaktivitenin (ana bileşik ve metabolitler) eliminasyon yarı-ömrü 3.6 saattir. İdrardaki temel metabolitlerin muskarinik reseptöre bağlanmaları ihmal edilebilir düzeydedir ve bu metabolitlerin etkili olmadıkları kabul edilmektedir.
Doğrusallık/Doğrusal olmayan durum:
Özel veri bulunmamaktadır.
Hastalardaki karakteristik özellikler:
Hastalardaki karakteristik özelliklere ilişkin ek bilgi bulunmamaktadır.
İpratropium bromür ve fenoterol hidrobromür kombinasyonuyla yapılan tekrarlı-doz toksisite çalışmalarında, HFA formülasyonu ve klasik CFC formülasyonunun toksikolojik profillerinin benzer olduğu gösterilmiştir.
Fare ve sıçanlarda ipratropium bromür ve fenoterol hidrobromür kombinasyonuyla 1/2.5 oranında (ipratropium bromür/fenoterol hidrobromür) yürütülen tek-doz toksisitesi çalışmalarında oral, intravenöz ve inhalasyon yoluyla uygulamadan sonra, akut toksisitenin düşük düzeyde olduğu açığa çıkarılmıştır. Tekil bileşenler arasında kıyaslama yapıldığında, kombinasyonun LD50 değerlerinin fenoterol hidrobromürden çok iprotropium bromür bileşeni tarafından belirlendiği görülmüş ve herhangi bir potansiyalizasyon göstergesi bulunmamıştır.
İpratropium bromür ve fenoterol hidrobromür kombinasyonuyla tekrarlı doz toksisite çalışmaları, 13 haftaya kadar sürelerle sıçanlar (oral, inhalasyon) ve köpeklerde (intravenöz, inhalasyon) yürütülmüştür. İnsanlarda önerilenin birkaç yüz katına varan dozlarda, yalnızca minör toksik etkiler gözlenmiştir. Sol ventrikülde miyokard sikatrisleri, sadece 4 haftalık intravenöz köpek çalışmasındaki en yüksek doz grubundan (84 mikrogram/kg/gün) bir hayvanda görülmüştür. Sıçanlardaki 13 haftalık oral ve köpeklerdeki 13 haftalık inhalasyon çalışmalarında, tekil bileşenlerle oluşanların dışında herhangi bir toksikolojik değişim görülmemiştir.
Kombinasyon ile tekil bileşenlere kıyasla herhangi bir potansiyalizasyon göstergesi bulunmamıştır. Gözlenen advers etkilerin tamamı fenoterol hidrobromür ve ipratropium bromür için iyi bilinen etkilerdir.
İpratropium bromür ve fenoterol hidrobromür kombinasyonu sıçanlara ve tavşanlara inhalasyon yoluyla uygulandığında, teratojenik etki oluşmamıştır. Teratojenik etkiler ipratropium bromür ve inhalasyonla uygulanan fenoterol hidrobromür ile de görülmemiştir. Oral doz uygulamasından sonra, >25 mg/kg/gün (tavşanlar) ve >38.5 mg/kg/gün (fareler) dozlarında fenoterol hidrobromür malformasyon oranında artışı indüklemiştir.
Gözlenen malformasyonların beta-agonistler için bir sınıf etkisi olduğu kabul edilmektedir. 90 mg/kg/güne kadar ipratropium bromür ve 40 mg/kg/güne kadar fenoterol hidrobromür oral dozlarında, sıçanlarda fertilite bozulmamıştı.
Kombinasyon ile genotoksisite çalışmaları yürütülmemiştir. In vitro ve in vivo çalışmalarda ne fenoterol hidrobromürün ne de ipratropium bromürün mutajenik potansiyele sahip olmadığı açığa çıkarılmıştır.
Kombinasyon ile karsinojenisite çalışmaları yürütülmemiştir.
Kombinasyon ile karsinojenisite çalışmaları yürütülmemiştir. İpratropium bromür ile fareler ve sıçanlardaki uzun dönemli çalışmalarda tümörijenik ya da karsinojenik etkiler gösterilmemiştir. Fenoterol hidrobromür için, oral (fareler ile 18 ay, sıçanlar ile 24 ay) ve inhalasyon (sıçanlar ile
24 ay) yoluyla uygulamadan sonra karsinojenisite çalışmaları yapılmıştır. Oral 25 mg/kg/gün dozlarında farelerde uterusta leiomiyoma insidansında artış ve değişken mitotik aktivite, sıçanlarda mezovaryal leiomiyoma insidansında artış gözlenmiştir. Bu bulgular fareler ve sıçanlarda beta adrenerjik ajanların uterus düz kası üzerindeki lokal aktivitesi sonucu ortaya çıkan, bilinen etkileridir. Araştırmaların günümüzde ulaştığı düzey dikkate alındığında, bu sonuçlar insanlar için geçerli değildir. Bulunan bütün diğer neoplaziler, kullanılan türlerde
spontan olarak ortaya çıkan, yaygın neoplazi tipleriydi ve fenoterol hidrobromür tedavisi sonucunda oluşan, biyolojik olarak önemli bir insidans artışı göstermemekteydi.
Ölçülü doz aerosol HFA ve ölçülü doz aerosol CFCnin solunum yolunda eşdeğer olarak iyi tolere edildikleri gösterilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
İtici gaz: 1,1,1,2-Tetrafloroetan (HFA 134 a)
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
30 °Cnin altında oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir gereklilik yoktur.
Kullanılmamış olan ürün ya da atık materyaller, "Tıbbi Atıkların Kontrolü ve "Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir.
Madde 4.2ye bakınız.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| COMBIBERO | 8699693520111 | 169.30TL |
| Diğer Eşdeğer İlaçlar |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | Geri Ödemede Değil |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693520104 |
| Etkin Madde | Ipratropium Bromur + Fenoterol Hidrobromur |
| ATC Kodu | R03AK03 |
| Birim Miktar | |
| Birim Cinsi | |
| Ambalaj Miktarı | 200 |
| Solunum Sistemi > Adrenerjikler (İnhalan) > Fenoterol Kombinasyonları |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |