BIMIERE 100 mg film kaplı tablet (2 tablet) Kısa Ürün Bilgisi
{ Lasmiditan }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BIMIERE 100 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet 100 mg lasmiditan (115,65 mg lasmiditan hemisüksinata eşdeğer) içerir.
Yardımcı maddeler
Yardımcı maddelerin tamamı için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Açık mor, oval, film kaplı, bir tarafında âL-100â ve diğer tarafında â4491â yazılı tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
BIMIERE, yetişkinlerde auralı veya aurasız migrenin akut tedavisinde endikedir. BIMIERE yetişkinlerde migrenin önleyici tedavisi için endike değildir.
4.2. Pozoloji ve uygulama şekli
Pozoloji:Önerilen doz, ağızdan alınan 100 mg BIMIERE'dir. Yirmi dört saat içinde en fazla bir doz alınmalı ve hasta, dozlama ile araç ya da makine kullanımı arasında en az 8 saat bekleyemiyorsa BIMIERE kullanılmamalıdır (bkz. Bölüm 4.4).
Aynı migren atağında ikinci bir BIMIERE dozunun etkili olduğu kanıtlanmamıştır.
Otuz günlük dönemde ortalama olarak 4'ten fazla migren atağını tedavi etmenin güvenliliği belirlenmemiştir.
Uygulama şekli:
BIMIERE oral kullanım içindir. BIMIERE aç veya tok karnına alınabilir. Özel popülasyonlara iliskin ek bilgiler:
Böbrek yetmezliği:
Böbrek fonksiyonuna bağlı olarak doz ayarlaması gerekli değildir.
Karaciğer yetmezliği:
Hafif ya da orta karaciğer yetmezliği olan hastalar için dozaj ayarlaması gerekli değildir (Child- Pugh A ya da B). BIMIERE şiddetli karaciğer yetmezliği (Child-Pugh C) olan hastalarda araştırılmamıştır ve bu hastalarda kullanımı önerilmemektedir.
Pediyatrik popülasyon:
Pediyatrik hastalardaki güvenlilik ve etkinlik belirlenmemiştir.
Geriyatrik popülasyon:
Kontrollü klinik çalışmalarda, sersemlik hali 65 yaş ve üzeri hastalarda (BIMIERE ile %19, plaseboyla %2) 65 yaşından küçük hastalara kıyasla (BIMIERE ile %14, plaseboyla %3) daha sık meydana gelmiştir. Sistolik kan basıncında da 65 yaş ve üzeri hastalarda 65 yaşından küçük hastalara kıyasla daha büyük bir artış olmuştur (bkz. Bölüm 4.8). Klinik BIMIERE çalışmalarında yeterli sayıda 65 yaş ve üzeri hasta yer almadığından, bu hastalarda daha genç hastalara kıyasla etkililik farkı olup olmadığı saptanamamıştır. Öte yandan, klinik farmakoloji çalışmalarında yaşlı hastalarda BIMIERE maruziyeti üzerinde klinik açıdan anlamlı etki gözlenmemiştir. Genel olarak, yaşlı bir hasta için doz seçimi, çoğunlukla daha yüksek sıklıkta karaciğer, böbrek veya kalp fonksiyonu azalmasını ve eşzamanlı hastalık ya da başka ilaç tedavisini düşünerek, doz aralığının düşük ucundan başlanarak dikkatlice yapılmalıdır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
İlacın yanlış kullanımı veya suistimal potansiyeli
Tüm BIMIERE dozlarında gönüllüler, BIMIERE'nin suistimal potansiyeline sahip olduğunu gösteren, plaseboya göre istatistiksel olarak önemli ölçüde daha yüksek "maddeden hoşlanma" puanları bildirmişlerdir.
Sağlıklı gönüllülerde, 7 günlük 200 mg veya 400 mg lasmiditan dozunu takiben dozun aniden kesilmesinin ardından fiziksel yoksunluk gözlenmemiştir.
Faz 2 ve 3 çalışmaları, terapötik dozlarda BIMIERE'nin plaseboya göre daha fazla öfori ve halüsinasyon yan etkileri oluşturduğunu göstermektedir. Ancak bu olaylar düşük bir sıklıkta meydana gelmiştir (hastaların yaklaşık %1'i).
Hastalar, ilaç suistimali riski açısından değerlendirmeli ve BIMIERE'nin yanlış kullanımı veya suistimali belirtileri açısından gözlemlenmelidir.
Merkezi Sinir Sistemi Depresyonu
BIMIERE sersemlik hali ve sedasyonu içeren merkezi sinir sistemi (MSS) depresyonuna neden olabilir (bkz. Bölüm 4.8).
BIMIERE'nin sedasyona, başka bilişsel ve/veya nöropsikiyatrik advers reaksiyonlara ve araç kullanma yetisinde bozukluğa neden olma potansiyeli nedeniyle, BIMIERE alkolle ya da başka MSS depresanlarıyla beraber alınacaksa dikkatle kullanılmalıdır (bkz. Bölüm 4.5).
Hastalar, BIMIERE aldıktan en az 8 saat sonrasına kadar araba kullanmamaları ve tam zihinsel uyanıklık gerektiren diğer aktivitelere girişmemeleri gerektiği konusunda uyarılmalıdır (bkz. Bölüm 4.4).
Serotonin Sendromu
Klinik çalışmalarda, serotonin sendromuyla ilişkili başka ilaç kullanmayan, BIMIERE tedavisi gören hastalarda serotonin sendromuyla uyumlu reaksiyonlar raporlanmıştır.
Serotonin sendromu aynı zamanda serotonerjik ilaçlarla [örn. selektif serotonin geri alım inhibitörleri (SSRI'lar), serotonin norepinefrin geri alım inhibitörleri (SNRI'lar), trisiklik antidepresanlar (TCA'lar) ve monoamin oksidaz (MAO) inhibitörleri] beraber uygulanan BIMIERE ile de görülebilir. Serotonin sendromu semptomları içinde mental durum değişiklikleri (örn. ajitasyon, halüsinasyonlar, koma), otonom instabilite (örn. taşikardi, değişken kan basıncı, hipertermi), nöromusküler bulgular (örn. hiperrefleksi, koordinasyonsuzluk) ve/veya gastrointestinal bulgu ve semptomlar (örn. bulantı, kusma, diyare) yer alır. Semptomlar çoğunlukla yeni ya da yüksek dozda serotonerjik ilaç alındıktan sonra birkaç dakika ila birkaç saat içinde ortaya çıkmaya başlar. Serotonin sendromu şüphesi olduğu takdirde, BIMIERE tedavisi kesilmelidir.
Fazla İlaç Kullanımına Bağlı Baş Ağrısı
Akut migren ilaçlarının fazla kullanımı (örn. ergotaminler, triptanlar, opioidler ya da bu ilaçların kombinasyonunun ayda en az 10 gün kullanımı) baş ağrısının şiddetlenmesine yol açabilir. Fazla ilaç kullanımına bağlı baş ağrısı, kendini migren benzeri günlük baş ağrıları ya da migren ataklarının sıklığında belirgin bir artış olarak gösterebilir. Fazla kullanılmış olan ilaçların kesilmesi ve yoksunluk semptomlarının tedavisi (çoğunlukla baş ağrısının geçici olarak kötüleşmesini içerir) gibi detoksifikasyon uygulamaları gerekebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
MSS Depresanları
BIMIERE ve alkolün ya da diğer MSS depresanlarının eşzamanlı olarak uygulanması klinik çalışmalarda değerlendirilmemiştir. BIMIERE'nin sedasyona ve başka bilişsel ve/veya nöropsikiyatrik advers reaksiyonlara neden olma potansiyeli bulunduğundan, BIMIERE alkolle ya da başka MSS depresanlarıyla beraber alınacaksa dikkatle kullanılmalıdır (bkz. Bölüm 4.4).
Serotonerjik İlaçlar
BIMIERE ve ilaçların (örn. SSRI'lar, SNRI'lar, TCA'lar, MAO inhibitörleri, trazodon vb.), reçetesiz ilaçların (örn. dekstrometorfan) ya da serotonini artıran bitkisel takviyelerin (örn. Kantaron (St. John's wort)) eşzamanlı olarak uygulanması serotonin sendromu riskini artırabilir (bkz. Bölüm 4.4). BIMIERE serotonin artıran ilaç alan hastalarda dikkatli kullanılmalıdır.
Kalp Atım Hızı Düşürücü İlaçlar
BIMIERE kalp atım hızının düşürülmesi ile ilişkilendirilmiştir (bkz. Bölüm 4.8). Bir ilaç etkileşimi çalışmasında, propranolol tedavisine tek doz 200 mg BIMIERE eklenmesi kalp atım hızında tek başına propranolol uygulanmasına kıyasla dakika başı 5 atım düşüş daha olmasına yol açarak, ortalama dakika başı maksimum 19 atım düşüşle sonuçlanmıştır.
Bu büyüklükteki kalp atım hızı düşüşünün tehlike arz ettiği durumlarda, kalp atım hızını düşüren eşzamanlı tedaviler gören hastalarda BIMIERE dikkatli kullanılmalıdır.
P-glikoprotein (P-gp) Taşıyıcı Substratlar
BIMIERE'nin, substrat plazma konsantrasyonundaki küçük bir değişikliğin ciddi toksisitelere yol açabileceği P-gp substratları (örn., digoksin) ile birlikte uygulanması önerilmez (bkz. Bölüm 5.2).
Lasmiditanın Diğer İlaçları Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan CYP2D6'nın in-vitro bir inhibitörüdür ancak diğer CYP450 enzimlerinin aktivitesini anlamlı ölçüde inhibe etmemiştir. Lasmiditanın bilinen duyarlı bir CYP2D6 substratı olan dekstrometorfan üzerindeki etkisinin modeli ve simülasyonu, lasmiditanın CYP2D6'yı klinik açıdan anlamlı derecede inhibe etmesinin olası olmadığını göstermektedir. Lasmiditan, M7, S-M8 ve [S,R]-M18; monoamin oksidaz A'nın (MAO-A) geri dönüşümlü ve zamana bağlı inhibitörleri değildir.
Günlük lasmiditan dozlaması sırasıyla CYP3A, CYP1A2 ve CYP2C9 substratları olan midazolam, kafein ya da tolbütamidin FK'sini değiştirmemiştir. Lasmiditanın sumatriptan, propranolol ya da topiramat ile beraber uygulanması, bu tıbbi ürünlerin maruziyetinde klinik olarak anlamlı değişikliklerle sonuçlanmamıştır.
İlaç Taşıyıcıları
Sağlıklı gönüllülerde yapılan bir ilaç etkileşimi çalışmasında, 200 mg BIMIERE'nin dabigatran (P-gp substratı) ile birlikte uygulanması dabigatranın sistemik maruziyetlerini, EAA ve C değerlerini sırasıyla %25 ve %22 arttırmıştır. Rosuvastatin (BCRP substratı) ile birlikte 200 mg BIMIERE'nin uygulanması, rosuvastatin maruziyetini etkilememiştir.
Lasmiditan OCT1'i in-vitro inhibe eder. Ancak lasmiditan ve sumatriptan (OCT1 substratı) ile ilgili bir ilaç-ilaç etkileşimi çalışmasında, sumatriptan FK'sinde değişiklik gözlenmemiştir. Lasmiditan renal akış taşıyıcıları MATE1 ve MATE2-K'yı in-vitro inhibe eder.
Diğer İlaçların Lasmiditanı Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan primer olarak CYP dışı enzimler tarafından hepatik ve ekstrahepatik olarak metabolize edilir. Dolayısıyla CYP inhibitörlerinin ya da indükleyicilerinin lasmiditanın farmakokinetik özelliklerini etkileme olasılığı düşüktür. Lasmiditanın sumatriptan, propranolol ya da topiramat ile birlikte değerlendirildiği klinik çalışmalarda anlamlı bir ilaç etkileşimi potansiyeli görülmemiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Hiçbir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Hiçbir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Tedavi sırasında gebe kalan ya da gebe kalmayı planlayan hastaların bu durumu hekimlerine bildirmeleri önerilmelidir.
Gebelik dönemi
BIMIERE'nin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
BIMIERE, gerekli olmadıkça (potansiyel yararların fetusun maruz kalabileceği potansiyel risklerden fazla olduğu durumlar) gebelik döneminde kullanılmamalıdır.
Gebe kadınlarda BIMIERE kullanımıyla ilişkili gelişimsel risk hakkında yeterli veri yoktur. Hayvanlar üzerindeki çalışmalarda, gelişim üzerindeki advers etkiler (fetal anormallik insidanslarında artış, embriyo-fetal ve yavru mortalitesinde yükselme, fetal vücut ağırlığında azalma) klinik olarak gözlemlenen maternal maruziyetlerden daha düşük (tavşan) ya da daha yüksek (sıçan) maruziyetlerde meydana gelmiştir. ABD genel popülasyonunda, klinik olarak tanınan gebeliklerde majör doğum kusurlarının ve düşüklerin tahmini arka plan riski sırasıyla
%2 ila %4 ve %15 ila %20'dir. Migrenli kadınların yaptığı doğumlarda tahmini majör doğum kusurları (%2,2 ila %2,9) ve düşük (%17) oranları, migreni olmayan kadınlarda bildirilen oranlara benzerdir.
Yayımlanan veriler migrenli kadınlarda gebelik sırasında preeklampsi ve gestasyonel hipertansiyon riskinin daha yüksek olabileceğini düşündürmektedir.
Lasmiditanın (0, 100, 175 veya 250 mg/kg/gün) gebe sıçanlara organogenez boyunca oral yoldan verilmesi, orta ve yüksek dozlarda iskelet varyasyonlarında artışa ve yüksek dozda fetal vücut ağırlığında azalmaya neden olmuştur. Yüksek doz, maternal toksisite ile ilişkilendirilmiştir.
Sıçanlarda embriyofetal gelişim üzerindeki advers etkiler için etkisiz dozda (100 mg/kg/gün), plazma maruziyeti (EAA) insanlarda önerilen maksimum dozdakinin yaklaşık 10 katıdır.
Organogenez boyunca gebe tavşanlara oral lasmiditan (0, 50, 75 veya 115 mg/kg/gün) uygulanması malformasyonlara (iskelet ve iç organlara), iskelet varyasyonlarında artışa ve embriyofetal ölüme ve en yüksek dozda fetal vücut ağırlığının azalmasına neden olmuştur , bu maternal toksisite ile ilişkilendirilmiştir. Tavşanlarda embriyofetal gelişim üzerindeki advers etkiler için etkisiz dozda (75 mg/kg/gün), plazma maruziyeti (EAA) insanlarda önerilen maksimum dozdakinden daha azdır.
Sıçanlara gebelik ve emzirme boyunca oral yoldan lasmiditan (0, 100, 150 veya 225 mg/kg/gün) uygulanması, test edilen en yüksek dozda ölü doğum ve yenidoğan ölümlerinde artışa neden olmuştur, bu maternal toksisite ve gecikmiş doğum ile ilişkilendirilmiştir. Doğum öncesi ve sonrası gelişim üzerindeki olumsuz etkiler için etkisiz dozda (150 mg/kg/gün) plazma
maruziyeti (EAA), insanlarda önerilen maksimum dozdakinin yaklaşık 16 katıdır.
Laktasyon dönemi
Lasmiditanın insan sütüyle atılıp atılmadıgı bilinmemektedir Hayvanlar üzerinde yapılan çalısmalar, lasmiditanın sütle atıldıgını göstermektedir. Emzirmenin durdurulup durdurulmayacagına ya da BIMIERE tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına iliskin karar verilirken, emzirmenin çocuk açısından faydası ve BIMIERE tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Lasmiditanın anne sütünde bulunması, lasmiditanın emzirilen bebeğe etkileri veya lasmiditanın süt üretimi üzerindeki etkileriyle ilgili veri bulunmamaktadır. Oral lasmiditan uygulamasından sonra, emziren sıçanlarda lasmiditanın ve/veya metabolitlerin maternal plazmaya kıyasla süte yaklaşık 3 kat düzeyde geçtiği gözlenmiştir.
Anne sütü vermenin gelişimsel ve sağlıkla ilgili yararları annenin BIMIERE ile ilgili klinik ihtiyacı ile birlikte değerlendirilmeli, ayrıca BIMIERE'nin ve altta yatan maternal hastalığın anne sütü alan bebekteki her türlü potansiyel advers etkileri dikkate alınmalıdır.
Üreme yeteneği /Fertilite
Lasmiditanın insanlarda fertilite üzerindeki etkisi bilinmemektedir. Sıçanlarla yapılan çalışmalarda erkek veya dişi fertilitesi üzerine etkisi görülmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
BIMIERE araç kullanma yetisi üzerinde belirgin olumsuz etkilere neden olabilir. Araç kullanımıyla ilgili bir çalışmada 50 mg, 100 mg ya da 200 mg tek doz BIMIERE uygulanması hastaların sürüş yeteneklerini anlamlı biçimde bozmuştur (bkz. Bölüm 5.1). Buna ilaveten tek doz BIMIERE'nin ardından 8 saat sonra plaseboya kıyasla daha fazla uyku hali raporlanmıştır. Hastalara her BIMIERE dozundan en az 8 saat sonrasına kadar motorlu araç ya da makine kullanmak gibi tam zihinsel uyanıklık gerektiren tehlike potansiyeline sahip aktivitelere girişmemeleri tavsiye edilmelidir. Bu tavsiyeye uyamayacak hastalar BIMIERE kullanmamalıdır. Reçete yazanlar ve hastalar, hastaların kendi araç kullanma kabiliyetlerini ve BIMIERE'nin neden olduğu bozukluk derecesini değerlendiremeyebileceğinin bilincinde olmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
BIMIERE'nin güvenliliği en az bir doz BIMIERE alan 4,878 hastada değerlendirilmiştir. Migrenli yetişkin hastaların yer aldığı iki plasebo kontrollü Faz 3 çalışmada (Çalışma 1 ve 2), toplam 3,177 hasta 50, 100 ya da 200 mg BIMIERE almıştır (bkz. Bölüm 5.1). Bu iki çalışmada BIMIERE ile tedavi edilen hastaların yaklaşık %84'ü kadın, %78'i beyaz ırk, %18'i siyahi ve
%18'i Hispanik ya da Latin kökenlidir. Gönüllülerin çalışmaya dahil edilmesi aşamasında ortalama yaş 42,4 (aralık: 18 ila 81) olarak saptanmıştır.
Uzun dönem güvenlilik çalışmasında, 12 aya kadar aralıklı dozlama yapılan 2.030 hastada uzun dönem güvenlilik değerlendirilmiştir. Bunlar arasında 728 hasta en az 3 ay boyunca 100 mg ya da 200 mg'a maruz bırakılmış, 361 hasta bu dozlara en az 6 ay boyunca maruz bırakılmış ve
180 hasta bu dozlara en az 12 ay boyunca maruz bırakılmış olup, tümünde ayda ortalama 2 migren atağı tedavi edilmiştir. Bu çalışmada advers olay nedeniyle 200 mg doz grubunun %14'ü (1.039 kişiden 148'i) ve 100 mg doz grubunun %11'i (991 kişiden 112'si) çalışmadan çekilmiştir. Uzun dönem güvenlilik çalışmasında tedaviyi bırakmayla sonuçlanan en yaygın advers olay (%2'den fazla) sersemlik hali olarak kaydedilmiştir.
Tablo 1'de, Çalışma 1 ve 2'de BIMIERE tedavisi gören hastaların en az %2'sinde ve plasebo alan hastalardan daha sık olarak meydana gelen advers reaksiyonlar gösterilmektedir. En yaygın advers reaksiyonlar (en az %5) sersemlik hali, yorgunluk, parestezi ve sedasyon olmuştur.
Tablo 1: Çalışma 1 ve 2'de ≥%2 Oranında ve Plaseboya Kıyasla Daha Yüksek Sıklıkta Gelişen Advers Reaksiyonlar
Advers Reaksiyon |
BIMIERE 50 mg |
BIMIERE 100 mg |
BIMIERE 200 mg |
Plasebo |
N=654 | N=1265 | N=1258 | N=1262 | |
% | % | % | % | |
Sersemlik hali | 9 | 15 | 17 | 3 |
Yorgunluk | 4 | 5 | 6 | 1 |
Parestezi | 3 | 7 | 9 | 2 |
Sedasyon | 6 | 6 | 7 | 2 |
Bulantı ve/veya kusma | 3 | 4 | 4 | 2 |
Kas Güçsüzlüğü | 1 | 1 | 2 | 0 |
Daha Az Yaygın Advers Reaksiyonlar
Aşağıdaki advers reaksiyonlar BIMIERE ile tedavi edilen hastaların %2'sinden azında fakat plasebo alan hastalara kıyasla daha yüksek sıklıkta meydana gelmiştir: vertigo, koordinasyonsuzluk, letarji, görme bozukluğu, kendini tuhaf hissetme, sıcak hissetme veya soğuk hissetme, çarpıntı, anksiyete, titreme, huzursuzluk, uyku bozukluğu ve anormal rüyalar gibi uyku anormallikleri, kas spazmı, uzuv rahatsızlığı, bilişsel değişiklikler, konfüzyon, öfori hali, göğüste rahatsızlık hissi, konuşma anormallikleri, dispne ve halüsinasyonlar.
Aşırı duyarlılık
BIMIERE tedavisi gören hastalarda anjiyoödem, döküntü ve fotosensitivite reaksiyonu gibi aşırı duyarlılık olayları gerçekleşmiştir. Kontrollü çalışmalarda BIMIERE tedavisi gören hastaların %0,2'sinde aşırı duyarlılık raporlanırken plasebo alan hastalarda aşırı duyarlılık görülmemiştir. Ciddi ya da şiddetli bir aşırı duyarlılık reaksiyonu meydana geldiği takdirde uygun tedavi başlatılmalı ve BIMIERE uygulaması kesilmelidir.
Yaşamsal Belirti Değişiklikleri
Kalp Atım Hızında Düşüş
BIMIERE kalp atım hızında 5 ila 10 dakika başı atım (bpm) ortalama azalmayla ilişkili bulunurken, plasebo 2 ila 5 bpm ortalama azalmayla ilişkilendirilmiştir. Kalp atım hızını düşüren başka ilaçlar alan hastalar dahil olmak üzere, bu değişikliklerin tolere edilemeyeceği hastalara BIMIERE verildikten sonraki kalp atım hızının değerlendirilmesi düşünülmelidir (bkz. Bölüm 4.5).
Kan Basıncının Yükselmesi
BIMIERE, tek doz ardından kan basıncını artırabilir. Yaşlı olmayan sağlıklı gönüllülerde, 200 mg BIMIERE uygulandıktan bir saat sonra ambulatuvar sistolik ve diyastolik kan basıncında başlangıca göre yaklaşık 2 ila 3 mmHg ortalama artış saptanırken, plasebo ile ortalama 1 mmHg artış görülmüştür. Sağlıklı ve 65 yaş üstü gönüllülerde, 200 mg BIMIERE uygulandıktan bir saat sonra ambulatuvar sistolik kan basıncında başlangıca göre 7 mmHg ortalama artış saptanırken, plasebo ile ortalama 4 mmHg artış kaydedilmiştir. İki saat sonunda, BIMIERE uygulaması için ortalama kan basıncı bakımından plaseboya kıyasla artış görülmemiştir. BIMIERE iskemik kalp hastalığı olan hastalarda yeterli düzeyde araştırılmamıştır. Bu değişikliklerin tolere edilemeyeceği hastalarda BIMIERE uygulamasından sonra kan basıncının değerlendirilmesi düşünülmelidir.
Advers reaksiyonların tablo halinde listesi
Aşağıdaki tablolarda, advers reaksiyonların sıklığı ve şiddeti MedDRA vücut sistem organ sınıfı, sıklık ve şiddet derecesine göre listelenmiştir. Sıklık dereceleri: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila
<1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her sıklık grubunda, advers reaksiyonlar azalan sıklıkta sunulmaktadır.
Bağışıklık sistemi hastalıkları Yaygın olmayan: Hipersensitivite* Psikiyatrik hastalıklar
Yaygın: Uyku bozuklukları
Yaygın olmayan: Öforik hal, huzursuzluk, anksiyete, halüsinasyonlar, konfüzyon
Sinir sistemi hastalıkları
Çok yaygın: Sersemlik hali
Yaygın: Parestezi, somnolans, hipoestezi, koordinasyonsuzluk, letarji, sedasyonYaygın olmayan: Tremor, konuşma bozuklukları, bilişsel değişiklikler
Seyrek: Serotonin sendromu
Göz Hastalıkları
Yaygın: Görme bozukluğu
Kulak ve iç kulak hastalıkları
Yaygın: Vertigo Kardiyak hastalıklar Yaygın: Palpitasyonlar
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: Dispne Gastrointestinal hastalıklar Yaygın: Bulantı, kusma
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Kas güçsüzlüğü
Yaygın olmayan: Kas spazmı,ekstremitelerde rahatsızlık
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Yorgunluk, anormal hissetme
Yaygın olmayan: Göğüste rahatsızlık, sıcak veya soğuk hissetme
![]()
* Döküntü ve anjiyoödem gibi olaylar bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlanma yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Aşırı dozda lasmiditan ile ilgili sınırlı klinik deney deneyim mevcuttur. Aşırı doz durumunda, hastayı advers reaksiyon belirtileri veya semptomları açısından izleyiniz ve uygun şekildedestekleyici semptomatik tedavi uygulayınız. Aşırı dozda lasmiditan için bilinen bir antidot yoktur.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif serotonin (5HT1) agonistleri ATC kodu: N02CC08
Etki mekanizması
Lasmiditan 5-HT 1F reseptörüne yüksek afinite ile bağlanır. Lasmiditan migren tedavisindeki
terapötik etkilerini tahminen 5-HT1F reseptöründeki agonist etkiler yoluyla göstermektedir; ancak kesin mekanizması bilinmemektedir.
Farmakodinamik etkiler
Kardiyak Elektrofizyoloji
Önerilen maksimum günlük dozun iki katı dozdaki BIMIERE, QTc aralığını klinik açıdan anlamlı derecede uzatmaz.
Klinik etkililik ve güvenlilik
Migren
BIMIERE'nin akut migren tedavisindeki etkililiği iki randomize, çift kör, plasebo kontrollü çalışmada [Çalışma 1 (NCT02439320) ve Çalışma 2 (NCT02605174)] gösterilmiştir. Bu çalışmalara, Uluslararası Baş Ağrısı Bozukluklarının Sınıflandırılması (ICHD-II) tanı kriterlerine göre auralı ve aurasız migren öyküsüne sahip hastalar kaydedilmiştir. Hastalar ağırlıklı olarak kadın (%84) ve beyaz (%78) olup, yaş ortalaması 42'dir (18-81 aralığında). Hastaların yüzde yirmi ikisinin başlangıçta migren için önleyici ilaç almakta olduğu kaydedilmiştir. Çalışma 1 hastaları BIMIERE 100 mg (n=744) veya 200 mg (n=745) ya da plasebo (n=742) için randomize etmiş ve Çalışma 2 hastaları BIMIERE 50 mg (n=750), 100 mg (n=754) veya 200 mg (n=750) ya da plasebo (n=751) için randomize etmiştir. Hastaların çalışma ilacını aldıktan 2 saat sonra kurtarma ilacı almalarına izin verilmiştir; ancak çalışma ilacının uygulanmasından itibaren 24 saat süreyle opioidlere, barbitüratlara, triptanlara ve ergotlara izin verilmemiştir.
Primer etkililik analizleri, atağın başlamasından itibaren 4 saat içinde orta ila şiddetli ağrılı migrenin tedavi edildiği hastalarla yürütülmüştür. BIMIERE'nin plaseboya kıyasla etkililiği, Çalışma 1 ve 2'de 2. saatte ağrının giderilmesi ve 2. saatte En Can Sıkıcı Semptomun (MBS) ortadan kalkması üzerindeki etkisiyle saptanmıştır. Ağrının giderilmesi orta ya da şiddetli baş ağrısının ağrısızlığa düşürülmesi ve MBS'nin ortadan kalkması hastanın belirlediği MBS'nin (fotofobi, fonofobi ya da bulantı) yokluğu olarak tanımlanmıştır.
Bir MBS seçen hastalar arasında en fazla seçilen MBS fotofobi (%54) olup, bunu bulantı (%24) ve fonofobi (%22) izlemiştir.
Her iki çalışmada, tedaviden 2 saat sonra ağrının giderildiği ve MBS'nin ortadan kalktığı hasta yüzdesi, tüm dozlarda BIMIERE alan hastalar arasında plasebo alanlara kıyasla anlamlı ölçüde yüksek bulunmuştur (bkz. Tablo 2).
Tablo 2: Çalışma 1 ve 2'de Tedavi Sonrası Migren Etkililik Sonlanım Noktaları
| Çalışma 1 | Çalışma 2 | |||||
BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | BIMIERE 50 mg | BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | |
2 saatte ağrısızlık | |||||||
N | 498 | 503 | 515 | 544 | 523 | 521 | 534 |
Yanıt veren % | 28.3 | 31.8 | 15.3 | 28.3 | 31.4 | 38.8 | 21.0 |
Plasebo ile fark (%) | 13 | 16.5 |
| 7.3 | 10.4 | 17.8 |
|
p-değeri | <0.001 | <0.001 |
| 0.006 | <0.001 | <0.001 |
|
2 saatte MBS'sizlik | |||||||
N | 464 | 467 | 480 | 502 | 491 | 478 | 509 |
Yanıt veren % | 41.2 | 40.7 | 29.6 | 40.8 | 44.0 | 48.7 | 33.2 |
Plasebo ile fark (%) | 11.6 | 11.1 |
| 7.6 | 10.8 | 15.5 |
|
p-değeri | <0.001 | <0.001 |
| 0.014 | <0.001 | <0.001 |
|
Migren ağrısının orta ya da şiddetli ağrıdan hafif ağrıya düşürülmesi ya da ortadan kaldırılması olarak tanımlanan, ağrının 2 saatte giderilmesi de değerlendirilmiştir (bkz. Tablo 3).
Tablo 3: Çalışma 1 ve 2'de Tedavi Sonrası İlave Migren Etkililik Sonlanım Noktası
| Çalışma 1 | Çalışma 2 | |||||
BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | BIMIERE 50 mg | BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | |
2 saatte ağrıyı giderme | |||||||
N | 498 | 503 | 515 | 544 | 523 | 521 | 534 |
Yanıt veren % | 54.0 | 55.3 | 40.0 | 55.9 | 61.4 | 61.0 | 45.1 |
Plasebo ile fark (%) | 14.0 | 15.3 |
| 10.8 | 16.3 | 15.9 |
|
Şekil 1, Çalışma 1 ve 2'deki tedaviden sonraki 2 saat içinde migren ağrısının ortadan kalktığı hastaların yüzde oranını göstermektedir.
Şekil 1: Birleştirilmiş Çalışmalar 1 ve 2'de Tedaviden Sonraki 2 Saat içinde Migren Ağrısının Ortadan Kalktığı Hastaların Yüzde Oranı
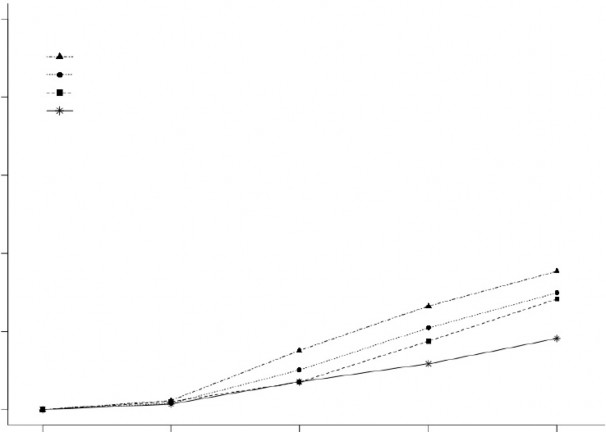
BIMIERE 200 mg
BIMIERE 100 mg
BIMIERE 50 mg
Plasebo
%100
Migren Ağrısının Ortadan Kalktığı Yüzde Oran
%80
%60
%40
%20
%0
0 0.5 saat 1 saat 1.5 saat 2 saat
Dozdan itibaren geçen süre, saat
Şekil 2, Çalışma 1 ve 2'deki 2 saat içinde MBS'nin ortadan kalktığı hastaların yüzde oranını göstermektedir.
Şekil 2: Birleştirilmiş Çalışmalar 1 ve 2'deki 2 saat içinde MBS'nin Ortadan Kalktığı Hastaların Yüzde Oranı
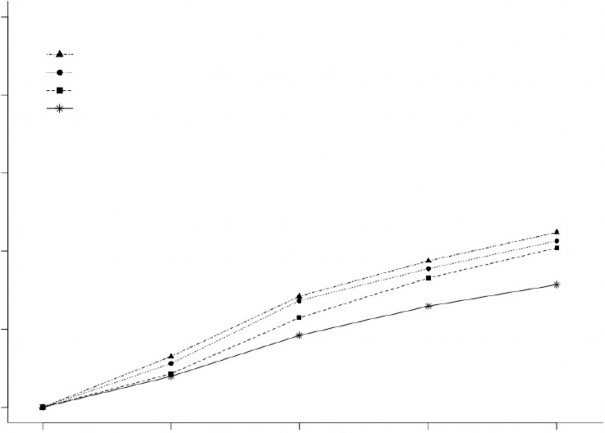
BIMIERE 200 mg
BIMIERE 100 mg
BIMIERE 50 mg
Plasebo
%100
MBS' nin Ortadan Kalktığı Yüzde Oran
%80
%60
%40
%20
%0
0 0.5 saat 1 saat 1.5 saat 2 saat
Dozdan itibaren geçen süre, saat
Araç Kullanma Üzerindeki Etkiler
Sağlıklı 90 gönüllü (ortalama yaş 34,9) ile yürütülen randomize, çift kör, plasebo ve aktif kontrollü, beş dönemlik çapraz geçişli bir çalışmada BIMIERE 50 mg, 100 mg, 200 mg, alprazolam 1 mg ve plasebo uygulandıktan 90 dakika sonra araç kullanma performansı bilgisayar tabanlı bir simülasyon ile değerlendirilmiştir. Araç kullanma performansı, kanda
%0.05 alkol konsantrasyonuna sahip bir popülasyonda saptanan valide edilmiş bir eşiğe göre değerlendirilmiştir. Primer sonuç ölçütü, bir araç kullanma performansı ölçütü olan Lateral Pozisyondan Standart Sapma (SDLP) ölçütünde plaseboya kıyasla kaydedilen farktır. Bilgisayar tabanlı simüle araç kullanma performansında doza bağlı bozukluk, uygulamadan 90 dakika sonra tüm BIMIERE dozlarında görülmüştür.
Sağlıklı 67 gönüllü (ortalama yaş 32.8) ile yürütülen ayrı bir randomize, çift kör, plasebo ve aktif kontrollü, dört dönemlik çapraz geçişli çalışmada da BIMIERE 100 mg ya da 200 mg uygulanmasından 8, 12 ve 24 saat sonra primer sonlanım noktası olarak SDLP kullanılıp
bilgisayar tabanlı simüle araç kullanma performansı ölçülerek araç kullanma performansı değerlendirilmiştir.
Pozitif kontrol olarak difenhidramin 50 mg kullanılmıştır. BIMIERE 100 ya da 200 mg uygulandıktan sonraki 8. saat ve sonrasında ortalama SDLP araç kullanmanın bozulması eşiğine ulaşmamıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Oral uygulamanın ardından lasmiditan medyan Tmaks 1,8 saat olmak üzere hızla emilir. Migren hastalarında lasmiditanın emilimi ya da farmakokinetik özellikleri, migren atağı sırasında ve interiktal süre sırasında farklı değildir.
Yiyecek Etkisi
Lasmiditanın yüksek yağlı bir yemekle beraber alınması ortalama lasmiditan Cmaks ve EAA değerlerini sırasıyla %22 ve %19 artırmış ve medyan tmaks değerini 1 saat geciktirmiştir. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir (bkz. Bölüm 4.2). Lasmiditan klinik etkililik çalışmalarında yiyecek göz önüne bulundurulmaksızın uygulanmıştır.
Dağılım
Lasmiditanın insan plazma proteinlerine bağlanma oranı yaklaşık %55 ila %60'tır ve 15 ile 500 ng/mL arasında konsantrasyondan bağımsızdır.
Biyotransformasyon
Lasmiditan primer olarak CYP dışı enzimler tarafından hepatik ve ekstrahepatik olarak metabolize edilir.
Lasmiditanın metabolizmasına aşağıdaki enzimler dahil değildir: MAO-A, MAO-B, flavin monooksigenaz 3, CYP450 redüktaz, ksantin oksidaz, alkol dehidrogenaz, aldehid dehidrogenaz ve aldo-keto redüktazlar. Lasmiditan ayrıca M7 (piperidin halkada oksidasyon) ve M18'e (M7 ve M8 yolaklarının kombinasyonu) metabolize edilir. Bu metabolitler farmakolojik olarak inaktif kabul edilir.
Eliminasyon
Lasmiditan yaklaşık 5.7 saatlik geometrik ortalama t1/2 değeri ile elimine edilmiştir. Günlük dozlamada lasmiditan birikimi gözlenmemiştir. Lasmiditan primer olarak metabolizma yoluyla, majör yolağı temsil eden keton azaltımı ile elimine edilir. Renal atılım, lasmiditan klirensinin minör bir yoludur.
Atılım
Değişmemiş lasmiditanın idrarda geri kazanım oranı düşüktür ve dozun yaklaşık %3'üne karşılık gelir. S-M8 metaboliti idrardaki dozun yaklaşık %66'sını temsil etmekte olup, geri kazanımın büyük kısmı doz sonrası 48 saat içinde kaydedilir.
Doğrusallık/doğrusal olmayan durum:
50 ila 200 mg klinik doz aralığının üzerinde, lasmiditan maruziyeti yaklaşık olarak doğrusal olacak şekilde doza bağlı olarak artmıştır.
İlaç Etkileşimi Çalışmaları
Lasmiditanın Diğer İlaçları Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan CYP2D6'nın in-vitro bir inhibitörüdür ancak diğer CYP450 enzimlerinin aktivitesini anlamlı ölçüde inhibe etmemiştir. Lasmiditanın bilinen duyarlı bir CYP2D6 substratı olan dekstrometorfan üzerindeki etkisinin modeli ve simülasyonu, lasmiditanın CYP2D6'yı klinik açıdan anlamlı derecede inhibe etmesinin olası olmadığını göstermektedir. Lasmiditan, M7, S-M8 ve [S,R]-M18; monoamin oksidaz A'nın (MAO-A) geri dönüşümlü ve zamana bağlı inhibitörleri değildir.
Günlük lasmiditan dozlaması sırasıyla CYP3A, CYP1A2 ve CYP2C9 substratları olan midazolam, kafein ya da tolbütamidin FK'sini değiştirmemiştir. Lasmiditanın sumatriptan, propranolol ya da topiramat ile beraber uygulanması, bu tıbbi ürünlerin maruziyetinde klinik olarak anlamlı değişikliklerle sonuçlanmamıştır.
İlaç Taşıyıcıları
Sağlıklı gönüllülerde yapılan bir ilaç etkileşimi çalışmasında, 200 mg BIMIERE'nin dabigatran (P-gp substratı) ile birlikte uygulanması dabigatranın sistemik maruziyetlerini, EAA ve C değerlerini sırasıyla %25 ve %22 arttırmıştır (bkz. Bölüm 4.5). Rosuvastatin (BCRP substratı) ile birlikte 200 mg BIMIERE'nin uygulanması, rosuvastatin maruziyetini etkilememiştir.
Lasmiditan OCT1'i in-vitro inhibe eder. Ancak lasmiditan ve sumatriptan (OCT1 substratı) ile ilgili bir ilaç-ilaç etkileşimi çalışmasında, sumatriptan FK'sinde değişiklik gözlenmemiştir. Lasmiditan renal akış taşıyıcıları MATE1 ve MATE2-K'yı in-vitro inhibe eder.
Diğer İlaçların Lasmiditanı Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan primer olarak CYP dışı enzimler tarafından hepatik ve ekstrahepatik olarak metabolize edilir. Dolayısıyla CYP inhibitörlerinin ya da indükleyicilerinin lasmiditanın farmakokinetik özelliklerini etkileme olasılığı düşüktür. Lasmiditanın sumatriptan, propranolol ya da topiramat ile birlikte değerlendirildiği klinik çalışmalarda anlamlı bir ilaç etkileşimi potansiyeli görülmemiştir.
İlaç Taşıyıcıları
Lasmiditan, P-gp'nin in-vitro bir substratıdır.
Hastalardaki karekteristik özellikler
Özel popülasyonlar:
Yaş, Cinsiyet, Irk/Etnik Köken ve Vücut Ağırlığı
Popülasyon farmakokinetiği (FK) analizine göre yaş, cinsiyet, ırk/etnik köken ve vücut ağırlığının lasmiditan FK'si (Cmaks ve EAA) üzerinde anlamlı bir etkisi yoktur. Dolayısıyla yaş, cinsiyet, ırk/etnik köken ve vücut ağırlığına dayalı doz ayarlamaları gerekli değildir.
Geriyatrik Kullanım
Bir klinik farmakoloji çalışmasında, lasmiditanın 65 yaş ve üzeri hastalara uygulanması 45 yaş ve altı hastalara kıyasla EAA(0-â) değerimde %26 daha fazla maruziyet ve %21 daha yüksek Cmaks ile sonuçlanmıştır. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir.
Böbrek Yetmezliği
Bir klinik farmakoloji çalışmasında, lasmiditanın şiddetli böbrek yetmezliği bulunan hastalara uygulanması (eGFR<30 mL/dak/1.73 m2) normal böbrek fonksiyonuna sahip hastalara kıyasla EAA(0-â) değerinde %18 daha fazla maruziyet ve %13 daha yüksek Cmaks ile sonuçlanmıştır. Böbrek fonksiyonuna dayalı doz ayarlaması gerekli değildir.
Karaciğer Yetmezliği
Bir klinik farmakoloji çalışmasında, hafif ve orta karaciğer yetmezliği bulunan hastalar (sırasıyla Child-Pugh A ve B sınıfı) normal karaciğer fonksiyonuna sahip hastalara kıyasla lasmiditana sırasıyla %11 ve %35 daha yüksek maruziyet [EAA(0-â)] sergilemiştir.
Cmaks değerinin hafif ve orta karaciğer yetmezliği bulunan hastalarda sırasıyla %19 ve %33 daha yüksek olduğu görülmüştür. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir. Şiddetli karaciğer yetmezliği bulunan hastalarda lasmiditanın kullanımı araştırılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Karsinogenez
Lasmiditanın TgRasH2 farelerine 26 hafta boyunca 150 (erkek) ya da 250 (dişi) mg/kg/gün dozlarına kadar ya da sıçanlara 2 yıl boyunca 75 mg/kg/gün dozuna kadar oral yoldan uygulanmasının ardından ilaçla ilgili tümörler gözlenmemiştir.
Sıçanlarda test edilen en yüksek dozlardaki plazma maruziyetleri (EAA), insanlar için önerilen maksimum doz (MRHD) olan 200 mg/gün için, insanlardaki maruziyetin yaklaşık 15 katı olarak kaydedilmiştir.
Mutagenez
Lasmiditan in vitro (bakteriyel ters mutasyon testi, memeli hücrelerinde kromozomal aberasyon testi) ve in vivo (fare kemik iliği mikronükleus testi) deneylerde negatif sonuç vermiştir.
Fertilitenin Bozulması
Lasmiditanın erkek (0, 100, 175 ya da 200 mg/kg/gün) ya da dişi (0, 100, 150 ya da 200
mg/kg/gün) sıçanlara çiftleşme öncesi ve sırasında oral yoldan uygulanması ve dişilerde gebeliğin 7. gününe kadar devam edilmesi fertilite ya da üreme performansında advers etki oluşturmamıştır.
Test edilen en yüksek dozdaki (200 mg/kg/gün) plazma maruziyetleri (EAA) MRHD'de insanlarınki maruziyetin yaklaşık 26 katı olarak saptanmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Çekirdek tablet â granül içi bileşenler:
Kroskarmeloz sodyum Magnezyum stearat Mikrokristalin selüloz Prejelatinize nişasta Sodyum lauril sülfat
Çekirdek tablet â granül dışı bileşenler:
Kroskarmeloz sodyum Magnezyum stearat Film kaplama:
Renk karışımı, mor 85F100069:
Siyah demir oksit Polietilen glikol Polivinil alkol Talk
Titanyum dioksit Demir oksit kırmızı
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Alüminyum folyo ile kapatılmış PCTFE/PVC blisterlerde veya alüminyum folyo ile kapatılmış
PVC bilisterlerde, 2, 4, 6, 12 veya 16 film kaplı tablet içeren ambalajlarda. Tüm ambalaj boyutlarında pazarlanmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Satış Fiyatı | 524.54 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 524.54 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699673098715 |
| Etkin Madde | Lasmiditan |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |