BIMIERE 50 mg film kaplı tablet (2 tablet) Farmakolojik Özellikler
{ Lasmiditan }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif serotonin (5HT1) agonistleri ATC kodu: N02CC08
Etki mekanizması
Lasmiditan 5-HT 1F reseptörüne yüksek afinite ile bağlanır. Lasmiditan migren tedavisindeki terapötik etkilerini tahminen 5-HT1F reseptöründeki agonist etkiler yoluyla göstermektedir; ancak kesin mekanizması bilinmemektedir.
Farmakodinamik etkiler
Kardiyak Elektrofizyoloji
Önerilen maksimum günlük dozun iki katı dozdaki BIMIERE, QTc aralığını klinik açıdan anlamlı derecede uzatmaz.
Klinik etkililik ve güvenlilik
Migren
BIMIERE'nin akut migren tedavisindeki etkililiği iki randomize, çift kör, plasebo kontrollü çalışmada [Çalışma 1 (NCT02439320) ve Çalışma 2 (NCT02605174)] gösterilmiştir. Bu çalışmalara, Uluslararası Baş Ağrısı Bozukluklarının Sınıflandırılması (ICHD-II) tanı kriterlerine göre auralı ve aurasız migren öyküsüne sahip hastalar kaydedilmiştir. Hastalar ağırlıklı olarak kadın (%84) ve beyaz (%78) olup, yaş ortalaması 42'dir (18-81 aralığında). Hastaların yüzde yirmi ikisinin başlangıçta migren için önleyici ilaç almakta olduğu kaydedilmiştir. Çalışma 1 hastaları BIMIERE 100 mg (n=744) veya 200 mg (n=745) ya da plasebo (n=742) için randomize etmiş ve Çalışma 2 hastaları BIMIERE 50 mg (n=750), 100 mg (n=754) veya 200 mg (n=750) ya da plasebo (n=751) için randomize etmiştir. Hastaların çalışma ilacını aldıktan 2 saat sonra kurtarma ilacı almalarına izin verilmiştir; ancak çalışma ilacının uygulanmasından itibaren 24 saat süreyle opioidlere, barbitüratlara, triptanlara ve ergotlara izin verilmemiştir.
Primer etkililik analizleri, atağın başlamasından itibaren 4 saat içinde orta ila şiddetli ağrılı migrenin tedavi edildiği hastalarla yürütülmüştür. BIMIERE'nin plaseboya kıyasla etkililiği, Çalışma 1 ve 2'de 2. saatte ağrının giderilmesi ve 2. saatte En Can Sıkıcı Semptomun (MBS) ortadan kalkması üzerindeki etkisiyle saptanmıştır. Ağrının giderilmesi orta ya da şiddetli baş ağrısının ağrısızlığa düşürülmesi ve MBS'nin ortadan kalkması hastanın belirlediği MBS'nin (fotofobi, fonofobi ya da bulantı) yokluğu olarak tanımlanmıştır. Bir MBS seçen hastalar arasında en fazla seçilen MBS fotofobi (%54) olup, bunu bulantı (%24) ve fonofobi (%22) izlemiştir.
Her iki çalışmada, tedaviden 2 saat sonra ağrının giderildiği ve MBS'nin ortadan kalktığı hasta yüzdesi, tüm dozlarda BIMIERE alan hastalar arasında plasebo alanlara kıyasla anlamlı ölçüde yüksek bulunmuştur (bkz. Tablo 2).
Tablo 2: Çalışma 1 ve 2'de Tedavi Sonrası Migren Etkililik Sonlanım Noktaları
| Çalışma 1 | Çalışma 2 | |||||
BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | BIMIERE 50 mg | BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | |
2 saatte ağrısızlık | |||||||
N | 498 | 503 | 515 | 544 | 523 | 521 | 534 |
Yanıt veren % | 28.3 | 31.8 | 15.3 | 28.3 | 31.4 | 38.8 | 21.0 |
Plasebo ile fark (%) | 13 | 16.5 |
| 7.3 | 10.4 | 17.8 |
|
p-değeri | <0.001 | <0.001 |
| 0.006 | <0.001 | <0.001 |
|
2 saatte MBS'sizlik | |||||||
N | 464 | 467 | 480 | 502 | 491 | 478 | 509 |
Yanıt veren % | 41.2 | 40.7 | 29.6 | 40.8 | 44.0 | 48.7 | 33.2 |
Plasebo ile fark (%) | 11.6 | 11.1 |
| 7.6 | 10.8 | 15.5 |
|
p-değeri | <0.001 | <0.001 |
| 0.014 | <0.001 | <0.001 |
|
Migren ağrısının orta ya da şiddetli ağrıdan hafif ağrıya düşürülmesi ya da ortadan kaldırılması olarak tanımlanan, ağrının 2 saatte giderilmesi de değerlendirilmiştir (bkz. Tablo 3).
Tablo 3: Çalışma 1 ve 2'de Tedavi Sonrası İlave Migren Etkililik Sonlanım Noktası
| Çalışma 1 | Çalışma 2 | |||||
BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | BIMIERE 50 mg | BIMIERE 100 mg | BIMIERE 200 mg | Plasebo | |
2 saatte ağrıyı giderme | |||||||
N | 498 | 503 | 515 | 544 | 523 | 521 | 534 |
Yanıt veren % | 54.0 | 55.3 | 40.0 | 55.9 | 61.4 | 61.0 | 45.1 |
Plasebo ile fark (%) | 14.0 | 15.3 |
| 10.8 | 16.3 | 15.9 |
|
Şekil 1, Çalışma 1 ve 2'deki tedaviden sonraki 2 saat içinde migren ağrısının ortadan kalktığı hastaların yüzde oranını göstermektedir.
Şekil 1: Birleştirilmiş Çalışmalar 1 ve 2'de Tedaviden Sonraki 2 Saat içinde Migren Ağrısının Ortadan Kalktığı Hastaların Yüzde Oranı
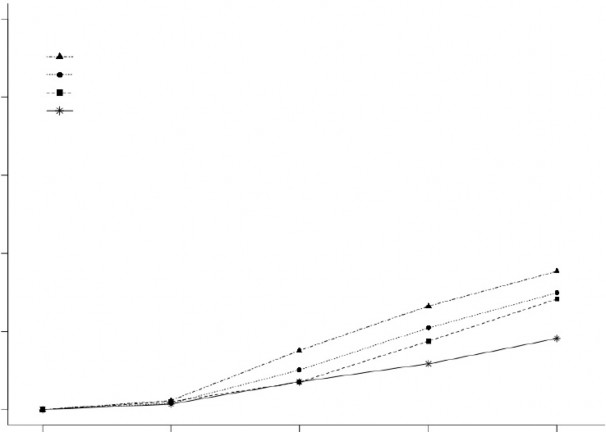
BIMIERE 200 mg
BIMIERE 100 mg
BIMIERE 50 mg
Plasebo
%100
Migren Ağrısının Ortadan Kalktığı Yüzde Oran
%80
%60
%40
%20
%0
0 0.5 saat 1 saat 1.5 saat 2 saat
Dozdan itibaren geçen süre, saat
Şekil 2, Çalışma 1 ve 2'deki 2 saat içinde MBS'nin ortadan kalktığı hastaların yüzde oranını göstermektedir.
Şekil 2: Birleştirilmiş Çalışmalar 1 ve 2'deki 2 saat içinde MBS'nin Ortadan Kalktığı Hastaların Yüzde Oranı
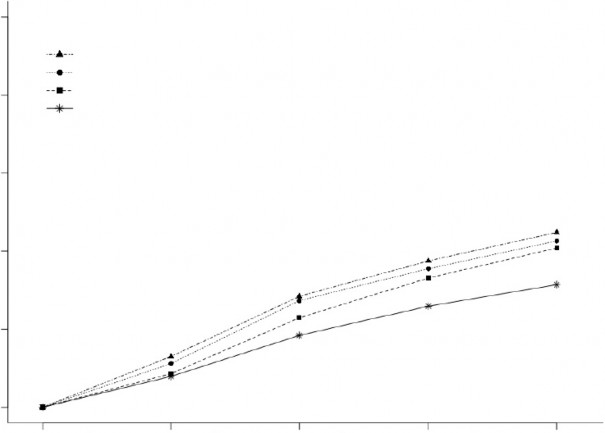
BIMIERE 200 mg
BIMIERE 100 mg
BIMIERE 50 mg
Plasebo
%100
MBS' nin Ortadan Kalktığı Yüzde Oran
%80
%60
%40
%20
%0
0 0.5 saat 1 saat 1.5 saat 2 saat
Dozdan itibaren geçen süre, saat
Araç Kullanma Üzerindeki Etkiler
Sağlıklı 90 gönüllü (ortalama yaş 34,9) ile yürütülen randomize, çift kör, plasebo ve aktif kontrollü, beş dönemlik çapraz geçişli bir çalışmada BIMIERE 50 mg, 100 mg, 200 mg, alprazolam 1 mg ve plasebo uygulandıktan 90 dakika sonra araç kullanma performansı bilgisayar tabanlı bir simülasyon ile değerlendirilmiştir. Araç kullanma performansı, kanda
%0.05 alkol konsantrasyonuna sahip bir popülasyonda saptanan valide edilmiş bir eşiğe göre değerlendirilmiştir. Primer sonuç ölçütü, bir araç kullanma performansı ölçütü olan Lateral Pozisyondan Standart Sapma (SDLP) ölçütünde plaseboya kıyasla kaydedilen farktır. Bilgisayar tabanlı simüle araç kullanma performansında doza bağlı bozukluk, uygulamadan 90 dakika sonra tüm BIMIERE dozlarında görülmüştür.
Sağlıklı 67 gönüllü (ortalama yaş 32.8) ile yürütülen ayrı bir randomize, çift kör, plasebo ve aktif kontrollü, dört dönemlik çapraz geçişli çalışmada da BIMIERE 100 mg ya da 200 mg uygulanmasından 8, 12 ve 24 saat sonra primer sonlanım noktası olarak SDLP kullanılıp
bilgisayar tabanlı simüle araç kullanma performansı ölçülerek araç kullanma performansı değerlendirilmiştir.
Pozitif kontrol olarak difenhidramin 50 mg kullanılmıştır. BIMIERE 100 ya da 200 mg uygulandıktan sonraki 8. saat ve sonrasında ortalama SDLP araç kullanmanın bozulması eşiğine ulaşmamıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Oral uygulamanın ardından lasmiditan medyan Tmaks 1,8 saat olmak üzere hızla emilir. Migren hastalarında lasmiditanın emilimi ya da farmakokinetik özellikleri, migren atağı sırasında ve interiktal süre sırasında farklı değildir.
Yiyecek Etkisi
Lasmiditanın yüksek yağlı bir yemekle beraber alınması ortalama lasmiditan Cmaks ve EAA değerlerini sırasıyla %22 ve %19 artırmış ve medyan tmaks değerini 1 saat geciktirmiştir. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir (bkz. Bölüm 4.2). Lasmiditan klinik etkililik çalışmalarında yiyecek göz önüne bulundurulmaksızın uygulanmıştır.
Dağılım
Lasmiditanın insan plazma proteinlerine bağlanma oranı yaklaşık %55 ila %60'tır ve 15 ile 500 ng/mL arasında konsantrasyondan bağımsızdır.
Biyotransformasyon
Lasmiditan primer olarak CYP dışı enzimler tarafından hepatik ve ekstrahepatik olarak metabolize edilir.
Lasmiditanın metabolizmasına aşağıdaki enzimler dahil değildir: MAO-A, MAO-B, flavin monooksigenaz 3, CYP450 redüktaz, ksantin oksidaz, alkol dehidrogenaz, aldehid dehidrogenaz ve aldo-keto redüktazlar. Lasmiditan ayrıca M7 (piperidin halkada oksidasyon) ve M18'e (M7 ve M8 yolaklarının kombinasyonu) metabolize edilir. Bu metabolitler farmakolojik olarak inaktif kabul edilir.
Eliminasyon
Lasmiditan yaklaşık 5.7 saatlik geometrik ortalama t1/2 değeri ile elimine edilmiştir. Günlük dozlamada lasmiditan birikimi gözlenmemiştir. Lasmiditan primer olarak metabolizma yoluyla, majör yolağı temsil eden keton azaltımı ile elimine edilir. Renal atılım, lasmiditan klirensinin minör bir yoludur.
Atılım
Değişmemiş lasmiditanın idrarda geri kazanım oranı düşüktür ve dozun yaklaşık %3'üne karşılık gelir. S-M8 metaboliti idrardaki dozun yaklaşık %66'sını temsil etmekte olup, geri kazanımın büyük kısmı doz sonrası 48 saat içinde kaydedilir.
Doğrusallık/doğrusal olmayan durum:
50 ila 200 mg klinik doz aralığının üzerinde, lasmiditan maruziyeti yaklaşık olarak doğrusal olacak şekilde doza bağlı olarak artmıştır.
İlaç Etkileşimi Çalışmaları
Lasmiditanın Diğer İlaçları Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan CYP2D6'nın in-vitro bir inhibitörüdür ancak diğer CYP450 enzimlerinin aktivitesini anlamlı ölçüde inhibe etmemiştir. Lasmiditanın bilinen duyarlı bir CYP2D6 substratı olan dekstrometorfan üzerindeki etkisinin modeli ve simülasyonu, lasmiditanın CYP2D6'yı klinik açıdan anlamlı derecede inhibe etmesinin olası olmadığını göstermektedir. Lasmiditan, M7, S-M8 ve [S,R]-M18; monoamin oksidaz A'nın (MAO-A) geri dönüşümlü ve zamana bağlı inhibitörleri değildir.
Günlük lasmiditan dozlaması sırasıyla CYP3A, CYP1A2 ve CYP2C9 substratları olan midazolam, kafein ya da tolbütamidin FK'sini değiştirmemiştir. Lasmiditanın sumatriptan, propranolol ya da topiramat ile beraber uygulanması, bu tıbbi ürünlerin maruziyetinde klinik olarak anlamlı değişikliklerle sonuçlanmamıştır.
İlaç Taşıyıcıları
Sağlıklı gönüllülerde yapılan bir ilaç etkileşimi çalışmasında, 200 mg BIMIERE'nin dabigatran (P-gp substratı) ile birlikte uygulanması dabigatranın sistemik maruziyetlerini, EAA ve Cdeğerlerini sırasıyla %25 ve %22 arttırmıştır (bkz. Bölüm 4.5). Rosuvastatin (BCRP substratı) ile birlikte 200 mg BIMIERE'nin uygulanması, rosuvastatin maruziyetini etkilememiştir.
Lasmiditan OCT1'i in-vitro inhibe eder. Ancak lasmiditan ve sumatriptan (OCT1 substratı) ile ilgili bir ilaç-ilaç etkileşimi çalışmasında, sumatriptan FK'sinde değişiklik gözlenmemiştir. Lasmiditan renal akış taşıyıcıları MATE1 ve MATE2-K'yı in-vitro inhibe eder.
Diğer İlaçların Lasmiditanı Etkileme Potansiyeli İlaç Metabolize Edici Enzimler
Lasmiditan primer olarak CYP dışı enzimler tarafından hepatik ve ekstrahepatik olarak metabolize edilir. Dolayısıyla CYP inhibitörlerinin ya da indükleyicilerinin lasmiditanın farmakokinetik özelliklerini etkileme olasılığı düşüktür. Lasmiditanın sumatriptan, propranolol ya da topiramat ile birlikte değerlendirildiği klinik çalışmalarda anlamlı bir ilaç etkileşimi potansiyeli görülmemiştir.
İlaç Taşıyıcıları
Lasmiditan, P-gp'nin in-vitro bir substratıdır.
Hastalardaki karekteristik özellikler
Özel popülasyonlar:
Yaş, Cinsiyet, Irk/Etnik Köken ve Vücut Ağırlığı
Popülasyon farmakokinetiği (FK) analizine göre yaş, cinsiyet, ırk/etnik köken ve vücut ağırlığının lasmiditan FK'si (Cmaks ve EAA) üzerinde anlamlı bir etkisi yoktur. Dolayısıyla yaş, cinsiyet, ırk/etnik köken ve vücut ağırlığına dayalı doz ayarlamaları gerekli değildir.
Geriyatrik Kullanım
Bir klinik farmakoloji çalışmasında, lasmiditanın 65 yaş ve üzeri hastalara uygulanması 45 yaş ve altı hastalara kıyasla EAA(0-âˆ) değerimde %26 daha fazla maruziyet ve %21 daha yüksek Cmaks ile sonuçlanmıştır. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir.
Böbrek Yetmezliği
Bir klinik farmakoloji çalışmasında, lasmiditanın şiddetli böbrek yetmezliği bulunan hastalara uygulanması (eGFR<30 mL/dak/1.73 m2) normal böbrek fonksiyonuna sahip hastalara kıyasla EAA(0-âˆ) değerinde %18 daha fazla maruziyet ve %13 daha yüksek Cmaks ile sonuçlanmıştır. Böbrek fonksiyonuna dayalı doz ayarlaması gerekli değildir.
Karaciğer Yetmezliği
Bir klinik farmakoloji çalışmasında, hafif ve orta karaciğer yetmezliği bulunan hastalar (sırasıyla Child-Pugh A ve B sınıfı) normal karaciğer fonksiyonuna sahip hastalara kıyasla lasmiditana sırasıyla %11 ve %35 daha yüksek maruziyet [EAA(0-âˆ)] sergilemiştir.
Cmaks değerinin hafif ve orta karaciğer yetmezliği bulunan hastalarda sırasıyla %19 ve %33 daha yüksek olduğu görülmüştür. Maruziyetteki bu farkın klinik açıdan anlamlı olması beklenmemektedir. Şiddetli karaciğer yetmezliği bulunan hastalarda lasmiditanın kullanımı araştırılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Karsinogenez
Lasmiditanın TgRasH2 farelerine 26 hafta boyunca 150 (erkek) ya da 250 (dişi) mg/kg/gün dozlarına kadar ya da sıçanlara 2 yıl boyunca 75 mg/kg/gün dozuna kadar oral yoldan uygulanmasının ardından ilaçla ilgili tümörler gözlenmemiştir.
Sıçanlarda test edilen en yüksek dozlardaki plazma maruziyetleri (EAA), insanlar için önerilen maksimum doz (MRHD) olan 200 mg/gün için, insanlardaki maruziyetin yaklaşık 15 katı olarak kaydedilmiştir.
Mutagenez
Lasmiditan in vitro (bakteriyel ters mutasyon testi, memeli hücrelerinde kromozomal aberasyon testi) ve in vivo (fare kemik iliği mikronükleus testi) deneylerde negatif sonuç vermiştir.
Fertilitenin Bozulması
Lasmiditanın erkek (0, 100, 175 ya da 200 mg/kg/gün) ya da dişi (0, 100, 150 ya da 200
mg/kg/gün) sıçanlara çiftleşme öncesi ve sırasında oral yoldan uygulanması ve dişilerde gebeliğin 7. gününe kadar devam edilmesi fertilite ya da üreme performansında advers etki oluşturmamıştır.
Test edilen en yüksek dozdaki (200 mg/kg/gün) plazma maruziyetleri (EAA) MRHD'de insanlarınki maruziyetin yaklaşık 26 katı olarak saptanmıştır.
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Satış Fiyatı | 524.54 TL [ 7 Apr 2025 ] |
| Önceki Satış Fiyatı | 524.54 TL [ 24 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699673098661 |
| Etkin Madde | Lasmiditan |
| ATC Kodu | N02CC08 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 2 |
| Sinir Sistemi > Migren İlaçları |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |