BINITOL 25 mg film kaplı tablet (30 tablet) Farmakolojik Özellikler
{ Erlotinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ilaç, protein kinaz inhibitörü ATC kodu: L01EB02
Etki mekanizması:
Erlotinib epidermal büyüme faktör reseptörü/insan epidermal büyüme faktör tip 1 reseptörünün (EGFR, aynı zamanda HER1 olarak bilinen) inhibitörüdür. EGFR'nin intrasellüler fosforilizasyonunu etkili bir şekilde inhibe eder. EGFR/HER1 reseptörü normal hücre ve kanser hücrelerinin hücre yüzeylerinde eksprese edilir. Klinik dışı modellerde, EGFR fosfotirozininin inhibisyonu hücre stazı ve/veya ölümü ile sonlanmaktadır.
EGFR mutasyonları antiapopitotik ve proliferatif sinyal yollarında konstitütif aktivasyona yol açabilir. Erlotinibin bu EGFR mutasyon pozitif tümörlerde EGFR aracılı sinyalleri engelleyen güçlü etkisi, EGFR'nin mutant kinaz bölgesindeki ATP bağlayan bölgesine erlotinibin sıkıca bağlanmasına atfedilmiştir. Aşağı akım sinyalin engellenmesi nedeniyle, hücre çoğalması durmakta ve intrinsik apopitotik yolla hücre ölümü başlamaktadır. EGFR'yi aktive eden bu mutasyonların ekspresyonunun tetiklendiği fare modellerinde tümör regresyonu gözlenmiştir.
Klinik etkililik
- EGFR aktive eden mutasyonları olan hastalarda küçük hücreli dışı akciğer kanserinin (KHDAK) birinci basamak tedavisi (monoterapi olarak erlotinib uygulaması):
EGFR aktive eden mutasyonları olan KHDAK hastalarının birinci basamak tedavisinde BİNİTOL ilacının etkinliği faz III, randomize, açık etiketli çalışmada gösterilmiştir (ML20650, EURTAC). Bu çalışma metastatik veya lokal olarak ileri evre (evre IIIB ve IV) KHDAK olan, daha önce ilerlemiş hastalığı için kemoterapi veya sistemik antitümör tedavisi almamış, EGFR tirozin kinaz bölgesinde mutasyonları (ekson 19 delesyonu veya ekson 21 mutasyonu) bulunan beyaz ırktan hastalarda gerçekleştirilmiştir. Hastalar günlük erlotinib 150 mg veya dört döngü platin bazlı ikili kemoterapi almak üzere 1:1 oranında randomize edilmişlerdir.
Birincil sonlanım noktası, araştırmacının değerlendirdiği progresyonsuz sağkalım (PFS) olan çalışmaya ait etkililik sonuçları Tablo 4'te verilmektedir.
Şekil 1: ML20650 (EURTAC) çalışmasında araştırmacı tarafından değerlendirilen PFS için Kaplan-Meier eğrisi (Nisan 2012 kesimli)
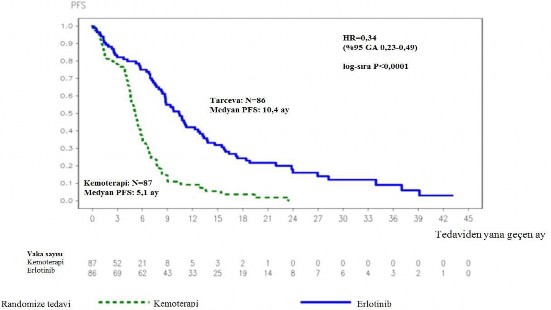
Tablo 3: ML20650 (EURTAC) çalışmasında Erlotinibin kemoterapi ile karşılaştırmalı etkililik sonuçları
|
| Erlotinib | Kemoterapi | Risk Oranı (95% GA) | p-değeri |
Önceden |
| n=77 | n=76 |
|
|
planlanmış | |||||
Birincil sonlanım noktası: Progresyonsuz Sağkalım (PFS, ay olarak medyan)* Araştırmacı tarafından değerlendirilen **
Bağımsız inceleme ** |
|
|
|
| |
ara analiz |
|
|
|
| |
(%35 OS |
|
|
|
| |
matürite) (n=153) | 9,4 | 5,2 | 0,42 [0,27-0,64] | p<0,0001 | |
Kesim tarihi: Ağu | 10,4 | 5,4 | 0,47 [0,27-0,78] | p=0,003 | |
2010 |
|
|
|
| |
En İyi Genel Yanıt Oranı | %54,5 | %10,5 |
| p<0,0001 | |
| (CR/PR) | ||||
| Genel Sağkalım (OS) (ay) | 22,9 | 18,8 | 0,80 | p=0,4170 |
| [0,47-1,37] | ||||
Araştırma |
| n=86 | n=87 |
|
|
amaçlı analiz (%40 OS matürite) (n=173) | |||||
PFS (ay olarak medyan), Araştırmacı tarafından değerlendirilen |
9,7 |
5,2 | 0,37 [0,27-0,54] |
p<0,0001 | |
En İyi Genel Yanıt Oranı (CR/PR) | %58,1 | %14,9 |
| p<0,0001 | |
Kesim tarihi: Oca 2011 |
OS (ay) |
19,3 |
19,5 | 1,04 [0,65-1,68] |
p=0,8702 |
Güncellenmi |
| n=86 | n=87 |
|
|
ş analiz (%62 OS matürite) | |||||
PFS (ay olarak medyan) | 10,4 | 5,1 | 0,34 [0,23-0,49] | p<0,0001 |
(n=173) |
OS*** (ay) |
22,9 |
20,8 |
0,93 [0,64-1,36] |
p=0,7149 |
Kesim tarihi: Nisan | |||||
2012 |
En az bir başarısız kemoterapi sonrası KHDAK tedavisi (monoterapi olarak erlotinib uygulaması):
İkinci-üçüncü basamak tedavi olarak erlotinib ilacının etkililik ve güvenliliği randomize, çift kör, plasebo kontrollü çalışmada (BR.21) gösterilmiştir. Bu çalışmada yer alan 731 hastada en az bir kemoterapi rejiminden sonra lokal olarak ilerlemiş veya metastatik KHDAK vardır. Hastalar günde bir kere oral olarak erlotinib 150 mg veya plasebo almak üzere 2:1 oranında randomize edilmişlerdir. Çalışma son noktaları: genel sağkalım, progresyonsuz sağkalım (PFS), yanıt oranı, yanıt süresi, akciğer kanserine bağlı belirtilerin (öksürük, dispne ve ağrı) kötüleşmesine dek geçen süre ve güvenliliktir. Birincil sonlanım noktası sağkalımdır.
Demografik özellikler iki tedavi grubu arasında dengelidir. Hastaların üçte ikisi erkektir ve yaklaşık üçte birinde başlangıç Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu (PS) 2 olup, %9'unda başlangıç ECOG PS 3'tür. Erlotinib ve plasebo grubundaki hastaların sırasıyla %93 ve 92 kadarı daha önce platin içerenrejim ve sırasıyla %36 ve %37 kadarı taksan tedavisi almıştır.
Erlotinib grubunda plaseboya göre ölüm için ayarlanan tehlike oranı (HR) 0,73 (%95 GA, 0,60 â 0,87) (p =0,001) olarak saptanmıştır. 12. ayda yaşayan hastaların oranı erlotinib ve plasebo grupları için sırasıyla %31,2 ve %21,5 olarak saptanmıştır. Medyan genel sağkalım erlotinib grubunda 6,7 ay iken (%95 GA, 5,5â 7,8 ay) plasebo grubunda 4,7 aydır (%95 GA, 4,1 â 6,3 ay).
Genel sağkalım üzerine etki farklı hasta alt kümelerinde incelenmiştir. Genel sağkalım üzerine erlotinib etkisi şu hastalarda benzerdir: başlangıç performans durumu (ECOG) 2-3 (HR = 0,77,
%95 GA, 0,6-1,0) veya 0-1 (HR = 0,73, %95 GA, 0,6-0,9), erkek (HR = 0,76, %95 GA, 0,6-
0,9) veya kadın (HR = 0,80, %95 GA, 0,6-1,1), < 65 yaş (HR = 0,75, %95 GA, 0,6-0,9) veya
daha yaşlı hastalar (HR = 0,79, %95 GA, 0,6- 1,0), daha önce bir rejim alan hastalar (HR = 0,76, %95 GA, 0,6-1,0) veya daha önce birden fazla rejim alan (HR = 0,75, %95 GA, 0,6-1,0),
beyazlar (HR = 0,79, %95 GA, 0,6-1,0) veya Asyalı hastalar (HR = 0,61, %95 GA, 0,4-1,0), adenokarsinomu olanlar (HR = 0,71, %95 GA, 0,6-0,9) veya skuamöz hücreli karsinomu olanlar (HR = 0,67, %95 GA, 0,5-0,9). Şu hastalarda ise benzer değildir: diğer histolojileri olanlar (HR 1,04, %95 GA, 0,7-1,5), tanıda hastalığı evre IV olan hastalar (HR = 0,92, %95 GA, 0,7-1,2) veya tanıda hastalığı evre < IV olanlar (HR = 0,65, %95 GA, 0,5-0,8). Daha önce hiç sigara içmemiş olan hastalar, şu anda veya eskiden sigara içenlere nazaran (HR = 0,87, %95 GA, 0,71-1,05) erlotinibden daha fazla fayda sağlamıştır (sağkalım HR = 0,42, %95 GA, 0,28- 0,64).
EGFR ekspresyon durumu bilinen hastaların %45 kadarında, EGFR pozitif tümörleri olanların tehlike oranı 0,68 (% 95 GA, 0,49-0,94) ve EGFR-negatif tümörü olanların tehlike oranı 0,93 (% 95 GA, 0,63-1,36) olarak saptanmıştır (EGFR pharmDx kit kullanılan IHC ile tanımlanmıştır ve yüzde ondan az boyalı tümör hücresi EGFR negatif olarak tanımlanmıştır. Kalan %55 hastanın EGFR ekspresyon durumu bilinmemektedir ve HR 0,77 (%95 GA, 0,61-
0,98) olarak saptanmıştır.
Erlotinib grubunda ortalama PFS 9,7 haftadır (%95 GA, 8,4 â 12,4 hafta) ve plasebo grubunda 8,0 haftadır (%95 GA, 7,9 â 8,1 hafta).
Objektif yanıt oranı, Solid Tümörlerde Yanıt Değerlendirme Kriterleri'ne (RECIST) göre erlotinib grubunda %8,9 olarak saptanmıştır (%95 GA, 6,4 â 12,0). İlk 330 hasta merkezi olarak değerlendirilmiştir (yanıt oranı %6,2); 401 hasta araştırmacı tarafından değerlendirilmiştir (yanıt oranı %11,2).
Medyan yanıt süresi 34,3 hafta olup, 9,7 ila 57,6+ hafta arasındadır. Tam yanıt, kısmi yanıt veya stabil hastalık yaşayan hasta oranı sırasıyla erlotinib ve plasebo gruplarında %44,0 ve 27,5 olarak saptanmıştır (p = 0,004).
Erlotinib için sağkalım faydası, (RECIST'e göre) nesnel tümör yanıtı elde etmeyen hastalarda da gözlenmiştir. Bunun kanıtı, en iyi yanıtı stabil hastalık veya progresif hastalık olan hastalar arasında ölüm için HR'nin 0,82 (%95 GA, 0,68 â 0,99) olmasıyla ortaya konmuştur.
Erlotinib, plaseboya nazaran semptomlar üzerinde de fayda göstermiş olup öksürük, dispne ve
ağrının kötüleşmesi için geçen süre anlamlı derecede uzamıştır.
Lokal ileri veya metastatik, sigara içen (yılda ortalama 38 paket) KHDAK hastalarında kemoterapi sonrası ikinci basamak tedavide iki erlotinib dozunun karşılaştırıldığı (300 mg'a karşılık 150 mg) çift-kör, randomize Faz III çalışmada (MO22162, CURRENTS), 300 mg doz progresyonsuz sağkalım faydası göstermemiştir (sırasıyla 7 hafta ve 6,86 hafta).
Sekonder sonlanım noktalarının tümü primer sonlanım noktalarıyla tutarlıdır ve günde 300 mg ve 150 mg erlotinib ile tedavi edilen hastalar arasında sağkalım farkı görülmemiştir (HR 1,03,
%95 GA 0,80 â 1,32). Güvenlik verileri, 300 mg ve 150 mg dozları arasında karşılaştırılabilirdir ancak, daha yüksek erlotinib dozu alan hastalarda döküntü, interstisyel akciğer hastalığı ve diyare insidansında sayısal bir artış olmuştur. CURRENTS çalışmasından elde edilen veriler, sigara içen hastalarda önerilen 150 mg doz ile karşılaştırıldığında 300 mg dozla herhangi bir yarar görülmediği göstermiştir.
CURRENT çalışmasındaki hastalar EGFR mutasyon durumuna göre seçilmemiştir (bkz. Bölüm 4.2, 4.4, 4.5 ve 5.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Oral uygulama sonrasında erlotinib ortalama doruk plazma düzeylerine oral dozdan yaklaşık 4 saat sonra ulaşır. Normal sağlıklı gönüllülerdeki bir çalışmada yaklaşık %59'luk bir biyoyararlanım elde edilmiştir. Bir oral doz sonrasındaki biyoyararlanım, yiyeceklerle birlikte arttırılabilir.
Dağılım:
Erlotinib, 232 L'lik ortalama sanal dağılım hacmine sahiptir ve insan tümör dokularına dağılır. Günlük 150 mg oral erlotinib dozu almakta olan 4 hastada (3'ü küçük hücreli dışı akciğer kanserli, biri de larinks kanserli) yapılan bir çalışmada, tedavinin 9. günündeki cerrahi eksizyonlardan alınan tümör örnekleri, tümördeki erlotinib konsantrasyonlarının ortalama 1,185 ng/g doku olduğunu ortaya koymuştur. Bu da kararlı durumda gözlenen doruk plazma konsantrasyonlarının genel ortalamasının %63'üne karşılık gelmektedir (%5-161 aralığı). Primer aktif metabolitler ortalama 160 ng/g doku konsantrasyonlarında tespit edilmiş olup bu değer de kararlı durumda gözlenen doruk plazma konsantrasyonlarının %113'lük genel
ortalamasına denk gelmektedir (%88-130). Plazma protein bağlanması yaklaşık olarak %95'tir. Erlotinib serum albumine ve alfa-1 asit glikoproteine (AAG) bağlanmaktadır.
Biyotransformasyon:
Erlotinib insanlarda karaciğerde hepatik sitokrom enzimleri tarafından, birincil olarak CYP3A4 ve daha az ölçüde CYP1A2 tarafından metabolize edilmektedir. CYP4A4'ün bağırsaktaki, CYP1A1'in akciğerdeki, CYP1B1'in tümör dokusundaki ekstrahepatik metabolizması erlotinibin metabolik klerensine potansiyel olarak yardım eder.
Tespit edilen 3 ana metabolik yol mevcuttur: 1) yan zincirlerden biri veya her ikisinin O- demetilasyonu ve bunu takiben karboksilik aside oksidasyon; 2) asetilen kısmının oksidasyonu ve takiben aril karboksilik aside hidrolizi; ve 3) fenil-asetilen kısmının aromatik hidroksilasyonu. Yan zincirlerden birinin O-demetilasyonu ile oluşan OSI 420 ve OSI 413 primer metabolitleri preklinik in vitro deneyler ve in vivo tümör modellerindeki erlotinib ile karşılaştırılabilir etkiye sahiptir. Bunlar plazmada erlotinibin <%10'u oranında mevcut bulunup, erlotinib ile benzer farmakokinetik gösterirler.
Eliminasyon:
Erlotinib büyük oranda metabolitleri halinde birincil olarak feçes ile atılırken (>%90), renal eliminasyon bir oral dozun yalnızca küçük bir miktarına (yaklaşık %9) karşılık gelir. Tek ajan olarak erlotinib verilen 591 hastadaki bir popülasyon farmakokinetik analizi, 36,2 saatlik ortalama yarı-ömürle, 4,47 L/saatlik ortalama görünen klerens ortaya koymuştur. Bu nedenle, kararlılık durumu plazma konsantrasyonlarına ulaşılmasının yaklaşık 7-8 gün içinde gerçekleşmesi beklenmektedir.
Doğrusallık/doğrusal olmayan durum:
Yeterli veri yoktur.
Hastalardaki karakteristik özellikler
Beklenen görünür klerens ile hasta yaşı, vücut ağırlığı, cinsiyet ve etnik özellikler arasında anlamlı bir ilişki gözlenmemiştir. Erlotinib farmakokinetiğini değiştiren hastaya ait faktörler, serum total bilirubin, albümin ve alfa-1 asit glikoprotein konsantrasyonları ve sigara kullanımının devam etmesidir. Artmış total bilirubin serum konsantrasyonları ve albümin ve alfa-1 asit glikoprotein konsantrasyonları daha yavaş hızda erlotinib klerensi ile birliktelik göstermiştir. Bu farklılıkların klinik relevansı belli değildir. Bununla birlikte, sigara içenlerde
daha hızlı bir erlotinib klerensi gözlenmiştir. Bu durum, tek bir oral doz olarak 150 mg erlotinib alan, sigara içmeyen ve halihazırda sigara içen sağlıklı bireylerde yapılan farmakokinetik çalışmada doğrulanmıştır. Cmaks'ın geometrik ortalaması sigara içmeyenlerde 1056 ng/mL iken sigara içenlerde 689 ng/mL olmuştur ve sigara içenler için sigara içmeyenlere göre ortalama oran %65,2'dir (95% GA: 44,3 ila 95,9, p = 0,031). EAA0- inf için geometrik ortalama sigara içmeyenlerde 18726 ngxh/mL ve sigara içenlerde 6718 ngxh/mL olmuştur ve ortalama oran %35,9'dur (95% GA: 23,7 ila 54,3, p < 0,0001). C24h için geometrik ortalama sigara içmeyenlerde 288 ng/mL ve sigara içenlerde 34,8 ng/mL olmuştur ve ortalama oran %12,1'dir (95% GA: 4,82 ila 30,2, p= 0,0001).
Pivotal faz III KHDAK çalışmasında, halihazırda sigara içenlerde erlotinib için kararlı durum plazma konsantrasyonu 0,65 mcg/mL olmuştur ve bu değer sigarayı bırakanlarda veya hiç sigara içmemiş bireylerde görülen konstrasyonun iki katından daha azdır (1,28 mcg/mL, n=108). Bu etki ile birlikte görülen erlotinib plazma klerensinde %24'lük bir artış gözlenmiştir. Daha önce sigara içmiş olan KHDAK hastaları üzerinde yapılan faz I doz eskalasyon çalışmasında, kararlı durumdaki farmakokinetik analizleri erlotinib dozu 150 mg'den maksimum tolere edilebilir doz olan 300 mg'ye artırıldığında erlotinib maruziyetinde doz orantılı artış göstermiştir. Bu çalışmadaki halihazırda sigara içenlerde uygulanan 300 mg dozda kararlı durum plazma konsantrasyonu 1,22 mcg/mL olmuştur (n=17) (bkz. Bölüm 4.2, 4.4, 4.5
ve 5.1).
Populasyon farmakokinetik analizinden elde edilen sonuçlara göre bir opioid varlığının maruziyeti %11 oranında artırdığı görülmüştür.
Pediyatrik populasyon:
Pediyatrik hastalara özgün çalışmalar bulunmamaktadır.
Geriyatrik populasyon:
Yaşlı hastalara özgün çalışmalar bulunmamaktadır.
Karaciğer bozukluğu:
Erlotinib birincil olarak karaciğer aracılığıyla metabolize edilir. Solid tümörleri olan ve orta derecede hepatik fonksiyon bozukluğu bulunan hastalarda (Child-Pugh skoru 7-9) erlotinib EAA0-t ve Cmaks geometrik ortalaması sırası ile 27000 ngxh/mL ve 805 ng/mL olmuştur ve
bu değerler primer karaciğer kanseri veya hepatik metastazları olanlar da dahil olmak üzere hepatik fonksiyonları yeterli olan hastalarda sırası ile 29300 ngxh/mL ve 1090 ng/mL şeklindedir. Cmaks değerinin orta derecede hepatik fonksiyon bozukluğu olan hastalarda istatiksel olarak anlamlı derecede daha düşük olmasına karşın bu farkın klinik olarak anlamlı olmadığı düşünülmektedir. Şiddetli hepatik disfonksiyonun erlotinib farmakokinetiği üzerindeki etkisi ile ilgili veri bulunmamaktadır. Popülasyon farmakokinetik analizinde, total bilirubinin artmış serum konsantrasyonlarının daha düşük erlotinib klerensi hızı ile ilişkili olduğu görülmüştür.
Böbrek bozukluğu:
Erlotinib ve metabolitlerinin böbrekler tarafından atılımı önemli ölçüde değildir. Tek bir dozun
%9'dan azı idrar ile atılmaktadır. Populasyon farmakokinetik analizinde, erlotinib klerensi ve kreatinin klerensi arasında klinik olarak anlamlı bir ilişki görülmemiştir ancak kreatinin klerensi 15 ml/dk'den az olan hastalar ile ilgili bir veri bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
En az bir hayvan türü veya çalışmada gözlenmiş olan kronik doz verilmesine bağlı etkiler kornea (atrofi, ülserasyon), deri (foliküler dejenerasyon ve enflamasyon, kızarıklık ve alopesi), overler (atrofi), karaciğer (karaciğer nekrozu), böbrekler (renal papiller nekroz ve tübüler dilatasyon) ve gastrointestinal sistem (mide boşalmasında gecikme ve diyare) üzerine etkileri içermiştir. Kırmızı kan hücresi parametreleri düşmüş ve beyaz kan hücreleri öncelikle de nötrofiller, artmıştır. Alanin aminotransferaz (ALT), aspartat aminotransferaz (AST) ve bilirubinde tedavi ile ilişkili artışlar meydana gelmiştir. Bu bulgular, klinik olarak anlamlı maruziyetlerin altındaki maruziyetlerde görülmüştür.
Etki mekanizmasına dayanarak, erlotinibin teratojenik olma potansiyeli bulunmaktadır. Sıçanlarda ve farelerde maksimum tolere edilebilir doz ve/veya maternal olarak toksik dozlarda yapılan reproduktif toksikoloji testlerinden elde edilen veriler reproduktif (sıçanlarda embriyotoksisite, tavşanlarda ise embriyo resorpsiyon ve fetotoksisite) ve gelişimsel (yavru büyümesinde düşüş ve sıçanlarda sağkalım) toksisite göstermiştir ancak bu teratojenik değildir ve fertiliteyi olumsuz bozmamıştır. Bu bulgular klinik olarak anlamlı tüm maruziyetlerde görülmüştür.
Konvansiyonel genotoksisite çalışmalarında erlotinib negatif sonuç göstermiştir. Sıçanlarda ve farelerde erlotinib ile yapılan iki yıllık karsinojenisite çalışmaları insan terapötik maruziyetini aşan maruziyetlere kadar negatif olmuştur (Cmaks ve/veya EAA'ya dayanarak, sırası ile 2 kata ve 10 kata kadar daha fazla).
Sıçanlarda UV irradyasyonu sonrası hafif derecede fototoksik deri reaksiyonu görülmüştür.
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
DR Sertus İlaç San.Ve Tic.Ltd.Şti
| Satış Fiyatı | 7128.28 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 7128.28 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8680352000266 |
| Etkin Madde | Erlotinib |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |