BLINCYTO 38.5 mcg liyofilize toz içeren 1 flakon (10 ml) Kısa Ürün Bilgisi
{ Blinatumomab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BLİNCYTO® 38,5 mcg infüzyonluk çözelti için konsantre toz ve çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tek kullanımlık flakon 38,5 mcg koruyucu içermeyen blinatumomabiçermektedir.
Blinatumomab Çin hamster yumurtalık hücrelerinde rekombinant DNA teknolojisiyle üretilmiş bir proteindir.
Koruyucu içermeyen 3 mL enjeksiyonluk steril su ile sulandırıldıktan sonra, sulandırılmış çözeltinin toplam hacmi 3,1 mL olur ve her mL 'si 12,5 mcg blinatumomab içerir.
Yardımcı maddeler
Sodyum hidroksit: pH ayarlayıcı
Yardımcı maddelerin tam listesi için, Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Liyofilize toz içeren flakon.
BLİNCYTO® toz (konsantre için toz): Beyaz ila kırık beyaz toz. Çözelti (stabilizör): Renksiz ila açık sarı, berrak çözelti, pH 7,0.
Aşırı köpük oluşumunu engellemek için, içeriği hafifçe döndürerek karıştırınız.
Çalkalamayınız.
Bir şırıngayla gereken hacimde sulandırılmış BLİNCYTO® çözeltisini aseptik olarak 9 mg/mL (%0,9) enjeksiyonluk sodyum klorür çözeltisi ve çözelti (stabilizatör) içeren infüzyon torbasına aktarınız. Köpük oluşmasını engellemek için torbanın içeriğini hafifçe karıştırınız.
45 kg ve üzeri hastalarda spesifik sulandırılmış BLİNCYTO® hacmi için tablo 12'ye bakınız.
45 kg altındaki (dozun VYA'ya göre belirlendiği) hastalarda spesifik sulandırılmış BLİNCYTO® hacmi için tablo 13'e bakınız.
Kullanılmamış sulandırılmış BLİNCYTO® çözeltisi içeren flakon atılmalıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Blinatumomab CD19 pozitifliği gösterilmiş olan prekürsör B-hücreli akut lenfoblastik lösemi tanılı erişkinler ve 1 yaşın üzerindeki çocuklarda
Daha önce en az 2 seri tedavi (standart tedavi + kurtarma tedavisi) uygulanmış olmasına rağmen hematolojik relaps gelişmiş olan veya uluslararası sertifikalı bir laboratuvarda valide edilmiş bir yöntemle %0,1 ve üzerinde minimal rezidüel hastalık (MRH) belirlenmiş olan allojenik kök hücre nakli için uygun hastalarda.
Daha önce allojenik kök hücre transplantasyonu uygulanmış olmasına rağmen hematolojik relaps gelişmiş olan veya uluslararası sertifikalı bir laboratuvarda valide edilmiş bir yöntemle %0,1 ve üzerinde MRH belirlenmiş olan, tekrar allojenik kök hücre nakli yapılacak hastaların tedavisinde uygundur.
4.2. Pozoloji ve uygulama şekli
Tedavi, hematolojik hastalıkların tedavisinde deneyimli bir sağlık mesleği mensubunun gözetimi altında uygulanmalıdır. BLİNCYTO® tedavisi alan hastalara Hastalar ve Bakıcılar için Eğitim Broşürü ve Hasta Kartı verilmelidir.
Nükseden veya dirençli B-hücreli prekürsör ALL tedavisinde, tedavinin başlangıcında en az ilk döngünün ilk 9 günü ve ikinci döngünün ilk 2 günü süresince hastaneye yatış yapılması önerilmektedir.
Philadelphia kromozomu negatif MRH pozitif B-hücreli prekürsör ALL tedavisinde, birinci döngünün en az ilk 3 günü ve ikinci döngünün ilk 2 günü boyunca hastaneye yatış yapılması önerilmektedir.
Klinik açıdan anlamlı merkezi sinir sistemi (MSS) patolojisi veya bu tip bir patoloji öyküsü bulunan hastalarda (bkz. Bölüm 4.4), en az ilk döngünün ilk 14 günü olacak şekilde hastaneye yatış önerilmektedir. İkinci döngüde, en az 2 gün süreyle hastaneye yatış önerilir ve klinik değerlendirme, ilk döngüdeki BLİNCYTO® toleransına dayalı olmalıdır. İlk nörolojik olayların gecikmeli şekilde ikinci döngüde ortaya çıktığı olgular gözlendiği için, dikkatli olunmalıdır.
Sonraki döngülerin tamamında başlangıç ve yeniden başlangıç (örn. tedaviye 4 saat ya da daha uzun süre ara verildiğinde) için bir sağlık mesleği mensubunun gözetimi veya hastaneye yatış önerilmektedir.
BLİNCYTO® infüzyon torbaları 24, 48, 72 veya 96 saatlik infüzyon için hazırlanmalıdır (bkz.
Bölüm 6.6).
Pozoloji/uygulama sıklığı ve süresi:
Nükseden veya dirençli B-hücreli prekürsör ALL
Nükseden veya dirençli B-hücreli prekürsör ALL'li hastalar 2 döngü tedavi alabilirler. Bir tedavi döngüsünde 28 gün (4 hafta) sürekli infüzyon uygulanır. İki tedavi döngüsü arasında 14 gün (2 haftalık) tedavi uygulanmayan bir ara verilir.
2 döngü indüksiyon tedavisinin ardından, remisyon (CR/CRh*) sağlanan hastalara, yarar-risk değerlendirmesi doğrultusunda 3 döngü daha BLİNCYTO® konsolidasyon tedavisi uygulanabilir.
Hastanın ağırlığına göre günlük doz önerilmektedir. 45 kg veya daha üstü hastalara bir sabit doz verilirken, 45 kg'ın altındaki hastalarda, hastanın vücut yüzey alanı (VYA) kullanılarak doz hesaplanır.
Hastanın kilosu | Tedavi döngüsü 1 | Sonraki döngüler | |||
Gün 1-7 | Gün 8-28 | Gün 29-42 | Gün 1-28 | Gün 29-42 | |
45 kg veya üstü (sabit doz) | 9 mcg/gün sürekli infüzyon | 28 mcg/gün sürekli infüzyon |
14 günlük tedavisiz dönem | 28 mcg/gün sürekli infüzyon |
14 günlük tedavisiz dönem |
45 kg'dan düşük (Vücut yüzey alanına dayanan doz) | 5 mcg/m/gün sürekli infüzyon (9 mcg/gün'ü geçemez) | 15 mcg/m/gün sürekli infüzyon (28 mcg/gün'ü geçemez) | 15 mcg/m/gün sürekli infüzyon (28 mcg/gün'ü geçemez) | ||
Premedikasyon ve ilave ilaç tedavisi önerileri
Yetişkin hastalarda, BLİNCYTO® tedavisinde her bir döngünün başlamasından 1 saat önce 20 mg intravenöz deksametazon uygulanmalıdır.
Pediyatrik hastalarda, BLİNCYTO® tedavisine başlamadan (1. döngü, 1. gün) 6 ila 12 saat önce deksametazon 10 mg/m2 (20 mg'ı aşmamalı) ile intravenöz olarak veya oral yolla uygulanmalıdır. Bunu, BLİNCYTO® tedavisine başlamadan (1. döngü, 1. gün) önceki 30 dakika içinde 5 mg/m2 oral veya intravenöz deksametazon uygulaması takip etmelidir.
Ateş yükselmesini baskılamak için bir antipiretik ilacın (parasetamol gibi) kullanımı her tedavi döngüsünün ilk 48 saati sırasında önerilmektedir.
MSS ALL nüksünün önlenmesine yönelik BLİNCYTO® tedavisi öncesinde ve tedavi
sırasında intratekal kemoterapi profilaksisi önerilmektedir.
Tümör yükü fazla olan hastalar için faz öncesi tedavi
Kemik iliğinde lösemik blast oranı ≥ %50 veya lösemik blast sayısı > 15.000/mikrolitre periferik kan olan hastalara deksametazon tedavisi uygulanmalıdır (en fazla 24 mg/gün).
MRH pozitif B-hücreli prekürsör ALL tedavisi
Philadelphia kromozomu negatif MRH pozitif B-hücreli prekürsör ALL için tedavi olarak BLİNCYTO® kullanımı düşünüldüğünde, tespit edilebilir MRH minimum 10-4 hassasiyete sahip valide edilmiş bir tayinde doğrulanmalıdır (bkz. Bölüm 5.1). MRH'ye yönelik klinik testler, teknik seçiminden bağımsız olarak, iyi bilinen teknik kılavuzlar izlenerek ve söz konusu teknikte deneyimli, kalifiye bir laboratuvar tarafından gerçekleştirilmelidir.
Hastalara, 1 döngü indüksiyon tedavisinin ardından 3 döngü daha BLİNCYTO® konsolidasyon tedavisi verilebilir. Bir BLİNCYTO® indüksiyon veya konsolidasyon tedavi döngüsü 28 günlük (4 hafta) sürekli infüzyon ve bunu takiben 14 günlük (2 hafta) tedavisiz dönemden oluşur (toplam 42 gün). Blinatumomab tedavisine yanıt veren hastaların çoğunda yanıt, 1 döngüden sonra elde edilir (bkz. Bölüm 5.1). Bu nedenle, 1 tedavi döngüsünden sonra hematolojik ve/veya klinik iyileşme göstermeyen hastalarda tedaviye devam etmeyle ilişkili potansiyel yarar ve riskler, tedaviyi yürüten hekim tarafından değerlendirilmelidir.
Önerilen doz (ağırlığı en az 45 kg olan hastalar için):
Tedavi döngüsü/döngüleri | |
İndüksiyon Döngüsü 1 | |
Gün 1-28 | Gün 29-42 |
28 mcg/gün | 14 günlük tedavisiz dönem |
Konsolidasyon Döngüleri 2-4 | |
Gün 1-28 | Gün 29-42 |
28 mcg/gün | 14 günlük tedavisiz dönem |
Premedikasyon ve ilave ilaç tedavisi önerileri
Her döngüde ilk BLİNCYTO® dozundan 1 saat önce prednizon 100 mg veya eşdeğeri (örn. deksametazon 16 mg) ile intravenöz olarak uygulanmalıdır.
Ateş yükselmesini baskılamak için bir antipiretik ilacın (parasetamol gibi) kullanımı her tedavi döngüsünün ilk 48 saati sırasında önerilmektedir.
BLİNCYTO® tedavisi öncesinde ve sırasında MSS ALL relapsını önlemek için intratekal kemoterapi profilaksisi önerilir.
Doz ayarlaması
BLİNCYTO® alan, nükseden veya dirençli B-hücreli prekürsör ALL ve Philadelphia kromozomu negatif MRH pozitif B-hücreli prekürsör ALL hastaları için, BLİNCYTO® tedavisinin geçici veya kalıcı olarak uygun şekilde kesilmesi kararı şiddetli (3. derece) veya hayatı tehdit edici (4. derece) sitokin salıverilme sendromu, tümör lizis sendromu, nörolojik toksisite, yüksek karaciğer enzimleri ve klinik açıdan anlamlı diğer toksisitelerin söz konusu olması halinde verilmelidir (bkz. Bölüm 4.4).
Bir advers olay sonrasında tedaviye ara verme süresi 7 günü aşmadığı takdirde, söz konusu döngüye ara vermeden önceki ve sonraki günler dahil olmak üzere toplam 28 gün olacak şekilde aynı döngüye devam edilmelidir. Advers olay nedeniyle tedaviye ara verme süresi 7 günü aştığı takdirde, yeni bir döngüye başlanmalıdır. Toksisitenin düzelmesi 14 günden uzun sürdüğü takdirde, aşağıdaki tabloda farklı şekilde belirtilen durumlar dışında, BLİNCYTO® kalıcı olarak kesilmelidir.
Toksisite | Derece* | 45 kg veya üstü hastalar için aksiyon | 45 kg'ın altındaki hastalar için aksiyon |
Sitokin salıverilme sendromu, tümör lizis sendromu | 3. derece | Düzelme olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 9 mcg/gün dozunda yeniden başlanmalıdır. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 28 mcg/gün olacak şekilde arttırılmalıdır. | Düzelme olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 5 mcg/m/gün dozunda yeniden başlanmalıdır. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 15 mcg/m/gün olacak şekilde arttırılmalıdır. |
| 4. derece | BLİNCYTO tedavisi kalıcı olarak kesilmelidir. | BLİNCYTO tedavisi kalıcı olarak kesilmelidir. |
Nörolojik toksisite | Konvülziyon | Birden fazla konvülziyon gelişmesi halinde, BLİNCYTO tedavisi kalıcı olarak kesilmelidir. | Birden fazla konvülziyon gelişmesi halinde, BLİNCYTO tedavisi kalıcı olarak kesilmelidir. |
| 3. derece | En az 3 gün süreyle en fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 9 mcg/gün dozunda devam edilmelidir. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 28 mcg/gün olacak şekilde arttırılmalıdır. Tedaviye yeniden başlanırken, 24 mg deksametazon ile ön tedavi uygulanmalıdır. Daha sonra deksametazon dozu 4 gün boyunca yavaş yavaş azaltılmalıdır. Toksisitenin 9 mcg/gün dozuyla gelişmesi halinde veya toksisitenin düzelmesi 7 günden uzun sürdüğü takdirde, BLİNCYTO tedavisi kalıcı olarak kesilmelidir. | En az 3 gün süreyle en fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 5 mcg/m/gün dozunda devam edilmelidir. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 15 mcg/m/gün olacak şekilde arttırılmalıdır. Toksisitenin 5 mcg/m/gün dozuyla gelişmesi halinde veya toksisitenin düzelmesi 7 günden uzun sürdüğü takdirde, BLİNCYTO tedavisi kalıcı olarak kesilmelidir. |
Toksisite | Derece* | 45 kg veya üstü hastalar için aksiyon | 45 kg'ın altındaki hastalar için aksiyon |
| 4. derece | BLİNCYTO tedavisi kalıcı olarak kesilmelidir. | BLİNCYTO tedavisi kalıcı olarak kesilmelidir. |
Karaciğer enzimlerinde yükselme | 3. derece | Klinik açıdan anlamlı olması halinde, en fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 9 mcg/gün dozunda yeniden başlanmalıdır. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 28 mcg/gün olacak şekilde arttırılmalıdır. | Klinik açıdan anlamlı olması halinde, en fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 5 mcg/m/gün dozunda yeniden başlanmalıdır. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 15 mcg/m/gün olacak şekilde arttırılmalıdır. |
| 4. derece | BLİNCYTO tedavisinin kalıcı olarak kesilmesi düşünülmelidir. | BLİNCYTO tedavisinin kalıcı olarak kesilmesi düşünülmelidir. |
Diğer klinik açıdan anlamlı (tedavi eden hekimin değerlendirmesine göre) advers reaksiyonlar | 3. derece | En fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 9 mcg/gün dozunda devam edilmelidir. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 28 mcg/gün olacak şekilde arttırılmalıdır. | En fazla 1. derece (hafif) olana kadar BLİNCYTO'ya ara verilmeli, daha sonra BLİNCYTO uygulamasına 5 mcg/m/gün dozunda devam edilmelidir. Tekrar toksisite gelişmediği takdirde, doz 7 gün sonunda 15 mcg/m/gün olacak şekilde arttırılmalıdır. |
| 4. derece | BLİNCYTO tedavisinin kalıcı olarak kesilmesi düşünülmelidir. | BLİNCYTO tedavisinin kalıcı olarak kesilmesi düşünülmelidir. |
*NCI (Amerikan Ulusal Kanser Enstitüsü) Advers Olaylar İçin Ortak Terminoloji Kriterleri (CTCAE) versiyon 4.0 doğrultusunda. 3. derece şiddetli, 4. derece ise hayatı tehdit edicidir. | |||
Uygulama şekli:
Önemli Not: BLİNCYTO infüzyon hattı veya intravenöz kateteri özellikle infüzyon torbalarını değiştirirken yıkanmamalıdır. Torbaları değiştirirken veya infüzyonun bitiminde yıkamak aşırı doz uygulanmasına ve komplikasyon gelişmesine sebep olabilir. Çok sayıda lümeni olan venöz kateter kullanıldığında, BLİNCYTO bunun için ayrılmış tek bir lümenden infüze edilmelidir.
Bu tıbbi ürünün hazırlanması ve kullanılması ile ilgili talimatlar için, bkz. Bölüm 6.6.
BLİNCYTO® infüzyonluk çözelti, 96 saate kadar bir süre boyunca infüzyon pompası kullanarak sabit akış hızında sürekli intravenöz infüzyon olarak uygulanır.
BLİNCYTO® infüzyonluk çözelti steril, pirojenik olmayan, protein bağlaması düşük olan, 0,2 mikronluk IV hat içi filtre kullanılarak uygulanmalıdır.
IV hattının hazırlanmasının hesaba katılması ve hastanın BLİNCYTO® dozunun tamamını almasının sağlanması için, karıştırılan BLİNCYTO®'nun başlangıç hacmi (270 mL) hastaya uygulanacak olan hacimden (240 mL) fazla olacaktır.
BLİNCYTO® çözeltisinin infüzyonu, hazırlanan torba üzerindeki eczane etiketinde bulunan talimatlar çerçevesinde aşağıdaki sabit infüzyon hızlarından birinde yapılmalıdır:
24 saatlik uygulama için 10 mL/saat infüzyon hızı
48 saatlik uygulama için 5 mL/saat infüzyon hızı
72 saatlik uygulama için 3,3 mL/saat infüzyon hızı
96 saatlik uygulama için 2,5 mL/saat infüzyon hızı
İnfüzyon sürecinin seçimi, infüzyon torbasının değişim sıklığını göz önüne alınarak, tedaviyi uygulayan hekim tarafından yapılmalıdır. Verilen BLİNCYTO®'nun hedef terapötik dozu değişmez.
İnfüzyon torbasının değiştirilmesi
Sterilizasyonun sağlanması için, infüzyon torbası en az her 96 saatte bir olmak üzere bir sağlık mesleği mensubu tarafından değiştirilmelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Farmakokinetik analizlere dayanarak, hafif-orta derecedeki renal disfonksiyonlu hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Böbrek yetmezliği bulunan hastalarda BLİNCYTO ile ilgili yapılmış çalışma bulunmamaktadır.
Karaciğer yetmezliği:
Farmakokinetik analizlere dayanarak, bazal karaciğer fonksiyonlarının ilaç maruziyeti üzerine etkisi beklenmemektedir ve başlangıç dozunun ayarlanması gerekli değildir (bkz. Bölüm 5.2). Ciddi düzeyde karaciğer yetmezliği bulunan hastalarda BLİNCYTO® ile ilgili yapılmış çalışma bulunmamaktadır.
Pediyatrik popülasyon:
BLİNCYTO®'nun 1 yaşın altındaki çocuklarda güvenlilik ve etkililiği henüz belirlenmemiştir.
7 aylıktan küçük çocuklar için herhangi bir veri bulunmamaktadır. Çocuklarla ilgili halihazırda mevcut veriler bölüm 4.8 ve 5.1'de açıklanmaktadır.
Geriyatrik popülasyon:
Yaşlı hastalarda (≥ 65 yaş) doz ayarlaması gerekli değildir, bkz. Bölüm 5.1. 75 yaşından
büyük hastalarda BLİNCYTO® ile ilgili deneyim sınırlıdır.
4.3. Kontrendikasyonlar
Blinatumomab veya bölüm 6.1'de listelenmiş olan yardımcı maddelerin herhangi birine karşı aşırı duyarlılık.
Laktasyon (bkz. Bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
Nörolojik Olaylar
Ölümle sonuçlanan olaylar dahil olmak üzere nörolojik olaylar gözlenmiştir. BLİNCYTO® uygulamasının başlamasından sonra ortaya çıkan 3. derece veya daha yüksek (şiddetli veya hayatı tehdit edici) nörolojik olaylar arasında ensefalopati, nöbetler, konuşma bozuklukları, bilinç bozuklukları, konfüzyon ve disoryantasyon ile koordinasyon ve denge bozuklukları yer almıştır. Nörolojik olay yaşayan hastalarda, birinci olayın ortaya çıkmasına kadar geçen medyan süre tedavinin ilk 2 haftası olmuştur ve olayların çoğu tedaviye ara verilince düzelmiştir. Bu olaylar nadiren BLİNCYTO® tedavisinin kalıcı olarak kesilmesine yol açmıştır.
Yaşlı hastalar bilişsel bozukluk, ensefalopati ve konfüzyonun dahil olduğu ciddi nörolojik olaylara daha duyarlı olabilir.
Nörolojik bulgu ve semptomlara ilişkin öyküsü bulunan hastalarda (örneğin baş dönmesi, hipoestezi, hiporefleksi, tremor, diestezi, parestezi ve hafıza bozukluğu) nörolojik olayların görülme (örneğin tremor, baş dönmesi, konfüzyonel durum, ensefalopati ve ataksi) oranının daha yüksek olduğu kaydedilmiştir. Bu hastalar arasında, ilk nörolojik olayın başlamasına kadar geçen medyan süre tedavinin ilk döngüsü içindedir.
Klinik açıdan anlamlı MSS patolojisi veya bu tip bir patoloji öyküsü bulunan hastalar (örn. epilepsi, nöbet, parezi, afazi, inme, ciddi beyin hasarları, demans, Parkinson hastalığı, serebellar hastalık, organik beyin sendromu ve psikoz) klinik çalışmalara dahil edilmediği için, bu hastalarla ilgili deneyim sınırlıdır. Nörolojik olay riskinin bu popülasyonda daha yüksek olma olasılığı vardır. Tedavinin potansiyel yararları nörolojik olaylara ilişkin risk karşısında dikkatle değerlendirilmeli ve bu hastalara BLİNCYTO® uygulanırken daha çok dikkat edilmelidir.
MSS veya beyin-omurilik sıvısında (BOS) belgelenmiş aktif ALL bulunan hastalarda blinatumomab ile ilgili deneyim sınırlıdır. Bununla birlikte, klinik çalışmalarda yer alan hastalar MSS'ni hedef alan tedaviyle (örneğin, intratekal kemoterapi) BOS blastlarının temizlenmesinden sonra blinatumomab tedavisi almıştır. Bu nedenle, BOS temizlendikten sonra, BLİNCYTO® tedavisine başlanabilir.
Hastalarda BLİNCYTO® tedavisine başlamadan önce nörolojik bir muayene yapılması ve hastaların nörolojik olaylarla ilgili belirti veya semptomlar için klinik açıdan izlenmesi (örn. yazma testi) önerilmektedir. Söz konusu belirti ve semptomların yönetimi BLİNCYTO® tedavisinin geçici veya kalıcı olarak kesilmesini gerektirebilir (bkz. Bölüm 4.2). Nöbet
durumunda, uygun antikonvülzan tıbbi ürünlerle (örn. levetirasetam) sekonder profilaksi önerilmektedir.
Enfeksiyonlar
BLİNCYTO® uygulanan hastalarda sepsis, pnömoni, bakteremi, fırsatçı enfeksiyonlar ve kateter bölgesinde enfeksiyon dahil olmak üzere bazıları hayatı tehdit edici veya ölümcül olan ciddi enfeksiyonlar gözlenmiştir. Eastern Cooperative Oncology Group (ECOG) performans durumu en az 2 olan yetişkin hastalarda ciddi enfeksiyon insidansının ECOG performans durumu 2'nin altında olanlara kıyasla daha yüksek olduğu saptanmıştır. Kontrol altında olmayan aktif enfeksiyon bulunan hastalarda BLİNCYTO® ile ilgili deneyim sınırlıdır.
BLİNCYTO® alan hastalar enfeksiyonla ilgili belirti ve semptomlar bakımından klinik açıdan izlenmeli ve uygun tedavi uygulanmalıdır. Enfeksiyonların yönetimi BLİNCYTO® tedavisinin geçici veya kalıcı olarak kesilmesini gerektirebilir (bkz. Bölüm 4.2).
Sitokin Salıverilme Sendromu
BLİNCYTO® alan hastalarda yaşamı tehdit edebilen veya ölümcül olabilen (derece ≥ 4) sitokin salıverilme sendromu (SSS) bildirilmiştir (bkz. Bölüm 4.8).
SSS'nin belirti ve semptomları olabilen ciddi advers olaylar arasında ateş, asteni, baş ağrısı, hipotansiyon, total bilirubin düzeyinde yükselme ve bulantı yer almış; bu olaylar nadiren BLİNCYTO®'nun kesilmesine yol açmıştır. Bir SSS'nin başlamasına kadar geçen medyan süre 2 gün olmuştur. Hastalar bu olaylarla ilgili belirti ve semptomları açısından yakından izlenmelidir.
Disemine intravasküler koagülasyon (DİK) ve kapiller kaçış sendromu (KKS, örn. hipotansiyon, hipoalbüminemi, ödem ve hemokonsantrasyon) yaygın olarak SSS ile ilişkilendirilmiştir (bkz. Bölüm 4.8). Kapiller kaçış sendromu ortaya çıkan hastalar hemen tedavi edilmelidir.
SSS koşullarında hemofagositik histiositoz/makrofaj aktivasyonu sendromu (MAS) nadiren
bildirilmiştir.
İnfüzyon reaksiyonları klinik açıdan sitokin salıverilme sendromunun (SSS) belirtilerinden ayırt edilemeyecek nitelikte olabilir (bkz. Bölüm 4.8). İnfüzyon reaksiyonları genellikle hızla gelişerek, infüzyon başladıktan sonraki 48 saat içinde ortaya çıkmıştır. Ancak, bazı hastalarda infüzyon reaksiyonu başlangıcının geciktiği veya sonraki döngülerde ortaya çıktığı kaydedilmiştir. Hastalar özellikle birinci ve ikinci tedavi döngüsünün başlatılması sırasında infüzyon reaksiyonları için yakın gözlem altında tutulmalı ve uygun tedavi uygulanmalıdır. Ateş yükselmesini baskılamak için bir antipiretik ilacın (parasetamol gibi) kullanımı her tedavi döngüsünün ilk 48 saati sırasında önerilmektedir. İnfüzyon reaksiyonlarının yönetimi BLİNCYTO® uygulamasının geçici olarak kesilmesini veya bırakılmasını gerektirebilir (bkz. Bölüm 4.2). SSS riskini hafifletmek için BLİNCYTO®'yu (1. döngü, 1-7. günler) önerilen başlangıç dozunda başlatmak önemlidir (bkz. Bölüm 4.2).
Bu olayların yönetimi BLİNCYTO® uygulamasının geçici olarak kesilmesini veya bırakılmasını gerektirebilir (bkz. Bölüm 4.2).
Tümör Lizis Sendromu
BLİNCYTO® uygulanan hastalarda, hayatı tehdit edici veya ölümcül (≥ 4. derece) olabilen tümör lizis sendromu (TLS) gözlenmiştir.
BLİNCYTO® tedavisi sırasında TLS'nin önlenmesi ve tedavisi için, özellikle lökositoz düzeyi yüksek veya tümör yükü fazla olan hastalarda agresif hidrasyon ve anti-hiperürisemik tedaviler (allopurinol veya rasburikaz gibi) dahil olmak üzere uygun profilaktik önlemler alınmalıdır. Hastalar ilk infüzyondan sonraki 48 saat içinde böbrek fonksiyonu ile sıvı dengesinin takibi dahil olmak üzere TLS ile ilgili belirti veya semptomlar açısından yakından izlenmelidir. Klinik çalışmalarda, orta dereceli böbrek yetmezliği bulunan hastalarda TLS insidansının hafif böbrek yetmezliği bulunan veya böbrek fonksiyonu normal olan hastalara kıyasla daha yüksek olduğu görülmüştür. Bu olayların yönetimi BLİNCYTO® uygulamasının geçici olarak kesilmesini veya bırakılmasını gerektirebilir (bkz. Bölüm 4.2).
Nötropeni ve Febril Nötropeni
BLİNCYTO® uygulanan hastalarda hayatı tehdit edici olgular dahil olmak üzere nötropeni ve febril nötropeni gözlenmiştir. Özellikle ilk döngünün ilk 9 günü süresince olmak üzere, BLİNCYTO® infüzyonu sırasında laboratuvar parametreleri (akyuvar sayısı ve mutlak nötrofil sayısı dahil ancak bunlarla sınırlı olmamak üzere) rutin olarak izlenmeli ve uygun şekilde tedavi edilmelidir.
Karaciğer Enzimlerinde Yükselme
BLİNCYTO® tedavisi karaciğer enzimlerinde geçici yükselmeyle ilişkilendirilmiştir. Bu olayların büyük bölümü tedaviye başlandıktan sonraki ilk hafta içinde gözlenmiş ve BLİNCYTO® tedavisine ara verilmesini veya tedavinin kesilmesini gerektirmemiştir (bkz. Bölüm 4.8).
Özellikle ilk 2 döngünün ilk 48 saati içinde olmak üzere, BLİNCYTO® tedavisine başlanırken ve tedavi süresince alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), gama glutamil transferaz (GGT) ve total bilirubin düzeyleri izlenmelidir. Bu olayların yönetimi BLİNCYTO® uygulamasının geçici olarak kesilmesini veya bırakılmasını gerektirebilir (bkz. Bölüm 4.2).
Pankreatit
Klinik çalışmalarda veya pazarlama sonrası deneyimde BLİNCYTO® alan hastalarda yaşamı tehdit eden veya ölümcül pankreatit bildirilmiştir. Bazı vakalarda pankreatite yüksek dozda steroid tedavisi katkı yapmış olabilir.
Hastalar pankreatit belirti ve semptomları açısından yakından izlenmelidir. Hasta değerlendirmesi fizik muayene, serum amilaz ve serum lipaz için laboratuvar değerlendirmesi ile ultrason ve diğer uygun tanısal ölçümler gibi abdominal görüntülemeyi içerebilir. Pankreatitin yönetimi BLİNCYTO® uygulamasının geçici olarak kesilmesini veya bırakılmasını gerektirebilir (bkz. Bölüm 4.2).
Progresif Multifokal Lökoensefalopatiyi İçeren Lökoensefalopati
BLİNCYTO® alan hastalarda, özellikle önceden kraniyal radyoterapi ve anti-lösemik kemoterapi (sistemik yüksek doz metotreksat veya intratekal sitarabin dahil) almış olanlarda lökoensefalopati göstergesi olan kraniyal manyetik rezonans görüntüleme (MRG) değişiklikleri gözlenmiştir. Görüntüleme çalışmalarındaki bu değişikliklerin klinik anlamlılığı bilinmemektedir.
Progresif multifokal lökoensefalopati (PML) potansiyeli nedeniyle, hastalar belirtiler ve semptomlar açısından izlenmelidir. Şüpheli durumlarda, bir nörologla görüşme, beyin MRG ve beyin omurilik sıvısını (BOS) inceleme değerlendirilmelidir, bkz. Bölüm 4.8.
CD19-negatif Nüks
Nüks görülen ve BLİNCYTO® kullanan hastalarda CD19-negatif B-hücreli prekürsör ALL bildirilmiştir. Kemik iliği testi sırasında CD19 ekspresyonu değerlendirmesine özellikle dikkat edilmelidir.
ALL'den Akut Miyeloid Lösemiye (AML) Soy Geçişi
İlk tanıda immünofenotipik ve/veya sitogenetik anormallik saptanmayanlar da dahil olmak üzere, nüks görülen ve BLİNCYTO® kullanan hastalarda ALL'den AML'ye soy geçişi nadiren bildirilmiştir. Nüks görülen tüm hastalar AML varlığı açısından izlenmelidir.
İmmünizasyon
BLİNCYTO® tedavisi sırasında veya sonrasında canlı viral aşılar ile immünizasyonun güvenliliği araştırılmamıştır. BLİNCYTO® tedavisinin başlangıcından en az 2 hafta öncesinde, tedavi sırasında ve son tedavi döngüsünün ardından B lenfositler normal aralığa dönene kadar canlı virüs aşılarıyla aşılama önerilmez.
Gebelik döneminde blinatumomab maruziyetini takiben yeni doğanlarda B hücrelerinde potansiyel azalma olabileceği için, yeni doğanlar B hücresi azalması bakımından izlenmeli ve canlı virüs aşılarıyla yapılan aşılamalar bebeğin B hücresi sayısı düzelene kadar ertelenmelidir (bkz. Bölüm 4.6).
Kontrasepsiyon
Çocuk doğurma potansiyeli olan kadınlar BLİNCYTO® ile tedavi sırasında ve tedaviden sonra en az 48 saat süreyle kontrasepsiyon kullanmalıdır (bkz. Bölüm 4.6).
İlaç Hataları
BLİNCYTO® tedavisiyle ilgili ilaç hataları gözlenmiştir. İlaç hatalarının (yetersiz doz ve doz aşımı dahil) en aza indirgenmesi için, hazırlama (sulandırma ve seyreltme dahil) ve uygulama talimatlarına kesinlikle bağlı kalınması son derece önemlidir (bkz. Bölüm 4.2).
Sodyum İçeriği
Bu tıbbi ürün 24 saatlik infüzyonda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında âsodyum içermezâ.
İzlenebilirlik
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
BLİNCYTO® ile herhangi bir ilaç etkileşim çalışması yapılmamıştır. İnsan hepatositlerinde yapılan in vitro bir testin sonuçları BLİNCYTO®'nun CYP450 enzim aktivitelerini etkilemediğini düşündürmektedir.
BLİNCYTO® tedavisine başlanması, tedavinin ilk günlerinde geçici bir sitokin salıverilmesine yol açarak CYP450 enzimlerinin baskılanmasına neden olabilir. Dar bir terapötik indekse sahip CYP450 ve taşıyıcı substratlardan oluşan tıbbi ürünleri alan hastalar bu süre boyunca advers etkiler (örn. varfarin) veya ilaç konsantrasyonları (örn. siklosporin) açısından izlenmelidir. Eşzamanlı uygulanan tıbbi ürünün dozu gerektiğinde ayarlanmalıdır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar BLİNCYTO® ile tedavi sırasında ve tedaviden sonra en az 48 saat süreyle kontrasepsiyon kullanmalıdır (bkz. Bölüm 4.4).
Gebelik dönemi
BLİNCYTO® ile üreme toksisitesi çalışmaları yapılmamıştır. Farelerde yapılan bir embriyofetal gelişim toksisitesi çalışmasında, mürin vekil molekülü plasentaya geçmiş ve embriyotoksisite veya teratojenisiteye neden olmamıştır (bkz. Bölüm 5.3). Gebe farelerde, B ve T hücrelerinde beklenen azalmanın olduğu görülmüş ancak fetuslardaki hematolojik etkiler değerlendirilmemiştir.
BLİNCYTO®'nun gebe kadınlarda kullanımına ilişkin herhangi bir veri mevcut değildir. BLİNCYTO®'nun potansiyel faydası fetüsün potansiyel riskine ağır basmadığı sürece gebelik
döneminde kullanılmamalıdır.
Gebelik sırasında maruziyet durumunda, ürünün farmakolojik özellikleri nedeniyle yenidoğanlarda B hücrelerinin azalması beklenebilir. Sonuç olarak, yenidoğanlar B hücresi azalması bakımından izlenmeli ve canlı virüs aşılarıyla yapılan aşılamalar bebeğin B hücresi sayısı düzelene kadar ertelenmelidir (bkz. Bölüm 4.4).
Laktasyon dönemi
BLİNCYTO®'nun veya metabolitlerinin insanlarda anne sütüne geçip geçmediği bilinmemektedir. FARMAKOLOJİK ÖZELLİKLERinden ötürü, anne sütü alan bir çocuğa yönelik risk göz ardı edilemez. Sonuç olarak, tedbir amaçlı bir önlem yaklaşımıyla, BLİNCYTO® ile tedavi sırasında ve tedaviden en az 48 saat sonra emzirmek kontrendikedir.
Üreme yeteneği/Fertilite
BLİNCYTO®'nun fertilite üzerindeki etkilerinin değerlendirilmesine yönelik bir çalışma yapılmamıştır. Mürin vekil molekülü kullanılarak yapılan 13 haftalık toksisite çalışmalarında erkek ya da dişi farelerin üreme organlarında herhangi bir etki yoktur (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
BLİNCYTO® araç ve makine kullanımı becerisi üzerinde yüksek düzeyli bir etkiye sahiptir. Konfüzyon ve yönelim bozukluğu, koordinasyon ve denge bozuklukları, nöbet riski ve bilinç bozuklukları ortaya çıkabilir (bkz. Bölüm 4.4). Nörolojik olay potansiyeli nedeniyle, BLİNCYTO® uygulanan hastalar BLİNCYTO® tedavisi süresince araç kullanmaktan ve ağır
veya potansiyel olarak tehlikeli makine kullanımı gibi tehlikeli iş ve faaliyetlerden uzak durmalıdır. Hastalara nörolojik olaylarla karşılaşabilecekleri konusunda bilgi verilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Bu bölümde tanımlanan advers reaksiyonlar B-hücreli prekürsör ALL hastalarla (N = 1045) yapılan klinik çalışmalar ile tanımlanmıştır .
BLİNCYTO® tedavisi esnasında oluşabilecek en ciddi advers reaksiyonlar: enfeksiyonlar (%22,6), nörolojik olaylar (%12,2), nötropeni/febril nötropeni (%9,1), sitokin salıverilme sendromu (%2,7) ve tümör lizis sendromunu (%0,8) içermektedir.
En yaygın advers reaksiyonlar şunlardır: pireksi (%70,8), enfeksiyonlar â patojen belirsiz (%41,4), infüzyonla ilgili reaksiyonlar (%33,4), baş ağrısı (%32,7), bulantı (%23,9), anemi
(%23,3), trombositopeni (%21,6), ödem (%21,4), nötropeni (%20,8), febril nötropeni
(%20,4), , diyare (%19,7), kusma (%19,0), döküntü (%18,0), karaciğer hepatik enzimlerinde
artış (%17,2), öksürük (%15,0), bakteriyel enfeksiyon bozuklukları (%14,1), titreme (%14,1),
sitokin salıverilme sendromu (%13,8), lökopeni (%13,8), kabızlık (%13,5), immünoglobulinlerde azalma (%13,4), viral enfeksiyon bozuklukları (%13,3), hipotansiyon (%13,0), sırt ağrısı (%12,5), ürperme (%11,7), karın ağrısı (%10,6), taşikardi (%10,6), insomnia (%10,4), ekstremitede ağrı (%10,1) ve mantar enfeksiyonu bozuklukları (%9,6).
Advers reaksiyonların tablo halinde listesi
Aşağıda verilmiş olan advers reaksiyonlar sistem organ sınıfları ve sıklıklarına göre sınıflandırılmıştır. Sıklık kategorileri, B-hücreli prekürsör ALL hastalarının yer aldığı klinik çalışmalarda her bir advers reaksiyon için bildirilen ham insidans oranına göre belirlenmiştir (N = 1045). Her bir sistem organ sınıfının içinde, advers reaksiyonlar azalan ciddiyet sırasına göre sunulmaktadır.
Advers reaksiyonların insidansı, sistem organ sınıfları ve sıklık esas alınarak aşağıda listelenmiştir. Sıklık şu şekilde tanımlanır: Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1: Advers reaksiyonların tablo halinde listesi
MedDRA sistem organ sınıfı | Çok yaygın | Yaygın | Nadir |
Enfeksiyonlar ve enfestasyonlar | Bakteriyel enfeksiyonlar Viral enfeksiyonlar Enfeksiyonlar - patojen belirtilmemiş | Sepsis Pnömoni Fungal enfeksiyonlar |
|
Kan ve lenfatik sistem hastalıkları | Febril nötropeni Anemi Nötropeni Trombositopeni Lökopeni | Lökositoz Lenfopeni | Lenfadenopati Hematofajik histiyositoz |
İmmün sistem | Sitokin salıverilme | Hipersensitivite | Sitokin fırtınası |
MedDRA sistem organ sınıfı | Çok yaygın | Yaygın | Nadir |
hastalıkları | sendromu |
|
|
Metabolizma ve beslenme hastalıkları |
| Tümör lizis sendromu |
|
Psikiyatrik hastalıklar | Uykusuzluk | Konfüzyon durumu Dezoryantasyon |
|
Sinir sistemi hastalıkları | Baş ağrısı Tremor | Ensefalopati Afazi Parestezi Nöbet Kognitif bozukluk Bellek bozukluğu Sersemlik Somnolans Hipoestezi Kraniyal sinir bozukluğu Ataksi | Konuşma bozukluğu |
Kardiyak hastalıklar | Taşikardi |
|
|
Vasküler hastalıklar | Hipotansiyon Hipertansiyon | Ateş basması | Kapiller kaçış sendromu |
Respiratuvar, torasik ve mediastinal hastalıklar | Öksürük | Dispne Balgamlı öksürük Solunum yetmezliği Hırıltılı solunum | Egzersiz dispnesi Akut solunum yetmezliği |
Gastrointestinal hastalıklar | Bulantı Kabızlık Diyare Karın ağrısı Kusma |
| Pankreatit |
Hepatobiliyer bozukluklar |
| Hiperbilirubinemi |
|
Deri ve deri altı doku hastalıkları | Döküntü |
|
|
Kas-iskelet ve bağ dokusu hastalıkları | Sırt ağrısı Ekstremite ağrısı | Kemik ağrısı |
|
Genel hastalıklar ve uygulama bölgesindeki durumlar | Pireksi Ödem Soğuk algınlığı | Göğüs ağrısı Ağrı |
|
Araştırmalar | Hepatik enzim artışı İmmünoglobulinlerde azalma | Kilo alma Kan alkalen fosfataz değerinde artış |
|
Yaralanma, zehirlenme ve prosedür ile ilgili komplikasyonlar | İnfüzyon ile ilgili reaksiyonlar |
|
|
a Ek bilgi âSeçilmiş advers reaksiyonların tanımlanmasıâ bölümünde verilmiştir.
b MedDRA Yüksek Seviye Grup Koşulları (MedDRA Versiyon 23,0).
Aynı tıbbi kavramı veya durumu temsil eden olay terimleri birlikte gruplanmış ve yukarıdaki tabloda tek bir advers reaksiyon olarak bildirilmiştir. İlgili advers reaksiyona katkıda bulunan terimler aşağıda belirtilmiştir:
1 Anemi, anemiyi ve hemoglobin düzeyinde azalmayı içerir.
2 Nötropeni, nötropeniyi ve nötrofil sayısında azalmayı içerir.
3 Trombositopeni, platelet sayısında azalmayı ve trombositopeniyi içerir.
4 Lökopeni, lökopeniyi ve akyuvar sayısında azalmayı içerir.
5 Lökositoz, lökositozu ve akyuvar sayısında artışı içerir.
6 Lenfopeni, lenfosit sayısında azalmayı ve lenfopeniyi içerir.
7 Taşikardi; sinüs taşikardisi, supraventriküler taşikardi, taşikardi, atriyal taşikardi ve ventriküler taşikardiyi içerir.
8 Hipotansiyon, kan basıncında azalmayı ve hipotansiyonu içerir.
9 Hipertansiyon, kan basıncında yükselmeyi ve hipertansiyonu içerir.
10 Hiperbilirubinemi, kan bilirubin düzeyinde artışı ve hiperbilirubinemiyi içerir.
11 Döküntü; eritem, döküntü, eritematöz döküntü, yaygın döküntü, maküler döküntü, makülopapüler döküntü, kaşıntılı döküntü, kateter yerinde döküntü, püstüler döküntü, genital döküntü, papüler döküntü ve veziküler döküntüyü içerir.
12 Ateş/pireksi, vücut sıcaklığında artışı ve ateşi içerir.
13 Ödem; kemik iliği ödemi, periorbital ödem, göz kapağında ödem, gözde ödem, dudak ödemi, yüz ödemi, lokalize ödem, yaygın ödem, ödem, periferik ödem, infüzyon yerinde ödem, ödemli böbrek, skrotal ödem, genital ödem, akciğer ödemi, laringeal ödem, anjioödem, ağız çevresinde ödem ve lenfödemi içerir.
14 Göğüs ağrısı; göğüste rahatsızlık hissini, göğüs ağrısını, göğüste kas-iskelet ağrısını ve kardiyak olmayan göğüs ağrısını içerir.
15 Hepatik enzim artışı; alanin aminotransferaz artışı, aspartat aminotransferaz artışı, gama- glutamiltransferaz artışı, karaciğer enzimlerinde artış, karaciğer fonksiyon testlerinde artış ve transaminaz artışını içerir.
16 İmmünoglobulinlerde azalma; kan immünoglobulin G düzeyinde azalma, kan immünoglobulin A düzeyinde azalma, kan immünoglobulin M düzeyinde azalma, globulinlerde azalma, hipogamaglobulinemi, hipoglobulinemi ve immünoglobulinlerde azalmayı içerir.
17 İnfüzyonla ilişkili reaksiyonlar, infüzyonla ilişkili reaksiyon terimi ile infüzyondan sonraki ilk 48 saat içinde meydana gelen ve ≤2 gün süren aşağıdaki olayları içeren birleşik bir terimdir: ateş, sitokin salıverilme sendromu, hipotansiyon, miyalji, akut böbrek hasarı, hipertansiyon, döküntü, takipne, yüzde şişme, yüzde ödem ve eritemöz döküntü.
Seçilmiş advers reaksiyonların tanımlanması
Nörolojik olaylar
BLİNCYTO® ile tedavi alan Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL hastalarının yer aldığı randomize faz III klinik çalışmada (N = 267) ve tek tedavi kollu faz II klinik çalışmada (N = 189), hastaların %66,0'sında primer olarak MSS içeren bir veya birden fazla (psikiyatrik hastalıklar da dahil) nörolojik advers reaksiyon gözlenmiştir. En yaygın olarak ensefalopati, tremor, afazi ve konfüzyonal durumu içeren ciddi ve derece ≥ 3 nörolojik advers reaksiyonlar hastaların sırasıyla %11,6 ve %12,1'inde izlenmiştir. Nörolojik olayların büyük çoğunluğu (%80,5) klinik olarak geri dönüşümlüdür ve BLİNCYTO®'nin kesilmesiyle düzelmektedir. İlk nörolojik olayın başlangıcına kadar geçen
ortalama süre tedavinin ilk iki haftası içindedir. Tek kollu klinik faz II çalışmasının erken aşamalarında bir ölümcül ensefalopati vakası bildirilmiştir.
Philadelphia kromozomu pozitif nükseden veya dirençli B-hücreli prekürsör ALL tanılı yetişkin hastaların %62,2'sinde nörolojik olaylar bildirilmiştir (N = 45). Ciddi ve ≥3. derece nörolojik olayların her biri, Philadelphia kromozomu pozitif nükseden veya dirençli B-hücreli prekürsör ALL olan yetişkin hastalarda %13,3 oranında bildirilmiştir.
MRH pozitif B-hücreli prekürsör ALL tanılı yetişkin hastaların %71,5'inde (N = 137) nörolojik olaylar bildirilmiş, hastaların %22,6'sında ciddi olaylar meydana gelmiştir. MRH pozitif B-hücreli prekürsör ALL olan yetişkin hastaların sırasıyla %16,1 ve %2,2'sinde ≥3. derece ve ≥ 4. derece olaylar bildirilmiştir.
Nörolojik olayların klinik yönetimi için Bölüm 4.4'e bakınız. Enfeksiyonlar
BLİNCYTO® ile tedavi olan hastalarda hayatı tehdit eden veya ölümcül (derece ≥ 4) viral, bakteriyel ve fungal enfeksiyonlar rapor edilmiştir. Ek olarak, Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL yetişkin hastalarda yapılan faz II klinik çalışmasında virüs enfeksiyonlarının reaktivasyonu (örn. Polyoma (BK)) gözlenmiştir. ECOG performans seviyesi başlangıç değeri 2 olan Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL vakalarında, ECOG performans seviyesi < 2 olanlar ile karşılaştırıldığında daha yüksek insidansta ciddi enfeksiyonların görüldüğü saptanmıştır. Enfeksiyonların klinik yönetimi için Bölüm 4.4'e bakınız.
Sitokin salıverilme sendromu (SSS)
BLİNCYTO® ile tedavi alan Philadelphia kromozomu negatif nükseden veya dirençli B- hücreli prekürsör ALL hastalarının yer aldığı randomize faz III klinik çalışmada (N = 267) ve tek tedavi kollu faz II klinik çalışmada (N = 189), hastaların %14,7'sinde SSS meydana gelmiştir. Hastaların %2,4'ünde ortalama başlangıç zamanı 2 gün olan ciddi SSS reaksiyonları rapor edilmiştir.
Philadelphia kromozomu pozitif nükseden veya dirençli B-prekürsör ALL tanılı yetişkin hastaların %8,9'unda (N = 45) sitokin salıverilme sendromu bildirilmiş, hastaların %2,2'sinde ciddi olaylar meydana gelmiştir. Herhangi bir ≥3. veya ≥4. derece olay bildirilmemiştir.
MRH pozitif B-hücreli prekürsör ALL tanılı yetişkin hastaların %2,9'unda sitokin salıverilme sendromu bildirilmiştir (N = 137). Ciddi ve 3. derece olayların her biri MRH pozitif B-hücreli prekürsör ALL olan yetişkin hastaların %1,5'inde bildirilmiş; ≥4. derece olay bildirilmemiştir.
Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL olan yetişkin hastaların faz II klinik çalışmasında yer alan 1 hastada ve MRH pozitif B-hücreli prekürsör ALL tanılı yetişkin hastaların faz II klinik çalışmasında yer alan 1 hastada kapiller kaçış sendromu gözlenmiştir. Philadelphia kromozomu pozitif nükseden veya dirençli B- hücreli prekürsör ALL hastalarının faz II klinik çalışmasında yer alan yetişkin hastalarda kapiller kaçış sendromu gözlenmemiştir.
SSS'nin klinik yönetimi için Bölüm 4.4'e bakınız.
Karaciğer enzimlerinde yükselme
BLİNCYTO® ile tedavi alan Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL hastalarının yer aldığı randomize faz III klinik çalışmada (N = 267) ve tek tedavi kollu faz II klinik çalışmada (N = 189), vakaların %22,4'ünde yüksek karaciğer enzimleri ve ilişkili belirti/semptomlar rapor edilmiştir. Hastaların sırasıyla %1,5 ve
%13,6'sında ciddi ve ≥ 3. derece advers reaksiyonlar (ALT artışı, AST artışı ve kan bilirubin düzeyinde artış gibi) gözlenmiştir. İlk olayın ortalama başlangıç zamanı BLİNCYTO® tedavisinin başlangıcından itibaren 4 gündür.
Philadelphia kromozomu pozitif nükseden veya dirençli B-prekürsör ALL tanılı yetişkin hastaların %17,8'inde (N = 45) karaciğer enziminde yükselme olayları bildirilmiş, hastaların
%2,2'sinde ciddi olaylar meydana gelmiştir. Philadelphia kromozomu pozitif nükseden veya dirençli B-prekürsör ALL olan yetişkin hastaların sırasıyla %13,3 ve %6,7'sinde ≥3. derece ve ≥4. derece olaylar bildirilmiştir.
MRH pozitif B-hücreli prekürsör ALL tanılı yetişkin hastaların %12,4'ünde karaciğer enziminde yükselme olayları bildirilmiştir (N = 137). MRH pozitif B-hücreli prekürsör ALL tanılı yetişkin hastaların sırasıyla %8,0 ve %4,4'ünde ≥ 3. derece ve ≥ 4. derece olaylar bildirilmiştir.
Hepatik advers reaksiyonların süresi genellikle kısadır ve sıklıkla BLİNCYTO® tedavisinin
kesilmesiyle hızla iyileşir.
Karaciğer enzimlerinde yükselmenin klinik yönetimi için Bölüm 4.4'e bakınız.
Pankreatit
Klinik çalışmalarda veya pazarlama sonrası deneyimde BLİNCYTO® alan hastalarda yaşamı tehdit eden veya ölümcül pankreatit bildirilmiştir. Medyan ortaya çıkma süresi 7,5 gündür. Pankreatitin klinik yönetimi için Bölüm 4.4'e bakınız.
Progresif multifokal lökoensefalopatiyi içeren lökoensefalopati
Lökoensefalopati rapor edilmiştir. Lökoensefalopatili vakalarda beyin MRG/CT bulguları ile sabit konfüzyonal durum, tremor, kognitif bozukluklar, ensefalopati ve konvülziyonu içeren ciddi yan etkiler gözlenmiştir. Progresif multifokal lökoensefalopatinin (PML) gelişmesi için bir potansiyel olmasına rağmen, klinik çalışmalarda teyit edilmiş PML vakası hiç rapor edilmemiştir.
İmmünojenisite
Klinik çalışmalarda, BLİNCYTO® ile tedavi edilen yetişkin ALL'li hastaların %3'ünden daha azında anti-blinatumomab antikor testinde pozitif sonuç elde edilmiştir. Bu hastaların 6'sında in vitro nötralize edici aktiviteye sahip anti-blinatumomab antikoru vardı. BLİNCYTO® ile tedavi edilen nükseden veya dirençli pediyatrik ALL'li hastalarla yapılan klinik çalışmalarda hiçbir anti-blinatumomab antikoru tespit edilmemiştir.
Klinik olarak anlamlı etkiye sahip nötralize edici antikor oluşumundan şüphe edilen durumlarda antikor testi yapılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
BLİNCYTO® nükseden veya dirençli prekürsör B-hücreli ALL'li çocuklarda, 7 aylıktan 17 yaşına kadar 70 pediyatrik hastanın önerilen doz rejimi ile tedavi edildiği bir tek kollu faz I/II doz araştırma/değerlendirme çalışması (MT103-205) ile incelenmiştir.
En sık bildirilen ciddi advers olaylar ateş (%11,4), febril nötropeni (%11,4), sitokin salıverilme sendromu (%5,7), sepsis (%4,3), cihazla ilgili enfeksiyon (%4,3), doz aşımı (%4,3), konvülziyon (%2,9), solunum yetmezliği (%2,9), hipoksi (%2,9), pnömoni (%2,9) ve çoklu organ yetmezliği (%2,9) olmuştur.
BLİNCYTO® ile tedavi alan pediyatrik hastalardaki advers reaksiyonlar, tip açısından yetişkin hastalarda görülenlere benzer bulunmuştur. Yetişkin popülasyona kıyasla pediyatrik popülasyonda daha sık görülen (≥ %10 fark) advers reaksiyonlar arasında anemi, trombositopeni, lökopeni, ateş, infüzyonla ilişkili reaksiyonlar, kilo alma ve hipertansiyon yer almıştır.
Advers olayların tipi ve sıklığı, farklı pediyatrik alt gruplar genelinde (cinsiyet, yaş ve coğrafi bölge) benzerlik sergilemiştir.
Çalışmada (MT103-205), önerilen dozdan daha yüksek dozlarda, hayatı tehdit eden sitokin salıverilme sendromu (SSS) ve tümör lizis sendromu (TLS) zemininde bir ölümcül kardiyak hastalık meydana gelmiştir, bkz. Bölüm 4.4.
BLİNCYTO® 1 ile 18 yaşları arasındaki 54 hastanın ilk kez nüks görülen yüksek riskli B-hücreli prekürsör ALL için önerilen dozaj rejimiyle tedavi edildiği randomize, kontrollü, açık etiketli bir faz III çalışmada (20120215) ilk kez nüks görülen yüksek riskli B-hücreli prekürsör ALL'li pediyatrik hastalarda da değerlendirilmiştir. BLİNCYTO®'nun 20120215 çalışmasındaki güvenlilik profili nükseden ya da dirençli B-hücreli prekürsör ALL popülasyonuyla daha önce yapılan çalışmalarla tutarlıdır.
Diğer özel popülasyonlar
≥ 75 yaş ve üstü hastalarda BLİNCYTO® ile yapılan çalışmalar sınırlıdır. Genellikle, güvenlilik; BLİNCYTO® ile tedavi gören yaşlı hastalar (≥ 65 yaş) ve 65 yaştan daha genç olan hastalar arasında benzerdir. Ancak, yaşlı hastalar kognitif bozukluk, ensefalopati ve konfüzyon gibi ciddi nörolojik olaylara daha elverişlidirler.
BLİNCYTO® ile tedavi alan yaşlı MRH pozitif ALL hastalarında hipogamaglobulinemi riski, genç hastalara kıyasla daha yüksek olabilir. BLİNCYTO® ile tedavi sırasında yaşlı hastaların immünoglobulin düzeylerinin izlenmesi önerilir.
Ciddi böbrek yetmezliği bulunan hastalarda BLİNCYTO® ile ilgili yapılmış çalışma bulunmamaktadır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Kısa süre içinde BLİNCYTO®'nun önerilen terapötik dozunun 133 katının uygulandığı bir hasta dahil olmak üzere, doz aşımı olguları gözlenmiştir. Doz aşımı olayları önerilen terapötik doz ile gözlenen reaksiyonlarla tutarlı advers reaksiyonlar olmuş, bunlar arasında ateş, tremor ve baş ağrısı yer almıştır. Doz aşımı durumunda infüzyona geçici olarak ara verilmeli ve hastalar yakından izlenmelidir. Tüm toksisite ortadan kalktığında, infüzyonun kesilmesinden sonra 12 saatten daha erken bir süre olmamak üzere BLİNCYTO®'nun doğru terapötik dozda yeniden başlatılması düşünülmelidir (bkz. Bölüm 4.2).
Sulandırırken ve infüzyondan önce sulandırılmış çözeltiyi partikül madde varlığı ve renk değişimi açısından görsel olarak inceleyiniz. Ortaya çıkan çözelti berrak ya da hafif mat, renksiz ila hafif sarı renkte olmalıdır.
Çözelti bulanıksa ya da içinde çökelti varsa kullanmayınız.
BLİNCYTO'nun hazırlanması
Her BLİNCYTO® infüzyon torbası için reçete edilen dozu ve infüzyon süresini doğrulayınız. En az hata için, BLİNCYTO® infüzyon torbasını hazırlarken Tablo 12 ve 13'te açıklanan spesifik hacimleri kullanınız.
45 kg ve üzeri hastalar için Tablo 12
45 kg'ın altındaki hastalar için Tablo 13
Aseptik koşullar altında, IV boruları steril 0,2 mikron hat içi filtreyle IV torbasına bağlanır. İntravenöz hortumun infüzyon pompası ile uyumlu olduğundan emin olunmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, diğer antineoplastik ajanlar ATC kodu: L01FX07
Etki mekanizması
Blinatumomab, özellikle B hücre serisinden gelen hücrelerin yüzeyinde eksprese edilen CD19'a ve T hücresi yüzeyinde eksprese edilen CD3'e bağlanan bispesifik bir T hücresi bağlayıcı (BiTE®) moleküldür. T hücresi reseptör kompleksindeki (TCR) CD3 ile benign ve malign B hücrelerinde bulunan CD19'u bağlayarak endojen T hücrelerini aktive etmektedir. Blinatumomab immünoterapisinin anti-tümör aktivitesi özgün bir TCR'ye sahip olan T hücrelerine veya kanser hücrelerinin sunduğu peptid antijenlere bağlı değildir; ancak, poliklonal yapılıdır ve hedef hücrelerdeki insan lökosit antijeninden (HLA) bağımsızdır. Blinatumomab T hücresi ile tümör hücresi arasındaki sitolitik sinapsın oluşmasına aracılık etmekte, prolifere olan hücrelerin ve istirahatte olan hedef hücrelerin öldürülmesi için proteolitik enzimlerin salımını sağlamaktadır. Blinatumomab hücre adezyonu moleküllerinin geçici up-regülasyonuyla, sitolitik proteinlerin üretimiyle, inflamatuvar sitokinlerin salıverilmesiyle ve T hücrelerinin poliferasyonuyla ilişkilidir ve CD19+ hücrelerinin eliminasyonuna yol açmaktadır.
Farmakodinamik etkiler
Çalışılan hastalarda tutarlı immün-farmakodinamik yanıtlar gözlenmiştir. 4 haftanın üzerinde devamlı infüzyon tedavisi esnasında, farmakodinamik yanıt; T-hücre aktivasyonu ve başlangıç redistribüsyon, ani periferal B-hücre azalması ve geçici sitokin yüksekliği ile karakterizedir.
Periferal T hücre redistribüsyonu (örn. kan damarları endoteline T hücre adezyonu ve/veya dokuya transmigrasyon) BLİNCYTO® infüzyonunun başlangıcında veya doz artırımında oluşmaktadır. T hücre sayısı başlangıçta 1 ila 2 gün içinde azalır ve daha sonra hastaların büyük çoğunluğunda 7 ila 14 gün arasında bazal seviyelere geri döner. T hücre sayısının bazalın üzerine çıkması (T hücre ekspansiyonu) birkaç hastada gözlenmiştir.
Hastaların büyük çoğunluğunda ≥ 5 mcg/m2/gün veya ≥ 9 mcg/gün dozlarındaki tedavi süresince periferal B hücre sayısı, aniden ölçülemeyen seviyeye düşer. Periferal B hücre sayısında tedavi döngüleri arasındaki 2 haftalık tedavi verilmeyen dönem süresince hiçbir iyileşme gözlenmemiştir. B hücrelerinde tamamlanmamış düşüş, 0,5 mcg/m2/gün ve 1,5 mcg/m2/gün dozlarda ve yüksek dozlarda birkaç yanıtsızda görülmektedir.
Periferal lenfositler pediyatrik hastalarda ölçülmemiştir.
IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, TNF-α, ve IFN-γ içeren sitokinler ölçülmüştür ve IL-6, IL-10 ve IFN-γ daha çok yükselmiştir. Sitokinlerdeki geçici yükseklik BLİNCYTO® infüzyonunun başlangıcını takiben ilk 2 günde gözlenmiştir. Yüksek sitokin seviyeleri infüzyon süresince 24 ila 48 saat içinde bazal seviyeye dönmektedir. Sonraki tedavi sikluslarında sitokin artışı, birkaç hastada birinci tedavi siklusunun ilk 48 saati ile karşılaştırıldığında daha az şiddetli olmuştur.
Klinik etkililik ve güvenlilik
Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL
Aşağıda tanımlanan faz II ve faz III klinik çalışmalarda nüks veya yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL) bulunan, en az 18 yaşında olan toplam 456 hastaya BLİNCYTO® verilmiştir.
BLİNCYTO®'nun güvenlilik ve etkililiği standart kemoterapiye (SOC) kıyasla açık etiketli, çok merkezli bir faz III çalışmada (TOWER) değerlendirilmiştir. Uygun olarak değerlendirilen hastalar ≥ 18 yaşında ve ECOG durumu ≤ 2 olan, nükseden veya dirençli B-prekürsör ALL hastalarıdır (kemik iliğinde > %5 blast bulunan ve allojenik HKHN'den sonra herhangi bir zamanda nüks görülen, ilk remisyon süresi < 12 ay olmak üzere ilk nüksün tedavi edilmemiş olduğu veya son tedaviye direnç görülen hastalar).
Hastalar BLİNCYTO® veya önceden belirlenmiş, araştırmacı tarafından seçilen, 4 SOC temel kemoterapi rejiminden 1'ini almak üzere 2:1 oranında randomize edilmiştir. Randomizasyon, yaşa (< 35 yaş ve ≥ 35 yaş), önceki kurtarma tedavisine (evet ve hayır) ve olur verildiği zaman değerlendirildiği üzere önceden allojenik HKHN durumuna (evet ve hayır) göre gruplanmıştır. Demografik özelliklerin ve başlangıç özelliklerinin iki tedavi kolu arasında iyi dengeli olduğu görülmüştür (bkz. Tablo 2).
Tablo 2: Faz III çalışmasındaki (TOWER) demografi ve başlangıç özellikleri
Özellik | BLİNCYTO (N = 271) | Standard Kemoterapi (N = 134) |
Yaş | ||
Medyan, yıl (min, maks.) | 37 (18; 80) | 37 (18; 78) |
Ortalama, yıl (SS) | 40,8 (17,1) | 41,1 (17,3) |
≥ 65 yaş, n (%) | 33 (12,2) | 15 (11,2) |
Önceki kurtarma tedavisi | 164 (60,5) | 80 (59,7) |
0 | 114 (42,1) | 65 (48,5) |
1 | 91 (33,6) | 43 (32,1) |
≥ 2 | 66 (24,3) | 26 (19,4) |
Önceki allo-HKHN | 94 (34,7) | 46 (34,3) |
ECOG Durumu - n (%) |
|
|
0 | 96 (35,4) | 52 (38,8) |
1 | 134 (49,4) | 61 (45,5) |
2 | 41 (15,1) | 20 (14,9) |
Direnç durumu - n (%) |
|
|
Özellik | BLİNCYTO (N = 271) | Standard Kemoterapi (N = 134) |
Birincil refrakter | 46 (17,0) | 27 (20,1) |
Kurtarma tedavisine refrakter | 87 (32,1) | 34 (25,4) |
Maksimum santral/lokal kemik iliği blastı - n (%) |
|
|
≥ %50 | 201 (74,2) | 104 (77,6) |
allo-HKHN = allojenik hematopoietik kök hücre nakli SOC = standart kemoterapi | ||
BLİNCYTO® sürekli IV infüzyon olarak uygulanmıştır. İlk döngüde başlangıç dozu 1 hafta süreyle 9 mcg/gün, sonrasında 3 hafta süreyle 28 mcg/gün olmuştur. Hedef doz olan 28 mcg/gün 2. döngüde ve sonraki döngülerde her bir döngünün 1. gününde başlanarak kullanılmıştır. Advers olay gelişmesi halinde doz ayarlaması yapılmasına izin verilmiştir. BLİNCYTO® alan 267 hastada tamamlanan tedavi döngülerinin ortalama sayısı 2,0 olurken; SOC kemoterapi alan 109 hastada tedavi döngülerinin ortalama sayısı 1,3 olmuştur.
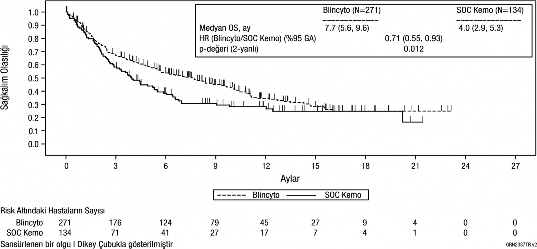
Primer sonlanım noktası olarak genel sağkalım (GS) değerlendirilmiştir. Medyan GS, SOC kemoterapi kolunda 4,0 ay (%95 GA: 2,9; 5,3), BLİNCYTO® kolunda ise 7,7 ay (%95 GA: 5,6; 9,6) olmuştur. Tedavi kolları arasındaki tehlike oranı (%95 GA) BLİNCYTO® lehine olmak üzere 0,71 (0,55; 0,93) olmuş ve BLİNCYTO® kolunda tehlike oranında %29'luk bir azalma olduğunu göstermiştir (p değeri = 0,012 [gruplanmış log-sıra testi]), bkz. Şekil 1. GS bulgularındaki tutarlılık, gruplama faktörlerine göre alt gruplarda da gösterilmiştir.
HKHN zamanında sansürleme yapıldıktan sonra tutarlı bulgular gözlenmiş; HKHN zamanında sansürlenen medyan GS, BLİNCYTO® grubunda 6,9 ay (%95 GA: 5,3; 8,8) ve
SOC grubunda 3,9 ay (%95 GA: 2,8; 4,9) olmuştur (HR, 0,66; %95 GA: 0,50; 0,88; p değeri
= 0,004). Anti-lösemik tedavi almayan tüm yanıt verenler arasında allo-HKHN sonrası mortalite oranı BLİNCYTO® grubunda 10/38 (%26,3; %95 GA: 13,4; 43,1) ve SOC
grubunda 3/12 (%25; %95 GA: 5,5; 57,2) olarak saptanmış; allo-HKHN'den 100 gün sonra
bu mortalite oranı BLİNCYTO® grubunda 4/38 (%12,4; %95 GA: %4,8, %29,9) ve SOC grubunda 0/12 (%0; %95 GA: hesaplanmayan değer) şeklinde kaydedilmiştir. Çalışmadaki diğer temel sonlanım noktalarında elde edilen etkililik bulguları Tablo 3'de özetlenmiştir.
Şekil 1. Kaplan-Meier Genel Sağkalım Eğrisi
Tablo 3: Philadelphia kromozomu negatif nüksetmiş veya yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL) bulunan, en az 18 yaşındaki hastalara ilişkin etkililik bulguları (TOWER)
| BLİNCYTO (N = 271) | Standart Kemoterapi (N = 134) |
Tam remisyon (CR) | ||
CR/CRh*/CRi, n (%) [%95 GA] | 119 (43,9) (37,9; 50,0) | 33 (24,6) (17,6; 32,8) |
Tedavi farkı [%95 GA] | 19,3 (9,9; 28,7) | |
p değeri | < 0,001 | |
CR, n (%) [%95 GA] | 91 (33,6) (28,0; 39,5) | 21 (15,7) (10,0; 23,0) |
Tedavi farkı [%95 GA] | 17,9 (9,6; 26,2) | |
p değeri | < 0,001 | |
Olaysız sağkalım | ||
6 aylık tahmin % [%95 GA] | 30,7 (25,0; 36,5) | 12,5 (7,2; 19,2) |
18 aylık tahmin % [%95 GA] | 9,5 (5,1; 15,6) | 7,9 (3,7; 14,2) |
Risk Oranı [%95 GA] | 0,55 (0,43; 0,71) | |
Hematolojik yanıt süresi- Olaya kadar geçen medyan süre [%95 GA] | ||
CR | 8,3 (5,7; 10,7) | 7,8 (2,2; 19,0) |
CR/CRh*/CRi | 7,3 (5,8; 9,9) | 4,6 (1,8; 19,0) |
CR/CRh*/CRi için MRH yanıtı | ||
MRH değerlendirilebilir hastalar (%) [%95 GA] | 74/97 (76,3) (66,6; 84,3) | 16/33 (48,5) (30,8; 66,5) |
MRH yanıt süresi- Olaya kadar geçen medyan süre [%95 GA] |
4,5 ay (3,6; 9,0) |
3,8 ay (1,9; 19,0) |
Başlangıç sonrası allo-HKHN - n (%) | ||
Toplam gönüllüler | 65 (24) | 32 (23,9) |
Hematolojik yanıt verenler (CR/CRh*/CRi) | 50 (42,0) | 18 (54,5) |
Nakil yapılan tüm hastalarda allo- HKHN'ye kadar geçen süre Olaya kadar geçen medyan süre (çeyrekler arası aralık) |
3,7 ay (3,0; 5,3) (N = 65) |
3,1 ay (2,6; 4,3) (N = 32) |
CR/CRh*/CRi yanıt verenlerde allo- HKHN'ye kadar geçen süre Olaya kadar geçen medyan süre [%95 GA] (KM tahmini) |
11,3 ay (5,2; NE) (N = 119) |
3,6 ay (2,3; 7,2) (N = 33) |
allo-HKHN'den sonra 100 günlük mortalite | ||
n/N (%), [%95 GA] | 4/38; 12,4% (4,8; 29,9) | 0/12; 0,0% (0.0; NE) |
a CR; kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının tam olarak iyileşmiş olması (trombosit > 100.000/mikrolitre ve mutlak nötrofil sayısı [ANC] > 1.000/mikrolitre) şeklinde tanımlanmıştır.
b CRh* (kısmi hematolojik iyileşmeyle tam remisyon); kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının kısmi olarak iyileşmiş olması (trombosit > 50.000/mikrolitre ve ANC > 500/mikrolitre) şeklinde tanımlanmıştır.
c CRi (yetersiz hematolojik iyileşmeyle tam remisyon); kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının yeterince iyileşmemiş olması (trombosit > 100.000/mikrolitre veya ANC > 1.000/mikrolitre) şeklinde tanımlanmıştır.
d Olaysız sağkalım süresi, randomizasyon zamanından CR/CRh*/CRi ulaşıldıktan sonra nüksü gösteren hastalık değerlendirme tarihi veya ölüme kadar (hangisi daha önceyse) hesaplanmıştır. Tedavi başladıktan sonra 12 hafta içinde CR/CRh*/CRi ulaşamayan gönüllüler, tedavi başarısızlığı olarak kabul edilir ve bunlara 1 günlük olaysız sağkalım (EFS) süresi atanır.
e MRH yanıtı, PCR veya akım sitometrisi < 1 Ã 10-4 olan MRH şeklinde tanımlanmıştır.
f CR/CRh*/CRi elde eden ve başlangıç sonrası değerlendirilebilir MRH değerlendirmesi
bulunan hastalar.
Sağlıkla İlişkili Yaşam Kalitesi
Hastalar tarafından bildirilen Sağlıkla İlişkili Yaşam Kalitesi (HRQoL), Avrupa Kanser Araştırma ve Tedavi Organizasyonu Yaşam Kalitesi Anketi â Çekirdek 30 (EORTC QLQ- C30) kullanılarak ölçülmüştür. Bir post-hoc duyarlılık analizinde, bakım standardına kıyasla BLİNCYTO®, global sağlık durumu [medyan BLİNCYTO® karşısında bakım standardı 8,1 aya karşılık 1,0 ay; Risk oranı = 0,60 (%95 GA = 0,42; 0,85)], fonksiyonel ölçekler, semptom ölçekleri ve bireysel öğelerde klinik olarak anlamlı HRQoL kötüleşmesine (başlangıca göre
≥ 10 puan kötüleşme) kadar geçen süreyi tutarlı olarak geciktirmiştir. Sağlıkla ilgili yaşam kalitesi sonuçları bir post hoc duyarlılık analizine dayalı olduğundan, sonuçlar dikkatle yorumlanmalıdır.
BLİNCYTO® ayrıca açık etiketli, çok merkezli ve tek tedavi kollu 189 hastalık bir faz II çalışmasında değerlendirilmiştir (MT103-211). En az 18 yaşında olup, Philadelphia kromozomu negatif nüks veya yanıtsız B-hücreli prekürsör ALL bulunan hastalar (ilk kurtarma tedavisinde ≤ 12 aylık remisyon süresiyle nüks gelişen veya ilk kurtarma tedavisinden sonra nüks gelişen ya da yanıtsız hale gelen veya allojenik HKHN sonraki 12 ay içinde nüks gelişen ve kemik iliğinde ≥ %10 blast bulunan) uygun olarak değerlendirilmiştir.
Premedikasyon, tedavi döngüsü başına BLİNCYTO® dozu ve uygulama yolunun, faz III çalışması ile aynı olması sağlanmıştır. Hastalara BLİNCYTO® tedavisine başlamadan önceki 1 hafta içinde kurumsal veya ulusal kılavuza göre bir intratekal rejimden oluşan zorunlu beyin-omurilik sıvısı profilaksisi ile premedikasyon uygulanmıştır. BLİNCYTO® sürekli IV infüzyon olarak uygulanmıştır. İlk döngüde başlangıç dozu 1 hafta süreyle 9 mcg/gün, sonrasında 3 hafta süreyle 28 mcg/gün olmuştur. Hedef doz olan 28 mcg/gün 2. döngüde ve sonraki döngülerde her bir döngünün 1. gününde başlanarak kullanılmıştır. Advers olay gelişmesi halinde doz ayarlaması yapılmasına izin verilmiştir. Tedavi edilen popülasyonda en az bir infüzyon BLİNCYTO® uygulanan 189 hasta yer almış; medyan tedavi döngülerinin sayısı 1,6 olmuştur. BLİNCYTO® tedavisine yanıt veren ancak sonradan nüks gelişen hastalara yeniden BLİNCYTO® tedavisi alma seçeneği sunulmuştur. Tedavi alan hastalar genelinde medyan yaşın 39 olduğu (aralık: 18 ila 79 yaş; 65 yaş ve üstü 25 hastayı içeriyor),
189 hastanın 64'üne (%33,9) BLİNCYTO® uygulanmadan önce HKHN yapılmış, 189 hastanın 32'si (%16,9) en az 2 kurtarma tedavisi almıştır.
Primer sonlanım noktası BLİNCYTO® tedavisinin iki döngüsü içindeki CR/CRh* oranı olmuştur. Değerlendirilebilen 189 hastanın seksen biri (%42,9) iki tedavi döngüsü içinde CR/CRh* elde etmiş, yanıtların büyük bölümü (81'de 64) tedavinin 1. döngüsünde ortaya
çıkmıştır. Yaşlı popülasyonda (≥ 65 yaş) 25 hastanın 11'i (%44,0) ilk 2 tedavi döngüsü içinde CR/CRh* elde etmiştir (yaşlılarda güvenlilik için bkz. Bölüm 4.8). Konsolidasyon döngülerinde dört hastada CR elde edilmiş, sonuç olarak kümülatif CR oranı %35,4 olmuştur (189'da 67; %95 GA: %28,6 - %42,7). BLİNCYTO® ile indüklenen CR/CRh* süresi içinde, 189 hastadan otuz ikisine (%17) allojenik HKHN yapılmıştır (bkz. Tablo 4).
Tablo 4: Philadelphia Kromozomu Negatif Nüks veya Yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL), en az 18 Yaşındaki Hastalara İlişkin Etkililik Bulguları (MT103-211)
| n (%) n = 189 | [%95 GA] |
Tam remisyon (CR)/Kısmi hematolojik iyileşmenin eşlik ettiği tam remisyon (CRh*) | 81 (%42,9) | [%35,7 - %50,2] |
CR | 63 (%33,3) | [%26,7 - %40,5] |
CRh* | 18 (%9,5) | [%5,7 - %14,6] |
Blastsız hipoplastik veya aplastik kemik iliği | 17 (%9,0) | [%5,3 - %14,0] |
Kısmi remisyon | 5 (%2,6) | [%0,9 - %6,1] |
CR/CRh* için medyan nüks gelişmeden sağkalım | 5,9 ay | [4,8 ila 8,3 ay] |
Medyan genel sağkalım | 6,1 ay | [4,2 ila 7,5 ay] |
1. CR kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının tam olarak iyileşmiş olması (trombosit > 100.000/mikrolitre ve mutlak nötrofil sayısı [ANC] > 1.000/mikrolitre) şeklinde tanımlanmıştır.
2. CRh* kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının kısmi olarak iyileşmiş olması (trombosit > 50.000/mikrolitre ve ANC
500/mikrolitre) şeklinde tanımlanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Geçerli değildir, veri bulunmamaktadır.
Dağılım
Blinatumomabın sürekli intravenöz infüzyonuyla terminal faz (Vz) temelinde tahmin edilen ortalama (SS) dağılım hacmi 4,35 (2,45) L olmuştur.
Biyotransformasyon
Blinatumomabın metabolik yolu karakterize edilmemiştir. Diğer protein bazlı terapötikler gibi BLİNCYTO®'nun da katabolik yolaklarla küçük peptidlere ve aminoasitlere bozunması beklenmektedir.
Eliminasyon
Klinik çalışmalarda blinatumomab alan hastalarda sürekli intravenöz infüzyonla tahmin edilen ortalama (SS) sistemik klerens 3,11 (2,98) L/saat olmuştur. Ortalama (SS) yarılanma ömrü 2,10 (1,41) saat olarak belirlenmiştir. Test edilen klinik dozlarda ihmal edilebilir miktarda blinatumomab idrarla atılmıştır.
Vücut yüzey alanı, Cinsiyet ve Yaş
Demografik özelliklerin blinatumomab farmakokinetiği üzerine etkilerinin değerlendirilmesi amacıyla bir popülasyon farmakokinetiği analizi yapılmıştır. Elde edilen bulgular yaş (7 ay ila 80 yaş), cinsiyetin blinatumomabın farmakokinetik özelliklerini etkilemediğini düşündürmektedir. Vücut yüzey alanının (0,37 ila 2,70 m2) blinatumomabın farmakokinetik özelliklerini etkilediğini düşündürmektedir. Bununla birlikte, yetişkinlerdeki etki ihmal edilebilir düzeydedir ve pediyatrik popülasyonda vücut yüzey alanına dayalı dozlama önerilmektedir.
Doğrusallık/doğrusal olmayan durum
Yetişkin hastalarda blinatumomabın farmakokinetik özelliklerinin 5 ila 90 mcg/m2/gün (yaklaşık 9 ila 162 mcg/gün dozuna eşdeğer) aralığında doğrusal olduğu görülmektedir. Sürekli intravenöz infüzyon sonrasında, serumdaki kararlı durum konsantrasyonuna (Css) bir gün içinde ulaşılmış ve bu konsantrasyon zaman içinde stabil kalmıştır. Ortalama Css değerlerindeki artış yaklaşık olarak test edilen aralıktaki dozla orantısal olmuştur. Nüksetmiş/yanıtsız ALL tedavisine yönelik klinik 9 mcg/gün ve 28 mcg/gün dozlarında, ortalama (SS) Css sırasıyla 228 (356) pg/mL ve 616 (537) pg/mL olmuştur. MRH pozitif B-hücreli prekürsör ALL hastalarında blinatumomabın farmakokinetik özellikleri, nükseden veya dirençli ALL hastalarındaki farmakokinetik özelliklere benzer bulunmuştur.
Hastalardaki karakteristik özellikler
Böbrek Yetmezliği
Böbrek yetmezliği bulunan hastalarda blinatumomab ile ilgili formal farmakokinetik çalışmaları yapılmamıştır.
Farmakokinetik analizler orta dereceli böbrek disfonksiyonu olan hastalar ile böbrek fonksiyonu normal olan hastalar arasında ortalama blinatumomab klerens değerleri bakımından yaklaşık 2 kat fark olduğunu göstermiştir. Hastalar arasında yüksek oranda değişkenlik olduğu saptandığı için (%96,8'e varan %CV) ve böbrek yetmezliği olan hastalarda klerens verileri temel olarak böbrek fonksiyonu normal olanlarda görülen aralık dahilinde olduğundan, böbrek fonksiyonu üzerinde klinik açıdan anlamlı klinik sonuçlar beklenmemektedir.
Karaciğer yetmezliği
Karaciğer yetmezliği bulunan hastalarda blinatumomab ile ilgili farmakokinetik çalışmaları yapılmamıştır. Başlangıçtaki ALT ve AST düzeyleri karaciğer yetmezliğinin blinatumomab klerensi üzerine etkisini değerlendirmek için kullanılmıştır. Popülasyona dayalı farmakokinetik analizleri ALT veya AST düzeyleri ile blinatumomab klerensi arasında bir ilişki olmadığını ortaya koymuştur.
Pediyatrik popülasyon
Nükseden veya dirençli B-hücreli prekürsör pediyatrik ALL'li hastalarda blinatumomabın farmakokinetiği, 5 ila 30 mcg/m2/gün doz aralığında doğrusal görünmektedir. Önerilen 5 ve
15 mcg/m2/gün dozlarında, ortalama (SS) kararlı durum konsantrasyonu (C) değerleri sırasıyla 162 (179) ve 533 (392) pg/mL olarak belirlenmiştir. Tahmini ortalama (SS) dağılım hacmi (Vz), klirens (CL) ve terminal yarılanma ömrü (t) sırasıyla 3,91 (3,36) L/m2, 1,88 (1,90) L/sa/m2 ve 2,19 (1,53) saat şeklindedir.
İlk kez nüks görülen yüksek riskli B-hücreli prekürsör ALL hastalarında blinatumomabın farmakokinetiği tahmini ortalama (SS) C15 mcg/m2/gün ile karakterizedir ve CL sırasıyla 921 (1.010) pg/mL ve 0,988 (0,450) L/sa/m2'dir; gözlenen değerler nüks görülen ya da refrakter B-hücreli prekürsör ALL hastalarından klinik olarak farklı bulunmamıştır. Dağılım hacmi ve yarılanma ömrü hesaplanamamıştır.
5.3. Klinik öncesi güvenlilik verileri
Blinatumomab ve mürin vekil ile yapılan tekrarlı doz toksisite çalışmalar (sitokinlerin salıverilmesi, lökosit sayısında azalma, B hücrelerinde deplesyon, T hücrelerinde azalma ve lenfoid dokularda hücreselliğin azalması dahil) beklenen farmakolojik etkileri ortaya çıkmıştır. Bu etkiler tedavinin kesilmesiyle geri dönüşümlü olmuştur.
Blinatumomab ile üreme toksisitesi çalışmaları yapılmamıştır. Farelerde yapılan bir embriyofetal gelişim toksisitesi çalışmasında, mürin vekil plasentadan sınırlı bir ölçüde geçmiş (fetal-maternal serum konsantrasyonu oranı < %1) ve embriyofetal toksisite veya teratojenisiteye neden olmamıştır. Gebe farelerde B- ve T- hücrelerinde beklenen azalmanın olduğu görülmüş ancak fetuslardaki hematolojik etkiler değerlendirilmemiştir. Tedavinin fertilite üzerindeki etkilerinin değerlendirilmesine yönelik bir çalışma yapılmamıştır. Mürin vekil kullanılarak yapılan toksisite çalışmalarında erkek ya da dişi üreme organlarında herhangi bir etki görülmemiştir.
IV torbasındaki hava boşaltılır. Bu özellikle ambulatuvar infüzyon pompası kullanırken önemlidir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tıbbi Ürün:Sitrik asit monohidrat (E330) Trehaloz dihidrat
Lizin hidroklorür
Polisorbat 80
Sodyum hidroksit (pH ayarı için)
IV Çözelti Stabilizörü:
Sitrik asit monohidrat (E330)
Lizin hidroklorür
Polisorbat 80
Sodyum hidroksit (pH ayarı için)
Enjeksiyonluk su
6.2. Geçimsizlikler
BLİNCYTO®, Bölüm 6.6'da belirtilen ürünler dışında diğer ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
BLİNCYTO flakon: 60 ay
IV Çözelti Stabilizörü flakonu: 60 ay
Sulandırılmış çözelti
Kullanım süresine ilişkin kimyasal ve fiziksel stabilite, 2°C - 8°C'de 24 saat veya 25°C ve
altında 4 saat olarak gösterilmiştir.
Mikrobiyolojik açıdan, sulandırma yönteminin mikrobiyal kontaminasyon risklerini ortadan kaldırdığı durumlar haricinde, sulandırılmış çözelti hemen seyreltilmelidir. Hemen seyreltilmediği takdirde, kullanım süresine ilişkin saklama süreleri ve koşulları kullanıcının sorumluluğundadır.
Seyreltilmiş çözelti (hazırlanan infüzyon torbası)
Kullanım süresine ilişkin kimyasal ve fiziksel stabilite, 2°C - 8°C'de 10 gün veya 25°C ve
altında 96 saat olarak gösterilmiştir.
Mikrobiyolojik açıdan, hazırlanan infüzyon torbaları hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım süresine ilişkin saklama süreleri ve koşulları kullanıcının sorumluluğundadır ve normalde, seyreltme işleminin kontrollü ve valide edilmiş aseptik koşullarda gerçekleştiği durumlar dışında 2°C-8°C'de 24 saati geçmemelidir.
6.4. Saklamaya yönelik özel tedbirler
2°C ila 8°C arasında buzdolabında saklayınız. Dondurmayınız.
BLİNCYTO® ve IV Çözelti Stabilizörü flakonlarını ışıktan korumak için orijinal ambalajında saklayınız.
Ürünün sulandırıldıktan ve seyreltildikten sonraki saklama koşulu için Bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
Ambalaj boyutu: 1 BLİNCYTO® flakonu ile 1 flakon IV Çözelti Stabilizatörü. Bir BLİNCYTO® kutusunda bulunanlar:
BLİNCYTO® tek kullanımlık flakon içinde steril, koruyucu içermeyen,
beyaz-beyazımsı liyofilize toz (38,5 mcg/flakon) olarak ve
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Aseptik hazırlık
İnfüzyon hazırlığı sırasında mutlaka aseptik teknik kullanılmalıdır. BLİNCYTO® hazırlığı:
özellikle parenteral ürünlerin aseptik şekilde hazırlanmasına ilişkin iyi uygulama kurallarına uygun olarak eğitim almış personel tarafından aseptik koşullar altında gerçekleştirilmelidir.
İntravenöz infüzyon hattını hazırlarken yalnızca BİTMİŞ hazır BLİNCYTO infüzyonluk çözeltiyi içeren torbadaki çözeltiyi kullanınız.
Hemen kullanılmayacak ise buzdolabında 2°C ila 8°C'de saklanır.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Amgen İlaç Tic. Ltd. Şti
| Geri Ödeme Kodu | A17029 |
| Satış Fiyatı | 59067.89 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 59067.89 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699862270021 |
| Etkin Madde | Blinatumomab |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |