BLINCYTO 38.5 mcg liyofilize toz içeren 1 flakon (10 ml) Farmakolojik Özellikler
{ Blinatumomab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, diğer antineoplastik ajanlar ATC kodu: L01FX07
Etki mekanizması
Blinatumomab, özellikle B hücre serisinden gelen hücrelerin yüzeyinde eksprese edilen CD19'a ve T hücresi yüzeyinde eksprese edilen CD3'e bağlanan bispesifik bir T hücresi bağlayıcı (BiTE®) moleküldür. T hücresi reseptör kompleksindeki (TCR) CD3 ile benign ve malign B hücrelerinde bulunan CD19'u bağlayarak endojen T hücrelerini aktive etmektedir. Blinatumomab immünoterapisinin anti-tümör aktivitesi özgün bir TCR'ye sahip olan T hücrelerine veya kanser hücrelerinin sunduğu peptid antijenlere bağlı değildir; ancak, poliklonal yapılıdır ve hedef hücrelerdeki insan lökosit antijeninden (HLA) bağımsızdır. Blinatumomab T hücresi ile tümör hücresi arasındaki sitolitik sinapsın oluşmasına aracılık etmekte, prolifere olan hücrelerin ve istirahatte olan hedef hücrelerin öldürülmesi için proteolitik enzimlerin salımını sağlamaktadır. Blinatumomab hücre adezyonu moleküllerinin geçici up-regülasyonuyla, sitolitik proteinlerin üretimiyle, inflamatuvar sitokinlerin salıverilmesiyle ve T hücrelerinin poliferasyonuyla ilişkilidir ve CD19+ hücrelerinin eliminasyonuna yol açmaktadır.
Farmakodinamik etkiler
Çalışılan hastalarda tutarlı immün-farmakodinamik yanıtlar gözlenmiştir. 4 haftanın üzerinde devamlı infüzyon tedavisi esnasında, farmakodinamik yanıt; T-hücre aktivasyonu ve başlangıç redistribüsyon, ani periferal B-hücre azalması ve geçici sitokin yüksekliği ile karakterizedir.
Periferal T hücre redistribüsyonu (örn. kan damarları endoteline T hücre adezyonu ve/veya dokuya transmigrasyon) BLİNCYTO® infüzyonunun başlangıcında veya doz artırımında oluşmaktadır. T hücre sayısı başlangıçta 1 ila 2 gün içinde azalır ve daha sonra hastaların büyük çoğunluğunda 7 ila 14 gün arasında bazal seviyelere geri döner. T hücre sayısının bazalın üzerine çıkması (T hücre ekspansiyonu) birkaç hastada gözlenmiştir.
Hastaların büyük çoğunluğunda ≥ 5 mcg/m2/gün veya ≥ 9 mcg/gün dozlarındaki tedavi süresince periferal B hücre sayısı, aniden ölçülemeyen seviyeye düşer. Periferal B hücre sayısında tedavi döngüleri arasındaki 2 haftalık tedavi verilmeyen dönem süresince hiçbir iyileşme gözlenmemiştir. B hücrelerinde tamamlanmamış düşüş, 0,5 mcg/m2/gün ve 1,5 mcg/m2/gün dozlarda ve yüksek dozlarda birkaç yanıtsızda görülmektedir.
Periferal lenfositler pediyatrik hastalarda ölçülmemiştir.
IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, TNF-α, ve IFN-γ içeren sitokinler ölçülmüştür ve IL-6, IL-10 ve IFN-γ daha çok yükselmiştir. Sitokinlerdeki geçici yükseklik BLİNCYTO® infüzyonunun başlangıcını takiben ilk 2 günde gözlenmiştir. Yüksek sitokin seviyeleri infüzyon süresince 24 ila 48 saat içinde bazal seviyeye dönmektedir. Sonraki tedavi sikluslarında sitokin artışı, birkaç hastada birinci tedavi siklusunun ilk 48 saati ile karşılaştırıldığında daha az şiddetli olmuştur.
Klinik etkililik ve güvenlilik
Philadelphia kromozomu negatif nükseden veya dirençli B-hücreli prekürsör ALL
Aşağıda tanımlanan faz II ve faz III klinik çalışmalarda nüks veya yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL) bulunan, en az 18 yaşında olan toplam 456 hastaya BLİNCYTO® verilmiştir.
BLİNCYTO®'nun güvenlilik ve etkililiği standart kemoterapiye (SOC) kıyasla açık etiketli, çok merkezli bir faz III çalışmada (TOWER) değerlendirilmiştir. Uygun olarak değerlendirilen hastalar ≥ 18 yaşında ve ECOG durumu ≤ 2 olan, nükseden veya dirençli B-prekürsör ALL hastalarıdır (kemik iliğinde > %5 blast bulunan ve allojenik HKHN'den sonra herhangi bir zamanda nüks görülen, ilk remisyon süresi < 12 ay olmak üzere ilk nüksün tedavi edilmemiş olduğu veya son tedaviye direnç görülen hastalar).
Hastalar BLİNCYTO® veya önceden belirlenmiş, araştırmacı tarafından seçilen, 4 SOC temel kemoterapi rejiminden 1'ini almak üzere 2:1 oranında randomize edilmiştir. Randomizasyon, yaşa (< 35 yaş ve ≥ 35 yaş), önceki kurtarma tedavisine (evet ve hayır) ve olur verildiği zaman değerlendirildiği üzere önceden allojenik HKHN durumuna (evet ve hayır) göre gruplanmıştır. Demografik özelliklerin ve başlangıç özelliklerinin iki tedavi kolu arasında iyi dengeli olduğu görülmüştür (bkz. Tablo 2).
Tablo 2: Faz III çalışmasındaki (TOWER) demografi ve başlangıç özellikleri
Özellik | BLİNCYTO (N = 271) | Standard Kemoterapi (N = 134) |
Yaş | ||
Medyan, yıl (min, maks.) | 37 (18; 80) | 37 (18; 78) |
Ortalama, yıl (SS) | 40,8 (17,1) | 41,1 (17,3) |
≥ 65 yaş, n (%) | 33 (12,2) | 15 (11,2) |
Önceki kurtarma tedavisi | 164 (60,5) | 80 (59,7) |
0 | 114 (42,1) | 65 (48,5) |
1 | 91 (33,6) | 43 (32,1) |
≥ 2 | 66 (24,3) | 26 (19,4) |
Önceki allo-HKHN | 94 (34,7) | 46 (34,3) |
ECOG Durumu - n (%) |
|
|
0 | 96 (35,4) | 52 (38,8) |
1 | 134 (49,4) | 61 (45,5) |
2 | 41 (15,1) | 20 (14,9) |
Direnç durumu - n (%) |
|
|
Özellik | BLİNCYTO (N = 271) | Standard Kemoterapi (N = 134) |
Birincil refrakter | 46 (17,0) | 27 (20,1) |
Kurtarma tedavisine refrakter | 87 (32,1) | 34 (25,4) |
Maksimum santral/lokal kemik iliği blastı - n (%) |
|
|
≥ %50 | 201 (74,2) | 104 (77,6) |
allo-HKHN = allojenik hematopoietik kök hücre nakli SOC = standart kemoterapi | ||
BLİNCYTO® sürekli IV infüzyon olarak uygulanmıştır. İlk döngüde başlangıç dozu 1 hafta süreyle 9 mcg/gün, sonrasında 3 hafta süreyle 28 mcg/gün olmuştur. Hedef doz olan 28 mcg/gün 2. döngüde ve sonraki döngülerde her bir döngünün 1. gününde başlanarak kullanılmıştır. Advers olay gelişmesi halinde doz ayarlaması yapılmasına izin verilmiştir. BLİNCYTO® alan 267 hastada tamamlanan tedavi döngülerinin ortalama sayısı 2,0 olurken; SOC kemoterapi alan 109 hastada tedavi döngülerinin ortalama sayısı 1,3 olmuştur.
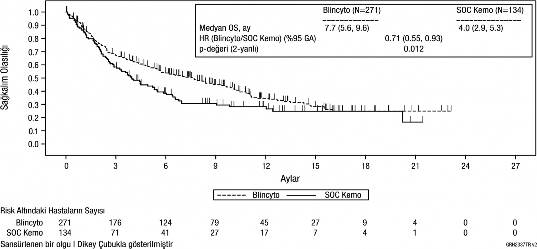
Primer sonlanım noktası olarak genel sağkalım (GS) değerlendirilmiştir. Medyan GS, SOC kemoterapi kolunda 4,0 ay (%95 GA: 2,9; 5,3), BLİNCYTO® kolunda ise 7,7 ay (%95 GA: 5,6; 9,6) olmuştur. Tedavi kolları arasındaki tehlike oranı (%95 GA) BLİNCYTO® lehine olmak üzere 0,71 (0,55; 0,93) olmuş ve BLİNCYTO® kolunda tehlike oranında %29'luk bir azalma olduğunu göstermiştir (p değeri = 0,012 [gruplanmış log-sıra testi]), bkz. Şekil 1. GS bulgularındaki tutarlılık, gruplama faktörlerine göre alt gruplarda da gösterilmiştir.
HKHN zamanında sansürleme yapıldıktan sonra tutarlı bulgular gözlenmiş; HKHN zamanında sansürlenen medyan GS, BLİNCYTO® grubunda 6,9 ay (%95 GA: 5,3; 8,8) ve
SOC grubunda 3,9 ay (%95 GA: 2,8; 4,9) olmuştur (HR, 0,66; %95 GA: 0,50; 0,88; p değeri
= 0,004). Anti-lösemik tedavi almayan tüm yanıt verenler arasında allo-HKHN sonrası mortalite oranı BLİNCYTO® grubunda 10/38 (%26,3; %95 GA: 13,4; 43,1) ve SOC
grubunda 3/12 (%25; %95 GA: 5,5; 57,2) olarak saptanmış; allo-HKHN'den 100 gün sonra
bu mortalite oranı BLİNCYTO® grubunda 4/38 (%12,4; %95 GA: %4,8, %29,9) ve SOC grubunda 0/12 (%0; %95 GA: hesaplanmayan değer) şeklinde kaydedilmiştir. Çalışmadaki diğer temel sonlanım noktalarında elde edilen etkililik bulguları Tablo 3'de özetlenmiştir.
Şekil 1. Kaplan-Meier Genel Sağkalım Eğrisi
Tablo 3: Philadelphia kromozomu negatif nüksetmiş veya yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL) bulunan, en az 18 yaşındaki hastalara ilişkin etkililik bulguları (TOWER)
| BLİNCYTO (N = 271) | Standart Kemoterapi (N = 134) |
Tam remisyon (CR) | ||
CR/CRh*/CRi, n (%) [%95 GA] | 119 (43,9) (37,9; 50,0) | 33 (24,6) (17,6; 32,8) |
Tedavi farkı [%95 GA] | 19,3 (9,9; 28,7) | |
p değeri | < 0,001 | |
CR, n (%) [%95 GA] | 91 (33,6) (28,0; 39,5) | 21 (15,7) (10,0; 23,0) |
Tedavi farkı [%95 GA] | 17,9 (9,6; 26,2) | |
p değeri | < 0,001 | |
Olaysız sağkalım | ||
6 aylık tahmin % [%95 GA] | 30,7 (25,0; 36,5) | 12,5 (7,2; 19,2) |
18 aylık tahmin % [%95 GA] | 9,5 (5,1; 15,6) | 7,9 (3,7; 14,2) |
Risk Oranı [%95 GA] | 0,55 (0,43; 0,71) | |
Hematolojik yanıt süresi- Olaya kadar geçen medyan süre [%95 GA] | ||
CR | 8,3 (5,7; 10,7) | 7,8 (2,2; 19,0) |
CR/CRh*/CRi | 7,3 (5,8; 9,9) | 4,6 (1,8; 19,0) |
CR/CRh*/CRi için MRH yanıtı | ||
MRH değerlendirilebilir hastalar (%) [%95 GA] | 74/97 (76,3) (66,6; 84,3) | 16/33 (48,5) (30,8; 66,5) |
MRH yanıt süresi- Olaya kadar geçen medyan süre [%95 GA] |
4,5 ay (3,6; 9,0) |
3,8 ay (1,9; 19,0) |
Başlangıç sonrası allo-HKHN - n (%) | ||
Toplam gönüllüler | 65 (24) | 32 (23,9) |
Hematolojik yanıt verenler (CR/CRh*/CRi) | 50 (42,0) | 18 (54,5) |
Nakil yapılan tüm hastalarda allo- HKHN'ye kadar geçen süre Olaya kadar geçen medyan süre (çeyrekler arası aralık) |
3,7 ay (3,0; 5,3) (N = 65) |
3,1 ay (2,6; 4,3) (N = 32) |
CR/CRh*/CRi yanıt verenlerde allo- HKHN'ye kadar geçen süre Olaya kadar geçen medyan süre [%95 GA] (KM tahmini) |
11,3 ay (5,2; NE) (N = 119) |
3,6 ay (2,3; 7,2) (N = 33) |
allo-HKHN'den sonra 100 günlük mortalite | ||
n/N (%), [%95 GA] | 4/38; 12,4% (4,8; 29,9) | 0/12; 0,0% (0.0; NE) |
a CR; kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının tam olarak iyileşmiş olması (trombosit > 100.000/mikrolitre ve mutlak nötrofil sayısı [ANC] > 1.000/mikrolitre) şeklinde tanımlanmıştır.
b CRh* (kısmi hematolojik iyileşmeyle tam remisyon); kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının kısmi olarak iyileşmiş olması (trombosit > 50.000/mikrolitre ve ANC > 500/mikrolitre) şeklinde tanımlanmıştır.
c CRi (yetersiz hematolojik iyileşmeyle tam remisyon); kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının yeterince iyileşmemiş olması (trombosit > 100.000/mikrolitre veya ANC > 1.000/mikrolitre) şeklinde tanımlanmıştır.
d Olaysız sağkalım süresi, randomizasyon zamanından CR/CRh*/CRi ulaşıldıktan sonra nüksü gösteren hastalık değerlendirme tarihi veya ölüme kadar (hangisi daha önceyse) hesaplanmıştır. Tedavi başladıktan sonra 12 hafta içinde CR/CRh*/CRi ulaşamayan gönüllüler, tedavi başarısızlığı olarak kabul edilir ve bunlara 1 günlük olaysız sağkalım (EFS) süresi atanır.
e MRH yanıtı, PCR veya akım sitometrisi < 1 Ã 10-4 olan MRH şeklinde tanımlanmıştır.
f CR/CRh*/CRi elde eden ve başlangıç sonrası değerlendirilebilir MRH değerlendirmesi
bulunan hastalar.
Sağlıkla İlişkili Yaşam Kalitesi
Hastalar tarafından bildirilen Sağlıkla İlişkili Yaşam Kalitesi (HRQoL), Avrupa Kanser Araştırma ve Tedavi Organizasyonu Yaşam Kalitesi Anketi â Çekirdek 30 (EORTC QLQ- C30) kullanılarak ölçülmüştür. Bir post-hoc duyarlılık analizinde, bakım standardına kıyasla BLİNCYTO®, global sağlık durumu [medyan BLİNCYTO® karşısında bakım standardı 8,1 aya karşılık 1,0 ay; Risk oranı = 0,60 (%95 GA = 0,42; 0,85)], fonksiyonel ölçekler, semptom ölçekleri ve bireysel öğelerde klinik olarak anlamlı HRQoL kötüleşmesine (başlangıca göre
≥ 10 puan kötüleşme) kadar geçen süreyi tutarlı olarak geciktirmiştir. Sağlıkla ilgili yaşam kalitesi sonuçları bir post hoc duyarlılık analizine dayalı olduğundan, sonuçlar dikkatle yorumlanmalıdır.
BLİNCYTO® ayrıca açık etiketli, çok merkezli ve tek tedavi kollu 189 hastalık bir faz II çalışmasında değerlendirilmiştir (MT103-211). En az 18 yaşında olup, Philadelphia kromozomu negatif nüks veya yanıtsız B-hücreli prekürsör ALL bulunan hastalar (ilk kurtarma tedavisinde ≤ 12 aylık remisyon süresiyle nüks gelişen veya ilk kurtarma tedavisinden sonra nüks gelişen ya da yanıtsız hale gelen veya allojenik HKHN sonraki 12 ay içinde nüks gelişen ve kemik iliğinde ≥ %10 blast bulunan) uygun olarak değerlendirilmiştir.
Premedikasyon, tedavi döngüsü başına BLİNCYTO® dozu ve uygulama yolunun, faz III çalışması ile aynı olması sağlanmıştır. Hastalara BLİNCYTO® tedavisine başlamadan önceki 1 hafta içinde kurumsal veya ulusal kılavuza göre bir intratekal rejimden oluşan zorunlu beyin-omurilik sıvısı profilaksisi ile premedikasyon uygulanmıştır. BLİNCYTO® sürekli IV infüzyon olarak uygulanmıştır. İlk döngüde başlangıç dozu 1 hafta süreyle 9 mcg/gün, sonrasında 3 hafta süreyle 28 mcg/gün olmuştur. Hedef doz olan 28 mcg/gün 2. döngüde ve sonraki döngülerde her bir döngünün 1. gününde başlanarak kullanılmıştır. Advers olay gelişmesi halinde doz ayarlaması yapılmasına izin verilmiştir. Tedavi edilen popülasyonda en az bir infüzyon BLİNCYTO® uygulanan 189 hasta yer almış; medyan tedavi döngülerinin sayısı 1,6 olmuştur. BLİNCYTO® tedavisine yanıt veren ancak sonradan nüks gelişen hastalara yeniden BLİNCYTO® tedavisi alma seçeneği sunulmuştur. Tedavi alan hastalar genelinde medyan yaşın 39 olduğu (aralık: 18 ila 79 yaş; 65 yaş ve üstü 25 hastayı içeriyor),
189 hastanın 64'üne (%33,9) BLİNCYTO® uygulanmadan önce HKHN yapılmış, 189 hastanın 32'si (%16,9) en az 2 kurtarma tedavisi almıştır.
Primer sonlanım noktası BLİNCYTO® tedavisinin iki döngüsü içindeki CR/CRh* oranı olmuştur. Değerlendirilebilen 189 hastanın seksen biri (%42,9) iki tedavi döngüsü içinde CR/CRh* elde etmiş, yanıtların büyük bölümü (81'de 64) tedavinin 1. döngüsünde ortaya
çıkmıştır. Yaşlı popülasyonda (≥ 65 yaş) 25 hastanın 11'i (%44,0) ilk 2 tedavi döngüsü içinde CR/CRh* elde etmiştir (yaşlılarda güvenlilik için bkz. Bölüm 4.8). Konsolidasyon döngülerinde dört hastada CR elde edilmiş, sonuç olarak kümülatif CR oranı %35,4 olmuştur (189'da 67; %95 GA: %28,6 - %42,7). BLİNCYTO® ile indüklenen CR/CRh* süresi içinde, 189 hastadan otuz ikisine (%17) allojenik HKHN yapılmıştır (bkz. Tablo 4).
Tablo 4: Philadelphia Kromozomu Negatif Nüks veya Yanıtsız B-prekürsör Akut Lenfoblastik Lösemi (ALL), en az 18 Yaşındaki Hastalara İlişkin Etkililik Bulguları (MT103-211)
| n (%) n = 189 | [%95 GA] |
Tam remisyon (CR)/Kısmi hematolojik iyileşmenin eşlik ettiği tam remisyon (CRh*) | 81 (%42,9) | [%35,7 - %50,2] |
CR | 63 (%33,3) | [%26,7 - %40,5] |
CRh* | 18 (%9,5) | [%5,7 - %14,6] |
Blastsız hipoplastik veya aplastik kemik iliği | 17 (%9,0) | [%5,3 - %14,0] |
Kısmi remisyon | 5 (%2,6) | [%0,9 - %6,1] |
CR/CRh* için medyan nüks gelişmeden sağkalım | 5,9 ay | [4,8 ila 8,3 ay] |
Medyan genel sağkalım | 6,1 ay | [4,2 ila 7,5 ay] |
1. CR kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının tam olarak iyileşmiş olması (trombosit > 100.000/mikrolitre ve mutlak nötrofil sayısı [ANC] > 1.000/mikrolitre) şeklinde tanımlanmıştır.
2. CRh* kemik iliğinde ≤ %5 blast bulunması, hastalık kanıtı olmaması ve periferik kan sayımlarının kısmi olarak iyileşmiş olması (trombosit > 50.000/mikrolitre ve ANC
500/mikrolitre) şeklinde tanımlanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Geçerli değildir, veri bulunmamaktadır.
Dağılım
Blinatumomabın sürekli intravenöz infüzyonuyla terminal faz (Vz) temelinde tahmin edilen ortalama (SS) dağılım hacmi 4,35 (2,45) L olmuştur.
Biyotransformasyon
Blinatumomabın metabolik yolu karakterize edilmemiştir. Diğer protein bazlı terapötikler gibi BLİNCYTO®'nun da katabolik yolaklarla küçük peptidlere ve aminoasitlere bozunması beklenmektedir.
Eliminasyon
Klinik çalışmalarda blinatumomab alan hastalarda sürekli intravenöz infüzyonla tahmin edilen ortalama (SS) sistemik klerens 3,11 (2,98) L/saat olmuştur. Ortalama (SS) yarılanma ömrü 2,10 (1,41) saat olarak belirlenmiştir. Test edilen klinik dozlarda ihmal edilebilir miktarda blinatumomab idrarla atılmıştır.
Vücut yüzey alanı, Cinsiyet ve Yaş
Demografik özelliklerin blinatumomab farmakokinetiği üzerine etkilerinin değerlendirilmesi amacıyla bir popülasyon farmakokinetiği analizi yapılmıştır. Elde edilen bulgular yaş (7 ay ila 80 yaş), cinsiyetin blinatumomabın farmakokinetik özelliklerini etkilemediğini düşündürmektedir. Vücut yüzey alanının (0,37 ila 2,70 m2) blinatumomabın farmakokinetik özelliklerini etkilediğini düşündürmektedir. Bununla birlikte, yetişkinlerdeki etki ihmal edilebilir düzeydedir ve pediyatrik popülasyonda vücut yüzey alanına dayalı dozlama önerilmektedir.
Doğrusallık/doğrusal olmayan durum
Yetişkin hastalarda blinatumomabın farmakokinetik özelliklerinin 5 ila 90 mcg/m2/gün (yaklaşık 9 ila 162 mcg/gün dozuna eşdeğer) aralığında doğrusal olduğu görülmektedir. Sürekli intravenöz infüzyon sonrasında, serumdaki kararlı durum konsantrasyonuna (Css) bir gün içinde ulaşılmış ve bu konsantrasyon zaman içinde stabil kalmıştır. Ortalama Css değerlerindeki artış yaklaşık olarak test edilen aralıktaki dozla orantısal olmuştur. Nüksetmiş/yanıtsız ALL tedavisine yönelik klinik 9 mcg/gün ve 28 mcg/gün dozlarında, ortalama (SS) Css sırasıyla 228 (356) pg/mL ve 616 (537) pg/mL olmuştur. MRH pozitif B-hücreli prekürsör ALL hastalarında blinatumomabın farmakokinetik özellikleri, nükseden veya dirençli ALL hastalarındaki farmakokinetik özelliklere benzer bulunmuştur.
Hastalardaki karakteristik özellikler
Böbrek Yetmezliği
Böbrek yetmezliği bulunan hastalarda blinatumomab ile ilgili formal farmakokinetik çalışmaları yapılmamıştır.
Farmakokinetik analizler orta dereceli böbrek disfonksiyonu olan hastalar ile böbrek fonksiyonu normal olan hastalar arasında ortalama blinatumomab klerens değerleri bakımından yaklaşık 2 kat fark olduğunu göstermiştir. Hastalar arasında yüksek oranda değişkenlik olduğu saptandığı için (%96,8'e varan %CV) ve böbrek yetmezliği olan hastalarda klerens verileri temel olarak böbrek fonksiyonu normal olanlarda görülen aralık dahilinde olduğundan, böbrek fonksiyonu üzerinde klinik açıdan anlamlı klinik sonuçlar beklenmemektedir.
Karaciğer yetmezliği
Karaciğer yetmezliği bulunan hastalarda blinatumomab ile ilgili farmakokinetik çalışmaları yapılmamıştır. Başlangıçtaki ALT ve AST düzeyleri karaciğer yetmezliğinin blinatumomab klerensi üzerine etkisini değerlendirmek için kullanılmıştır. Popülasyona dayalı farmakokinetik analizleri ALT veya AST düzeyleri ile blinatumomab klerensi arasında bir ilişki olmadığını ortaya koymuştur.
Pediyatrik popülasyon
Nükseden veya dirençli B-hücreli prekürsör pediyatrik ALL'li hastalarda blinatumomabın farmakokinetiği, 5 ila 30 mcg/m2/gün doz aralığında doğrusal görünmektedir. Önerilen 5 ve
15 mcg/m2/gün dozlarında, ortalama (SS) kararlı durum konsantrasyonu (C) değerleri sırasıyla 162 (179) ve 533 (392) pg/mL olarak belirlenmiştir. Tahmini ortalama (SS) dağılım hacmi (Vz), klirens (CL) ve terminal yarılanma ömrü (t) sırasıyla 3,91 (3,36) L/m2, 1,88 (1,90) L/sa/m2 ve 2,19 (1,53) saat şeklindedir.
İlk kez nüks görülen yüksek riskli B-hücreli prekürsör ALL hastalarında blinatumomabın farmakokinetiği tahmini ortalama (SS) C15 mcg/m2/gün ile karakterizedir ve CL sırasıyla 921 (1.010) pg/mL ve 0,988 (0,450) L/sa/m2'dir; gözlenen değerler nüks görülen ya da refrakter B-hücreli prekürsör ALL hastalarından klinik olarak farklı bulunmamıştır. Dağılım hacmi ve yarılanma ömrü hesaplanamamıştır.
5.3. Klinik öncesi güvenlilik verileri
Blinatumomab ve mürin vekil ile yapılan tekrarlı doz toksisite çalışmalar (sitokinlerin salıverilmesi, lökosit sayısında azalma, B hücrelerinde deplesyon, T hücrelerinde azalma ve lenfoid dokularda hücreselliğin azalması dahil) beklenen farmakolojik etkileri ortaya çıkmıştır. Bu etkiler tedavinin kesilmesiyle geri dönüşümlü olmuştur.
Blinatumomab ile üreme toksisitesi çalışmaları yapılmamıştır. Farelerde yapılan bir embriyofetal gelişim toksisitesi çalışmasında, mürin vekil plasentadan sınırlı bir ölçüde geçmiş (fetal-maternal serum konsantrasyonu oranı < %1) ve embriyofetal toksisite veya teratojenisiteye neden olmamıştır. Gebe farelerde B- ve T- hücrelerinde beklenen azalmanın olduğu görülmüş ancak fetuslardaki hematolojik etkiler değerlendirilmemiştir. Tedavinin fertilite üzerindeki etkilerinin değerlendirilmesine yönelik bir çalışma yapılmamıştır. Mürin vekil kullanılarak yapılan toksisite çalışmalarında erkek ya da dişi üreme organlarında herhangi bir etki görülmemiştir.
IV torbasındaki hava boşaltılır. Bu özellikle ambulatuvar infüzyon pompası kullanırken önemlidir.
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Amgen İlaç Tic. Ltd. Şti
| Geri Ödeme Kodu | A17029 |
| Satış Fiyatı | 59067.89 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 57635.51 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699862270021 |
| Etkin Madde | Blinatumomab |
| ATC Kodu | L01XC19 |
| Birim Miktar | 38.5 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |