BOSULIF 100 mg FT (28 tablet) Kısa Ürün Bilgisi
{ Bosutinib Monohidrat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BOSULİF 100 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her film kaplı tablet 100 mg bosutinibe eşdeğer 103,4 mg bosutinib monohidrat içerir.
Yardımcı maddeler
için, 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bir yüzünde âPfizerâ ve diğer yüzünde â100â işlemeli, sarı renkte, oval, bikonveks film kaplı
tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
BOSULİF,
Yeni tanı konmuş kronik faz (KF) Philadelphia kromozomu pozitif (Ph+) kronik miyeloid lösemisi (KML) olan yetişkin hastaların tedavisinde ve
Daha önce en az bir basamak tirozin kinaz inhibitörü (TKI) (imatinib, dasatinib veya nilotinib) tedavisi alıp, direnç veya intolerans gelişmiş olan kronik faz (KF), akselere faz (AF) ve blastik faz (BF) Philadelphia kromozomu pozitif (Ph+) kronik miyeloid lösemisi (KML) olan yetişkin hastaların tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, KML'li hastaların tanı ve tedavisinde deneyimli bir doktor tarafından başlatılmalıdır.
Pozoloji
Yeni tanı konmuş KF Ph+ KML
Bosutinib için önerilen doz günde bir kez 400 mg'dır.
Direnç veya intolerans gelişmiş olan KF, AF veya BF Ph+ KML
Bosutinib için önerilen doz günde bir kez 500 mg'dır. Klinik çalışmalarda, bosutinib ile tedavi, hastalık ilerleyene kadar veya hasta tarafından artık tolere edilemeyene kadar devam etmiştir.
Doz ayarlaması
Daha önce tedavi edilen Ph+ lösemili yetişkin hastaların Faz 1/2 klinik çalışmalarında, aşağıdaki herhangi birinde şiddetli veya inatçı orta-advers reaksiyon gözlemlenmeyen hastalarda günde bir kez yemek ile beraber 500 mg'dan 600 mg'a kadar doz artışı yapılmasına izin verilmiştir.
Doz artışı için koşullar
Derece 3 veya üzeri ilaç ilişkili advers olay yaşanmaması ve
4.3. Kontrendikasyonlar
Etkin madde
ye veya bölüm 6.1'de listelenen yardımcı maddelere karşı aşırı duyarlılık. Karaciğer bozukluğu (bkz. bölüm 5.1 ve 5.2).4.4. Özel kullanım uyarıları ve önlemleri
Karaciğer fonksiyon anormallikleri
Bosutinib ile tedavi, serum transaminazlarında (ALT, AST) yükselme ile ilişkilidir.
Transaminaz yükselmeleri genellikle tedavinin başlangıcında (her dereceden transaminaz yükselmesi yaşayan hastalarda,>%80'i ilk 3 ay içinde ilk olaylarını yaşamıştır) meydana gelmiştir. Bosutinib alan hastalar, tedavinin başlangıcı öncesinde ve tedavinin ilk 3 ayında her ay ve klinik olarak gerekli olduğunda karaciğer fonksiyon testlerinden geçmelidir.
Transaminazlarında artış olan hastalarda, bosutinib geçici olarak durdurulmalı (1. Dereceye kadar iyileşme olduğunda doz azaltma seçeneği göz önünde bulundurulmalıdır) ve/veya bosutinib tedavisi sonlandırılmalıdır. Özellikle bilirubinde eşzamanlı artışla birlikte görülen transaminaz artışları, ilaç kaynaklı karaciğer hasarının erken bir göstergesi olabilir ve bu hastalarla uygun şekilde ilgilenilmesi gerekmektedir (bkz. bölüm 4.2 ve 4.8).
İshal ve kusma
Bosutinib tedavisi ishal ve kusma ile ilişkilendirilmiştir bu nedenle kısa süre önce görülmüş ya da devam eden klinik açıdan anlamlı gastrointestinal bozukluğu bulunan hastalar, (bu tarz hastalar klinik çalışmalardan hariç tutulmuştur) bu tıbbi ürünü dikkatli bir şekilde ve yalnızca ayrıntılı bir fayda-risk değerlendirmesi yapıldıktan sonra kullanmalıdır. İshal ve kusma yaşayan hastalar, ishal önleyici veya antiemetik bir tıbbi ürün ve/veya sıvı replasmanını içeren şekilde standart bakım kapsamında tedavi ile yönetilmelidir. Ayrıca, bu olaylar bosutinibin geçici olarak durdurulması, doz azaltma ve/veya bosutinib kullanımının sonlandırılmasıyla da yönetilebilir (bkz. bölüm 4.2 ve 4.8). Antiemetik ajan, domperidon, QT aralığı (QTc) süresini uzatarak âtorsades de pointesâ- aritmileri tetikleyebilir; bu nedenle domperidon ile birlikte kullanımdan kaçınılmalıdır. Bu madde, yalnızca başka tıbbi ürünler etkili olmadığında
kullanılmalıdır. Bu durumlarda kişisel bir fayda-risk analizi yapılması zorunludur ve hastalar QTc süre uzaması açısından izlenmelidir.
Miyelosüpresyon
Bosutinib ile tedavi, anemi, nötropeni ve trombositopeni olarak tanımlanan miyelosüpresyon ile ilişkilidir. Kan sayımları ilk ay her hafta, daha sonrasında da aylık olarak veya klinik olarak belirtildiği şekilde yapılmalıdır. Miyelosüpresyon, bosutinibin geçici olarak durdurulması, doz azaltma ve/veya bosutinib kullanımının sonlandırılmasıyla da yönetilebilir/yönetilmelidir (bkz. bölüm 4.2 ve 4.8).
Sıvı tutulumu
Bosutinib ile tedavi perikardiyal efüzyon, plevral efüzyon, pulmoner ödem ve/veya periferik ödemi de içeren şekilde sıvı tutulumu ile ilişkilendirilebilir. Hastalar standart bakım tedavisi ile izlenmeli ve yönetilmelidir. Ayrıca, bu olaylar bosutinibin geçici olarak durdurulması, doz azaltma ve/veya bosutinib kullanımının sonlandırılmasıyla da yönetilebilir (bkz. bölüm 4.2 ve 4.8).
Serum lipaz
Serum lipazda yükselme gözlemlenmiştir. Daha önce pankreatit geçmişi olan hastalarda dikkatli olunması önerilmektedir. Lipaz seviyesindeki yükselmelere abdominal belirtilerin eşlik etmesi durumunda, bosutinib kullanımı kesilmeli ve pankreatiti ortadan kaldırmak üzere uygun tanısal tedbirler alınmalıdır (bkz. bölüm 4.2).
Enfeksiyonlar
Bosutinib, hastaları bakteri, mantar, virüs veya protozoan enfeksiyonlarına karşı hassas hale
getirebilir.
Proaritmi potansiyeli
Aritminin de eşlik etmediği, otomatik makine değerleri ile elde edilen QTc süresinde uzama gözlemlenmiştir. Bosutinib, daha önce QTc süre uzaması eğilimi geçmişi olan, kontrol edilmeyen veya kayda değer düzeyde kalp hastalıkları bulunan (kısa süre önce miyokard enfarktüsü, konjestif kalp yetmezliği, unstabil anjina veya klinik açıdan anlamlı bradikardi yaşamış olanlar) ya da QTc süresini uzattığı bilinen tıbbi ürünler kullanan (ör. anti-aritmi tıbbi ürünleri veya QTc süresini uzatabilecek diğer maddeler [bkz. bölüm 4.5]) hastalara dikkatli bir şekilde uygulanmalıdır. Hipokalemi ve hipomagnezemi de bu etkiyi arttırabilir.
Bosutinib tedavisine başlanmadan önce QTc üzerindeki etkilerin izlenmesi önerilir ve tedavi öncesinde ve klinik olarak gerekli olduğunda bir referans elektrokardiyogramı (EKG) çekilmesi önerilmektedir. Hipokalemi veya hipomagnezemi bosutinib uygulaması öncesinde düzeltilmeli ve tedavi sırasında düzenli olarak izlenmelidir.
Böbrek yetmezliği
Bosutinib tedavisi KML hastalarında böbrek fonksiyonlarında klinik olarak anlamlı bir azalmaya neden olabilir. Klinik çalışmalarda, bosutinib ile tedavi edilen hastalarda tahmini glomerüler filtrasyon hızında (eGFR) zaman içinde düşüş gözlemlenmiştir. 400 mg ile tedavi edilen yeni tanı konmuş KF KML hastalarında eGFR'de başlangıca göre medyan düşüş 1. yılda
11,1 mL/dk/1,73 m ve tedavi almaya devam eden hastalar için 5. yılda 14,1 mL/dk/1,73 mâdir. 500 mg ile tedavi edilen daha önce tedavi almamış KML hastaları eGFR'de 1. yılda 9,2 mL/dk/1,73 m ve tedavi almaya devam eden hastalar için 5. yılda 12 mL/dk/1,73 m ve 10 yılda 16,6 mL/ dk/1,73 m'ye kadar medyan düşüş göstermiştir. 500 mg ile tedavi edilen daha önce tedavi edilmiş kronik fazda ve ilerlemiş fazda KML hastaları eGFR'de 1. yılda 7,6 mL/dk/1,73 m, tedavi almaya devam eden hastalar için 5. yılda 12,3 mL/dk/1,73 m ve 10. yılda 15,9 mL/ dk/1,73 m'ye medyan düşüş göstermiştir. Daha önce 1 ya da daha fazla TKI ile tedavi edilen ve günde 500 mg tedavi uygulanan Ph+ KML hastalarında, tedavi uygulanmakta olan hastalar için medyan eGFR'de başlangıca göre kaydedilen azalma 1 yılda 9,2 mL/dk/1,73 m ve 4 yılda 14,5 mL/dk/1,73 m olarak saptanmıştır.
Böbrek fonksiyonlarının tedavi başlatılmadan önce değerlendirilmesi ve bosutinib tedavisi sırasında yakından izlenmesi önemlidir. Özellikle daha önce böbrek sorunları yaşamış olan ya da böbrek fonksiyon bozuklukları için risk faktörleri sergileyen hastalarda (diüretikler, anjiyotensin dönüştürücü enzim (ACE) inhibitörleri, anjiyotensin reseptör blokerleri ve nonsteroidal antiinflamatuvar ilaçları (NSAİİ'ler) içeren şekilde nefrotoksisite potansiyeli bulunan tıbbi ürünlerin kullanımı dahil) dikkatli olunmalıdır.
Bir böbrek yetmezliği çalışmasında, orta şiddette ve ciddi böbrek fonksiyonu bozukluğu bulunan gönüllülerde bosutinib maruziyetleri artmıştır. Orta şiddette ve ciddi böbrek bozukluğu olan hastalarda doz azaltma önerilmektedir (bkz. bölüm 4.2 ve 5.2).
Serum kreatinin düzeyi > 1,5 Ã NÜS olan hastalar KML çalışmalarından hariç tutulmuştur. Orta şiddette ve ciddi böbrek yetmezliği olan hastalarda artan maruziyet (EAA) ile ilgili farmakokinetik bir analizde, çalışmalar sırasında tedavi başlangıcında ciddi böbrek yetmezliği gözlemlenmiştir (bkz. bölüm 4.2 ve 5.2).
Yükseltilmiş 600 mg bosutinib alan, orta şiddette böbrek bozukluğu bulunan KML hastaları için klinik veriler oldukça sınırlıdır (n = 3).
Asya ırkı
Popülasyon farmakokinetik analizlerine göre, Asyalılar daha düşük bir klirense sahipti ve bu da artan maruziyete neden olmuştur. Bu nedenle, bu hastalar özellikle doz artırımı durumunda advers reaksiyonlar açısından yakından izlenmelidir.
Ciddi cilt reaksiyonları
Bosutinib, Stevens-Johnson Sendromu ve Toksik Epidermal Nekroliz gibi şiddetli cilt reaksiyonlarını tetikleyebilir. Bosutinib, tedavi sırasında ciddi cilt reaksiyonları yaşayan hastalarda kalıcı olarak durdurulmalıdır.
Tümör lizis sendromu
Tümör lizis sendromu (TLS) görülme olasılığı nedeniyle, bosutinib tedavisine başlanmadan önce klinik olarak anlamlı dehidrasyonun ve yüksek ürik asit seviyelerinin tedavi edilmesi önerilmektedir (bkz. bölüm 4.8).
Hepatit B reaktivasyonu
Hepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar, karaciğer nakli veya ölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatit ile sonuçlanmıştır.
BOSULİF tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavi sırasında HBV enfeksiyonu için pozitif test sonucu veren hastalarda, tedavi başlatılmadan önce karaciğer hastalığı ve HBV tedavisi konusunda uzman hekimlere danışılmalıdır. BOSULİF ile tedaviye ihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavi sonlandırıldıktan sonra birkaç ay boyunca aktif HBV enfeksiyonu bulgu ve belirtileri için yakından izlenmelidir (bkz. bölüm 4.8).
Fotosensitivite
Bosutinib tedavisi ile ilişkili fotosensitivite riski nedeniyle, doğrudan güneş ışığına veya ultraviyole (UV) radyasyonuna maruziyetten kaçınılmalı veya en aza indirilmelidir. Hastalara koruyucu giysi ve yüksek güneş koruma faktörlü (SPF) güneş kremi gibi önlemleri kullanmaları söylenmelidir.
Sitokrom P 450 (CYP)3A inhibitörleri
Bosutinibin plazma konsantrasyonunda artış oluşabileceğinden bosutinibin güçlü veya orta düzeyde CYP3A inhibitörleri ile eşzamanlı kullanımından kaçınılmalıdır (bkz. bölüm 4.5).
Mümkün olan durumlarda CYP3A inhibisyon potansiyeli olmayan ya da minimum düzeyde olan alternatif bir eş zamanlı tıbbi ürün seçimi önerilmektedir.
Bosutinib tedavisi sırasında güçlü veya orta düzeyde bir CYP3A inhibitörünün uygulanması gerektiğinde, bosutinib tedavisine ara verilmesi ya da bosutinib dozunun azaltılması seçenekleri göz önünde bulundurulmalıdır.
CYP3A indükleyicileri
Bosutinibin plazma konsantrasyonunda düşüş oluşabileceğinden bosutinibin güçlü veya orta düzeyde CYP3A indükleyicileri ile eşzamanlı kullanımından kaçınılmalıdır (bkz. bölüm 4.5).
Besinlerin etkisi
Greyfurt suyuda dahil greyfurt ürünleri ve CYP3A inhibitörü olduğu bilinen diğer gıdalardan kaçınılmalıdır (bkz. bölüm 4.5).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlerin bosutinib üzerindeki etkileri
CYP3A inhibitörleri
Bosutunibin güçlü CYP3A inhibitörleri (itrakonazol, ketokonazol, posakonazol, vorikonazol, klaritromisin, telitromisin, nefazodon, mibefradil, indinavir, lopinavir/ritonavir, nelfinavir, ritonavir, sakinavir, boceprevir, telaprevir, greyfurt ürünleri dahil fakat bunlarla sınırlı olmayan) ile veya orta dereceli CYP3A inhibitörleri (flukonazol, siprofloksasin, eritromisin,
diltiazem, verapamil, amprenavir, atazanavir, darunavir/ritonavir, fosamprenavir, aprepitant, krizotinib, imatinib dahil fakat bunlarla sınırlı olmayan) ile birlikte kullanıldığında bosutinib plazma konsantrasyonunda bir artış meydana geleceğinden kaçınılmalıdır.
Hafif CYP3A inhibitörleri, bosutinib ile birlikte kullanılıyorsa dikkatli olunmalıdır.
Mümkün olan durumlarda CYP3A enzimi inhibisyon potansiyeli olmayan ya da minimum düzeyde olan alternatif bir eş zamanlı tıbbi ürün kullanımı önerilmektedir.
Eğer bosutinib tedavisi sırasında güçlü veya orta dereceli bir CYP3A inhibitörü uygulanması gerekiyorsa, bosutinib tedavisinin kesilmesi veya doz azaltılması düşünülmelidir.
Açlık koşullarında günde 5 doz halinde 400 mg ketokonazolün (güçlü bir CYP3A inhibitörü) günlük tek doz 100 mg bosutinib ile birlikte uygulandığı 24 sağlıklı birey üzerinde yapılan bir çalışmada, ketokonazol, bosutinibin tek başına uygulandığı durum ile karşılaştırıldığında bosutinib Cdeğerini 5,2 kat, plazmadaki bosutinib EAA değerini de 8,6 kat arttırmıştır.
Tokluk koşullarında günde tek bir doz halinde 125 mg aprepitantın (orta düzeyde bir CYP3A inhibitörü) günlük tek doz 500 mg bosutinib ile birlikte uygulandığı 20 sağlıklı birey üzerinde yapılan bir çalışmada, aprepitant, bosutinibin tek başına uygulandığı durum ile karşılaştırıldığında bosutinib Cdeğerini 1,5 kat, plazmadaki bosutinib EAA değerini de 2 kat artırmıştır.
CYP3A indükleyicileri
Bosutinib ile birlikte güçlü CYP3A indükleyicileri (karbamazepin, fenitoin, rifampisin, St. John's Wort dahil ancak bunlarla sınırlı olmayan) veya orta CYP3A indükleyicileri (bosentan, efavirenz, etravirin, modafinil, nafsilin dahil ancak bunlarla sınırlı olmayan) ile birlikte kullanıldığında bosutinib plazma konsantrasyonunda bir azalma meydana geleceğinden kaçınılmalıdır.
Bosutinibin rifampisin ile eş zamanlı uygulaması sırasında bosutinibteki yüksek düşüş nedeniyle güçlü veya orta şiddette CYP3A uyarıcıları ile eş zamanlı olarak bosutinib dozunun arttırılması, maruziyet kaybını yeterli miktarda takviye etmeyebilir.
Bosutinibin hafif CYP3A indükleyicileri ile birlikte kullanılması gerektiği durumlarda dikkatli
olunmalıdır.
Tokluk koşullarında günde 6 doz halinde 600 mg rifampisinin günlük tek doz bosutinib ile birlikte uygulandığı 24 sağlıklı birey üzerinde yapılan bir çalışmada, bosutinib 500 mg'nin tek başına uygulandığı durumla karşılaştırıldığında bosutinibe maruz kalma sırasıyla (plazmada Cve EAA) %14'e ve %6'ya düşmüştür.
Proton pompası inhibitörleri (PPİ'ler)
Bosutinib PPİ ile eş zamanlı olarak uygulanılırken dikkatli olunmalıdır. PPİ'lere alternatif olarak kısa etkili antasitler düşünülmeli ve bosutinib ile antasit uygulama zamanları mümkün olduğunca birbirinden ayrılmalıdır (ör. bosutinibin sabah, antiasitlerin de akşam alınması). Bosutinib, in vitro olarak pH bağımlı suda çözünürlük göstermektedir. Açlık durumda birden fazla oral lansoprazol (60 mg) dozu ile eş zamanlı olarak tek bir oral doz halinde bosutinib (400
mg) uygulananan 24 sağlıklı gönüllü üzerinde yapılan bir çalışmada 400 mg bosutinibin tek başına uygulandığı durumla karşılaştırıldığında bosutinib Cve EAA değerleri sırasıyla
%54'e ve %74'e düşmüştür.
Bosutinibin diğer tıbbi ürünler üzerindeki etkileri
Tokluk durumunda tek doz 500 mg bosutinibin tek doz 150 mg dabigatran eteksilat mesilat (p- glikoprotein [P-gp] substratı) ile birlikte uygulandığı 27 sağlıklı birey üzerinde yapılan bir çalışmada, dabigatran eteksilat mesilatın tek başına uygulandığı durum ile karşılaştırıldığında, bosutinib dabigatranın plazma Cveya EAA değerlerini arttırmamıştır. Çalışma sonuçları, bosutinibin klinik olarak anlamlı P-gp inhibe edici etki sergilemediğini göstermiştir.
Bir in vitro çalışmada, CYP1A2, CYP2B6, CYP2C9, CYP2C19 ve CYP3A4 substratları olan tıbbi ürünlerin metabolizmasının bosutinib tarafından indüksiyonun bir sonucu olarak terapötik dozlarda ilaç-ilaç etkileşiminin görülme olasılığının düşük olduğunu göstermiştir.
Bir in vitro çalışmada, CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 veya CYP3A4/5 substratları olan tıbbi ürünlerin metabolizmasının bosutinib tarafından inhibisyonunun bir sonucu olarak terapötik dozlarda ilaç-ilaç etkileşiminin görülme olasılığının düşük olduğunu göstermiştir.
İn vitro çalışmalar klinik olarak anlamlı dozlarda bosutinibin meme kanseri direnç proteini (sistemik BCRP), organik anyon taşıyıcı peptid (OATP)1B1, OATP1B3, organik anyon taşıyıcı (OAT)1, OAT3, organik katyon taşıyıcı (OCT)2'yi inhibe etme potansiyelinin düşük olduğunu; ancak gastrointestinal kanalda BCRP'yi ve OCT1'i imhibe etme potansiyelinin bulunduğunu göstermektedir.
Anti-aritmik tıbbi ürünler ve QT'yi uzatabilecek diğer maddeler
Bosutinib, amiodaron, disopiramid, prokainamid, kinidin ve sotalol gibi anti-aritmik tıbbi ürünleri kullanan ya da klorokin, halofantrin, klaritromisin, domperidon, haloperidol, metadon ve moksifloksasin gibi QT uzamasına yol açabilecek diğer tıbbi ürünleri kullanan hastalarda dahil QT süre uzaması yaşamış ya da böyle bir risk barındıran hastalarda, dikkatli bir şekilde kullanılmalıdır (bkz. bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Özel veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kullanım kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlara bosutinib tedavisi sırasında ve son bosutinib dozundan sonra en az 1 ay boyunca etkin kontrasepsiyon kullanmaları ve gebe kalmamaları tavsiye edilmelidir. Ayrıca; hasta kusma ya da ishalin oral kontraseptiflerinin tam emilimini
engelleyerek oral olarak uygulanan doğum kontrol yöntemlerinin etkisini azaltabileceği konusunda bilgilendirilmelidir.
Gebelik dönemi
Bosutinib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. BOSULİF gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Hamilelerde bosutinib kullanımı ile ilgili sınırlı veri bulunmaktadır. Hayvanlar üzerindeki çalışmalar üreme toksisitesi göstermiştir (bkz. bölüm 5.3). Bosutinib gebelik sırasında veya doğum kontrol yöntemi kullanmayan çocuk sahibi olma potansiyeli olan kadınlarda kullanılması önerilmez. Eğer bosutinib hamilelik sırasında kullanılıyorsa ya da hasta bosutinib alırken gebe kalırsa, fetüse potansiyel bir tehlike olduğu konusunda uyarılmalıdır.
Laktasyon dönemi
Bosutinibin ve metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Sıçanlar üzerinde [C] radyoaktif işaretli bosutinib ile yapılan bir çalışmada, anne sütünde bosutinib türevli radyoaktivite tespit edilmiştir (bkz. bölüm 5.3). Emzirilen bebek üzerindeki potansiyel risk göz ardı edilemez. Bosutinib ile tedavi sırasında emzirmeye son verilmelidir.
Üreme yeteneği/Fertilite
Klinik olmayan bulgulara dayanarak, bosutinibin insanlarda üreme fonksiyonunu ve fertiliteyi bozma potansiyeli vardır (bkz. bölüm 5.3). Bosutinib tedavisi nedeni ile fertilitede bozulma potansiyeli bulunduğundan bosutinib ile tedavi edilen erkeklerin tedavi öncesi sperm saklanması konusunda görüş almaları önerilmektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Bosutinibin araç ve makine kullanma kabiliyeti üzerinde etkisi yoktur ya da önemsenmeyecek kadar azdır. Bununla birlikte, eğer bosutinib kullanan bir hasta, baş dönmesi, yorgunluk, görme bozukluğu araç ya da makine kullanımını etkileyebilecek başka istenmeyen etkilerle karşılaşması durumunda, istenmeyen etki devam ettiği sürece bu faaliyetlerden kaçınmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Toplamda 1.372 Ph+ lösemi hastası, en az 1 doz monoterapi bosutinib almıştır. Tedavinin medyan süresi 26,30 aydır (aralık: 0,03-170,49 ay). Bu hastalar, yeni tanı konmuş Ph+ KF KML hastaları ya da önceki tedaviye karşı direnç göstermiş ya da tedaviyi tolere etmemiş kronik, akselere veya blastik faz KML veya Ph+ akut lenfoblastik lösemi (ALL) hastalarıdır. Bu hastalar arasından 268'i (400 mg başlangıç dozu) ve 248'i (500 mg başlangıç dozu) daha önce tedavi edilmemiş KML hastalarının dahil olduğu 2 Faz 3 çalışmasından, 60'ı (400 mg başlangıç dozu) daha önce tedavi görmemiş KML hastalarında yapılan bir Faz 2 çalışmasından, 570 ve 63'ü (Faz 2: 500 mg başlangıç dozu) daha önce tedavi edilmiş Ph+ lösemi hastaları üzerinde yapılan 2 Faz 1/2 çalışmasından ve 163'ü (500 mg başlangıç dozu) daha önce tedavi edilmiş KML hastalarında yapılan bir Faz 4 çalışmasındandır. Medyan tedavi süresi sırasıyla 55,1 ay (aralık: 0,2-60,05 ay), 61,6 ay (0,03-145,86 ay), 15,3 ay (aralık: 0,3-21,8 ay) 11,1 ay (aralık:
0,03-170,49 ay), 30,2 ay (aralık: 0,2-85,6 ay), ve 37,80 ay (aralık: 0,16-50 ay)'dır. Güvenlilik
analizi tamamlanan bir uzatma çalışmasının verilerini içermektedir.
1.349 (%98,3) hasta için herhangi bir toksisite derecesinde en az 1 advers reaksiyon bildirilmiştir. Hastaların ≥%20'si için en sık bildirilen advers reaksiyonlar ishal (%80,4), bulantı (%41,5), karın ağrısı (%35,6), trombositopeni (%34,4), kusma (%33,7), döküntü (%32,8), yorgunluk (%32), alanin aminotranseraz (ALT) düzeyinde artış (%28), anemi (%27,2), pireksi (%23,4), aspartat aminotransferaz (AST) düzeyinde artış (%22,5), ve baş ağrısıdır (%20,3). 943 (%68,7) hasta için en az 1 Derece 3 veya Derece 4 advers reaksiyon bildirilmiştir. Hastaların
≥%5'inde görülen Derece 3 veya Derece 4 advers reaksiyonlar; trombositopeni (%19,7), ALT artışı (%14,6), nötropeni (%10,6), ishal (%10,6), anemi (%10,3), lipaz düzeyinde artış (%10,1),
AST artışı (%6,7) ve döküntüdür (%5).
Advers reaksiyonların listesi
Bosutinib klinik çalışmalarında aşağıdaki advers reaksiyonlar rapor edilmiştir. Bunlar yeni tanı konmuş KF KML ya da önceki tedaviye direnç göstermiş ya da tedaviyi tolere etmemiş kronik, akselere veya blastik faz KML veya Ph+ akut lenfoblastik lösemi (ALL) tedavisine ve daha önce en az 1 doz tek ajanlı bosutinib almış 1.372 hastadan gelen advers reaksiyon verilerinin değerlendirilmesini temsil etmektedir.
Advers reaksiyonlar sistem organ sınıfına, sıklık kategorisine ve şiddetinin derecesine göre listelenmektedir. Sıklık kategorileri şu şekilde tanımlanmaktadır: Çok yaygın (≥l/10); yaygın (≥l/100 ile <1/10); yaygın olmayan (≥l/1000 ile <1/100); seyrek (≥l/10.000 ile <1/1000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık grubu içinde, advers reaksiyonlar azalan ciddiyet sırasıyla sunulmaktadır.
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Solunum yolu enfeksiyonu (alt solunum yolu enfeksiyonu, viral solunum yolu enfeksiyonu, üst solunum yolu enfeksiyonu, viral üst solunum yolu enfeksiyonu dahil), nazofarenjit
Yaygın: Pnömoni (atipik pnömoni, bakteriyel pnömoni, fungal pnömoni, nekrotizan pnömoni, streptokokal pnömoni dahil), grip (H1N1 grip dahil), bronşit
Benign, malign ve tanımlanmamış neoplazmlar (kistler ve polipler dahil)
Yaygın olmayan: Tümör lizis sendromu*
Kan ve lenf sistemi hastalıkları
Çok Yaygın: Trombositopeni (azalmış platelet sayımı dahil), nötropeni (azalmış nötrofil sayımı dahil), anemi (azalmış hemoglobin, azalmış kırmızı kan hücre sayısı dahil),
Yaygın: Lökopeni (azalmış beyaz kan hücresi sayımı dahil) Yaygın olmayan: Febril nötropeni, granülositopeni
Bağışıklık sistemi hastalıkları Yaygın: İlaç aşırı duyarlılığı Yaygın olmayan: Anafilaktik şok
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah azalması
Yaygın: Dehidratasyon, hiperkalemi (kandaki potasyum artışı dahil), hipofosfatemi (kandaki fosforun azalması dahil)
Sinir sistemi hastalıkları
Çok yaygın: Baş dönmesi, baş ağrısı Yaygın: Disguzi
Kulak ve iç kulak hastalıkları
Yaygın: Kulak çınlaması
Kardiyak hastalıklar Yaygın: Perikardiyal efüzyon Yaygın olmayan: Perikardit
Vasküler hastalıklar
Yaygın: Hipertansiyon (yüksek kan basıncı, yüksek sistolik kan basıncı, esansiyel hipertansiyon, hipertansif kriz dahil)
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok yaygın: Plevral efüzyon, dispne, öksürük
Yaygın: Pulmoner hipertansiyon (Pulmoner arteriyel hipertansiyon, pulmoner arter basıncı
artışı dahil), solunum yetmezliği
Yaygın olmayan: Akut pulmoner ödem (pulmoner ödem dahil)
Gastrointestinal hastalıklar
Çok yaygın: Diyare, kusma, bulantı, abdominal ağrı (karın bölgesinde rahatsızlık, alt karın bölgesinde ağrı, üst karın bölgesinde ağrı, karın bölgesinde hassasiyet, gastrointestinal ağrı) Yaygın: Gastrointestinal hemoraji (anal kanama, gastrik kanama, intestinal kanama, alt gastrointestinal kanama, rektal kanama, üst gastrointestinal kanama dahil), Pankreatit (akut pankreatit dahil), gastrit
Hepatobiliyer hastalıklar
Yaygın: Hepatotoksisite (hepatit, toksik hepatit, karaciğer bozukluğu dahil), hepatik fonksiyon anormaliği (hepatik enzim artışı, karaciğer fonksiyon testlerinde anormallik, karaciğer fonksiyon testlerinde artış, transaminazda artış dahil)
Yaygın olmayan: Karaciğer hasarı (ilaçla indüklenen karaciğer hasarı, hepatosellüler hasar dahil)
Deri ve deri altı doku hastalıkları
Çok yaygın: Döküntü (maküler döküntü, makülopapüler döküntü, papüler döküntü, pruritik döküntü dahil), kaşıntı
Yaygın: Fotosensitivite reaksiyonu, (polimorf ışık erüpsiyonu dahil), ürtiker, akne Yaygın olmayan: Eritema multiforma, eksfolyatif döküntü, ilaç erüpsiyonu Bilinmiyor: Stevens-Johnson Sendromu*, Toksik epidermal nekroliz*
Kas-iskelet bozuklukları ve bağ doku ve kemik hastalıkları
Çok yaygın: Artralji, sırt ağrısı Yaygın: Miyalji
Böbrek ve idrar yolu hastalıkları
Yaygın: Akut böbrek hasarı, böbrek yetmezliği, böbrek fonksiyon bozukluğu
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Çok yaygın: Ödem (göz kapağı ödemi, yüzde ödem, genel ödem, lokalize ödem, periferal ödem, periorbital ödem, periorbital şişme, periferal şişme, şişme, göz kapağı şişmesi dahil), pireksi, yorgunluk (asteni, halsizlik dahil)
Yaygın: Göğüs ağrısı (göğüs bölgesinde rahatsızlık dahil), ağrı
Araştırmalar
Çok yaygın: Lipaz artışı (hiperlipazemi dahil), Alanin aminotransferaz artışı (anormal alanin aminotransferaz dahil), Aspartat aminotransferaz artışı, Kan kreatinin artışı
Yaygın: Elektrokardiyogram QT uzaması (Uzun QT sendromu dahil), kanda amilaz artışı (hiperamilazemi dahil), kan kreatin fosfokinaz artışı, Gama glutamiltransferaz artışı, Kan bilirubin artışı (Hiperbilirubinemi dahil, Konjuge bilirubin artışı, Konjuge olmayan kan bilirubin artışı dahil)
* Pazarlama sonrası tanımlanan ADR Seçilen advers reaksiyonların tanımı
Aşağıda yer alan açıklamalar; yeni tanı konmuş KF KML hastaları veya daha önce tedaviye karşı direnç göstermiş ya da tedaviyi tolere edememiş olan kronik, akselere veya blastik faz KML veya Ph+ ALL hastaları için en az bir doz bosutinib almış 1.372 hastalık bir güvenlilik popülasyonuna dayanmaktadır.
Kan ve lenf sistemi hastalıkları
Anemi rapor edilen 372 hastadan (%27,1) 6'sında anemi nedeniyle bosutinib kullanımına son verilmiştir. 95 hastada (%25,5) Derece 1 maksimum toksisite, 135 hastada (%36,3) Derece 2,
113 hastada (%30,4) Derece 3 ve 29 hastada (%7,8) Derece 4 meydana gelmiştir. Bu hastalar arasında, ilk olaya kadar geçen medyan süre 29 gündür (aralık: 1-3.999 gün) ve olay başına medyan süre 22 gündür (aralık: 1â3.682 gün).
Nötropeni rapor edilen 209 hastadan (%15,2) 19'unda nötropeni nedeniyle bosutinib kullanımına son verilmiştir. 19 hastada (%9,1) Derece 1 maksimum toksisite, 45 hastada
(%21,5) Derece 2, 95 hastada (%45,5) Derece 3 ve 50 hastada (%23,9) Derece 4 meydana gelmiştir. Bu hastalar arasında ilk olaya kadar geçen medyan süre 56 gündür (aralık: 1-1.769 gün) ve olay başına medyan süre 15 gündür (aralık: 1-913 gün).
Trombositopeni rapor edilen 472 hastanın (%34,4) 42'sinde trombositopeni nedeniyle bosutinib kullanımına son verilmiştir. 114 hastada (%24,2) Derece 1 maksimum toksisite, 88 hastada
(%18,6) Derece 2, 172 hastada (%36,4) Derece 3 ve 98 hastada (%20,8) Derece 4 meydana
gelmiştir. Bu hastalar arasında, ilk olaya kadar geçen medyan süre 28 gündür (aralık: 1-1.688 gün) ve olay başına medyan süre 15 gündür (aralık: 1-3.921 gün).
Hepatobilyer hastalıklar
ALT veya AST artışlarını (tüm derecelerde) advers reaksiyonları olarak bildiren hastalar arasında, çalışmada gözlemlenen başlangıç için medyan süre 29 gündür; bunda ALT ve AST için başlangıç aralığı 1-3.995 gündür. Bir olay için medyan süre, ALT ve AST için sırasıyla 17 gün (aralık: 1-1.148 gün) ve 15 gündür (aralık: 1-803 gün).
Alternatif nedenler olmadan, bosutinib ile tedavi edilmiş 2/1.711 (%0,1) kişide ilaca bağlı karaciğer hasarı (ALT veya AST ≥ 3 Ã NÜS ile eşzamanlı olarak total bilirubin > 2 Ã NÜS ve alkalen fosfataz < 2 Ã NÜS olacak şekilde tanımlanır) gözlenmiştir.
Hepatit B reaktivasyonu
BCR-ABL TKI'ler ile ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda karaciğer nakli gerektirecek ya da ölümcül olabilecek düzeyde akut karaciğer yetmezliği veya fulminan hepatit görülmüştür (bkz. bölüm 4.4).
Gastrointestinal hastalıklar
İshal gözlenen 1.103 (%80,4) hastadan, 14'ü bu olay nedeniyle bosutinibi bırakmıştır. Hastaların 756'sına (%68,5) ishal tedavisi için eşzamanlı olarak tıbbi ürünler verilmiştir. Derece 1 maksimum toksisite hastaların 575'inde (%52,1), Derece 2 383'ünde (%34,7), Derece
3 144'ünde (%13,1), Derece 4 ise 1 hastada (%0,1) meydana gelmiştir. İshal advers olayları yaşayan hastalar arasında, ilk olaya kadar geçen medyan süre 2 gündür (aralık: 1-2.702 gün) ve her dereceden ishal için medyan süre 2 gündür (aralık: 1â4.247 gün).
İshal olayı yaşayan 1.103 hasta arasında 218 hasta (%19,8) tedaviye ara verilerek tedavi edilmiş ve bunlar arasında 208'i (%95,4) yeniden bosutinib tedavisine dönmüştür. Yeniden tedaviye dönenler arasında, 201'i (%96,6) daha sonra bir olay yaşamamış ya da daha sonra yaşanan ishal olayı nedeniyle bosutinibi bırakmamıştır.
Kardiyak hastalıklar
Yedi hastada (%0,5) QTcF süre uzaması (500 ms'den büyük) gözlemlenmiştir. On bir (%0,8) hasta, başlangıç düzeyinden > 60 ms QTcF artışı yaşamıştır. QTc süre uzamasını da içeren şekilde kontrol edilemeyen veya kayda değer düzeyde kalp hastalığı bulunan hastalar, başlangıçta klinik çalışmalara dahil edilmemiştir (bkz. bölüm 5.1 ve 5.3).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda bosutinib aşırı dozu ile ilgili deneyim birkaç vaka ile sınırlıdır. Aşırı dozda bosutinib alan hastalar gözlemlenmeli ve bu hastalara uygun destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EA04
Etki mekanizması
Bosutinib, farmakolojik olarak kinaz inhibitörü olarak bilinen bir tıbbi ürün sınıfına aittir. Bosutinib KML'yi destekleyen anormal Bcr-Abl kinazını inhibe eder. Modelleme çalışmaları, bosutinibin Bcr-Abl kinaz alanını bağladığını göstermiştir. Bosutinib aynı zamanda Src, Lyn ve Hck'yi de içeren Src familyasını da inhibe etmektedir. Bosutinib, asgari olarak PDGF reseptörü ile c-Kit'i inhibe etmektedir.
İn vitro çalışmalarda, bosutinib belirlenmiş KML hücre dizisinin, Ph+ ALL hücre dizilerinin ve hastadan elde edilen primer primitif KML hücrelerinin çoğalması ve sağkalımını inhibe etmiştir. Bosutinib, murin miyeloid hücre dizilerinde bulunan Bcr-Abl'nin 18 imatinibe karşı dirençli formundan 16'sını inhibe etmiştir. Bosutinib tedavisi, çıplak farelerde KML tümörlerinin büyüme boyutunda düşüş sağlamış ve Bcr-Abl'nin imatinibe karşı dirençli formlarında murin miyeloid tümörlerinin büyümesini inhibe etmiştir. Bosutinib aynı zamanda reseptör tirosin kinazlar c-Fms, EphA ve B reseptörleri, Trk familyası kinazları, Axl familyası kinazları, Tec familyası kinazları, ErbB familyasının bazı üyeleri, reseptör olmayan tirosin kinaz Csk, Ste20 familyasının serin/treonin kinazları ve iki kalmoduline bağlı protein kinazını da inhibe etmektedir.
Farmakodinamik etkiler
Sağlıklı gönüllüler üzerinde gerçekleştirilen randomize, tek dozlu, çift kör (bosutinib açısından), çapraz, plasebo ve açık etiketli moksifloksasin kontrollü bir çalışmada 500 mg bosutinib uygulamasının düzeltilmiş QTc üzerindeki etkisi değerlendirilmiştir.
Bu çalışmadan elde edilen veriler, bosutinibin önerilen doz olan ve yemekle alınan günde 500 mg bosutinibin, supraterapötik plazma konsantrasyonu koşullarında sağlıklı gönüllülerde QTc süre uzamasına neden olmadığını göstermektedir. Sağlıklı gönüllülerde ağız yoluyla tek doz halinde alınan 500 mg bosutinibin (terapötik doz) ve 400 mg ketokonazol ile 500 mg bosutinibin (supraterapötik bosutinib konsantrasyonlarını elde etmek için) uygulanmasının ardından, tek taraflı %95 güven aralığı (GA) üst sınırında, QTc'deki orta değişim, tüm doz sonrası zaman noktalarında 10 ms'den düşük olmuş ve QTc süre uzatımını ifade eden herhangi bir advers olay gözlemlenmemiştir.
Karaciğeri hasar görmüş gönüllülerde karaciğer fonksiyonlarında azalma ile QTc süre uzaması
> 450 ms sıklığında artış gözlemlenmiştir. Daha önce 500 mg bosutinib ile tedavi edilen Ph+ lösemi hastaları üzerinde yapılan bir Faz 1/2 klinik çalışmada, 570 hastadan 9'unda (%1,6) başlangıçtan itibaren QTcF'de > 60 ms'lik artış gözlemlenmiştir. Yeni Ph+ KF KML tanısı konmuş 400 mg bosutinib ile tedavi edilen hastalar üzerinde yapılan bir Faz 3 klinik çalışmada, bosutinib tedavi grubunda (N=268) başlangıca göre QTcF'de > 60 ms'lik artışı olan hasta bulunmamaktadır. Yeni Ph+ KF KML tanısı konmuş 500 mg bosutinib ile tedavi edilen hastalar üzerinde yapılan bir Faz 3 klinik çalışmada, bosutinib alan 248 hastadan 2'sinde (%0,8) başlangıçtan itibaren QTcF'de >60 ms'lik artış gözlemlenmiştir. Daha önce 1 ya da daha fazla TKI ile tedavi edilen ve bosutinib 500 mg tedavisi uygulanan Ph+ KML hastalarında (N=163) yapılan Faz 4 klinik çalışmada, hiçbir hastada QTcF'de başlangıca göre >60 ms artış ortaya çıkmamıştır. Bosutinibin proaritmi potansiyeli göz ardı edilemez.
Klinik etkililik
Daha önce tedavi edilmemiş KML ile kronik fazdaki klinik çalışma
Bosutinib 400 mg çalışması
Yeni tanı konmuş yetişkin Ph+ KF KML hastalarında günde 400 mg tek başına bosutinibin etkililik ve güvenliliğini değerlendirmek üzere tek başına günde 400 mg imatinib ile karşılaştırmalı 2 kollu, Faz 3, açık etiketli, çok merkezli süperiorite çalışması yürütülmüştür. Çalışmada b2b2 ve/veya b3b2 transkripti bulunan ve başlangıçta BCR-ABL kopyaları >0 olan 487 Ph+ KML hastasını (modifiye edilmiş ITT (mITT) popülasyonu) içeren Ph+ veya Ph- yeni tanı konmuş 536 (her tedavi grubunda 268'er hasta) KF KML hastası (ITT popülasyonu) randomize edilmiştir.
Çalışmanın primer etkililik sonlanım noktası 12. ayda (48 hafta) mITT popülasyonda imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda major moleküler bir yanıt (MMY) gösterme oranıdır. MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır.
Ana sekonder sonlanım noktaları 12 ayda TSY, TSY süresi, MMY süresi, olaysız sağkalım ve genel sağkalımdır. 12. ayda TSY; kemik iliğinden elde edilen ≥ 20 metafazın kromozom bantlama analizinde Ph+ metafazların bulunmaması veya uygun bir sitogenetik değerlendirme bulunmuyorsa MMY olarak tanımlanmıştır. 12. ayda MMY dışındaki sonlanım noktaları için p-değerleri ve 12 ayda TSY çoklu karşılaştırmalar için ayarlanmamıştır.
mITT popülasyonu için başlangıç özellikleri 2 tedavi grubu arasında yaş (bosutinib grubu için medyan yaş 52 ve imatinib grubu için 53; hastaların sırasıyla %19,5'i ve %17,4'si 65 yaş ve üzeridir), cinsiyet (sırasıyla %42,3 ve %44 kadın), ırk (sırasıyla Kafkasyalı %78 ve %77,6,
Asyalı %12,2 ve %12,4, Siyahi veya Afrikan Amerikan %4,1 ve %4,1, ve Diğer %5,7 ve %5,4, ve imatinib grubunda 1 bilinmeyen) ve Sokal risk skoru (sırasıyla düşük risk %35 ve %39,4, orta risk %43,5 ve %38,2, yüksek risk %21,5 ve %22,4) açısından iyi dengelenmiştir.
mITT popülasyonunda 60 aylık takip sonrasında, bosutinib ile tedavi edilen hastaların (N=246)
%60,2'si ve imatinib ile tedavi edilen hastaların (N=239) %59,8'i halen ilk basamak tedavi
almaktadır.
mITT popülasyonunda 60 aylık takip sonrasında, hastalığın AF veya BF KML'ye ilerlemesi nedeniyle çalışmayı bırakma imatinib ile tedavi edilen hastalar için %1,7'e kıyasla bosutinib ile tedavi edilen grupta %0,8 olmuştur. Altı (%2,4) bosutinib hastası ve yedi (%2,9) imatinib hastası AF KML veya BF KML'ye dönüşmüştür. Araştırmacı tarafından değerlendirilen suboptimal yanıt veya tedavi başarısızlığı nedeniyle çalışmanın bırakılması, imatinib ile tedavi edilen gruptaki hastaların %15,5'ine kıyasla bosutinib ile tedavi edilen gruptaki hastaların
%5,3'ünde görülmüştür. Çalışma sırasında bosutinib grubunda 12 (%4,9) ve imatinib grubunda
14 (%5,8) hasta hayatını kaybetmiştir. ITT popülasyonunda ek transformasyon meydana
gelmemiştir, ITT popülasyonunda bosutinib kolunda 2 ek ölüm meydana gelmiştir. Tablo 2'de MMY ve TSY etkililik sonuçları özetlenmiştir.
Tablo 2 - mITT popülasyonunda tedavi grubuna göre 12. ve 18. ayda MMY ve 12 ayda TSY özeti
Yanıt | Bosutinib (N=246) | İmatinib (N=241) | Tahmini risk oranı (%95 GA) |
Majör Moleküler yanıt 12. ayda MMY, n (%) (%95 GA) | 116 (47,2) (40,9-53,4) |
89 (36,9) (30,8-43) |
1,55(1,07-2,23) |
Tek taraflı p-değeri | 0,0100 | ||
18. ayda MMY, n (%) %95 GA | 140 (56,9) (50,7-63,1) | 115 (47,7) (41,4-54) | 1,45 (1,02-2,07) |
Tek taraflı p-değeri | 0,0208 | ||
Tam sitogenetik yanıt 12. ayda TSY, n (%) (%95 GA) | 190 (77,2) (72-82,5) |
160 (66,4) (60,4-72,4) |
1,74 (1,16-2,61) |
Tek taraflı p-değeri | 0,0037 | ||
Not: MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR-ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır. TSY; kemik iliğinden elde edilen ≥20 metafazın kromozom bantlama analizinde Ph+ metafazların bulunmaması veya uygun bir sitogenetik değerlendirme bulunmuyorsa MMY olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; CMH=Cochran Mantel Haenszel; TSY=tam sitogenetik yanıt; mITT=modifiye ITT; MMY=major moleküler yanıt; N/n=hasta sayısı; Ph+=Philadelphia kromozomu-pozitif.
12. ayda mITT popülasyonunda, MY oranı (minimum 9.800 ABL transkript ile ≤ %0,01 BCR ABL [standardize edilmiş başlangıçtan ≥4 log azalmaya denk gelir] şeklinde tanımlanır)
imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksek bulunmuştur (bosutinib grubunda %20,7'ye [%95 GA: %15,7-%25,8] karşılık imatinib grubunda %12 [%95 GA: %7,9-
%16,1], tahmini risk oranı 1,88 [%95 GA: 1,15-3,08], tek taraflı p değeri=0,0052).
3, 6 ve 9. aylarda MMY'li hastaların oranı imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksektir (Tablo 3).
Tablo 3 - mITT popülasyonunda 3, 6 ve 9. aylarda tedaviye göre MMY karşılaştırması
Zaman | MMY'li hastaların sayısı (%) | Tahmini risk oranı (%95 GA) | |
Bosutinib (N=246) | İmatinib (N=241) | ||
3. ay (%95 GA) | 10 (4,1) (1,6-6,5) | 4 (1,7) (0-3,3) | 2,48 (0,77-7,98) |
Tek taraflı p-değeri | 0,0578 | ||
6. ay (%95 GA) | 86 (35) (29-40,9) | 44 (18,3) (13,4-23,1) | 2,42 (1,59-3,69) |
Tek taraflı p-değeri | <0,0001 | ||
9. ay (%95 GA) | 104 (42,3) (36,1-48,4) | 71 (29,5) (23,7-35,2) | 1,78 (1,22-2,6) |
Tek taraflı p-değeri | 0,0015 | ||
Not: Yüzdeler her tedavi grubundaki hasta sayısına dayanmaktadır. MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; CMH=Cochran Mantel Haenszel; mITT=modifiye ITT; MMY=major moleküler yanıt; N=hasta sayısı.
60. ayda mITT popülasyonunda MMY, MY ve MY olan hastaların oranı, imatinib grubuna kıyasla bosutinib grubunda daha yüksekti (Tablo 4). Sokal risk alt gruplarında 60. aydaki MMY oranları Tablo 5'te özetlenmiştir.
Tablo 4 - 60. ayda mITT popülasyonundaki moleküler yanıtın özeti
Yanıt | Bosutinib (N=246) | İmatinib (N=241) | Tahmini risk oranı (%95 GA) |
60. ayda moleküler yanıt, n (%) (%95 GA) |
|
|
|
MMY | 182 (74) (68,5-79,5) | 158 (65,6) (59,6-71,6) | 1,52 (1,02-2,25) |
MY | 145 (58,9) (52,8-65,1) | 120 (49,8) (43,5-56,1) | 1,46 (1,02-2,09) |
MY | 119 (48,4) (42,1-54,6) | 93 (38,6) (32,4-44,7) | 1,50 (1,05-2,16) |
Not: MMY/MY/MY, merkezi laboratuvar tarafından değerlendirilen minimum 3.000/9.800/30.990 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1/0,01/0,0032 BCR-ABL/ABL oranı (standard başlangıç noktasından ≥ 3/4/4,5 log azalmaya denk) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; mITT=modifiye ITT; MMY=majör moleküler yanıt; MY=moleküler yanıt; N/n=hasta sayısı.
Tablo 5 - 60. ayda mITT popülasyonunda Sokal risk skoruna göre MMY özeti
Yanıt | Bosutinib | İmatinib | Tahmini risk oranı (%95 GA) |
Düşük Sokal risk MMY, n (%) (%95 GA) | N=86 67 (77,9) (69,1-86,7) | N=95 68 (71,6) (62,5-80,6) | 1,40 (0,71-2,76) |
Orta Sokal risk MMY, n (%) (%95 GA) | N=107 79 (73,8) (65,5-82,2) | N=92 62 (67,4) (57,8-77) | 1,37 (0,74-2,52) |
Yüksek Sokal risk MMY, n (%) (%95 GA) | N=53 36 (67,9) (55,4-80,5) | N=54 28 (51,9) (38,5-65,2) | 1,97 (0,90-4,32) |
Not: Yüzdeler, her tedavi grubundaki hasta sayısına göre belirlenmiştir. MMY merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR-ABL/ABL oranı (standart başlangıç noktasından ≥ 3/ log azalmaya denk) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson; GA=güven aralığı; mITT=modifiye ITT; MMY=majör moleküler yanıt; N/n=hasta sayısı.
TSY'siz tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış TSY'nin kümülatif insidansı mITT popülasyonunda bosutinib tedavi grubunda imatinib tedavi grubuna kıyasla daha yüksektir (60. ayda %83,3'e [%95 GA: %78,1-%87,4] karşılık %76,8 [%95 GA: %70,9-
%81,6]; kademelenmiş orantısal alt dağıtımlı bir tehlike modelinden tehlike oranı [HR]: 1,35 [%95 GA: 1,11-1,64]). TSY'ye (sadece yanıt verenler) olan medyan süre bosutinib grubunda
24 haftaya (aralık: 11,4-120,7) karşılık imatinib grubunda 24,3 hafta (aralık: 11,4-96,6) olmuştur.
MMY, MY ve MY'e kadar geçen medyan süre mITT popülasyonunda (sadece yanıt verenler) bosutinib tedavi grubu için sırasıyla 36,1 hafta (aralık: 11,9-241,9), 83,7 hafta (aralık: 12,4-244,3), 108 hafta (aralık: 24,1-242,1) iken, imatinib tedavi grubunda sırasıyla 47,7 hafta
(aralık: 12,1-216,1), 84,4 hafta (aralık: 23,6-241,9), 120,4 haftaydı (aralık: 24,6 -240,7).
Şekil 1 ila 3'te gösterildiği gibi, olay olmadan tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış MMY, MY ve MY'in kümülatif insidansı, imatinib ile karşılaştırıldığında bosutinib ile daha yüksekti.
Şekil 1 - Kümülatif MMY insidansı (mITT popülasyonu)
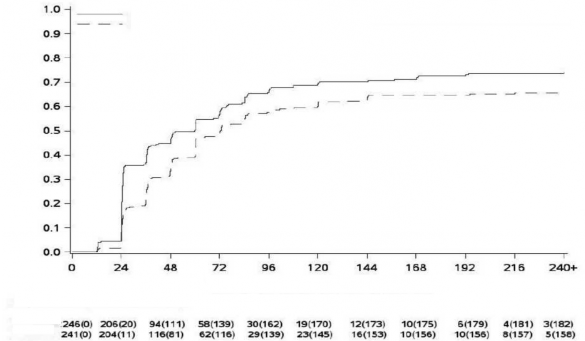
MMR Olasılığı
MMY Olasılığı
Randomizasyondan itibaren geçen süre (hafta)
MR Olasılığı
Randomizasyondan itibaren geçen süre (hafta)
MY Olasılığı
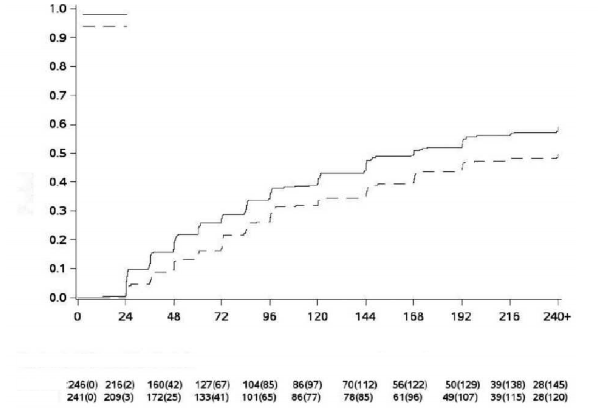
Şekil 2 - Kümülatif MYinsidansı (mITT popülasyonu)
Randomizasyondan itibaren geçen süre (hafta)
MY Olasılığı
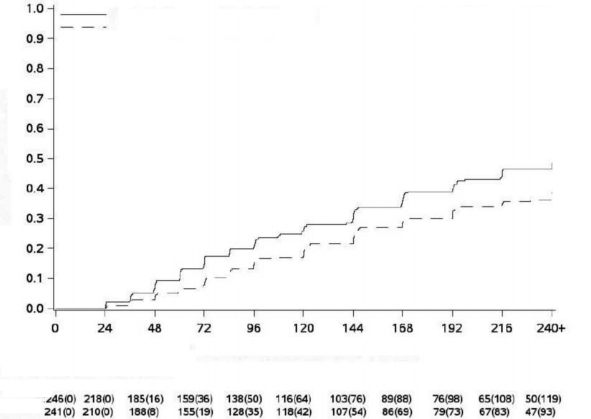
Şekil 3 - Kümülatif MYinsidansı (mITT popülasyonu)
mITT popülasyonunda, TSY'ye ulaşan hastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinib gruplarında sırasıyla %97,4 (%95 GA: %93,9-
%98,9) ve %93,7 (%95 GA: %88,9-%96,5) (HR 0,39 [%95 GA: 0,14-1,13] idi. MMY'ye ulaşan
hastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinib gruplarında sırasıyla %92,2 (%95 GA: %86,8-%95,4) ve %92 (%95 GA: %85,9-%95,5) (HR
1,09 [%95 GA: 0,49-2,44] idi.
60. ayda, mITT popülasyonunda bosutinib ve imatinib ile tedavi edilen hastaların sırasıyla
%43,9'u (%95 GA: %37,7-%50,1) ve %38,6'sında (%95 GA: %32,4-%44,7) (tahmini risk oranı
1,24 [%95 GA: 0,87, -1,78]), şu kriterlere göre tanımlanan MY mevcuttu: 1 yıllık süre zarfında
yapılan tüm değerlendirmelerde en az MY ile minimum 3 yıl boyunca tedavi.
60. ayda mITT popülasyonunda tedavi sırasında olaysız sağkalım olaylarının kümülatif insidansı bosutinib kolunda %6,9 (%95 GA: %4,2-%10,5) ve imatinib kolunda %10,4 (%95
GA: %6,9-%14,6) (HR 0,64, %95 GA: 0,35-1,17) idi.
60. ayda mITT popülasyonunda genel sağkalımın Kaplan-Meier tahminleri bosutinib ve
imatinib hastaları için sırasıyla %94,9 (%95 GA: %91,1-%97) ve %94 (%95 GA: %90,1-
%96,4) (HR 0,80, %95 GA: 0.37-1.73) olmuştur.
Retrospektif bir analizde, ITT popülasyonundaki değerlendirilebilir hastalar arasında, bosutinib kolunda daha fazla hastada 200/248 (%80,6) imatinib kolundaki hastalara 153/253 (%60,5) kıyasla erken moleküler yanıt (BCR-ABL transkriptleri 3. ayda ≤%10) elde edilmiştir, tahmini
risk oranı 2,72 (%95 GA: 1,82-4,08). Erken moleküler yanıt veren ve vermeyen bosutinib
hastalarında 60. aydaki MMY ve olaysız sağkalım Tablo 6'da özetlenmiştir.
Tablo 6 - ITT popülasyonunda 3. ayda BCR-ABL'nin ≤ %10'a karşılık > %10 olduğu bosutinib hastalarında 60. aydaki sonuçlar
Bosutinib (N=248) | 3. ayda BCR-ABL'nin ≤ %10 olduğu hastalar (N=200) | 3. ayda BCR-ABL'nin > %10 olduğu hastalar (N=48) | Tehlike Oranı (%95 GA) |
Kümülatif MMY insidansı, % (%95 GA) | 84 (78,1-88,4) | 56,5 (41,1-69,4) | 2,67 (1,90-3,75) |
Kümülatif olaysız sağkalım olayları insidansı, % (%95 GA) | 5,5 (2,9-9,3) | 12,5 (5,1-23,4) | 0,40 (0,14-1,17) |
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson; GA=güven aralığı; ITT=
tedavi-amaçlı; MMY=majör moleküler yanıt; N= 3. ayda ≥ 3.000 ABL kopya olan hastaların sayısı.
60. ayda mITT popülasyonunda, bosutinib kolunda [6 (%2,4) bosutinib ve 12 (%5) imatinib]
daha az hastada saptanabilir yeni mutasyonlar görülmüştür.
İmatinibe karşı direnç gösteren veya imatinibi tolere etmeyen, kronik fazda (KF), akselere fazda (AF) ve blastik fazda (BF) KML hastaları üzerinde yapılan Faz 1/2 klinik çalışma
Daha önce 1 TKI (imatinib) veya 1'den fazla TKI (imatinib ardından dasatinib ve/veya nilotinib) ile tedavi edilmiş kronik fazda, akselere fazda ve blastik faz için ayrı kohortlarla imatinibe karşı direnç gösteren veya imatinibi tolere etmeyen hastalarda günde bir defa verilen 500 mg bosutinibin etkililiği ve güvenliliğinin değerlendirilmesi için tek kollu, Faz 1/2 açık etiketli, çok merkezli bir klinik çalışma yürütülmüştür.
Bu araştırmada, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilen kronik faz KML hastaları, daha önce imatinib ve en az 1 ilave TKI (dasatinib ve/veya nilotinib) ile tedavi edilen kronik faz KML hastaları, daha önce en az 1 TKI (imatinib) ile tedavi edilmiş akselere veya blast fazındaki KML hastaları ve daha önce en az 1 TKI (imatinib) ile tedavi edilmiş Ph+ ALL hastalarını içeren şekilde bu araştırmada bosutinib tedavisi görmüş 570 hasta bulunmaktadır.
Çalışmanın birincil etkililik sonlanım noktası, imatinibe karşı direnç gösteren, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilmiş kronik faz KML hastalarında 24. haftada majör sitogenetik yanıt (MSY) oranı olmuştur. Diğer etkililik sonlanım noktaları, kümülatif sitogenetik ve moleküler yanıt oranlarını, sitogenetik ve moleküler yanıtlara kadar geçen süreyi ve bu yanıtların süresini, başlangıç mutasyonlarındaki yanıtı, AF/BF'ye dönüşüm, progresyonsuz sağkalım ve tüm kohortlar için genel sağkalımı içermektedir.
Faz 1/2 çalışmanın sonunda halen bosutinib kullanan ve araştırmacının değerlendirmesine göre bosutinib tedavisinin yarar sağladığı hastaların yanı sıra Faz 1/2 çalışma kapsamında daha önce bosutinib kullanmayı bırakan ve uzun süreli sağkalım takibi uygulanan veya Faz 1/2 çalışmayı tamamlayan hastaların uzatma çalışmasına kayıt için uygun olduğu kabul edilmiştir. Gerek bosutinib tedavisi uygulanan gerekse uzun süreli sağkalım takibinde olan her hasta, son hastanın 10 yıllık takip süresine (ilgili hastanın Faz 1/2 çalışmada ilk bosutinib dozunun uygulandığı tarihe göre hesaplanmaktadır) ulaşmasına kadar uzatma çalışmasına devam etmiştir.
Uzatma çalışmasının etkililik sonlanım noktaları sitogenetik ve moleküler yanıtların süresini, AF/BF'ye transformasyonu, progresyonsuz sağkalım ve genel sağkalımı içermiştir.
Etkililik analizleri, tamamlanan bu uzatma çalışmasından elde edilen verileri içermektedir.
KF KML Hastaları
Daha önce imatinib ve en az 1 ilave TKI ile tedavi edilmiş Ph+ KF KML hastaları için etkililik sonuçları (minimum takip 120 ay, medyan tedavi süresi 9 ay (0,23 â 164,28 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %20,2 ve %7,6) ve daha önce yalnızca imatinib ile tedavi edilmiş Ph+ KF KML hastaları için sonuçlar (minimum takip 120 ay, medyan tedavi süresi 26 ay (0,16 â 170,49 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %40,5 ve %19,4) Tablo 7'de verilmektedir.
Akselere ve blastik fazlardaki KML hastaları
AF (minimum takip 120 ay, medyan tedavi süresi 10 ay (0,10 â 156,15 ay) ve sırasıyla 60 ve
120. ayda halen tedavi almaya devam eden hasta oranları %12,7 ve % 7,6) ve BF (minimum takip 120 ay, medyan tedavi süresi 2,8 ay (0,03 â 71,38 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %3,1ve % 0) Ph+ KML hastaları için etkililik sonuçları Tablo 7'de verilmiştir.
Tablo 7 â Daha önce tedavi görmüş kronik ve ilerlemiş fazda KML hastalarında etkililik sonuçları*
| Daha önce sadece imatinib ile tedavi edilen Ph+ kronik faz KML | Daha önce imatinib ve dasatinib veya nilotinib ile tedavi edilen Ph+ kronik faz KML | Daha önce en az imatinib ile tedavi edilen akselere faz | Daha önce en az imatinib ile tedavi edilen blastik faz |
Kümülatif sitogenetik yanıt | N=262 59,9 (53,7-65,9) 49,6 (43,4-55,8) | N=112 42(32,7-51,7) 32,1(23,6-41,6) | N=72 40,3 (28,9-52,5) 30,6 (20,2-42,5) | N=54 37 (24,3-51,3) 27,8 (16,5-41,6) |
MSY, % (%95 GA) | ||||
TSY, % (%95 GA) | ||||
Kümülatif moleküler yanıt MMY, % (%95 GA) MY, % (%95 GA) | N=197
42,1 (35,1-49,4) 37,1 (30,3-44,2) | N=107
17,8 (11-26,3) 15 (8,8-23,1) | N=54
16,7 (7,9-29,3) 13 (5,4-24,9) | N=48 10,4 (3,5-22,7) 10,4 (3,5-22,7) |
Yalnızca yanıt verenler için MSY zamanı, medyan (aralık), hft |
12,3 (4 â 46) |
12,3 (3,9 â 550,6) |
12 (3,9 â 144,7) |
8,2 (3,9 â 25,1) |
MSY süresi | N=157 70,7 (63,1-78,3)
65,3 (56,6-74) N/R | N=47 66,6 (51,5-81,7)
55,3 (36,3-74,4)
N/R | N=29 40,8 (20,9-60,7)
40,8 (20,9-60,7) 84 (24-N/E) | N=20 21,2 (0,1-42,3)
N/E 29,1 (11,9-38,3) |
5. yılda K-M % (%95 GA) | ||||
10. yılda K-M % (%95 GA) | ||||
Medyan , hft (%95 GA) | ||||
Yalnızca yanıt verenler için TSY zamanı, medyan (aralık), hft | 24 (7,7-240,6) | 24 (11,6-216) | 23,8 (4,1-120) | 8,4 (3,9-25,1) |
TSY süresi 5. yılda K-M (%95 GA) 10. yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=130 69,7 (61,3-78,2) 63,4 (54-72,8) N/R | N=36 54,4 (36,7-72,1) 40,8 (22-59,6) 252 (24-N/E) | N=22 40 (18,5-61,5) 40 (18,5-61,5) 72 (36,1-N/E) | N=15 24,9 (0,9-48,9) N/E 20 (9,1-29,6) |
Yalnızca yanıt verenler için MMY zamanı, medyan (aralık), hft | 35,6 (3,1-367,1) | 12,4 (4-171,7) | 36,1 (12,1-144,1) | 4,7 (3,9-168,9) |
MMY süresi 5 yılda K-M (%95 GA) 10 yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=83 74,1 (64,2-83,9) 63,4 (50,2-76,6) N/R | N=19 70 (47,5-92,5) 70 (47,5-92,5) N/R | N=9 66,7 (35,9-97,5) 66,7 (35,9-97,5) N/R | N=5 60 (17,1-100) N/E N/R |
Yalnızca yanıt verenler için MYzamanı, medyan (aralık), hft | 28 (3,1-583,1) | 23,8 (4-240,1) | 24,1 (22,9-96) | 4,7 (3,9-284,9) |
MYsüresi 5. yılda K-M (%95 GA) 10. yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=73 74,7 (64,2-85,2) 60,8 (46,1-75,4) N/R | N/A | N/A | N/A |
AF/BF'ye dönüşüm Tedavi altındayken dönüşüm, n | N=284 15 | N=119 5 | N=79 3 | N/A |
Progresyonsuz sağkalım 5. yılda Kümİns % (%95 GA) 10. yılda Kümİns % (%95 GA) | N=284 19,7 (15,6-24,9)
23,9 (19,5-29,5) | N=119 24,4 (17,8-33,4)
26,9 (20-36,2) | N=79 41,8 (32,2-54,2)
41,8 (32,2-54,2) | N=64 67,2 (56,6-79,7)
N/E |
Genel sağkalım | N=284 83,5 (78,7-88,3) 71,5 (64,4-78,7)
N/R | N=119 74,1 (64,8-83,4) 60,4 (47,2-73,7)
N/R | N=79 58,5 (46,9-70,2) 50,7 (36,5-65)
N/R | N=64 22,5 (7,1-37,9) 22,5 (7,1-37,9)
10.9 (8.7,19.7) |
5. yılda K-M % (%95 GA) 10.yılda K-M % (%95 GA)Medyan, ay (%95 GA) |
Görüntüleme tarihi: Faz 1/2 çalışma 2 Ekim 2015, Uzatma tarihi 2 Eylül 2020
Sitogenetik Yanıt kriterleri: MSY, tam [kemik iliğinden %0 Ph+ metafazları veya floresan in situ hibridizasyondan (FISH) <%1 pozitif hücreler] veya kısmi (%1-%35) sitogenetik yanıtları içermiştir. Sitogenetik yanıtlar, her bir kemik iliği numunesinde >/= 20 metafaz hücre arasında Ph+ metafazlarının yüzdesine dayalıdır. >/= 20 metafaz kullanılabilir olmadığında başlangıç sonrası sitogenetik değerlendirmeler için FISH analizi (>/= 200 hücre) kullanılabilir. Uzatma çalışmasında, spesifik bir tarihte geçerli bir sitogenetik değerlendirme mevcut olmaması durumunda TSY, MMY'ye dayanarak yerine konmuştur.
Moleküler yanıt kriterleri: Faz 1/2 çalışmada MMY/MY, merkezi laboratuvar (uluslararası ölçekte olmayan) tarafından değerlendirildiği üzere, ≤%0,1/0,01 BCR-ABL transkripti olarak tanımlanmıştır. Uzatma çalışmasında, olgu bildirim formunda yerel laboratuvar tarafından değerlendirilip yanıt veren hastalarda MMY/MY elde edildiği belirtilmiştir.
Kısaltmalar: AF=Akselere faz, BF=Blastik faz, Ph+=Philadelphia kromozomu pozitif; KF=Kronik faz, KML=kronik miyeloid lösemi; KM=Kaplan-Meier; N/n=hasta sayısı; N/A=Uygulanamaz, N/R=Ulaşılamaz, N/E=tahmin edilemez; GA=Güven Aralığı, MSY=Majör Sitogenetik Yanıt, TSY=Tam Sitogenetik Yanıt, Kümİns= Kümülatif İnsidans, MMY= Majör Moleküler Yanıt, BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson
KF, AF ve BF kohortlarında genel sağkalım Şekil 4'te grafiksel olarak gösterilmiştir.
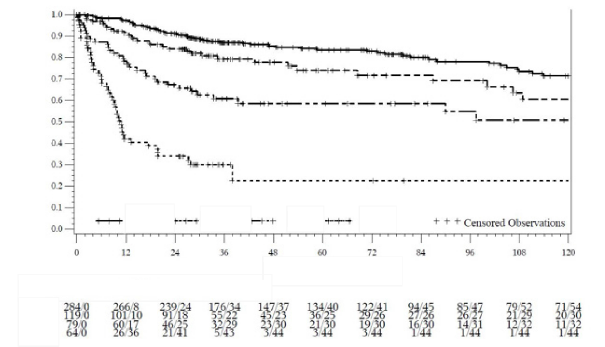
Şekil 4 - KF2L, KF3L, AF ve BF'de Kaplan-Meier Genel Sağkalım Tahmini
Genel Sağkalım Olasılığı
Ölüm zamanı (ay)
Riske tabi gönüllü / Kümülatif Olaylar
Tablo 8- KF KML'nin değerlendirilebilir popülasyonunda başlangıçtaki BCR-ABL mutasyon durumuna göre yanıt; imatinib ve dasatinib ve/veya nilotinib öncesi (üçüncü dizi)
Başlangıçta BCR-ABL mutasyon durumu | Başlangıçta insidans n (%) | Elde edilen veya korunan MSY Yan/Değr(%) N=112 |
Mutasyon değerlendirildi | 98 (100) | 36/92 (39,1) |
Mutasyon yok | 59 (60,2) | 23/55 (41,8) |
En az 1 mutasyon | 39 (39,8) | 13/37 (35,1) |
Dasatinib'e dirençli mutasyonlar | 10 (10,2) | 1/9 (11,1) |
E255K/V | 2 (2) | 0/2 |
F317L | 8 (8,2) | 1/7 (14,3) |
Nilotinib'e dirençli mutasyonlar | 13 (13,3) | 8/13 (61,5) |
Y253H | 6 (6,1) | 5/6 (83,3) |
E255K/V | 2 (2) | 0/2 |
F359C/I/V | 7 (7,1) | 5/7 (71,4) |
Görüntüleme tarihi: Faz 1/2 çalışma 2 Ekim 2015, Uzatma Çalışması 2 Eylül 2020
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, KF= kronik faz, KML= kronik miyeloid lösemi, MSY = Majör Sitogenetik Yanıt, N/n=hasta sayısı, Yan = yanıt verenler, Değr = değerlendirilebilir.
Not: Başlangıçtaki mutasyonlar, hastanın çalışma ilacının ilk dozu öncesinde tanımlanmıştır.
Daha önce nilotinib ile tedavi edilen ve E255V mutasyonu bulunan bir hasta en iyi yanıt olarak THY almıştır.
İn vitro testleri, bosutinibin T315I veya V299L mutasyonuna karşı sınırlı düzeyde aktivitesi olduğunu göstermiştir. Bu nedenle, bu mutasyonlara sahip hastalarda klinik aktivite beklenmemektedir.
Daha önce 1 ya da daha fazla TKI ile tedavi edilmiş Ph+ KML hastalarında yapılan Faz 4 Klinik çalışma
Daha önce 1 ya da daha fazla TKI ile tedavi edilmiş KF, AF veya BF hastalık açısından ayrı kohortlara ayrılan TKI'ya dirençli ya da TKI'yı tolere edemeyen KML hastalarında günde bir kez 500 mg bosutinibin sağladığı etkililiği ve güvenliliği değerlendirmek üzere tek kollu, açık etiketli, randomize olmayan, çok merkezli bir Faz 4 çalışma yapılmıştır.
Bu araştırmada, daha önce 1 TKI (imatinib veya dasatinib veya nilotinib) ile tedavi edilmiş olan 46 KF Ph+ KML hastasını, daha önce 2 TKI (imatinib ve/veya dasatinib ve/veya nilotinib) ile tedavi edilmiş olan 61 KF Ph+ KML hastasını, daha önce 3 TKI (imatinib ve dasatinib ve nilotinib) ile tedavi edilmiş olan 49 KF Ph+ KML hastasını, daha önce en az 1 TKI (2 hasta daha önce 2 TKI ile tedavi edilmiş ve 2 hasta daha önce 3 TKI ile tedavi edilmiştir) ile tedavi
edilmiş olan 4 AF Ph+ KML hastasını ve daha önce en az 1 TKI ile tedavi edilmiş olan 3 Ph- KML hastasını içeren toplam 163 hastaya bosutinib tedavisi uygulanmıştır.
Daha önce 1 ya da 2 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar ve daha önce 3 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar için primer etkililik sonlanım noktası, 1 yılda (52. hafta) belirlenen kümülatif doğrulanmış MSY'dir. Daha önce herhangi bir TKI tedavisi uygulanmış olan AF ve BF Ph+ KML hastaları için primer etkililik sonlanım noktasını 1 yıldaki (52. hafta kümülatif doğrulanmış genel hematolojik yanıt (GHY) oluşturmuştur. Ph+ KF KML hastalarındaki diğer etkililik sonlanım noktaları kümülatif sitogenetik ve moleküler yanıt oranını, sitogenetik ve moleküler yanıtların süresini, başlangıç mutasyonlarındaki yanıtı, AF/BF'ye transformasyonu, progresyonsuz sağkalımı ve genel sağkalımı içermektedir. Ph+ AF/BF kohortundaki ek sonlanım noktaları kümülatif sitogenetik ve moleküler yanıt oranlarını, progresyonsuz sağkalımı ve genel sağkalımı içermektedir.
KF KML hastaları
Bir yıldaki (52 hafta) kümülatif doğrulanmış MSY'yi (%95 GA) içeren primer sonlanım noktası oranı, daha önce 1 ya da 2 TKI ile tedavi edilmiş olan hastalarda %76,5 (66,9, 84,5) ve daha önce 3 TKI ile tedavi edilmiş olan hastalarda %62,2 (46,5 - 76,2) olarak saptanmıştır.
Daha önce 1 (medyan tedavi süresi 47,5 ay [0,9-50,1 ay] ve halen tedaviye devam eden %60,9), 2 (medyan tedavi süresi 41,9 ay [0,4-48,9 ay] ve halen tedaviye devam eden %45,9) ve 3 (medyan tedavi süresi 20 ay [0,2-48,9 ay] ve halen tedaviye devam eden %38,8) TKI ile tedavi edilmiş olan Ph+ KF KML hastalarında en az 3 yıl süren takipten sonra, çalışmanın kapanış tarihinde elde edilen ek etkililik sonuçları Tablo 9'da sunulmaktadır.
Tablo 9 â Daha önce tedavi görmüş kronik faz Ph+ KML hastalarında etkililik sonuçları
| Daha önce 1 TKI ile tedavi edilen Ph+ KF KML | Daha önce 2 TKI ile tedavi edilen Ph+ KF KML | Daha önce 3 TKI ile tedavi edilen Ph+ KF KML | Total Ph+ KF KML kohortu |
Kümülatif Doğrulanmış | N=43 | N=55 | N=45 | N=143 |
MSY1 yıla kadar, % (%95 GA) | 83,7 (69,3-93,2) | 70,9 (57,1-82,4) | 62,2 (46,5-76,2) | 72 (63,9-79,2) |
Kümülatif sitogeneti yanıt | N=43 | N=55 | N=45 | N=143 |
MSY, % (%95 GA) | 88,4 (74,9-96,1) | 85,5 (73,3-93,5) | 77,8 (62,9-88,8) | 83,9 (76,9-89,5) |
TSY, % (%95 GA) | 86 (72,1-94,7) | 83,6 (71,2-92,2) | 73,3 (58,1-85,4) | 81,1 (73,7-87,2) |
Kümülatif moleküler yanıt | N=46 | N=55 | N=48 | N=149 |
MMY, % (%95 GA) | 82,6 (68,6-92,2) | 76,4 (63-86,8) | 56,3 (41,2-70,5) | 71,8 (63,9-78,9) |
MY, % (%95 GA) | 73,9 (58,9-85,7) | 63,6 (49,6-76,2) | 41,7 (27,6-56,8) | 59,7 (51,4-67,7) |
MY, % (%95 GA) | 58,7 (43,2-73) | 50,9 (37,1-64,6) | 35,4 (22,2-50,5) | 48,3 (40,1-56,6) |
Yalnızca yanıt verenler için sitogenetik yanıta kadar geçen zaman, medyan (aralık), ay |
|
|
|
|
MSY | 3 (1-11,8) | 2,9 (0.3-6,4) | 3 (1,8-8,8) | 3 (0,3-11,8) |
TSY | 3 (1-17,6) | 2,9 (0.3-6,4) | 3 (1,8-8,8) | 3 (0,3-17,6) |
Sitogenetik yanıtın süresi |
|
|
|
|
MSY, 3. yılda K-M, % (%95 GA) | 96,6 (77,9-99,5) | 94,4 (79,2-98,6) | 96,9 (79,8-99.6) | 95,6 (88,7-98,4) |
TSY, 3. yılda K-M, % (%95 GA) | 96,4 (77,2-99,5) | 94,4 (79,2-98,6) | 100 (100-100) | 96,5 (89,5-98,9) |
Yalnızca yanıt verenler için moleküler yanıta kadar geçen zaman, medyan (aralık), ay |
|
|
|
|
MMY | 3 (2,8-23,3) | 3 (1-35,9) | 3,1 (1,8-9,3) | 3 (1-35,9) |
MY | 6 (2,8-47,4) | 3,1 (1-36,1) | 3,2 (1,8-47,9) | 5,5 (1-47,9) |
MY | 9,2 (2,8-47,6) | 6 (2,8-36,2) | 5,8 (1,8-18) | 6 (1,8-47,6) |
Moleküler yanıtın süresi |
|
|
|
|
MMY, 3 yılda K-M, % (%95 GA) | 90,7 (73,9-96,9) | 81,5 (63,2-91.3) | 90,2 (65,9-97,5) | 87,2 (78-92,7) |
MY, 3 yılda K-M at, % (%95 GA) | 89,5 (70,9-96,5) | 68,7 (48-82.5) | 85,2 (51,9-96,2) | 80,7 (69,4-88,1) |
Görüntüleme tarihi: 23 Kasım 2020 Kısaltmalar: Ph+=Philadelphia kromozomu pozitif; KF=kronik faz; KML=kronik miyeloid lösemi; K-M=Kaplan Meier; N=hasta sayısı; GA=güven aralığı; MSY=majör sitogenetik yanıt; TSY=tam sitogenetik yanıt; MMY=majör moleküler yanıt; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4 log azalma; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4,5 log azalma. Kümülatif Doğrulanmış MSY kriterleri: Yanıt, en az 28 gün arayla yapılan art arda 2 değerlendirmeyle doğrulanmaktadır. Yanıt veren hasta olarak kabul edilmesi için hastada başlangıçtaki yanıtın en az 52 hafta boyunca devam etmesi veya başlangıca göre düzelmesi gereklidir. Sitogenetik yanıt veren hasta olarak kabul edilebilmeleri için, başlangıçta kısmi sitogenetik yanıt (PCyR) vermiş olan hastalarda tedavi sırasında TSY elde edilmesi gereklidir. Başlangıca göre en azından MMY ve göre daha derin moleküler yanıt elde edilen hastalar doğrulanmış TSY olarak kabul edilmektedir. Kümülatif Sitogenetik Yanıt kriterleri: Tam [kemik iliğinde %0 Ph+ metafaz veya fluoresan in situ hibridizasyonda (FISH) <%1 pozitif hücre] veya kısmi (%1-%35) sitogenetik yanıtları içeren Majör Sitogenetik Yanıt. Sitogenetik yanıtlar için her bir kemik iliği örneğinde ≥20 metafaz hücredeki Ph+ metafazların yüzdesi temel alınmıştır. ≥20 metafaz mevcut olmaması durumunda, | ||||
TSY değerlendirmesi için FISH analizi (≥200 hücre) kullanılabilmiştir. Geçerli bir kemik iliği veya FISH değerlendirmesi olmayan ve en az MMY elde edilen hastalar TSY olarak kabul edilmektedir. Kümülatif Moleküler Yanıt kriterleri: MMY, MY ve MY, uluslararası ölçekte sırasıyla ≤% 0,1,
≤ %0,01 ve ≤ %0,0032 BCR-ABL/ABL oranı (standardize edilmiş başlangıca göre ≥ 3, ≥ 4 ve ≥ 4,5 log azalmaya karşılık gelmektedir) ve merkezi laboratuvar tarafından değerlendirilen sırasıyla minimum 10.000, 10.000 ve 32.000 ABL transkripti olarak tanımlanmıştır.
Olay olmaksızın tedaviyi bırakılma yarışan riski için ayarlanmış kümülatif MMY, MY ve
MY insidansı Şekil 5'te gösterilmektedir.
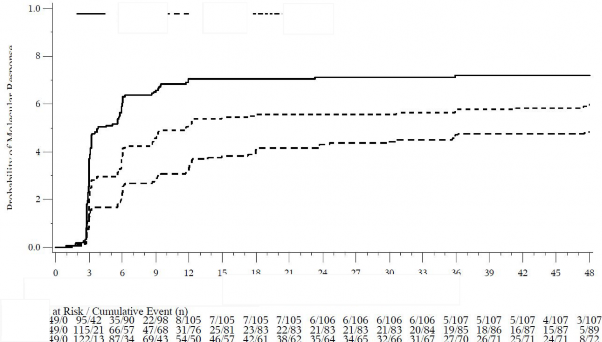
İlk doz üstünden geçen süre (ay)
Moleküler Yanıt Olasılığı
Şekil 5 - Kümülatif Moleküler Yanıt İnsidansı (KF Değerlendirilebilen Popülasyon)
Tedavi basamağına göre elde edilen moleküler yanıtlar Tablo 10'da gösterilmektedir.
Tablo 10 - Elde edilen moleküler yanıtlar
| Daha önce 1 TKI ile tedavi edilen Ph+ KF KML | Daha önce 2 TKI ile tedavi edilen Ph+ KF KML | Daha önce 3 TKI ile tedavi edilen Ph+ KF KML | Total Ph+ KF KML kohortu |
Başlangıçta MMY olmayan hastalar | N=25 | N=28 | N=26 | N=79 |
MMY, % (%95 GA) | 76 (54,9-90,6) | 64,3 (44,1- 81,4) | 38,5 (20,2- 59,4) | 59,5 (47,9- 70,4) |
Başlangıçta MY olmayan hastalar | N=37 | N=38 | N=37 | N=112 |
MY, % (%95 GA) | 70,3 (53-84,1) | 55,3 (38,3- 71,4) | 32,4 (18-49,8) | 52,7 (43-62,2) |
Başlangıçta MY olmayan hastalar | N=42 | N=46 | N=43 | N=131 |
MY, % (%95 GA) | 54,8 (38,7- 70,2) | 43,5 (28,9- 58,9) | 30,2 (17,2- 46,1) | 42,7 (34,1- 51,7) |
Başlangıçta MMY olan hastalar | N=21 | N=27 | N=22 | N=70 |
Daha derin MY, % (%95 GA) | 85,7 (63,7-97) | 66,7 (46-83,5) | 63,6 (40,7- 82,8) | 71,4 (59,4- 81,6) |
Görüntüleme kopyası tarihi: 23 Kasım 2020 Kısaltmalar: Ph+=Philadelphia kromozomu pozitif; KF=kronik faz; KML=kronik miyeloid lösemi; N=hasta sayısı; GA=güven aralığı; MMY=majör moleküler yanıt; MY=moleküler yanıt; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4 log azalma; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4,5 log azalma. | ||||
KF hastalarda, tedavi uygulaması sırasında AF veya BF KML'ye progresyonlar meydana gelmemiştir.
AF KML hastaları
Ph+ AF KML olan hastalarda, medyan tedavi süresi 22,1 ay (aralık: 1,6-50,1 ay), 1 yılda (52 hafta) kümülatif doğrulanmış GHY, kümülatif TSY oranında olduğu gibi %75 (%95 GA: 19,4, 99,4) olarak belirlenmiş ve 3 hastanın tümünde, elde edilen TSY tedavi sırasında da devam etmiştir.
Başlangıçta BCR-ABL Mutasyonlarına göre yanıt
KF kohortundaki on hastada başlangıçta mutasyonlar (A365V, E453K, E255K, E255V, Q252H, L298V [her biri n=1], Y253F ve G250E [her biri n=2]) olduğu kaydedilmiştir. KF kohortundaki bir hastada, çalışmanın 8. gününde F359I mutasyonu olduğu saptanmıştır. AF kohortundaki bir hastada, başlangıçta 2 mutasyon (F311L ve L387F) tanımlanmıştır. KF
kohortunda mutasyonları olan hastalar arasında, moleküler yanıtlar 4/11 (%36,4) hastada gözlenmiş, E255V mutasyonu olan 1 hastada MMY ve sırasıyla F359I, Y253F ve A365V mutasyonu olan 3 hastada MY elde edilmiştir. AF kohortundaki mutasyonları olan hastada herhangi bir yanıt elde edilmemiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Tek doz bosutinibin (500 mg) sağlıklı gönüllülere yemekle birlikte uygulanması sonrasında, mutlak biyoyararlanım %34'tür. Emilim göreceli olarak yavaş olduğundan pik konsantrasyona ulaşma için medyan süre (t) 6 saattir. Bosutinib 200 ve 600 mg arası bir doz aralığında EAA ve Cdeğerlerinde doz oranlı artışlar göstermektedir. Aç durumla karşılaştırıldığında, yemek ile bosutinibin Cdeğeri 1,8 kat ve EAA değeri 1,7 kat artmaktadır. KML hastalarında günde 400 mg bosutinibin yiyeceklerle uygulanmasını takiben kararlı durumda C(geometrik ortalama varyasyon katsayısı % [CV]) 145 (14) ng/mL, ve EAA(geometrik ortalama, %CV) 2.700 (16) ngâ¢h/mL'dir. Yemek ile günlük 500 mg bosutinib uygulamasını takiben, Cdeğeri 200 (6) ng/mL ve EAAdeğeri 3.640 (12) ngâ¢h/mL'dir. Bosutinibin çözünebilirliği pH'a bağlıdır ve emilim, gastrik pH arttığında azalmaktadır (bkz. bölüm 4.5).
Dağılım:
120 mg bosutinibin sağlıklı gönüllülere tek intravenöz doz uygulanmasını takiben, bosutinib için ortalama dağılım hacmi (% varyasyon katsayısı [CV]) 2.331 (32) L olmuştur; bu da bosutinibin ekstra vasküler dokulara kapsamlı bir şekilde dağıtıldığını göstermektedir.
Sağlıklı gönüllüler üzerinde yapılan in vitro (%94) ve ex vivo (%96) çalışmalarda bosutinibin insan plazmasındaki proteinlere yüksek oranda bağlandığı ve bu bağın konsantrasyona bağlı olmadığı gözlemlenmiştir.
Biyotransformasyon:
İn vitro ve in vivo çalışmalarda, bosutinibin (ana bileşik) insanlarda baskın olarak karaciğer metabolizmasından geçtiği gösterilmiştir. İnsanlara tek veya birden fazla bosutinib (400 veya 500 mg) uygulanması sonrasında, dolaşımdaki majör metabolitler oksideklorinlenmiş (M2) ve N-desmetilatlanmış (M5) olarak gözlemlenmiş, bosutinib N-oksit (M6) dolaşımdaki minör bir metabolittir. N-desmetilatlanmış metabolitin sistemik maruziyeti, ana bileşenin %25'idir bu süreçte oksideklorinlenmiş metabolit, ana bileşenin %19'udur. Üç metabolit de bir Src- dönüştürülmüş fibroblast ankoraj bağımlı dağıtım miktar tayininde bosutinibin ≤%5'i olmuştur. Dışkıda, bosutinib ve N-desmetil bosutinib ilaç ile ilgili majör bileşenler olmuştur. İnsan karaciğeri mikrozomları ile yapılan in vitro çalışmalar, bosutinib metabolizmasına müdahil olan majör sitokrom P450 izoziminin CYP3A4 olduğunu ve ilaç etkileşim çalışmaları da ketokonazol ve rifampisinin bosutinib farmakokinetikleri üzerinde etkisi olduğunu göstermiştir (bkz. bölüm 4.5). CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 veya 3A5 ile bosutinib metabolizması gözlemlenmemiştir.
Eliminasyon:
Sağlıklı gönüllülerde intravenöz tek bir doz halinde 120 mg bosutinib sonrasında, ortalama (%CV) vücuttan uzaklaştırılma yarı ömrü yaklaşık 35,5 (24) saat ve ortalama (%CV) klerens 61,9 (26) L/sa'dır. Ağız yoluyla alınan bosutinib üzerinde yapılan bir kütle dengesi çalışmasında, toplam dozun ortalama %94,6'sı 9 günde geri çıkarılmıştır; majör vücuttan dışarı atma yolu dışkılama (%91,3) olmakla birlikte, %3,29'luk bir oran da idrarla atılmaktadır. Dozun yüzde yetmiş beşi 96 saat içinde geri çıkarılmıştır. İdrarda bosutinibin değişmeden vücuttan atılma oranı hem sağlıklı gönüllülerde hem de ileri evre habis solid tümörleri bulunan gönüllülerde yaklaşık %1 düzeyindedir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Bir böbrek yetmezliği çalışmasında, hafif, orta şiddette veya ciddi böbrek yetmezliği bulunan 26 gönüllüye yemekle birlikte tek doz halinde 200 mg bosutinib verilmiş ve 8 kişinin sonuçları sağlıklı gönüllülerle eşleşmiştir. Böbrek yetmezliği şu KrKL değerlerine bağlıdır (Cockcroft- Gault formülü ile hesaplanır): < 30 mL/dk (ciddi böbrek yetmezliği), 30 ≤ KrKL ≤ 50 mL/dk (orta şiddetli böbrek yetmezliği) veya 50 < KrKL ≤ 80 mL/dk (hafif şiddetli böbrek yetmezliği). Orta şiddetli ve ciddi böbrek yetmezliği bulunan gönüllülerde, sağlıklı gönüllüler ile karşılaştırıldığında sırasıyla %35 ve %60 düzeyde EAA artışı gözlemlenmiştir. Maksimum maruziyet Cdeğeri, orta şiddetli ve ciddi böbrek yetmezliği olan gruplarda sırasıyla %28 ve %34 oranda artmıştır. Bosutinib maruziyeti, hafif şiddetli böbrek yetmezliği bulunan kişilerde artış göstermemiştir. Bosutinibin böbrek yetmezliği bulunan gönüllülerde vücuttan uzaklaştırılma yarı ömrü, sağlıklı gönüllülerdekine benzerdir.
Böbrek yetmezliği için doz ayarlamaları bu çalışmanın sonuçlarına ve 200-600 mg doz
aralığında bosutinibin bilinen lineer farmakokinetiğine dayanmaktadır.
Karaciğer yetmezliği:
Yemekle verilen 200 mg'lik bir bosutinib dozu, karaciğer bozukluğu bulunan 18 gönüllüden oluşan bir kohortta (Child-Pugh, sınıf A, B ve C) değerlendirilmiş ve 9 kişi sağlıklı gönüllüler ile aynı sonucu vermiştir. Child-Pugh, sınıf A, B ve C'de plazmada bosutinibin Cdeğeri sırasıyla 2,4 kat, 2 kat ve 1,5 kat; plazmada bosutinibin EAA değeri ise sırasıyla 2,3 kat, 2 kat ve 1,9 kat artmıştır. Sağlıklı gönüllüler ile karşılaştırıldığında hepatik bozuklukları olan gönüllülerde bosutinib için t½ değeri artmıştır.
Pediyatrik popülasyon:
BOSULİF henüz 18 yaşından küçük çocuklarda ve ergenlerde çalışılmamıştır.
Yaş, cinsiyet, ırk özellikleri:
Bu demografik faktörlerin etkilerini değerlendirmek için resmi bir çalışma yapılmamıştır. Ph+ lösemi veya malign solid tümörü bulunan hastalarda ve sağlıklı gönüllülerde popülasyon farmakokinetik analizleri yaşın, cinsiyetin veya vücut ağırlığının klinik olarak anlamlı etkileri bulunmadığını göstermektedir. Popülasyon farmakokinetik analizleri, Asyalıların bosutinib maruziyetinde (EAA) yaklaşık %25'lik bir artışa karşılık gelen, %18 daha düşük bir klirense sahip olduğunu ortaya koymuştur.
5.3. Klinik öncesi güvenlilik verileri
Bosutinib, güvenlilik farmakolojisi, yinelenen doz toksisitesi, genotoksisite, üremeye ilişkin toksisite ve fototoksisite çalışmalarında değerlendirilmiştir.
Güvenlilik farmakolojisi
Bosutinib, solunum fonksiyonları üzerinde herhangi bir etki yaratmamıştır. Merkezi sinir sistemi (MSS) üzerinde yapılan bir çalışmada, bosutinib ile tedavi edilen sıçanların göz bebeği boyutunda küçülme ve yürümede bozulma gözlemlenmiştir. Göz bebeği boyutu için gözlemsiz etki düzeyi (GED) belirlenmemiştir ancak yürüme bozukluğu için GED, 400 mg'lık klinik dozla elde edilen insan maruziyetinin yaklaşık 11 katı ve 500 mg'lık klinik dozla elde edilen insan maruziyetinin yaklaşık >8 katı maruziyetlerde oluşmuştur (ilgili türlerde bağlanmamış C'a göre). hERG miktar tayinlerinde in vitro bosutinib aktivitesi, kardiyak ventriküler repolarizasyon (QTc) süre uzatması için bir potansiyel bulunduğunu göstermektedir. Bosutinibin ağız yoluyla uygulandığı, köpekler üzerinde yapılan bir çalışmada, bosutinib, 400 mg dozluk klinik maruziyetin 3 katına ve 500 mg dozluk klinik maruziyetin 2 katına (ilgili türlerde bağlı olmayan C'a dayalı olarak) kadar maruziyetlerde kan basıncında değişikliklere, anormal atriyal veya ventriküler aritmilere veya PR, QRS ya da EKG'nin QTc süre uzamasına neden olmamıştır. Gecikmeli bir nabız artışı gözlemlenmiştir. Köpekler üzerinde yapılan bir intravenöz çalışmada, 400 mg klinik doz ile elde edilenin yaklaşık 6 ile 20 katı arası ve 500 mg doz ile elde edilenin yaklaşık 4 ile 15 katı arası değişen maruziyetlerde nabızda geçici artışlar ve kan basıncında düşüşler ile QTc için minimum süre uzaması (<10 msn) gözlemlenmiştir (ilgili türlerde bağlanmamış C'a göre). Gözlemlenen etkiler ve tıbbi ürün tedavisi arasındaki ilişki sonuçsuz kalmıştır.
Tekrarlanan doz toksisitesi
Sıçanlarda 6 aya kadar, köpeklerde 9 aya kadar süre için yapılan tekrarlanan doz toksisitesi çalışmaları, bosutinib toksisitesinde birincil hedef organın gastrointestinal sistem olduğunu açığa çıkarmıştır. Klinik toksisite emareleri, dışkı değişikliklerini içermiştir ve gıda tüketiminde azalma ve kilo kaybı ile ilişkilendirilmiştir; bunlar zaman zaman ölüme veya seçici ötenaziye yol açmıştır.
Histopatolojik olarak, lümen genişlemesi, goblet hücresi hiperplazisi, kanama, erozyon ve bağırsak yolunda ödem ile mesenterik lenf nodlarında eritrositoz ve kanama gözlemlenmiştir. Sıçanlarda, karaciğer de bir hedef organ olarak tanımlanmıştır. Toksisiteler, karaciğer enzimlerinde artış veya hepatoselüler sitotoksite belirtilerinin eksikliğinde oluşan hepatoselüler hipertropi ile ilgili olarak karaciğer ağırlıklarında artış ile karakterize edilmektedir ve bunların insanlarla ilişkisi bilinmemektedir. Türler arası maruziyet karşılaştırması, sıçanlar ve köpekler üzerinde yapılan sırasıyla 6 ve 9 aylık çalışmalarda advers olaylar ortaya çıkarmayan maruziyetlerin 400 mg'lik ve 500 mg'lik klinik dozlarla elde edilen insan maruziyetine benzer olduğunu göstermektedir (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak).
Genotoksisite
Bakteriyel in vitro sistemlerde ve memeli in vitro ve in vivo sistemlerde metabolik aktivasyon ile ya da metabolik aktivasyon olmadan yapılan genotoksisite çalışmaları, bosutinibin mutajenik potansiyeline dair bir kanıt göstermemiştir.
Üreme ve gelişim toksisitesi
Sıçanlar üzerinde yapılan bir üreme çalışmasında, erkeklerde fertilitede hafif bir düşüş gözlemlenmiştir. Dişilerde embriyonik resorpsiyonlarda artış ve implantasyonlar ile canlı embriyolarda düşüş gözlemlenmiştir. Erkeklerde (günde 30 mg/kg) ve kadınlarda (günde 3 mg/kg) advers üreme etkilerinin gözlemlenmediği doz, 400 mg'lik klinik dozdan doğan insan maruziyetinin sırasıyla 0,6 ve 0,3 katı ve 500 mg'lik klinik dozdan doğan insan maruziyetinin sırasıyla 0,5 ve 0,2 katı kadar maruziyetlere yol açmıştır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). Erkek fertilitesi üzerine etkisi göz ardı edilemez (bkz. bölüm 4.6).
Gebe Sprague-Dawley sıçanlarında yapılan bir plasenta transferi çalışmasında, fetüslerin gebelik sırasında bosutinib türevli radyoaktiviteye maruziyeti gösterilmiştir. Sıçanlar üzerinde yapılan bir doğum öncesi ve doğum sonrası gelişim çalışmasında, ≥ 30 mg/kg/gün dozunda doğan yavru sayıları azalmış, toplam tek seferde doğan yavru kaybı insidansı artmış ve 70 mg/kg/gün dozunda doğumdan sonra yavruların büyümesinde azalma gerçekleşmiştir. Yan etki gelişmesi gözlemlenmeyen doz (10 mg/kg/gün), 400 mg ve 500 mg klinik dozlarda insanlarda görülenin sırasıyla 1,3 katına ve 1 katına eşit maruz kalmayla sonuçlanmıştır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). Tavşanlar üzerinde yapılan bir toksisite çalışmasında anneler için toksik dozda fetüs anomalileri gözlemlenmiş (birleşik sternebra ve iki fetüste farklı viseral gözlemler bulunması) ve fetüs vücut ağırlığında hafif bir düşüş olmuştur. Tavşanlarda test edilen en yüksek dozda (10 mg/kg/gün) fetüs üzerinde advers etkilere neden olmayan maruziyet, 400 mg ve 500 mg dozlarda insanlarda görülenin sırasıyla 0,9 ve 0,7 katıdır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak).
Emziren Sprague-Dawley sıçanlarında ağız yoluyla tek doz halinde (10 mg/kg) [C] radyoaktif işaretli bosutinib uygulamasının ardından, radyoaktivite, dozlamadan 0,5 sa sonra kadar kısa bir süre içinde anne sütüne geçmiştir. Sütte radyoaktivite konsantrasyonu, plazmada olduğundan 8 kat yüksektir. Bu da ölçülebilir radyoaktivite konsantrasyonlarının anne sütü alan yavruların plazmasında görülmesine neden olmuştur.
Karsinojenisite
Bosutinib, 2 yıllık sıçan ve 6 aylık rasH2 fare karsinojenisite çalışmalarında karsinojenik bulunmamıştır.
Fototoksisite
Bosutinib, UV-B ve UV-A aralığında ışık absorbe etme yetisi göstermiş ve pigmentli sıçanların cildine ve gözün damarlı orta tabakasına dağıtılmıştır. Ancak bosutinib ile, 400 ve 500 mg klinik dozlarla insanlarda oluşan maruziyetin sırasıyla 2 ve 3 katına kadar olan maruziyetlerde UV radyasyon bulunurken bosutinibe maruz kalmış pigmentli sıçanlarda ciltte veya gözlerde fototoksisite potansiyeli göstermemiştir (ilgili türlerde bağlanmamış C'a göre).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği Mikrokristalin selüloz (E460) Kroskarmeloz sodyum (E468) Poloksamer 188
Povidon (E1201) Magnezyum stearat (E470b)
Film kaplama Polivinil alkol
Titanyum dioksit (E171) Makrogol 3350
Talk (E553b)
Sarı demir oksit (E172)
6.2. Geçimsizlikler
Uygulanamaz.
6.3. Raf ömrü
48 ay.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
14 veya 15 tablet içeren beyaz opak 3 katmanlı PVC/ACLAR/PVC blister
Her kartonda 28 veya 30 tablet (paket başına 2 blister) veya 112 tablet (paket başına 8 blister)
bulunur.
Tüm ambalaj boyutları satışa sunulmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler veya atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Geri Ödeme Kodu | A17459 |
| Satış Fiyatı | 10829.6 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 14442.28 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308097446 |
| Etkin Madde | Bosutinib Monohidrat |
| ATC Kodu | L01EA04 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |