BOSULIF 100 mg FT (28 tablet) Farmakolojik Özellikler
{ Bosutinib Monohidrat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EA04
Etki mekanizması
Bosutinib, farmakolojik olarak kinaz inhibitörü olarak bilinen bir tıbbi ürün sınıfına aittir. Bosutinib KML'yi destekleyen anormal Bcr-Abl kinazını inhibe eder. Modelleme çalışmaları, bosutinibin Bcr-Abl kinaz alanını bağladığını göstermiştir. Bosutinib aynı zamanda Src, Lyn ve Hck'yi de içeren Src familyasını da inhibe etmektedir. Bosutinib, asgari olarak PDGF reseptörü ile c-Kit'i inhibe etmektedir.
İn vitro çalışmalarda, bosutinib belirlenmiş KML hücre dizisinin, Ph+ ALL hücre dizilerinin ve hastadan elde edilen primer primitif KML hücrelerinin çoğalması ve sağkalımını inhibe etmiştir. Bosutinib, murin miyeloid hücre dizilerinde bulunan Bcr-Abl'nin 18 imatinibe karşı dirençli formundan 16'sını inhibe etmiştir. Bosutinib tedavisi, çıplak farelerde KML tümörlerinin büyüme boyutunda düşüş sağlamış ve Bcr-Abl'nin imatinibe karşı dirençli formlarında murin miyeloid tümörlerinin büyümesini inhibe etmiştir. Bosutinib aynı zamanda reseptör tirosin kinazlar c-Fms, EphA ve B reseptörleri, Trk familyası kinazları, Axl familyası kinazları, Tec familyası kinazları, ErbB familyasının bazı üyeleri, reseptör olmayan tirosin kinaz Csk, Ste20 familyasının serin/treonin kinazları ve iki kalmoduline bağlı protein kinazını da inhibe etmektedir.
Farmakodinamik etkiler
Sağlıklı gönüllüler üzerinde gerçekleştirilen randomize, tek dozlu, çift kör (bosutinib açısından), çapraz, plasebo ve açık etiketli moksifloksasin kontrollü bir çalışmada 500 mg bosutinib uygulamasının düzeltilmiş QTc üzerindeki etkisi değerlendirilmiştir.
Bu çalışmadan elde edilen veriler, bosutinibin önerilen doz olan ve yemekle alınan günde 500 mg bosutinibin, supraterapötik plazma konsantrasyonu koşullarında sağlıklı gönüllülerde QTc süre uzamasına neden olmadığını göstermektedir. Sağlıklı gönüllülerde ağız yoluyla tek doz halinde alınan 500 mg bosutinibin (terapötik doz) ve 400 mg ketokonazol ile 500 mg bosutinibin (supraterapötik bosutinib konsantrasyonlarını elde etmek için) uygulanmasının ardından, tek taraflı %95 güven aralığı (GA) üst sınırında, QTc'deki orta değişim, tüm doz sonrası zaman noktalarında 10 ms'den düşük olmuş ve QTc süre uzatımını ifade eden herhangi bir advers olay gözlemlenmemiştir.
Karaciğeri hasar görmüş gönüllülerde karaciğer fonksiyonlarında azalma ile QTc süre uzaması
> 450 ms sıklığında artış gözlemlenmiştir. Daha önce 500 mg bosutinib ile tedavi edilen Ph+ lösemi hastaları üzerinde yapılan bir Faz 1/2 klinik çalışmada, 570 hastadan 9'unda (%1,6) başlangıçtan itibaren QTcF'de > 60 ms'lik artış gözlemlenmiştir. Yeni Ph+ KF KML tanısı konmuş 400 mg bosutinib ile tedavi edilen hastalar üzerinde yapılan bir Faz 3 klinik çalışmada, bosutinib tedavi grubunda (N=268) başlangıca göre QTcF'de > 60 ms'lik artışı olan hasta bulunmamaktadır. Yeni Ph+ KF KML tanısı konmuş 500 mg bosutinib ile tedavi edilen hastalar üzerinde yapılan bir Faz 3 klinik çalışmada, bosutinib alan 248 hastadan 2'sinde (%0,8) başlangıçtan itibaren QTcF'de >60 ms'lik artış gözlemlenmiştir. Daha önce 1 ya da daha fazla TKI ile tedavi edilen ve bosutinib 500 mg tedavisi uygulanan Ph+ KML hastalarında (N=163) yapılan Faz 4 klinik çalışmada, hiçbir hastada QTcF'de başlangıca göre >60 ms artış ortaya çıkmamıştır. Bosutinibin proaritmi potansiyeli göz ardı edilemez.
Klinik etkililik
Daha önce tedavi edilmemiş KML ile kronik fazdaki klinik çalışma
Bosutinib 400 mg çalışması
Yeni tanı konmuş yetişkin Ph+ KF KML hastalarında günde 400 mg tek başına bosutinibin etkililik ve güvenliliğini değerlendirmek üzere tek başına günde 400 mg imatinib ile karşılaştırmalı 2 kollu, Faz 3, açık etiketli, çok merkezli süperiorite çalışması yürütülmüştür. Çalışmada b2b2 ve/veya b3b2 transkripti bulunan ve başlangıçta BCR-ABL kopyaları >0 olan 487 Ph+ KML hastasını (modifiye edilmiş ITT (mITT) popülasyonu) içeren Ph+ veya Ph- yeni tanı konmuş 536 (her tedavi grubunda 268'er hasta) KF KML hastası (ITT popülasyonu) randomize edilmiştir.
Çalışmanın primer etkililik sonlanım noktası 12. ayda (48 hafta) mITT popülasyonda imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda major moleküler bir yanıt (MMY) gösterme oranıdır. MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır.
Ana sekonder sonlanım noktaları 12 ayda TSY, TSY süresi, MMY süresi, olaysız sağkalım ve genel sağkalımdır. 12. ayda TSY; kemik iliğinden elde edilen ≥ 20 metafazın kromozom bantlama analizinde Ph+ metafazların bulunmaması veya uygun bir sitogenetik değerlendirme bulunmuyorsa MMY olarak tanımlanmıştır. 12. ayda MMY dışındaki sonlanım noktaları için p-değerleri ve 12 ayda TSY çoklu karşılaştırmalar için ayarlanmamıştır.
mITT popülasyonu için başlangıç özellikleri 2 tedavi grubu arasında yaş (bosutinib grubu için medyan yaş 52 ve imatinib grubu için 53; hastaların sırasıyla %19,5'i ve %17,4'si 65 yaş ve üzeridir), cinsiyet (sırasıyla %42,3 ve %44 kadın), ırk (sırasıyla Kafkasyalı %78 ve %77,6,
Asyalı %12,2 ve %12,4, Siyahi veya Afrikan Amerikan %4,1 ve %4,1, ve Diğer %5,7 ve %5,4, ve imatinib grubunda 1 bilinmeyen) ve Sokal risk skoru (sırasıyla düşük risk %35 ve %39,4, orta risk %43,5 ve %38,2, yüksek risk %21,5 ve %22,4) açısından iyi dengelenmiştir.
mITT popülasyonunda 60 aylık takip sonrasında, bosutinib ile tedavi edilen hastaların (N=246)
%60,2'si ve imatinib ile tedavi edilen hastaların (N=239) %59,8'i halen ilk basamak tedavi
almaktadır.
mITT popülasyonunda 60 aylık takip sonrasında, hastalığın AF veya BF KML'ye ilerlemesi nedeniyle çalışmayı bırakma imatinib ile tedavi edilen hastalar için %1,7'e kıyasla bosutinib ile tedavi edilen grupta %0,8 olmuştur. Altı (%2,4) bosutinib hastası ve yedi (%2,9) imatinib hastası AF KML veya BF KML'ye dönüşmüştür. Araştırmacı tarafından değerlendirilen suboptimal yanıt veya tedavi başarısızlığı nedeniyle çalışmanın bırakılması, imatinib ile tedavi edilen gruptaki hastaların %15,5'ine kıyasla bosutinib ile tedavi edilen gruptaki hastaların
%5,3'ünde görülmüştür. Çalışma sırasında bosutinib grubunda 12 (%4,9) ve imatinib grubunda
14 (%5,8) hasta hayatını kaybetmiştir. ITT popülasyonunda ek transformasyon meydana
gelmemiştir, ITT popülasyonunda bosutinib kolunda 2 ek ölüm meydana gelmiştir. Tablo 2'de MMY ve TSY etkililik sonuçları özetlenmiştir.
Tablo 2 - mITT popülasyonunda tedavi grubuna göre 12. ve 18. ayda MMY ve 12 ayda TSY özeti
Yanıt | Bosutinib (N=246) | İmatinib (N=241) | Tahmini risk oranı (%95 GA) |
Majör Moleküler yanıt 12. ayda MMY, n (%) (%95 GA) | 116 (47,2) (40,9-53,4) |
89 (36,9) (30,8-43) |
1,55(1,07-2,23) |
Tek taraflı p-değeri | 0,0100 | ||
18. ayda MMY, n (%) %95 GA | 140 (56,9) (50,7-63,1) | 115 (47,7) (41,4-54) | 1,45 (1,02-2,07) |
Tek taraflı p-değeri | 0,0208 | ||
Tam sitogenetik yanıt 12. ayda TSY, n (%) (%95 GA) | 190 (77,2) (72-82,5) |
160 (66,4) (60,4-72,4) |
1,74 (1,16-2,61) |
Tek taraflı p-değeri | 0,0037 | ||
Not: MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR-ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır. TSY; kemik iliğinden elde edilen ≥20 metafazın kromozom bantlama analizinde Ph+ metafazların bulunmaması veya uygun bir sitogenetik değerlendirme bulunmuyorsa MMY olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; CMH=Cochran Mantel Haenszel; TSY=tam sitogenetik yanıt; mITT=modifiye ITT; MMY=major moleküler yanıt; N/n=hasta sayısı; Ph+=Philadelphia kromozomu-pozitif.
12. ayda mITT popülasyonunda, MY oranı (minimum 9.800 ABL transkript ile ≤ %0,01 BCR ABL [standardize edilmiş başlangıçtan ≥4 log azalmaya denk gelir] şeklinde tanımlanır)
imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksek bulunmuştur (bosutinib grubunda %20,7'ye [%95 GA: %15,7-%25,8] karşılık imatinib grubunda %12 [%95 GA: %7,9-
%16,1], tahmini risk oranı 1,88 [%95 GA: 1,15-3,08], tek taraflı p değeri=0,0052).
3, 6 ve 9. aylarda MMY'li hastaların oranı imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksektir (Tablo 3).
Tablo 3 - mITT popülasyonunda 3, 6 ve 9. aylarda tedaviye göre MMY karşılaştırması
Zaman | MMY'li hastaların sayısı (%) | Tahmini risk oranı (%95 GA) | |
Bosutinib (N=246) | İmatinib (N=241) | ||
3. ay (%95 GA) | 10 (4,1) (1,6-6,5) | 4 (1,7) (0-3,3) | 2,48 (0,77-7,98) |
Tek taraflı p-değeri | 0,0578 | ||
6. ay (%95 GA) | 86 (35) (29-40,9) | 44 (18,3) (13,4-23,1) | 2,42 (1,59-3,69) |
Tek taraflı p-değeri | <0,0001 | ||
9. ay (%95 GA) | 104 (42,3) (36,1-48,4) | 71 (29,5) (23,7-35,2) | 1,78 (1,22-2,6) |
Tek taraflı p-değeri | 0,0015 | ||
Not: Yüzdeler her tedavi grubundaki hasta sayısına dayanmaktadır. MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR ABL/ABL oranı (standart hale getirilmiş başlangıç noktasından ≥3 log azalmaya denk gelir) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; CMH=Cochran Mantel Haenszel; mITT=modifiye ITT; MMY=major moleküler yanıt; N=hasta sayısı.
60. ayda mITT popülasyonunda MMY, MY ve MY olan hastaların oranı, imatinib grubuna kıyasla bosutinib grubunda daha yüksekti (Tablo 4). Sokal risk alt gruplarında 60. aydaki MMY oranları Tablo 5'te özetlenmiştir.
Tablo 4 - 60. ayda mITT popülasyonundaki moleküler yanıtın özeti
Yanıt | Bosutinib (N=246) | İmatinib (N=241) | Tahmini risk oranı (%95 GA) |
60. ayda moleküler yanıt, n (%) (%95 GA) |
|
|
|
MMY | 182 (74) (68,5-79,5) | 158 (65,6) (59,6-71,6) | 1,52 (1,02-2,25) |
MY | 145 (58,9) (52,8-65,1) | 120 (49,8) (43,5-56,1) | 1,46 (1,02-2,09) |
MY | 119 (48,4) (42,1-54,6) | 93 (38,6) (32,4-44,7) | 1,50 (1,05-2,16) |
Not: MMY/MY/MY, merkezi laboratuvar tarafından değerlendirilen minimum 3.000/9.800/30.990 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1/0,01/0,0032 BCR-ABL/ABL oranı (standard başlangıç noktasından ≥ 3/4/4,5 log azalmaya denk) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson, GA=güven aralığı; mITT=modifiye ITT; MMY=majör moleküler yanıt; MY=moleküler yanıt; N/n=hasta sayısı.
Tablo 5 - 60. ayda mITT popülasyonunda Sokal risk skoruna göre MMY özeti
Yanıt | Bosutinib | İmatinib | Tahmini risk oranı (%95 GA) |
Düşük Sokal risk MMY, n (%) (%95 GA) | N=86 67 (77,9) (69,1-86,7) | N=95 68 (71,6) (62,5-80,6) | 1,40 (0,71-2,76) |
Orta Sokal risk MMY, n (%) (%95 GA) | N=107 79 (73,8) (65,5-82,2) | N=92 62 (67,4) (57,8-77) | 1,37 (0,74-2,52) |
Yüksek Sokal risk MMY, n (%) (%95 GA) | N=53 36 (67,9) (55,4-80,5) | N=54 28 (51,9) (38,5-65,2) | 1,97 (0,90-4,32) |
Not: Yüzdeler, her tedavi grubundaki hasta sayısına göre belirlenmiştir. MMY merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABL transkripti olacak şekilde, uluslararası skalada ≤ %0,1 BCR-ABL/ABL oranı (standart başlangıç noktasından ≥ 3/ log azalmaya denk) olarak tanımlanmıştır.
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson; GA=güven aralığı; mITT=modifiye ITT; MMY=majör moleküler yanıt; N/n=hasta sayısı.
TSY'siz tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış TSY'nin kümülatif insidansı mITT popülasyonunda bosutinib tedavi grubunda imatinib tedavi grubuna kıyasla daha yüksektir (60. ayda %83,3'e [%95 GA: %78,1-%87,4] karşılık %76,8 [%95 GA: %70,9-
%81,6]; kademelenmiş orantısal alt dağıtımlı bir tehlike modelinden tehlike oranı [HR]: 1,35 [%95 GA: 1,11-1,64]). TSY'ye (sadece yanıt verenler) olan medyan süre bosutinib grubunda
24 haftaya (aralık: 11,4-120,7) karşılık imatinib grubunda 24,3 hafta (aralık: 11,4-96,6) olmuştur.
MMY, MY ve MY'e kadar geçen medyan süre mITT popülasyonunda (sadece yanıt verenler) bosutinib tedavi grubu için sırasıyla 36,1 hafta (aralık: 11,9-241,9), 83,7 hafta (aralık: 12,4-244,3), 108 hafta (aralık: 24,1-242,1) iken, imatinib tedavi grubunda sırasıyla 47,7 hafta
(aralık: 12,1-216,1), 84,4 hafta (aralık: 23,6-241,9), 120,4 haftaydı (aralık: 24,6 -240,7).
Şekil 1 ila 3'te gösterildiği gibi, olay olmadan tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış MMY, MY ve MY'in kümülatif insidansı, imatinib ile karşılaştırıldığında bosutinib ile daha yüksekti.
Şekil 1 - Kümülatif MMY insidansı (mITT popülasyonu)
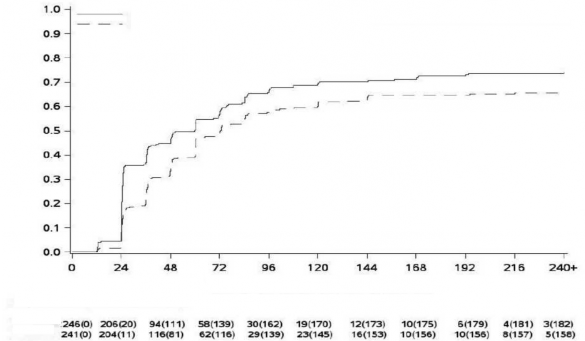
MMR Olasılığı
MMY Olasılığı
Randomizasyondan itibaren geçen süre (hafta)
MR Olasılığı
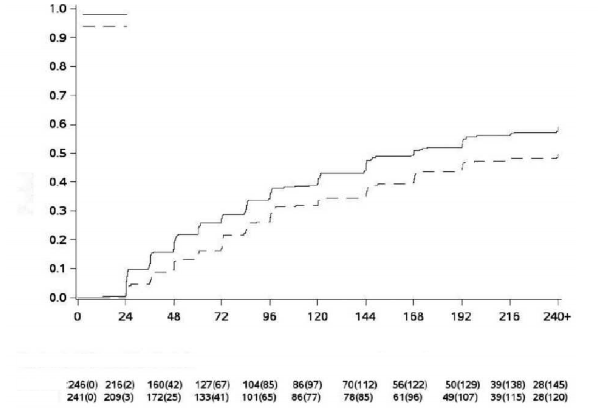
Randomizasyondan itibaren geçen süre (hafta)
MY Olasılığı
Şekil 2 - Kümülatif MYinsidansı (mITT popülasyonu)
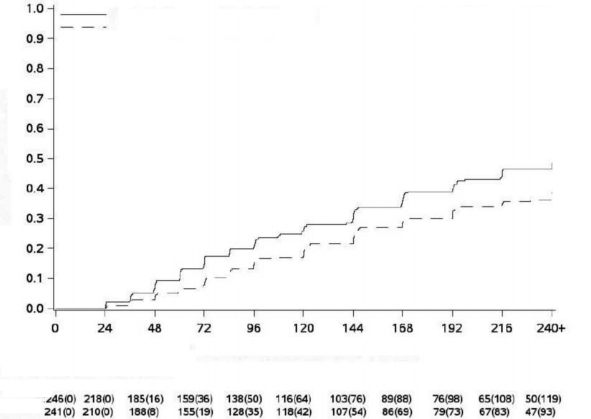
Randomizasyondan itibaren geçen süre (hafta)
MY Olasılığı
Şekil 3 - Kümülatif MYinsidansı (mITT popülasyonu)
mITT popülasyonunda, TSY'ye ulaşan hastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinib gruplarında sırasıyla %97,4 (%95 GA: %93,9-
%98,9) ve %93,7 (%95 GA: %88,9-%96,5) (HR 0,39 [%95 GA: 0,14-1,13] idi. MMY'ye ulaşan
hastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinib gruplarında sırasıyla %92,2 (%95 GA: %86,8-%95,4) ve %92 (%95 GA: %85,9-%95,5) (HR
1,09 [%95 GA: 0,49-2,44] idi.
60. ayda, mITT popülasyonunda bosutinib ve imatinib ile tedavi edilen hastaların sırasıyla
%43,9'u (%95 GA: %37,7-%50,1) ve %38,6'sında (%95 GA: %32,4-%44,7) (tahmini risk oranı
1,24 [%95 GA: 0,87, -1,78]), şu kriterlere göre tanımlanan MY mevcuttu: 1 yıllık süre zarfında
yapılan tüm değerlendirmelerde en az MY ile minimum 3 yıl boyunca tedavi.
60. ayda mITT popülasyonunda tedavi sırasında olaysız sağkalım olaylarının kümülatif insidansı bosutinib kolunda %6,9 (%95 GA: %4,2-%10,5) ve imatinib kolunda %10,4 (%95
GA: %6,9-%14,6) (HR 0,64, %95 GA: 0,35-1,17) idi.
60. ayda mITT popülasyonunda genel sağkalımın Kaplan-Meier tahminleri bosutinib ve
imatinib hastaları için sırasıyla %94,9 (%95 GA: %91,1-%97) ve %94 (%95 GA: %90,1-
%96,4) (HR 0,80, %95 GA: 0.37-1.73) olmuştur.
Retrospektif bir analizde, ITT popülasyonundaki değerlendirilebilir hastalar arasında, bosutinib kolunda daha fazla hastada 200/248 (%80,6) imatinib kolundaki hastalara 153/253 (%60,5) kıyasla erken moleküler yanıt (BCR-ABL transkriptleri 3. ayda ≤%10) elde edilmiştir, tahmini
risk oranı 2,72 (%95 GA: 1,82-4,08). Erken moleküler yanıt veren ve vermeyen bosutinib
hastalarında 60. aydaki MMY ve olaysız sağkalım Tablo 6'da özetlenmiştir.
Tablo 6 - ITT popülasyonunda 3. ayda BCR-ABL'nin ≤ %10'a karşılık > %10 olduğu bosutinib hastalarında 60. aydaki sonuçlar
Bosutinib (N=248) | 3. ayda BCR-ABL'nin ≤ %10 olduğu hastalar (N=200) | 3. ayda BCR-ABL'nin > %10 olduğu hastalar (N=48) | Tehlike Oranı (%95 GA) |
Kümülatif MMY insidansı, % (%95 GA) | 84 (78,1-88,4) | 56,5 (41,1-69,4) | 2,67 (1,90-3,75) |
Kümülatif olaysız sağkalım olayları insidansı, % (%95 GA) | 5,5 (2,9-9,3) | 12,5 (5,1-23,4) | 0,40 (0,14-1,17) |
Kısaltmalar: BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson; GA=güven aralığı; ITT=
tedavi-amaçlı; MMY=majör moleküler yanıt; N= 3. ayda ≥ 3.000 ABL kopya olan hastaların sayısı.
60. ayda mITT popülasyonunda, bosutinib kolunda [6 (%2,4) bosutinib ve 12 (%5) imatinib]
daha az hastada saptanabilir yeni mutasyonlar görülmüştür.
İmatinibe karşı direnç gösteren veya imatinibi tolere etmeyen, kronik fazda (KF), akselere fazda (AF) ve blastik fazda (BF) KML hastaları üzerinde yapılan Faz 1/2 klinik çalışma
Daha önce 1 TKI (imatinib) veya 1'den fazla TKI (imatinib ardından dasatinib ve/veya nilotinib) ile tedavi edilmiş kronik fazda, akselere fazda ve blastik faz için ayrı kohortlarla imatinibe karşı direnç gösteren veya imatinibi tolere etmeyen hastalarda günde bir defa verilen 500 mg bosutinibin etkililiği ve güvenliliğinin değerlendirilmesi için tek kollu, Faz 1/2 açık etiketli, çok merkezli bir klinik çalışma yürütülmüştür.
Bu araştırmada, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilen kronik faz KML hastaları, daha önce imatinib ve en az 1 ilave TKI (dasatinib ve/veya nilotinib) ile tedavi edilen kronik faz KML hastaları, daha önce en az 1 TKI (imatinib) ile tedavi edilmiş akselere veya blast fazındaki KML hastaları ve daha önce en az 1 TKI (imatinib) ile tedavi edilmiş Ph+ ALL hastalarını içeren şekilde bu araştırmada bosutinib tedavisi görmüş 570 hasta bulunmaktadır.
Çalışmanın birincil etkililik sonlanım noktası, imatinibe karşı direnç gösteren, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilmiş kronik faz KML hastalarında 24. haftada majör sitogenetik yanıt (MSY) oranı olmuştur. Diğer etkililik sonlanım noktaları, kümülatif sitogenetik ve moleküler yanıt oranlarını, sitogenetik ve moleküler yanıtlara kadar geçen süreyi ve bu yanıtların süresini, başlangıç mutasyonlarındaki yanıtı, AF/BF'ye dönüşüm, progresyonsuz sağkalım ve tüm kohortlar için genel sağkalımı içermektedir.
Faz 1/2 çalışmanın sonunda halen bosutinib kullanan ve araştırmacının değerlendirmesine göre bosutinib tedavisinin yarar sağladığı hastaların yanı sıra Faz 1/2 çalışma kapsamında daha önce bosutinib kullanmayı bırakan ve uzun süreli sağkalım takibi uygulanan veya Faz 1/2 çalışmayı tamamlayan hastaların uzatma çalışmasına kayıt için uygun olduğu kabul edilmiştir. Gerek bosutinib tedavisi uygulanan gerekse uzun süreli sağkalım takibinde olan her hasta, son hastanın 10 yıllık takip süresine (ilgili hastanın Faz 1/2 çalışmada ilk bosutinib dozunun uygulandığı tarihe göre hesaplanmaktadır) ulaşmasına kadar uzatma çalışmasına devam etmiştir.
Uzatma çalışmasının etkililik sonlanım noktaları sitogenetik ve moleküler yanıtların süresini, AF/BF'ye transformasyonu, progresyonsuz sağkalım ve genel sağkalımı içermiştir.
Etkililik analizleri, tamamlanan bu uzatma çalışmasından elde edilen verileri içermektedir.
KF KML Hastaları
Daha önce imatinib ve en az 1 ilave TKI ile tedavi edilmiş Ph+ KF KML hastaları için etkililik sonuçları (minimum takip 120 ay, medyan tedavi süresi 9 ay (0,23 â 164,28 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %20,2 ve %7,6) ve daha önce yalnızca imatinib ile tedavi edilmiş Ph+ KF KML hastaları için sonuçlar (minimum takip 120 ay, medyan tedavi süresi 26 ay (0,16 â 170,49 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %40,5 ve %19,4) Tablo 7'de verilmektedir.
Akselere ve blastik fazlardaki KML hastaları
AF (minimum takip 120 ay, medyan tedavi süresi 10 ay (0,10 â 156,15 ay) ve sırasıyla 60 ve
120. ayda halen tedavi almaya devam eden hasta oranları %12,7 ve % 7,6) ve BF (minimum takip 120 ay, medyan tedavi süresi 2,8 ay (0,03 â 71,38 ay) ve sırasıyla 60. ve 120. ayda halen tedavi almaya devam eden hasta oranları %3,1ve % 0) Ph+ KML hastaları için etkililik sonuçları Tablo 7'de verilmiştir.
Tablo 7 â Daha önce tedavi görmüş kronik ve ilerlemiş fazda KML hastalarında etkililik sonuçları*
| Daha önce sadece imatinib ile tedavi edilen Ph+ kronik faz KML | Daha önce imatinib ve dasatinib veya nilotinib ile tedavi edilen Ph+ kronik faz KML | Daha önce en az imatinib ile tedavi edilen akselere faz | Daha önce en az imatinib ile tedavi edilen blastik faz |
Kümülatif sitogenetik yanıt | N=262 59,9 (53,7-65,9) 49,6 (43,4-55,8) | N=112 42(32,7-51,7) 32,1(23,6-41,6) | N=72 40,3 (28,9-52,5) 30,6 (20,2-42,5) | N=54 37 (24,3-51,3) 27,8 (16,5-41,6) |
MSY, % (%95 GA) | ||||
TSY, % (%95 GA) | ||||
Kümülatif moleküler yanıt MMY, % (%95 GA) MY, % (%95 GA) | N=197
42,1 (35,1-49,4) 37,1 (30,3-44,2) | N=107
17,8 (11-26,3) 15 (8,8-23,1) | N=54
16,7 (7,9-29,3) 13 (5,4-24,9) | N=48 10,4 (3,5-22,7) 10,4 (3,5-22,7) |
Yalnızca yanıt verenler için MSY zamanı, medyan (aralık), hft |
12,3 (4 â 46) |
12,3 (3,9 â 550,6) |
12 (3,9 â 144,7) |
8,2 (3,9 â 25,1) |
MSY süresi | N=157 70,7 (63,1-78,3)
65,3 (56,6-74) N/R | N=47 66,6 (51,5-81,7)
55,3 (36,3-74,4)
N/R | N=29 40,8 (20,9-60,7)
40,8 (20,9-60,7) 84 (24-N/E) | N=20 21,2 (0,1-42,3)
N/E 29,1 (11,9-38,3) |
5. yılda K-M % (%95 GA) | ||||
10. yılda K-M % (%95 GA) | ||||
Medyan , hft (%95 GA) | ||||
Yalnızca yanıt verenler için TSY zamanı, medyan (aralık), hft | 24 (7,7-240,6) | 24 (11,6-216) | 23,8 (4,1-120) | 8,4 (3,9-25,1) |
TSY süresi 5. yılda K-M (%95 GA) 10. yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=130 69,7 (61,3-78,2) 63,4 (54-72,8) N/R | N=36 54,4 (36,7-72,1) 40,8 (22-59,6) 252 (24-N/E) | N=22 40 (18,5-61,5) 40 (18,5-61,5) 72 (36,1-N/E) | N=15 24,9 (0,9-48,9) N/E 20 (9,1-29,6) |
Yalnızca yanıt verenler için MMY zamanı, medyan (aralık), hft | 35,6 (3,1-367,1) | 12,4 (4-171,7) | 36,1 (12,1-144,1) | 4,7 (3,9-168,9) |
MMY süresi 5 yılda K-M (%95 GA) 10 yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=83 74,1 (64,2-83,9) 63,4 (50,2-76,6) N/R | N=19 70 (47,5-92,5) 70 (47,5-92,5) N/R | N=9 66,7 (35,9-97,5) 66,7 (35,9-97,5) N/R | N=5 60 (17,1-100) N/E N/R |
Yalnızca yanıt verenler için MYzamanı, medyan (aralık), hft | 28 (3,1-583,1) | 23,8 (4-240,1) | 24,1 (22,9-96) | 4,7 (3,9-284,9) |
MYsüresi 5. yılda K-M (%95 GA) 10. yılda K-M (%95 GA) Medyan, hft (%95 GA) | N=73 74,7 (64,2-85,2) 60,8 (46,1-75,4) N/R | N/A | N/A | N/A |
AF/BF'ye dönüşüm Tedavi altındayken dönüşüm, n | N=284 15 | N=119 5 | N=79 3 | N/A |
Progresyonsuz sağkalım 5. yılda Kümİns % (%95 GA) 10. yılda Kümİns % (%95 GA) | N=284 19,7 (15,6-24,9)
23,9 (19,5-29,5) | N=119 24,4 (17,8-33,4)
26,9 (20-36,2) | N=79 41,8 (32,2-54,2)
41,8 (32,2-54,2) | N=64 67,2 (56,6-79,7)
N/E |
Genel sağkalım | N=284 83,5 (78,7-88,3) 71,5 (64,4-78,7)
N/R | N=119 74,1 (64,8-83,4) 60,4 (47,2-73,7)
N/R | N=79 58,5 (46,9-70,2) 50,7 (36,5-65)
N/R | N=64 22,5 (7,1-37,9) 22,5 (7,1-37,9)
10.9 (8.7,19.7) |
5. yılda K-M % (%95 GA) 10.yılda K-M % (%95 GA)Medyan, ay (%95 GA) |
Görüntüleme tarihi: Faz 1/2 çalışma 2 Ekim 2015, Uzatma tarihi 2 Eylül 2020
Sitogenetik Yanıt kriterleri: MSY, tam [kemik iliğinden %0 Ph+ metafazları veya floresan in situ hibridizasyondan (FISH) <%1 pozitif hücreler] veya kısmi (%1-%35) sitogenetik yanıtları içermiştir. Sitogenetik yanıtlar, her bir kemik iliği numunesinde >/= 20 metafaz hücre arasında Ph+ metafazlarının yüzdesine dayalıdır. >/= 20 metafaz kullanılabilir olmadığında başlangıç sonrası sitogenetik değerlendirmeler için FISH analizi (>/= 200 hücre) kullanılabilir. Uzatma çalışmasında, spesifik bir tarihte geçerli bir sitogenetik değerlendirme mevcut olmaması durumunda TSY, MMY'ye dayanarak yerine konmuştur.
Moleküler yanıt kriterleri: Faz 1/2 çalışmada MMY/MY, merkezi laboratuvar (uluslararası ölçekte olmayan) tarafından değerlendirildiği üzere, ≤%0,1/0,01 BCR-ABL transkripti olarak tanımlanmıştır. Uzatma çalışmasında, olgu bildirim formunda yerel laboratuvar tarafından değerlendirilip yanıt veren hastalarda MMY/MY elde edildiği belirtilmiştir.
Kısaltmalar: AF=Akselere faz, BF=Blastik faz, Ph+=Philadelphia kromozomu pozitif; KF=Kronik faz, KML=kronik miyeloid lösemi; KM=Kaplan-Meier; N/n=hasta sayısı; N/A=Uygulanamaz, N/R=Ulaşılamaz, N/E=tahmin edilemez; GA=Güven Aralığı, MSY=Majör Sitogenetik Yanıt, TSY=Tam Sitogenetik Yanıt, Kümİns= Kümülatif İnsidans, MMY= Majör Moleküler Yanıt, BCR-ABL=kırılma bölgesi (breakpoint cluster region)-Abelson
KF, AF ve BF kohortlarında genel sağkalım Şekil 4'te grafiksel olarak gösterilmiştir.
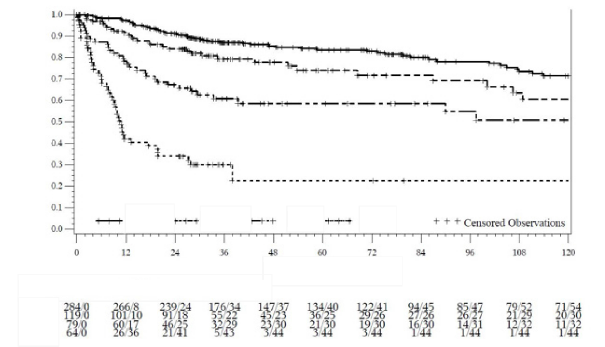
Şekil 4 - KF2L, KF3L, AF ve BF'de Kaplan-Meier Genel Sağkalım Tahmini
Genel Sağkalım Olasılığı
Ölüm zamanı (ay)
Riske tabi gönüllü / Kümülatif Olaylar
Tablo 8- KF KML'nin değerlendirilebilir popülasyonunda başlangıçtaki BCR-ABL mutasyon durumuna göre yanıt; imatinib ve dasatinib ve/veya nilotinib öncesi (üçüncü dizi)
Başlangıçta BCR-ABL mutasyon durumu | Başlangıçta insidans n (%) | Elde edilen veya korunan MSY Yan/Değr(%) N=112 |
Mutasyon değerlendirildi | 98 (100) | 36/92 (39,1) |
Mutasyon yok | 59 (60,2) | 23/55 (41,8) |
En az 1 mutasyon | 39 (39,8) | 13/37 (35,1) |
Dasatinib'e dirençli mutasyonlar | 10 (10,2) | 1/9 (11,1) |
E255K/V | 2 (2) | 0/2 |
F317L | 8 (8,2) | 1/7 (14,3) |
Nilotinib'e dirençli mutasyonlar | 13 (13,3) | 8/13 (61,5) |
Y253H | 6 (6,1) | 5/6 (83,3) |
E255K/V | 2 (2) | 0/2 |
F359C/I/V | 7 (7,1) | 5/7 (71,4) |
Görüntüleme tarihi: Faz 1/2 çalışma 2 Ekim 2015, Uzatma Çalışması 2 Eylül 2020
Kısaltmalar: BCR-ABL= kırılma bölgesi (breakpoint cluster region)-Abelson, KF= kronik faz, KML= kronik miyeloid lösemi, MSY = Majör Sitogenetik Yanıt, N/n=hasta sayısı, Yan = yanıt verenler, Değr = değerlendirilebilir.
Not: Başlangıçtaki mutasyonlar, hastanın çalışma ilacının ilk dozu öncesinde tanımlanmıştır.
Daha önce nilotinib ile tedavi edilen ve E255V mutasyonu bulunan bir hasta en iyi yanıt olarak THY almıştır.
İn vitro testleri, bosutinibin T315I veya V299L mutasyonuna karşı sınırlı düzeyde aktivitesi olduğunu göstermiştir. Bu nedenle, bu mutasyonlara sahip hastalarda klinik aktivite beklenmemektedir.
Daha önce 1 ya da daha fazla TKI ile tedavi edilmiş Ph+ KML hastalarında yapılan Faz 4 Klinik çalışma
Daha önce 1 ya da daha fazla TKI ile tedavi edilmiş KF, AF veya BF hastalık açısından ayrı kohortlara ayrılan TKI'ya dirençli ya da TKI'yı tolere edemeyen KML hastalarında günde bir kez 500 mg bosutinibin sağladığı etkililiği ve güvenliliği değerlendirmek üzere tek kollu, açık etiketli, randomize olmayan, çok merkezli bir Faz 4 çalışma yapılmıştır.
Bu araştırmada, daha önce 1 TKI (imatinib veya dasatinib veya nilotinib) ile tedavi edilmiş olan 46 KF Ph+ KML hastasını, daha önce 2 TKI (imatinib ve/veya dasatinib ve/veya nilotinib) ile tedavi edilmiş olan 61 KF Ph+ KML hastasını, daha önce 3 TKI (imatinib ve dasatinib ve nilotinib) ile tedavi edilmiş olan 49 KF Ph+ KML hastasını, daha önce en az 1 TKI (2 hasta daha önce 2 TKI ile tedavi edilmiş ve 2 hasta daha önce 3 TKI ile tedavi edilmiştir) ile tedavi
edilmiş olan 4 AF Ph+ KML hastasını ve daha önce en az 1 TKI ile tedavi edilmiş olan 3 Ph- KML hastasını içeren toplam 163 hastaya bosutinib tedavisi uygulanmıştır.
Daha önce 1 ya da 2 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar ve daha önce 3 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar için primer etkililik sonlanım noktası, 1 yılda (52. hafta) belirlenen kümülatif doğrulanmış MSY'dir. Daha önce herhangi bir TKI tedavisi uygulanmış olan AF ve BF Ph+ KML hastaları için primer etkililik sonlanım noktasını 1 yıldaki (52. hafta kümülatif doğrulanmış genel hematolojik yanıt (GHY) oluşturmuştur. Ph+ KF KML hastalarındaki diğer etkililik sonlanım noktaları kümülatif sitogenetik ve moleküler yanıt oranını, sitogenetik ve moleküler yanıtların süresini, başlangıç mutasyonlarındaki yanıtı, AF/BF'ye transformasyonu, progresyonsuz sağkalımı ve genel sağkalımı içermektedir. Ph+ AF/BF kohortundaki ek sonlanım noktaları kümülatif sitogenetik ve moleküler yanıt oranlarını, progresyonsuz sağkalımı ve genel sağkalımı içermektedir.
KF KML hastaları
Bir yıldaki (52 hafta) kümülatif doğrulanmış MSY'yi (%95 GA) içeren primer sonlanım noktası oranı, daha önce 1 ya da 2 TKI ile tedavi edilmiş olan hastalarda %76,5 (66,9, 84,5) ve daha önce 3 TKI ile tedavi edilmiş olan hastalarda %62,2 (46,5 - 76,2) olarak saptanmıştır.
Daha önce 1 (medyan tedavi süresi 47,5 ay [0,9-50,1 ay] ve halen tedaviye devam eden %60,9), 2 (medyan tedavi süresi 41,9 ay [0,4-48,9 ay] ve halen tedaviye devam eden %45,9) ve 3 (medyan tedavi süresi 20 ay [0,2-48,9 ay] ve halen tedaviye devam eden %38,8) TKI ile tedavi edilmiş olan Ph+ KF KML hastalarında en az 3 yıl süren takipten sonra, çalışmanın kapanış tarihinde elde edilen ek etkililik sonuçları Tablo 9'da sunulmaktadır.
Tablo 9 â Daha önce tedavi görmüş kronik faz Ph+ KML hastalarında etkililik sonuçları
| Daha önce 1 TKI ile tedavi edilen Ph+ KF KML | Daha önce 2 TKI ile tedavi edilen Ph+ KF KML | Daha önce 3 TKI ile tedavi edilen Ph+ KF KML | Total Ph+ KF KML kohortu |
Kümülatif Doğrulanmış | N=43 | N=55 | N=45 | N=143 |
MSY1 yıla kadar, % (%95 GA) | 83,7 (69,3-93,2) | 70,9 (57,1-82,4) | 62,2 (46,5-76,2) | 72 (63,9-79,2) |
Kümülatif sitogeneti yanıt | N=43 | N=55 | N=45 | N=143 |
MSY, % (%95 GA) | 88,4 (74,9-96,1) | 85,5 (73,3-93,5) | 77,8 (62,9-88,8) | 83,9 (76,9-89,5) |
TSY, % (%95 GA) | 86 (72,1-94,7) | 83,6 (71,2-92,2) | 73,3 (58,1-85,4) | 81,1 (73,7-87,2) |
Kümülatif moleküler yanıt | N=46 | N=55 | N=48 | N=149 |
MMY, % (%95 GA) | 82,6 (68,6-92,2) | 76,4 (63-86,8) | 56,3 (41,2-70,5) | 71,8 (63,9-78,9) |
MY, % (%95 GA) | 73,9 (58,9-85,7) | 63,6 (49,6-76,2) | 41,7 (27,6-56,8) | 59,7 (51,4-67,7) |
MY, % (%95 GA) | 58,7 (43,2-73) | 50,9 (37,1-64,6) | 35,4 (22,2-50,5) | 48,3 (40,1-56,6) |
Yalnızca yanıt verenler için sitogenetik yanıta kadar geçen zaman, medyan (aralık), ay |
|
|
|
|
MSY | 3 (1-11,8) | 2,9 (0.3-6,4) | 3 (1,8-8,8) | 3 (0,3-11,8) |
TSY | 3 (1-17,6) | 2,9 (0.3-6,4) | 3 (1,8-8,8) | 3 (0,3-17,6) |
Sitogenetik yanıtın süresi |
|
|
|
|
MSY, 3. yılda K-M, % (%95 GA) | 96,6 (77,9-99,5) | 94,4 (79,2-98,6) | 96,9 (79,8-99.6) | 95,6 (88,7-98,4) |
TSY, 3. yılda K-M, % (%95 GA) | 96,4 (77,2-99,5) | 94,4 (79,2-98,6) | 100 (100-100) | 96,5 (89,5-98,9) |
Yalnızca yanıt verenler için moleküler yanıta kadar geçen zaman, medyan (aralık), ay |
|
|
|
|
MMY | 3 (2,8-23,3) | 3 (1-35,9) | 3,1 (1,8-9,3) | 3 (1-35,9) |
MY | 6 (2,8-47,4) | 3,1 (1-36,1) | 3,2 (1,8-47,9) | 5,5 (1-47,9) |
MY | 9,2 (2,8-47,6) | 6 (2,8-36,2) | 5,8 (1,8-18) | 6 (1,8-47,6) |
Moleküler yanıtın süresi |
|
|
|
|
MMY, 3 yılda K-M, % (%95 GA) | 90,7 (73,9-96,9) | 81,5 (63,2-91.3) | 90,2 (65,9-97,5) | 87,2 (78-92,7) |
MY, 3 yılda K-M at, % (%95 GA) | 89,5 (70,9-96,5) | 68,7 (48-82.5) | 85,2 (51,9-96,2) | 80,7 (69,4-88,1) |
Görüntüleme tarihi: 23 Kasım 2020 Kısaltmalar: Ph+=Philadelphia kromozomu pozitif; KF=kronik faz; KML=kronik miyeloid lösemi; K-M=Kaplan Meier; N=hasta sayısı; GA=güven aralığı; MSY=majör sitogenetik yanıt; TSY=tam sitogenetik yanıt; MMY=majör moleküler yanıt; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4 log azalma; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4,5 log azalma. Kümülatif Doğrulanmış MSY kriterleri: Yanıt, en az 28 gün arayla yapılan art arda 2 değerlendirmeyle doğrulanmaktadır. Yanıt veren hasta olarak kabul edilmesi için hastada başlangıçtaki yanıtın en az 52 hafta boyunca devam etmesi veya başlangıca göre düzelmesi gereklidir. Sitogenetik yanıt veren hasta olarak kabul edilebilmeleri için, başlangıçta kısmi sitogenetik yanıt (PCyR) vermiş olan hastalarda tedavi sırasında TSY elde edilmesi gereklidir. Başlangıca göre en azından MMY ve göre daha derin moleküler yanıt elde edilen hastalar doğrulanmış TSY olarak kabul edilmektedir. Kümülatif Sitogenetik Yanıt kriterleri: Tam [kemik iliğinde %0 Ph+ metafaz veya fluoresan in situ hibridizasyonda (FISH) <%1 pozitif hücre] veya kısmi (%1-%35) sitogenetik yanıtları içeren Majör Sitogenetik Yanıt. Sitogenetik yanıtlar için her bir kemik iliği örneğinde ≥20 metafaz hücredeki Ph+ metafazların yüzdesi temel alınmıştır. ≥20 metafaz mevcut olmaması durumunda, | ||||
TSY değerlendirmesi için FISH analizi (≥200 hücre) kullanılabilmiştir. Geçerli bir kemik iliği veya FISH değerlendirmesi olmayan ve en az MMY elde edilen hastalar TSY olarak kabul edilmektedir. Kümülatif Moleküler Yanıt kriterleri: MMY, MY ve MY, uluslararası ölçekte sırasıyla ≤% 0,1,
≤ %0,01 ve ≤ %0,0032 BCR-ABL/ABL oranı (standardize edilmiş başlangıca göre ≥ 3, ≥ 4 ve ≥ 4,5 log azalmaya karşılık gelmektedir) ve merkezi laboratuvar tarafından değerlendirilen sırasıyla minimum 10.000, 10.000 ve 32.000 ABL transkripti olarak tanımlanmıştır.
Olay olmaksızın tedaviyi bırakılma yarışan riski için ayarlanmış kümülatif MMY, MY ve
MY insidansı Şekil 5'te gösterilmektedir.
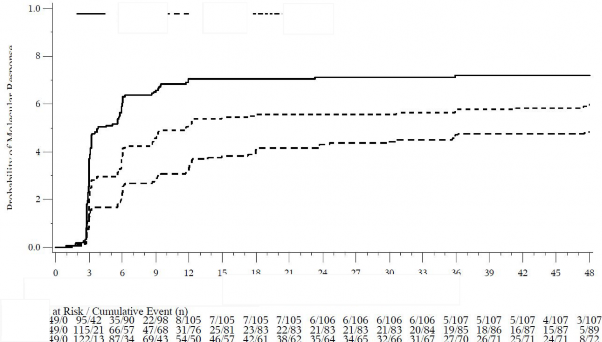
İlk doz üstünden geçen süre (ay)
Moleküler Yanıt Olasılığı
Şekil 5 - Kümülatif Moleküler Yanıt İnsidansı (KF Değerlendirilebilen Popülasyon)
Tedavi basamağına göre elde edilen moleküler yanıtlar Tablo 10'da gösterilmektedir.
Tablo 10 - Elde edilen moleküler yanıtlar
| Daha önce 1 TKI ile tedavi edilen Ph+ KF KML | Daha önce 2 TKI ile tedavi edilen Ph+ KF KML | Daha önce 3 TKI ile tedavi edilen Ph+ KF KML | Total Ph+ KF KML kohortu |
Başlangıçta MMY olmayan hastalar | N=25 | N=28 | N=26 | N=79 |
MMY, % (%95 GA) | 76 (54,9-90,6) | 64,3 (44,1- 81,4) | 38,5 (20,2- 59,4) | 59,5 (47,9- 70,4) |
Başlangıçta MY olmayan hastalar | N=37 | N=38 | N=37 | N=112 |
MY, % (%95 GA) | 70,3 (53-84,1) | 55,3 (38,3- 71,4) | 32,4 (18-49,8) | 52,7 (43-62,2) |
Başlangıçta MY olmayan hastalar | N=42 | N=46 | N=43 | N=131 |
MY, % (%95 GA) | 54,8 (38,7- 70,2) | 43,5 (28,9- 58,9) | 30,2 (17,2- 46,1) | 42,7 (34,1- 51,7) |
Başlangıçta MMY olan hastalar | N=21 | N=27 | N=22 | N=70 |
Daha derin MY, % (%95 GA) | 85,7 (63,7-97) | 66,7 (46-83,5) | 63,6 (40,7- 82,8) | 71,4 (59,4- 81,6) |
Görüntüleme kopyası tarihi: 23 Kasım 2020 Kısaltmalar: Ph+=Philadelphia kromozomu pozitif; KF=kronik faz; KML=kronik miyeloid lösemi; N=hasta sayısı; GA=güven aralığı; MMY=majör moleküler yanıt; MY=moleküler yanıt; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4 log azalma; MY=BCR-ABL transkriptlerinde standardize edilmiş başlangıca göre ≥ 4,5 log azalma. | ||||
KF hastalarda, tedavi uygulaması sırasında AF veya BF KML'ye progresyonlar meydana gelmemiştir.
AF KML hastaları
Ph+ AF KML olan hastalarda, medyan tedavi süresi 22,1 ay (aralık: 1,6-50,1 ay), 1 yılda (52 hafta) kümülatif doğrulanmış GHY, kümülatif TSY oranında olduğu gibi %75 (%95 GA: 19,4, 99,4) olarak belirlenmiş ve 3 hastanın tümünde, elde edilen TSY tedavi sırasında da devam etmiştir.
Başlangıçta BCR-ABL Mutasyonlarına göre yanıt
KF kohortundaki on hastada başlangıçta mutasyonlar (A365V, E453K, E255K, E255V, Q252H, L298V [her biri n=1], Y253F ve G250E [her biri n=2]) olduğu kaydedilmiştir. KF kohortundaki bir hastada, çalışmanın 8. gününde F359I mutasyonu olduğu saptanmıştır. AF kohortundaki bir hastada, başlangıçta 2 mutasyon (F311L ve L387F) tanımlanmıştır. KF
kohortunda mutasyonları olan hastalar arasında, moleküler yanıtlar 4/11 (%36,4) hastada gözlenmiş, E255V mutasyonu olan 1 hastada MMY ve sırasıyla F359I, Y253F ve A365V mutasyonu olan 3 hastada MY elde edilmiştir. AF kohortundaki mutasyonları olan hastada herhangi bir yanıt elde edilmemiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Tek doz bosutinibin (500 mg) sağlıklı gönüllülere yemekle birlikte uygulanması sonrasında, mutlak biyoyararlanım %34'tür. Emilim göreceli olarak yavaş olduğundan pik konsantrasyona ulaşma için medyan süre (t) 6 saattir. Bosutinib 200 ve 600 mg arası bir doz aralığında EAA ve Cdeğerlerinde doz oranlı artışlar göstermektedir. Aç durumla karşılaştırıldığında, yemek ile bosutinibin Cdeğeri 1,8 kat ve EAA değeri 1,7 kat artmaktadır. KML hastalarında günde 400 mg bosutinibin yiyeceklerle uygulanmasını takiben kararlı durumda C(geometrik ortalama varyasyon katsayısı % [CV]) 145 (14) ng/mL, ve EAA(geometrik ortalama, %CV) 2.700 (16) ngâ¢h/mL'dir. Yemek ile günlük 500 mg bosutinib uygulamasını takiben, Cdeğeri 200 (6) ng/mL ve EAAdeğeri 3.640 (12) ngâ¢h/mL'dir. Bosutinibin çözünebilirliği pH'a bağlıdır ve emilim, gastrik pH arttığında azalmaktadır (bkz. bölüm 4.5).
Dağılım:
120 mg bosutinibin sağlıklı gönüllülere tek intravenöz doz uygulanmasını takiben, bosutinib için ortalama dağılım hacmi (% varyasyon katsayısı [CV]) 2.331 (32) L olmuştur; bu da bosutinibin ekstra vasküler dokulara kapsamlı bir şekilde dağıtıldığını göstermektedir.
Sağlıklı gönüllüler üzerinde yapılan in vitro (%94) ve ex vivo (%96) çalışmalarda bosutinibin insan plazmasındaki proteinlere yüksek oranda bağlandığı ve bu bağın konsantrasyona bağlı olmadığı gözlemlenmiştir.
Biyotransformasyon:
İn vitro ve in vivo çalışmalarda, bosutinibin (ana bileşik) insanlarda baskın olarak karaciğer metabolizmasından geçtiği gösterilmiştir. İnsanlara tek veya birden fazla bosutinib (400 veya 500 mg) uygulanması sonrasında, dolaşımdaki majör metabolitler oksideklorinlenmiş (M2) ve N-desmetilatlanmış (M5) olarak gözlemlenmiş, bosutinib N-oksit (M6) dolaşımdaki minör bir metabolittir. N-desmetilatlanmış metabolitin sistemik maruziyeti, ana bileşenin %25'idir bu süreçte oksideklorinlenmiş metabolit, ana bileşenin %19'udur. Üç metabolit de bir Src- dönüştürülmüş fibroblast ankoraj bağımlı dağıtım miktar tayininde bosutinibin ≤%5'i olmuştur. Dışkıda, bosutinib ve N-desmetil bosutinib ilaç ile ilgili majör bileşenler olmuştur. İnsan karaciğeri mikrozomları ile yapılan in vitro çalışmalar, bosutinib metabolizmasına müdahil olan majör sitokrom P450 izoziminin CYP3A4 olduğunu ve ilaç etkileşim çalışmaları da ketokonazol ve rifampisinin bosutinib farmakokinetikleri üzerinde etkisi olduğunu göstermiştir (bkz. bölüm 4.5). CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 veya 3A5 ile bosutinib metabolizması gözlemlenmemiştir.
Eliminasyon:
Sağlıklı gönüllülerde intravenöz tek bir doz halinde 120 mg bosutinib sonrasında, ortalama (%CV) vücuttan uzaklaştırılma yarı ömrü yaklaşık 35,5 (24) saat ve ortalama (%CV) klerens 61,9 (26) L/sa'dır. Ağız yoluyla alınan bosutinib üzerinde yapılan bir kütle dengesi çalışmasında, toplam dozun ortalama %94,6'sı 9 günde geri çıkarılmıştır; majör vücuttan dışarı atma yolu dışkılama (%91,3) olmakla birlikte, %3,29'luk bir oran da idrarla atılmaktadır. Dozun yüzde yetmiş beşi 96 saat içinde geri çıkarılmıştır. İdrarda bosutinibin değişmeden vücuttan atılma oranı hem sağlıklı gönüllülerde hem de ileri evre habis solid tümörleri bulunan gönüllülerde yaklaşık %1 düzeyindedir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Bir böbrek yetmezliği çalışmasında, hafif, orta şiddette veya ciddi böbrek yetmezliği bulunan 26 gönüllüye yemekle birlikte tek doz halinde 200 mg bosutinib verilmiş ve 8 kişinin sonuçları sağlıklı gönüllülerle eşleşmiştir. Böbrek yetmezliği şu KrKL değerlerine bağlıdır (Cockcroft- Gault formülü ile hesaplanır): < 30 mL/dk (ciddi böbrek yetmezliği), 30 ≤ KrKL ≤ 50 mL/dk (orta şiddetli böbrek yetmezliği) veya 50 < KrKL ≤ 80 mL/dk (hafif şiddetli böbrek yetmezliği). Orta şiddetli ve ciddi böbrek yetmezliği bulunan gönüllülerde, sağlıklı gönüllüler ile karşılaştırıldığında sırasıyla %35 ve %60 düzeyde EAA artışı gözlemlenmiştir. Maksimum maruziyet Cdeğeri, orta şiddetli ve ciddi böbrek yetmezliği olan gruplarda sırasıyla %28 ve %34 oranda artmıştır. Bosutinib maruziyeti, hafif şiddetli böbrek yetmezliği bulunan kişilerde artış göstermemiştir. Bosutinibin böbrek yetmezliği bulunan gönüllülerde vücuttan uzaklaştırılma yarı ömrü, sağlıklı gönüllülerdekine benzerdir.
Böbrek yetmezliği için doz ayarlamaları bu çalışmanın sonuçlarına ve 200-600 mg doz
aralığında bosutinibin bilinen lineer farmakokinetiğine dayanmaktadır.
Karaciğer yetmezliği:
Yemekle verilen 200 mg'lik bir bosutinib dozu, karaciğer bozukluğu bulunan 18 gönüllüden oluşan bir kohortta (Child-Pugh, sınıf A, B ve C) değerlendirilmiş ve 9 kişi sağlıklı gönüllüler ile aynı sonucu vermiştir. Child-Pugh, sınıf A, B ve C'de plazmada bosutinibin Cdeğeri sırasıyla 2,4 kat, 2 kat ve 1,5 kat; plazmada bosutinibin EAA değeri ise sırasıyla 2,3 kat, 2 kat ve 1,9 kat artmıştır. Sağlıklı gönüllüler ile karşılaştırıldığında hepatik bozuklukları olan gönüllülerde bosutinib için t½ değeri artmıştır.
Pediyatrik popülasyon:
BOSULİF henüz 18 yaşından küçük çocuklarda ve ergenlerde çalışılmamıştır.
Yaş, cinsiyet, ırk özellikleri:
Bu demografik faktörlerin etkilerini değerlendirmek için resmi bir çalışma yapılmamıştır. Ph+ lösemi veya malign solid tümörü bulunan hastalarda ve sağlıklı gönüllülerde popülasyon farmakokinetik analizleri yaşın, cinsiyetin veya vücut ağırlığının klinik olarak anlamlı etkileri bulunmadığını göstermektedir. Popülasyon farmakokinetik analizleri, Asyalıların bosutinib maruziyetinde (EAA) yaklaşık %25'lik bir artışa karşılık gelen, %18 daha düşük bir klirense sahip olduğunu ortaya koymuştur.
5.3. Klinik öncesi güvenlilik verileri
Bosutinib, güvenlilik farmakolojisi, yinelenen doz toksisitesi, genotoksisite, üremeye ilişkin toksisite ve fototoksisite çalışmalarında değerlendirilmiştir.
Güvenlilik farmakolojisi
Bosutinib, solunum fonksiyonları üzerinde herhangi bir etki yaratmamıştır. Merkezi sinir sistemi (MSS) üzerinde yapılan bir çalışmada, bosutinib ile tedavi edilen sıçanların göz bebeği boyutunda küçülme ve yürümede bozulma gözlemlenmiştir. Göz bebeği boyutu için gözlemsiz etki düzeyi (GED) belirlenmemiştir ancak yürüme bozukluğu için GED, 400 mg'lık klinik dozla elde edilen insan maruziyetinin yaklaşık 11 katı ve 500 mg'lık klinik dozla elde edilen insan maruziyetinin yaklaşık >8 katı maruziyetlerde oluşmuştur (ilgili türlerde bağlanmamış C'a göre). hERG miktar tayinlerinde in vitro bosutinib aktivitesi, kardiyak ventriküler repolarizasyon (QTc) süre uzatması için bir potansiyel bulunduğunu göstermektedir. Bosutinibin ağız yoluyla uygulandığı, köpekler üzerinde yapılan bir çalışmada, bosutinib, 400 mg dozluk klinik maruziyetin 3 katına ve 500 mg dozluk klinik maruziyetin 2 katına (ilgili türlerde bağlı olmayan C'a dayalı olarak) kadar maruziyetlerde kan basıncında değişikliklere, anormal atriyal veya ventriküler aritmilere veya PR, QRS ya da EKG'nin QTc süre uzamasına neden olmamıştır. Gecikmeli bir nabız artışı gözlemlenmiştir. Köpekler üzerinde yapılan bir intravenöz çalışmada, 400 mg klinik doz ile elde edilenin yaklaşık 6 ile 20 katı arası ve 500 mg doz ile elde edilenin yaklaşık 4 ile 15 katı arası değişen maruziyetlerde nabızda geçici artışlar ve kan basıncında düşüşler ile QTc için minimum süre uzaması (<10 msn) gözlemlenmiştir (ilgili türlerde bağlanmamış C'a göre). Gözlemlenen etkiler ve tıbbi ürün tedavisi arasındaki ilişki sonuçsuz kalmıştır.
Tekrarlanan doz toksisitesi
Sıçanlarda 6 aya kadar, köpeklerde 9 aya kadar süre için yapılan tekrarlanan doz toksisitesi çalışmaları, bosutinib toksisitesinde birincil hedef organın gastrointestinal sistem olduğunu açığa çıkarmıştır. Klinik toksisite emareleri, dışkı değişikliklerini içermiştir ve gıda tüketiminde azalma ve kilo kaybı ile ilişkilendirilmiştir; bunlar zaman zaman ölüme veya seçici ötenaziye yol açmıştır.
Histopatolojik olarak, lümen genişlemesi, goblet hücresi hiperplazisi, kanama, erozyon ve bağırsak yolunda ödem ile mesenterik lenf nodlarında eritrositoz ve kanama gözlemlenmiştir. Sıçanlarda, karaciğer de bir hedef organ olarak tanımlanmıştır. Toksisiteler, karaciğer enzimlerinde artış veya hepatoselüler sitotoksite belirtilerinin eksikliğinde oluşan hepatoselüler hipertropi ile ilgili olarak karaciğer ağırlıklarında artış ile karakterize edilmektedir ve bunların insanlarla ilişkisi bilinmemektedir. Türler arası maruziyet karşılaştırması, sıçanlar ve köpekler üzerinde yapılan sırasıyla 6 ve 9 aylık çalışmalarda advers olaylar ortaya çıkarmayan maruziyetlerin 400 mg'lik ve 500 mg'lik klinik dozlarla elde edilen insan maruziyetine benzer olduğunu göstermektedir (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak).
Genotoksisite
Bakteriyel in vitro sistemlerde ve memeli in vitro ve in vivo sistemlerde metabolik aktivasyon ile ya da metabolik aktivasyon olmadan yapılan genotoksisite çalışmaları, bosutinibin mutajenik potansiyeline dair bir kanıt göstermemiştir.
Üreme ve gelişim toksisitesi
Sıçanlar üzerinde yapılan bir üreme çalışmasında, erkeklerde fertilitede hafif bir düşüş gözlemlenmiştir. Dişilerde embriyonik resorpsiyonlarda artış ve implantasyonlar ile canlı embriyolarda düşüş gözlemlenmiştir. Erkeklerde (günde 30 mg/kg) ve kadınlarda (günde 3 mg/kg) advers üreme etkilerinin gözlemlenmediği doz, 400 mg'lik klinik dozdan doğan insan maruziyetinin sırasıyla 0,6 ve 0,3 katı ve 500 mg'lik klinik dozdan doğan insan maruziyetinin sırasıyla 0,5 ve 0,2 katı kadar maruziyetlere yol açmıştır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). Erkek fertilitesi üzerine etkisi göz ardı edilemez (bkz. bölüm 4.6).
Gebe Sprague-Dawley sıçanlarında yapılan bir plasenta transferi çalışmasında, fetüslerin gebelik sırasında bosutinib türevli radyoaktiviteye maruziyeti gösterilmiştir. Sıçanlar üzerinde yapılan bir doğum öncesi ve doğum sonrası gelişim çalışmasında, ≥ 30 mg/kg/gün dozunda doğan yavru sayıları azalmış, toplam tek seferde doğan yavru kaybı insidansı artmış ve 70 mg/kg/gün dozunda doğumdan sonra yavruların büyümesinde azalma gerçekleşmiştir. Yan etki gelişmesi gözlemlenmeyen doz (10 mg/kg/gün), 400 mg ve 500 mg klinik dozlarda insanlarda görülenin sırasıyla 1,3 katına ve 1 katına eşit maruz kalmayla sonuçlanmıştır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). Tavşanlar üzerinde yapılan bir toksisite çalışmasında anneler için toksik dozda fetüs anomalileri gözlemlenmiş (birleşik sternebra ve iki fetüste farklı viseral gözlemler bulunması) ve fetüs vücut ağırlığında hafif bir düşüş olmuştur. Tavşanlarda test edilen en yüksek dozda (10 mg/kg/gün) fetüs üzerinde advers etkilere neden olmayan maruziyet, 400 mg ve 500 mg dozlarda insanlarda görülenin sırasıyla 0,9 ve 0,7 katıdır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak).
Emziren Sprague-Dawley sıçanlarında ağız yoluyla tek doz halinde (10 mg/kg) [C] radyoaktif işaretli bosutinib uygulamasının ardından, radyoaktivite, dozlamadan 0,5 sa sonra kadar kısa bir süre içinde anne sütüne geçmiştir. Sütte radyoaktivite konsantrasyonu, plazmada olduğundan 8 kat yüksektir. Bu da ölçülebilir radyoaktivite konsantrasyonlarının anne sütü alan yavruların plazmasında görülmesine neden olmuştur.
Karsinojenisite
Bosutinib, 2 yıllık sıçan ve 6 aylık rasH2 fare karsinojenisite çalışmalarında karsinojenik bulunmamıştır.
Fototoksisite
Bosutinib, UV-B ve UV-A aralığında ışık absorbe etme yetisi göstermiş ve pigmentli sıçanların cildine ve gözün damarlı orta tabakasına dağıtılmıştır. Ancak bosutinib ile, 400 ve 500 mg klinik dozlarla insanlarda oluşan maruziyetin sırasıyla 2 ve 3 katına kadar olan maruziyetlerde UV radyasyon bulunurken bosutinibe maruz kalmış pigmentli sıçanlarda ciltte veya gözlerde fototoksisite potansiyeli göstermemiştir (ilgili türlerde bağlanmamış C'a göre).
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Geri Ödeme Kodu | A17459 |
| Satış Fiyatı | 10829.6 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 14442.28 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308097446 |
| Etkin Madde | Bosutinib Monohidrat |
| ATC Kodu | L01EA04 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |