BRILINTA 60 mg 56 film kaplı tablet Kısa Ürün Bilgisi
{ Tikagrelor }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
BRILINTATM 60 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Tikagrelor 60 mg
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Yuvarlak, bikonveks, bir yüzü âTâ ve üzerinde â60â ile işaretli, diğer yüzü düz, pembe renkli tabletler.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Asetil salisilik asit (ASA) ile birlikte uygulanan BRILINTA,
Yetişkinlerde; miyokard infarktüsü (MI) hikayesi olan (1-3 yıl içinde) ve aterotrombotik olay açısından yüksek risk taşıyan hastalarda aterotrombotik olayların önlenmesinde endikedir.
4.2. Pozoloji ve uygulama şekli
BRILINTA kullanan hastalar ayrıca, spesifik olarak kontrendike olmadıkça günde bir kez ASA'nın 75-150 mg'lık düşük idame dozunu da kullanmalıdır.
Miyokard infarktüsü (MI)
Eğer tedavinin değiştirilmesi gerekli olursa ilk BRILINTA dozu, diğer antitrombositik ilacın son dozundan 24 saat sonra uygulanmalıdır.
Koroner arter hastalığı (KAH) ile birlikte tip 2 DM'si olan ve perkütan koroner girişim (PKG) öyküsü bulunan hastalar
Daha önce MI olmadan PKG öyküsü ile birlikte KAH ve tip 2 DM'si olan hastalar için önerilen doz günde iki kez BRILINTA 60 mg'dır. BRILINTA için yükleme dozu gerekli değildir.
Hastalar, önceki antitrombosit tedavilerine bakılmaksızın tedaviye günde iki kez BRILINTA 60 mg ile başlayabilir.
KAH ile birlikte tip 2 DM'si olan hastalarda BRILINTA ile, hasta yüksek aterotrombotik olay riski ve düşük kanama riski altında olduğu sürece tedaviye üç yıla kadar devam edilmelidir. Etkililik ve güvenlilik verileri, üç yıllık tedaviden sonra halen BRILINTA'nın faydalarının risklere ağır basıp basmadığını belirlemek için yetersizdir (Bkz. Bölüm 4.4).
KAH ile birlikte Tip 2 DM'si olan ve PKG öyküsü bulunan hastaları BRILINTA tedavisine geçirmek isteyen hekimler, ilk BRILINTA dozunu diğer P2Yreseptör antagonistin son dozundan 24 saat sonra uygulamalıdır.
Unutulan doz
Tedavide kesintilerden de kaçınılmalıdır. BRILINTA'nın bir dozunu almayı unutan hastalar, planlanmış olan zamanda yalnızca bir adet tablet olan bir sonraki dozu almalıdır.
Uygulama şekli:
Oral kullanım içindir.
BRILINTA yemeklerle birlikte veya aç karnına alınabilir.
Tablet(ler)i bir bütün olarak yutamayan hastalar için, tabletler ince toz haline gelecek şekilde ezilip yarım bardak suda karıştırılarak hemen içilebilir. Takibinde boş bardak yarım bardak su ile çalkalanıp kalan içerikler de içilmelidir. Karışım ayrıca nazogastrik tüp (CH8 veya daha büyüğü) ile uygulanabilir. Karışımın uygulanmasından sonra nazogastrik tüpü su ile durulamak önemlidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2).
Karaciğer yetmezliği
Ağır derecede karaciğer yetmezliği olan hastalarda tikagrelor çalışılmamıştır ve tikagrelorun bu hastalarda kullanılması kontrendikedir (Bkz. Bölüm 4.3). Orta derecede karaciğer yetmezliği olan hastaların tedavisinde sınırlı bilgi mevcuttur. Doz ayarlamasına gerek yoktur, ancak tikagrelor dikkatli kullanılmalıdır (Bkz. Bölüm 4.4 ve 5.2) Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir (Bkz. Bölüm 4.4 ve Bölüm 5.2).
Pediyatrik popülasyon
Tikagrelorun 18 yaşın altındaki çocuklarda güvenliliği ve etkililiği belirlenmemiştir.
Orak hücre hastalığı olan çocuklarda tikagrelorun ilgili kullanımı yoktur (Bkz. Bölüm 5.1 ve 5.2).
Geriyatrik popülasyon
Yaşlı hastalarda doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Tikagrelore veya Bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine karşı aşırı duyarlılık (Bkz. Bölüm 4.8),
Aktif patolojik kanama,
İntrakraniyal hemoraji öyküsü (Bkz. Bölüm 4.8),
Ağır derecede karaciğer yetmezliği (Bkz. Bölüm 4.2, 4.4 ve 5.2).
Eş zamanlı uygulama tikagrelore maruziyette belirgin bir artışa neden olabileceği için, güçlü CYP3A4 inhibitörleri (örn.; ketokonazol, klaritromisin, nefazodon, ritonavir ve atazanavir) ile tikagrelorun birlikte kullanılması (Bkz. Bölüm 4.5).
4.4. Özel kullanım uyarıları ve önlemleri
KAH, tip 2 DM hastalarında fayda-risk
THEMIS çalışmasında, genel THEMIS çalışma popülasyonunun %58'ini temsil eden, PKG öyküsü olan önceden belirlenmiş hasta alt grubunda pozitif bir fayda-risk profili gözlemlenmiştir. Tüm THEMIS popülasyonunda fayda-risk profili BRILINTA kullanımını desteklemek açısından olumlu değerlendirilmemiştir. KAH, tip 2 DM ve PKG öyküsü olan hastalarda tedaviye başlamadan önce, hastanın aterotrombotik olaylar açısından yüksek ve kanama açısından düşük risk taşıdığı doğrulanmalıdır.
Kanama riski
Bilinen kanama riski artmış olan hastalarda tikagrelor kullanımı, aterotrombotik olayların önlenmesinden elde edilecek yarara karşı dengelenmelidir (Bkz. Bölüm 4.8 ve 5.1). Eğer klinik olarak endike ise, tikagrelor aşağıdaki hasta gruplarında dikkatli kullanılmalıdır:
Kanama eğilimi olan hastalar (örn.; yeni travma, yeni ameliyat, koagülasyon bozuklukları, aktif veya yeni gastrointestinal kanama) veya travma riski yüksek olan hastalar. Aktif patolojik kanaması olan hastalarda ve intrakraniyal hemoraji öyküsü ve ağır derecede karaciğer yetmezliği olanlarda tikagrelor kullanımı kontrendikedir (Bkz. Bölüm 4.3).
Kanama riskini artırabilen tıbbi ürünleri (örn.; nonsteroidal antiinflamatuvar ilaçlar (NSAİİ'ler), oral antikoagülanlar ve/veya fibrinolitikler) tikagrelor dozundan sonra 24 saat içinde eş zamanlı kullanan hastalar.
Trombosit transfüzyonu sağlıklı gönüllülerde tikagrelorun antitrombotik etkisini tersine çevirmez ve kanaması bulunan hastalarda klinik yarar sağlaması mümkün değildir. Tikagrelorun desmopressin ile eş zamanlı olarak uygulanması temel kanama zamanını azaltmadığı için, desmopressinin klinik kanama olaylarının tedavisinde etkili olması mümkün değildir (Bkz. Bölüm 4.5)
Antifibrinolitik tedavi (aminokaproik asit veya traneksamik asit) ve/veya rekombinant faktör VIIa tedavisi hemostazı artırabilir. Kanamanın sebebi tanımlanıp kontrol altına alındıktan sonra tikagrelor tedavisi yeniden başlatılabilir.
Cerrahi
Hastalara, herhangi bir cerrahi işlem planlanmadan önce ve herhangi bir yeni tıbbi ürün kullanmadan önce, tikagrelor aldıkları konusunda hekimlerini ve diş hekimlerini bilgilendirmeleri konusunda tavsiye verilmelidir.
Koroner arter bypass greft (CABG) operasyonu geçiren PLATO hastalarında, ameliyattan önceki birinci gün içinde ilaç kullanımı durdurulduğunda tikagrelor ile, klopidogrelden daha fazla kanama meydana gelmiş; ancak ameliyattan 2 veya daha fazla gün önce tedavi durdurulduktan sonra majör kanama olaylarının oranı klopidogrel ile karşılaştırıldığında benzer olmuştur (Bkz. Bölüm 4.8). Eğer hastaya elektif cerrahi uygulanacaksa ve antitrombositik etki istenmiyorsa, tikagrelor ameliyattan 5 gün önce kesilmelidir (Bkz. Bölüm 5.1).
Daha önce iskemik inme geçirmiş hastalar
Daha önce iskemik inme geçirmiş AKS hastaları, 12 aya kadar tikagrelor ile tedavi edilebilir (PLATO çalışması).
PEGASUS (≥1 yıl MI öyküsü) ve THEMIS (KAH ve tip 2 DM) çalışmalarına daha önce iskemik inme geçirmiş hastalar dahil edilmemiştir çünkü önceki çalışmalar antiplatelet ajanın (tikagrelor değil) kombinasyonunun intrakranyal hemoraji ile ilişkili olduğunu göstermektedir. Dolayısıyla, veri yokluğu nedeniyle daha önce iskemik inme geçirmiş AKS hastalarında bir yılı aşan BRILINTA tedavisi önerilmemektedir. KAH, tip 2 DM ve önceki iskemik inme hastalarında da BRILINTA tedavisi önerilmemektedir.
Karaciğer yetmezliği
Tikagrelor kullanımı ağır derecede karaciğer yetmezliği olan hastalarda kontrendikedir (Bkz. Bölüm 4.2 ve 4.3). Orta derecede karaciğer yetmezliği olan hastalarda tikagrelor ile deneyim sınırlı olduğundan bu hastalarda dikkatli olunması tavsiye edilmektedir. (Bkz. Bölüm 4.2 ve 5.2).
Bradikardik olaylar için risk altında olan hastalar
Holter EKG takibi klopidogrele kıyasla tikagrelor ile uygulanan tedavi sırasında genellikle asemptomatik olan ventriküler duraklamaların sıklığında artış olduğunu göstermiştir. Bradikardik olay riski artan hastalar (örn.; hasta sinüs sendromu, 2. veya 3. derece AV blok veya bradikardiye bağlı senkop gözlenen pacemaker olmayan hastalar) tikagrelorun etkililiğinin ve güvenliliğinin değerlendirildiği ana çalışmalardan hariç tutulmuştur. Bu sebeple sınırlı klinik deneyim nedeniyle, tikagrelor bu hastalarda dikkatli kulanılmalıdır (Bkz. Bölüm 5.1).
Ek olarak, tikagrelor, bradikardiyi uyardığı bilinen tıbbi ürünlerle eş zamanlı olarak uygulandığında dikkatli olunmalıdır. Bununla birlikte, PLATO çalışmasında bradikardiyi uyardığı bilinen bir ya da daha fazla tıbbi ürünün (örn.; %96 beta blokörler, %33 kalsiyum kanal blokörleri diltiazem ve verapamil ve %4 digoksin) eş zamanlı uygulanmasının ardından klinik açıdan anlamlı advers reaksiyon kanıtı gözlenmemiştir (Bkz. Bölüm 4.5). THEMIS'te hastaların %73,8'i çalışmaya girişte beta blokör almıştır.
PLATO'da Holter alt çalışması sırasında, AKS'nin akut fazı süresince klopidogrele kıyasla tikagrelor ile daha fazla hastada ≥3 saniyelik ventriküler duraklamalar ortaya çıkmıştır. Tikagrelor ile Holter tespitli ventriküler duraklamalardaki artış, genel çalışma popülasyonu ile karşılaştırıldığında AKS'nin akut fazı sırasında kronik kalp yetmezliği (KKY) olan hastalarda daha yüksek bulunmuştur; fakat bu etki, tikagrelor ile birinci ayda ya da klopidogrel ile karşılaştırıldığında gözlenmemiştir.Buhastapopülasyonundaki bu dengesizlik ile ilişkili
Bölüm 5.1).
Özellikle kardiyak iskemi ve kalp hızını azaltan veya kardiyak iletimi etkileyen ilaçların potansiyel karıştırıcı olduğu, tikagrelor alan AKS'li hastalarda, pazarlama sonrasında bradiaritmik olaylar ve AV blokları bildirilmiştir (Bkz. Bölüm 4.8). Hastanın klinik durumu ve birlikte kullandığı ilaçlar potansiyel karıştırıcı nedenler olarak tedaviyi ayarlamadan önce değerlendirilmelidir.
Dispne
Dispne, tikagrelor ile tedavi edilen hastalarda bildirilmiştir. Şiddeti genellikle hafif ila orta arasında değişmiş ve sıklıkla tedavinin kesilmesini gerektirmeden düzelmiştir. Astım/KOAH (Kronik Obstrüktif Akciğer Hastalığı) hastalarında tikagrelor ile dispne olayının meydana gelmesindeki mutlak risk artmış olabilir. Tikagrelor, astım ve/veya KOAH öyküsü olan hastalarda dikkatle kullanılmalıdır. Mekanizma henüz aydınlatılmamıştır. Bir hastanın yeni, uzun süreli veya ağırlaşan dispne olayını bildirmesi durumunda, bu olay detaylıca araştırılmalı ve tolere edilemezse tikagrelor tedavisi durdurulmalıdır. Daha fazla bilgi için Bölüm 4.8'e bakınız.
Santral uyku apnesi
Tikagrelor alan hastalarda pazarlama sonrası Cheyne-Stokes solunumu dahil santral uyku apnesi bildirilmiştir. Santral uyku apnesinden şüpheleniliyorsa, daha ileri klinik değerlendirme düşünülmelidir.
Kreatinin yükselmeleri
Tikagrelor ile tedavi sırasında kreatinin düzeyleri yükselebilir. Mekanizma henüz aydınlatılmamıştır. Rutin tıbbi uygulamalara göre böbrek fonksiyonları kontrol edilmelidir. Ayrıca AKS hastalarında böbrek fonksiyonlarının, tikagrelor ile tedaviye başlandıktan bir ay sonra, ≥75 yaş hastalara, orta/şiddetli böbrek yetmezliği olan hastalara ve bir anjiyotensin reseptör blokörü (ARB) ile eş zamanlı tedavi alan hastalara özel dikkat gösterilerek kontrol edilmesi önerilir.
Ürik asit artışı
Tikagrelor ile tedavi sırasında hiperürisemi oluşabilir (Bkz. Bölüm 4.8). Hiperürisemi ya da gut artriti öyküsü olan hastalarda dikkat edilmesi önerilir. İhtiyati tedbir olarak ürik asit nefropatisi olan hastalarda tikagrelor kullanımı tavsiye edilmez.
Trombotik Trombositopenik Purpura (TTP)
Tikagrelor kullanımıyla ilgili olarak çok nadiren TTP bildirilmiştir. Nörolojik bulgular, böbrek disfonksiyonu ya da ateş ile ilişkili olabilen trombositopeni ve mikroanjiyopatik hemolitik anemi ile karakterizedir. TTP, plazmaferez de dahil acil tedavi gerektiren potansiyel olarak ölümcül bir durumdur.
Heparin ile indüklenen trombositopeni (HIT) tanısı koymak için kullanılan trombosit fonksiyon testleri ile enterferans
HIT tanısı koymak için kullanılan heparin ile indüklenen trombosit aktivasyonu (HIPA) testinde, hastanın serumunda bulunan anti-trombosit faktör 4/heparin antikorları, heparin varlığında sağlıklı donörlerin trombositlerini aktive eder.
Tikagrelor uygulanan hastalarda, HIT için kullanılan trombosit fonksiyon testlerinde (HIPA testi dahildir, ancak bununla sınırlı olmayabilir) yanlış negatif sonuçlar bildirilmiştir. Bu durum, testin içerdiği sağlıklı donörlere ait trombositler üzerindeki P2Yreseptörünün hastanın serumundaki/plazmasındaki tikagrelor tarafından inhibe edilmesi ile ilgilidir. HIT trombosit fonksiyon testlerinin yorumlanması için, tikagrelor ile eş zamanlı tedavi hakkında bilgi sağlanması gereklidir.
HIT gelişen hastalarda, tikagrelor ile tedaviye devam edilmesinin yarar-risk değerlendirmesi, hem HIT'nin protrombotik durumu, hem de eş zamanlı antikoagülan ve tikagrelor tedavisinde artan kanama riski dikkate alınarak yapılmalıdır.
Diğer
İdame ASA dozu ve klopidogrele kıyasla tikagrelorun bağıl etkililiğinin araştırıldığı PLATO çalışmasında gözlenmiş olan bir ilişki temel alınarak, tikagrelor ve 300 mg üzerindeki ASA'nın yüksek idame dozunun eş zamanlı uygulanması önerilmemektedir (Bkz. Bölüm 5.1).
Tedavinin erken kesilmesi
BRILINTA dahil herhangi bir antitrombotik tedavinin erken kesilmesi, hastanın altta yatan hastalığına bağlı olarak kardiyovasküler (KV) ölüm, MI veya inme riskinde artışa neden olabilir. Bu nedenle tedavinin erken kesilmesinden kaçınılmalıdır.
Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Tikagrelor esasen bir CYP3A4 substratıdır ve zayıf bir CYP3A4 inhibitörüdür. Tikagrelor aynı zamanda bir P-glikoprotein (P-gp) substratı ve zayıf bir P-gp inhibitörüdür ve P-gp substratlarına maruziyeti artırabilir.
Tıbbi ve diğer ürünlerin tikagrelor üzerindeki etkisi
CYP3A4 inhibitörleri
Güçlü CYP3A4 inhibitörleri - Ketokonazolün tikagrelor ile birlikte uygulanması tikagrelorun Cve EAA değerlerini sırasıyla 2,4 kat ve 7,3 kat artırmış; aktif metabolitin Cve EAA değerlerini sırasıyla %89 ve %56 azaltmıştır. Diğer güçlü CYP3A4 inhibitörlerinin (klaritromisin, nefazadon, ritonavir ve atazanavir) benzer etki göstermesi beklenmektedir ve bu nedenle güçlü CYP3A4 inhibitörlerinin tikagrelor ile aynı anda kullanılmaları kontrendikedir (Bkz. Bölüm 4.3).
Orta dereceli CYP3A4 inhibitörleri - Diltiazemin tikagrelor ile birlikte uygulanması tikagrelorun Cdeğerini %69, EAA değerini 2,7 kat artırmıştır ve aktif metabolitin Cdeğerini %38 azaltmış, EAA değerini değiştirmemiştir. Tikagrelorun diltiazemin plazma düzeyleri üzerinde etkisi bulunmamaktadır. Diğer orta dereceli CYP3A4 inhibitörlerinin (örn.; amprenavir, aprepitant, eritromisin ve flukonazol) benzer bir etkiye sahip olacağı beklenmektedir ve tikagrelor ile aynı anda uygulanabilirler.
Her gün yüksek miktarlarda (3x200 ml) greyfurt suyu tüketimlerinin ardından tikagrelor maruziyetinde 2 kat artış gözlenmiştir. Bu boyutta bir maruziyet artışının çoğu hastada klinik anlama sahip olması beklenmemektedir.
CYP3A indükleyicileri
Rifampisinin tikagrelor ile birlikte uygulanması, tikagrelorun Cve EAA değerlerini sırasıyla %73 ve %86 azaltmıştır. Aktif metabolitin Cdeğeri değişmemiş ve EAA değeri
%46 azalmıştır. Diğer CYP3A indükleyicilerinin (örn.; fenitoin, karbamazepin ve fenobarbital) tikagrelore maruziyeti azaltması beklenmektedir. Tikagrelorun güçlü CYP3A indükleyicileri ile birlikte uygulanması, tikagrelor maruziyetini ve etkililiğini azaltabilir; bu nedenle tikagrelor ile eş zamanlı olarak uygulanmaları tercih edilmez.
Siklosporin (P-gp ve CYP3A inhibitörü)
Tikagrelor ile siklosporinin (600 mg) birlikte uygulanması, tikagrelorun Cve EAA değerlerini sırasıyla 2,3 kat ve 2,8 kat artırmıştır. Siklosporin varlığında aktif metabolitin EAA değeri %32 artarken, Cdeğeri %15 azalmıştır.
Tikagrelorun, potent P-gp inhibitörleri ve orta dereceli CYP3A4 inhibitörleri (örn.; verapamil, kinidin) olan ve tikagrelor maruziyetini de artırabilecek diğer etkin maddelerle eş zamanlı kullanımına ilişkin veri mevcut değildir. Eğer bu tür bir birliktelikten kaçınılamıyorsa, eş zamanlı uygulama dikkatle yapılmalıdır.
Diğerleri
Klinik farmakoloji etkileşim çalışmaları, tikagrelorun heparin, enoksaparin ve ASA veya desmopressin ile birlikte uygulanmasının, tek başına tikagrelor uygulanmasına kıyasla tikagrelor ya da aktif metabolitinin farmakokinetiği üzerinde veya ADP'nin indüklediği trombosit agregasyonu üzerinde herhangi bir etkisinin olmadığını göstermiştir. Klinik olarak endike olduğu takdirde, hemostazı değiştiren tıbbi ürünler tikagrelor ile kombinasyon halinde uygulanırken dikkatle kullanılmalıdır.
Morfinle tedavi uygulanan AKS'li hastalarda tikagrelor ve aktif metabolitinin de aralarında olduğu oral P2Yinhibitörlerine gecikmiş ve azalmış maruziyet gözlenmiştir (tikagrelor maruziyetinde %35 azalma). Bu etkileşim azalmış gastrointestinal motiliteyle ilişkili olabilir ve diğer opioidler için de geçerli olabilir. Bu durumun klinik önemi bilinmemektedir fakat veriler tikagrelor ve morfinin eş zamanlı uygulandığı hastalarda tikagrelorun etkililiğinde azalma olması potansiyeline işaret etmiştir. Morfinin durdurulamayacağı ve hızlı P2Yinhibisyonunun gerekli görüldüğü AKS'li hastalarda parenteral bir P2Yinhibitörünün kullanılması düşünülebilir.
Tikagrelorun diğer tıbbi ürünler üzerinde etkisi
CYP3A4 ile metabolize olan tıbbi ürünler
Simvastatin â Tikagrelor ile simvastatinin birlikte uygulanması, simvastatinin Cdeğerini %81, EAA değerini %56 artırmıştır ve bazı bireysel 2 ila 3 kat artışlarla birlikte simvastatin asidin Cdeğerini %64 ve EAA değerini %52 artırmıştır. Tikagrelorun günlük 40 mg'ı aşan simvastatin dozları ile birlikte uygulanması, simvastatinin advers etkilerinin ortaya çıkmasına yol açabilir ve böyle uygulamalara potansiyel yararlarla karşılaştırma yapılarak karar verilmelidir. Simvastatinin tikagrelor plazma düzeyleri üzerinde etkisi bulunmamaktadır. Tikagrelor, lovastatin üzerinde de benzer etki gösterebilir. Tikagrelorun 40 mg'ın üzerindeki simvastatin veya lovastatin dozları ile eş zamanlı kullanılması önerilmez.
Atorvastatin - Atorvastatin ve tikagrelorun birlikte uygulanması, atorvastatin asidin Cdeğerini %23 ve EAA değerini %36 artırmıştır. Tüm atorvastatin asit metabolitleri için EAA ve C'ta benzer artışlar gözlenmiştir. Bu artışların klinik açıdan anlamlı olmadığı düşünülmektedir.
CYP3A4 tarafından metabolize olan diğer statinler üzerinde benzer bir etki oluşumu ihmal edilemez. PLATO çalışmasında yer alan ve tikagrelor kullanan hastalar çeşitli statinler kullanmış olup, bu tıbbi ürünleri alan PLATO kohort grubunun %93'ünde statin güvenliliği ile ilişkili endişe söz konusu olmamıştır.
Tikagrelor zayıf bir CYP3A4 inhibitörüdür. Tikagrelor ile dar terapötik indekse sahip CYP3A4 substratlarının (ör; sisapridveyaergotalkaloidleri)birlikteuygulanması önerilmez; çünkü
P-glikoprotein (P-gp) substratları (digoksin, siklosporin dahil)
Eş zamanlı tikagrelor uygulaması digoksinin Cdeğerini %75 ve EAA değerini %28 artırmıştır. Tikagrelor ile eş zamanlı uygulanmasıyla ortalama taban digoksin düzeyleri yaklaşık olarak %30 artmış, bazı kişilerdeki artış maksimum 2 kata kadar ulaşmıştır. Digoksin varlığında tikagrelorun ve aktif metabolitinin Cve EAA değerleri etkilenmemiştir. Bu nedenle, digoksin gibi dar terapötik indekse sahip olan ve P-gp bağımlı tıbbi ürünlerin tikagrelor ile eş zamanlı uygulanmasında uygun klinik ve/veya laboratuvar takibinin yapılması önerilmektedir.
Tikagrelorun siklosporin kan düzeyleri üzerinde etkisi olmamıştır. Tikagrelorun diğer P-gp substratları üzerindeki etkisi çalışılmamıştır.
CYP2C9 ile metabolize olan tıbbi ürünler
Tikagrelorun tolbutamid ile birlikte uygulanması, her iki tıbbi ürünün de plazma düzeylerini değiştirmemiş, bu da tikagrelorun CYP2C9 inhibitörü olmadığı ve varfarin ve tolbutamid gibi CYP2C9 bağımlı metabolize olan tıbbi ürünlerin metabolizmasını değiştirmeyeceği izlenimini vermiştir.
Rosuvastatin
Tikagrelor, rosuvastatinin renal atılımını etkileyerek rosuvastatin birikimi riskini artırabilir. Kesin mekanizması bilinmese de, bazı durumlarda tikagrelor ve rosuvastatinin eş zamanlı kullanımı renal fonksiyonun azalmasına, CPK düzeyi ve rabdomiyolizin artmasına yol açmaktadır.
Oral kontraseptifler
Tikagrelorun levonorgestrel ve etinil estradiol ile birlikte uygulanması etinil estradiol maruziyetini yaklaşık %20 arttırmış; fakat levonorgestrelin farmakokinetiğini değiştirmemiştir. Levonorgestrel ve etinil estradiol tikagrelor ile birlikte uygulandığında oral kontraseptifin etkililiği üzerinde klinik olarak ilişkili bir etki beklenmemektedir.
Bradikardiyi indüklediği bilinen tıbbi ürünler
Çoğunlukla asemptomatik olan ventriküler duraklamalar ve bradikardi gözlemleri nedeniyle, tikagrelorun bradikardiyi uyardığı bilinen tıbbi ürünler ile eş zamanlı uygulanması sırasında dikkatli olunmalıdır (Bkz. Bölüm 4.4). Bununla birlikte, PLATO çalışmasında bradikardiyi uyardığı bilinen bir ya da daha fazla tıbbi ürünün (örn.; %96 beta blokörler, %33 kalsiyum kanal blokörleri diltiazem ve verapamil ve %4 digoksin) eş zamanlı uygulanmasının ardından klinik açıdan anlamlı advers reaksiyon kanıtı gözlenmemiştir.
Diğer eşlik eden tedavi
Klinik çalışmalarda tikagrelor yaygın olarak, uzun vadede eş zamanlı hastalıklar için gerekli oldukça ASA, proton pompası inhibitörleri, statinler, beta-blokörler, anjiyotensin dönüştürücü enzim (ADE) inhibitörleri ve ARB'ler ile birlikte ve kısa süreler için heparin, düşük molekül ağırlıklı heparin ve intravenöz GpIIb/IIIa inhibitörleri ile birlikte uygulanmıştır (Bkz. Bölüm 5.1). Bu tıbbi ürünlerle klinik olarak anlamlı advers etkileşimler gözlendiğine dair bulgu yoktur.
Tikagrelorun heparin, enoksaparin veya desmopressin ile eş zamanlı uygulanmasının aktive parsiyel tromboplastin zamanı (aPTT), aktive pıhtılaşma zamanı (aPT) veya faktör Xa testleri üzerinde etkisi olmamıştır. Bununla birlikte, potansiyel farmakodinamik etkileşimler nedeniyle tikagrelorun, hemostazı değiştirdiği bilinen tıbbi ürünler ile bir arada uygulanması sırasında dikkatli olunmalıdır.
Selektif serotonin gerialım inhibitörleri (SSRI) (örn.; paroksetin, sertralin ve sitalopram) ile kutanöz kanama anomalilerini içeren vakalar bildirilmiştir. Tikagrelor ile SSRI'lar uygulanırken kanama riski artabileceği için dikkatli olunması önerilmektedir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar, tikagrelor ile tedavi süresince gebe kalmamak için uygun doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi
Tikagrelorun gebe kadınlarda kullanımına ilişkin veri yoktur veya sınırlıdır. Hayvanlarda yapılan çalışmalar üreme toksisitesini göstermiştir (Bkz. Bölüm 5.3). Tikagrelor hamilelik sırasında önerilmemektedir.
Laktasyon dönemi
Hayvanlardan elde edilen mevcut farmakodinamik/toksikolojik veriler, tikagrelorun ve aktif metabolitlerinin süte geçtiğini göstermektedir (Bkz. Bölüm 5.3). Yenidoğanlar/bebekler için risk göz ardı edilemez. Çocuk için emzirmenin yararları ve kadın için tedavinin yararları dikkate alınarak, emzirmenin kesilmesine ya da tikagrelor tedavisinin kesilmesine/bu tedaviden kaçınılmasına karar verilmelidir.
Üreme yeteneği/Fertilite
Tikagrelorun deney hayvanlarında erkek veya dişi fertilitesi üzerinde etkisi bulunmamaktadır (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Tikagrelorun araç ve makine kullanma yetisi üzerinde etkisi yoktur ya da göz ardı edilebilir etkilere sahiptir. Tikagrelor ile tedavi süresince sersemlik ve konfüzyon bildirilmiştir. Bu nedenle, bu semptomların görüldüğü hastalar araç veya makine kullanırken dikkatli olmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Tikagrelorun güvenlilik profili 32.000'den fazla hastanın tikagrelora maruz kaldığı 58.000'in üzerinde hastayı içeren üç büyük faz 3 sonuç çalışmasında (PLATO, PEGASUS ve THEMIS) değerlendirilmiştir (Bkz. Bölüm 5.1).
PLATO çalışmasında tikagrelor tedavisi alan hastalarda advers olaylar sebebiyle tedaviyi bırakma insidansı, klopidogrel kullanan hastalara göre daha yüksek olmuştur (%7,4'e karşın
%5,4). PEGASUS çalışmasında tikagrelor tedavisi alan hastalarda advers olaylar sebebiyle tedaviyi bırakma insidansı, tek başına ASA tedavisi ile karşılaştırıldığında daha yüksektir (tikagrelor 60 mg + ASA için %16,1'e karşın tek başına ASA tedavisi için %8,5). Tikagrelor ile tedavi edilen hastalarda en yaygın bildirilen advers reaksiyonlar kanama ve dispnedir (Bkz. Bölüm 4.4).
Advers reaksiyonların tablolanmış özeti
Aşağıdaki advers reaksiyonlar, tikagrelor ile yapılan çalışmaları takiben ya da pazarlama sonrası deneyimde bildirilmiş olanlara göre tanımlanmıştır.
Advers reaksiyonlar MedDRA Sistem Organ Sınıfına (SOC) göre listelenmiştir. Advers reaksiyonlar, her bir SOC içinde sıklık kategorilerine göre sıralanmıştır ve azalan ciddiyet sırasına göre sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
İyi huylu, kötü huylu ve belirtilmemiş neoplazmalar (kist ve polipler de dahil olmak üzere)
Yaygın olmayan: Tümör kanamalarıa
Kan ve lenf sistemi hastalıkları
Çok yaygın: Kan hastalığı kanamalarıb Bilinmiyor: Trombotik Trombositopenik Purpurac
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Anjiyoödemi içeren hipersensivitec
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hiperürisemid Yaygın: Gut/Gut artriti
Psikiyatrik hastalıklar
Yaygın olmayan: Konfüzyon
Sinir sistemi hastalıkları
Yaygın: Baş dönmesini de içeren sersemlik hali, senkop, başağrısı Yaygın olmayan: İntrakraniyal hemorajim
Göz hastalıkları
Yaygın olmayan: Göz içi hemorajie
Kulak ve iç kulak hastalıkları
Yaygın: Vertigo
Yaygın olmayan: Kulak içi hemoraji
Kardiyak hastalıkları
Bilinmiyor: Bradiaritmi, AV bloklamac
Vasküler hastalıklar
Yaygın: Hipotansiyon
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın : Dispne
Yaygın: Solunum sistemi kanamalarıf
Gastrointestinal hastalıklar
Yaygın: Gastrointestinal hemoraji , diyare, bulantı, dispepsi, konstipasyon
Yaygın olmayan: Retroperitoneal hemoraji
Deri ve deri altı doku hastalıkları
Yaygın: Deri altı veya deride kanamah, kaşıntı, döküntü
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın olmayan: Kas içi kanamai
Böbrek ve idrar yolu hastalıkları
Yaygın: İdrar yolunda kanamaj
Üreme sistemi ve meme hastalıkları
Yaygın olmayan: Üreme sistemi kanamalarık
Araştırmalar
Yaygın: Kan kreatininde artışd
Yaralanma, zehirlenme ve prosedüre ait komplikasyonlar
Yaygın: Post-prosedürel hemoraji, travmatik kanamalarl
a örn.; mesane kanseri, gastrik kanser, kolon kanseri nedeniyle kanama.
b örn.; ekimoz, spontan hematoma, hemorajik diatez eğilimde artış.
c Pazarlama sonrası teşhis edilmiş deneyim
d Sıklıklar laboratuvar gözlemlerinden elde edilmiştir (Başlangıçta referans aralığının altında ya da referans aralığı dahilinde değerden ürik asit artışı > normalin üst sınırı. Başlangıca göre
>%50 kreatinin artışları) ve ham advers olay bildirim sıklığı değildir.
e örn.; konjonktival, retinal, intraoküler kanama.
f örn.; burun kanaması, hemoptizi.
g örn.; dişeti kanaması, rektal hemoraji, gastrik ülser hemorajisi.
h örn.; ekimoz, cilt hemorajisi, peteşi.
i örn.; hemartroz, kas hemorajisi.
j örn.; hematüri, hemorajik sistit.
k örn.; vajinal hemoraji, hematospermi, post-menopozal hemoraji.
l örn.; kontüzyon, travmatik hematom, travmatik hemoraji.
m örn.; spontan, prosedürle ilgili veya travmatik intrakranial hemoraji. Seçilen advers reaksiyonların tanımı
Kanama
PLATO çalışmasındaki kanama bulguları
PLATO çalışmasındaki genel kanama oranları sonuçları Tablo 1'de gösterilmektedir.
Tablo 1 â Genel kanama olaylarının analizi, 12 ayda Kaplan-Meier tahminleri (PLATO)
| Günde iki kez Tikagrelor 90 mg N=9235 | Klopidogrel N=9186 | p-değeri* |
PLATO Toplam Majör | 11,6 | 11,2 | 0,4336 |
PLATO Majör Ölümcül/Yaşamı tehdit edici | 5,8 | 5,8 | 0,6988 |
CABG olmayan PLATO Majör | 4,5 | 3,8 | 0,0264 |
Prosedürel olmayan PLATO Majör | 3,1 | 2,3 | 0,0058 |
PLATO Toplam Majör + Minör | 16,1 | 14,6 | 0,0084 |
Prosedürel olmayan PLATO Majör + Minör | 5,9 | 4,3 | <0,0001 |
TIMI tanımlı Majör | 7,9 | 7,7 | 0,5669 |
TIMI tanımlı Majör + Minör | 11,4 | 10,9 | 0,3272 |
Kanama kategorisi tanımları:
Majör Ölümcül/Yaşamı tehdit edici kanama: Hemoglobinde (Hgb) >50 g/L azalma veya
≥4 ünite eritrosit transfüzyonu ile klinik olarak belirgin; VEYA ölümcül; VEYA intrakraniyal; VEYA kardiyak tamponad ile intraperikardiyal; VEYA presör ajan veya ameliyat gerektiren şiddetli hipotansiyon veya hipovolemik şokun eşlik ettiği.
Majör Diğer: Hgb'de 30-50 g/L azalma veya 2-3 ünite eritrosit transfüzyonu ile klinik olarak belirgin; veya anlamlı derecede kısıtlayıcı.
Minör kanama: Kanamayı durdurmak veya tedavi etmek için tıbbi müdahale gerektiren. TIMI Majör kanama: Hgb'de >50 g/L azalma veya intrakraniyal hemoraji ile klinik olarak belirgin.
TIMI Minör kanama: Hgb'de 30-50 g/L azalma ile klinik olarak belirgin.
*Tek açıklayıcı değişken olarak tedavi grubu ile Cox orantısal risk modelinden hesaplanan
p-değeri.
Tikagrelor ve klopidogrel PLATO Majör Ölümcül/Yaşamı tehdit edici kanama, PLATO toplam majör kanama, TIMI Majör kanama ya da TIMI Minör kanama oranları bakımından farklılık göstermemiştir (Tablo 1). Ancak klopidogrel ile karşılaştırıldığında tikagrelor ile daha fazla PLATO Majör + Minör kanama bileşimi meydana gelmiştir. PLATO'da daha az sayıda hastada ölümcül kanama olmuştur: Tikagrelor için 20 (%0,2) ve klopidogrel için 23 (%0,3) (Bkz.
Bölüm 4.4).
Yaş, cinsiyet, vücut ağırlığı, ırk, coğrafi bölge, eş zamanlı hastalıklar, eşlik eden tedavi ve önceki inme veya geçici iskemik atak dahil tıbbi öykü parametrelerinden hiçbiri genel ya da prosedürel olmayan PLATO Majör kanamayı öngörmemiştir. Dolayısıyla, herhangi bir kanama alt grubu için belirli bir grubun risk altında olduğu teşhis edilmemiştir.
CABG ilişkili kanama:
PLATO çalışmasında, CABG ameliyatı geçiren 1584 hastanın (kohortun %12'si) %42'sinde tedavi grupları arasında fark olmaksızın PLATO Majör Ölümcül/Yaşamı tehdit edici kanama meydana gelmiştir. Ölümcül CABG kanaması her tedavi grubunda 6 kişide meydana gelmiştir (Bkz. Bölüm 4.4).
CABG ile ilişkili olmayan kanama ve prosedürel ilişkili olmayan kanama:
Tikagrelor ve klopidogrel CABGolmayanPLATOtanımlı Majör Ölümcül/Yaşamı tehdit edici kanamaaçısındanfarklılıkgöstermemiştir; fakat PLATOtanımlıToplamMajör,TIMIMajör ve TIMI Majör + Minör kanama tikagrelor ile daha yaygın olarak görülmüştür. Benzer şekilde,
prosedürle ilişkili tüm kanamalar çıkarıldığında, klopidogrele kıyasla tikagrelor ile daha fazla kanama meydana gelmiştir (Tablo 1). Prosedürel olmayan kanama nedeniyle tedaviyi kesme, klopidogrel (%1,2; p<0,001) ile karşılaştırıldığında tikagrelor (%2,9) ile daha yaygın olarak görülmüştür.
İntrakraniyal kanama:
Klopidogrel (n=14 kanama, %0,2) ile karşılaştırıldığında tikagrelor (26 hastada n=27 kanama,
%0,3) ile daha fazla prosedürel olmayan intrakraniyal kanama meydana gelmiştir; bunlar arasında tikagrelor ile 11 kanama ve klopidogrel ile 1 kanama ölümcüldür. Genel ölümcül kanamalarda farklılık bulunmamıştır.
PEGASUS çalışmasında kanama bulguları
PEGASUS çalışmasındaki genel kanama olaylarının sonuçları Tablo 2'de gösterilmektedir.
Tablo 2 - Genel kanama olaylarının analizi, 36 ayda Kaplan-Meier tahminleri (PEGASUS)
| Günde iki kez Tikagrelor 60 mg + ASA N=6958 | Tek başına ASA N=6996 |
| |
Güvenlilik sonlanım noktaları | %KM | Risk oranı (RO) (%95 GA) | %KM | p-değeri |
TIMI tanımlı kanama kategorileri | ||||
TIMI Majör | 2,3 | 2,32 (1,68, 3,21) | 1,1 | <0,0001 |
Ölümcül | 0,3 | 1 (0,44, 2,27) | 0,3 | 1 |
İntrakraniyal Kanama (İK) | 0,6 | 1,33 (0,77, 2,31) | 0,5 | 0,3130 |
Diğer TIMI majör | 1,6 | 3,61 (2,31, 5,65) | 0,5 | <0,0001 |
TIMI Majör veya Minör | 3,4 | 2,54 (1,93, 3,35) | 1,4 | <0,0001 |
TIMI Majör veya Minör veya Tıbbi müdahale gerektiren | 16,6 | 2,64 (2,35, 2,97) | 7 | <0,0001 |
PLATO tanımlı kanama kategorileri | ||||
PLATO Majör | 3,5 | 2,57 (1,95, 3,37) | 1,4 | <0,0001 |
Ölümcül/Yaşamı tehdit edici | 2,4 | 2,38 (1,73, 3,26) | 1,1 | <0,0001 |
Diğer PLATO Majör | 1,1 | 3,37 (1,95, 5,83) | 0,3 | <0,0001 |
PLATO Majör veya Minör | 15,2 | 2,71 (2,40, 3,08) | 6,2 | <0,0001 |
Kanama kategorisi tanımları:
TIMI Majör: Ölümcül kanama VEYA herhangi bir intrakraniyal kanama VEYA Hgb'de ≥50 g/L'lik düşme veya Hgb mevcut olmadığında hemotokritte (Hct) %15'lik düşme ile ilişkili klinik olarak belirgin hemoraji bulguları.
Ölümcül: 7 gün içinde doğru danölümeyolaçanbirkanamao layı.
Diğer TIMI Majör: Ölümcül olmayan İK dışı TIMI Majör kanama.
TIMI Minör: Hgb'de 30-50 g/L azalma ile klinik olarak belirgin.
Tıbbi müdahale gerektiren TIMI: Müdahale gerektiren VEYA hastaneye yatışa yol açan VEYA değerlendirmeyi gerektiren.
PLATO Majör Ölümcül/Yaşamı tehdit edici: Ölümcül kanama VEYA herhangi bir intrakraniyal kanama VEYA kardiyak tamponad ile intraperikardiyal VEYA presör/inotrop veya ameliyat gerektiren hipovolemik şok veya şiddetli hipotansiyon ile VEYA Hgb'de >50 g/L azalma ile klinik olarak belirgin VEYA ≥ 4 ünite eritrosit transfüzyonu.
PLATO Majör Diğer: Anlamlı derecede kısıtlayıcı VEYA Hgb'de 30-50 g/L azalma ile klinik olarak belirgin VEYA 2-3 ünite eritrosit transfüzyon gerektiren.
PLATO Minör: Kanamayı durdurmak veya tedavi etmek için tıbbi girişim gerektiren.
PEGASUS çalışmasında, günde iki kez tikagrelor 60 mg için TIMI Majör kanama tek başına ASA için olandan daha yüksektir. Ölümcül kanama için kanama riskinde artış görülmemiş ve tek başına ASA tedavisine kıyasla sadece intrakraniyal hemorajilerde küçük bir artış gözlenmiştir. Çalışmada birkaç ölümcül kanama olayı yaşanmıştır: Tikagrelor 60 mg için 11 (%0,3) ve tek başına ASA tedavisi için 12 (%0,3). Tikagrelor 60 mg ile TIMI Majör kanama riskinde gözlenen artışın nedeni, başlıca gastrointestinal SOC'daki olaylardan kaynaklanan diğer TIMI Majör kanama sıklığının daha yüksek olmasıdır.
TIMI Majöre benzer kanama paternlerinde artış, TIMI Majör veya Minör ve PLATO Majör ve PLATO Majör veya Minör kanama kategorileri için görülmüştür (Bkz. Tablo 2). Kanama nedeniyle tedavinin kesilmesi tek başına ASA tedavisine kıyasla tikagrelor 60 mg ile daha yaygındır (sırasıyla %6,2 ve %1,5). Bu kanamaların büyük çoğunluğu epistaksis, ekimoz ve hematomlar gibi daha düşük ciddiyette (TIMI tıbbi müdahale gerektiren olarak sınıflandırılmış) kanamalardır.
Tikagrelor 60 mg'ın kanama profili TIMI Majör, TIMI Majör veya Minör ve PLATO Majör kanama olayları için çoklu önceden tanımlanmış alt gruplar arasında (örn.; yaş, cinsiyet, vücut ağırlığı, ırk, coğrafik bölge, eş zamanlı hastalıklar, eş zamanlı tedavi ve tıbbi öykü) tutarlı bulunmuştur.
İntrakraniyal kanama:
Spontan intrakraniyal hemorajiler tikagrelor 60 mg ve tek başına ASA tedavisi için benzer oranlarda bildirilmiştir (her iki tedavi grubunda da n=13, %0,2). Travmatik ve prosedürle ilişkili intrakraniyal hemorajiler tek başına ASA tedavisine (n=10, %0,1) kıyasla tikagrelor 60 mg tedavisi ile küçük bir artış göstermiştir (n=15, %0,2). Tikagrelor 60 mg ile 6 ölümcül intrakraniyal kanama ve tek başına ASA tedavisi ile 5 ölümcül intrakraniyal kanama meydana gelmiştir. İntrakraniyal kanama insidansı, araştırma altındaki popülasyonun anlamlı komorbidite ve kardiyovasküler risk faktörleri dikkate alındığında her iki tedavi grubunda da düşük olmuştur.
THEMIS çalışmasında kanama bulguları
PKG uygulanan THEMIS hastalarındaki genel kanama olaylarının sonuçları Tablo 3'te gösterilmektedir.
Tablo 3 - PKG öyküsü olan hastalardan oluşan THEMIS alt grubunda 36 ayda tedaviye göre kanama olaylarının analizi, Kaplan-Meier kanama oranlarının tahmini ("tedavi analizinde")
| ASA ile günde iki kez BRILINTA N=5536 | Tek başına ASA N=5564 |
Risk Oranı (RO) (%95 GA) |
p-değeri |
Güvenlilik Sonlanım Noktaları | %KM | %KM | ||
TIMI-tanımlı kanama kategorileri | ||||
TIMI Majör | %2,4 | %1,3 | 2,03 (1,48, 2,76) | <,0001 |
TIMI Majör ya da Minör | %3,4 | %1,7 | 2,23 (1,70, 2,92) | <,0001 |
TIMI Majör ya da Minör veya Tıbbi müdahale gerektiren | %13,1 | %6,3 | 2,28 (1,99, 2,62) | <,0001 |
PLATO-tanımlı kanama kategorileri | ||||
PLATO Majör | %3,8 | %1,9 | 2,22 (1,72, 2,86) | <,0001 |
Ölümcül/Yaşamı tehdit edici | %2,5 | %1,3 | 2,10 (1,54, 2,86) | <,0001 |
Diğer PLATO Majör | %1,5 | %0,6 | 2,53 (1,64, 3,93) | <,0001 |
Kanama kategorisi tanımları:
TIMI Majör: Ölümcül kanama VEYA herhangi bir intrakraniyal kanama VEYA Hgb'de ≥50 g/L'lik düşme veya Hgb mevcut olmadığında Hct'de %15'lik düşme ile ilişkili klinik olarak belirgin hemoraji bulguları.
CABG ilişkili kanama: Ölümcül kanama veya perioperatif intrakraniyal kanama veya kanamanın kontrol altına alınması amacıyla sternotomi kesisinin kapatılmasını takiben yeniden ameliyat ya da 48 saatlik bir süre içinde ≥5 ünite tam kan veya PRBC transfüzyonu (kan ürünleri hesaplamalarında hücre koruyucu transfüzyonu sayılmamıştır) veya 24 saatlik bir süre içinde
>2 L göğüs tüpü çıkışı.
TIMI Minör: Hgb'de 30-50 g/L düşüş veya Hct'de ≥%10 ila <%15 düşüş VEYA kan kaybı olmadığında; Hgb konsantrasyonunda ≥40 g/L düşüş veya Hct'de ≥%12 düşüşle klinik olarak belirgin.
Tıbbi müdahale gerektiren TIMI: Müdahale gerektiren VEYA hastaneye yatışa yol açan VEYA değerlendirme gerektiren.
PLATO Majör Ölümcül/Yaşamı tehdit edici: Ölümcül kanama VEYA herhangi bir intrakraniyal kanama VEYA kardiyak tamponad ile intraperikardiyal VEYA presör/inotrop veya ameliyat gerektiren hipovolemik şok veya şiddetli hipotansiyon ile VEYA Hgb'de >50 g/L azalma ile klinik olarak belirgin VEYA ≥ 4 ünite eritrosit transfüzyonu gerektiren.
THEMIS çalışmasında primer güvenlilik sonlanım noktası âTIMI Majör Kanamaâ olaylarıdır. Güvenlilik analizi ayrıca PLATO ve BARC kanama sınıflandırmalarını kapsıyordu.
THEMIS çalışmasında, TIMI Majör kanama günde iki kez BRILINTA için tek başına ASA'dan daha yüksektir (36 aydaki Kaplan-Meier tahmini: sırasıyla %2,2 karşısında %1,2, p <0,0001). Bu daha yüksek insidans, daha fazla sayıda ölümcül kanama (ASA için 10 karşısında BRILINTA için 17) ve intrakraniyal kanamalar (tek başına ASA için 46'ya karşı BRILINTA
için 70) ile karakterize edilmiştir.BRILINTAtedavikolunda bildirilen intrakraniyal
PKG öyküsü olan hasta alt grubunda, TIMI Majör kanama insidansı da tek başına ASA'ya kıyasla BRILINTA için daha yüksektir (Tablo 3). ASA ile kombinasyon halinde BRILINTA için 6 ve tek başına ASA tedavisi için 6 olmak üzere birkaç ölümcül kanama olayı olmuştur. İntrakraniyal hemorajileri olan hasta sayısı, ASA ile kombinasyon halinde BRILINTA için 33 ve tek başına ASA için 31 olup, KM yüzdeleri sırasıyla %0,7 ve %0,6'dır, p=0,4545. Bununla birlikte ölümcül kanama ve intrakraniyal hemoraji oranı iki tedavi kolunda da benzerdir. BRILINTA ile bildirilen intrakraniyal hemoraji vakalarından 23'ü travmatik ve 10'u spontandır. Bu nedenle, BRILINTA ile gözlenen artmış TIMI Majör kanama riski, esas olarak olayların SOC gastrointestinal bozukluklarda ve yaralanma, zehirlenme ve yapılan işleme ait komplikasyonlarda daha sık görülmesinden kaynaklanmıştır.
PKG öyküsü bulunan hastalarda kanama olayları nedeniyle çalışma ilacının kesilmesi tek başına ASA tedavisine kıyasla BRILINTA ile daha yaygındır (sırasıyla %1,3 ve %4,7). Epistaksis ve artan ekimoz eğilimi, BRILINTA tedavisinin kesilmesi ile sonuçlanan en yaygın kanama olaylarıdır.
Hasta Alt Popülasyonlarında Kanama: BRILINTA'nın kanama profili genel olarak önceden tanımlanmış birden çok alt grupta (örn.; yaş, cinsiyet, vücut ağırlığı, etnik köken, coğrafi bölge, eşlik eden hastalıklar, eş zamanlı tedavi ve tıbbi geçmişe göre) tutarlıdır.
Diğer Advers Olaylar
THEMIS çalışma protokolünde advers olay toplama, ciddi advers olaylar, advers olaylar nedeniyle bırakmalar ve öneme sahip advers olaylarla sınırlandırılmıştır. THEMIS çalışmasında toplanan advers olay verilerinin PLATO ve PEGASUS çalışmalarından elde edilen verilerle tutarlı olduğu görülmektedir.
Dispne
Tikagrelor ile tedavi edilen hastalarda bir tür nefessizlik hissi olan dispne bildirilmiştir. PLATO çalışmasında dispne advers olayları (dispne, istirahat halinde dispne, efora bağlı dispne, paroksismal noktürnal dispne ve noktürnal dispne) bir arada ele alındığında, tikagrelor ile tedavi edilen hastaların %13,8'i ve klopidogrel ile tedavi edilen hastaların %7,8'si tarafından bildirilmiştir. Tikagrelor kullanan hastaların %2,2'sinde ve klopidogrel kullanan hastaların
%0,6'sında araştırmacılar dispnenin PLATO çalışmasındaki tedavi ile nedensellik ilişkisi içinde olduğunu ve azının ciddi olduğunu (%0,14 tikagrelor; %0,02 klopidogrel) düşünmüştür (Bkz. Bölüm 4.4). En çok bildirilen dispne semptomları hafif ila orta şiddette olup çoğu tedavi başlangıcından kısa bir süre sonra tek bir epizot olarak bildirilmiştir. THEMIS çalışmasında, BRILINTA'ya randomize edilen hastaların yaklaşık %21,4'ü dispne olayları yaşamıştır. THEMIS'teki bu dispne olaylarının özellikleri, daha önce açıklananlarla uyumludur (Bkz. Bölüm 4.4).
Klopidogrel ile karşılaştırıldığında tikagrelor ile tedavi edilen astım/KOAH hastalarında ciddi olmayan dispne (tikagrelor ile %3,29'a karşın klopidogrel ile %0,53) ve ciddi dispne (tikagrelor ile %0,38'e karşın klopidogrel ile %0) yaşama riski artmış olabilir. Mutlak terimlere göre, bu risk genel PLATO popülasyonundakinden daha yüksek bulunmuştur. Tikagrelor, astım ve/veya KOAH öyküsü olan hastalarda dikkatle kullanılmalıdır (Bkz. Bölüm 4.4).
Epizotların yaklaşık %30'u 7 gün içerisinde düzelmiştir. PLATO çalışmasına başlangıçta konjestif kalp yetmezliği, KOAHveyaastımıolanhastalardahil edilmiştir; bu hastalar ve
karşılaştırıldığında tikagrelor için hastaların %0,9'u dispne nedeniyle çalışma ilacını
bırakmıştır. Tikagrelor ile daha yüksek dispne insidansına yeni veya kötüleşen kalp veya akciğer hastalığı eşlik etmemiştir (Bkz. Bölüm 4.4). Tikagrelor pulmoner fonksiyon testlerini etkilemez.
PEGASUS çalışmasında dispne, günde iki kez tikagrelor 60 mg alan hastaların %14,2'sinde ve tek başına ASA alan hastaların %5,5'inde bildirilmiştir. PLATO çalışmasında en çok bildirilen dispne olayları hafif ila orta şiddete olmuştur (Bkz. Bölüm 4.4). Dispne bildiren hastalar daha yaşlı olma ve daha sık olarak da, KOAH veya astım hastalığı temelinde dispneik olma eğilimindedir.
Araştırmalar
Ürik asit yükselmeleri: PLATO çalışmasında, klopidogrel alan hastalar ile %13 olan oran ile kıyaslandığında tikagrelor alan hastaların %22'sinde serum ürik asit, normalin üst sınırından daha fazla yükselmiştir. PEGASUS çalışmasında karşılık gelen değerler tikagrelor 90 mg, 60 mg ve plasebo için sırasıyla %9,1, %8,8 ve %5,5 olmuştur. Ortalama serum ürik asit klopidogrel ile yaklaşık %7,5 olan oran ile karşılaştırıldığında tikagrelor ile yaklaşık %15 artmış ve tedavi durdurulduktan sonra tikagrelor tedavisinde yaklaşık %7'ye düşmüştür; ancak klopidogrel ile bir azalma gözlenmemiştir. PEGASUS çalışmasında tikagrelor 90 mg ve 60 mg için ortalama serum ürik asit düzeylerinde sırasıyla %6,3 ve %5,6'lık geri dönüşlü yükselmeler bulunmuş, plasebo grubunda ise %1,5'lik bir azalma yaşanmıştır. PLATO çalışmasında gut artriti sıklığı tikagrelor için %0,2'ye karşın klopidogrel için %0,1 bulunmuştur. PEGASUS çalışmasında gut/gut artriti için karşılık gelen değerler tikagrelor 90 mg, 60 mg ve plasebo için sırasıyla %1,6,
%1,5 ve %1,1'dir.
THEMIS'te, tek başına aspirine karşı BRILINTA kullanan hastalarda hiperürisemi insidansı daha yüksek ancak gut insidansı benzerdir. Hiperürisemi ya da gutlu artrit öyküsü olan hastalarda BRILINTA uygulaması sırasında dikkatli olunması gerekmektedir. Tedbir amaçlı olarak, ürik asit nefropatisi olan hastalarda BRILINTA kullanımı önerilmez.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Tikagrelor 900 mg'a kadar olan tekli dozlarda iyi tolere edilir. Tekli artan doz çalışmasında gastrointestinal toksisitenin, doz sınırlayıcı olduğu belirlenmiştir. Doz aşımı ile ortaya çıkabilecek diğer klinik olarak anlamlı advers reaksiyonlar arasında dispne ve ventriküler duraklamalar mevcuttur (Bkz. Bölüm 4.8).
Doz aşımı durumunda yukarıdaki potansiyel advers reaksiyonlar meydana gelebilir ve bu durumda EKG takibi düşünülmelidir.
Tikagrelorun etkilerini tersine çevirecek bilinen bir antidot halihazırda mevcut değildir ve tikagrelor diyalizle temizlenebilir değildir (Bkz. Bölüm 5.2). Doz aşımı tedavisinde yerel standart tıbbi uygulamalar takip edilmelidir. Aşırı tikagrelor dozunda, beklenen etki trombosit inhibisyonu ile ilişkili olarakkanamariskisüresininuzamasıdır. Trombosit transfüzyonunun
kanama gözlenirse, uygun destekleyici tedbirler alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Trombosit agregasyon inhibitörleri (Heparin hariç) ATC kodu: B01AC24
Etki mekanizması
BRILINTA, oral, direk etkili, P2Yreseptörünü selektif ve geri dönüşümlü olarak bağlanarak antagonize eden ve ADP-aracılı P2Y'ye bağımlı trombosit aktivasyonunu ve agregasyonunu engelleyen, siklopentiltriazolopirimidin (SPTP) kimyasal sınıfının bir üyesi olan tikagrelor içermektedir. Tikagrelor ADP'nin bağlanmasını engellemez; ancak P2Yreseptörüne bağlandığı zaman ADP ile indüklenen sinyal iletimini engeller. Trombositler aterosklerotik hastalığın trombotik komplikasyonlarının başlaması ve/veya gelişmesinde yer aldıklarından, trombosit fonksiyon inhibisyonunun ölüm, MI veya inme gibi KV olay riskini azalttığı gösterilmiştir.
Tikagrelor aynı zamanda, dengeleyici nükleozit taşıyıcısı-1'i (ENT-1) inhibe ederek lokal endojen adenozin düzeylerini de artırır.
Tikagrelorun sağlıklı gönüllülerde ve AKS hastalarında adenozin kaynaklı aşağıdaki etkileri güçlendirdiği belirlenmiştir: Vazodilatasyon (sağlıklı gönüllülerde ve AKS hastalarında koroner kan akışı artışları ile ölçülür; baş ağrısı), trombosit fonksiyonun inhibisyonu (in vitro koşullarda insan tam kanında) ve dispne. Bununla birlikte, adenozinde gözlenen artışlar ve klinik sonuçlar (örn.; morbidite-mortalite) arasındaki ilişki henüz tam olarak açıklığa kavuşturulmuş değildir.
Farmakodinamik etkiler
Etkinin başlaması
Tikagrelor için 180 mg yükleme dozundan 0,5 saat sonra yaklaşık %41'lik ortalama trombosit agregasyon inhibisyonu (TAİ) değeri ile gösterildiği üzere, ASA tedavisi görmekte olan stabil KAH olan hastalarda tikagrelor hızlı bir farmakolojik etki başlangıcı gösterir; %89'luk maksimum TAİ etkisi dozdan 2-4 saat sonra ortaya çıkar ve 2-8 saat arasında sürer. Hastaların
%90'ında son uzatılmış TAİ, dozdan 2 saat sonra >%70 olmuştur.
Etkinin sonlanması
Eğer bir CABG prosedürü planlanıyorsa, tikagrelorun prosedürden önce 96 saatten daha kısa bir süre içerisinde kesilmesi durumunda tikagrelor kanama riski klopidogrele göre artmaktadır.
Geçiş verileri
Klopidogrel 75 mg'dan günde iki kez tikagrelor 90 mg'a geçiş, %26,4 mutlak TAİ artışı ile sonuçlanır ve tikagrelordan klopidogrele geçiş %24,5 mutlak TAİ azalması ile sonuçlanır. Hastalar antitrombositik etkide herhangi bir kesinti olmaksızın klopidogrelden tikagrelore geçebilir (Bkz. Bölüm 4.2).
Klinik etkililik ve güvenlilik
Tikagreloun etkililiği ve güvenliliği için klinik bulgular üç faz 3 çalışmasından elde edilmiştir:
PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients] çalışması, ASA ile kombinasyon halinde verilen tikagrelor tedavisinin tek başına ASA tedavisi ile karşılaştırılması
THEMIS çalışması KAH ve tip 2 DM'li hastalarda tek başına ASA tedavisine kıyasla düşük doz ASA (75-150 mg) ile kombinasyon halinde verilen tikagrelor tedavisi ile karşılaştırılması
PLATO çalışması (Akut Koroner Sendromlar)
PLATO çalışmasına stabil olmayan anjina (UA), ST yükselmesiz MI (NSTEMI) veya ST yükselmeli MI (STEMI) semptomları başladıktan sonraki 24 saat içerisinde gelen ve ilk tedavisi medikal veya PKG ya da CABG olan 18.624 hasta dahil edilmiştir.
Klinik etkililik
Arka plan tedavisi olarak günde bir kez ASA kullanıldığında, günde iki kez tikagrelor 90 mg, KV ölüm, MI veya inmeden oluşan bileşik sonlanım noktasını önlemede günde bir kez 75 mg klopidogrele göre üstünlük göstermiş, oluşan farka ise KV ölüm ve MI sebebiyet vermiştir. Hastalar 300 mg klopidogrel yükleme dozu (PKG varsa 600 mg olması mümkündür) veya 180 mg tikagrelor dozu almıştır.
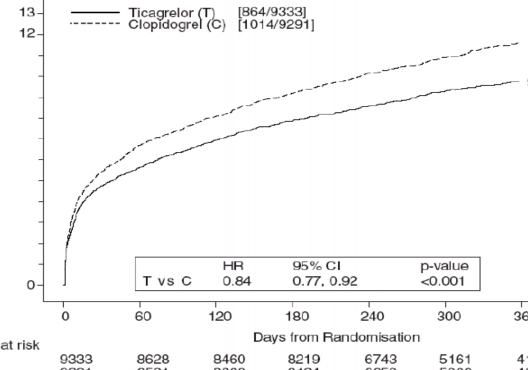
Bu sonuç erken dönemde ortaya çıkmış (30 günde mutlak risk azalması [ARR] %0,6 ve rölatif risk azalması [RRR] %12), 12 aylık dönemin tamamında sabit bir tedavi etkisi söz konusu olmuş, %16'lık RRR ile yıl başına %1,9 ARR verimini sağlamıştır. Bu bulgu, hastaların 12 ay süreyle günde iki kez tikagrelor 90 mg ile tedavisinin uygun olduğunu düşündürmektedir (Bkz. Bölüm 4.2). AKS hastalarının klopidogrel yerine tikagrelor ile tedavi edilmesi sonucu, 54 hastada 1 aterotrombotik olay; 91 hastada bir KV ölüm önlenecektir (Bkz. Şekil 1 ve Tablo 3).
Tikagrelorun, klopidogrele üstün olan tedavi edici etkisi vücut ağırlığı; cinsiyet; DM, geçici iskemik atak veya hemorajik olmayan inme veya revaskülarizasyon dahil tıbbi öykü; heparinler, GpIIb/IIIa inhibitörleri ve proton pompa inhibitörlerini içeren eş zamanlı tedaviler (Bkz. Bölüm 4.5); final indeks olay tanısı (STEMI, NSTEMI veya UA); ve randomizasyonda hedeflenen tedavi yolağı (invazif veya medikal) dahil bir çok alt grup arasında tutarlı olmuştur.
Bölge ile zayıf anlamlılığa sahip bir tedavi etkileşimi gözlenmiş olup bunun neticesinde birincil sonlanım noktasının risk oranı (RO), dünyanın geri kalanında tikagrelor lehine iken incelenen toplam popülasyonun yaklaşık %10'unu temsil eden Kuzey Amerika'da klopidogrel lehinedir (etkileşim p-değeri=0,045). Keşif amaçlı analizler ASA dozu ile olası bir etkileşim akla getirmektedir: Artan ASA dozları ile tikagrelorda azalan etkililik gözlenmiştir. Tikagrelor ile verilecek kronik günlük ASA dozları 75-150 mg olmalıdır (Bkz. Bölüm 4.2 ve 4.4).
Şekil 1'de bileşik etkililik sonlanım noktasında herhangi bir olayın ilk meydana gelmesine ait riskin tahmini gösterilmektedir.
%95 GA
p-değeri
Randomizasyondan sonra günler
Risk taşıyan hasta sayısı
Kaplan-Meier Yüzdesi (%)
Şekil 1 â KV ölüm, MI ve inmenin birincil klinik bileşik sonlanım noktası analizi (PLATO)
Tikagrelor hem UA/NSTEMI hem de STEMI popülasyonunda (Tablo 4) klopidogrel ile karşılaştırıldığında birincil bileşik sonlanım noktasının oluşma oranını azaltmıştır. Dolayısıyla, medikal tedavi gören hastalar ve PKG ya da CABG ile tedavi edilen hastalar dahil olmak üzere AKS hastalarında (UA, NSTMI, STEMI) düşük doz ASA ile birlikte günde iki kez BRILINTA 90 mg kullanılabilir.
Tablo 4 â Birincil ve ikincil etkililik sonlanım noktalarının analizi (PLATO)
| Günde iki kez tikagrelor 90 mg (% olay yaşayan hasta yüzdesi) N=9333 | Günde bir kez klopidogrel 75 mg (% olay yaşayan hasta yüzdesi) N=9291 | MRA (%/yr) | NRA (%) (%95 GA) | p-değeri |
KV ölüm, MI (sessiz MI hariç) veya inme | 9,3 | 10,9 | 1,9 | 16 (8,23) | 0,0003 |
İnvazif müdahale | 8,5 | 10 | 1,7 | 16 (6,25) | 0,0025 |
Medikal müdahale | 11,3 | 13,2 | 2,3 | 15 (0,3,27) | 0,0444 |
KV ölüm | 3,8 | 4,8 | 1,1 | 21 (9,31) | 0,0013 |
MI (sessiz MI hariç) | 5,4 | 6,4 | 1,1 | 16 (5,25) | 0,0045 |
| Günde iki kez tikagrelor 90 mg (% olay yaşayan hasta yüzdesi) N=9333 | Günde bir kez klopidogrel 75 mg (% olay yaşayan hasta yüzdesi) N=9291 | MRA (%/yr) | NRA (%) (%95 GA) | p-değeri |
İnme | 1,3 | 1,1 | -0,2 | -17 (-52,9) | 0,2249 |
Tüm nedenlere bağlı ölüm, MI (sessiz MI hariç) veya inme | 9,7 | 11,5 | 2,1 | 16 (8,23) | 0,0001 |
KV ölüm, toplam MI, inme, CRİ, Rİ, TIA veya diğer ATO | 13,8 | 15,7 | 2,1 | 12 (5,19) | 0,0006 |
Tüm nedenlere bağlı ölüm | 4,3 | 5,4 | 1,4 | 22 (11,31) | 0,0003 |
Belirli stent trombozu | 1,2 | 1,7 | 0,6 | 32 (8,49) | 0,0123 |
aMRA=mutlak risk azalması; NRA=nispi risk azalması= 1-risk oranı) x %100. Negatif NRA nispi risk artışını gösterir.
bSessiz MI hariç.
cCRİ=ciddi reküren iskemi; Rİ=reküren iskemi; TIA=geçici iskemik atak; ATO=arteriyel trombotik olay. Toplam MI, sessiz MI'yi içerir ve olayın tarihi, keşfedildiği tarih olarak belirlenir.
dNominal anlamlılık değeri; tüm diğerleri önceden belirlenmiş hiyerarşi testlerine göre resmi olarak ve istatistiksel olarak anlamlıdır.
PLATO genetik alt çalışması
PLATO çalışmasında 10.285 hastanın CYP2C19 ve ABCB1 genotiplerinin belirlenmesi, genotip grupları ile PLATO sonuçları arasındaki ilişkileri göstermiştir. Majör KV olayları azaltmada tikagrelorun klopidogrele üstünlüğü, hasta CYP2C19 veya ABCB1 genotipinden anlamlı derecede etkilenmemiştir. Genel olarak PLATO çalışmasına benzer şekilde, toplam PLATO Majör kanama, CYP2C19 veya ABCB1 genotipinden bağımsız olarak tikagrelor ve klopidogrel arasında farklılık göstermemiştir. CABG olmayan PLATO Majör kanama, bir veya daha fazla CYP2C19 işlev kaybı alleline sahip hastalarda klopidogrel ile karşılaştırıldığında tikagrelor ile artmıştır fakat işlev kaybı alleli olmayan hastalarda klopidogrel ile benzer olmuştur.
Kombine etkililik ve güvenlilik bileşimi
Kombine etkililik ve güvenlilik bileşimi (KV ölüm, MI, inme veya PLATO tanımlı âToplam Majörâ kanama), klopidogrel ile karşılaştırıldığında tikagrelorun etkililiğindeki faydanın, AKS'den sonraki 12 ayda majör kanama olayları ile dengelenmediğini göstermektedir (MRA
%1,4, NRA %8, RO (risk oranı) 0,92; p=0,0257).
Klinik güvenlilik
Holter alt çalışması
PLATO çalışması sırasında ventriküler duraklamaların ve diğer aritmik epizotların ortaya çıkışını incelemek üzere araştırmacılar yaklaşık 3000 hastadan oluşan bir alt grupta Holter izlemi yapmıştır; bu hastaların yaklaşık 2000'nininde hem AKS'lerinin akut fazında hem de bir ay sonrasında kayıtlar mevcuttur. İncelenen ana değişken ≥3 saniyelik ventriküler duraklamaların meydana gelmesi olmuştur. Akut fazla klopidogrel (%3,5) ile karşılaştırıldığında tikagrelor (%6) ile daha fazla hastada ventriküler duraklamalar olmuştur; ve 1 ay sonrasında sırasıyla %1,6 ve %2,2 olmuştur (Bkz. Bölüm 4.4). AKS'nin akut fazında ventriküler duraklamalardaki artış, KKY öyküsü olan tikagrelor hastalarında daha belirgin olmuştur (%9,2'ye karşın KKY öyküsü olmayan hastalarda %5,4; klopidogrel hastaları için,
%4'e karşın KKY öyküsü olmayan hastalarda %3,6'dır). Bu dengesizlik bir ayda meydana gelmemiştir: tikagrelor hastalarında KKY öyküsü olan ve olmayanlarda sırasıyla %2'e karşın
%2,1 ve klopidogrel ile %3,8'e karşın %1,4'tür. Bu hasta popülasyonunda bu dengesizlik ile ilişkili advers klinik sonuçlar söz konusu olmamıştır (pacemaker yerleştirilmesi durumları dahil).
PEGASUS Çalışması (Miyokard İnfarktüsü Öyküsü)
PEGASUS TIMI-54 çalışması, MI öyküsü ve aterotromboz açısından ek risk faktörleri olan hastalarda tek başına ASA tedavisi ile karşılaştırıldığında düşük doz ASA (75-150 mg) ile kombinasyon halinde 2 doz şeklinde (ya günde iki kez 90 mg ya da günde iki kez 60 mg) verilen tikagrelor ile aterotrombotik olayların önlenmesini değerlendiren 21.162 hastalı, olayların yön verdiği, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli bir çalışmadır.
50 yaş veya üzeri, MI öyküsü (randomizasyondan 1 ila 3 yıl önce) ve aşağıdaki aterotromboz risk faktörlerinden en azından birine sahip hastalar çalışmaya katılım açısından uygun bulunmuştur: ≥65 yaş, ilaç tedavisi gerektiren DM, önceden geçirilmiş ikinci bir MI, çok damarda KAH bulgusu veya son evre olmayan kronik böbrek yetmezliği.
P2Y12 reseptör antagonisti, dipiridamol, silostazol veya antikoagülan tedavisi planlanmışsa;
pıhtılaşma bozukluğu varsa veya iskemik inme veya intrakraniyal kanama öyküsü varsa, santral sinir sistemi tümörü veya bir intrakraniyal vasküler anomali varsa; önceki 6 ay içinde gastrointestinal kanamaları olmuşsa veya önceki 30 gün içinde majör ameliyat geçirmişlerse.
Klinik etkililik
Şekil 2 â KV ölüm, MI ve inmenin birincil klinik bileşik sonlanım noktası analizi (PEGASUS)
----- Tikagrelor 60 mg bd Plasebo
Hasta sayısı 7045 7067
Olay görülen hastalar 487 (%6,9) 578 (%8,2)
36. ayda %KM %7,8 %9
Risk Oranı (%95 GA) 0,84 (0,74, 0,95)
% Kümülatif
p-değeri 0,0043
Risk taşıyan hasta sayısı Randomizasyondan sonra günler
Tablo 5 â Birincil ve İkincil Etkililik Sonlanım Noktalarının Analizi (PEGASUS)
| Günde iki kez tikagrelor 60 mg + ASA N=7045 | Tek başına ASA N=7067 |
p- değeri | |||
Özellikler | Olay görülen hastalar |
%KM | Risk Oranı (RO) (%95 GA) | Olay görülen hastalar |
%KM | |
Birincil sonlanım noktası | ||||||
KV ölüm/MI/İnme bileşimi | 487 (%6,9) | %7,8 | 0,84 (0,74, 0,95) | 578 (%8,2) | %9 | 0,0043 (s) |
KV ölüm | 174 (%2,5) | %2,9 | 0,83 (0,68, 1,01) | 210 (%3) | %3,4 | 0,0676 |
MI | 285 (%4) | %4,5 | 0,84 (0,72, 0,98) | 338 (%4,8) | %5,2 | 0,0314 |
İnme | 91 (%1,3) | %1,5 | 0,75 (0,57, 0,98) | 122 (%1,7) | %1,9 | 0,0337 |
İkincil sonlanım noktası | ||||||
KV ölüm |
174 (%2,5) |
%2,9 | 0,83 (0,68, 1,01) |
210 (%3) |
%3,4 |
- |
Tüm nedenlere bağlı mortalite |
289 (%4,1) |
%4,7 | 0,89 (0,76, 1,04) |
326 (%4,6) |
%5,2 |
- |
RO ve p-değerleri, tek açıklayıcı değişken olarak tedavi grubu ile Cox orantısal risk modelinden hareketle tek başına ASA tedavisine karşın tikagrelor için ayrı ayrı hesaplanır.
36 ayda hesaplanan Kaplan-Meier yüzdesi.
Not: KV ölüm, MI ve İnme bileşenleri için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısı olup, bileşik sonlanım noktasındaki olay sayısına ilave edilmez.
(s) İstatistiksel anlamı belirtir.
GA=Güven aralığı; KV=Kardiyovasküler; RO=Risk oranı; KM=Kaplan-Meier; MI=Miyokard infarktüsü.
N= Hasta sayısı
ASA ile kombinasyon halinde hem günde iki kez 60 mg hem de günde iki kez 90 mg tikagrelor rejimleri çalışma periyodu boyunca tutarlı bir tedavi etkisi ile aterotrombotik olayların önlenmesinde (bileşik sonlanım noktası: KV ölüm, MI ve inme) tek başına ASA'dan üstün olup, tikagrelor 60 mg için %16 NRA ve %1,27 MRA ve tikagrelor 90 mg için %15 NRA ve
%1,19 MRA değerlerini vermektedir.
90 mg ve 60 mg'ın etkililik profili benzer olmasına rağmen, daha düşük dozun kanama ve dispne riski ile ilişkili olarak daha iyi güvenlilik profiline ve tolerabiliteye sahip olduğuna dair kanıtlar bulunmaktadır. Bu nedenle, ASA ile birlikte yalnızca günde iki kez uygulanan BRILINTA 60 mg MI öyküsü olan ve aterotrombotik olay gelişimi açısından yüksek risk taşıyan hastalarda aterotrombotik olayların (KV ölüm, MI ve inme) önlenmesi için önerilmektedir.
NRA).
Birinci günden 360. güne kadar (%17 NRA) ve 361 gün ve sonrasındaki (%16 NRA) bileşik sonlanım noktası NRA'ları benzerdir. Uzatılmış tedaviden 3 yıl sonrasında tikagrelora ait etkililik ve güvenlilik verileri sınırlıdır.
MI'den sonra 2 yıldan fazla bir sürede klinik olarak stabil olan hastalarda veya önceki ADP reseptör inhibitörü tedavisi bırakıldıktan sonra bir yıldan fazla süre geçtiğinde günde iki kere tikagrelor 60 mg uygulandığında fayda olduğu yönünde kanıt söz konusu olmamıştır (KV ölüm, MI ve inmede birincil bileşik sonlanım noktasında azalma yoktur; ancak majör kanamada artış vardır) (ayrıca Bkz. Bölüm 4.2).
Klinik güvenlilik
Kanama ve dispne nedeniyle tikagrelor 60 mg ile tedaviyi kesme oranı, >75 yaş hastalarda (%42), daha genç hastalar (%23 - %31 aralığında) ile karşılaştırıldığında daha yüksek olmuş,
>75 yaş hastalarda plaseboya karşın fark %10'dan yüksek bulunmuştur (%42'ye karşın %29).
THEMIS çalışması (PKG Öyküsü ile Birlikte KAH ve tip 2 DM Bulunan Hastalar)
THEMIS çalışması, KAH ve tip 2 DM'li hastalarda tek başına ASA tedavisine kıyasla düşük doz ASA (75-150 mg) ile kombine BRILINTA ile aterotrombotik olayların önlenmesini değerlendirmeye yönelik 19220 hastadan oluşan, olay odaklı, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli bir çalışmadır. Medyan tikagrelor tedavi süresi 33,2 aydır.
50 yaş veya üzerinde, PKG (çalışma popülasyonunun %58'i) veya CABG (%29) öyküsü olan veya koroner revaskülarizasyon öyküsü bulunmayan ve KAH olarak tanımlanan, ancak en az 1 koroner arterde ≥ %50 lümen stenozuna ilişkin anjiyografik kanıt bulunan (%20) ve çalışma başlamadan önce en az 6 ay süreyle glukoz düşürücü ilaçla tedavi edilen tip 2 DM hastası çalışmaya uygundur.
MI veya inme öyküsü olması; ADP reseptör antagonistlerinin planlanmış kullanımı, ASA tedavisi günde iki kez >150 mg, dipiridamol veya silostazol kullanımı; planlanmış koroner, serebrovasküler veya periferik arteriyel revaskülarizasyon veya dar terapötik indeks veya güçlü CYP3A4 inhibitörlerine sahip CYP3A4 substratlarının öngörülen kullanımı; bilinen yüksek kanama riski (örneğin, kronik oral antikoagülan ihtiyacı, bilinen kanama diyatezi, pıhtılaşma bozukluğu, yakın zamanda yapılan majör cerrahi, önceki intraserebral kanama veya son 6 ay içinde GI kanama öyküsü vb.) veya kalp pili ile tedavi edilmedikçe bradikardik olaylar; kontrolsüz hipertansiyon veya diyaliz gerektiren böbrek yetmezliği veya BRILINTA tedavisi almak için herhangi bir kontrendikasyonun bulunması halinde hastalar çalışmaya katılmak için uygun bulunmamıştır.
THEMIS çalışması, BRILINTA'ya medyan maruz kalma süresi 29,2 ay (33,2 ay) ile 57 aya kadar olan bir süre boyunca yürütülmüştür. Çalışma ilacına maruz kalma süresi ile ilgili olarak, 7322 (%76,6) hasta 12 ay, 6421 (%67,2) hasta 24 ay ve 4107 hasta (%43) 36 ay boyunca BRILINTA'ya maruz bırakılmıştır. 48 ayda, 1175 (%12,3) hasta BRILINTA'ya maruz bırakılmıştır. Hastalar, çalışma ilacının kesilip kesilmediğine bakılmaksızın çalışmanın sonlandırılmasına kadar takip edilmiştir.
Toplam THEMIS çalışma popülasyonunda, tek başına ASA ile karşılaştırıldığında ASA ile kombinasyon halinde BRILINTA tedavisi, %10'luk rölatif risk azalmasına (RRR) ve
%0,73'lük mutlak risk azalmasına (ARR) (36 aylık tedaviden sonra tedavi edilmesi gerekenlerin sayısı [NNT] 138) karşılık gelen 0,9 (%95 GA: 0,81, 0,99, p=0,0378) RO ile aterotrombotik olayların (bileşik sonlanım noktası: KV ölüm, MI ve inme) önlenmesiyle sonuçlanmıştır. Etki, KV ölümlerdefarkolmaksızın(RO:1,02, %95 GA: 0,88, 1,18), MI (RO
yönlendirilmiştir. BRILINTA, primer bileşik sonlanım noktasının bir parçası olarak
değerlendirilmeyen ikincil sonlanım noktalarından tüm nedenlere bağlı ölümde (RO 0,98, %95 GA 0,87, 1,10) hiçbir fark olmaksızın iskemik inme olaylarının sayısını azaltmıştır (RO 0,80,
%95 GA: 0,64, 0,99). Toplam THEMIS çalışma popülasyonunda BRILINTA'nın fayda-risk profili, BRILINTA kullanımını desteklemek açısından uygun görülmemiş ve bu nedenle toplam çalışma popülasyonu için bir endikasyon verilmemiştir.
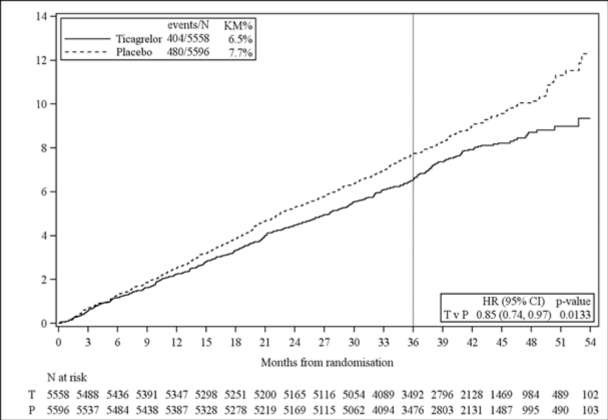
Toplam çalışma popülasyonunun %58'ine karşılık gelen önceden belirlenmiş bir alt grup olan PKG öyküsü olan THEMIS hastalarında, tek başına ASA ile karşılaştırıldığında ASA ile kombinasyon halinde BRILINTA tedavisi, aterotrombotik olayların önlenmesiyle sonuçlanmıştır (bileşik sonlanım noktası: KV ölüm, MI ve inme) (Bkz. Tablo 6). BRILINTA tedavisi %15 RRR, %1,19 ARR (36 aylık tedaviden sonra NNT 84) ve toplam THEMIS çalışma popülasyonundan daha olumlu bir fayda-risk profili sağlamıştır. Yine, tedavi yararı, bileşik sonlanım noktasının MI ve inme bileşenleri ile yönlendirilmiştir.
PKG öyküsü olan hasta alt grubundaki temel özellikler, her iki tedavi kolunda da benzerdir.
| Günde iki kez BRILINTA + ASA N=5558 | Tek başına ASA N=5596 |
%RRR |
Risk Oranı (RO) (%95 GA) |
p-değeri |
Özellik | Olayların görüldüğü hastalar | Olayların görüldüğü hastalar | |||
Primer sonlanım noktası | |||||
Bileşik KV Ölüm/MI/İnme | 404 (%7,3) | 480 (%8,6) | %15 | 0,85 (0,74, 0,97) | 0,0133 |
KV ölüm | 174 (%3,1) | 183 (%3,3) | %4 | 0,96 (0,78, 1,18) | 0,6803 |
MI | 171 (%3,1) | 216 (%3,9) | %20 | 0,80 (0,65, 0,97) | 0,0266 |
İnme | 96 (%1,7) | 131 (%2,3) | %26 | 0,74 (0,57, 0,96) | 0,0243 |
Sekonder sonlanım noktası | |||||
KV ölüm | 174 (%3,1) | 183 (%3,3) | %4 | 0,96 (0,78, 1,18) | - |
MI | 171 (%3,1) | 216 (%3,9) | %20 | 0,80 (0,65, 0,97) | - |
İskemik İnme | 88 (%1,6) | 113 (%2,0) | %21 | 0,79 (0,59, 1,04) | - |
Tüm nedenlere bağlı ölüm | 282 (%5,1) | 323 (%5,8) | %12 | 0,88 (0,75, 1,03) | - |
Tablo 6 â PKG öyküsü olan THEMIS hastaları alt grubunda primer ve sekonder etkililik sonlanım noktalarının analizi (tam analiz seti)
RO ve p-değerleri, günde iki kez tek başına ASA karşısında BRILINTA + ASA için tedavinin tek açıklayıcı değişken olduğu Cox orantısal risk modelinden hesaplanır.
KV ölüm, MI ve inme bileşenleri için ilk olayların sayısı, her bir bileşen için ilk olayların fiili sayısıdır ve bileşik sonlanım noktasındaki olayların sayısına eşit değildir.
GA = Güven aralığı; KV = Kardiyovasküler; RO = Risk oranı; MI = Miyokard infarktüsü; N = Tedavi grubundaki hasta sayısı; RRR = Bağıl risk düşüşü.
a p-değerleri nominaldir.
b Onayı geri çeken hastalarda kamuya açık hayati durum verilerine dayanan ölümleri içerir.
KAH, tip 2 DM ve PKG öyküsü bulunan hastalarda BRILINTA ile tedaviye, hasta üç yıla kadar yüksek aterotrombotik olay riski ve düşük kanama riski altında olduğu sürece devam edilmelidir. Etkililik ve güvenlilik verileri, BRILINTA'nın faydalarının, üç yıllık uzun süreli tedaviden sonra halen risklere ağır basıp basmadığını belirlemek için yetersizdir.
Risk taşıyan hasta sayısı
Randomizasyondan sonra aylar
% Kümülatif
Şekil 3 â PKG öyküsü olan THEMIS hastalarında KV ölüm, MI ve inmenin primer klinik bileşik sonlanım noktasının Kaplan-Meier grafiği ve analizi (tam analiz seti)
Pediyatrik popülasyon
Randomize, çift kör, paralel gruplu bir Faz III çalışmasında (HESTIA 3), orak hücre hastalığı olan 193 pediyatrik hasta (2 ila 18 yaş altı), vücut ağırlığına bağlı olarak günde iki kez 15 mg ila 45 mg dozlarında plasebo veya tikagrelor alacak şekilde randomize edilmiştir. Tikagrelor, kararlı durumda doz öncesi %35 ve dozdan 2 saat sonra %56 medyan trombosit inhibisyonu ile
sonuçlanmıştır.
Plasebo ile karşılaştırıldığında, tikagrelorun vazo-okluzif krizlerin oranı üzerinde faydalı bir tedavi edici etkisi olmamıştır.
Avrupa İlaç Ajansı, akut koroner sendromlar (AKS) ve miyokard enfarktüsü (MI) öyküsüne sahip pediyatrik popülasyonun tüm alt kümelerinde BRILINTA ile çalışma sonuçlarını sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım hakkında bilgi için Bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Tikagrelorun emilimi, medyan tdeğeri ile yaklaşık 1,5 saat olup hızlıdır. Tikagrelorun dolaşımdaki başlıca metaboliti AR-C124910XX'in (aynı zamanda aktif metaboliti) oluşumu yaklaşık 2,5 saat medyan tdeğeri ile hızlıdır. 90 mg tikagrelorun sağlıklı gönüllülere aç karnına oral yolla uygulanmasının ardından Cdeğeri 529 ng/mL ve EAA değeri 3451 ng*s/mL'dir. Ana metabolit oranları Ciçin 0,28 ve EAA için 0,42'dir. MI öyküsü olan hastalarda tikagrelor ve AR-C124910XX'in farmakokinetiği, AKS popülasyondaki ile genel olarak benzer olmuştur. PEGASUS çalışmasının popülasyon farmakokinetik analizine dayalı olarak, medyan tikagrelor Cdeğeri 391 ng/mL ve tikagrelor 60 mg için kararlı durumda EAA değeri 3801 ng*s/mL'dir. Tikagrelor 90 mg için kararlı durumda C627 ng/mL ve EAA 6255 ng*s/mL'dir.
Tikagrelorun ortalama mutlak biyoyararlanımı %36 olarak tahmin edilmektedir. Yüksek oranda yağ içeren bir öğünün alınması, tikagrelor EAA değerinde %21'lik artışa ve aktif metabolitin Cdeğerinde %22'lik düşüşe neden olmuştur; fakat tikagrelorun Cdeğerinde veya aktif metabolitin EAA değeri üzerinde herhangi bir etkisi olmamıştır. Bu küçük değişikliklerin minimal klinik öneme sahip olduğu düşünülmektedir; bu nedenle tikagrelor aç veya tok karnına alınabilir. Gerek tikagrelor gerekse aktif metaboliti P-gp substratlarıdır.
Ezilmiş ve suyla karıştırılmış tikagrelor tabletler, oral olarak ya da bir nazogastrik tüp aracılığıyla mideye uygulandığında, tikagrelorun ve aktif metabolitin EAA ve Cdeğerleri göz önünde bulundurulduğunda tam tabletlerle benzer bir biyoyararlanıma sahip oldukları görülmektedir. Ezilmiş ve suyla karıştırılmış tikagrelor tabletlerden başlangıç maruziyeti (dozdan 0,5 ve 1 saat sonra) tam tabletlere kıyasla daha yüksek olmuş, daha sonra (2 ila 48 saat) genellikle benzer bir konsantrasyon profili ortaya çıkmıştır.
Dağılım
Tikagrelorun kararlı durum dağılım hacmi 87,5 litredir. Tikagrelor ve aktif metaboliti insan plazma proteinine büyük ölçüde bağlanır (>%99).
Biyotransformasyon
CYP3A4, tikagrelorun metabolizmasından ve aktif metabolitin oluşumundan sorumlu majör enzimdir ve diğer CYP3A substratları ile etkileşimleri aktivasyondan inhibisyona kadar değişebilir.
Tikagrelorun majör metaboliti AR-C124910XX olup, aynı zamanda trombosit P2YADP-reseptörüne in vitro bağlanması değerlendirildiğinde aktif olduğu da belirlenmiştir. Aktif metabolite sistemik maruziyet, tikagrelor için elde edilenin yaklaşık olarak %30-40'ıdır.
Eliminasyon
Tikagrelor eliminasyonunun primer yolu hepatik metabolizmadır. Radyoaktif işaretli tikagrelor uygulandığında, radyoaktivitenin ortalama geri eldesi yaklaşık olarak %84'tür (feçeste %57,8, idrarda %26,5). Tikagrelor ve aktif metabolitinin her ikisinin de idrardan geri eldesi dozun
%1'inden daha azdır. Aktif metabolit için primer eliminasyon yolu ağırlıklı olarak safra ile atılımdır. Ortalama ttikagrelor için yaklaşık olarak 7 saat ve aktif metabolit için 8,5 saattir.
Doğrusallık/Doğrusal olmayan durum
Tikagrelor doğrusal farmakokinetik sergiler ve tikagrelora ve aktif metabolite (AR-C124910XX) maruziyet 1260 mg'a kadar yaklaşık olarak dozla orantılıdır.
Özel popülasyonlar:
Yaşlı hastalarda
Popülasyon farmakokinetik analizine göre yaşlı (≥75 yaş) AKS hastalarında daha genç hastalara kıyasla tikagrelora (Cve EAA'nın her ikisi için yaklaşık %25) ve aktif metabolite daha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir (Bkz. Bölüm 4.2).
Pediyatrik hastalarda
Orak hücre hastalığı olan çocuklarla ilgili sınırlı veri mevcuttur (Bkz. Bölüm 4.2 ve 5.1).
HESTIA 3 çalışmasında, 2 ila 18 yaşından küçük, ≥ 12 ila ≤ 24 kg, >24 ila ≤ 48 kg ve >48 kg olan hastalara, pediyatrik dağılabilir 15 mg tabletler olarak sırasıyla günde iki kez 15, 30 ve 45 mg dozlarında tikagrelor verilmiştir. Popülasyon farmakokinetik analizi ışığında, kararlı durumda ortalama EAA 1095 ng*sa/mL ile 1458 ng*sa/mL arasında ve ortalama C143 ng/mL ile 206 ng/mL arasında değişmiştir.
Cinsiyet
Erkeklere kıyasla kadınlarda tikagrelora ve aktif metabolitine daha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir.
Böbrek yetmezliği
Böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında ağır derecede böbrek yetmezliği olan hastalarda (kreatinin klirensi <30 mL/dakika) tikagrelora maruziyet yaklaşık
%20 daha düşüktür ve aktif metabolite maruziyet yaklaşık %17 daha yüksektir.
Hemodiyaliz uygulanmakta olan terminal evre böbrek yetmezliğine sahip hastalarda diyaliz uygulanmayan bir günde uygulanan tikagrelor 90 mg'nin EAA ve Cdeğerinin normal böbrek fonksiyonuna sahip gönüllülerdekine kıyasla %38 ve %51 daha yüksek olduğu görülmüştür. Tikagrelorun diyalizle temizlenebilir olmadığını gösterir şekilde, tikagrelor diyalizden hemen önce uygulandığında maruziyette benzer bir artış gözlenmiştir (sırasıyla %49 ve %61). Aktif metabolite maruziyet daha düşük boyutta artış sergilemiştir (EAA %13-14, C%17-36). Terminal evre böbrek yetmezliği bulunan hastalarda tikagrelorun trombosit agregasyonu inhibisyonu (IPA) etkisinin diyalizden bağımsız olduğu ve normal böbrek fonksiyonuna sahip gönüllülerdekiyle benzer olduğu görülmüştür (Bkz. Bölüm 4.2).
Karaciğer yetmezliği
Eşlenmiş sağlıklı gönüllülerle karşılaştırıldığında hafif derecede karaciğer yetmezliği olan hastalarda tikagrelor için Cve EAA değerleri sırasıyla %12 ve %23 daha yüksektir; bununla
birlikte tikagrelorun TAİ etkisi iki grup arasında benzerdir. Hafif derecede karaciğer yetmezliği
olan hastalarda doz ayarlaması gerekli değildir. Tikagrelor, ağır derecede karaciğer yetmezliği
olan hastalarda çalışılmamış olup, orta derecede karaciğer yetmezliği olan hastalarla ilgili farmakokinetik bilgi bulunmamaktadır. Başlangıçta bir veya daha fazla karaciğer fonksiyonu testinde orta veya şiddetli yükselmesi olan hastalarda tikagrelor plazma konsantrasyonları, başlangıçta yükselmeleri olmayan hastalar ile karşılaştırıldığında ortalama olarak benzer veya hafif şekilde daha yüksek olmuştur. Orta derecede karaciğer yetmezliği olan hastalarda herhangi bir doz ayarlaması önerilmemektedir (Bkz. Bölüm 4.2 ve 4.4).
Irk
Beyaz ırktan hastalarla kıyaslandığında Asya kökenli hastalarda ortalama biyoyararlanım %39 daha yüksektir. Beyaz ırktan hastalarla kıyaslandığında tikagrelorun biyoyararlanımı kendilerini siyah ırk olarak tanımlayan hastalarda %18 daha düşük; klinik farmakoloji çalışmalarında beyaz ırkla kıyaslandığında Japon gönüllülerde tikagrelore maruziyet (Cve EAA) yaklaşık %40 (vücut ağırlığı için ayarlandıktan sonra %20) daha yüksektir. Kendilerini İspanyol veya Latin kökenli olarak tanımlayan hastalarda maruziyet beyaz ırk ile benzerdir.
5.3. Klinik öncesi güvenlilik verileri
Tikagrelor ve majör metaboliti için klinik öncesi veriler, güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesi ve genotoksik potansiyel konvansiyonel çalışmalara dayalı olarak insanlar için kabul edilemez riskli advers etkiler göstermemiştir.
Çeşitli hayvan türlerinde klinik açıdan anlamlı maruziyet düzeylerinde gastrointestinal iritasyon gözlenmiştir (Bkz. Bölüm 4.8).
Dişi sıçanlarda yüksek dozda tikagrelor uterus tümörleri (adenokarsinomalar) insidansında artış ve hepatik adenomların insidansında artış göstermiştir. Uterus tümörlerinin mekanizması olasılıkla sıçanlarda tümörlere neden olan hormonal dengesizliktir. Hepatik adenomların mekanizması olasılıkla karaciğerde kemirgenlere özgü enzim indüksiyonudur. Dolayısıyla, karsinojenisite bulgularının insanlarla ilişkisinin olası olmadığı düşünülmektedir.
Sıçanlarda maternal toksik dozda (güvenlilik sınırı 5,1) minör gelişimsel anomaliler görülmüştür. Tavşanlarda yüksek dozda dişilerin fetüslerinde, maternal toksisite görülmeksizin (güvenlilik sınırı 4,5) karaciğer olgunlaşmasında ve iskelet gelişiminde hafif bir gecikme görülmüştür.
Sıçanlar ve tavşanlar üzerinde yürütülen çalışmalar, anne vücut ağırlığı artışında hafif azalma ve gecikmiş doğum ile yenidoğan yaşama kapasitesi ve doğum ağırlığında azalma ile üreme toksisitesi göstermiştir. Tikagrelor dişi sıçanlarda düzensiz siklüslere (genellikle uzamış siklüsler) neden olmuş; fakat erkek ve dişi sıçanlarda genel fertiliteyi etkilememiştir. Radyoaktif işaretli tikagrelor ile yürütülen farmakokinetik çalışmalar, ana bileşiğin ve metabolitlerinin, sıçanların sütü ile atıldığını göstermiştir (Bkz. Bölüm 4.6).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol (E421) Dibazik kalsiyum fosfat Sodyum nişasta glikolat
Hidroksipropil selüloz (E463)
Magnezyum stearat (E470b)
Hidroksipropil metilselüloz (Hipromelloz 2910 (E464)) Titanyum dioksit (E171)
Polietilen glikol 400 Siyah demir oksit (E172)
Kırmızı demir oksit (E172)
6.2. Geçimsizlikler
Bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30oC'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Karton kutu içinde 56 (4x14 tablet) tabletlik PVC-PVDC/Al transparan takvimli blister (güneş/ay sembolleri ile birlikte) ambalajda.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikleriâne uygun olarak imha edilmelidir.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BRILINTA | 8699786090286 | 981.70TL |
| CAMILLA | 8699536092898 | 981.62TL |
| GOLWAX | 8699514094678 | |
| TALDEROL | 8699527090995 | 977.42TL |
| TICASA | 8699540025684 | 890.12TL |
| Diğer Eşdeğer İlaçlar |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 890.05 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 890.05 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699786092785 |
| Etkin Madde | Tikagrelor |
| İthal ( ref. ülke : Isvec ) ve Beşeri bir ilaçdır. |