BUTINUP 12.5 mg sert kapsül (28 kapsül) Farmakolojik Özellikler
{ Sunitinib Maleat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antinoeplastik ilaçlar, protein kinaz inhibitörleri ATC kodu: L01XE04
Sunitinib; tümör gelişiminde, neoanjiyogenezde ve kanserin metastatik progresyonunda rol oynayan bir çok tirozin kinaz reseptörünü (TKR) inhibe eder. Sunitinib trombosit kaynaklı büyüme faktörü reseptörleri (PDGFRα ve PDGFRβ), VEGF reseptörleri (VEGFR1, VEGFR2 ve VEGFR3), kök hücre faktör reseptörü (KIT), Fms-tipi tirozin kinaz-3 (FLT3), koloni uyarıcı faktör reseptörü (CSF- 1R) ve glial hücre kaynaklı nörotrofik faktör reseptörünün (RET) inhibitörü olarak tanımlanmıştır. Başlıca metaboliti olan desetil sunitinibin, biyokimyasal ve hücresel testlerde sunitinibe benzer etkide olduğu gösterilmiştir.
Klinik Çalışmalar
Sunitinibin klinik güvenlilik ve etkililiği imatinibe toleransı olmayan veya imatinib rezistan olan (imatinib tedavisi süresince veya sonrasında hastalık progresyonu görülen) malign gastrointestinal stromal tümörlü (GİST) hastaların tedavisinde ve metastatik renal hücre karsinomlu (mRHK) hastaların tedavisinde ve anrezektabl pNET olan hastaların tedavisinde araştırılmıştır.
Etkililik; GİST'de tümör progresyonuna kadar geçen süreyi (TTP) ve sağkalımdaki artışı, tedavi uygulanmamış mRHK için progresyonsuz sağkalımı ve sitokine dirençli mRHK için objektif yanıt oranlarını, pNET için de progresyonsuz sağkalımı temel almıştır.
Gastrointestinal Stromal Tümörler (GİST)
![]()
hafta ara vermek suretiyle (''4/2 şeması'') 50 mg olarak almıştır. Bu çalışmada medyan TTP
34,0 haftadır ( %95 GA = 22,0 hafta-46,0 hafta).
İmatinibi tolere edemeyen veya imatinib (medyan maksimum günlük doz 800 mg) ile tedavi esnasında veya sonrasında hastalık progresyonu görülen GİST'i olan hastalarda randomize, çift- kör ve plasebo-kontrollü bir faz III çalışma gerçekleştirilmiştir. Bu çalışmada 312 hasta, hastalık progresyonu veya çalışmadan başka bir sebeple çekilme olmadığı sürece 50 mg Sunitib veya plaseboyu ağızdan günde bir kez ve 4/2 şemasına göre alacak şekilde randomize (2:1) edilmiştir (hastaların 207'si Sunitinib, 105'i plasebo almıştır). Çalışmanın primer etkililik sonlanım noktası, randomizasyondan objektif tümör progresyona kadar geçen süre olarak tanımlanan TTP idi.
Önceden belirlenen ara dönem analizinde, Sunitinib için medyan TTP (progresyona kadar geçen süre) araştırmacı değerlendirmesinde 28,9 hafta (%95 GA=21,3-34,1 hafta) ve bağımsız değerlendirmeye göre 27,3 hafta (%95 GA=16,0-32,1) olup, plasebo kolundaki araştırmacı değerlendirmesine göre 5,1 haftalık (%95 GA=4,4-10,1), bağımsız değerlendirmedeki 6,4 haftalık (%95 GA=4,4-10,0) TTP'den istatistiksel anlamlı olarak daha uzun olmuştur. Genel sağkalım (OS)'deki fark istatistiksel olarak sunitinib lehinedir [HR: 0,491 (%95 GA:0,290- 0,831)]. Ölüm riski sunitinib koluyla karşılaştırıldığında plasebo kolunda 2 kat fazladır.
Etkililik ve güvenlilik interim analiz sonuçları sonrası çalışma körlemeden çıkarılmış ve plasebo kolundaki hastalara açık etiketli sunitinib tedavisi önerilmiştir.
Başta plasebo alan 99 hastada dahil çalışmanın açık etiketli tedavi fazında toplam 255 hasta sunitinib almıştır.
Çalışmanın açık etiket fazındaki primer ve sekonder sonlanım noktası analizleri zamanında elde edilen interim analiz sonuçlarını doğrulamıştır (Bkz. Tablo 1).
Tablo 1 GİST etkilik sonlanım noktası özetleri (ITT popülasyonu)
| Çift-kör tedavi |
| |||
| Medyan (% 95 GA) | Risk Oranı | Plasebo / Çapraz geçiş grubu tedavi | ||
Sonlanım noktası | Sunitinib | Plasebo | (% 95 GA) | p | |
Primer |
| ||||
TTP (hafta) |
| ||||
Ara | 27,3 (16,0-32,1) | 6,4 (4,4-10,0) | 0,329 (0,233-0,466) | <0,001 | - |
Final | 26,6 (16,0-32,1) | 6,4 (4,4-10,0 ) | 0,339 (0,244-0,472) | <0,001 | 10,4 (4,3-2,0) |
Sekonder |
| ||||
PFS (hafta) |
| ||||
Ara | 24,1 (11,1-28,3) | 6,0 (4,4-9,9) | 0,333 (0,238-0,467) | <0,001 | - |
Final | 22,9 (10,9-28,0) | 6,0 (4,4-9,7) | 0,347 (0,253-0,475) | <0,001 | - |
ORR (%) |
| ||||
Ara | 6,8 (3,7-11,1) | 0 (-) | NA | 0,006 | - |
Final | 6,6 (3,8-10,5) | 0 (-) | NA | 0,004 | 10,1 (5,0-17,8) |
OS (hafta) |
| ||||
Ara | - | - | 0,491 (0,290-0,831) | 0,007 | - |
Final | 72,7 (61,3-83,0) | 64,9 (45,7-96,0) | 0,876 (0,679-1,129) | 0,306 | - |
Kısaltmalar: GA = güven aralığı;ITT=tedavisi amaçlananhasta; NA = uygulanamaz; ORR =
Başlangıç noktası, çaprazlama olduğunda sıfırlanmış ve etkililik analizleri araştırmacının değerlendirmesi baz alınarak yapılmıştır.
ITT popülasyonundaki medyan OS sunitinib ve plasebo kollarında sırasıyla 72,7 hafta ve 64,9 haftadır (HR 0,876, %95 GA: 0,679-1,129, p = 0,306). Bu analizde plasebo kolu daha önceden açık etiketli sunitinib tedavisi almış ve plaseboya randomize edilmiş hastaları içermektedir.
Tedavi edilmemiş renal hücreli karsinomu (mRHK)
Tedavi-edilmemiş mRHK'li hastalarda tek ajan olarak sunitinib ve IFN-α'yı karşılaştıran bir faz III randomize çalışma yapılmıştır. Yedi yüz elli (750) hasta ya sunitinib ile tekrarlayan 6 haftalık siklüsler halinde 4 hafta 50 mg günlük oral doz takiben 2 hafta dinlenme (4/2 doz şeması) veya ilk hafta 3 milyon ünite (MU) ikinci hafta 6 MU ve üçüncü hafta 9 MU ve bundan sonra her hafta ardışık olmayan günlerde subkütan olarak IFN-α almak üzere randomize edilmiştir (1:1).
Sunitinib tedavisinin medyan süresi 11,1 ay (0,4-46,1 aralığında), IFN-α tedavisinin medyan süresi ise 4,1 aydır (0,1-45,6 aralığında). Tedavi ile alakalı ciddi yan etkiler sunitinib ve IFN-α alan hastalarda sırasıyla %23,7 ve %6,9 olarak raporlanmıştır. Bunun yanında yan etkilerden dolayı tedavinin yarım bırakılma oranı sunitinib için %20 iken IFN-α için %23'dür. Doz kesilmesi sunitinib kullanan 202 hastada (%54) görülmüşken IFN-α kullanan hastalarda bu sayı 141'dir (%39). Doz azaltılması ise sunitinib ve IFN-α kullanan hastaların sırasıyla 194 (%52) ve 98 (%27)'inde görülmüştür. Hastalar progresyon görülene kadar ya da tedaviden çıkarılana kadar tedavi edilmişlerdir.
Primer etkililik sonlanım noktası progresyonsuz sağkalımdır (PFS). Planlı bir ara analiz, sunitinib için IFN-α'nın üstünde istatistiksel olarak anlamlı bir avantaj göstermiştir. Bu çalışmada medyan PFS sırasıyla 47,3 ve 22,0; HR 0,415'tir. (%95 GA: 0,320-0,539, p<0,001). Diğer sonlanım noktaları objektif yanıt oranı (ORR), OS ve güvenliliktir. Primer sonlanım noktası elde edildikten sonra çekirdek radyolojik değerlendirmeye devam edilmemiştir. Final analizde araştırıcının değerlendirmesi ile ORR sunitinib kolu için %46 (%95 GA: 41-51) IFN- α kolu için %12 (%95 GA: 9-16) olarak belirlenmiştir (p<0,001).
IFN-α ile karşılaştırıldığında sunitinib tedavisi daha uzun sağkalım süreleriyle ilişkilendirilmiştir. Medyan OS sunitinib kolu için 114,6 hafta (%95 GA: 100,1-142,9) ve IFN- α kolu için 94,9 hafta (%95 GA: 77,7-117,0) olmuştur [HR= 0,821 (%95 GA: 0,673-1,001); log-rank testi ile p=0,0510.]
ITT popülasyonunda gözlemlenen ve çekirdek radyolojik laboratuvar değerlendirmesine ile belirlenen genel PFS ve OS tablo 2'de özetlenmiştir:
Tablo 2 â Daha önce tedavi edilmemiş mRHK etkililik sonlanım noktası özetleri (ITT popülasyonu)
PFS özeti | Sunitinib (N = 375) | IFN-α (N = 375) |
Progrese olmayan veya ölen hastalar [n (%)] | 161 (42,9) | 176 (46,9) |
Progrese olmayan veya ölen hastalar [n (%)] | 214 (57,1) | 199 (53,1) |
PFS (hafta) | ||
Çeyrek (%95 GA) | ||
%25 | 22,7 (18,0-34,0) | 10,0 (7,3-10,3) |
%50 | 48,3 (46,4-58,3) | 22,1 (17,1-24,0) |
%75 | 84,3 (72,9-95,1) | 58,1 (45,6-82,1) |
Tabakalandırılmamış analiz | ||
Risk oranı(sunitinib vs IFN-α) | 0,5268 | |
Risk oranı için %95 GA | (0,4316-0,6430) | |
p-değeri |
| <0,0001 |
OS özeti | Sunitinib (N = 375) | IFN-α (N = 375) |
Progrese olmayan veya ölen hastalar [n (%)] | 185 (49,3) | 175 (46,7) |
Progrese olmayan veya ölen hastalar [n (%)] | 190 (50,7) | 200 (53,3) |
OS (hafta) | ||
Çeyrek (%95 GA) | ||
%25 | 56,6 (48,7-68,4) | 41,7 (32,6-51,6) |
%50 | 114,6 (100,1-142,9) | 94,9 (77,7-117,0) |
%75 | NA (NA-NA) | NA (NA-NA) |
Tabakalandırılmamış analiz | ||
Risk oranı (sunitinib vs IFN- α) | 0,8209 | |
Risk oranı için %95 GA | (0,6730-1,0013) | |
p-değeri | 0,0510 | |
Kısaltmalar: GA = güven aralığı; IFN-α = interferon-alfa; ITT = tedavisi amaçlanan hasta; N = hasta sayıs ı;
NA = uygulanamaz; OS = genel sağkalım; PFS = progresyonsuz sağkalım
Sitokin-refrakter metastatik renal hücreli karsinom
Sunitinib ile bir faz 2 çalışma gerçekleştirilmiştir. Çalışma interleukin-2 ya da IFN-α ile birlikte önceki sitokin tedavisine refrakter hastaları kapsamaktadır. 63 hasta 50 mg oral sunitinib (6 haftalık tamamlanmış siklüs-4 hafta boyunca günde bir kere ve takiben 2 hafta dinlenme periyodu (4/2 doz şeması)) ile başlamıştır. Primer sonlanım noktası ORR'dir. RECIST (solid tümörlerde yanıt değerlendirme kriteri) kriterlerine göre belirlenmiştir.
Bu çalışmada objektif yanıt oranı % 36,5'dır (%95 GA: %24,7-%49,6). Progresyona kadar geçen süre (TTP) 37,7 haftadır (%95 GA: 24,0-46,4 hafta).
Açık etiketli, tek kollu, çokmerkezli,doğrula yıcı birçalışmada sunitinibin etkililik ve
hasta 4/2 şemasına göre en az 1 doz 50 mg sunitinib almıştır.
Bu çalışmanın primer sonlanım noktası ORR'dir. Sekonder sonlanım noktası TTP, yanıt süresi (DoR) ve OS'yi içermektedir. Bu çalışmada ORR %35,8 (%95 GA: %26,8-%47,5). Medyan DoR'ye ve OS'ye henüz ulaşılamamıştır.
Pankreatik nöroendokrin tümörler (pNET)
Destekleyici faz 2, açık etiketli, çok merkezli çalışma, rezektabl olmayan pNET'li hastalarda günde tek ajan olarak sunitinibin etkililiğini ve güvenliliğini, 4/2 şemasında [4 haftalık tedavi, 2 haftalık dinlenme periyodu, günde bir kere 50 mg] değerlendirdi. 66 hastanın pankreatik adacık hücreli tümör kohortunda birincil sonlanım noktası yanıt oranı %17 idi.
Unrezektabl pNET olan hastalarda tek başına sunitinib ile ilgili faz III, çok merkezli, uluslararası, randomize, çift kör plasebo kontrollü bir pivot çalışma yapılmıştır.
Hastalar, RECIST'e dayalı olarak, önceki 12 ay içinde belgelenmiş progresyona ihtiyaç duydu ve planlanmış bir istirahat dönemi (n = 86) veya plasebo (n = 85) olmadan, günde bir kez 37,5 mg sunitinib almak üzere randomize edildi (1: 1).
Primer objektif, plasebo alan hastalara karşı sunitinib alan hastalarda PFS'yi karşılaştırmaktı. Diğer sonlanım noktaları arasında OS, ORR, Hasta Tarafından Bildirilen Sonuçlar ve güvenlik yer almaktadır.
Demografik veriler, sunitinib ve plasebo grupları arasında karşılaştırılabilir düzeydeydi. Buna ek olarak, sunitinib hastalarının %49'unda plasebo hastalarının %52'sinde fonksiyonel olmayan tümörler vardı ve her iki kolun %92'sinde karaciğer metastazı vardı.
Çalışmada somatostatin analoglarının kullanımına izin verildi.
Sunitinib hastalarının toplam %66'sı buna karşın plasebo hastalarının %72'si daha önce sistemik tedavi aldı. Buna ek olarak, sunitinib hastalarının %24'ü plasebo hastalarının ise %22'si somatostatin analogları almıştır.
Plaseboya kıyasla sunitinib için araştırmacılar tarafından değerlendirilen PFS'de klinik olarak anlamlı bir avantaj gözlenmiştir. Medyan PFS, sunitinib kolunda 11,4 ay ve plasebo kolunda 5,5 ay olmuştur [risk oranı (nispi risk) : 0,418 (%95 GA 0,263-0,662), p = 0,0001].
Hastalığın progresyonunu belirlemek için RECIST'in araştırmacı tümör ölçümleri uygulanmasına dayanan türetilmiş tümör yanıt değerlendirmeleri yapıldığında benzer sonuçlar gözlemlenmiştir (Tablo 3). Değerlendirilen temel özelliklerin tüm alt gruplarında, önceki alınan sistemik tedavilerin sayısına göre bir analizi de içerecek şekilde sunitinib lehine bir risk oranı gözlenmiştir. Sunitinib kolunda 29 hasta ve plasebo kolunda 24 hasta önceden sistemik tedavi almadı; bu hastalardan PFS için risk oranı 0,365 (%95 GA: 0,156-0,857), p = 0,0156 idi. Benzer şekilde, sunitinib kolundaki 57 hastada (28'i önceden bir sistemik terapi ve 29'u önceden 2 veya daha fazla sistemik terapi almış) ve plasebo kolundaki 61 hastada (25'i önceden bir sistemik terapi ve 36'sı önceden 2 veya daha fazla sistemik terapi almış), PFS için risk oranı 0,456 (%95 GA: 0,264-0,787), p = 0,0036 idi.
ortaya koyarak birincil analizi desteklemiştir.
pNET ile ilgili pivot çalışma, bağımsız bir âİlaç İzleme Komitesiâ'nin önerisi üzerine erken sonlandırılmıştır ve birincil sonlanım noktası, her ikisi de tedavi etkisinin tahminlerini etkilemiş olan araştırmacı değerlendirmesine dayandırılmıştır.
PFS'nin araştırmacı temelli değerlendirmesinde yanlılığı bertaraf edebilmek için kör bağımsız merkez incelemesi yapıldı; bu inceleme araştırmacı değerlendirmesini desteklemiştir. Tablo 3'te gösterilmiştir.
Tablo 3 - Faz III çalışmasından elde edilen pNET etkinliği sonuçları
Etkililik parametresi | Sunitinib (n = 86) | Plasebo (n = 85) | HR (% 95 GA) | p-değeri |
Araştırmacı değerlendirmesine göre progresyonsuz sağkalım[medyan, aylar (%95 GA)] | 11,4 (7,4â19,8) | 5,5 (3,6â7,4) | 0,418 (0,263â 0,662) | 0,0001 |
Araştırıcı tümör değerlendirmelerine RECIST uygulanmasına dayanan türetilmiş tümör yanıtı değerlendirmesi ile progresyonsuz sağkalım[medyan, aylar (%95 GA)] |
12,6 (7,4â16,9) |
5,4 (3,5â6,0) |
0,401 (0,252â 0,640) |
0,000066 |
Tümör değerlendirmelerinin kör bağımsız merkez gözden geçirilmesiyle progresyonsuz sağkalım[medyan, aylar (%95 GA)], |
12,6 (11,1â20,6) |
5,8 (3,8â7,2) |
0,315 (0,181â 0,546) |
0,000015 |
Genel sağkalım [5 yıl takip] [medyan, aylar (%95 GA)] | 38,6 (25,6â56,4) | 29,1 (16,4â36,8) | 0,730 (0,504â 1,057) | 0,0940 |
Objektif yanıt oranı [%, (%95 GA)] | 9,3 (3,2â15,4) | 0 | NA | 0,0066 |
GA=Güven Aralığı, HR=Risk Oranı, NA=Uygulanamaz, pNET=Pankreatik Nöroendokrin Tümör
Şekil 1 â pNET Faz 3 çalışmasında, Kaplan Meier Progresyonsuz Sağkalım Grafiği
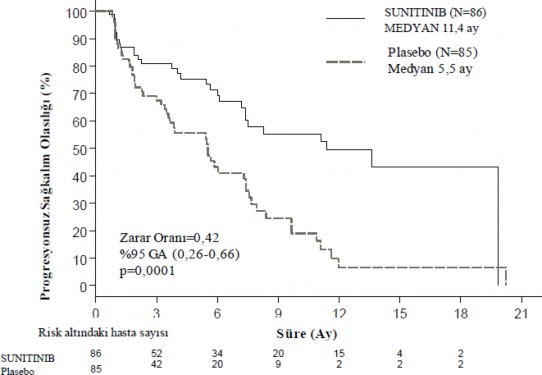
Kısaltmalar: GA=Güven Aralığı; N=Hasta Sayısı; PFS=Progresyonsuz Sağkalım; pNET=Pankreatik Nöroendokrin Tümör
OS verileri, çalışma sonunda olgunlaşmamıştır. Sunitinib kolu için [20,6 ay (%95 GA 20,6, NR) verileri, plasebo kolu için NR (%95 GA 15,5, NR) verileri ile karşılaştırıldığında risk oranı: 0,409 (%95 GA: 0,187-0,894), p-değeri = 0,0204]'dır. Sunitinib kolunda 9 ve plasebo kolunda 21 ölüm meydana gelmiştir.
Hastalık progresyonu sırasında hastalar körleştirilmemiştir ve plasebo alan hastalara, ayrı bir uzantı çalışmasında açık etiketli sunitinibe erişim sunulmuştur. Çalışmanın erken dönemde sonlanması nedeniyle, kalan hastalar körleştirilmemiştir ve bu hastalara, ayrı bir uzantı çalışmasında açık etiketli sunitinibe erişim sağlanmıştır. Plasebo kolundaki 85 hastadan (%69,4) 59'u, hastalığın ilerlemesi veya çalışma sonlanmasındaki körleme kalktıktan sonra açık etiketli sunitinibe geçti. Uzatma çalışmasında 5 yıllık izlem sonrasında gözlemlenen OS, 0,730 (%95 GA 0,504-1,057) risk oranını gösterdi.
Avrupa Kanser Araştırma ve Tedavisi Organizasyonu Yaşam Kalitesi Anketinden (EORTC QLQC-30) alınan sonuçlar; toplamda genel sağlık ile ilişkili yaşam kalitesinin ve beş fonksiyon alanının (fiziksel, rol, bilişsel, duygusal ve sosyal), sınırlı advers semptomatik etkilerle, plaseboya karşı sunitinib tedavisi alan hastalarda korunduğunu göstermiştir.
Progresif, ileri/metastatik, iyi diferansiye edilmiş, rezeke edilemeyen pNET'li hastalarda sunitinibin etkililiğini ve güvenilirliğini değerlendiren faz IV çok uluslu, çok merkezli, tek kollu, açık etiketli bir çalışma gerçekleştirildi.
Yüz altı hasta (hiçbir tedavi almamışkohortunda61hastavesonraki basamak kohortunda 45
tedavi gördü.
Araştırmacı tarafından değerlendirilen progresyonsuz sağkalım hem genel popülasyonda (%95 GA: 10,9-16,7) hem de hiçbir tedavi almamış kohortta (%95 GA: 7,4-16,8) 13,2 ay idi.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediyatrik hastalarda sunitinib kullanımına ilişkin deneyimler kısıtlıdır (Bkz. Bölüm 4.2).
Refrakter solid tümörleri olup, büyük bölümü primer beyin tümörü tanısı olan 35 hastada; 30'u pediyatrik hastalardan (3-17 yaş) ve 5'i genç erişkin hastalardan (18-21 yaş) oluşan, oral sunitinibe ilişkin, bir faz I doz artış çalışması gerçekleştirilmiştir. Çalışmanın birinci kısmında doz kısıtlayıcı kardiyotoksisite gözlenmiş ve bu nedenle önceden potansiyel kardiyotoksik tedaviler (antrasiklinler dahil) veya kardiyak radyasyon uygulanan hastalar dışlanacak şekilde düzeltme yapılmıştır. Daha önce kanser tedavisi alan fakat kardiyak toksisite açısından risk faktörleri bulunmayan hastaların yer aldığı çalışmanın ikinci kısmında, 4/2 şemasında günlük 15 mg/m2 dozunda (MTD) sunitinib genellikle tolere edilebilir ve klinik açıdan kontrol altına alınabilir olmuştur. Olguların hiçbirinde tam yanıt veya kısmi yanıt elde edilmemiştir. 6 hastada (%17) stabil hastalık gözlenmiştir. GİST'i olan bir hasta, 15 mg/m2 doz düzeyinde dahil edilmiş ve yarara ilişkin kanıt gözlenmemiştir. Gözlenen advers ilaç reaksiyonları genel olarak erişkinlerde görülenlere benzer bulunmuştur (Bkz. Bölüm 4.8).
HGG veya epandimomu bulunan, 27'si pediyatrik hastadan (3-16 yaş) ve 2'si genç erişkin hastadan (18-19 yaş) oluşan 29 hastada, faz II açık etiketli bir çalışma gerçekleştirilmiştir. Çalışma, hastalık kontrolünün olmaması nedeniyle planlı bir ara dönem analizi sırasında kapatılmıştır. Medyan PFS, HGG grubunda 2,3 ay ve epandimoma grubunda 2,7 ay olmuştur. Medyan genel OS, HGG grubunda 5,1 ay ve epandimoma grubunda 12,3 ay olmuştur. En yaygın (≥% 10) tedaviye bağlı advers olayların, her iki grupta kombine olarak nötrofil sayısının azalması (6 hasta [%20,7]) ve intrakraniyal hemoraji (3 hasta [%10,3]) olduğu bildirilmiştir
(Bkz. Bölüm 4.8).
Günde 15 mg/m2 ila 30 mg/m2 arasında değişen dozlarda 4/2 şemasına göre sunitinib alan, yaşları 13-16 arasında değişen GİST'i olan 6 pediyatrik hastada oral sunitinibin bir faz 1/2 çalışmasından elde edilen kanıtlar ve mevcut yayınlanmış veriler (GİST'i olan 20 pediyatrik veya genç erişkin hasta) sunitinib tedavisinin, 26 hastadan 18'inde (%69,2) hem imatinib yetersizliğinden veya intoleransından sonra (21 hastadan 16'sında stabil hastalık) hem de novo/cerrahi ameliyat sonrasında (5 hastadan 2'sinde stabil hastalık) hastalık stabilizasyonu sağladığı gözlenmiştir. Faz 1/2 çalışmasında, 6 hastanın 3'ünde stabil hastalık ve 3'ünde hastalık ilerlemesi gözlenmiştir (sırasıyla 1 hastaya neo adjuvan ve 1 hastaya adjuvan imatinib verilmiştir). Aynı çalışmada, 6 hastanın 4'ünde (%66,7) Grade 3-4 tedaviye bağlı advers olaylar (Grade 3 hipofosfatemi, nötropeni ve trombositopeninin her biri 1 hastada ve 1 hastada Grade 4 nötropeni) görülmüştür. Ek olarak, yayınlar, 5 hastada gözlenen şu Grade 3 advers ilaç reaksiyonları bildirmiştir: Yorgunluk (2), gastrointestinal advers ilaç reaksiyonları (diyare dahil) (2), hematolojik advers ilaç reaksiyonları (anemi dahil) (2), kolesistit (1), hipertiroidizm
(1) ve mukozit (1).
GİST'i olan pediyatrik hastalarda (6-17 yaş grubu) sunitinibin farmakokinetik (PK) ve kilit güvenlilik ile etkililik sonlanım noktalarının ekstrapolasyonu amacıyla, bir popülasyon PK ve farmakokinetik/farmakodinamik (PK/PD) analizi gerçekleştirilmiştir. Bu analizde GİST veya solid tümörleri olan erişkinlerden ve solid tümörleri olan pediyatrik hastalardan toplanan veriler temel alınmıştır. Modelleme analizleri doğrultusunda, küçük yaş ve düşük vücut ölçümlerinin
plazma ilaç maruziyetine güvenlilikveetkililikyanıtlarınıolum suz etkilemediği belirlenmiştir.
![]()
Sunitinib yarar/riskinin, küçük yaş veya düşük vücut ölçümlerinden olumsuz etkilenmediği ve
başlıca plazma ilaç maruziyetine bağlı olduğu görülmüştür.
Avrupa İlaç Ajansı, böbrek veya renal pelvis karsinomunun (nefroblastom, nefroblastomatoz, berrak hücreli sarkom, mezoblastik nefrom, renal medüller karsinom ve böbrek rabdoid tümörü hariç olmak üzere) tedavisinde çocuk nüfusun tüm alt gruplarında sunitinib ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etti (çocuklarda kullanım hakkında bilgi için bölüm 4.2'ye bakın).
Avrupa İlaç Ajansı, gastroenteropankreatik nöroendokrin tümörlerin (nöroblastom, nöroganglioblastoma, feokromasitom hariç) tedavisinde çocuk nüfusunun tüm alt gruplarında sunitinib ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etti (bkz. çocuklarda kullanım hakkında bilgi için bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerSunitinibin farmakokinetiği 135 sağlıklı gönüllüde ve solid tümörlü 266 hastada
değerlendirilmiştir. Her iki grupta da farmakokinetik benzerdir.
25-100 mg'lık doz aralığında plazma konsantrasyon-zaman eğrisi altındaki alan (EAA) ve Cmaks dozla orantılı olarak artar. Günlük tekrarlayan uygulamalarda sunitinib miktarı 3-4 katına çıkarken, primer metabolitinin miktarı 7-10 katına çıkar. Sunitinib ve primer aktif metabolitin kararlı durum konsantrasyonlarına 10-14 gün içinde ulaşılır. 14. gün itibariyle sunitinib ve aktif metabolitinin kombine plazma konsantrasyonları 62,9-101 ng/ml olup, bu konsantrasyonlar klinik verilerde öngörülen in vitro olarak reseptör fosforilasyonunu inhibe edecek ve in vivo olarak tümör stazı/büyümesini azaltacak hedef konsantrasyonlardır. Primer aktif metabolit toplam maruziyetin %23-%37'sini oluşturmaktadır. Tekrarlayan günlük uygulamalarda veya test edilen doz rejimlerinin tekrarlayan kürlerinde sunitinib veya primer aktif metabolitinin farmakokinetiğinde anlamlı değişiklikler olmamıştır.
Emilim:
Sunitinib ağızdan uygulanmasını takiben 6-12 saat (Tmaks) içinde maksimum konsantrasyona (Cmaks) ulaşır. Yiyeceklerin sunitinibin biyoyararlanımına herhangi bir etkisi yoktur.
Dağılım:
Sunitinib ve primer aktif metabolitinin in vitro çalışmalarda konsantrasyondan bağımsız olarak plazma proteinine bağlanma derecesi sırasıyla %95 ve %90 olmuştur. Sunitinib için dağılım hacmi (Vd), dokulara dağılımı gösterecek şekilde, büyüktür (2230 litre).
Metabolik etkileşimler
Test edilen tüm sitokrom P450 izoformları (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5, ve CYP4A9/11) için hesaplanan in vitro Ki değerleri; sunitinib ve primer aktif metabolitinin, bu enzimlerle metabolize olan diğer etkin maddelerin metabolizmasını indükleme ihtimalinin az olacağını göstermektedir.
Biyotransformasyon:
Sunitinib asıl olarak, bir sitokrom P450 enzimi olan CYP3A4 tarafından metabolize edilir. Primer aktif metaboliti desetil sunitinibtir ve bu metabolit tekrardan CYP3A4 tarafından metabolize edilir. Sunitinibin potent CYP3A4 indükleyicileri veya inhibitörleri ile birlikte kullanımı ile sunitinibin plazma düzeyi değişebileceğinden, birlikte kullanımından kaçınılmalıdır (Bkz. Bölüm4.4ve4.5).
Eliminasyon:
Atılım primer olarak feçes yoluyla (%61) gerçekleşir. Renal eliminasyon metabolitler ile birlikte uygulanan dozun %16'sıdır. Sunitinib ve primer aktif metaboliti plazmada, idrarda ve feçeste görülen ilaç bağlantılı esas bileşiklerdir ve sırasıyla %91,5, %86,4 ve %73,8 oranında görülmektedir. Minör metabolitler idrar ve feçeste görülmüş, ancak genellikle plazmada görülmemişlerdir. Total oral klerens (CL/F) 34-62 litre/saat olmuştur. Sağlıklı gönüllülere tek doz oral uygulamanın ardından sunitinibin terminal yarılanma ömrü yaklaşık olarak 40-60 saat iken, primer aktif desetil metabolitininki 80-110 saat olmuştur.
BCRP inhibitörü olan ilaçlarla birlikte kullanım
In vitro ortamda sunitinib, efluks taşıyıcı BCRP'nın substratıdır. A6181038 çalışmasında bir BCRP inhibitörü olan gefitinibin, sunitinib veya toplam ilacın (sunitinib + metabolit) Cve EAA değerleri üzerinde klinik olarak anlamlı bir etkisi olmamıştır (Bkz. Bölüm 4.5). Bu çalışma mRHK'lı hastalarda sunitinibin gefitinib ile birlikte kullanıldığında güvenlilik/tolere edilebilirliği, maksimum tolere edilen dozu ve antitümör aktivitesinin araştırıldığı çok merkezli, açık etiketli, faz 1/2 bir çalışmadır. Gefitinib (günlük 250 mg) ve sunitinib (4 hafta kullanım sonrası 2 hafta ara verecek şekilde günlük 37,5 mg [Kohort 1, n=4] veya 50 mg [Kohort 2, n=7]) birlikte uygulandığındaki farmakokinetikleri sekonder çalışma objektifi olarak değerlendirilmiştir. Sunitinib farmakokinetik parametrelerindeki değişiklikler klinik olarak anlamlı bulunmamış ve bir ilaç-ilaç etkileşimi olduğunu göstermemiştir; ancak göreceli düşük hasta sayısı (N=7+4) ve farmakokinetik parametrelerdeki hastalar arası varyasyonun orta- yüksek seviyede olması göz önüne alındığında, bu çalışmanın farmakokinetik ilaç-ilaç etkileşimi sonuçlarını değerlendirirken dikkatli olunması gerekmektedir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Sunitinib ve aktif metaboliti esas olarak karaciğer tarafından metabolize edilir. Hafif (Child- Pugh Sınıf A) veya orta (Child-Pugh Sınıf B) karaciğer yetmezliği olan hastalarda sunitinibin tek bir dozuna sistemik maruz kalım, normal karaciğer fonksiyonu olan deneklerle karşılaştırıldığında benzer olmuştur. Sunitinib, ciddi (Child- Pugh Sınıf C) karaciğer yetersizliği olan hastalarda çalışılmamıştır.
Çalışmalara ALT veya AST değerleri >2,5xULN (normalin en üst sınırı) veya karaciğer metastazı > 5,0 x ULN olan hastalar dahil edilmemiştir.
Böbrek yetmezliği:
Popülasyon farmakokinetik analizleri, kreatinin klerensi 42-347 ml/dak olan hastalarda, sunitinibin klerensinin değişmediğini göstermektedir. Tek doz sunitinib uygulamasından sonra, ciddi böbrek yetmezliği (kreatinin klerensi <30ml/dak) olan kişilerle normal renal fonksiyona (kreatinin klerensi >80ml/dak) sahip kişilerde sistemik maruziyet aynı olmuştur. Son evre böbrek yetmezliği hastalarında sunitinib ve primer metabolitinin hemodiyalizle eliminasyonu yapılamasa da, normal böbrek fonksiyonuna sahip kişilerle karşılaştırıldığında sistemik maruziyet sunitinib için %47, primer metaboliti için %31 daha az olmuştur.
Kilo ve performans durumu:
Demografik verinin popülasyon farmakokinetik analizi, vücut ağırlığı veya performans durumunda, başlangıç doz ayarlamalarının gerekli olmadığını gösterir.
![]()
az
Eldeki veriler kadınlarda görünür sunitinib klerensinin (CL/F) erkeklere oranla %30 daha
olduğunu göstermektedir; ancak bu fark başlangıç dozunun değiştirilmesini gerektirmemektedir.
Pediyatrik popülasyon
Pediyatrik hastalarda sunitinib kullanımına ilişkin deneyimler kısıtlıdır (Bkz. bölüm 4.2). GİST ve solid tümörleri olan erişkin hastaları ve solid tümörleri olan pediyatrik hastaları içeren toplu veritabanına ilişkin popülasyon PK analizleri tamamlanmıştır. Yaş ve vücut ölçümlerinin (toplam vücut ağırlığı veya vücut yüzey alanı) yanı sıra diğer eş değişkenlerin sunitinib ve metabolitlerinin önemli PK parametreleri üzerindeki etkisini değerlendirmek üzere adımsal eş değişken modelleme analizleri yapılmıştır. Test edilen yaş ve vücut ölçümü ile ilişkili eş değişkenlerden yaş, sunitinibin görünen klerensi üzerinde anlamlı bir eş değişken olarak belirlenmiştir (pediyatrik hasta ne kadar küçükse, görünen klerens o kadar düşüktür). Benzer şekilde, vücut yüzey alanı, aktif metabolitin görünen klerensi üzerinde anlamlı bir eş değişken olarak belirlenmiştir (vücut yüzey alanı ne kadar düşükse, görünen klerens o kadar düşüktür).
Ayrıca, 3 pediyatrik çalışmadan toplu veri setine ilişkin birleştirilmiş popülasyon PK analizine göre (2 pediyatrik solid tümör çalışması ve 1 pediyatrik GİST çalışması: 6-11 yaş ve 12-17 yaş) başlangıç vücut yüzey alanı (BSA), sunitinibin ve aktif metabolitinin görünen klirensi üzerinde anlamlı bir eş değişken olarak belirlenmiştir. Bu analize dayanarak, BSA değerleri 1,10 ve 1,87 m arasında olan pediyatrik hastalarda günlük yaklaşık 20 mg/m'lik bir doz, sunitinib ve aktif metabolitine plazma maruziyetinin (EAA'nın %75 ila %125'i arasında), GİST'i olan yetişkinlere, 4/2 şemasına göre (EAA 1233 ng.hr/mL) günlük 50 mg sunitinib uygulaması ile gözlenen plazma maruziyetine benzer olması beklenir. Pediyatrik çalışmalarda, 15 mg/m olan başlangıç sunitinib dozu (faz I doz-artış çalışmasında tanımlanan MTD'ye göre, Bkz. Bölüm 5.1), GİST'i olan pediyatrik hastalarda 22,5 mg/m'ye ve ardından bireysel hasta güvenliliği/tolere edilebilirliğine bağlı olarak 30 mg/m'ye (toplam günlük 50 mg dozu aşmayacak şekilde) yükselmiştir. Ayrıca, GİST'i olan pediyatrik hastalarda yayınlanmış literatürlere göre, 16,6 mg/m ila 36 mg/m arasında değişmekte olan hesaplanmış başlangıç dozu, toplam günlük 50 mg dozu aşmayacak şekilde 40,4 mg/mâye kadar yükselmiştir.
5.3. Klinik öncesi güvenlilik verileri
Maymun ve sıçanlarda 9 aya kadar devam eden tekrarlayan doz toksisite çalışmalarında primer hedef organ etkileri gastrointestinal sistem (maymunlarda emezis ve diyare), adrenal bez (sıçanlarda fibrozis görülen nekrozu takiben ve maymunlarda kortikal konjesyon ve/veya hemoraji), hemolenfopoetik sistem (kemik iliği hiposelülaritesi ve timusta lenfoid dokunun azalması, dalak ve lenf nodülü), ekzokrin pankreas (tek hücre nekrozuyla asinar hücre degranülasyonu), tükrük bezi (asinar hipertrofi), eklem (büyüme plağı kalınlaşması), uterus (atrofi), overler (azalmış foliküler gelişim) görülmüştür. Tüm bu bulgular klinik olarak anlamlı bir sunitinibin plazma maruziyeti seviyesinde görülmüştür. QT aralığında uzama, böbrekte mezangiyal matriks, gastrointestinal sistemde ve oral mukozada hemoraji ve testislerde (tübüler atrofi) ve anterior pitüiter hücreleri hipertrofisi diğer çalışmalarda görülen ilave etkiler arasındadır. Uterustaki (endometriyal atrofi) ve kemik büyüme plağındaki (fizeal kalınlaşma veya kıkırdak displazisi) değişimler sunitinibin farmakolojik etkisiyle ilişkilendirilmiştir. Bu bulguların çoğu tedavi kesildiğinde 2-6 hafta içinde geri dönüşümlü olmuştur.
Genotoksisite
Sunitinibin genotoksik potansiyeli in vitro ve in vivo olarak değerlendirilmiştir. Sunitinib, sıçan karaciğeri ile sağlanan metabolik aktivasyonu kullanan bakterilerde mutajenik değildi. Sunitinib in vitro olarakinsan periferikkan lenfosithücrelerinde yapısal kromozom
![]()
aberasyonuna neden olmamıştır. İnsan periferik kan lenfositlerinde in vitro olarak metabolik
ir.
aktivasyon varlığında ve yokluğunda poliploidi (sayısal kromozom aberasyonu) gözlenmişt
Sunitinib, sıçan kemik iliğinde in vivo olarak klastojenik değildi. Esas aktif metabolit genotoksisite açısından değerlendirilmemiştir.
Karsinojenite
aylık oral gavaj doz-aralığı belirleme çalışmasında (0, 10, 25, 75 veya 200 mg/kg/gün dozlarında) devamlı günlük dozlama yapılan rasH2 transgenik farelerde test edilen en yüksek dozda (200 mg/kg/gün) dudenumun Brunner bezinin karsinoması ve hiperplazisi gözlenmiştir.
RasH2 transgenik farelerde günlük dozlama ile 6 aylık bir oral gavaj karsinojenite çalışması (0, 8, 25, 75 (50'ye azaltılan) mg/kg/gün) yapılmıştır. Günlük 25 mg/kg'lık ve daha fazla dozlarda 1-veya 6- aylık süreleri (günlük önerilen dozu kullanan hastaların EAA'sının 7,3 katı veya daha fazlası) takiben gastroduodenal karsinomalar, arka plan hemajiyosarkom insidansında artış, ve/veya gastrik mukozal hiperplazi gözlenmiştir.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Genveon İlaç San. ve Tic. A.Ş.
| Satış Fiyatı | 16520.73 TL [ 19 Nov 2024 ] |
| Önceki Satış Fiyatı | 16520.73 TL [ 8 Nov 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699293150312 |
| Etkin Madde | Sunitinib Maleat |
| ATC Kodu | L01EX01 |
| Birim Miktar | 12.5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |