CABOMETYX 40 mg film kaplı tablet Farmakolojik Özellikler
{ Kabozantinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: antineoplastik ajan, protein kinaz inhibitörü ATC kodu: L01EX07.
Etki mekanizması
Kabozantinib tümör büyümesinden, anjiyogenezden, patolojik kemik yeniden modellenmesinden, ilaç direncinden ve metastatik kanser progresyonundan sorumlu birden fazla reseptör tirozin kinazı (RTK) inhibe eden küçük bir moleküldür. Kabozantinib çeşitli kinazlara karşı inhibe edici aktivitesi açısından değerlendirilmiştir ve MET (hepatosit büyüme faktörü reseptörü proteini) ve VEGF (vasküler endotelyal büyüme faktörü) reseptörlerini inhibe ettiği bulunmuştur. Ek olarak kabozantinib GAS6 reseptörü (AXL), RET, ROS1, TYRO3, MER, kök hücre faktörü reseptörü (KIT), TRKB, Fms-benzeri tirozin kinaz-3 (FLT3) ve TIE- 2'nin de aralarında olduğu başka tirozin kinazları da inhibe etmektedir.
Farmakodinamik etkiler
Kabozantinib geniş çeşitlilikte preklinik tümör modellerinde dozla ilişkili tümör büyümesi inhibisyonu ve tümör regresyonu sergilemiştir ve/veya metastazı inhibe etmiştir.
Kardiyak elektrofizyoloji
Medullar tiroid kanseri hastaları üzerinde gerçekleştirilen bir kontrollü klinik çalışmada kabozantinib tedavisine (günde 140 mg dozunda) başlanmasını takiben Fridericia ile düzeltilmiş QT aralığında (QTcF) 29. Günde (fakat 1. Günde değil) başlangıca göre 10 - 15 ms'lik bir artış gözlenmiştir. Bu etki kardiyak dalga formu morfolojisinde bir değişiklikle veya yeni ritimlerle ilişkilendirilmemiştir. Bu çalışmada kabozantinible tedavi uygulanan hastaların veya RHK veya HSK çalışmalarında kabozantinible tedavi uygulanan gönüllülerin hiçbirinde (60 mg dozunda) doğrulanmış QTcF >500 ms gözlenmemiştir.
Klinik etkililik ve güvenlilik
Renal hücreli karsinom (RHK)
Daha önce vasküler endotelyal büyüme faktörü (VEGF) hedefli tedavi gören RHK hastalarındaki randomize çalışma (METEOR)
Önceki vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedaviyi takiben renal hücreli karsinom tedavisinde CABOMETYX'in güvenliliği ve etkililiği randomize, açık etiketli, çok merkezli bir faz 3 çalışmada (METEOR) değerlendirilmiştir. Daha önce en az 1 VEGF reseptörü tirozin kinaz inhibitörü (VEGFR TKI) almış olan berrak hücreli bileşene sahip ilerlemiş RHK hastaları (N=658) CABOMETYX (N=330) veya everolimus (N=328) almak üzere randomize edilmiştir (1/1). Hastaların daha önce sitokinlerin ve VEGF'yi,
programlı ölüm 1 (PD-1) reseptörünü veya onun ligandlarını hedef alan antikorların da aralarında olduğu başka tedaviler almış olmasına izin verilmiştir. Beyin metastazları tedavi edilmiş olan hastaların çalışmaya katılmasına izin verilmiştir. Progresyonsuz sağkalım (PFS) körleştirilmiş bir bağımsız radyolojik inceleme kurulu tarafından değerlendirilmiştir ve randomize edilmiş olan ilk 375 gönüllü üzerinde primer analiz gerçekleştirilmiştir. Sekonder etkililik sonlanma noktaları objektif yanıt oranı (ORR) ve genel sağkalım (OS) olarak belirlenmiştir.
Tümör değerlendirmeleri ilk 12 ay süresince 8 haftada bir ve ardından 12 haftada bir gerçekleştirilmiştir.
Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve everolimus kollarında birbiri ile benzerlik sergilemiştir.
Hastaların çoğunun erkek (%75) ve medyan yaşın 62 olduğu belirlenmiştir. Yüzde yetmiş biri (%71) daha önce yalnızca bir VEGFR TKI almıştır; hastaların %41'inin daha önce aldığı tek VEGFR TKI'nın sunitinib olduğu belirlenmiştir. Prognostik risk kategorisine ilişkin Memorial Sloan Kettering Cancer Center kriterlerine göre %46'sının olumlu (0 risk faktörü), %42'sinin orta (1 risk faktörü) ve %13'ünün kötü (2 veya 3 risk faktörü) olduğu görülmüştür. Hastaların
%54'ünün 3 veya daha fazla organında metastatik hastalık tespit edilmiştir ve bu organları akciğer (%63), lenf düğümleri (%62), karaciğer (%29) ve kemikler (%22) oluşturmaktadır. Medyan tedavi süresinin CABOMETYX alan hastalarda 7,6 ay (aralık 0,3 â 20,5), everolimus alan hastalarda ise 4,4 ay (aralık 0,21 â 18,9) olduğu belirlenmiştir.
CABOMETYX için everolimus ile kıyasla PFS'de istatistiksel olarak anlamlı bir iyileşme gösterilmiştir (Şekil 1 ve Tablo 4). PFS analizi sırasında planlı bir OS analizi gerçekleştirilmiştir ve istatistiksel anlamlılığa ilişkin ara sınıra ulaşmamıştır (202 olay, HR=0,68 [0,51, 0,90], p=0,006). Daha sonra gerçekleştirilen planlı olmayan bir ara OS analizinde CABOMETYX'e randomize edilmiş hastalarda everolimusa kıyasla istatistiksel olarak anlamlı iyileşme ortaya konmuştur (320 olay, medyan 21,4 aya karşılık 16,5 ay; HR=0,66 [0,53, 0,83], p=0,0003; Şekil 2). 430 olayda bir takip analizi (tanımlayıcı) ile OS için karşılaştırılabilir bulgular gözlenmiştir.
ITT popülasyon üzerinde gerçekleştirilen keşifsel PFS ve OS analizleri de yaşa (<65 veya ≥65), cinsiyete, MSKCC risk grubuna (olumlu, orta, kötü), ECOG durumuna (0 veya 1), tanıdan randomizasyona kadar geçen süreye (<1 yıl veya ≥1 yıl), tümör MET durumuna (yüksek veya düşük veya bilinmiyor), kemik metastazları (yok veya var), viseral metastazlar (yok veya var), viseral ve kemik metastazları (yok veya var), önceki VEGFR-TKI'ların sayısı (1 veya ≥2), ilk VEGFR-TKI'nın süresi (≤6 ay veya >6 ay) göre oluşturulmuş farklı alt gruplarda everolimusa kıyasla CABOMETYX lehine tutarlı sonuçlar ortaya koymuştur.
Objektif yanıt oranı bulguları Tablo 5'te özetlenmektedir.
Şekil 1: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde bağımsız radyolojik inceleme kurulu incelemesiyle elde edilen Kaplan Meier progresyonsuz sağkalım eğrisi (randomize edilen ilk 375 gönüllü) (METEOR)
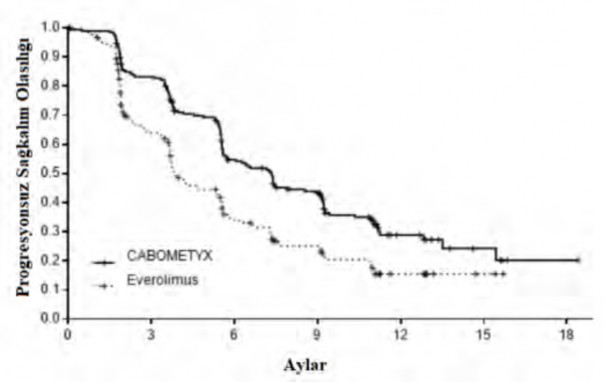
Risk altındaki gönüllülerin sayısı |
| ||||
CABOMETYX 187 152 | 92 | 68 | 20 | 6 | 2 |
Everolimus 188 99 | 46 | 29 | 10 | 2 | 0 |
Tablo 4: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde bağımsız radyolojik inceleme kurulu incelemesiyle elde edilen PFS bulgularının özeti (METEOR)
| Primer PFS analizi popülasyonu | Tedavi amaçlı popülasyon | ||
Sonlanma Noktası | CABOMETYX | Everolimus | CABOMETYX | Everolimus |
| N=187 | N= 188 | N = 330 | N = 328 |
Medyan PFS (%95 GA), ay | 7,4 (5,6, 9,1) | 3,8 (3,7, 5,4) | 7,4 (6,6, 9,1) | 3,9 (3,7, 5,1) |
HR (%95 GA), p değeri | 0,58 (0,45, 0,74), p<0,0001 | 0,51 (0,41, 0,62), p<0,0001 | ||
Şekil 2: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde genel sağkalıma ilişkin Kaplan-Meier eğrisi (METEOR)
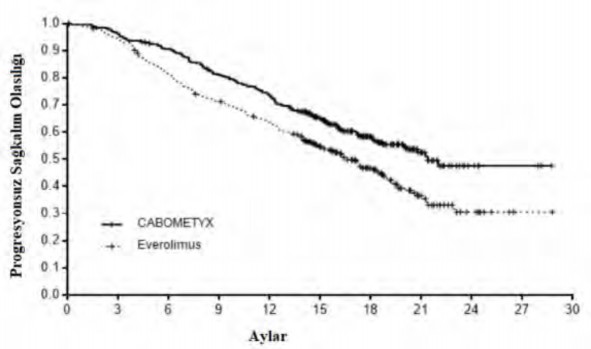
Risk altındaki gönüllülerin sayısı |
| |||||||
CABOMETYX 330 318 296 | 264 | 239 | 178 | 105 | 41 | 6 | 3 | 0 |
Everolimus 328 307 262 | 229 | 202 | 141 | 82 | 32 | 8 | 1 | 0 |
Tablo 5: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde bağımsız radyolojik inceleme kurulu (IRC) incelemesiyle elde edilen ORR bulgularının özeti
| Primer analiz ORR tedavi amaçlı popülasyon (IRC) | Araştırmacının incelemesine göre ORR tedavi amaçlı popülasyon | ||
Sonlanma noktası | CABOMETY X | Everolimus | CABOMETYX | Everolimus |
| N = 330 | N = 328 | N = 330 | N = 328 |
ORR (yalnızca kısmi yanıtlar) (%95 GA) | %17 (%13, %22) | %3 (%2, %6) | %24 (%19, %29) | %4 (%2, %7) |
p değeri | P < 0,0001 | P < 0,0001 | ||
Kısm yanıt | %17 | %3 | %24 | %4 |
İlk yanıta kadar geçen medyan süre, ay (%95 GA) | 1,91 (1,6, 11,0) | 2,14 (1,9, 9,2) | 1,91 (1,3, 9,8) | 3,50 (1,8, 5,6) |
En iyi yanıt olarak Sstabil hastalık | %65 | %62 | %63 | %63 |
En iyi yanıt olarak progresif hastalık | %12 | %27 | %9 | %27 |
Daha önce tedavi uygulanmamış renal hücreli karsinom hastalarında randomize çalışma (CABOSUN)
Daha önce tedavi uygulanmamış renal hücreli karsinom tedavisinde CABOMETYX'in güvenliliği ve etkililiği randomize, açık etiketli, çok merkezli bir çalışmada (CABOSUN) değerlendirilmiştir. Daha önce tedavi uygulanmamış, lokal olarak ilerlemiş veya metastatik berrak hücreli bileşene sahip RHK hastaları (N=157) CABOMETYX (N=79) veya sunitinib (N=78) almak üzere randomize edilmiştir (1/1). Hastaların, Uluslararası Metastatik RHK Veri Tabanı Konsorsiyumu (IMDC) risk grubu kategorilerine göre tanımlandığı üzere, orta veya kötü riskli hastalığa sahip olması gerekmiştir.
Hastalar IMDC risk grubuna göre ve kemik metastazı varlığına göre (evet/hayır) basamaklandırılmıştır. Hastaların yaklaşık %75'i tedavinin başlamasının öncesinde bir nefrektomi geçirmiştir.
Orta riskli hastalıkta aşağıdaki risk faktörlerinden bir veya ikisi karşılanmıştır, kötü riskli hastalıkta ise üç veya daha fazla faktör karşılanmıştır: RHK tanısından sistemik tedaviye kadar geçen süre < 1 yıl, Hgb < LLN, Düzeltilmiş kalsiyum > ULN, KPS < %80, nötrofil sayısı > ULN ve trombosit sayısı > ULN.
Primer sonlanma noktası PFS olarak belirlenmiştir. Sekonder etkililik sonlanma noktaları objektif yanıt oranı (ORR) ve genel sağkalım (OS) olarak belirlenmiştir. Tümör değerlendirmeleri 12 haftada bir gerçekleştirilmiştir.
Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve sunitinib kollarında birbiri ile benzerlik sergilemiştir. Hastaların çoğunun erkek (%78) ve medyan yaşın 62 olduğu belirlenmiştir. IMDC risk gruplarına göre hasta dağılımı %81 orta (1-2 risk faktörü) ve %19 kötü (≥3 risk faktörü) olmuştur. Çoğu hastanın (%87) ECOG performans durumunun 0 veya 1; hastaların %13'ünün ise ECOG performans durumunun 2 olduğu görülmüştür. Hastaların %36'sında kemik metastazları tespit edilmiştir.
Körleştirilmiş Bağımsız Radyolojik İnceleme Kurulu (IRC) tarafından retrospektif şekilde değerlendirildiği üzere, CABOMETYX ile sunitinible olana kıyasla PFS'de istatistiksel olarak anlamlı iyileşme ortaya konmuştur (Şekil 3 ve Tablo 6). PFS üzerinde araştırmacı tarafından yapılmış analiz ile IRC tarafından yapılmış analizin sonuçları tutarlılık sergilemiştir.
MET durumu hem pozitif hem de negatif olan hastalar CABOMETYX ile sunitinib ile olana kıyasla olumlu bir etki sergilemiştir ve MET durumu pozitif olan hastalarda MET durumu negatif olan hastalara kıyasla daha fazla aktivite gözlenmiştir (sırasıyla HR=0,32 (0,16 , 0,63) ve 0,67 (0,37, 1,23)).
CABOMETYX tedavisi sunitinible karşılaştırıldığında daha uzun bir sağkalım yönünde eğilim ortaya çıkarmıştır (Tablo 6). Çalışma, OS analizi için yeterli güce sahip değildi ve veriler olgun değildi.
Objektif yanıt oranı (ORR) bulguları Tablo 6'te özetlenmektedir.
Şekil 3: Daha önce tedavi uygulanmamış RHK'li gönüllülerde IRC değerlendirmesine göre progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisi
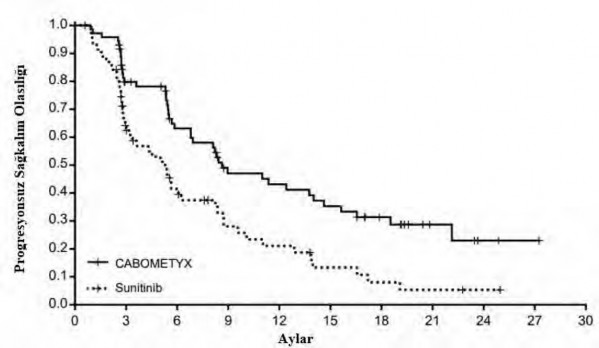
Risk altındaki gönüllülerin sayısı |
| |||||||
CABOMETYX 79 51 37 | 24 | 22 | 18 | 12 | 5 | 2 | 1 | 0 |
Sunitinib 78 36 21 | 12 | 9 | 5 | 3 | 2 | 1 | 0 | 0 |
Tablo 6: Daha önce tedavi uygulanmamış RHK'li gönüllülerde etkililik sonuçları (ITT popülasyon, CABOSUN)
| CABOMETYX (N=79) | Sunitinib (N=78) |
IRC'ye göre progresyonsuz sağkalım (PFS) |
|
|
Ay olarak medyan PFS (%95 GA) | 8,6 (6,2, 14,0) | 5,3 (3,0, 8,2) |
HR (%95 GA); basamaklandırılmış | 0,48 (0,32, 0,73) | |
İki yanlı log-sıra p değeri: basamaklandırılmış | p=0,0005 | |
Araştırmacıya göre progresyonsuz sağkalım (PFS) | ||
Ay olarak medyan PFS (%95 GA) | 8,3 (6,5, 12,4) | 5,4 (3,4, 8,2) |
HR (%95 GA); basamaklandırılmış | 0,56 (0,37, 0,83) | |
İki yanlı log-sıra p değeri: basamaklandırılmış | p=0,0042 | |
Genel sağkalım |
|
|
Ay olarak medyan OS (%95 GA) | 30,3 (14,6, NE) | 21,0 (16,3, 27,0) |
HR (%95 GA); basamaklandırılmış | 0,74 (0,47, 1,14) | |
IRC'ye göre objektif yanıt oranı n (%) |
|
|
Tam yanıtlar | 0 | 0 |
Kısmi yanıtlar | 16 (20) | 7 (9) |
ORR (yalnızca kısmi yanıtlar) | 16 (20) | 7 (9) |
Stabil hastalık | 43 (54) | 30 (38) |
Progresif Hastalık | 14 (18) | 23 (29) |
Araştırmacıya göre Objektif Yanıt Oranı n (%) | ||
Tam yanıtlar | 1 (1) | 0 |
Kısmi yanıtlar | 25 (32) | 9 (12) |
ORR (yalnızca kısmi yanıtlar) | 26 (33) | 9 (12) |
Stabil hastalık | 34 (43) | 29 (37) |
Progresif hastalık | 14 (18) | 19 (24) |
IxRS'ye göre basamaklandırma faktörleri IMDC risk kategorilerinden (orta risk, kötü risk ve kemik metastazı (evet, hayır)) oluşmaktadır.
tehlikeler modeli kullanılarak hesaplanmıştır. Tehlike oranı < 1 kabozantinib lehine progresyonsuz sağkalım göstermektedir
Sunitinib karşısında nivolumab ile kombinasyon halindeki kabozantinib için randomize faz 3 çalışması (CA2099ER)
İleri evre/metastatik RHK'nin birinci basamak tedavisi için 2 haftada bir intravenöz yoldan 240 mg nivolumab ile kombinasyon halinde günde bir kez oral yoldan alınan 40 mg kabozantinibin güvenliliği ve etkililiği, bir faz 3, randomize, açık etiketli çalışmada (CA2099ER) değerlendirilmiştir. Çalışmaya, PD-L1 durumlarına veya IMDC risk grubuna bakılmaksızın, berrak hücreli bileşene sahip ileri evre veya metastatik RHK'li, Karnofsky Performans Durumu (KPS)>%70 ve RECIST v1.1'e göre ölçülebilir hastalığı olan hastalar (18 yaş veya üstü) dahil edilmiştir. Çalışmada, otoimmün hastalığı veya sistemik immünosupresyon gerektiren diğer tıbbi koşulları olan hastalar, daha önce bir anti-PD-1, anti PD-L1, anti-PD-L2, anti-CD137 veya anti-CTLA-4 antikoru ile tedavi görmüş hastalar, antihipertansif tedaviye rağmen hipertansiyonu kontrol edilemeyenler, aktif beyin metastazları ve kontrolsüz adrenal yetmezliği olan hastalar dışarıda bırakılmıştır. Hastalar IMDC prognostik skoru, PD-L1 tümör ekspresyonu ve bölgeye göre katmanlandırılmıştır.
Toplam 651 hasta, her 2 haftada bir intravenöz yoldan uygulanan 240 mg (n =323) nivolumab ile kombinasyon halinde oral olarak günde bir kez 40 mg kabozantinib veya 4 hafta boyunca günde bir kez 50 mg sunitinib (n = 328) ve takiben 2 hafta ara verilerek uygulanacak şekilde randomize edilmiştir. Tedavi, en fazla 24 ay boyunca nivolumab uygulamasıyla hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam etmiştir. Araştırmacı tarafından belirlendiği üzere, hastanın klinik fayda sağlaması ve çalışma ilacını tolere etmesi halinde, araştırmacı tarafından değerlendirilen RECIST versiyon 1.1 ile tanımlanan ilk progresyon sonrasında tedaviye izin verilmiştir. Başlangıç sonrası ilk tümör değerlendirmesi, randomizasyondan sonra 12 haftada (± 7 gün) gerçekleştirilmiştir. Sonraki tümör değerlendirmeleri, 60. Haftaya kadar her 6 haftada bir (± 7 gün), daha sonra radyografik progresyona kadar her 12 haftada bir (± 14 gün) yapılmış ve Körleştirilmiş Bağımsız Merkezi İnceleme (BICR) ile doğrulanmıştır. Primer etkililik sonuç ölçüsü, bir BICR tarafından belirlendiği şekliyle PFS idi. Diğer etkililik ölçüleri arasında kilit sekonder sonlanım noktaları olarak OS ve ORR bulunuyordu.
İki grup arasında başlangıç özellikleri genel olarak dengelenmişti. Medyan yaş 61 olup (aralık: 28-90), %38,4'üï³ 65 yaşında ve %9,5'i ï³ 75 yaşındaydı. Hastaların çoğu erkek (%73,9) ve beyazdı (%81,9). Hastaların yüzde sekizi Asyalıydı, %23,2'si ve %76,5'i, sırasıyla
%70 ila %80 ve %90 ila %100'lük bir başlangıç KPS'sine sahipti. IMDC risk kategorilerine göre hasta dağılımı %22,6 iyi, %57,6 orta ve %19,7 yüksekti. Tümör PD-L1 ekspresyonu açısından, hastaların %72,5'inde PD-L1 ekspresyonu <% 1 veya belirsizdi ve hastaların
%24,9'unda PD-L1 ekspresyonu >% 1'di,. Hastaların %11,5'inde sarkomatoid özellikli
tümörler vardı. Tedavinin medyan süresi nivolumab ile birlikte kabozantinible tedavi edilen hastalarda 14,26 ay (aralık: 0,2-27,3 ay) ve sunitinib ile tedavi edilen hastalarda 9,23 aydı (aralık: 0,8-27,6 ay).
Çalışma, nivolumab ile kombinasyon halinde kabozantinibe randomize edilen hastalarda sunitinib ile karşılaştırıldığında PFS, OS ve ORR'de istatistiksel olarak anlamlı bir fayda olduğunu kanıtlamıştır. Önceden belirlenmiş alt gruplarda, IMDC risk kategorileri ve PD-L1 tümör ekspresyon durumunda tutarlı sonuçlar gözlenmiştir.
Primer analizden elde edilen etkililik sonuçları (minimum takip 10,6 ay; medyan takip 18,1 ay) Tablo 7'de gösterilmektedir.
Tablo 7: Etkililik sonuçları (CA2099ER)
| nivolumab + kabozantinib (n = 323) | sunitinib (n = 328) |
BICR'ye göre PFS |
|
|
Olaylar | 144 (%44,6) | 191 (%58,2) |
Tehlike oranı | 0,51 | |
%95 CI | (0,41, 0,64) | |
p-değeri | < 0,0001 | |
Medyan (%95 CI) | 16,59 (12,45, 24,94) | 8,31 (6,97, 9,69) |
OS |
|
|
Olaylar | 67 (%20,7) | 99 (%30,2) |
Tehlike oranı | 0,60 | |
%98,89 CI | (0,40, 0,89) | |
p-değeri | 0,0010 | |
Medyan (%95 CI) | N.E. | N.E. (22,6, N.E.) |
Oran (%95 CI) |
|
|
6 ayda | 93,1 (89,7, 95,4) | 86,2 (81,9, 89,5) |
BICR'ye göre ORR (CR + PR) | 180 (%55,7) | 89 (%27,1) |
(%95 CI) | (50,1, 61,2) | (22,4, 32,3) |
ORR'de Fark (%95 CI) | 28,6 (21,7, 35,6) | |
p-değeri | < 0,0001 | |
Tam yanıt (CR) | 26 (%8,0) | 15 (%4,6) |
Kısmi yanıt (PR) | 154 (%47,7) | 74 (%22,6) |
Stabil hastalık (SD) | 104 (%32,2) | 138 (%42,1) |
Medyan yanıt süresi |
|
|
Ay (aralık ) | 20,17 (17,31, N.E.) | 11,47 (8,31, 18,43) |
Yanıta kadar medyan süre |
|
|
Ay (aralık ) | 2,83 (1,0-19,4) | 4,17 (1,7-12,3) |
IMDC prognostik risk skoru (0, 1-2, 3-6), PD-L1 tümör ekspresyonu (ï³%1'e karşı <% 1 veya belirsiz) ve IRT'ye girildiği gibi bölgeye (ABD/Kanada/Batı Avrupa/Kuzey Avrupa, ROW) göre katmanlandırılmış log-sıra testi.
Sunitinib) katman ayarlı fark
PFS'nin primer analizi, yeni kanser tedavisi için sansürlemeyi içeriyordu (Tablo 7). Yeni kanser tedavisi için sansür içeren ve içermeyen PFS sonuçları tutarlıydı.
Sunitinib karşısında, nivolumab ile kombinasyon halindeki kabozantinib kolunda, tümör PD L1 ekspresyonundan bağımsız olarak PFS yararı gözlenmiştir. Tümör PD L1 ekspresyonu ≥ 1% için medyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 13.08 ay, ve sunitinib kolunda 4,67 aydı (HR = 0,45; %95 CI: 0,29, 0,68). Tümör PD L1 ekspresyonu < 1% için medyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 19.84 ay, ve sunitinib kolunda 9,26 aydı (HR = 0,50; %95 CI: 0,38, 0,65).
Sunitinib karşısında, nivolumab ile kombinasyon halindeki kabozantinib kolunda, tümör (IMDC) risk kategorisinden bağımsız olarak PFS yararı gözlenmiştir. İyi risk grubu için medyan PFS'e, nivolumab ile kombinasyon halinde kabozantinib için erişilmemiştir ve sunitinib kolunda 12,81 aydı (HR = 0,60; %95 CI: 0,37, 0,98). Orta risk grubu için medyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 17,71 ay ve sunitinib kolunda 8,38 aydı (HR = 0,54; %95 CI: 0,41, 0,73). Yüksek risk grubu için medyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 12,29 ay ve sunitinib kolunda 4,21 aydı (HR = 0,36;
%95 CI: 0,23, 0,58).
Güncellenmiş bir PFS ve OS analizi, tüm hastaların minimum 16 aylık bir takip süresi ve 23,5 aylık bir medyan takip süresi dolduğunda gerçekleştirilmiştir (bkz. Şekil 4 ve 5). PFS tehlike oranı 0,52'ydi (%95 CI: 0,43, 0,64). OS tehlike oranı 0,66'ydı (%95 CI: 0,50, 0,87). IMDC risk kategorileri ve PD-L1 ekspresyon seviyeleri için alt gruplarda güncellenmiş etkililik verileri (PFS ve OS) orijinal sonuçları doğrulamıştır. Güncellenen analizle iyi risk grubunda medyan PFS'ye ulaşılmıştır.
Şekil 4: Kaplan-Meier PFS eğrileri (CA2099ER)
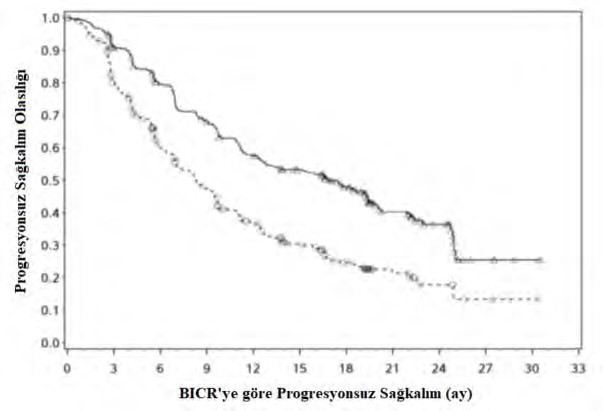
Risk altındaki gönüllülerin sayısı Nivolumab + kabozantinib
323 | 280 | 236 | 201 | 166 | 145 | 102 | 56 | 26 | 5 | 2 | 0 |
Sunitinib | |||||||||||
328 | 230 | 160 | 122 | 87 | 61 | 37 | 17 | 7 | 2 | 1 | 0 |
![]()
Nivolumab + kabozantinib (olaylar: 175/323), medyan ve %95 CI : 16,95 (12,58, 19,38)
![]() Sunitinib (olaylar: 206/328), medyan ve %95 CI: 8,31 (6,93, 9,69)
Sunitinib (olaylar: 206/328), medyan ve %95 CI: 8,31 (6,93, 9,69)
Şekil 5: Kaplan Meier OS eğrileri (CA2099ER)
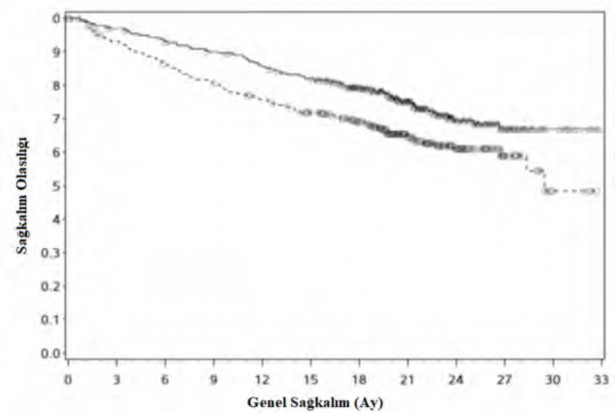
Risk altındaki gönüllülerin sayısı Nivolumab + kabozantinib
323 | 308 295 283 | 269 | 255 | 220 | 147 | 84 | 40 | 10 | 0 |
Sunitinib 328 |
295 272 254 |
236 |
217 |
189 |
118 |
62 |
22 |
4 |
0 |
![]()
Nivolumab + kabozantinib (olaylar: 86/323), medyan ve %95 CI: NE ![]() Sunitinib (olaylar: 116/328), medyan ve %95 CI: 29,47 (28,35, NE)
Sunitinib (olaylar: 116/328), medyan ve %95 CI: 29,47 (28,35, NE)
Hepatoselüler karsinom
Sorafenib alan hastalarda kontrollü çalışma (CELESTIAL)
CABOMETYX'in güvenliliği ve etkinliği randomize, çift kör, plasebo kontrollü Ffaz 3 çalışmasında (CELESTIAL) değerlendirilmiştir. Küratif tedaviye uygun olmayan ve daha önce ilerlemiş hastalık için sorafenib alan HSK'lı hastalar (N = 707), CABOMETYX (N = 470) veya plasebo (N = 237) alacak şekilde randomize edilmiştir (2: 1). Hastalar, sorafenibin yanı sıra ilerlemiş hastalık için daha önce bir başka sistemik tedavi almış olabilirler. Randomizasyon, hastalığın etiyolojisi (HBV [HCV ile birlikte olan veya olmayan], HCV [HBV ile olmayan] veya diğer), coğrafi bölge (Asya, diğer bölgeler) ve hastalığın ekstrahepatik yayılımının ve/ veya makrovasküler invazyonun varlığına (Evet, Hayır) göre sınıflara ayrılmıştır.
Primer sonlanma noktası genel sağkalım (OS) olarak belirlenmiştir. Sekonder etkililik sonlanma noktaları progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) araştırmacı tarafından Katı Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST ) 1.1 kullanılarak belirlenmiştir. Tümör değerlendirmeleri 8 haftada bir gerçekleştirilmiştir. Gönüllüler radyolojik hastalığın ilerlemesinden sonra klinik fayda görürken veya sonraki sistemik veya karaciğer
yönelimli lokal antikanser tedavisine ihtiyaç duyulana kadar kör çalışma tedavisine devam etmişlerdir. Kör tedavi aşamasında plasebodan kabozantinibe çapraz geçişe izin verilmemiştir.
Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve placebo kollarında birbiri ile benzerlik sergilemiştir ve 707 randomize hastanın tümü için aşağıda gösterilmiştir:
Hastaların çoğu erkek (%82) ve medyan yaş 64'tü. Hastaların çoğu (%56) Beyaz ve hastaların
%34'ü Asyalıydı. Hastaların yüzde elli üçünün (%53) ECOG performans durumu (PS) 0 ve
%47'sinin ECOG PS'i 1'di. Hemen hemen tüm hastalar (%99) Child Pugh A ve %1'i Child Pugh B idi. HSK için etiyolojide %38 hepatit B virüsü (HBV), %21 hepatit C virüsü (HCV),
%40 diğer (ne HBV ne de HCV) bulunuyordu. Yüzde yetmiş sekizinde (%78) makroskopik vasküler invazyon ve/veya karaciğer dışı tümör yayılması, %41'inde alfa-fetoprotein (AFP) seviyeleri ≥400μg/L idi, %44'ü lokal-bölgesel transarteryel embolizasyon veya kemoinfüzyon prosedürleriyle tedavi edilmişti ve %37'si kabozantinib tedavisinden önce radyoterapi almıştı. Sorafenib tedavisinin medyan süresi 5,32 aydı. İleri evre hastalık için daha önce hastaların yüzde yetmiş ikisi (%72) 1 ve %28'i 2 sistemik tedavi rejimi almıştır.
OS'de CABOMETYX için plaseboya kıyasla istatistiksel olarak anlamlı bir iyileşme olduğu gösterilmiştir (Tablo 8 ve Şekil 6)
PFS ve ORR bulguları Tablo 8'de özetlenmiştir.
Tablo 8: HSK'da etkililik sonuçları (ITT popülasyon, CELESTIAL)
| CABOMETYX (N=470) | Placebo (N=237) |
Genel sağkalım | ||
Ay olarak medyan OS (%95 GA) | 10,2 (9,1, 12,0) | 8,0 (6,8, 9,4) |
HR (%95 GA) | 0,76 (0,63, 0,92) | |
p-değeri | p=0,0049 | |
Progresyonsuz sağkalım (PFS) | ||
Ay olarak medyan PFS (%95 GA) | 5,2 (4,0, 5,5) | 1,9 (1,9, 1,9) |
HR (%95 GA) | 0,44 (0,36, 0,52) | |
p-değeri | p<0,0001 | |
Kaplan-Meier eğrisine göre 3 ayda olaysız gönüllülerin yüzdesi | ||
% (%95 GA) | %67,0 (%62,2, %71,3) | %33.3 (%27.1, %39.7) |
Objektif yanıt oranı n (%) | ||
Tam yanıtlar (CR) | 0 | 0 |
Kısmi yanıtlar (PR) | 18 (4) | 1 (0,4) |
ORR (CR+PR) | 18 (4) | 1 (0,4) |
p-değeri | p=0,0086 | |
Stabil hastalık | 282 (60) | 78 (33) |
Progresif Hastalık | 98 (21) | 131 (55) |
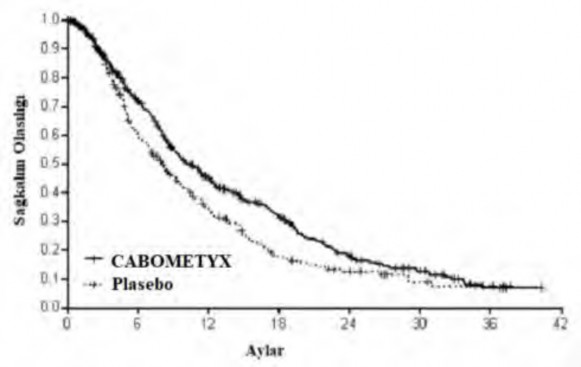
Şekil 6: Genel sağkalıma ilişkin Kaplan-Meier eğrisi (CELESTIAL)
Risk altındaki gönüllülerin sayısı | ||||||||
CABOMETYX | 470 | 281 | 159 | 93 | 44 | 22 | 4 | 0 |
Plasebo | 237 | 117 | 57 | 25 | 15 | 7 | 3 | 0 |
Şekil 7: Progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisi (CELESTIAL)
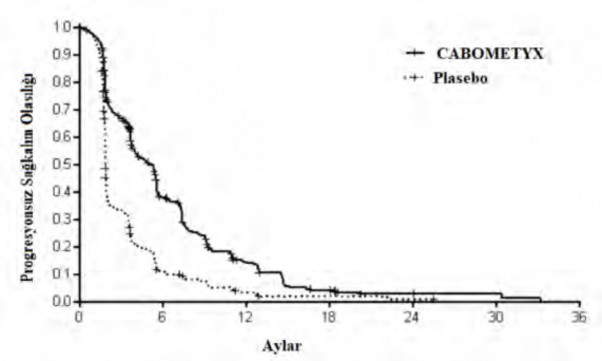
Risk altındaki gönüllülerin sayısı
CABOMETYX 470 | 131 | 39 | 10 | 3 | 2 | 0 |
Plasebo 237 | 21 | 5 | 2 | 1 | 0 | 0 |
Sistemik radyasyon dışı ve lokal karaciğere yönelik sistemik protokol olmayan antikanser tedavisi (NPACT) insidansı, kabozantinib kolunda % 26 ve plasebo kolunda %33'tür. Bu tedavileri alan gönüllüler, çalışma tedavisine son vermek zorunda kalmıştır. NPACT kullanımı için sansür uygulayıcı bir inceleme OS analizi, birincil analizi desteklemiştir: tabakalaşma faktörleri (IxRS'e göre) için düzeltilen HR 0.66 (% 95 GA: 0.52, 0.84; tabakalı logrank p-değeri
= 0.0005)'tir. Kaplan-Meier eğrisine göre medyan OS süresi 4.2 aylık fark ile, kabozantinib kolunda 11.1 aya karşılık plasebo kolunda 6.9 ay olarak tahmin edilmiştir.
EuroQoL EQ-5D-5L kullanılarak hastalığa özgü olmayan yaşam kalitesi (QoL) değerlendirilmiştir. CABOMETYX'in plaseboya karşı EQ-5D fayda endeksi skoru üzerinde olumsuz bir etkisi tedavinin ilk haftası boyunca gözlenmiştir. Bu periyot sonunda yalnızca sınırlı QoL verileri elde edilmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı, solid malign tümörlerin tedavisinde pediatrik popülasyonun bir ya da daha fazla alt grubunda CABOMETYX ile yapılan çalışmalardan elde edilen bulguların sunulması zorunluluğunu ertelemiştir. (pediatrik kullanıma ilişkin bilgiler için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
Kabozantinibin oral yolla uygulanmasını takiben pik plazma konsantrasyonlarına dozdan 3 ila
4 saat sonra erişilmektedir. Plazma konsantrasyonu-zaman profilleri, kabozantinibin enterohepatik yeniden dolaşıma maruz kaldığına işaret eder şekilde, uygulamadan yaklaşık 24 saat sonra ikinci bir emilim piki olduğunu göstermektedir.
Kabozantinible 19 gün süresince 140 mg dozunda her gün yapılan tekrarlı doz uygulaması tek doz uygulamasına kıyasla yaklaşık 4 ila 5 katlık bir ortalama kabozantinib birikimi ortaya çıkarmıştır (EAA'ya göre); kararlı duruma yaklaşık 15 günde erişilmektedir.
Kabozantinibin 140 mg'lik tek bir oral dozunun uygulandığı sağlıklı gönüllülerde yüksek miktarda yağ içeren bir öğün, açlık durumuna kıyasla, Cmaks ve EAA değerlerini orta düzeyde arttırmıştır (sırasıyla %41 ve %57). Kabozantinib uygulamasından 1 saat sonra alınan gıdaların kesin etkisi konusunda bilgi bulunmamaktadır.
Sağlıklı gönüllülerde 140 mg'lik tek bir dozun ardından kabozantinib kapsül ile tablet formülasyonları arasında biyoeşdeğerlik ortaya konamamıştır. Tablet formülasyonunun Cmaks değerinde kapsül formülasyonuna kıyasla %19'luk bir artış gözlenmiştir. Kabozantinib tablet ve kapsül formülasyonları arasında %10'un altında bir EAA farkı görülmüştür.
Dağılım:
Kabozantinibin in vitro insan plazmasında proteine bağlanma oranı yüksektir (>%99,7). Popülasyon farmakokinetiği (PF) modeline göre merkez bölmenin (Vc/F) dağılım hacminin 212 L olduğu tahmin edilmiştir.
Biyotransformasyon:
Kabozantinib in vivo metabolize edilmiştir. Plazmada ana maddenin %10'undan yüksek maruziyelerde (EAA) dört metabolit tespit edilmiştir: XL184-N-oksit, XL184 amid kleavaj ürünü, XL184 monohidroksi sülfat ve 6-desmetil amid kleavaj ürünü sülfat.
Ana madde kabozantinibin hedefli kinaz inhibisyonu potensinin <%1'ine sahip iki konjuge olmayan metabolitin (XL184-N-oksit ve XL184 amid klevaj ürünü) her biri toplam ilaçla ilişkili plazma maruziyetinin <%10'unu oluşturmaktadır.
Bir nötralize edici CYP3A4 antikoru, NADPH katalizörlü insan karaciğeri mikrozomal (HLM) inkübasyonunda metabolit XL184 N-oksit oluşumunu >%80 inhibe ettiğinden, kabozantinib bir in vitro CYP3A4 metabolizması substratıdır; bunun aksine CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 ve CYP2E1 nötralize edici antikorları kabozantinib metaboliti oluşumu üzerinde herhangi bir etki ortaya çıkarmamıştır. Bir CYP2C9 nötralize edici antikor kabozantinib metaboliti oluşumu üzerinde minimal etki (yani <%20 azalma) sergilemiştir.
Eliminasyon:
1.883 hasta ve 140 sağlıklı gönüllüden toplanan veriler kullanılarak kabozantinib üzerinde gerçekleştirilen bir popülasyon FK analizinde 20 ila 140 mg aralığında dozların oral yolla
uygulanmasının ardından kabozantinibin plazma terminal yarı ömrünün yaklaşık110 saat olduğu görülmüştür. Kararlı durumdaki ortalama klirensin (CL/F) 2,48 L/sa olduğu hesaplanmıştır. Sağlıklı gönüllülere tek doz 14C-kabozantinib uygulanmasını takip eden 48 günlük bir toplama periyodu içinde, %54'ü feçeste, %27'si ise idrarda olmak üzere, uygulanan toplam radiyoaktivitenin yaklaşık %81'i tespit edilmiştir.
Hastalardaki karakteristik özellikler ve farmakokinetik/farmakodinamik ilişkiler
Böbrek yetmezliği:
Tek bir 60 mg dozunda kabozantinib ile yapılan böbrek yetmezliği çalışmasında, toplam plazma kabozantinib, Cmaks ve EAA0-inf değerlerine ilişkin geometrik LS ortalama oranlarının böbrek fonksiyonu normal olan gönüllülere kıyasla hafif derecede böbrek yetmezliği görülen gönüllülerde %19 ve %30 daha yüksek (Cmaks değerine ilişkin %90 GA %91,60 ila %155,51; EAA0-inf %98,79 ila %171,26), orta derecede böbrek yetmezliği görülen gönüllülerde ise %2 ve %6-7 daha yüksek (Cmaks değerine ilişkin %90 GA %78,64 ila %133,52; EAA0-inf %79,61 ila %140,11) olduğu gösterilmiştir. Bağlanmamış plazma kabozantinib EAA0-inf için geometrik LS ortalamaları, normal böbrek fonksiyonu olan gönüllülere kıyasla, hafif böbrek yetmezliği olan gönüllüler için %0,2 daha yüksek (%90 CI %55,9 ila % 180) ve orta derecede böbrek yetmezliği olanlar için %17 daha yüksekti (% 90 CI %65,1 ila %209,7). Ciddi böbrek yetmezliği olan gönüllüler üzerinde çalışma yapılmamıştır.
Karaciğer yetmezliği:
Sağlıklı gönüllülerde ve kanser hastalarında (HSK dahil) kabozantinibin bütünleşik bir popülasyon farmakokinetik analizine dayanarak, normal karaciğer fonksiyonuna (n = 1425) ve hafif karaciğer yetmezliğine sahip (n = 558) deneklerde ortalama kabozantinib plazma maruziyetinde klinik olarak anlamlı bir fark gözlenmemiştir. UKE-ODÇG (Ulusal Kanser Enstitüsü - Organ Disfonksiyonu Çalışma Grubu) kriterlerine göre orta derecede karaciğer yetmezliği (n = 15) olan hastalarda sınırlı veri vardır. Kabozantinibin farmakokinetiği şiddetli karaciğer yetmezliği olan hastalarda değerlendirilmemiştir.
Irk:
Gerçekleştirilmiş olan bir popülasyon FK analizinde kabozantinibin FK'sinde ırk bazında klinik açıdan anlamlı farklılık tespit edilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik çalışmalarda advers etkiler gözlemlenmemiştir ancak klinik maruz kalma düzeylerine benzer maruz kalma düzeylerinde hayvanlarda advers etkiler gözlemlenmiştir ve bu, muhtemelen klinik kullanım açısından önem taşımaktadır.
Sıçanlar ve köpekler üzerinde 6 aya varan sürelerle gerçekleştirilen tekrarlı doz toksisitesi çalışmalarında toksisite açısından hedef organların Gİ kanal, kemik iliği, lenfoid dokular, böbrek, adrenal dokular ve üreme sistemi dokuları olduğu görülmüştür. Bu bulgular için advers etki görülmeyen düzeyin (NOAEL) amaçlanan terapötik dozda insanlardaki klinik maruziyet düzeylerinin altında olduğu belirlenmiştir.
Kabozantinib standart bir grup genotoksisite tayininde mutajenik veya klastojenik potansiyel sergilememiştir. Kabozantinibin karsinojenik potansiyeli iki tür üzerinde değerlendirilmiştir:
rasH2 transgenik fareler ve Sprague-Dawley sıçanları. Sıçanlar üzerinde gerçekleştirilen 2 yıllık karsinojenisite çalışmasında, insanlardaki amaçlanan maruziyetin oldukça altında kalan maruziyetlerde kabozantinible ilişkili neoplastik bulgular, her iki cinsiyette adrenal medullada tek başına veya malign feokromositoma/kompleks malign feokromositoma ile birlikte selim feokromositoma insidansında artış şeklinde olmuştur. Sıçanlarda gözlenen neoplastik lezyonların klinik anlamı belirsizdir fakat düşük olması olasıdır.
Kabozantinibin insanlarda amaçlanan terapötik maruziyetten hafifçe daha yüksek maruziyetlerde rasH2 fare modelinde karsinojenik olmadığı görülmüştür.
Sıçanlar üzerine yapılan fertilite çalışmaları erkek ve dişi fertilitesinde azalma ortaya koymuştur. Ek olarak, insanlarda amaçlanan terapötik dozda ortaya çıkan klinik maruziyet düzeylerinin altındaki maruziyet düzeylerinde erkek köpeklerde hipospermatogenez gözlenmiştir.
Sıçanlar ve tavşanlar üzerinde embriyofetal gelişim çalışmaları yapılmıştır. Sıçanlarda kabozantinib implantasyon sonrası kayıp, fetal ödem, yarık damak/dil, dermal aplazi ve kıvrık veya rudimenter kuyruk ortaya çıkmasına neden olmuştur. Tavşanlarda kabozantinib fetal yumuşak doku değişikliklerine (dalak boyutunda azalma, akciğer orta lobunun küçük olması veya mevcut olmaması) neden olmuş ve fetal total malformasyon insidansını arttırmıştır. Embriyofetal toksisite ve teratojenik bulgulara ilişkin NOAEL düzeyinin amaçlanan terapötik dozda insanlardaki klinik maruziyet düzeylerinin altında olduğu belirlenmiştir.
Kabozantinib uygulanan juvenil sıçanlar (>2 yaş pediyatrik popülasyon ile karşılaştırılabilir) artmış WBC parametreleri, azalmış hematopoez, pubesent/olgunlaşmamış dişi üreme sistemi (vajinal açılım gecikmesi olmadan), diş anormallikleri, kemik mineral içeriğinde ve yoğunluğunda azalma, karaciğer pigmentasyonu ve lenf düğümü lenfoid hiperplazisi sergilemiştir. Uterustaki/yumurtalıklardaki bulguların ve azalmış hematopoezin geçici olduğu görülmüştür, kemik parametreleri ve karaciğer pigmentasyonu üzerindeki etkiler ise devam etmiştir. Juvenil sıçanlar (<2 yaş pediyatrik popülasyon ile korelasyon sergiler) tedaviyle ilişkili benzer bulgular sergilemiştir fakat karşılaştırılabilir doz düzeylerinde kabozantinible ilişkili toksisiteye karşı daha hassas oldukları görülmüştür.
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Gen İlaç Ve Sağlık Ürünleri San. Ve Tic. Ltd. Sti.
| Satış Fiyatı | 157985.37 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 169328.27 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699783090456 |
| Etkin Madde | Kabozantinib |
| ATC Kodu | L01EX07 |
| Birim Miktar | 40 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |