CALQUENCE 100 mg sert kapsül (56 kapsül) Kısa Ürün Bilgisi
{ Acalabrutinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
CALQUENCETM 100 mg sert kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir sert kapsül 100 mg akalabrutinib içerir.
Yardımcı maddeler
Soyum nişasta glikolat 6 mg
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Sert kapsül (kapsül)
Sarı gövdeli, mavi kapaklı, boyut 1 (20 mm), siyah mürekkeple âACA 100 mgâ baskısı bulunan sert kapsül.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
CALQUENCETM, monoterapi olarak veya obinutuzumab ile kombinasyon halinde, daha önce tedavi edilmemiş kronik lenfositik lösemi (KLL) hastalığı olan erişkin hastaların tedavisinde endikedir.
CALQUENCETM, daha önce bruton tirozin kinaz inhibitörü ile tedavi edilmemiş ve en az bir sıra tedaviye dirençli veya relaps kaydedilen kronik lenfositik lösemili hastalarda monoteapi olarak endikedir.
4.2. Pozoloji ve uygulama şekli
CALQUENCETM tedavisi, antikanser tıbbi ürünlerin uygulanmasında deneyimli hekimler tarafından başlatılmalı ve denetlenmelidir.
Pozoloji/uygulama sıklığı ve süresi:
Önerilen doz günde iki kez 100 mg akalabrutinibdir (200 mg günlük toplam doza eşdeğer). Önerilen obinutuzumab doz bilgisi için obinutuzumab reçeteleme bilgilerine bakınız.
Doz aralığı yaklaşık 12 saattir.
CALQUENCETM ile tedavi, hastalık progresyonuna veya kabul edilemez toksisiteye kadar sürdürülmelidir.
Doz ayarlaması
Advers reaksiyonlar
Derece ≥ 3 advers reaksiyonlar için CALQUENCETM'in önerilen doz ayarlamaları Tablo 1'de verilmektedir.
Tablo 1: Advers reaksiyonlar için önerilen doz ayarlamaları*
Advers reaksiyon | Advers reaksiyon oluşumu | Doz ayarlaması (Başlangıç dozu = yaklaşık her 12 saatte bir 100 mg) |
Kanamalı 3. derece trombositopeni, 4. derece trombositopeni veya 7 günden uzun süren 4. derece nötropeni
3. derece veya daha büyük hematolojik olmayan toksisiteler | Birinci ve ikinci | CALQUENCE'e ara verilir. Toksisite, 1. dereceye gerilediğinde veya başlangıçtaki seviyesine düzeldiğinde, CALQUENCE yaklaşık her 12 saatte bir 100 mg olarak devam ettirilebilir. |
Üçüncü | CALQUENCE'e ara verilir. Toksisite 1. dereceye gerilediğinde veya başlangıçtaki seviyesine düzeldiğinde, CALQUENCE günde bir kez 100 mg olarak azaltılmış bir sıklıkta devam ettirilebilir. | |
Dördüncü | CALQUENCE kesilir. |
* Advers reaksiyonlar, Ulusal Kanser Enstitüsü Advers Olaylar için Ortak Terminoloji Kriterleri (NCI CTCAE) sürüm 4.03'e göre derecelendirilmiştir.
Etkileşimler
CALQUENCETM'in CYP3A inhibitörleri veya indükleyicileri ve mide asidi azaltıcı ajanlarla kullanımına ilişkin öneriler Tablo 2'de verilmektedir (bkz. Bölüm 4.5).
Tablo 2: CYP3A inhibitörleri veya indükleyicileri ve mide asidi azaltıcı ajanlarla kullanım
| Birlikte uygulanan tıbbi ürün | Önerilen CALQUENCE kullanımı |
CYP3A inhibitörleri |
Güçlü CYP3A inhibitörü | Eş zamanlı kullanımından kaçınınız. Bu inhibitörler kısa süreli kullanılacaksa (yedi güne kadar anti-infektifler gibi), CALQUENCE'e ara veriniz. |
Orta CYP3A inhibitörü | Doz ayarlaması bulunmamaktadır. Orta derecede CYP3A inhibitörleri alınıyorsa, hastaları advers reaksiyonlar açısından yakından izleyiniz. |
| Birlikte uygulanan tıbbi ürün | Önerilen CALQUENCE kullanımı |
| Hafif CYP3A inhibitörü | Doz ayarlaması bulunmamaktadır. |
CYP3A indükleyicileri | Güçlü CYP3A indükleyicileri | Eş zamanlı kullanımından kaçınınız. |
Mide asidi azaltıcı ajanlar | Proton pompa inhibitörleri | Eş zamanlı kullanımından kaçınınız. |
H2-reseptör antagonistleri | CALQUENCE'i bir H2-reseptör antagonisti almadan 2 saat önce (veya 10 saat sonra) alınız. | |
Antiasitler | Tıbbi ürünlerin alınmaları arasındaki aralık en az 2 saat olmalıdır. |
Unutulan doz
Hasta bir CALQUENCETM dozunu 3 saatten fazla süre kaçırırsa, hastaya bir sonraki dozu düzenli olarak planlanan saatte alması söylenmelidir. Kaçırılan bir dozu telafi etmek için çift doz CALQUENCETM alınmamalıdır.
Uygulama şekli:
CALQUENCETM oral kullanım içindir. Kapsüller, her gün yaklaşık olarak aynı saatte, aç veya tok karnına, su ile bütün olarak yutulmalıdır (bkz. Bölüm 4.5). Tıbbi ürünün emilimini etkileyebileceğinden kapsüller çiğnenmemeli, çözdürülmemeli veya açılmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda spesifik klinik çalışma yapılmamıştır. CALQUENCETM klinik çalışmalarında hafif veya orta şiddetli böbrek yetmezliği olan hastalar tedavi edilmiştir. Hafif veya orta şiddetli böbrek yetmezliği (30 mL/dk'dan fazla kreatinin klerensi) olan hastalar için doz ayarlamasına gerek bulunmamaktadır. Hidrasyon sürdürülmeli ve serum kreatinin seviyeleri periyodik olarak izlenmelidir. CALQUENCETM, şiddetli böbrek yetmezliği olan hastalara (30mL/dk'dan az kreatinin klerensi), yalnızca faydanın riskten ağır basması durumunda uygulanmalıdır ve bu hastalar toksisite belirtileri açısından yakından izlenmelidir. Şiddetli böbrek yetmezliği olan hastalar veya diyaliz hastalarına ilişkin veri bulunmamaktadır (bkz. Bölüm 5.2).
Karaciğer yetmezliği:
Hafif veya orta şiddetli karaciğer yetmezliği olan hastalarda (Child-Pugh A, Child-Pugh B veya normalin üst sınırının [ULN] 1,5-3 katı toplam bilirubin ve herhangi bir AST düzeyi) herhangi bir doz ayarlaması önerilmemektedir. Bununla birlikte, orta şiddetli karaciğer yetmezliği olan hastalar, toksisite belirtileri açısından yakından izlenmelidir. Ciddi karaciğer yetmezliği (Child- Pugh C veya ULN'nin 3 katından fazla toplam bilirubin ve herhangi bir AST düzeyi) olan hastalarda CALQUENCETM kullanımı önerilmemektedir (bkz. Bölüm 5.2).
Geriyatrik popülasyon:
Yaşlı hastalar (65 yaş ve üzeri) için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
0 ila 18 yaş arası çocuklarda ve ergenlerde CALQUENCETM'in güvenliliği ve etkililiği belirlenmemiştir. Bu hasta grubunda veri bulunmamaktadır.
Ciddi kalp hastalığı:
Ciddi kardiyovasküler hastalığı olan hastalar, CALQUENCETM klinik çalışmalarının dışında tutulmuştur.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Hemoraji
CALQUENCETM monoterapisi ve obinutuzumab kombinasyonu ile tedavi edilen hematolojik maligniteleri olan hastalarda, bazıları ölümle sonuçlanan, merkezi sinir sistemi ve gastrointestinal hemoraji içeren önemli hemorajik olaylar meydana gelmiştir. Bu olaylar, hem trombositopenisi olan hem de olmayan hastalarda görülmüştür. Genel olarak, kanama olayları morarma ve peteşi gibi daha az ciddi olaylar şeklinde olmuştur (bkz. Bölüm 4.8).
Kanama olaylarının mekanizması tam olarak anlaşılmamıştır.
Antitrombotik ajan alan hastalarda kanama riski daha yüksek olabilir. Eş zamanlı kullanımı medikal olarak gerekli olduğunda, antitrombotik ajanlar dikkatli kullanılmalı ve kanama belirtileri için ek izleme göz önünde bulundurulmalıdır. Varfarin veya diğer K vitamini antagonistleri, CALQUENCETM ile birlikte uygulanmamalıdır.
CALQUENCETM'i ameliyattan önce ve sonra en az 3 gün durdurmanın yararı ve riski göz önünde bulundurulmalıdır.
Enfeksiyonlar
CALQUENCETM monoterapisi ve obinutuzumab kombinasyonu ile tedavi edilen hematolojik maligniteleri olan hastalarda ölümcül olaylar dahil olmak üzere ciddi enfeksiyonlar (bakteriyel, viral veya fungal) meydana gelmiştir. Bu enfeksiyonlar ağırlıklı olarak 3. veya 4. derece nötropeni durumunda meydana gelirken, nötropenik enfeksiyon tüm hastaların %1,9'unda bildirilmiştir. Hepatit B virüsü (HBV) ve herpes zoster virüsü (HZV) reaktivasyonuna bağlı enfeksiyonlar, aspergilloz ve progresif multifokal lökoensefalopati (PML) meydana gelmiştir (bkz. Bölüm 4.8).
Viral reaktivasyon
CALQUENCETM alan hastalarda hepatit B reaktivasyonu vakaları bildirilmiştir. CALQUENCETM ile tedaviye başlamadan önce Hepatit B virüsü (HBV) durumu belirlenmelidir. Hastalarda hepatit B serolojisi pozitifse, tedaviye başlamadan önce bir karaciğer hastalıkları uzmanına danışılmalı ve hepatit B reaktivasyonunu önlemek için hasta güncel tıbbi standartlara göre izlenmeli ve yönetilmelidir.
Önce veya eşzamanlı bir immünosupresif tedavi kapsamında CALQUENCETM kullanımını takiben ölümcül olanlar da dahil olmak üzere progresif multifokal lökoensefalopati (PML) vakaları bildirilmiştir. Doktorlar yeni veya kötüleşen nörolojik, bilişsel veya davranışsal belirti veya semptomları olan hastalarda ayırıcı tanıda PML'yi dikkate almalıdır. PML'den şüpheleniliyorsa, uygun tanısal değerlendirmeler yapılmalı ve PML dışlanana kadar CALQUENCETM ile tedavi askıya alınmalıdır. Herhangi bir şüphe söz konusu ise, bir nöroloğa sevk ve PML için tercihen kontrastlı MR görüntülemesi, JC virüs (JCV) Viral DNA için beyin
omurilik sıvısı (BOS) testi ve tekrar nörolojik değerlendirmeler dahil olmak üzere uygun tanı yöntemleri uygulanmalıdır.
Fırsatçı enfeksiyon riski yüksek olan hastalarda standart bakım yöntemine göre profilaksi düşünülmelidir. Hastalar enfeksiyon belirtileri ve semptomları açısından izlenmeli ve tıbbi durumun gerektirdiği şekilde tedavi edilmelidir.
Sitopeniler
CALQUENCETM monoterapisi ve obinutuzumab kombinasyonu ile tedavi edilen hematolojik maligniteleri olan hastalarda nötropeni, anemi ve trombositopeni dahil tedaviyle ortaya çıkan 3. veya 4. derece sitopeniler meydana gelmiştir. Tıbbi olarak belirtildiği şekilde tam kan sayımları takip edilmelidir (bkz. Bölüm 4.8).
İkinci primer maligniteler
CALQUENCETM monoterapisi ve obinutuzumab kombinasyonu ile tedavi edilen hematolojik maligniteleri olan hastalarda deri kanseri ve deri kanseri dışındaki kanserler dahil olmak üzere ikinci primer maligniteler meydana gelmiştir. Deri kanserleri yaygın olarak bildirilmiştir. Hastalar cilt kanserlerinin başlangıcı açısından izlenmeli ve güneş maruziyetinden korunmaları önerilmelidir (bkz. Bölüm 4.8 ve 5.3).
Atriyal fibrilasyon
CALQUENCETM monoterapisi ve obinutuzumab kombinasyonu ile tedavi edilen hematolojik maligniteli hastalarda atriyal fibrilasyon/çarpıntı meydana gelmiştir. Atriyal fibrilasyon ve atriyal çarpıntı semptomları (örn. çarpıntı, baş dönmesi, senkop, göğüs ağrısı, dispne) izlemeli ve medikal olarak belirtildiği şekilde EKG alınmalıdır (bkz. Bölüm 4.5 ve 4.2). CALQUENCETM ile tedavide atriyal fibrilasyon gelişen hastalarda, tromboembolik hastalık riskinin kapsamlı bir değerlendirmesi yapılmalıdır. Tromboembolik hastalık riski yüksek hastalarda, antikoagülanlarla sıkı kontrollü tedavi ve CALQUENCETM'e alternatif tedavi seçenekleri düşünülmelidir.
Diğer tıbbi ürünler
Güçlü CYP3A inhibitörlerinin CALQUENCETM ile birlikte uygulanması, akalabrutinib maruziyetinin artmasına ve sonuç olarak daha yüksek toksisite riskine yol açabilir. Bunun aksine, CYP3A indükleyicilerinin birlikte uygulanması, akalabrutinib maruziyetinin azalmasına ve sonuç olarak etkililik eksikliği riskine neden olabilir. Güçlü CYP3A inhibitörleri ile eşzamanlı kullanımdan kaçınılmalıdır. Bu inhibitörler kısa süreli kullanılacaksa (yedi güne kadar anti- enfektifler gibi), CALQUENCETM ile tedavi kesilmelidir. Orta dereceli bir CYP3A inhibitörü kullanılıyorsa, hastalar toksisite belirtileri açısından yakından takip edilmelidir (bkz. Bölüm 4.2 ve 4.5). Etkililik eksikliği riski nedeniyle güçlü CYP3A4 indükleyicileri ile eş zamanlı kullanımdan kaçınılmalıdır.
Bu tıbbi ürün, her dozunda 1 mmol'den (23 mg) daha az sodyum ihtiva eder, yani aslında âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Akalabrutinib ve aktif metaboliti esas olarak sitokrom P450 enzimi 3A4 (CYP3A4) tarafından metabolize edilir ve her iki madde de P-gp ve meme kanseri direnç proteini (BCRP) için substrattır.
Akalabrutinib plazma konsantrasyonlarını artırabilecek etkin maddeler
CYP3A/P-gp inhibitörleri
Güçlü bir CYP3A/P-gp inhibitörü (5 gün boyunca günde bir kez 200 mg itrakonazol) ile birlikte uygulama, sağlıklı gönüllülerde (N = 17) akalabrutinib Cve EAA değerlerini sırasıyla 3,9 kat ve 5,0 kat artırmıştır.
Güçlü CYP3A/P-gp inhibitörleri ile eşzamanlı kullanımdan kaçınılmalıdır. Güçlü CYP3A/P-gp inhibitörleri (örneğin, ketokonazol, konivaptan, klaritromisin, indinavir, itrakonazol, ritonavir, telaprevir, posakonazol, vorikonazol) kısa süreli kullanılacaksa, CALQUENCETM ile tedaviye ara verilmelidir (bkz. Bölüm 4.2).
Sağlıklı gönüllülerde orta dereceli CYP3A inhibitörleriyle (tek doz olarak 400 mg flukonazol veya 5 gün boyunca tekrarlanan doz olarak 200 mg isavukonazol) birlikte uygulama, akalabrutinib Cve EAA'sını 1,4 kat artırarak 2 kata çıkarırken, aktif metabolit ACP-5862 Cve EAA, akalabrutinib'in tek başına dozlandığı zamana göre 0,65 kat azalarak 0,88 kata düşmüştür. Orta derecede CYP3A inhibitörleri ile kombinasyon halinde doz ayarlaması gerekli değildir. Hastalar advers reaksiyonlar açısından yakından izlenmelidir (bkz. Bölüm 4.2).
Akalabrutinib plazma konsantrasyonlarını azaltabilen etkin maddeler
CYP3A indükleyicileri
Güçlü bir CYP3A indükleyicisinin (9 gün boyunca günde bir kez 600 mg rifampisin) birlikte uygulanması, sağlıklı gönüllülerde (N = 24) akalabrutinib Cve EAA değerlerini sırasıyla %68 ve %77 azaltmıştır.
Güçlü CYP3A aktivitesi indükleyicileri (örn. fenitoin, rifampisin, karbamazepin) ile eş zamanlı kullanımdan kaçınılmalıdır. Akalabrutinib plazma konsantrasyonlarını tahmin edilemeyecek şekilde düşürebilen St. John's wort ile eş zamanlı tedaviden kaçınılmalıdır.
Mide asidini azaltan tıbbi ürünler
Akalabrutinib çözünürlüğü artan pH ile azalır. Akalabrutinibin bir antiasit (1 g kalsiyum karbonat) ile birlikte uygulanması, sağlıklı gönüllülerde akalabrutinib EAA değerini %53 azaltmıştır. Bir proton pompası inhibitörü (5 gün boyunca 40 mg omeprazol) ile birlikte uygulama, akalabrutinib EAA değerini %43 oranında azaltmıştır.
Bir asit azaltıcı ajan ile tedavi gerekiyorsa, bir antiasit (örn., kalsiyum karbonat) veya bir H2- reseptör antagonistinin (örn., ranitidin veya famotidin) kullanımı göz önünde bulundurulmalıdır. Antiasitlerle kullanım için, tıbbi ürünlerin alınması arasındaki süre en az 2 saat olmalıdır (bkz. Bölüm 4.2). H2-reseptör antagonistleri için, CALQUENCETM, H2-reseptör antagonistini almadan 2 saat önce (veya 10 saat sonra) alınmalıdır. Proton pompa inhibitörlerinin uzun süreli etkisi nedeniyle, proton pompa inhibitörleri ile dozların ayrılması, CALQUENCETM ile etkileşimi ortadan kaldırmayabilir ve bu nedenle eş zamanlı kullanımdan kaçınılmalıdır (bkz. Bölüm 4.2).
![]()
Plazma konsantrasyonları CALQUENCETM tarafından değiştirilebilen etkin maddeler
CYP3A substratları
In vitro verilere dayanılarak, akalabrutinibin intestinal düzeyde bir CYP3A4 inhibitörü olduğu ve bağırsak CYP3A metabolizmasına duyarlı CYP3A4 substratlarının maruziyetini artırabileceği olasılığı göz ardı edilmemelidir. Akalabrutinib, oral yoldan uygulanan dar terapötik aralıklı
CYP3A4 substratları (örn. siklosporin, ergotamin, pimozid) ile birlikte uygulanıyorsa dikkatli olunmalıdır.
Akalabrutinibin CYP1A2 substratları üzerindeki etkisi
In vitro çalışmalar, akalabrutinibin CYP1A2'yi indüklediğini göstermektedir. Akalabrutinibin CYP1A2 substratları (örn. teofilin, kafein) ile birlikte uygulanması, maruziyetlerini azaltabilir.
Akalabrutinib ve aktif metaboliti ACP-5862'nin tıbbi ürün taşıma sistemleri üzerindeki etkileri Akalabrutinib, intestinal BCRP'nin inhibisyonu yoluyla, birlikte uygulanan BCRP substratlarına (örn. metotreksat) maruziyeti artırabilir (bkz. Bölüm 5.2). Gastrointestinal (GI) sistemdeki etkileşim potansiyelini en aza indirmek için, metotreksat gibi oral dar terapötik aralıklı BCRP substratları, akalabrutinibden en az 6 saat önce veya sonra alınmalıdır.
ACP-5862, MATE1'in inhibisyonuyla, birlikte uygulanan MATE1 substratlarına (örn., metformin) maruziyeti artırabilir (bkz. Bölüm 5.2). Durumu MATE1'e bağlı olan eşzamanlı tıbbi ürünleri (örneğin, metformin) alan hastalar, CALQUENCETM alırken eş zamanlı ilaca artan maruziyetin bir sonucu olarak değişen tolerabilite belirtileri açısından izlenmelidir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Pediyatrik hastalarda CALQUENCETM'in güvenliliği ve etkililiği çalışılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisiGebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlara, CALQUENCETM alırken gebe kalmaktan kaçınmaları tavsiye edilmelidir.
Gebelik dönemi
CALQUENCETM'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Hayvan çalışmalarından elde edilen bulgulara göre, fetüsün gebelik sırasında akalabrutinibe maruz kalması nedeniyle bir risk olabilir. Sıçanda distosi (zor veya uzamış doğum eylemi) gözlenmiştir ve gebe tavşanlara uygulama, azalmış fetal büyüme ile ilişkilendirilmiştir (bkz. Bölüm 5.3).
Kadının klinik durumu akalabrutinib ile tedavi gerektirmedikçe gebelik sırasında CALQUENCETM kullanılmamalıdır.
Laktasyon dönemi
Akalabrutinibin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, akalabrutinibin sütle atıldığını göstermektedir. Emzirmenin durdurulup durdurulmayacağına ya da CALQUENCETM tedavisinin durdurulup durdurulmayacağına/
tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve CALQUENCETM tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Akalabrutinibin anne sütüyle beslenen çocuk veya süt üretimi üzerindeki etkisine dair veri yoktur. Akalabrutinib ve aktif metaboliti, emziren sıçanların sütünde tespit edilmiştir. Emzirilen çocuk için bir risk olasılığı göz ardı edilmemelidir. Emziren annelere, CALQUENCETM ile tedavi sırasında ve son dozu aldıktan sonraki 2 gün boyunca emzirmemeleri tavsiye edilir.
Üreme yeteneği/Fertilite
CALQUENCETM'in insan fertilitesi üzerindeki etkisine dair veri bulunmamaktadır. Erkek ve dişi sıçanlarda akalabrutinib ile yapılan klinik dışı bir çalışmada, fertilite parametreleri üzerinde herhangi bir advers etki gözlenmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
CALQUENCETM'in araç ve makine kullanma yeteneği üzerinde herhangi bir etkisi bulunmamaktadır veya göz ardı edilebilir düzeyde etkiye sahiptir. Bununla birlikte, akalabrutinib ile tedavi sırasında yorgunluk ve baş dönmesi bildirilmiştir ve bu semptomları yaşayan hastalara semptomlar geçene kadar araç veya makine kullanmamaları tavsiye edilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
CALQUENCETM monoterapisi ile tedavi edilen 1.040 hastadan, hastalarda bildirilen herhangi bir derecede en yaygın (≥%20) advers ilaç reaksiyonları (AİR'ler) enfeksiyon (%66,7), baş ağrısı (%37,8), diyare (%36,7), morarma (%34,1), kas-iskelet ağrısı (%33,1), bulantı (%21,7), yorgunluk
(%21,3), öksürük (%21) ve döküntü (%20,3) olmuştur. En yaygın olarak bildirilen (≥ %5) 3 ve daha büyük derece advers ilaç reaksiyonları enfeksiyon (%17,6), lökopeni (%14,3), nötropeni (%14,2) ve anemidir (%7,8).
CALQUENCETM kombinasyon tedavisi ile tedavi edilen 223 hastadan, hastalarda bildirilen herhangi bir derecede en yaygın (≥%20) AİR'ler enfeksiyon (%74), kas-iskelet ağrısı (%44,8), diyare (%43,9), baş ağrısı (%43), lökopeni (%31,8), nötropeni (%31,8), öksürük (%30,5),
yorgunluk (%30,5), artralji (%26,9), bulantı (%26,9), baş dönmesi (%23,8) ve kabızlık (%20,2) olmuştur. En yaygın olarak bildirilen (≥%5) 3. ve daha büyük derece advers ilaç reaksiyonları lökopeni (%30), nötropeni (%30), enfeksiyon (%21,5), trombositopeni (%9) ve anemidir (%5,8).
Advers reaksiyonların tablolaştırılmış listesi
Aşağıdaki advers ilaç reaksiyonları (AİR'ler), hematolojik malignitelere yönelik tedavi olarak CALQUENCETM alan hastalarla yapılan klinik çalışmalarda tanımlanmıştır. Havuzlanmış veri kümesinde CALQUENCETM tedavisinin medyan süresi 26,2 aydır.
Advers ilaç reaksiyonları, Sistem Organ Sınıfı'na göre sınıflandırılmıştır. Sıklık grupları şu şekilde tanımlanmıştır: çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila
<1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000) ve bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
İstenmeyen etkiler, her bir sıklık grubunda azalan ciddiyet sırasına göre verilmiştir.
Tablo 3: Akalabrutinib monoterapisi (n= 1.040) ile tedavi edilen hematolojik maligniteli hastaların advers ilaç reaksiyonları*
MedDRA SOC |
MedDRA Terimi | Genel Sıklık (tüm CTCAE dereceleri) | CTCAE Derecesi ≥ 3 Sıklığı |
Enfeksiyonlar ve enfestasyonlar | Üst solunum yolu enfeksiyonu | Çok yaygın (%22) | %0,8 |
Sinüzit | Çok yaygın (%10,7) | %0,3 | |
Pnömoni | Yaygın (%8,7) | %5,1 | |
İdrar yolu enfeksiyonu | Yaygın (%8,5) | %1,5 | |
Nazofarenjit | Yaygın (%7,4) | %0 | |
Bronşit | Yaygın (%7,6) | %0,3 | |
Herpes viral enfeksiyonları â | Yaygın (%5,9) | %0,7 | |
Aspergillus enfeksiyonları â | Yaygın olmayan (%0,5) | %0,4 | |
Hepatit B reaktivasyonu | Yaygın olmayan (%0,1) | %0,1 | |
(Kist ve polipler de dahil olmak üzere) İyi huylu ve kötü huylu neoplazmalar |
İkinci Primer Malignite â Melanom dışı deri malignitesi Melanom dışı deri hariç İPM |
Çok yaygın (%12,2) Yaygın (%6,6) Yaygın (%6,5) |
%4,1 %0,5 %3,8 |
Kan ve lenf sistemi hastalıkları | Nötropeni â | Çok yaygın (%15,7) | %14,2 |
Anemiâ | Çok yaygın (%13,8) | %7,8 | |
Trombositopeni â | Yaygın (%8,9) | %4,8 | |
Lenfositoz | Yaygın olmayan (%0,3) | %0,2 | |
Metabolizma ve beslenme hastalıkları |
Tümör Lizis Sendromu | Yaygın olmayan (%0,5) |
%0,4 |
Sinir sistemi hastalıkları | Baş ağrısı | Çok yaygın (%37,8) | %1,1 |
Baş dönmesi | Çok yaygın (%13,4) | %0,2 | |
Kardiyak hastalıkları | Atriyal fibrilasyon/Çarpıntıâ | Yaygın (%4,4) | %1,3 |
Vasküler hastalıkları | Morarma Kontüzyon Peteşi Ekimozlar | Çok yaygın (%34,1) Çok yaygın (%21,7) Çok yaygın (%10,7) Yaygın (%6,3) | %0 %0 %0 %0 |
Hemoraji/hematom Gastrointestinal hemoraji İntrakraniyal hemoraji | Çok yaygın (%12,6) Yaygın (%2,3) Yaygın (%1) | %1,8 %0,6 %0,5 | |
Epistaksis | Yaygın (%7) | %0,3 | |
| Diyare | Çok yaygın (%36,7) | %2,6 |
MedDRA SOC |
MedDRA Terimi | Genel Sıklık (tüm CTCAE dereceleri) | CTCAE Derecesi ≥ 3 Sıklığı |
Gastrointestinal hastalıkları | Bulantı | Çok yaygın (%21,7) | %1,2 |
Kabızlık | Çok yaygın (%14,5) | %0,1 | |
Kusma | Çok yaygın (%13,3) | %0,9 | |
Abdominal ağrıâ | Çok yaygın (%12,5) | %1 | |
Deri ve deri altı doku hastalıkları | Döküntüâ | Çok yaygın (%20,3) | %0,6 |
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları | Kas İskelet Ağrısı â | Çok yaygın (%33,1) | %1,5 |
Artralji | Çok yaygın (%19,1) | %0,7 | |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yorgunluk | Çok yaygın (%21,3) | %1,7 |
Asteni | Yaygın (%5,3) | %0,8 | |
Araştırmalar (Test sonuçlarına dayalı bulgular) | Hemoglobin azalması | Çok yaygın (%42,6) | %10,1 |
Mutlak nötrofil sayısında azalma | Çok yaygın (%41,8) | %20,7 | |
Trombosit azalması | Çok yaygın (%31,1) | %6,9 |
* Ulusal Kanser Enstitüsü Advers Olaylar için Ortak Terminoloji Kriterleri (NCI CTCAE) versiyon 4.03'e göre.
â Birden çok AİR terimi içerir.
± ASCEND Çalışmasında akalabrutinib kolunda ilaca bağlı bir Tümör Lizis Sendromu vakası gözlendi.
§ Bildirilen advers olayları değil, laboratuvar bulgularının insidansını temsil eder.
¶ CTCAE derece değerleri olarak sunulmuştur.
Tablo 4: Akalabrutinib kombinasyon tedavisi ile tedavi edilen hematolojik maligniteli hastaların advers ilaç reaksiyonları* (n= 223)
MedDRA SOC |
MedDRA Terimi | Genel Sıklık (tüm CTCAE dereceleri) | CTCAE Derecesi ≥ 3 Sıklığı |
Enfeksiyonlar ve enfestasyonlar | Üst solunum yolu enfeksiyonu | Çok yaygın (%31,4) | %1,8 |
Sinüzit | Çok yaygın (%15,2) | %0,4 | |
Nazofarenjit | Çok yaygın (%13,5) | %0,4 | |
İdrar yolu enfeksiyonu | Çok yaygın (%13) | %0,9 | |
Pnömoni | Çok yaygın (%10,8) | %5,4 | |
Bronşit | Yaygın (%9,9) | %0 | |
Herpes viral enfeksiyonları â | Yaygın (%6,7) | %1,3 | |
Progresif multifokal lökoensefalopati | Yaygın olmayan (%0,4) | %0,4 | |
Hepatit B reaktivasyonu | Yaygın olmayan (%0,9) | %0,1 |
MedDRA SOC |
MedDRA Terimi | Genel Sıklık (tüm CTCAE dereceleri) | CTCAE Derecesi ≥ 3 Sıklığı |
| Aspergillus enfeksiyonları â | Çok seyrek (%0) | %0 |
(Kist ve polipler de dahil olmak üzere) İyi huylu ve kötü huylu neoplazmalar | İkinci primer malignite â Melanom dışı deri malignitesi Melanom dışı deri hariç İPM | Çok yaygın (%13) Yaygın (%7,6) Yaygın (%6,3) | %4,0 %0,4 %3,6 |
Kan ve lenf sistemi hastalıkları | Nötropeni â | Çok yaygın (%31,8) | %30 |
Trombositopeni â | Çok yaygın (%13,9) | %9 | |
Anemiâ | Çok yaygın (%11,7) | %5,8 | |
Lenfositoz | Yaygın olmayan (%0,4) | %0,4 | |
Metabolizma ve beslenme hastalıkları |
Tümör Lizis Sendromu | Yaygın olmayan (%1,8) |
%1,3 |
Sinir sistemi hastalıkları | Baş ağrısı | Çok yaygın (%43) | %0,9 |
Baş dönmesi | Çok yaygın (%23,8) | %0 | |
Kardiyak hastalıklar | Atriyal fibrilasyon/Çarpıntıâ | Yaygın (%3,1) | %0,9 |
Vasküler hastalıkları | Morarma Kontüzyon Peteşi Ekimozlar | Çok yaygın (%38,6) Çok yaygın (%27,4) Çok yaygın (%11,2) Yaygın (%3,1) | %0 %0 %0 %0 |
Hemoraji/hematom Gastrointestinal hemoraji İntrakraniyal hemoraji | Çok yaygın (%17,5) Yaygın (%3,6) Yaygın olmayan (%0,9) | %1,3 %0,9 %0 | |
Epistaksis | Yaygın (%8,5) | %0 | |
Gastrointestinal hastalıklar | Diyare | Çok yaygın (%43,9) | %4,5 |
Bulantı | Çok yaygın (%26,9) | %0 | |
Kabızlık | Çok yaygın (%20,2) | %0 | |
Kusma | Çok yaygın (%19,3) | %0,9 | |
Abdominal ağrıâ | Çok yaygın (%14,8) | %1,3 | |
Deri ve deri altı doku hastalıkları | Döküntüâ | Çok yaygın (%30,9) | %1,8 |
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları | Kas-iskelet Ağrısı â | Çok yaygın (%44,8) | %2,2 |
Artralji |
Çok yaygın (%26,9) |
%1,3 | |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yorgunluk | Çok yaygın (%30,5) | %1,8 |
Asteni |
Yaygın (%7,6) |
%0,4 | |
| Mutlak nötrofil sayısında azalma | Çok yaygın (%57,4) | %35 |
MedDRA SOC |
MedDRA Terimi | Genel Sıklık (tüm CTCAE dereceleri) | CTCAE Derecesi ≥ 3 Sıklığı |
Araştırmalar (Test sonuçlarına dayalı bulgular) | Trombosit azalması | Çok yaygın (%46,2) | %10,8 |
Hemoglobin azalması |
Çok yaygın (%43,9) |
%9 |
* Ulusal Kanser Enstitüsü Advers Olaylar için Ortak Terminoloji Kriterleri (NCI CTCAE) versiyon 4.03'e göre.
â Birden çok AİR terimi içerir.
± ASCEND Çalışmasında akalabrutinib kolunda ilaca bağlı bir Tümör Lizis Sendromu vakası gözlenmiştir.
§Bildirilen advers olayları değil, laboratuvar bulgularının insidansını temsil eder.
¶ CTCAE derece değerleri olarak sunulmuştur.
Seçilen advers reaksiyonların tanımı
Advers reaksiyonlar nedeniyle tedavinin kesilmesi ve dozun azaltılması
CALQUENCETM monoterapisi ile tedavi edilen 1,040 hastadan, advers reaksiyonlar nedeniyle tedavinin kesilmesi, hastaların %9,3'ünde bildirilmiştir. Bu ana advers reaksiyonlar, pnömoni, trombositopeni ve diyareyi içermektedir. Advers reaksiyonlar nedeniyle doz azaltılması hastaların
%4,2'sinde bildirilmiştir. Bu ana advers reaksiyonlar arasında hepatit B reaktivasyonu, sepsis ve diyare yer almıştır.
CALQUENCETM kombinasyonu ile tedavi edilen 223 hastadan, yan etkiler nedeniyle tedavinin kesilmesi, hastaların %10,8'inde bildirilmiştir. Bu ana advers reaksiyonlar, pnömoni, trombositopeni ve diyareyi içermektedir. Advers reaksiyonlar nedeniyle doz azaltılması hastaların
%6,7'sinde bildirilmiştir. Bu ana yan etkiler nötropeni, diyare ve kusmayı içermiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Geriyatrik popülasyon:
CALQUENCETM monoterapisinin klinik çalışmalarındaki 1,040 hastadan %41'i 65 yaşın üzerinde ve 75 yaşın altındaydı ve %22'si 75 yaş ve üzerindeydi. 65 yaş ve üzeri ile altı hastalar arasında güvenlilik veya etkililik açısından klinik olarak önemli bir farklılık gözlenmemiştir.
CALQUENCETM'in obinutuzumab tedavisi kombinasyonunda klinik çalışmalarındaki 223 hastanın %47'si 65 yaşın üzerinde ve 75 yaşın altındadır ve %26'sı 75 yaşında veya üzeri yaşlardadır. 65 yaş ve üzeri ile altı hastalar arasında güvenlilik veya etkililik açısından klinik olarak önemli bir farklılık gözlenmemiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Akalabrutinib doz aşımı için spesifik bir tedavi bulunmamaktadır ve aşırı doz belirtileri belirlenmemiştir. Doz aşımı durumunda, hastalar advers reaksiyonların belirti ve semptomları açısından yakından izlenmeli ve uygun semptomatik tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EL02
Etki mekanizması
Akalabrutinib, Bruton tirozin kinazın (BTK) seçici bir inhibitörüdür. BTK, B hücresi antijen reseptörü (BCR) ve sitokin reseptör yolaklarının sinyal molekülüdür. B hücrelerinde, BTK sinyalizasyonu B hücresinin hayatta kalmasına ve çoğalmasına neden olur ve hücresel adezyon, hücreler arası haberleşme ve kemotaksis için gereklidir.
Akalabrutinib ve aktif metaboliti ACP-5862, BTK aktif bölgesinde bir sistein kalıntısı ile kovalent bir bağ oluşturur ve minimum hedef dışı etkileşimlerle BTK'nin geri dönüşsüz inaktivasyonuna yol açar.
Farmakodinamik etkiler
Günde iki kez 100 mg akalabrutinib dozları uygulanan, B hücresi maligniteleri olan hastalarda, periferik kanda ≥%95'lik medyan kararlı durum BTK varlığı 12 saat boyunca sürdürülmüş ve önerilen doz aralığı boyunca BTK'nın inaktivasyonu ile sonuçlanmıştır.
Kardiyak elektrofizyoloji
Akalabrutinibin QTc aralığı üzerindeki etkisi, plasebo ve pozitif kontrollü randomize, çift kör kapsamlı bir QT çalışmasında 46 sağlıklı erkek ve kadın gönüllüde değerlendirilmiştir. Önerilen maksimum dozun 4 katı supraterapötik bir dozda, CALQUENCETM, QT/QTc aralığını klinik olarak ilgili herhangi bir ölçüde uzatmamıştır (örn., ≤ 10 ms) (bkz. Bölüm 4.4, 4.8 ve 5.3).
Klinik etkililik ve güvenlilik
Daha önce tedavi edilmemiş KLL hastaları
CALQUENCETM'in daha önce tedavi edilmemiş KLL'de güvenliliği ve etkililiği, 535 hastayı içeren randomize, çok merkezli, açık etiketli bir Faz 3 çalışmasında (ELEVATE-TN) değerlendirilmiştir. Hastalar, CALQUENCETM artı obinutuzumab, CALQUENCETM monoterapisi veya obinutuzumab artı klorambusil almıştır. ELEVATE-TN çalışmasına 65 yaş ve üzeri veya 18 ile 65 yaşları arasında, eşzamanlı eşlik eden diğer hastalıkları bulunan hastalar dahil edilmiştir. Hastaların 27,9'unda CrCl <60 mL/dakikadır. 65 yaşın altındaki hastaların %16,1'inin medyan CIRS-G skoru 8'dir. Çalışmada, hastaların antitrombotik ajan almasına izin verilmiştir. Varfarin veya eşdeğer K vitamini antagonistleri ile antikoagülasyon gerektiren hastalar çalışma dışı tutulmuştur.
Hastalar 1:1:1 oranında aşağıdakileri almak üzere 3 kola randomize edilmiştir.
CALQUENCETM artı obinutuzumab (CALQUENCETM + G): CALQUENCETM 100 mg, hastalık progresyonu veya kabul edilemez toksisiteye kadar 1. döngü 1.günden başlayarak günde iki kez uygulanmıştır. Obinutuzumab, maksimum 6 tedavi döngüsü için 2. kür 1.
günden itibaren uygulanmıştır. 2. döngüden başlamak üzere, 1. ve 2. günlerde 1000 mg
obinituzumab (1. günde 100 mg, 2. günde 900 mg), 8. ve 15. günlerde 1000 mg obinituzumab,
3. döngüden 7. döngüye kadar ise her döngünün 1. gününde 1000 mg obinituzumab uygulanmıştır. Her döngü 28 gündür.
CALQUENCETM monoterapisi: CALQUENCETM 100 mg, hastalık progresyonuna veya kabul edilemez toksisiteye kadar günde iki kez uygulanmıştır.
Obinutuzumab artı klorambusil (GClb): Obinutuzumab ve klorambusil maksimum 6 tedavi döngüsü süresiyle uygulanmıştır. 1. ve 2. günlerde (1. günde 100 mg ve 2. günde 900 mg), 1. döngüde 8. ve 15. günlerde obinutuzumab 1.000 mg, ardından Döngü 2'den 6'ya kadar 1. günde 1.000 mg uygulanmıştır. Klorambusil 0,5 mg/kg 1. ila 6, Döngülerin 1. ve 15. günlerinde uygulanmıştır. Her döngü 28 gündür.
Hastalar 17p delesyon mutasyon durumuna (var ya da yok), ECOG performans durumuna (0 veya 1'e karşı 2) ve coğrafi bölgeye (Kuzey Amerika ve Batı Avrupa'ya karşı diğer) göre katmanlandırılmıştır. Doğrulanmış hastalık progresyonundan sonra, GClb kolunda randomize edilen 45 hasta, CALQUENCETM monoterapisine geçmiştir. Tablo 5'te, çalışma popülasyonunun temel demografik özellikleri ve hastalık özellikleri özetlenmektedir.
Tablo 5: Daha önce tedavi edilmemiş KLL (ELEVATE-TN) hastalarında başlangıç hasta karakteristikleri
Karakteristikler | CALQUENCE + obinutuzumab N=179 | CALQUENCE monoterapisi N=179 | Obinutuzumab + klorambusil N=177 |
Yaş, yıl; medyan (aralık) | 70 (41-88) | 70 (44-87) | 71 (46-91) |
Erkek; % | 62 | 62 | 59,9 |
Beyaz ırk; % | 91,6 | 95 | 93,2 |
ECOG performans durumu 0-1; % | 94,4 | 92,2 | 94,4 |
Tanıdan itibaren medyan süre (ay) | 30,5 | 24,4 | 30,7 |
≥ 5 cm nodları içeren kitlesel (bulky) hastalık; % | 25,7 | 38 | 31,1 |
Sitogenetik/FISH Kategorisi; % |
|
|
|
17p delesyonu | 9,5 | 8,9 | 9 |
11q delesyonu | 17,3 | 17,3 | 18,6 |
TP53 mutasyonu | 11,7 | 10,6 | 11,9 |
Mutasyonsuz IGHV | 57,5 | 66,5 | 65,5 |
Kompleks karyotip (≥ 3 anormallik) | 16,2 | 17,3 | 18,1 |
Rai evresi; % |
|
|
|
0 | 1.7 | 0 | 0,6 |
I | 30,2 | 26,8 | 28,2 |
II | 20,1 | 24,6 | 27,1 |
III | 26,8 | 27,9 | 22,6 |
IV | 21,2 | 20,7 | 21,5 |
Birincil sonlanım noktası, CALQUENCETM + G koluna karşı GClb kolunun, tedavi ile ilişkili lenfositoz ile ilgili bir açıklama eklenerek Uluslararası Kronik Lenfositik Lösemi Çalıştayı (IWCLL) 2008 kriterlerine göre bir Bağımsız İnceleme Komitesi (IRC) tarafından değerlendirilen progresyonsuz sağkalımdır (PFS) (Cheson 2012). Medyan 28,3 aylık takip süresiyle IRC'nin PFS'si, GClb koluna kıyasla CALQUENCETM + G kolunda daha önce tedavi edilmemiş KLL hastalarında hastalık progresyonu veya ölüm riskinde %90 istatistiksel olarak anlamlı bir azalma
olduğunu göstermiştir. Etkililik sonuçları Tablo 6'da sunulmaktadır. PFS için Kaplan-Meier eğrileri Şekil 1'de gösterilmektedir.
Tablo 6: KLL hastalarında (ELEVATE-TN) IRC Değerlendirmelerine göre etkililik sonuçları
| CALQUENCE + obinutuzumab N=179 | CALQUENCE monoterapisi N=179 | Obinutuzumab + klorambusil N=177 |
Progresyonsuz sağkalım | |||
Olay sayısı (%) | 14 (7,8) | 26 (14,5) | 93 (52,5) |
PD, n (%) | 9 (5) | 20 (11.2) | 82 (46,3) |
Ölüm olayları (%) | 5 (2,8) | 6 (3,4) | 11 (6,2) |
Medyan (%95 GA), ay | Ulaşılmamıştır | Ulaşılmamıştır (34,2, Ulaşılmamıştır) | 22,6 (20,2, 27,6) |
HR â (%95 GA) | 0,10 (0,06, 0,17) | 0,20 (0,13, 0,30) | - |
p değeri | < 0,0001 | < 0,0001 | - |
24 aylık tahmin % (%95 GA) | 92,7 (87,4, 95,8) | 87,3 (80,9, 91.7) | 46,7 (38,5, 54,6) |
Genel sağkalım | |||
Ölüm olayları (%) | 9 (5) | 11 (6,1) | 17 (9,6) |
Tehlike Oranı (%95 GA) â | 0,47 (0,21, 1.06) | 0,60 (0,28, 1.27) | - |
En iyi genel yanıt oranı (CR + CRi + nPR + PR) | |||
ORR, n (%) (%95 GA) | 168 (93,9) (89,3, 96,5) | 153 (85,5) (79,6, 89,9) | 139 (78,5) (71.9, 83,9) |
P değeri | < 0,0001 | 0,0763 | - |
CR, n (%) | 23 (12,8) | 1 (0,6) | 8 (4,5) |
CRi, n (%) | 1 (0,6) | 0 | 0 |
nPR, n (%) | 1 (0,6) | 2 (1.1) | 3 (1.7) |
PR, n (%) | 143 (79,9) | 150 (83,8) | 128 (72,3) |
GA = güven aralığı; HR = tehlike oranı; CR = tam yanıt; CRi = tamamlanmamış kan sayımı geri kazanımı ile tam yanıt; nPR = nodüler kısmi yanıt; PD= Progresif hastalık; PR = kısmi yanıt
* IRC değerlendirmesine göre
â Katmanlı Cox-Orantılı-Tehlikeler modeline göre
a her iki kol için Medyan OS'ye ulaşılmamıştır.
Şekil 1: KLL (ELEVATE-TN) hastalarında IRC ile değerlendirilen PFS'nin Kaplan-Meier eğrisi (ITT Popülasyonu)
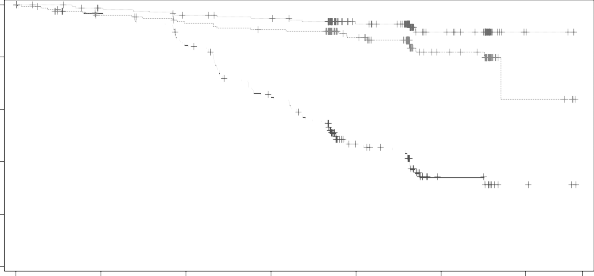
Calquence+G
Calquence
GClb
Progresyonsuz sağ kalım(%)
![]()
Randomizasyondan sonra geçen süre (ay)
Riskli hasta sayısı | ||||||||||||||
Ay | 0 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 27 | 30 | 33 | 36 | 39 |
CALQUENCE | 179 | 166 | 161 | 157 | 153 | 150 | 148 | 147 | 103 | 94 | 43 | 40 | 4 | 3 |
CALQUENCE+G | 179 | 176 | 170 | 168 | 163 | 160 | 159 | 155 | 109 | 104 | 46 | 41 | 4 | 2 |
GClb | 177 | 162 | 157 | 151 | 136 | 113 | 102 | 86 | 46 | 41 | 13 | 13 | 3 | 2 |
Obinutuzumablı veya obinutuzumabsız CALQUENCETM için PFS sonuçları, yüksek riskli özellikler dahil olmak üzere alt gruplar arasında tutarlı olmuştur. Yüksek riskli KLL popülasyonunda (17p delesyonu, 11q delesyonu, TP53 mutasyonu veya mutasyona uğramamış IGHV), obinutuzumablı veya obinutuzumabsız CALQUENCETM'in PFS Tehlike Oranları, obinutuzumab artı klorambusil karşısında sırasıyla 0,08 [%95 GA (0,04, 0,15)] ve 0,13 [%95 GA
(0,08, 0,21)] olarak bulunmuştur.
Tablo 7: PFS'nin alt grup analizi (ELEVATE-TN Çalışması)
| CALQUENCE monoterapisi | CALQUENCE+G | ||||
N | Tehlike oranı | %95 GA | N | Tehlike oranı | %95 GA | |
Tüm olgular | 179 | 0,20 | (0,13, 0,30) | 179 | 0,10 | (0,06, 0,17) |
Del 17P |
|
|
|
|
|
|
Evet | 19 | 0,20 | (0,06, 0,64) | 21 | 0,13 | (0,04, 0,46) |
Hayır | 160 | 0,20 | (0,12, 0,31) | 158 | 0,09 | (0,05, 0,17) |
TP53 mutasyonu |
|
|
|
|
|
|
Evet | 19 | 0,15 | (0,05, 0,46) | 21 | 0,04 | (0,01, 0,22) |
Hayır | 160 | 0,20 | (0,12, 0,32) | 158 | 0,11 | (0,06, 0,20) |
Del 17P veya/ve |
|
|
|
|
|
|
TP53 mutasyonu |
|
|
|
|
|
|
Evet | 23 | 0,10 | (0,03, 0,34) | 25 | (0,03, 0,34) | (0,09, 0,48) |
Hayır | 156 | 0,10 | (0,05, 0,18) | 154 | (0,05, 0,18) | (0,21, 0,61) |
| CALQUENCE monoterapisi | CALQUENCE+G | ||||
N | Tehlike oranı | %95 GA | N | Tehlike oranı | %95 GA | |
IGHV mutasyonu |
|
|
|
|
|
|
Mutasyonlu | 58 | 0,69 | (0,31, 1,56) | 74 | 0,15 | (0,04, 0,52) |
Mutasyonsuz | 119 | 0,11 | (0,07, 0,19) | 103 | 0,08 | (0,04, 0,16) |
Del 11q |
|
|
|
|
|
|
Evet | 31 | 0,07 | (0,02, 0,22) | 31 | 0,09 | (0,03, 0,26) |
Hayır | 148 | 0,26 | (0,16, 0,41) | 148 | 0,10 | (0,05, 0,20) |
Kompleks Karyotip |
|
|
|
|
|
|
Evet | 31 | 0,10 | (0,03, 0,33) | 29 | 0,09 | (0,03, 0,29) |
Hayır | 117 | 0,27 | (0,16, 0,46) | 126 | 0,11 | (0,05, 0,21) |
Daha önce en az bir tedavi almış KLL hastaları
CALQUENCETM'in nükseden veya refrakter KLL'deki güvenliliği ve etkililiği, BCL-2 inhibitörleri veya B hücresi reseptör inhibitörleri hariç en az bir tedavi almış 310 hastayı içeren randomize, çok merkezli, açık etiketli bir faz 3 çalışmada (ASCEND) değerlendirilmiştir. Hastalar CALQUENCETM monoterapisi veya araştırmacının tercihi olan idelalisib artı rituksimab veya bendamustin artı rituksimab ile tedavi edilmiştir. Çalışmada hastaların antitrombotik ajanlar almasına izin verilmiştir. Varfarin veya eşdeğer K vitamini antagonistleri ile antikoagülasyon gerektiren hastalar çalışma dışı bırakılmıştır.
Hastalar, aşağıdakilerden birini almak üzere 1:1 oranında randomize edilmiştir:
Hastalık progresyonuna ya da kabul edilemez toksisiteye kadar günde iki kez 100 mg CALQUENCETM veya
Araştırmacının tercihi:
İlk döngünün 1. gününde rituksimab 375 mg/m2 IV ile kombinasyon halinde günde iki kez 150 mg idelalisib, ardından 4 doz boyunca her 2 haftada bir 500 mg/m2 IV, ardından toplam 8 infüzyon olmak üzere 4 haftada bir 3 doz
6 döngüye kadar her 28 günlük döngünün 1. gününde rituksimab (375 mg/m2/500 mg/m2) ile kombinasyon halinde bendamustin 70 mg/m2 (her 28 günlük döngünün 1. ve 2. günü)
5.2. Farmakokinetik özellikler
Akalabrutinib ve aktif metaboliti ACP-5862'nin farmakokinetiği (FK), sağlıklı gönüllülerde veB hücresi maligniteleri olan hastalarda çalışılmıştır. Akalabrutinib, doz oransallığı gösterir ve hem akalabrutinib hem de ACP-5862, 75 ila 250 mg'lık bir doz aralığında neredeyse doğrusal FK sergiler. Popülasyon FK modellemesi, akalabrutinib ve ACP-5862'nin FK'sinin farklı B hücresi maligniteleri olan hastalar arasında benzer olduğunu göstermektedir. B hücresi maligniteleri (KLL dahil) olan hastalarda önerilen günde iki kez 100 mg dozunda, zaman eğrisi boyunca plazma konsantrasyonunun altındaki geometrik ortalama kararlı durum günlük alan (EAA) ve maksimum plazma konsantrasyonu (C) akalabrutinib için sırasıyla 1679 ngâ¢s/mL ve 438 ng/mL ve ACP-5862 için sırasıyla 4166 ngâ¢s/mL ve 446 ng/mL'dir.
Emilim:
En yüksek plazma konsantrasyonlarına kadar geçen süre (T) akalabrutinib için 0,5-1,5 saat ve ACP-5862 için 1,0 saattir. CALQUENCETM'in mutlak biyoyararlanımı %25 bulunmuştur.
Yiyeceklerin akalabrutinib üzerindeki etkisi:
Sağlıklı gönüllülerde yüksek oranda yağ ve yüksek oranda kalori içeren bir öğünle (yaklaşık 918 kalori, 59 gram karbonhidrat, 59 gram yağ ve 39 gram protein) tek bir 75 mg akalabrutinib dozunun uygulanması, aç karnına uygulanan doza kıyasla ortalama EAA'yı etkilememiştir. Sonuçta oluşan C%69 azalmış ve T1-2 saat gecikmiştir.
Dağılım:
İnsan plazma proteinine geri dönüşlü bağlanma, akalabrutinib için %99,4 ve ACP-5862 için %98,8 olmuştur. İn vitro ortalama kan/plazma oranı akalabrutinib için 0,8 ve ACP-5862 için 0,7'dir. Akalabrutinib için ortalama kararlı durum dağılım hacmi (Vss) yaklaşık 34 L'dir.
Biyotransformasyon/Metabolizma
In vitro ortamda akalabrutinib, ağırlıklı olarak CYP3A enzimleri tarafından ve küçük ölçüde de glutatyon konjugasyonu ve amid hidrolizi ile metabolize edilir. ACP-5862, plazmadaki ana metabolit olarak tanımlanmıştır ve bu metabolit, esas olarak ve akalabrutinib maruziyetinden yaklaşık 2 ila 3 kat daha yüksek geometrik ortalama maruziyet (EAA) ile CYP3A aracılı oksidasyonla metabolize edilmiştir. ACP-5862, BTK inhibisyonu açısından akalabrutinibden yaklaşık %50 daha az potenttir.
In vitro çalışmalar, akalabrutinibin klinik olarak ilgili konsantrasyonlarda CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, UGT1A1 veya UGT2B7'yi inhibe etmediğini ve bu CYP'lerin substratlarının klirensini etkilemesinin olası olmadığını göstermektedir.
In vitro çalışmalar, ACP-5862'nin klinik olarak ilgili konsantrasyonlarda CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4/5, UGT1A1 veya UGT2B7'yi inhibe
etmediğini ve bu CYP'lerin substratlarının klirensini etkilemesinin olası olmadığını göstermektedir.
Taşıma proteinleri ile etkileşimler
In vitro çalışmalar, akalabrutinib ve ACP-5862'nin P-gp ve BCRP substratları olduğunu göstermektedir. Bununla birlikte, BCRP inhibitörleri ile birlikte uygulama, klinik olarak ilgili ilaç etkileşimlerine neden olma olasılığı düşüktür. Bir OATP1B1/1B3 inhibitörü (600 mg rifampin, tek doz) ile birlikte uygulama, akalabrutinib Cve EAA değerlerinde sırasıyla 1,2 kat ve 1,4 kat (N = 24, sağlıklı gönüllüler) artışa neden olmuştur ki bu farklar klinik olarak anlamlı değildir.
Akalabrutinib ve ACP-5862, klinik olarak ilgili konsantrasyonlarda P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 ve MATE2-K'yi inhibe etmez. Akalabrutinib, bağırsak BCRP'yi inhibe edebilirken, ACP-5862, klinik olarak ilgili konsantrasyonlarda MATE1'i inhibe edebilir (bkz. Bölüm 4.5). Akalabrutinib, MATE1'i inhibe etmezken ACP-5862, klinik olarak ilgili konsantrasyonlarda BCRP'yi inhibe etmez.
Eliminasyon
Tek bir oral 100 mg akalabrutinib dozunu takiben, akalabrutinibin terminal eliminasyon yarılanma ömrü (t) 1 ila 2 saat olmuştur. Aktif metabolit ACP-5862'nin t'si yaklaşık 7 saattir.
Ortalama görünür oral klirens (CL/F), B hücresi maligniteleri olan hastalarda akalabrutinib için 134 L/saat ve ACP-5862 için 22 L/saattir.
Sağlıklı gönüllülerde radyoaktif işaretli tek bir 100 mg [14C]-akalabrutinib dozunun uygulanmasının ardından, dozun %84'ü feçeste ve dozun %12'si idrarda tespit edilmiş, dozun
%2'sinden azının ise değişmemiş akalabrutinib olduğu belirlenmiştir.
Hastalardaki karakteristik özellikler
Popülasyon FK analizine göre, yaş (> 18 yaş), cinsiyet, ırk (Beyaz, Afrikalı Amerikalı) ve vücut ağırlığı, akalabrutinib ve aktif metaboliti ACP-5862'nin FK'si üzerinde klinik olarak anlamlı etkilere sahip değildir.
Pediatrik popülasyon
18 yaşın altındaki hastalarda CALQUENCETM ile herhangi bir farmakokinetik çalışma yapılmamıştır.
Böbrek yetmezliği
Akalabrutinib minimal renal eliminasyona uğrar. Böbrek yetmezliği olan hastalarda farmakokinetik bir çalışma yapılmamıştır.
Popülasyon FK analizine göre, hafif böbrek yetmezliği olan (MDRD ile tahmini eGFR 60 ila 89 mL/dk/1,73 m2 arasında) 408 gönüllüde, orta derecede böbrek yetmezliği olan 109 gönüllüde (eGFR 30 ila 59 mL/dk/1,73m2 arasında), normal böbrek fonksiyonuna sahip (eGFR 90 mL/dk/1,73m2'den büyük veya buna eşit) 192 gönüllüye göre klinik olarak anlamlı bir farmakokinetik fark gözlenmemiştir. Akalabrutinibin farmakokinetiği, şiddetli böbrek yetmezliği (eGFR 29 mL/dk/1,73m2'den az) veya diyaliz gerektiren böbrek yetmezliği olan hastalarda karakterize edilmemiştir. Kreatinin düzeyleri kurumsal ULN'nin 2,5 katından daha yüksek olan hastalar klinik çalışmalara dahil edilmemiştir (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Akalabrutinib, karaciğerde metabolize edilir. Özel karaciğer yetmezliği (KY) çalışmalarında, normal karaciğer fonksiyonu olan gönüllülerle (n= 6) karşılaştırıldığında, akalabrutinib maruziyeti (EAA), sırasıyla hafif (n= 6) (Child-Pugh A), orta (n=6) (Child-Pugh B) ve şiddetli (n= 8) (Child- Pugh C) karaciğer yetmezliği olan gönüllülerde 1,9 kat, 1,5 kat ve 5,3 kat artmıştır. Bununla birlikte, orta dereceli karaciğer yetmezliği grubundaki gönüllüler, ilaçların eliminasyon kapasitesi ile ilgili belirteçlerde önemli ölçüde etkilenmemişlerdir, bu nedenle, bu çalışmada orta derecede karaciğer yetmezliğinin etkisi muhtemelen olduğundan düşük hesaplanmıştır. Popülasyon FK analizine göre, hafif (n= 79) veya orta (n= 6) dereceli karaciğer yetmezliği (toplam bilirubin, ULN'nin 1,5 ila 3 katı arasında ve herhangi bir AST düzeyi) olan hastalar arasında, karaciğer fonksiyonu normal (n= 613) (toplam bilirubin ve ULN dahilinde AST düzeyi) gönüllülere kıyasla klinik olarak anlamlı bir fark gözlenmemiştir (bkz. bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite:
Akalabrutinib ile karsinojenisite çalışmaları yapılmamıştır.
Genotoksisite/Mutajenisite/Fototoksisite:
Akalabrutinib, bakteriyel ters mutasyon analizinde, in vitro kromozom aberasyon tayininde veya
in vivo fare kemik iliği mikronükleus tayininde mutajenik etki göstermemiştir.
Akalabrutinibin 3T3 hücre hattı kullanılarak yapılan bir in vitro fototoksisite tayininde olası bir fototoksik potansiyele sahip olduğu bulunmuştur (bkz. Bölüm 4.4).
Tekrarlı doz toksisitesi
Sıçanlarda, tüm doz seviyelerinde pankreasta minimal ila hafif şiddette mikroskobik bulgular (adacıklarda hemoraji/pigment/enflamasyon/fibroz) gözlenmiştir. Sıçanlarda 30 mg/kg/gün Advers Etkinin Gözlenmediği Seviyenin (NOAEL) kullanıldığı 6 aya kadar sürelere sahip çalışmalarda, böbreklerde minimal ila hafif şiddette advers olmayan bulgular (tübüler bazofili, tübüler rejenerasyon ve enflamasyon) gözlenmiştir. Erkek ve dişi sıçanlarda NOAEL'deki ortalama maruziyet (EAA), günde iki kez 100 mg'lık önerilen dozda klinik maruziyetin sırasıyla 0,6 ve 1 katına karşılık gelir. Kronik sıçan çalışmasında geri dönüşlü böbrek (orta derecede tübüler dejenerasyon) ve karaciğer (münferit hepatosit nekrozu) bulgularının gözlemlendiği Advers
Etkinin Gözlendiği En Düşük Seviye (LOAEL) 100 mg/kg/gün olmuş ve günde iki kez 100 mg'lık önerilen dozdaki klinik maruziyetin 4,2 katı büyük bir maruziyet marjı vermiştir. Köpeklerde 9 ay süreli çalışmalarda NOAEL, önerilen klinik dozda klinik EAA'nın 3 katı maruziyete karşılık gelen 10 mg/kg/gün olmuştur. Köpeklerde 30 mg/kg/gün'de (klinik EAA'nın 9 katı) böbrekte minimal tübüler dejenerasyon, dalak ağırlıklarında hafif düşüşler ve kırmızı hücre kütlesinde geçici minimal ila hafif düşüşler ve ALT ve ALP'de artışlar gözlenmiştir. Sıçanlarda (miyokardiyal hemoraji, enflamasyon, nekroz) ve köpeklerde (perivasküler/vasküler enflamasyon) kardiyak toksisiteler, yalnızca tolere edilen maksimum dozun (MTD) üzerindeki dozlarda çalışmalar sırasında ölen hayvanlarda gözlenmiştir. Kalp bulguları olan sıçanlarda ve köpeklerde maruziyet, sırasıyla klinik EAA'nın en az 6,8 katı ve 25 katıdır. Kalp bulguları sadece MTD'nin üzerindeki dozlarda gözlendiğinden bu bulgular için geri dönüşlülük değerlendirilememiştir.
Üreme toksikolojisi
Önerilen dozda sırasıyla klinik EAA'nın 10 veya 9 katı maruziyetlerde erkek veya dişi sıçanlarda fertilite üzerinde hiçbir etki gözlenmemiştir.
Gebe sıçanlarda, günde iki kez 100 mg'lık önerilen dozda, hastalarda EAA'nın yaklaşık 9 katı maruziyetlerde, embriyofetal gelişim ve sağkalım üzerinde herhangi bir etki gözlenmemiştir. İki sıçan üreme çalışmasında, günde iki kez 100 mg klinik maruziyetin 2,3 katından büyük maruziyetlerde distosi (uzamış/zor doğum) gözlenmiştir. Fetal sıçan plazmasında akalabrutinib ve aktif metabolitinin varlığı doğrulanmıştır. Akalabrutinib ve aktif metabolitinin, emziren sıçanların sütünde mevcut olduğu görülmüştür.
Gebe tavşanlarda yapılan bir embriyofetal çalışmada, önerilen dozda insan EAA değerinden 2,4 kat daha fazla olan maternal toksisite üreten maruziyet düzeylerinde fetal vücut ağırlığında azalma ve kemikleşmede gecikme gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül içeriği Mikrokristal selüloz Kolloidal susuz silika
Prejelatinize edilmiş mısır nişastası Magnezyum stearat (E470b) Sodyum nişasta glikolat
Kapsül kabuğu
Jelatin (sığır kaynaklı) Titanyum dioksit (E171) Sarı demir oksit (E172) İndigo karmin (E132)
Baskı boyası Şellak
Siyah demir oksit (E172) Propilen glikol (E1520) Amonyum hidroksit
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
6 veya 8 sert kapsül içeren güneş/ay sembollü alüminyum/alüminyum blisterler. Her bir karton kutuda 56 veya 60![]() sert kapsül bulunmaktadır.
sert kapsül bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 117241.31 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 117241.31 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699786150010 |
| Etkin Madde | Acalabrutinib |
| ATC Kodu | L01EL02 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvec ) ve Beşeri bir ilaçdır. |