CANCIDAS 70 mg 1 flakon Kısa Ürün Bilgisi
{ Kaspofungin Asetat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
CANCIDAS 70 mg Konsantre Çözelti için İnfüzyonluk Liyofilize Toz Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her flakon 70 mg kaspofungine eşdeğer 75,6 mg kaspofungin asetat içerir.
Yardımcı maddeler
Sodyum hidroksit (pH ayarlaması için) Yardımcı maddeler için bkz. bölüm 6.1.
3. FARMASÖTİK FORMU
İnfüzyon için liyofilize toz.
Hazırlamadan önce toz beyaz-beyaza yakın renkte kompakt bir tozdur.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
CANCIDAS erişkinlerde ve pediyatrik hastalarda (3 aylıktan büyük) aşağıdaki durumlar için endikedir:
Ateşli, nötropenik hastalarda kuşkulanılan fungal enfeksiyonların ampirik tedavisi,
4.2. Pozoloji ve uygulama şekli
Pozoloji/ Uygulama sıklığı ve süresi:Erişkin hastalarda (18 yaş ve üzeri) önerilen dozaj
Klasik doz günde bir kez 50 mg'dir (çoğu endikasyonda 70 mg yükleme dozunun ardından uygulanır). Günde 150 mg dozunun güvenliliği ve etkililiği (tedavi süresi: 1-51 gün; ortalama: 14 gün) kandidemi ve diğer Candida enfeksiyonları olan 100 erişkin hastada incelenmiştir. Bu yüksek dozda CANCIDAS'ın etkililiği CANCIDAS'ın günde 50 mg dozunun etkililiğinden anlamlı olarak daha iyi değildi. CANCIDAS'ın endike olduğu diğer erişkin hastalarda günde 50 mg'dan yüksek dozların etkililiği bilinmemektedir (bkz. bölüm 5.2).
Ampirik Tedavi
1. günde tekli 70 mg yükleme dozu ve ardından günde 50 mg uygulanmalıdır. Tedavi süresi hastanın klinik yanıtına dayanmalıdır. Nötropeni iyileşinceye kadar ampirik tedaviye devam edilmelidir. Fungal enfeksiyon saptanan hastalar en az 14 gün tedavi edilmelidir; tedaviye hem nötropeni hem de klinik semptomlar ortadan kalktıktan sonra en az 7 gün devam edilmelidir.
50 mg dozu iyi tolere edilir, fakat yeterli klinik yanıt sağlanamazsa, günlük doz 70 mg'a çıkarılabilir.
Kandidemi ve diğer candida enfeksiyonları
1. günde tekli 70 mg yükleme dozu ve ardından günde 50 mg uygulanmalıdır. Tedavi süresi hastanın klinik ve mikrobiyolojik yanıtına göre belirlenmelidir. Genel olarak, antifungal tedavi son pozitif kültürden sonra en az 14 gün devam etmelidir. Nötropenisi devam eden hastalarda nötropeni iyileşinceye kadar daha uzun tedavi süresi gerekebilir.
Özofajiyal kandidiyazis
Doz, semptomlar ortadan kalktıktan sonra 7-14 gün süreyle günde bir kez 50 mg'dir. Bu endikasyon için 70 mg yükleme dozu incelenmemiştir. HIV enfeksiyonlu hastalarda orofarenjiyal kandidiyazisin relaps riski mevcut olduğundan, supresif oral tedavi düşünülebilir (bkz. bölüm 5.2).
İnvazif aspergilloz
1. günde tekli 70 mg yükleme dozu ve ardından günde 50 mg uygulanmalıdır. Tedavi süresi hastada altta yatan hastalığın şiddetine, immün supresyondan sonra iyileşmeye ve klinik yanıta bağlı olarak belirlenmelidir.
İlaç klerens indükleyicilerini eş zamanlı alan hastalar
Rifampin alan erişkin hastalar günde 70 mg CANCIDAS almalıdır. Nevirapin, efavirenz, karbamazepin, deksametazon veya fenitoin alan hastalarda CANCIDAS'ın günlük dozunun 70 mg'ye çıkarılması gerekebilir (bkz. bölüm 4.5).
Tedavi süresi, erişkinlerde her bir endikasyon için tarif edilen şekilde, endikasyona göre belirlenmelidir (bkz. bölüm 4.2). Günde 50 mg/mdozu iyi tolere edilir; fakat yeterli klinik yanıt sağlamazsa, günlük doz günde 70 mg/m'ye yükseltilebilir (70 mg aşılmamalıdır).
Uygulama şekli:
Hazırlama ve seyreltme işlemlerinden sonra, CANCIDAS yaklaşık 1 saat süren, yavaş intravenöz
(IV) infüzyonla uygulanmalıdır. Hazırlama talimatları için bkz. bölüm 6.6. CANCIDAS IV bolus şeklinde uygulanmamalıdır.
Hem 70 mg hem de 50 mg flakonlar mevcuttur. Kaspofungin tekli günlük infüzyon şeklinde verilmelidir.
Özel popülasyonlara ilişkin ek bilgiler
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda doz ayarlaması gerekmez (bkz. bölüm 5.2).
Karaciğer yetmezliği
Hafif karaciğer yetmezliği olan erişkin hastalarda (Child-Pugh skoru 5 - 6) dozaj ayarlaması gerekmez. Orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh skoru 7- 9), farmakokinetik verilere dayanarak günde 35 mg CANCIDAS önerilir. Başlangıçta 1. günde 70 mg yükleme dozu uygulanmalıdır. Ciddi karaciğer yetmezliği olan erişkin hastalarda (Child-Pugh skoru >9) ve herhangi bir derecede karaciğer yetmezliği olan pediyatrik hastalarda klinik deneyim yoktur.
Pediyatrik popülasyon
CANCIDAS'ın yeni doğanlarda ve 12 ay altı çocuklardaki klinik çalışmalarda güvenliliği ve etkililiği yeterli oranda çalışılmamıştır. Bu yaş grubuna uygulanırken dikkatli olunmalıdır. Günde 25 mg/mCANCIDAS'ın yeni doğanlarda ve bebeklerde (üç aydan küçük) ve günde 50 mg/mCANCIDAS'ın çocuklarda (3-11 ay) kullanımıyla ilgili sınırlı veri vardır (bkz. bölüm 5.2).
Pediyatrik hastalarda (3 ay-17 yaş arası) önerilen dozaj
Tüm endikasyonlarda 1. günde tekli 70 mg/myükleme dozu ve ardından günde 50 mg/muygulanmalıdır. Eğer günde 50 mg/mdozu iyi tolere edilir; fakat yeterli klinik yanıtı sağlamazsa, doz günde 70 mg/m'ye çıkarılabilir (gerçek doz günde 70 mg'yi aşmamalıdır. Hastanın hesaplanan dozu ne olursa olsun, maksimum yükleme dozu ve günlük idame dozu olan 70 mg'ı aşmamalıdır. Pediyatrik hastalarda (3 ay-17 yaş arası) dozaj hastanın aşağıdaki formülle hesaplanan Vücut Yüzey Alanına (VYA) göre belirlenmelidir (bkz. Mosteller Formula- Ref: Mosteller RD: Simplified Calculation of Body Surface Area. N Engl J Med 1987 Oct 22;317(17 ): 1098 (letter)).
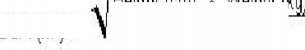
VYA(m) =
Boy (cm) x Kilo (kg) 3600
Hastanın VYA'sı hesaplandıktan sonra, miligram cinsinden yükleme dozu VYA (m ) x 70 mg/m çarpımıyla hesaplanmalıdır. Miligram cinsinden idame dozu VYA (m ) x 50 mg/mçarpımıyla hesaplanmalıdır.
CANCIDAS pediyatrik hastalara ilaç klirensinin indükleyicileriyle (rifampin, nevirapin, efavirenz, karbamazepin, deksametazon veya fenitoin) eş zamanlı olarak uygulanırken CANCIDAS'ın günde 70 mg/mdozu düşünülmelidir (70 mg aşılmamalıdır) (bkz. bölüm 4.2).
Geriyatrik popülasyon
Yaşlı hastalarda (65 yaş ve üzeri) eğri altında kalan alan (EAA) yaklaşık %30 artar. Ancak sistematik doz ayarlaması gerekmez. 65 yaş ve üzeri hastalarda tedavi deneyimi sınırlıdır (bkz. bölüm 5.2).
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Kaspofungin uygulaması sırasında anaflaksi rapor edilmiştir. Anaflaksi ortaya çıkarsa kaspofungin kesilmeli ve uygun tedavi uygulanmalıdır. Döküntü, yüzde şişlik, anjiyoödem, kaşıntı, sıcaklık hissi veya bronkospazm gibi muhtemelen histamin aracılı istenmeyen olaylar bildirilmiştir; bu olaylar ilacın kesilmesini ve/veya uygun tedavinin uygulanmasını gerektirebilir.
Sınırlı veriler daha az yaygın olan Candida dışı mayalar ve Aspergillus dışı küflere karşı kaspofunginin etkili olmadığını göstermektedir. Kaspofunginin bu fungal patojenlere karşı etkililiği belgelenmemiştir.
Kaspofunginin siklosporin ile eş zamanlı uygulanması sağlıklı yetişkin gönüllülerde ve yetişkin hastalarda değerlendirilmiştir.
Siklosporinin 3 mg/kg'lık iki dozu ile birlikte kaspofungin alan bazı sağlıklı yetişkin gönüllülerin alanin transaminaz (ALT) ve aspartat transaminaz (AST) düzeylerinde normalin üst sınırının (ULN) ï£3 katı geçici yükselmeler görülmüş ve tedavinin kesilmesiyle bu artışlar normale dönmüştür. Pazarlama sonrası dönemde kaspofungin ve siklosporin ile 1-290 gün arasında değişen sürelerle (medyan 17,5 gün) tedavi edilen 40 hastanın incelendiği geriye dönük bir çalışmada ciddi hiçbir hepatik istenmeyen olay kaydedilmemiştir. Bu veriler siklosporin alan hastalarda kaspofunginin potansiyel yararı potansiyel riskten fazla olduğunda kullanılabileceğini ortaya koymaktadır. Kaspofungin ve siklosporin eş zamanlı uygulandığında karaciğer enzimlerinin yakından takip edilmesi gerektiği göz önüne alınmalıdır.
Hafif ve orta derecede karaciğer bozukluğu olan yetişkin hastalarda EAA sırasıyla yaklaşık % 20 ve %75 artar. Orta derecede karaciğer bozukluğu olan yetişkinlerde günlük dozun 35 mg'ye düşürülmesi tavsiye edilir. Şiddetli karaciğer bozukluğu olan yetişkinlere veya herhangi bir derecede karaciğer bozukluğu olan pediyatrik hastalara ilişkin klinik deneyim mevcut değildir. Bu hastalarda orta derecede karaciğer bozukluğundakine kıyasla daha yüksek maruz kalım beklenir ve kaspofungin dikkatli kullanılmalıdır (bkz. bölüm 4.2 ve 5.2).
Kaspofungin ile tedavi edilen sağlıklı gönüllülerde ve yetişkin ve pediyatrik hastalarda karaciğer fonksiyon testlerinde laboratuvar anormallikleri gözlenmiştir. Kaspofungin ile eş zamanlı çoklu ilaç tedavisi gören ve altta yatan ciddi durumları olan bazı yetişkin ve pediyatrik hastalarda, klinik olarak belirgin hepatik disfonksiyon, hepatit ve karaciğer yetmezliği vakaları rapor edilmiştir ancak kaspofungin ile nedensel ilişki ortaya konmamıştır. Kaspofungin tedavisi sırasında karaciğer fonksiyon testi anormalliği gelişen hastalar, kötüleşen hepatik fonksiyonun bulguları yönünden izlenmeli ve kaspofungin tedavisine devam edilmesinin risk/yarar oranı tekrar değerlendirilmelidir.
Kaspofunginin pazarlama sonrası dönemde kullanımıyla Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) vakaları bildirilmiştir. Alerjik deri reaksiyonu hikayesi olan hastalarda dikkatli olunmalıdır (bkz. bölüm 4.8).
Yardımcı maddeler
Bu tıbbi ürün her flakonunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında âsodyum içermezâ.
Sukroz: Bu tıbbi ürün her flakonunda 54 mg sukroz içerir. Bu durum, diyabet hastalarında göz önünde bulundurulmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İn vitro çalışmalar kaspofunginin sitokrom P450 (CYP) sistemine ait herhangi bir enzimin inhibitörü olmadığını göstermektedir. Klinik çalışmalarda kaspofungin diğer maddelerin CYP3A4 metabolizmasını indüklememiştir. Kaspofungin P-glikoproteinin bir substratı değildir ve sitokro m P450 enzimlerinin zayıf bir substratıdır. Bununla birlikte, farmakolojik ve klinik çalışmalarda kaspofunginin diğer tıbbi ürünlerle etkileştiği gösterilmiştir. (aşağıya bkz.).
Sağlıklı yetişkinlerde yürütülen iki klinik çalışmada, siklosporin (4 mg/kg'lık 1 doz ve ya 12 saat arayla 3 mg/kg'lık iki doz) kaspofunginin A'nın EAA'sını yaklaşık %35 artırmıştır. Bu EAA artışları muhtemelen, kaspofunginin karaciğer tarafından alımında azalmaya bağlıdır. Kaspofungin siklosporinin plazma düzeylerini yükseltmemiştir. Kaspofungin ve siklosporin birlikte uygulandığında karaciğer ALT ve AST düzeylerinde normalin üst sınırının (ULN) ï£3 katı geçici artışlar görülmüş ve bunlar tıbbi ürünlerin bırakılmasıyla normale dönmüştür. Pazarlama sonrası dönemde kaspofungin ve siklosporin ile 1-290 gün arasında değişen sürelerle (medyan 17 ,5 gün) tedavi edilen 40 hastanın incelendiği geriye dönük bir çalışmada ciddi hiçbir hepatik istenmeyen olay kaydedilmemiştir (bkz. bölüm 4.4). Bu iki tıbbi ürün eş zamanlı uygulandığında karaciğer enzimlerinin yakından takip edilmesi gerektiği göz önüne alınmalıdır.
Kaspofungin sağlıklı yetişkin gönüllülerde takrolimusun vadi konsantrasyonunu %26 oranında düşürmüştür. Her iki ilacı alan hastalarda takrolimus kan konsantrasyonlarının standart takibi ve takrolimus dozajında uygun ayarlamalar yapılması zorunludur.
Sağlıklı erişkin gönüllülerdeki klinik çalışmalar kaspofunginin farmakokinetik parametrelerinin itrakonazol, amfoterisin B, mikofenolat, nelfinavir veya takrolimus ile klinik yönden önemli ölçüde değişmediğini göstermektedir. Kaspofungin, itrakonazol, amfoterisin B, rif ampisin veya mikofenolat mofetilin farmakokinetik özelliklerini etkilememiştir. Güvenlilik verileri sınırlı
olmakla beraber, kaspofungin itrakonazol, amfoterisin B, rifampisin veya mikofenolat mofetil ile birlikte uygulanırken özel önlemlerin alınmasına gerek yoktur.
Sağlıklı yetişkin gönüllülerde rifampisin ve kaspofungin birlikte başlandığında eş zamanlı uygulamanın ilk gününde, rifampisin kaspofunginin EAA'sında %60 artış ve vadi konsantrasyonunda %170 artışa yol açmıştır. Kaspofunginin vadi düzeyleri tekrarlı uygulama sonrasında kademeli olarak azalmıştır. İki hafta uygulamadan sonra, rifampisin EAA üzerinde sınırlı etki göstermiş ancak vadi düzeyleri tek başına kaspofungin alan yetişkin hastalara kıyasla
%30 daha düşük bulunmuştur. Bu etkileşimin muhtemel mekanizması, taşıma proteinlerinin başlangıçtaki inhibisyonu ve sonraki indüksiyonudur. Metabolik enzimleri indükleyen diğer tıbbi ürünler için de benzer bir etki beklenebilir. Popülasyon farmakokinetik çalışmalarının sınırlı verileri, kaspofunginin efavirenz indükleyicileri , nevirapin, efavirenz, rifampisin, karbamazepin, deksametazon veya fenitoin gibi indükleyici ajanlar ile birlikte uygulanmasının kaspofungin EAA'sında azalmaya neden olabildiğini göstermektedir. Yetişkin hastalarda, kaspofungin metabolik enzimleri indükleyen ilaçlarla eş zamanlı uygulanırken 70 mg yükleme dozunun ardından günlük kaspofungin dozunun 70 mg'ye yükseltilmesi düşünülmelidir (bkz. bölüm 4.2).
Yukarıda belirtilen tüm yetişkin ilaç etkileşimleri çalışmaları günde 50 mg veya 70 mg kaspofungin dozuyla yürütülmüştür. Kaspofunginin daha yüksek dozlarının diğer tıbbi ürünler ile etkileşimi formel biçimde çalışılmamıştır.
Pediyatrik hastalarda, farmakokinetik verilerin regresyon analizlerinin sonuçları, kaspofungin ile eş zamanlı olarak deksametazon uygulanmasının kaspofungin vadi konsantrasyonlarında klinik yönden anlamlı azalmalara yol açabildiğini ortaya koymaktadır. Bu bulgu, pediyatrik hastalarda da tıpkı yetişkinlerde olduğu gibi indükleyici ajanlara bağlı benzer azalmalar olacağını göstermektedir. Kaspofungin pediyatrik hastalara (12 aydan 17 yaşa kadar) ilaç klerensinin indükleyicileriyle (rifampisin, nevirapin, efavirenz, karbamazepin, deksametazon veya fenitoin) eş zamanlı olarak uygulanırken CANCIDAS'ın günde 70 mg/mdozu düşünülmelidir (bir günde alınan gerçek doz 70 mg aşılmamalıdır).
4.6. Gebelik ve laktasyon
Gebelik kategorisi C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Kaspofungin için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Çocuk doğurma potansiyeli bulunan kadınlar uygun bir doğum kontrolü uygulamalıdır.
Gebelik dönemi
CANCIDAS'ın gebe kadınlarda kullanımına ilişkin veriler yoktur veya sınırlıdır. Gebelik döneminde kaspofungin kesin gereklilik olmadıkça kullanılmamalıdır. Hayvan çalışmaları gelişimsel toksisiteyi göstermiştir (bkz. bölüm 5.3). Hayvan çalışmalarında kaspofunginin plasenta bariyerini geçtiği gösterilmiştir.
Laktasyon dönemi
Kaspofunginin anne sütüne geçip geçmediği bilinmemektedir. Hayvanlardan elde edilen farmakodinamik/ toksikoloji verileri kaspofunginin süte geçtiğini göstermiştir. Kaspofungin alan kadınlar emzirmemelidir.
Üreme yeteneği/ Fertilite
Erkek ve dişi sıçanlarda yürütülen çalışmalarda kaspofungin fertilite üzerinde hiçbir etki göstermemiştir (bkz. bölüm 5.3). Kaspofunginin fertilite üzerindeki etkisini değerlendirmek için klinik veriler mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma becerisi üzerine etkileri ile ilgili bir çalışma yoktur.
4.8. İstenmeyen etkiler
Aşırı duyarlılık reaksiyonları (anaflaksi ve muhtemelen histamin aracılı advers reaksiyonlar) rapor edilmiştir (bkz. bölüm 4.4).
Ayrıca, invazif aspergillozlu hastalarda akciğer ödemi, yetişkin solunum sıkıntısı sendromu (ARDS) ve radyografik infiltratlar da bildirilmiştir.
Erişkin hastalar
Klinik çalışmalarda 1865 erişkin hasta tekli veya çoklu dozlarda kaspofungin almıştır: 564 f ebril nötropeni hastası (ampirik tedavi çalışması), 382 invazif kandidiyazis hastası, 228 invazif aspergilloz hastası, 297 lokalize Candida enfeksiyonu hastası ve Faz 1 çalışmalara katılan 394 birey. Ampirik tedavi çalışmasında hastalar malignite için kemoterapi almış veya (39 allojenik transplantasyon dahil) hematopoetik kök hücre transplantasyonu geçirmişlerdir. Belgelenmiş Candida enfeksiyonları olan hastaların dahil edildiği çalışmalarda, invazif Candida enfeksiyonları olan hastaların büyük kısmında, eş zamanlı çok sayıda ilaç kullanımını gerektiren altta yatan ciddi tıbbi durumlar mevcuttu (örneğin: hematolojik veya diğer maligniteler, yakın zamanda önemli cerrahi operasyon, HIV). Karşılaştırmalı olmayan Aspergillus çalışmasındaki hastalarda genellikle eş zamanlı çok sayıda ilaç kullanımını gerektiren ciddi predispozan tıbbi durumlar mevcuttu (örneğin kemik iliği veya periferik kök hücre transplantasyonları, hematolojik maligniteler, solid tümör veya organ transplantları).
Flebit, bütün hasta popülasyonlarında yaygın olarak rapor edilen lokal bir enjeksiyon bölgesi advers reaksiyonudur. Diğer lokal reaksiyonlar ise eritem, ağrı/hassasiyet, kaşıntı, akıntı ve yanma hissidir.
Kaspofungin ile tedavi edilen tüm yetişkinlerde rapor edilen klinik ve laboratuvar anormallikleri (toplam 1780) tipik olarak hafifti ve nadiren ilacın kesilmesini gerektirmiştir.
Klinik çalışmalarda ve/veya pazarlama sonrası kullanımda aşağıdaki advers reaksiyonlar rapor edilmiştir:
Çok yaygın (≥1/10), yaygın (â¥1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), Seyrek (⥠1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları:
Yaygın: Hemoglobinde azalma, hematokritte azalma, akyuvar sayısında azalma.
Yaygın olmayan: Anemi, trombositopeni, koagülopati, lökopeni, eozinofil sayısında artış, trombosit sayısında azalma, trombosit sayısında artış, lenfosit sayısında azalma, akyuvar sayısında artış, nötrofil sayısında azalma.
Metabolizma ve beslenme hastalıkları:
Yaygın: Hipokalemi
Yaygın olmayan: Aşırı sıvı yüklenmesi, hipomagnezemi, anoreksi, elektrolit dengesizliği, hiperglisemi, hipokalsemi, metabolik asidoz.
Psikiyatrik hastalıklar:
Yaygın olmayan: Anksiyete, oryantasyon bozukluğu, uykusuzluk.
Sinir sistemi hastalıkları:
Yaygın: Baş ağrısı
Yaygın olmayan: Baş dönmesi, tat duyumunda bozukluk, parestezi, somnolans, tremor, hipoestezi.
Göz hastalıkları:
Yaygın olmayan: Gözde sarılık, bulanık görme, göz kapağı ödemi, gözyaşı artışı.
Kardiyak hastalıklar:
Yaygın olmayan: Çarpıntı, taşikardi, aritmi, atriyal fibrilasyon, konjestif kalp yetmezliği
Vasküler hastalıklar:
Yaygın: Flebit
Yaygın olmayan: Tromboflebit, flushing (ciltte kızarıklık), sıcak basması, hipertansiyon, hipotansiyon.
Solunum, göğüs ve mediastinal hastalıklar:
Yaygın: Dispne
Yaygın olmayan: Nazal konjesyon, faringolaringeal ağrı, takipne, bronkospazm, öksürük, paroksismal noktürnal dispne, hipoksi, raller, hırıltılı solunum.
Gastrointestinal hastalıklar:
Yaygın: Bulantı, ishal, kusma
Yaygın olmayan: Abdominal ağrı, üst abdominal ağrı, ağız kuruluğu, dispepsi, mide rahatsızlığı, abdominal distansiyon, assit, kabızlık, disfaji, flatulans.
Hepato-bilier hastalıklar:
Yaygın: Karaciğer değerlerinde yükselme (alanin aminotransferaz, aspartat aminotransferaz, kan alkali fosfataz, konjuge bilirübin, kan bilirübini).
Yaygın olmayan: Kolestaz, hepatomegali, hiperbilirübinemi, sarılık, karaciğer fonksiyon anormalliği, hepatotoksisite, karaciğer bozukluğu, gama-glutamil transferaz artışı.
Deri ve deri altı doku hastalıkları:
Yaygın: Döküntü, kaşıntı, eritem, aşırı terleme.
Yaygın olmayan: Eritema multiforme, maküler döküntü, makülo-papüler döküntü, pruritik döküntü, ürtiker, alerjik dermatit, jeneralize prurit, eritamatöz döküntü, jeneralize döküntü, morbiliform döküntü, deri lezyonları.
Bilinmiyor: Toksik epidermal nekroliz ve Stevens-Johnson sendromu (bkz. Bölüm 4.4)
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları:
Yaygın: Artralji
Yaygın olmayan: Sırt ağrısı, ekstremitelerde ağrı, kemik ağrısı, kas güçsüzlüğü, miyalji.
Böbrek ve idrar hastalıkları:
Yaygın olmayan: Böbrek yetmezliği, akut böbrek yetmezliği
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Yaygın: Ateş, üşüme, infüzyon bölgesinde kaşıntı
Yaygın olmayan: Ağrı, kateter giriş yerinde ağrı, yorgunluk, üşüme, sıcak basması, infüzyon yerinde eritem, infüzyon yerinde sertlik, infüzyon yerinde ağrı, infüzyon yerinde şişlik, enjeksiyon yerinde flebit, periferik ödem, hassasiyet, göğüs rahatsızlığı, göğüs ağrısı, yüzde ödem, vücut ısısında değişiklik hissi, sertleşme, infüzyon yerinde ekstravazasyon, infüzyon yerinde iritasyon, infüzyon yerinde flebit, infüzyon yerinde döküntü, infüzyon yerinde ürtiker, enjeksiyon yerinde
eritem, enjeksiyon yerinde ödem, enjeksiyon yerinde ağrı, enjeksiyon yerinde şişlik, malaise (kırıklık), ödem.
Araştırmalar:
Yaygın: Kan potasyumunda azalma, kan albümininde azalma.
Yaygın olmayan: Kan kreatininde artış, idrarda alyuvar hücreleri pozitif, total proteinde azalma, idrarda protein varlığı, protrombin zamanında uzama, protrombin zamanında kısalma, kan sodyumunda azalma, kan sodyumunda artış, kan kalsiyumunda artış, kan kalsiyumunda azalma, kan klorüründe azalma, kan glukoz artışı, kanda magnezyum azalması, kanda fosforun azalması, kanda fosfor artışı, kan üre artışı, aktif parsiyel tromboplastin zamanının uzaması, kanda bikarbonat azalması, kanda klorür artışı, kanda potasyum artışı, kan basıncı artışı, kanda ürik asit azalması, idrarda kan varlığı, anormal solunum sesleri, karbondioksit azalması, bağışıklık sistemini baskılayıcı ilaçların seviyelerinde artış, uluslararası normalize oranda artış, üriner silindirler, idrarda akyuvar hücrelerinin pozitif olması, idrar pH'ında artış.
Kaspofungin aynı zamanda 100 erişkin hastada günde 150 mg (51 güne kadar) verilerek değerlendirilmiştir (bkz. Bölüm 5.1). Çalışma invazif kandidiyazis tedavisinde günde 50 mg kaspofungini (1. günde 70 mg yükleme dozunu takiben) günde 150 mg dozu ile karşılaştırm ıştır. Bu hasta grubunda daha yüksek olan bu kaspofungin dozunun güvenliliği genel olarak günde 50 mg kaspofungin alan hastalarla benzer bulunmuştur. İlaçla ilişkili ciddi bir advers reaksiyon veya kaspofunginin kesilmesine neden olan, ilaçla ilişkili bir advers reaksiyon yaşayan hastaların oranı iki tedavi grubunda da benzer bulunmuştur.
Pediyatrik hastalar
171 pediyatrik hastada tamamlanan 5 klinik çalışmanın verileri klinik istenmeyen olayların toplam insidansının (%26,3; %95 güven aralığı: -19,9, 33,6) kaspofungin ile tedavi edilen yetişkinlerde
bildirilen insidanstan (%43,1; %95 güven aralığı: -40, 46,2) daha kötü olmadığını ortaya
koymaktadır. Ancak, pediyatrik hastaların istenmeyen olay profili yetişkin hastalara kıyasla muhtemelen farklıdır. Kaspofungin ile tedavi edilen pediyatrik hastalarda en yaygın, ilaçla ilişkili klinik istenmeyen olaylar pireksi (%11,7), döküntü (%4,7) ve baş ağrısıydı (%2,9).
Aşağıdaki advers reaksiyonlar rapor edilmiştir:
(Çok yaygın (â¥1/10), yaygın (â¥1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), Seyrek (⥠1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları:
Yaygın: Eozinofil sayısında artış
Sinir sistemi hastalıkları:
Yaygın: Baş ağrısı
Kardiyak hastalıklar:
Yaygın: Taşikardi
Vasküler hastalıklar:
Yaygın: Flushing (ciltte kızarıklık), hipotansiyon
Hepato-bilier hastalıklar:
Yaygın: Karaciğer enzimlerinde yükselme (AST, ALT)
Deri ve deri altı doku hastalıkları:
Yaygın: Döküntü, kaşıntı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları:
Çok yaygın: Ateş
Yaygın: Üşüme, kateter bölgesinde ağrı
Araştırmalar:
Yaygın: Potasyumda azalma, hipomagnezemi, glukoz artışı, fosforda azalma, fosfor artışı.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Bir günde 400 mg'a kadar kaspofunginin yanlışlıkla alındığı rapor edilmiştir. Bu olaylar klinik yönden önemli advers reaksiyonlara yol açmamıştır. Kaspofungin diyalizle atılmaz.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakotedavi grubu: Sistemik kullanım için antiinfektifler, Sistemik kullanım için antimikotikler, Diğer sistemik kullanılan antimikotikler, kaspofungin
ATC kodu: J02AX04
Etki mekanizması
Kaspofungin asetat Glarea lozoyensis'in bir fermantasyon ürününden sentezlenen yarı sentetik bir lipopetiddir (ekinokandin). Kaspofungin pek çok filamentli mantarın ve mayanın hücre duvarının önemli bir bileşeni olan beta (1,3)-D-glukanın sentezini inhibe eder. Beta (1,3)-D-glukan memeli hücrelerinde bulunmaz.
Candida mayalarına karşı kaspofunginin fungisit aktivitesi gösterilmiştir. İn vitro ve in vivo çalışmalar Aspergillus'un kaspofungine maruz kalımının hücre büyümesi ve bölünmesinin gerçekleştiği hifli apikal uçlar ve dallanma noktalarının parçalanmasına ve ölmesine yol açtığını göstermektedir.
Farmakodinamik etkiler:
Kaspofungin Aspergillus türlerine karşı in vitro aktiviteye sahiptir (Aspergillus fumigatus [N = 75], Aspergillus flavus [N = 111], Aspergillus niger [N = 31], Aspergillus nidulans [N = 8], Aspergillus terreus [N = 52] ve Aspergillus candidus [N = 3]). Ayrıca kaspofungin, çoklu direnç transport mutasyonları olan suşlar ve flukonazol, amfoterisin B ve 5 -flusitozine karşı edinilmiş veya intrinsik direnci olan suşlar dahil olmak üzere Candida türlerine karşı in vitro aktiviteye sahiptir (Candida albicans [N = 1,032], Candida dubliniensis [N = 100], Candida glabrata [N = 151], Candida guilliermondii [N = 67], Candida kefyr [N = 62], Candida krusei [N = 147], Candida lipolytica [N = 20], Candida lusitaniae [N = 80], Candida parapsilosis [N = 215], Candida rugosa [N = 1] ve Candida tropicalis [N = 258]). Duyarlılık testleri Klinik ve Laboratuvar Standartları Enstitüsü'nün (CLSI; önceki adı Ulusal Klinik Laboratuvar Standartları Komitesi [NCCLS]) hem metod M38-A2 (Aspergillus türleri için) hem de metod M27-A3'nin (Candida türleri için) bir modifikasyonuna göre yapılmıştır.
Duyarlılık testlerine yönelik standardize edilmiş teknikler EUCAST tarafından mayalar için geliştirilmiştir. Kaspofungin için MIC aralığındaki anlamlı laboratuvarlar arası farklılıklar nedeniyle kaspofungin için EUCAST kesim noktaları henüz belirlenmemiştir. Kesim noktaları
yerine, anidulafungin ve mikafungine duyarlı Candida suşları, kaspofungine duyarlı olarak değerlendirilmelidir. Benzer olarak, anidulafungin ve mikafungine orta duyarlı C. Parapsilosis suşları kaspofungine de orta duyarlı olarak kabul edilebilir.
Direnç mekanizması
Kaspofungine karşı azalmış duyarlılığa sahip Candida suşları tedavi döneminde az sayıda hastada tespit edilmiştir (CLSI tarafından onaylanan standardize edilmiş MIC (minimum inhibitör konsantrasyon) test teknikleri kullanılarak kaspofungin için >2 mg/L MIC değerleri (4- 30 kat MIC artışları) rapor edilmiştir). Tespit edilen direnç mekanizması FKS1 ve/veya FKS2 gen mütasyonlarıdır (C.glabrata için). Bu vakalar kötü klinik sonuçlarla ilişkili olmuştur.
Aspergillus türlerinde kaspofungine karşı in vitro direnç gelişimi saptanmıştır. Sınırlı klinik deneyimde, invazif aspergillozlu hastalarda kaspofungine direnç gözlenmiştir. Direncin mekanizması belirlenmemiştir. Aspergillus'un çeşitli klinik suşlarında kaspofungine karşı direnç görülme sıklığı nadirdir. Candida'da kaspofungin direnci gözlemlenmiştir ancak görülme sıklığı tür ya da bölgeye göre değişiklik gösterebilir.
Klinik Etkililik ve Güvenlilik
Yetişkin Hastalarda İnvazif Kandidiyazis: İnvazif kandidiyazis tedavisinde kaspofungini amfoterisin B ile karşılaştırmak amacıyla ilk çalışmaya 239 hasta dahil edilmiştir. 24 hasta nötropenikti. En sık koyulan tanılar kan dolaşımı enfeksiyonları (kandidemi) (%77, n=186) ve Candida peritonitiydi (%8, n=19); Candida kaynaklı endokardit, osteomiyelit veya menenjiti olan hastalar çalışmaya alınmamıştır. Kaspofungin, 70 mg yükleme dozundan sonra günde bir kez 50 mg uygulanmış, amfoterisin B ise nötropenik olmayan hastalara günde 0,6- 0,7 mg/kg ve nötropenik hastalara günde 0,7 â 1 mg/kg dozuyla verilmiştir. İntravenöz tedavinin ortalama süresi 11,9 gündü (aralık: 1 - 28 gün). Olumlu yanıt, hem Candida enfeksiyonunun mikrobiyolojik klerensini hem de semptomların ortadan kalkmış olmasını gerektiriyordu. 224 hasta çalışmada uygulanan İV tedavinin sonundaki yanıtın primer etkililik analizine dahil edilmiştir (MITT analizi); invazif kandidiyazisin tedavisinde kaspofungin (%73 [80/109]) ve amfoterisin B'nin (%62 [71/115]) olumlu yanıt oranları benzerdi [% fark: 12,7 (%95,6 GA: -0,7, 26)]. Kandidemili hastalarda, primer etkililik analizinde (MITT analizi) çalışmada uygulanan İV tedavinin sonunda olumlu yanıt oranları kaspofungin (%72 [66/92]) ve amfoterisin B (%63 [59/94]) için benzerdi [% fark 10 (%95 GA: -4,5, 24,5)]. Kan dışı bölgelerde enfeksiyonu olan hastalara ait veriler daha sınırlıydı. Nötropenik hastalarda olumlu yanıt oranları kaspofungin grubunda 7/14 (%50) ve amfoterisin B grubunda 4/10'du (%40). Bu sınırlı veriler ampirik tedavi çalışmasının sonucuyla desteklenmiştir.
İkinci bir çalışmada, invazif kandidiyazisli hastalar günde 50 mg (1. günde 70 mg yükleme dozunun ardından) veya günde 150 mg olmak üzere günlük kaspofungin dozlarını almıştır (bkz. bölüm 4.8). Bu çalışmada kaspofungin dozu 2 saat boyunca uygulanmıştır (rutin 1 saatlik uygulama yerine). Candida kaynaklı kuşkulu endokardit, osteomiyelit veya menenjiti olan hastalar çalışmaya alınmamıştır. Bu çalışma bir primer tedavi çalışması olduğundan, önceki antifungal ajanlara yanıt vermeyen hastalar da dışlanmıştır. Bu çalışmaya alınan nötropenik hasta sayısı da sınırlıydı (%8). Bu çalışmada etkililik bir sekonder son noktaydı. Çalışmaya giriş kriterlerini karşılayan ve kaspofungin çalışma tedavisinin bir veya daha fazla dozunu alan hastalar etkililik analizine alınmıştır. İki tedavi grubunda kaspofungin tedavisinin sonundaki olumlu genel yanıt oranları benzerdi: kaspofungin 50-mg grubunda %72 (73/102) ve 150 mg tedavi grubunda % 78 (74/95) (fark %6,3 [%95 GA: -5,9, 18,4]).
Yetişkin Hastalarda İnvazif Aspergilloz: İnvazif aspergillozlu 69 yetişkin hasta (18-80 yaş arası) kaspofunginin güvenlilik, etkililik ve tolerabilitesini değerlendiren açık etiketli, karşılaştırmasız bir çalışmaya dahil edilmiştir. Hastaların diğer standart antifungal tedavilere yanıt vermemiş olması (en az 7 gün süreyle verilen diğer antifungal tedaviler ile hastalığın ilerlemesi veya
iyileşme başarısızlığı) (dahil edilen hastaların %84'ü) ya da toleranssız olması gerekiyordu (dahil edilen hastaların %16'sı). Hastaların çoğunda altta yatan durumlar mevcuttu (hematolojik malignite [N = 24], allojenik kemik iliği transplantı veya kök hücre transplantı [N = 18], organ transplantı [N = 8], solid tümör [N = 3] veya diğer durumlar [N = 10]). İnvazif aspergillozun tanısı ve tedavi yanıtı için Mikozlar Çalışma Grubu Kriterlerine dayanarak modellenen katı tanımlar kullanılmıştır (olumlu yanıt için radyograflarda ve semptom ve bulgularda klinik yönden anlamlı iyileşme şartı koşulmuştu). Ortalama tedavi süresi 33,7 gündü (aralık: 1 â 162 gün). Bağımsız bir uzman paneli, kaspofunginin en az bir dozunu alan hastaların %41'inde (26/63) olumlu yanıta ulaşıldığını belirlemiştir. Kaspofungin ile 7 günden daha uzun süre tedavi gören hastaların
%50'sinde (26/52) olumlu yanıt mevcuttu. Önceki tedavilere yanıt vermeyen veya toleranssız olan hastalarda olumlu yanıt oranları sırasıyla %36 (19/53) ve %70'di (7/10). Tedaviye yanıtsız olarak dahil edilen 5 hastada önceki antifungal tedavilerin dozları, invazif aspergilloz için sıklıkla uygulanan dozlardan daha düşük olmakla birlikte, kaspofungin tedavisi sırasında bu hastaların olumlu yanıt oranı geri kalan yanıtsız hastalardakine benzerdi (sırasıyla 2/5 ve 17/48). Akciğer hastalığı ve akciğer dışı olan hastalardaki yanıt oranları sırasıyla %47 (21/45) ve %28 'di (5 /18 ). Akciğer dışı hastalığı olan hastalar arasında, aynı zamanda kesin, muhtemel veya düşük olasılıklı MSS tutulumu olan 8 hastadan 2'sinde olumlu yanıt saptanmıştır.
Ateşli Nötropenik Yetişkin Hastaların Ampirik Tedavisi: Bir klinik çalışmaya inatçı ateş ve nötropenisi olan toplam 1.111 hasta dahil edilmiş ve 70 mg yükleme dozunun ardından günde 50 mg kaspofungin veya günde 3 mg/kg lipozomal amfoterisin B ile tedavi edilmiştir. Uygun hastalar malignite için kemoterapi almış veya hematopoetik kök hücre transplantasyonu uygulanmış ve nötropeni (96 saatte <500 hücre/mm) ve ≥96 saat parenteral antibiyotik tedavisine yanıt vermeyen ateş (>38°C) ile başvurmuş hastalardı. Hastaların nötropeni düzeldikten sonra 72 saate kadar, maksimum 28 gün süreyle tedavi edilmeleri gerekiyordu. Ancak belgelenmiş bir fungal enfeksiyonu olan hastalar daha uzun süre tedavi edilebiliyordu. İlaç iyi tolere edilmişse fakat 5 gün tedaviden sonra hastanın ateşi devam etmiş ve klinik durumu kötüleşmişse çalışma ilacının dozajı kaspofungin için günde 70 mg'ye (tedavi edilen hastaların %13,3'ü) ve lipozomal amfoterisin B için günde 5 mg/kg'a (tedavi edilen hastaların %14,3'ü) çıkarılabilmiştir. Genel olumlu yanıta ilişkin Primer Modifiye Edilmiş Tedavi Amaçlı (MITT) etkililik analizine 1.095 hasta alınmıştır; kaspofungin (%33,9) lipozomal amfoterisin B (%33,7) kadar etkili bulunmuştur [% fark 0,2 (%95,2 GA: â5,6, 6)]. Genel olumlu yanıt için 5 kriterden her birinin karşılanmış olması gerekliydi: (1) başlangıçtaki herhangi bir fungal enfeksiyonun başarılı tedavisi (kaspofungin %51,9 [14/27], lipozomal amfoterisin B %25,9 [7/27]), (2) çalışma ilacının uygulanması sırasında veya tedavinin tamamlanmasından sonra 7 gün içerisinde yeni fungal enfeksiyonların ortaya çıkmaması (kaspofungin %94,8 [527/556], lipozomal amfoterisin B %95,5 [515/539]), (3) çalışma tedavisinin tamamlanmasından 7 gün sonra hayatta kalmış olmak (kaspofungin %92,6 [515/556], lipozomal amfoterisin B %89,2 [481/539]), (4) ilaçla ilişkili toksisite veya etkililik yokluğu nedeniyle çalışma ilacının kesilmemiş olması (kaspofungin %89 ,7 [499/556], lipozomal amfoterisin B %85,5 [461/539]) ve (5) nötropeni döneminde ateşin iyileşmesi (kaspofungin %41,2 [229/556], lipozomal amfoterisin B %41,4 [223/539]). Aspergillus türlerine bağlı başlangıç enfeksiyonlarında kaspofungin ve lipozomal amfoterisin B'ye yanıt oranları sırasıyla %41,7 (5/12) ve %8,3 (1/12) iken, Candida türlerine bağlı başlangıç enfeksiyonlarında yanıt oranları sırasıyla %66,7 (8/12) ve %41,7 (5/12) olarak saptanmıştır. Kaspofungin grubundaki hastalar aşağıdaki yaygın olmayan mayalar ve küflere bağlı yeni enfeksiyonlara yakalanmıştır: Trichosporon türleri (1), Fusarium türleri (1), Mucor türleri (1 ) ve Rhizopus türleri (1).
Pediyatrik popülasyon
Kaspofunginin güvenliliği ve etkililiği iki ileriye dönük, çok-merkezli klinik çalışmada 3 ay-17 yaş arası pediyatrik hastalarda değerlendirilmiştir. Çalışma tasarımı, tanı kriterleri ve etkililik değerlendirme kriterleri yetişkin hastalarda yürütülen çalışmalardakilerle benzerdi (bkz. bölüm 5.1).
2-17 yaş arası 82 hastayı içeren ilk çalışma, inatçı ateş ve nötropenisi olan pediyatrik hastaların ampirik tedavisinde kaspofungini (1. gün 70-mg/myükleme dozunu takiben günde bir kez İV yolla 50 mg/m[günde 70 mg aşılmadan]) lipozomal amfoterisin B (günde 3 mg/kg İV) ile 2:1 tedavi oranında (kaspofungin alan 56, lipozomal amfoterisin B alan 26 hasta) karşılaştıran randomize, çift-kör bir çalışmaydı. MITT analiz sonuçlarında genel başarı oranları (risk sınıflarına göre düzeltilmiş oranlardır) şöyleydi: kaspofungin için %46,6 (26/56), lipozomal amf oterisin B için %32,2 (8/25).
İkinci çalışma invazif kandidiyazis, özofageal kandidiyazis ve invazif aspergillozlu (kurtarıcı tedavi olarak) pediyatrik hastalarda (6 ay-17 yaş arası) kaspofunginin güvenliliğini ve etkililiğini inceleyen ileriye dönük, açık etiketli, karşılaştırmasız bir çalışmaydı. 49 hasta dahil edilmiş ve 1 . gün 70-mg/myükleme dozunu takiben günde bir kez İV yolla 50 mg/m (günde 70 mg aşılmadan) almışlardır; bu hastalardan 48'i MITT analizine dahil edilmiştir. Bu hastalardan 37'sinde invazif kandidiyazis, 10'unda invazif aspergilloz ve 1'inde özofageal kandidiyazis mevcuttu. Kaspofungin tedavisinin sonunda, MITT analizinde endikasyona göre olumlu yanıt oranları şöyleydi: invazif kandidiyaziste %81 (30/37), invazif aspergillozda %50 (5/10) ve özofageal kandidiyaziste %100 (1/1).
Çift-kör, randomize (2:1), karşılaştırmalı kontrollü bir çalışmada, kaspofunginin (intravenöz yolla günde 2 mg/kg 2 saatlik infüzyonla verilmiştir) güvenliliği, etkililiği ve tolerabilitesi kültürle doğrulanan invazif kandidiyazisli yenidoğanlarda ve 3 aylıktan küçük bebeklerde amfoterisin B deoksikolata (günde 1 mg/kg) göre değerlendirilmiştir. Hasta alımının yetersiz olması nedeniyle çalışma erken sonlandırılmış ve sadece 51 hasta randomize edilmiştir. Tedavi bitiminden 2 hafta sonra fungal enfeksiyonu iyileşip hayatta kalan hastaların oranı kaspofungin tedavi grubunda (%71) ve amfoterisin B deoksikolat tedavi grubunda (%68,8) benzerdir. Bu çalışmaya dayanarak yenidoğanlar ve bebekler için pozolojiye dair hiçbir öneride bulunulamamaktadır.
5.2. Farmakokinetik özellikler
Emilim
Kaspofungin asetat intravenöz yolla uygulandığından, emilim söz konusu değildir.
Dağılım
Kaspofungin albümine yüksek oranda bağlanır. Kaspofunginin plazmada bağlanmamış fraksiyonu sağlıklı gönüllülerde %3,5 ile invazif kandidiyazisli hastalarda %7,6 arasında değişir. Dağılım kaspofunginin plazma farmakokinetiğinde önemli rol oynar ve alfa ve beta dispozisyon fazlarının her ikisinde hızı kontrol eden adımdır. Dozajdan sonra dokulara dağılım 1,5-2 günde maksimum düzeye ulaşmış ve bu süre zarfında dozun %92'si dokulara dağılmıştır. Dokular tarafından alınan kaspofunginin sadece küçük bir kısmının daha sonra plazmaya ana bileşik olarak geri dönüyor olması muhtemeldir. Dolayısıyla eliminasyon, dağılım dengesi olmaksızın gerçekleşir ve güncel olarak kaspofunginin gerçek dağılım hacmini tespit etmek mümkün değildir.
Biyotransformasyon
Kaspofungin spontan degradasyona uğrayarak açık halkalı bir bileşiğe dönüşür. Sonraki metabolizma peptid hidrolizini ve N-asetilasyonu içerir. Kaspofunginin bu açık halkalı bileşiğe degradasyonu sırasında oluşan iki ara ürün, plazma proteinleriyle kovalent adduktlar oluşturarak plazma proteinlerine düşük düzeyde, geri dönüşsüz bağlanmayla sonuçlanır.
İn vitro çalışmalar kaspofunginin sitokrom P450 enzimleri 1A2, 2A6, 2C9, 2C19, 2D6 veya 3A4'ün inhibitörü olmadığını göstermektedir. Klinik çalışmalarda kaspofungin diğer tıbbi ürünlerin CYP3A4 metabolizmasını indüklememiş veya inhibe etmemiştir. Kaspofungin P- glikoproteinin bir sübstratı değildir ve sitokrom P450 enzimlerinin zayıf bir sübstratıdır.
Eliminasyon
Kaspofunginin plazmadan eliminasyonu yavaştır ve klerensi dakikada 10-12 ml'dir. Kaspofunginin plazma konsantrasyonları tekli 1 saatlik intravenöz infüzyonlardan sonra polifazik olarak azalır. İnfüzyondan hemen sonra kısa bir alfa fazı gerçekleşir, onu 9-11 saatlik yarı ömre sahip beta fazı izler. Yarı ömrü 45 saat olan ek bir gama fazı da görülür. Atılım veya biyotransformasyondan ziyade dağılım, plazma klerensini etkileyen baskın mekanizmadır.
Bir radyoaktif dozun yaklaşık %75'i 27 günde tespit edilmiştir: idrarda %41 ve feçeste %34 oranında. Uygulamadan sonra ilk 30 saatte kaspofungin çok az atılır veya biyotransformasyona uğrar. Atılım yavaştır ve radyoaktivitenin terminal yarı ömrü 12- 15 gün bulunmuştur. Kaspofunginin küçük bir miktarı idrarla değişmeden atılır (dozun yaklaşık %1,4'ü).
Doğrusallık/Doğrusal olmayan durum:
Kaspofungin doğrusal olmayan orta düzeyde farmakokinetik özellikler (doz arttıkça birikim artar) ve çoklu doz uygulanmasından sonra kararlı duruma ulaşmak için gereken zamanda doza bağımlılık sergiler.
Hastalardaki karakteristik özellikler
Böbrek bozukluğu ve hafif karaciğer bozukluğu olan yetişkin hastalarda, kadın hastalarda ve yaşlı hastalarda artmış kaspofungin maruz kalımı görülmüştür. Genellikle artış hafif düzeyde olmuş ve doz ayarlamasını gerektirecek kadar büyük olmamıştır. Orta derecede karaciğer bozukluğu olan yetişkin hastalarda veya vücut ağırlığı fazla olan hastalarda dozaj ayarlaması gerekebilir (bkz. aşağı).
Vücut ağırlığı: Yetişkin kandidiyazisli hastalarda yapılan popülasyon farmakokinetik analizinde vücut ağırlığının kaspofunginin farmakokinetik özelliklerini etkilediği saptanmıştır. Vücut ağırlığı arttıkça plazma konsantrasyonları azalır. Vücut ağırlığı 80 kg olan yetişkin bir hastada ortalama maruz kalımın 60 kg ağırlığındaki yetişkin bir hastadan yaklaşık % 23 daha düşük olduğu öngörülmüştür (bkz. bölüm 4.2).
Böbrek bozukluğu
Klinik çalışmalarda tekli 70 mg dozlarda, kaspofunginin farmakokinetik özellikleri haf if böbrek bozukluğu olan erişkin gönüllülerde (kreatinin klerensi 50- 80 mL/dak) ve kontrol gönüllüllerinde benzer bulunmuştur. Orta derecede (kreatinin klerensi 31- 49 mL/dak), şiddetli (kreatinin klerensi 5 - 30 mL/dak) ve son evre (kreatinin klerensi <10 mL/dak ve diyalize bağımlı) böbrek bozukluğunda kaspofungin plazma konsantrasyonları tekli doz uygulandıktan sonra orta derecede yükselmiştir (EAA için aralık: %30- %49). Ancak kaspofungin 50 mg'nin çoklu günlük dozlarını alan invazif kandidiyazis, özofageal kandidiyazis veya invazif aspergillozlu yetişkin hastalarda hafiften ilerlemiş böbrek fonksiyon bozukluğuna kadar böbrek hastalığının kaspofungin konsantrasyonları üzerinde anlamlı bir etkisi saptanmamıştır. Böbrek bozukluğu olan hastalarda dozaj ayarlaması gerekmez. Kaspofungin diyalizle atılmaz; bu nedenle hemodiyalizden sonra ek doz gerekmez.
Karaciğer bozukluğu
Hafif ve orta düzeyde karaciğer bozukluğu olan yetişkin hastalarda EAA sırasıyla yaklaşık %20 ve
%75 yükselmiştir. Şiddetli karaciğer bozukluğu olan yetişkin hastalarda veya herhangi bir derecede karaciğer bozukluğu olan pediyatrik hastalarda klinik deneyim yoktur. Bir çoklu doz çalışmasında, orta düzeyde karaciğer bozukluğu olan yetişkin hastalarda günlük dozun 35 mg'ye düşürülmesinin standart rejimi alan, karaciğer fonksiyonu normal yetişkin hastalardakine benzer EAA sağladığı gösterilmiştir (bkz. bölüm 4.2).
Cinsiyet
Kaspofunginin plazma konsantrasyonları kadınlarda erkeklere göre ortalama %17-38 oranında daha yüksektir.
Geriyatrik hastalar
Yaşlı erkek hastalarda EAA'da (%28) ve C değerinde (%32) genç erkek hastalara kıyasla hafif bir artış gözlenmiştir. Ampirik tedavi uygulanan veya invazif kandidiyazisi olan hastalarda, genç hastalara göre yaşlı hastalarda yaşın hafif düzeyde benzer bir etkisi görülmüştür.
Pediyatrik hastalar
Günde 50 mg/m(günde maksimum 70 mg) kaspofungin alan adolesanlarda (12 - 17 yaş arası) kaspofunginin plazma EAA değeri, günde 50 mg/mkaspofungin alan yetişkinlerde gözlenen ile genel olarak benzer bulunmuştur. Tüm adolesanlar günde >50 mg dozlar almış, hatta
8 hastadan 6'sı maksimum doz olan günde 70 mg dozunu almıştır. Bu adolesanlarda kaspofunginin plazma konsantrasyonları, günde 70 mg (adolesanlara en sık uygulanan doz) alan yetişkinlere kıyasla daha düşük bulunmuştur.
Günde 50 mg/m(günde maksimum 70 mg) kaspofungin alan çocuklarda (2-11 yaş arası), çoklu dozlardan sonra kaspofunginin plazma EAA değeri günde 50 mg kaspofungin alan yetişkinlerde gözlenen ile genel olarak benzer bulunmuştur.
Günde 50 mg/m(günde maksimum 70 mg) kaspofungin alan küçük çocuklarda ve emekleme dönemindeki bebeklerde (12 - 23 ay arası), çoklu dozlardan sonra kaspofunginin plazma EAA değeri günde 50 mg kaspofungin alan yetişkinlerde ve günde 50 mg/malan daha büyük çocuklarda (2-11 yaş arası) gözlenen ile benzer bulunmuştur.
Genel olarak mevcut farmakokinetik, etkililik ve güvenlilik verileri 3-10 ay arası hastalarla sınırlıdır. Günde 50 mg/mdozunu alan bir 10 aylık çocuğa ait farmakokinetik verileri, EAA değerinin günde 50 mg/malan daha büyük çocuklarda ve günde 50 mg kaspofungin alan yetişkinlerde gözlenenler ile aynı aralıkta olduğunu, günde 50 mg/mdozunu alan 6 aylık bir çocukta ise EAA değerinin biraz daha yüksek olduğunu göstermiştir.
Günde 25 mg/mkaspofungin (ortalama günlük 2,1 mg/kg dozuna karşılık gelir) alan yenidoğanlarda ve bebeklerde (<3 aylık), çoklu dozlardan sonra kaspofunginin zirve konsantrasyonu (C ) ve kaspofunginin vadi konsantrasyonu (C ) günde 50 mg kaspofungin alan yetişkinlerde gözlenenler ile benzer bulunmuştur. Bu yenidoğanlarda ve bebeklerde 1. gündeki C değeri yetişkinlerdekine benzer iken C değeri hafifçe yükselmişti (%36). Bununla birlikte, hem C (4.günde geometrik ortalama 11,73 μg/ml, aralık: 2,63 -22,05 μg/ml) hem de C (4.günde geometrik ortalama 3,55 μg/ml, aralık: 0,13 -7,17 μg/ml) değerinde değişkenlik görülmüştür. Plazma numunelerinin azlığı nedeniyle bu çalışmada EAA ölçümleri yapılmamıştır. Üç aylıktan küçük yenidoğanları ve bebekleri içeren ileriye dönük klinik çalışmalarda kaspofunginin etkililik ve güvenliliğinin yeterli düzeyde çalışılmadığı kaydedilmelidir.
Irk
Hasta farmakokinetik verileri, beyazlarda, siyahlarda İspanyol kökenlilerde ve melez ırklarda kaspofunginin farmakokinetik özellikleri yönünden klinik olarak anlamlı farkları göstermemiştir.
5.3. Klinik öncesi güvenlilik verileri
Sıçanlarda ve maymunlarda intravenöz yolla verilen 7 -8 mg/kg'a kadar dozlar kullanılarak yürütülen tekrarlı doz toksisite çalışmaları, sıçanlarda ve maymunlarda enjeksiyon bölgesi reaksiyonlarını, sıçanlarda histamin salınımı belirtilerini ve maymunlarda karaciğere yönelik istenmeyen etkilere dair kanıtları ortaya koymuştur. Sıçanlarda yapılan gelişimsel toksisite çalışmaları, 5 mg/kg dozlarında kaspofunginin fetus vücut ağırlıklarında azalmalara, omurga, sternebra ve kafatası kemiklerinde eksik kemikleşme insidansında artışa ve gebe sıçanlarda histamin salınımı belirtileri gibi istenmeyen maternal etkilere yol açtığını göstermiştir. Servikal kaburgaların insidansında artış da not edilmiştir. Kaspofungin potansiyel genotoksisite için yapılan
in vitro testlerde ve in vivo fare kemik iliği kromozom testinde negatif sonuç elde etmiştir. Hayvanlarda karsinojenik potansiyeli değerlendirmek üzere hiçbir uzun süreli çalışma yapılmamıştır. Erkek ve dişi sıçanlarda günde 5 mg/kg'a kadar dozlarla yürütülen çalışmalarda kaspofungin fertilite üzerinde hiçbir etkiye yol açmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sukroz Mannitol (E421)
Glasiyal asetik asit
Sodyum hidroksit (pH ayarlamak için)
6.2. Geçimsizlikler
Glukoz içeren seyrelticilerle karıştırmayınız çünkü CANCIDAS glukoz içeren seyrelticiler içerisinde stabil değildir. Geçimlilik çalışmaları yapılmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
Flakonlar
Liyofilize flakonlar buzdolabında 2- 8°C'de saklanmalıdır.
Hazırlanmış konsantre ilaç
Hazırlanan CANCIDAS hasta infüzyon solüsyonu hazırlanmadan önce 1 saat ï£ 25°C'de saklanabilir.
Seyreltilmiş ilaç
IV torba veya şişedeki son hasta infüzyon solüsyonu ï£ 25°C'de 24 saat veya 2-8°C'de 48 saat saklanabilir.
6.5. Ambalajın niteliği ve içeriği
CANCIDAS 70 mg sarı-turuncu alüminyum bantlı ve plastik kapaklı flakon içerisinde infüzyonluk beyaz-beyazımsı renkte toz/kompakt tozdur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
CANCIDAS'ı infüzyon için hazırlama
Buzdolabından çıkardığınız CANCIDAS flakonu oda ısısına getiriniz.
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AFUNDAS-L | 8699541794794 | 6,760.51TL |
| CANCAS | 8699844791384 | 6,393.55TL |
| CANCIDAS | 8699636260227 | |
| CAPIFUNG | 8681428791392 | 22,054.77TL |
| CASFUCIDE | 8681697790058 | 6,477.03TL |
| Diğer Eşdeğer İlaçlar |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Merck İlaç Ecza ve Kimya Ticaret AŞ
| Geri Ödeme Kodu | A01581 |
| Satış Fiyatı | 6118.49 TL [ 27 Sep 2024 ] |
| Önceki Satış Fiyatı | 6118.49 TL [ 20 Sep 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699636260203 |
| Etkin Madde | Kaspofungin Asetat |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |