CERVARIX 0.5 ml IM enjeksiyon için süspansiyon içeren kullanıma hazır 1 enjektör Farmasötik Özellikler
{ Hpv Tip 6l1 Protein + Hpv Tip 18l1 Protein }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum klorür
Sodyum dihidrojen fosfat dihidrat Enjeksiyonluk su
AS04 adjuvanı içeriğinde:
3-O-desasil-4' – monofosforil lipid A (MPL)
Alüminyum hidrokside adsorbe edilmiş, hidrate (Al (OH))
6.2. Geçimsizlikler
Bu tıbbi ürüne ait geçimlilik çalışmaları olmadığından diğer tıbbi ürünlerle karıştırılarak kullanılmamalıdır.
6.3. Raf ömrü
48 aydır.
CERVARIX buzdolabından çıkartıldıktan sonra mümkün olan en kısa sürede uygulanmalıdır. Bununla birlikte, üretilen stabilite verileri CERVARIX'in buzdolabının dışında 8°C ile 25°C arasındaki sıcaklıklarda üç güne kadar ya da 25°C ile 37°C derece arasındaki sıcaklıklarda bir güne kadar saklanması halinde stabil kaldığını ve aşının uygulanabileceğini göstermektedir. Bu koşullarda belirtilen sürelerin aşılması halinde aşı kullanılmamalıdır. Bu aşının bu parametreler dışında saklanmış olması halinde firmamız ile irtibata geçiniz.
6.4. Saklamaya yönelik özel tedbirler
2ºC - 8ºC arası sıcaklıklarda (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünü çözüp kullanmayınız. Ambalajında, ışıktan koruyarak saklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda; bütil kauçuk tıpalı 1,25 ml'lik tek dozluk ambalajlarda kullanıma hazır 1 adet cam
enjektör+iğne
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Depolama sırasında kullanıma hazır şırınga içinde berrak renksiz süpernatant ile birlikte ince beyaz çökelti gözlenebilir. Bu durum bozulma belirtisi değildir.
Uygulama öncesi, şırınga içeriği çalkalanmadan önce ve çalkalandıktan sonra herhangi bir partikül oluşumu ve/veya anormal fiziksel görüntü yönünden görsel olarak kontrol edilmelidir.
Herhangi birinin varlığı gözlendiğinde aşı imha edilmelidir. Aşı kullanılmadan önce iyice çalkalanmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve
“Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir. Kullanıma hazır enjektör içindeki aşının uygulanmasına yönelik talimatlar
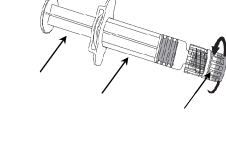
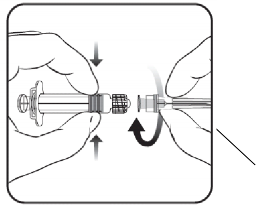
Enjektörün gövdesini bir elinizde tutup (pistonu tutmayınız) enjektör kapağını saat yönünün tersine çevirerek açınız.
Enjektör pistonu
19
Enjektör gövdesi
Enjektör Kapağı
İğne kılıfı
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 2357.73 TL [ 28 Jul 2025 ] |
| Önceki Satış Fiyatı | 2357.73 TL [ 21 Jul 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522967544 |
| Etkin Madde | Hpv Tip 6l1 Protein + Hpv Tip 18l1 Protein |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |