COPELLOR 80 mg/1 ml enjeksiyonluk çözelti içeren kullanıma hazır kalem (3 kalem) Kısa Ürün Bilgisi
{ Iksekizumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
COPELLOR 80 mg/1 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her kullanıma hazır enjektör 1 ml içinde 80 mg ixekizumab içerir.
Ixekizumab CHO (Çin hamster ovaryumu) hücrelerinde rekombinant DNA teknolojisi ile üretilir.
Yardımcı maddeler
Sodyum sitrat dihidrat Sodyum klorür
Yardımcı maddelerin tamamı için 6.1'e bakınız
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti (enjeksiyon).
Çözelti berraktır ve renksiz ya da hafif sarıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Plak Psöriyazis
COPELLOR; siklosporin, metotreksat veya PUVA gibi sistemik tedavilere yanıt vermeyen, tolere edemeyen ya da bu tür tedavilerin kontrendike olduğu erişkin hastalardaki orta derece veya şiddetli plak psöriyazis tedavisinde endikedir.
Psöriyatik Artrit
COPELLOR; tek başına veya metotreksat ile kombinasyon halinde, bir veya birden fazla hastalık modifiye edici antiromatizmal ilaç (DMARD) tedavisine yetersiz yanıt veren ya da intolerans gösteren yetişkin aktif psöriyatik artrit hastalarının tedavisinde endikedir (bkz. Bölüm 5.1).
Aksiyel spondiloartrit
Ankilozan spondilit (radyografik aksiyel spondiloartrit)
COPELLOR; konvansiyonel tedaviye yetersiz yanıt veren aktif ankilozan spondilitli yetişkin hastaların tedavisinde endikedir.
Non-radyografik aksiyel spondiloartrit
COPELLOR; nonsteroidal antiinflamatuvar ilaçlara (NSAİİ'lar) yetersiz yanıt veren, yüksek C-reaktif protein (CRP) ve/veya manyetik rezonans görüntüleme (MRI) ile gösterilen objektif inflamasyon belirtileri olan, aktif non-radyografik aksiyel spondiloartriti olan yetişkin hastaların tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiBu tıbbi ürün, endike olduğu durumların tanı ve tedavisinde deneyimli bir hekimin rehberliği
ve gözetimi altında kullanılmalıdır.
Pozoloji
Yetişkinlerde Plak Psöriyazis
Önerilen doz 0. haftada subkütan enjeksiyonla 160 mg (80 mg'lık iki enjeksiyon), ardından 2, 4, 6, 8, 10 ve 12. haftalarda 80 mg (tek enjeksiyon) ve sonrasında da 4 haftada bir 80 mg (tek enjeksiyon) idame dozu şeklindedir (Q4W).
Psöriyatik Artrit
Önerilen doz 0. haftada subkütan enjeksiyonla 160 mg (80 mg'lik iki enjeksiyon), ardından 4 haftada bir 80 mg (tek enjeksiyon) idame dozu şeklindedir. Eş zamanlı orta ila şiddetli plak psöriyazis bulunan psöriyatik artrit hastalarında önerilen dozlama rejimi plak psöriyazise yönelik dozlama rejimiyle aynıdır.
Aksiyel spondiloartrit (radyografik ve non-radyografik)
Önerilen doz 0. haftada subkütan enjeksiyonla 160 mg (80 mg'lık iki enjeksiyon), ardından her 4 haftada bir 80 mg'dır (daha fazla bilgi için bkz. Bölüm 5.1).
Tüm endikasyonlar için (yetişkinlerde plak psöriyazis, psöriyatik artrit, aksiyel spondiloartrit)
16 ila 20 haftalık tedaviye yanıt göstermeyen hastalarda, tedavinin sonlandırılması düşünülmelidir Başlangıçta kısmi yanıt gösteren bazı hastalar, 20 haftadan sonra tedaviye devam edildiğinde iyileşebilir.
Uygulama şekli:
Subkütan kullanım içindir.
COPELLOR subkütan enjeksiyon olarak uygulanır. Enjeksiyon yapılacak bölgeler değiştirilebilir. Mümkünse, psöriyazis görülen cilt bölgelerine enjeksiyon yapmaktan kaçınılmalıdır. Çözelti/enjektör çalkalanmamalıdır.
Subkütan enjeksiyon tekniği iyice öğretildikten sonra, sağlık mesleği mensubu uygun gördüğü takdirde hastalar kendi kendilerine COPELLOR enjeksiyonu yapabilirler. Ancak hekim hastaların takibinin yapıldığından emin olmalıdır. Uygulama için kapsamlı talimatlar Kullanma
Talimatında ve Kullanma Kılavuzunda verilmiştir.
Tıbbi ürünün uygulamadan önce hazırlanmasına ilişkin talimatlar için bkz. Bölüm 6.6.
Özel popülasyonlara ilişkin bilgiler Böbrek/Karaciğer yetmezliği:
COPELLOR bu hasta popülasyonlarında çalışılmamıştır. Doz önerisi yapılamamaktadır.
Pediyatrik popülasyon:
COPELLOR 80 mg/1 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektörün'un çocuklarda kullanılması ile ilgili bir endikasyonu yoktur (bkz. Bölüm 4.1).
Geriyatrik popülasyon:
Doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2).
75 yaş ve üzeri hastalarla ilgili sınırlı bilgi bulunmaktadır.
4.3. Kontrendikasyonlar
Etkin madde
Klinik olarak önemli aktif enfeksiyonlar (örn. aktif tüberküloz, bkz. Bölüm 4.4)
4.4. Özel kullanım uyarıları ve önlemleri
İzlenebilirlik
Biyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Enfeksiyonlar
COPELLOR tedavisi üst solunum yolu enfeksiyonu, oral kandidiyaz, konjonktivit ve tinea gibi enfeksiyonların riskinde artışla ilişkilendirilmektedir (bkz. Bölüm 4.8).
COPELLOR klinik olarak anlamlı kronik enfeksiyonu veya tekrarlayan enfeksiyon öyküsü olan hastalarda dikkatle kullanılmalıdır. Hastalara, bir enfeksiyon olduğunu düşündüren belirti veya semptomlar meydana gelirse tıbbi yardım almaları söylenmelidir. Enfeksiyon gelişmesi halinde, dikkatle izlem yapılmalı ve hasta standart enfeksiyon tedavisine yanıt vermediği takdirde veya eğer enfeksiyon ciddi hale gelirse COPELLOR kesilmelidir. Enfeksiyon düzelene kadar COPELLOR tedavisi tekrar başlatılmamalıdır. COPELLOR aktif tüberkülozu (Tbc) olan hastalara verilmemelidir. Latent Tbc hastalarında COPELLOR tedavisine başlamadan önce anti-Tbc tedavi düşünülmelidir.
Aşırı duyarlılık
Bazı anafilaksi, anjiyoödem, ürtiker ve seyrek olarak yaygın ürtiker, dispne ve yüksek antikor titreli geç oluşan (enjeksiyonu takiben 10-14 gün) ciddi aşırı duyarlılık reaksiyonları bildirilmiştir. Ciddi bir aşırı duyarlılık reaksiyonu oluşursa, COPELLOR uygulaması derhal
kesilmeli ve uygun tedaviyebaşlanmalıdır.
Enflamatuvar Bağırsak Hastalığı (Crohn hastalığı ve ülseratif kolit dahil)
Ixekizumab ile enflamatuvar bağırsak hastalığında yeni olgular veya alevlenme olguları bildirilmiştir (bkz. Bölüm 4.8). Enflamatuvar bağırsak hastalığı olan hastalarda ixekizumab önerilmemektedir. Eğer hastada enflamatuvar bağırsak hastalığı belirti ve semptomları gelişirse veya önceden var olan enflamatuvar bağırsak hastalığı alevlenirse ixekizumab kesilmeli ve uygun tıbbi tedavi başlatılmalıdır.
Aşılar
COPELLOR canlı aşılarla birlikte kullanılmamalıdır. Canlı aşılara yanıtla ilgili veri yoktur, inaktif aşılara yanıtla ilgili yeterli veri bulunmamaktadır (bkz. Bölüm 5.1).
Sodyum:
Bu tıbbi ürün 80 mg doz başına 1 mmol'den az (23 mg) sodyum ihtiva eder, yani temel olarak “sodyum içermezâ€.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli olan kadınlar/doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip olan kadınlar tedavi boyunca ve tedaviden sonra en az 10 hafta etkili bir kontrasepsiyon metodu kullanmalıdırlar.
Gebelik dönemi
Ixekizumabın gebe kadınlarda kullanımıyla ilgili yeterli klinik veri bulunmamaktadır. Hayvan çalışmalarında gebelik, embriyonik/fetal gelişim, doğum ve postnatal gelişim bakımından doğrudan veya dolaylı herhangi bir zararlı etki gösterilmemiştir (bkz. Bölüm 5.3). Önleme yönelik bir tedbir olarak, gebelikte COPELLOR kullanımından kaçınılması tercih edilmektedir.
Laktasyon dönemi
Ixekizumabın insanlarda anne sütüne geçip geçmediği ya da alımdan sonra sistemik emilime uğrayıp uğramadığı bilinmemektedir. Ancak ixekizumab sinomolgus maymunlarının sütüne düşük miktarda geçmektedir. Emzirmeye ara verilmesi veya COPELLOR kullanımından kaçınılması konusu emzirmenin çocuğa sağladığı yarar ile tedavinin kadına getirdiği yarar dikkate alınarak kararlaştırılmalıdır.
Üreme yeteneği (Fertilite)
Ixekizumabın insan fertilitesi üzerindeki etkisi değerlendirilmemiştir. Hayvan çalışmalarında fertiliteyle ilgili doğrudan veya dolaylı herhangi bir zararlı etki gösterilmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
COPELLOR araç ve makine kullanımı üzerinde etki göstermemekte veya ihmal edilebilir etki göstermektedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
En sık bildirilen advers reaksiyonları enjeksiyon bölgesi reaksiyonları (%15,5) ve üst solunum yolu enfeksiyonu (%16,4) (en sık nazofarenjit) olmuştur.
Advers reaksiyonların tablo halindeki listesi
Klinik çalışmalarda ve pazarlama sonrası raporlarda görülen advers reaksiyonlar (Tablo 1) MedDRA sistem organ sınıfına göre verilmiştir. Her sistem organ sınıfı içindeki advers reaksiyonlar en sıktan başlanarak sıklığa göre sıralanmıştır. Advers reaksiyonlar her sıklık grubunda azalan ciddiyet düzeyine göre sunulmuştur. Ayrıca, her advers reaksiyonun sıklık kategorisi şu sisteme dayanmıştır: Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Plak psöriyazis, psöriyatik artrit, aksiyel spondiloartrit ve diğer otoimmün sorunlarla ilgili körlenmiş ve açık etiketli klinik çalışmalarda toplam 8.956 hasta COPELLOR tedavisi almıştır. Bu hastaların 6.385'inde en az bir yıl süreli COPELLOR maruziyeti kaydedilmiştir, bu sayı kümülatif olarak 19.833 hasta yılı maruziyetini temsil etmektedir.
Tablo 1. Klinik Çalışmalardaki Advers Reaksiyon Listesi ve Pazarlama Sonrası Raporlar
Sistem Organ Sınıfı | Sıklık | Advers Reaksiyon |
Enfeksiyonlar ve enfestasyonlar | Çok yaygın | Üst solunum yolu enfeksiyonu |
Yaygın | Tinea enfeksiyonu, Herpes simpleks (mukokütanöz) | |
Yaygın olmayan | İnfluenza, Rinit, Oral kandidiyaz, Konjonktivit, Sellülit | |
Seyrek | Özofageal kandidiyaz | |
Kan ve lenf sistemi hastalıkları | Yaygın olmayan | Nötropeni, Trombositopeni |
Bağışıklık sistemi hastalıkları | Yaygın olmayan | Anjiyoödem |
Seyrek | Anafilaksi | |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | Yaygın | Orofarengeal ağrı |
Gastrointestinal hastalıkları | Yaygın | Bulantı |
Yaygın olmayan | Enflamatuvar bağırsak hastalığı | |
Deri ve deri altı doku hastalıkları | Yaygın olmayan | Ürtiker, Döküntü, Egzama |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları | Çok yaygın | Enjeksiyon bölgesinde reaksiyonlar |
Enjeksiyon bölgesi reaksiyonları
En sık gözlenen enjeksiyon bölgesi reaksiyonları eritem ve ağrı olmuştur. Bu reaksiyonlar ağırlıklı olarak hafif ila orta şiddette olup COPELLOR'un kesilmesine neden olmamıştır. Yetişkin plak psöriyazis çalışmalarında, enjeksiyon bölgesi reaksiyonları vücut ağırlığı <60 kg olan hastalarda ≥60 kg olan hastalara kıyasla daha yaygın olmuştur (Kombine edilmiş Q2W ve Q4W grupları için %25'e karşı %14). Psöriyatik artrit çalışmalarında enjeksiyon bölgesi reaksiyonları vücut ağırlığı <100 kg olan hastalarda ≥100 kg olanlara kıyasla daha yaygın görülmüştür (kombine Q2W ve Q4W grupları için %24 ve %13). Kombine Q2W ve Q4W gruplarında artmış enjeksiyon bölgesi reaksiyonlarının sıklığı, plak psöriyazis veya psöriyatik artrit çalışmalarında tedaviyi bırakmaların artmasına yol açmamıştır. Aksiyel spondiloartrit çalışmalarında, vücut ağırlığı <100 kg olan hastalarda, vücut ağırlığı ≥100 kg olan grupla karşılaştırıldığında enjeksiyon bölgesi reaksiyonları benzer olmuştur (kombine Q2W ve Q4W grupları için %14'e karşı %9). Kombine Q2W ve Q4W gruplarında artmış enjeksiyon bölgesi
reaksiyonlarının sıklığı, plak psöriyazis, psöriyatik artrit veya aksiyel spondiloartrit
Enfeksiyonlar
Plak tipi yetişkin psöriyazis ile ilgili faz III klinik çalışmaların plasebo ayağında, 12 haftaya kadar COPELLOR ile tedavi edilen hastaların %27,2'sinde, plasebo alanların ise %22,9'unda enfeksiyonlar bildirilmiştir.
Enfeksiyonların çoğu hafif ila orta şiddette olup ciddi değildir, tedavinin kesilmesini gerektirmemiştir. Ciddi enfeksiyonlar COPELLOR alan hastaların 13'ünde (%0,6) ve plasebo alanların 3'ünde (%0,4) görülmüştür (bkz. Bölüm 4.4). Tüm tedavi süresi boyunca COPELLOR tedavisi gören hastaların %52,8'inde enfeksiyon bildirilmiştir (100 hasta yılında 46,9). COPELLOR tedavisi gören hastaların %1,6'sında ciddi enfeksiyon bildirilmiştir (100 hasta yılında 1,5).
Psöriyatik artrit ve aksiyel spondiloartrit klinik çalışmalarında gözlenen enfeksiyon oranları, plak psöriyazis çalışmalarındaki oranlarla tutarlıdır, istisnai olarak influenza ve konjonktivit advers reaksiyon sıklıkları psöriyatik artrit hastalarında yaygındır.
Nötropeni ve trombositopenin laboratuvar değerlendirmesi
Plak psöriyazis çalışmalarında, COPELLOR alan hastaların %9'unda nötropeni gelişmiştir. Çoğu vakada kan nötrofil sayısı ≥1000 hücre/mm'tür. Nötropeni seviyeleri kalıcı, düzensiz ya da geçici olabilir. COPELLOR alan hastaların %0,1'inde nötrofil sayısı <1000 hücre/mm tür. Genel olarak, nötropeni COPELLOR tedavisinin kesilmesini gerektirmemiştir. COPELLOR alan hastaların %3'ünde normal başlangıç trombosit değerinden ≥75.000 hücre/mm ila <150.000 hücre/mme geçiş olmuştur. Trombositopeni devam edebilir, düzensiz veya geçici olabilir.
Psöriyatik artrit ve aksiyel spondiloartrit ile ilgili klinik çalışmalarda nötropeni ve trombositopeni sıklığı plak psöriyazis çalışmalarında gözlenen ile benzerdir.
İmmünojenisite
Önerilen dozda COPELLOR ile yetişkin plak psöriyazis tedavisi gören hastaların yaklaşık %9– 17'sinde ilaca karşı antikor gelişmiş ve bunların çoğu düşük titreli olup 60 haftaya kadar tedavide klinik yanıtta azalmayla ilişkilendirilmemiştir. Bununla birlikte, COPELLOR ile tedavi gören hastaların yaklaşık %1'inde düşük ilaç konsantrasyonu ve klinik yanıtta azalmayla ilişkili nötralizan antikor varlığı doğrulanmıştır.
Elli iki haftaya kadar önerilen dozlama rejiminde COPELLOR tedavisi alan psöriyatik artrit hastalarının yaklaşık %11'inde büyük kısmı düşük titreli olmak üzere anti-ilaç antikorları gelişirken yaklaşık %8'inde nötralizan antikorlar doğrulanmıştır. Nötralizan antikor varlığı ile ilaç konsantrasyonu veya etkililiği üzerindeki etki arasında belirgin bir ilişki gözlenmemiştir.
On altı haftaya kadar önerilen dozlama rejiminde COPELLOR tedavisi alan radyografik aksiyel spondiloartrit hastalarının %5,2'sinde büyük kısmı düşük titreli olmak üzere anti-ilaç antikorları gelişirken yaklaşık %1,5'inde (3 hasta) nötralizan antikorlar (NAb) görülmüştür. Bu
3 hastada NAb-pozitif numuneleridüşükixekizumabkonsantrasyonları göstermiştir ve bu
hastaların hiçbiri bir ASAS40 yanıtı elde etmemiştir. Elli iki haftaya kadar önerilen dozlama rejiminde COPELLOR tedavisi alan non-radyografik aksiyel spondiloartrit hastalarının
%8,9'unda büyük kısmı düşük titreli olmak üzere anti-ilaç antikorları gelişirken, hiçbir hastada nötralizan antikorlar görülmemiştir ve anti-ilaç antikorlarının varlığı ile ilaç konsantrasyonu, etkililiği veya güvenliği arasında hiçbir belirgin ilişki gözlenmemiştir.
Tüm endikasyonlarda, immünojenisite ve acil tedavi edilmesi gereken advers olaylar arasında açıkça bir ilişki kurulmamıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda doz sınırlayıcı toksisite olmaksızın 180 mg'a varan dozlar subkütan olarak uygulanmıştır. Subkütan yoldan, klinik çalışmalarda tek bir uygulama olarak 240 mg'ı bulan doz aşımlarında ciddi advers olay olmadığı bildirilmiştir. Doz aşımı durumunda, hastanın advers reaksiyon belirti ve bulguları yönünden izlenmesi ve uygun semptomatik tedaviye derhal başlanması önerilmektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosüpresanlar, interlökin inhibitörleri ATC kodu: L04AC13
Etki mekanizması
Ixekizumab, interlökin 17A'ya (IL-17A ve IL-17A/F) yüksek afinite (< 3 pM) ve özgüllükle bağlanan bir IgG4 monoklonal antikorudur. IL-17A'nın yüksek konsantrasyonları, keratinosit proliferasyonu ve aktivasyonunu uyararak psöriyazis patogenezinden olduğu gibi eroziv kemik hasarına ve patolojik yeni kemik oluşumuna yol açan inflamasyonu tetikleyerek aksiyel spondiloartrit ve psöriyatik artrit patogenezinden de sorumlu tutulmuştur. Ixekizumabın IL- 17A'yı nötralize etmesi bu etkileri inhibe etmektedir. Ixekizumab IL-17B, IL-17C, IL-17D, IL- 17E ya da IL-17F ligandlarına bağlanmaz.
İn vitro bağlanma testleri ixekizumabın insan Fcγ reseptörleri I, IIa ve IIIa'ya veya kompleman bileşeni C1q'ya bağlanmadığını doğrulamıştır.
Farmakodinamik etkiler
Ixekizumab, IL-17A ile indüklenen ya da düzenlenen biyolojik yanıtları modüle eder. Yapılan bir faz I çalışmasından elde edilen psöriyatik deri biyopsisi verilerine dayanarak, başlangıçtan
43. güne kadar epidermis kalınlığındaveprolifereolankeratinosit sayısında, T hücreleri ve
dendritik hücre sayısında azalmanın yanı sıra lokal enflamatuvar belirteçlerde azalma yönünde doza bağımlı bir eğilim bulunmuştur. Doğrudan sonuç olarak ixekizumab tedavisi psöriyazis plak lezyonlarında bulunan eritem, endurasyon ve deskuamasyonu azaltmaktadır.
COPELLOR'un inflamasyon belirteçlerinden C reaktif protein düzeylerini düşürdüğü (tedavinin 1 haftası içinde) gösterilmiştir.
Klinik etkililik ve güvenlilik
Yetişkinlerde plak psöriyazis
COPELLOR'un etkililik ve güvenliliği fototerapi ya da sistemik tedavi önerilen orta ila ağır plak tipi psöriyazisli yetişkin hastaların (N=3.866) yer aldığı randomize, çift kör, plasebo kontrollü üç faz III çalışmada değerlendirilmiştir (UNCOVER-1, UNCOVER-2 ve UNCOVER-3). COPELLOR'un etkililik ve güvenliliği etanerseptle karşılaştırılarak da değerlendirilmiştir (UNCOVER-2 ve UNCOVER-3). COPELLOR almak üzere randomize edilen ve 12. haftada sPGA (static Physician Global Assessment) (0,1) yanıtı olan hastalar 48 haftalık ekstra bir süre boyunca plasebo ya da COPELLOR almak üzere tekrar randomize edilmiş (UNCOVER-1 ve UNCOVER-2); plasebo, etanersept ya da COPELLOR almak üzere randomize edilmiş olup sPGA (0,1) yanıtı görülmeyen hastalara ise 48 hafta daha COPELLOR uygulanmıştır. Ek olarak, çalışmanın tamamına katılan hastalarda toplam 5 yıla kadar, uzun dönem etkililik ve güvenlilik her üç çalışmada da değerlendirilmiştir.
Hastaların %64'ünün daha önce sistemik tedavi (biyolojik, konvansiyonel sistemik ya da psoralen ve ultaviyole A (PUVA)), %43,5'inin fototerapi, %49,3'ünün konvansiyonel sistemik tedavi ve %26,4'ünün biyolojik tedavi almış olduğu kaydedilmiştir. %14,9'unun en az bir anti- TNF alfa ajan ve %8,7'sinin bir anti-IL-12/IL-23 almış olduğu belirlenmiştir. Hastaların
%23,4'ünde başlangıçta psöriyatik artrit öyküsü kaydedilmiştir.
Üç çalışmada da bileşik primer sonlanım noktaları 12. haftada plaseboya kıyasla PASI (Psöriyazis Alan Şiddet İndeksi) 75 yanıtına ve “0†("temiz") ya da 1 ("minimal") sPGA yanıtına ulaşan hasta oranı olarak belirlenmiştir. Medyan başlangıç PASI skoru 17,4 ile 18,3 arasında değişmiş; hastaların %48,3 ila %51,2'sinde başlangıç sPGA skorunun şiddetli ila çok şiddetli olup ortalama başlangıç kaşıntı Sayısal Derecelendirme Ölçeğinin (kaşıntı NRS) 6,3 ile 7,1 arasında olduğu kaydedilmiştir.
12. haftada Klinik Yanıt
UNCOVER-1 çalışmasında 1296 hasta, 12 hafta süresince plasebo ya da COPELLOR (160 mg başlangıç dozunun ardından iki ya da dört haftada bir 80 mg [Q2W ya da Q4W]) almak üzere randomize (1:1:1) edilmiştir.
Tablo 2. UNCOVER-1 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları | Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | |||
Plasebo (N = 431) | COPELLOR 80 mg Q4W (N = 432) | COPELLOR 80 mg Q2W (N = 433) | COPELLOR 80 mg Q4W | COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
14 (3,2) |
330 (76,4) |
354 (81,8) | 73,1 (68,8 ; 77,5) | 78,5 (74,5 ; 82,5) |
sPGA "0" (temiz) | 0 | 149 (34,5) | 160 (37) | 34,5 (30 ; 39) | 37 (32,4 ; 41,5) |
PASI 75 | 17 (3,9) | 357 (82,6) | 386 (89,1) | 78,7 (74,7 ; 82,7) | 85,2 (81,7 ; 88,7) |
PASI 90 | 2 (0,5) | 279 (64,6) | 307 (70,9) | 64,1 (59,6 ; 68,7) | 70,4 (66,1 ; 74,8) |
PASI 100 | 0 | 145 (33,6) | 153 (35,3) | 33,6 (29,1 ; 38) | 35,3 (30,8 ; 39,8) |
Kaşıntı NRS azalması ≥ 4 | 58 (15,5) | 305 (80,5) | 336 (85,9) | 65 (59,5 ; 70,4) | 70,4 (65,4 ; 75,5) |
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır.
= 379, COPELLOR 80 mg Q2W N = 391
UNCOVER-2 çalışmasında 1224 hasta, 12 hafta süresince plasebo, COPELLOR (160 mg başlangıç dozunun ardından iki veya dört haftada bir 80 mg [Q2W ya da Q4W]) veya haftada iki kez etanersept 50 mg almak üzere randomize (1:2:2:2) edilmiştir.
Tablo 3. UNCOVER-2 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları | Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
Plasebo (N = 168) | COPELLO R 80 mg Q4W (N = 347) | COPELLO R 80 mg Q2W (N = 351) | Etanersept 50 mg, haftada iki kez (N = 358) | COPELLOR 80 mg Q4W | COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
4 (2,4) |
253 (72,9) |
292 (83,2) |
129 (36) | 70,5 (65,3 ; 75,7) | 80,8 (76,3 ; 85,4) |
sPGA "0" | 1 (0,6) | 147(41,9) | 31,7 | 41,3 | ||
PASI 75 | 4 (2,4) | 269 (77,5) | 315 (89,7) | 149 (41,6) | 75,1 (70,2 ; 80,1) | 87,4 (83,4 ; 91,3) |
PASI 90 | 1 (0,6) | 207 (59,7) | 248 (70,7) | 67 (18,7) | 59,1 (53,8 ; 64,4) | 70,1 (65,2 ; 75) |
PASI 100 | 1 (0,6) | 107 (30,8) | 142 (40,5) | 19 (5,3) | 30,2 (25,2 ; 35,2) | 39,9 (34,6 ; 45,1) |
Kaşıntı NRS azalması ≥ 4 | 19 (14,1) | 225 (76,8) | 258 (85,1) | 177 (57,8) | 62,5 (55,1 ; 70,3) | 71,1 (64 ; 78,2) |
Kısaltmalar: N = tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır.
= 293, COPELLOR 80 mg Q2W N = 303, Etanersept N = 306
UNCOVER-3 çalışmasında 1346 hasta , 12 hafta süresince plasebo, COPELLOR (160 mg başlangıç dozunun ardından iki veya dört haftada bir 80 mg [Q2W ya da Q4W]) veya haftada iki kez etanersept 50 mg almak üzere randomize (1:2:2:2) edilmiştir.
Tablo 4. UNCOVER-3 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları |
Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
Plasebo (N = 193) |
COPELLOR 80 mg Q4W (N = 386) |
COPELLOR 80 mg Q2W (N = 385) | Etanersept 50 mg haftada iki kez (N = 382) |
COPELLOR 80 mg Q4W |
COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
13 (6,7) |
291 (75,4) |
310 (80,5) |
159 (41,6) | 68,7 (63,1 ; 74,2) | 73,8 (68,5 ; 79,1) |
sPGA "0" (temiz) | 0 | 139 (36) | 155 (40,3) | 33 (8,6) | 36 (31,2 ; 40,8) | 40,3 (35,4 ; 45,2) |
PASI 75 | 14 (7,3) | 325 (84,2) | 336 (87,3) | 204 (53,4) | 76,9 (71,8 ; 82,1) | 80 (75,1 ; 85) |
PASI 90 | 6 (3,1) | 252 (65,3) | 262 (68,1) | 98 (25,7) | 62,2 (56,8 ; 67,5) | 64,9 (59,7 ; 70,2) |
PASI 100 | 0 | 135 (35) | 145 (37,7) | 28 (7,3) | 35 (30,2 ; 39,7) | 37,7 (32,8 ; 42,5) |
Kaşıntı NRS Azalması ≥4 | 33 (20,9) | 250 (79,9) | 264 (82,5) | 200 (64,1) | 59 (51,2 ; 66,7) | 61,6 (54,0 ; 69,2) |
Kısaltmalar: N = tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olanhastalarcevapvermeyenolaraksayılmıştır.
= 313, COPELLOR 80 mg Q2W N = 320, Etanersept N = 312
COPELLOR 2. haftada ortalama PASI'de >%50 azalmayla hızlı başlangıçlı etkililik göstermiştir (Şekil 1). COPELLOR ile PASI 75'e ulaşan hasta yüzdesi daha 1. haftada plasebo ve etanersepte kıyasla anlamlı ölçüde yüksek bulunmuştur. COPELLOR ile tedavi edilen hastaların yaklaşık %25'inde 2. haftada <5 PASI skoruna ulaşılmış, 4. haftada %55'ten fazlasında <5 PASI skoruna ulaşılmış ve 12. haftada bu oran %85'e çıkmıştır (etanersept için
%3, %14 ve %50). COPELLOR ile tedavi edilen hastalarda 1. haftada kaşıntıda anlamlı düzelmeler görülmüştür.
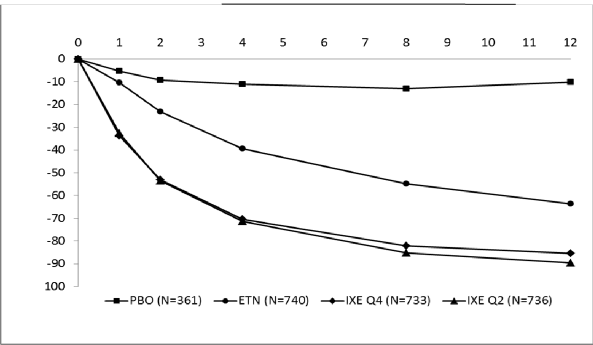
Tedavi Haftası
Şekil 1. İndüksiyon Dozlama Döneminde Tedavi Yönelimli Popülasyonda Başlangıç Sonrası Her Vizitte (mBOCF) PASI Skoru, Düzelme Yüzdesi - UNCOVER-2 ve UNCOVER-3
COPELLOR'un etkililik ve güvenliliği yaş, cinsiyet, ırk, vücut ağırlığı, başlangıçtaki PASI şiddet derecesi, plak bölgesi, eş zamanlı psöriyatik artrit ve önceden uygulanan biyolojik tedaviden bağımsız olarak ortaya konmuştur. COPELLOR sistemik tedavi görmemiş, biyolojik ürün kullanmamış, biyolojik/anti-TNF'ye maruz kalmış ve biyolojik/anti-TNF'yle başarısız olunmuş hastalarda etkili olmuştur.
UNCOVER-2 çalışmasında 12. haftada sPGA (0,1) etanersepte yanıtsız olduğu belirlenen (N
= 200) ve 4 haftalık arınma döneminden sonra COPELLOR 80 mg Q4W'ye geçen hastaların sırasıyla %73 ve %83,5'inde 12 haftalık COPELLOR tedavisinden sonra sPGA (0,1) ve PASI 75 elde edilmiştir.
Aktif komparatörün yer aldığı 2 klinik çalışmada (UNCOVER-2 ve UNCOVER-3), ciddi advers olayların oranı etanersept ve COPELLOR için %1,9 olup advers olaylara bağlı ilacı bırakma oranı etanersept için %1,2 ve COPELLOR için %2 bulunmuştur. Enfeksiyon oranı etanersept için %21,5 ve COPELLOR için %26 olup ciddi enfeksiyon oranı etanersept için
%0,4 ve COPELLOR için %0,5 olmuştur.
Yanıtın 60. Haftada ve 5 Yıla Kadar Korunması
UNCOVER-1 ve UNCOVER-2'de normalde COPELLOR için randomize edilen ve 12. haftada yanıt veren hastalar (sPGA skoru 0,1) 48 hafta daha plasebo ya da COPELLOR (dört ila on iki haftada bir 80 mg [Q4W ya da Q12W]) tedavi rejimlerinden birini almak üzere tekrar randomize edilmiştir.
On ikinci haftada sPGA (0,1) yanıtı veren ve tedaviden çekilmek üzere yeniden randomize edilenlerde relapsa kadar geçen medyan süre UNCOVER-1 ve UNCOVER-2 çalışmaları entegre edildiğinde (sPGA ≥ 3) 164 gün olarak belirlenmiştir. Bu hastaların %71,5'i COPELLOR 80 mg Q4W ile tekrar tedaviye başlandıktan sonra 12 hafta içinde en az sPGA (0,1) yanıtını geri kazanmıştır.
Tablo 5. 60. Haftada Yanıt ve Etkililiğin Korunması (UNCOVER-1 ve UNCOVER-2 çalışmaları)
Sonlanım noktaları |
Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
80 mg Q4W (indüksiyon) / Plasebo (idame) (N=191) | 80 mg Q2W (indüksiyon) / Plasebo (idame) (N=211) | 80 mg Q4W (indüksiyon) / 80 mg Q4W (idame) (N=195) | 80 mg Q2W (indüksiyon) / 80 mg Q4W (idame) (N=221) | 80 mg Q4W (indüksiyon) / 80 mg Q4W (idame) | 80 mg Q2W (indüksiyon) / 80 mg Q4W (idame) | |
İdame Ettirilen sPGA "0" (temiz) ya da "1" (minimal) |
12 (6,3) |
16 (7,6) |
134 (68,7) |
173 (78,3) |
62,4 (55,1 ; 69,8) |
70,7 (64,2 ; 77,2) |
İdame Ettirilen ya da Ulaşılan sPGA 0 (temiz) |
3 (1,6) |
6 (2,8) |
96 (49,2) |
130 (58,8) |
47,7 (40,4 ; 54,9) |
56 (49,1 ; 62,8) |
İdame Ettirilen ya da Ulaşılan PASI 75 |
15 (7,9) |
19 (9) |
145 (74,4) |
184 (83,3) |
66,5 (59,3 ; 73,7) |
74,3 (68 ; 80,5) |
İdame Ettirilen ya da Ulaşılan PASI 90 |
9 (4,7) |
10 (4,7) |
130 (66,7) |
169 (76,5) |
62 (54,7 ; 69,2) |
71,7 (65,4 ; 78) |
İdame Ettirilen ya da Ulaşılan PASI 100 |
3 (1,6) |
6 (2,8) |
97 (49,7) |
127 (57,5) |
48,2 (40,9 ; 55,4) |
54,6 (47,7 ; 61,5) |
Kısaltmalar: N = analiz popülasyonundaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır
COPELLOR'un sistemik tedavi görmemiş, biyolojik ajan kullanmamış, biyolojik/anti-TNF'ye maruz kalmış ve biyolojik/anti-TNF'yle başarısız olunmuş hastalardaki etkililiği korunmuştur.
Tırnak psöriyazisinde (Tırnak Psöriyazis Şiddet İndeksi [NAPSI] ile değerlendirilen), kafa derisi psöriyazisinde (Psöriyazis Kafa Derisi Şiddet İndeksi [PSSI] ile değerlendirilen) ve palmoplantar psöriyaziste (Psöriyazis Palmoplantar Şiddet İndeksi [PPASI] ile değerlendirilen) plaseboya ve etanersepte kıyasla 12. haftada başlangıca göre anlamlı derecede yüksek düzelmeler olduğu ortaya konmuştur ve COPELLOR ile tedavi edilip 12. haftada sPGA (0,1) yanıtı veren hastalarda 60. haftada korunmuştur.
UNCOVER-1, UNCOVER-2 ve UNCOVER-3 çalışmasında, Başlangıç Dönemi sırasında Copellor Q2W ve sonrasında Q4W alan 591 kişiden 427'si 5 yıllık Copellor tedavisini tamamlamıştır ve bunlardan 101'inde doz artışı gerekmiştir. İki yüz altmış dördüncü hafta değerlendirmesini tamamlayan hastalardan (N=427), 295 (%69), 289 (%68) ve 205 (%48) hastada, 264. haftada sırasıyla sPGA (0,1), PASI 90 ve PASI 100 yanıtı olduğu görülmüştür. UNCOVER-1 ve UNCOVER-2'de İndüksiyon Döneminden sonra DLQI toplanmıştır, 113 hastada (%66) DLQI (0,1) yanıtı olduğu gözlenmiştir.
Yaşam Kalitesi/Hasta Tarafından Bildirilen Sonuçlar
12. haftada ve çalışmaların tamamında COPELLOR, Dermatoloji Yaşam Kalitesi İndeksinde (DLQI) başlangıca göre ortalama azalma aralıklarıyla değerlendirilen Sağlıkla İlgili Yaşam Kalitesinde istatistiksel olarak anlamlı düzelmeler ile ilişkili bulunmuştur (COPELLOR 80 mg Q2W -10,2'den -11,1'e, COPELLOR 80 mg Q4W -9,4'ten - 10,7'ye, etanersept -7,7'den -8,0'a ve plasebo -1,0'dan -2,0'a). COPELLOR ile tedavi edilen hastaların anlamlı ölçüde yüksek bir bölümünde DLQI 0 veya 1 elde edilmiştir. Çalışmalar genelinde COPELLOR ile tedavi edilen hastaların anlamlı ölçüde yüksek bir bölümünde 12. Haftada Kaşıntı NRS≥4 noktalarında azalma elde edilmiş (COPELLOR Q2W için %84,6, COPELLOR Q4W için %79,2 ve plasebo için %16,5) ve COPELLORiletedaviedilen12. haftadasPGA(0 veya 1) yanıtı olan hastalarda
değerlendirilen 60. haftaya kadar COPELLOR ile tedavide depresyonun kötüleştiğine dair bir kanıt bulunamamıştır.
Pazarlama Sonrası doğrudan karşılaştırma çalışmaları
IXORA-S: Çift kör bir çalışmada, Copellor'un primer çalışma amacı 12. haftada PASI 90 yanıtı (Tablo 6) bakımından ustekinumaba üstün olduğu gösterilmiştir. Yanıt başlangıcı PASI 75 için 2. hafta gibi erken bir süreyle (p <0,001), PASI 90 ve PASI 100 için de 4. haftaya kadar olmak üzere üstün bulunmuştur (p <0,001). Copellor'un ustekinumaba kıyasla üstünlüğü vücut ağırlığına göre gruplanan alt gruplarda da ortaya konmuştur.
Tablo 6. Ixekizumab ve Ustekinumab Karşılaştırma Çalışmasında PASI Yanıt Oranları
| 12. hafta | 24. hafta | 52. hafta | |||
| Copellor* | Ustekinumab ** | Copellor * | Ustekinumab ** | Copellor* | Ustekinumab* * |
Hastalar (n) | 136 | 166 | 136 | 166 | 136 | 166 |
PASI 75, n (%) | 120 (%88,2) | 114 (%68,7) | 124 (%91,2) | 136 (%81,9) | 120 (%88,2) | 126 (%75,9) |
PASI 90, n (%) | 99 (%72,8) | 70 (%42,2) | 113 (%83,1) | 98 (%59) | 104 (%76,5) | 98 (%59) |
PASI 100, n (%) | 49 (%36) | 24 (%14,5) | 67 (%49,3) | 39 (%23,5) | 71 (%52,2) | 59 (%35,5) |
* Ixekizumab 160 mg yükleme dozu olarak verilmiş, ardından 2, 4, 6, 8, 10 ve 12. haftalarda 80 mg, daha sonra da Q4W 80 mg verilmiştir
** Vücut ağırlığına dayalı dozlama: Ustekinumab tedavisi alan hastalara 0 ve 4. haftalarda ve daha sonra 52. haftaya kadar 12. haftada bir 45 mg veya 90 mg uygulanmıştır (onaylı pozolojiye göre vücut ağırlığına bağlı olarak)
IXORA-R: Copellor'un etkililiği ve güvenliliği, Copellor'u guselkumab ile karşılaştıran 24 haftalık randomize, çift kör, paralel gruplu bir çalışmada da araştırılmıştır; Copellor, 4. haftadan itibaren tam cilt temizliği elde etmede ve birincil çalışma hedefinde (12. haftada PASI 100) üstündür ve 24. haftada PASI 100'de daha düşük değildir (Tablo 7).
Tablo 7. İxekizumab ile Guselkumab Karşılaştırmalı Çalışmasından Etkililik Yanıtları, Tedavi Amaçlı Popülasyon
Sonlanım Noktası |
Zaman | Guselkumab (N=507) yanıt, n (%) | Ixekizumab (N=520) yanıt, n (%) | Fark (IXE - GUS), % (CI) |
p-değeri | ||
Primer Hedefler | |||||||
PASI 100 | 12. hafta | 126 (24,9) | 215 | (41,3) | 16,5 | (10,8 ; 22,2) | <0,001 |
Majör Sekonder Hedefler | |||||||
PASI 75 | 2. hafta | 17,8 | (13,7 ; 21,8) | <0,001 | |||
PASI 90 | 4. hafta | 40 (7,9) | 109 | (21) | 13,1 | (8,9 ; 17,3) | <0,001 |
PASI 100 | 4. hafta | 7 (1,4) | 35 | (6,7) | 5,4 | (3 ; 7,7) | <0,001 |
PASI 90 | 8. hafta | 182 (35,9) | 304 | (58,5) | 22,6 | (16,6 ; 28,5) | <0,001 |
sPGA (0) | 12. hafta | 128 (25,2) | 218 | (41,9) | 16,7 | (11 ; 22,4) | <0,001 |
PASI 50 | 1. hafta | 47 (9,3) | 143 | (27,5) | 18,2 | (13,6 ; 22,8) | <0,001 |
PASI 100 | 8. hafta | 69 (13,6) | 154 | (29,6) | 16 | (11,1 ; 20,9) | <0,001 |
PASI 100 | 24. hafta | 265 (52,3) | 260 | (50) | -2,3 | (-8,4 ; 3,8) | 0,414 |
Kısaltmalar: CI = güven aralığı; GUS = guselkumab; IXE = ixekizumab; N = analiz popülasyonundaki hasta sayısı; n = belirtilen kategorideki hasta sayısı; PASI = Psöriyazis Alan Şiddet İndeksi; sPGA = statik Hekimin Genel Değerlendirmesi.
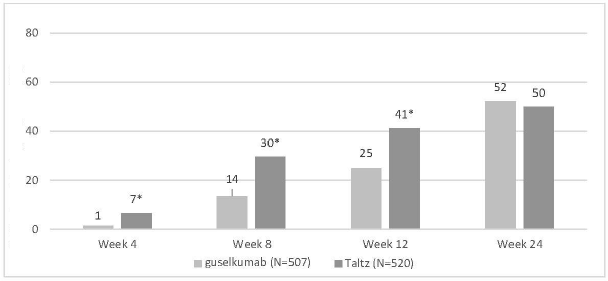
24. hafta
12. hafta
8. hafta
4. hafta
Şekil 2: 4, 8, 12 ve 24. Haftalarda PASI 100, NRI
*4, 8 ve 12. haftalarda guselkumab'a karşı p<0,001 NRI = Yanıt Vermeyen İmputasyonu
Genital Psöriyaziste Etkililik
Orta ila şiddetli genital psöriyazis (Genital sPGA skoru ≥3) bulunan, vücut yüzey alanının (VYA) minimum %1'i etkilenmiş (%60,4'ünde etkilenen VYA ≥%10) ve genital psöriyazis için önceden en az bir topikal tedaviyle başarısızlık ya da intolerans kaydedilmiş 149 yetişkin hastanın (%24 kadın) yer aldığı randomize, çift kör, plasebo kontrollü bir çalışma (IXORA-Q) yapılmıştır. Hastalarda en az 6 aydır ve en az orta dereceli olmak üzere plak psöriyazis (sPGA skoru ≥3 ve fototerapi ve/veya sistemik tedavi adayı olma şeklinde tanımlı) kaydedilmiştir.
COPELLOR tedavisine randomize edilen hastalar ilk doz olarak 160 mg ve ardından 12 hafta süreyle 2 haftada bir 80 mg almıştır. Primer sonlanım noktası genital organlarda sPGA için en az "0†(temiz) veya “1†(minimal) yanıt (genital sPGA 0/1) elde eden hastaların oranıdır. On ikinci haftada, COPELLOR grubunda plasebo grubuna kıyasla anlamlı derecede daha fazla sayıda hasta genital sPGA 0/1 ve başlangıç VYA değerinden bağımsız genital sPGA 0/1 elde etmiştir (sırasıyla başlangıçtaVYA%1-<%10,≥%10:genitalsPGA ‘0' veya ‘1': COPELLOR
büyük bir bölümü genital organlarda ağrı, genital organlarda kaşıntı, genital psöriyazisin cinsellik üzerine etkisi, Dermatoloji Yaşam Kalitesi İndeksi (DLQI) ve hasta tarafından bildirilen sonuçlarda (Patient Reported Outcomes - PRO) azalma elde etmiştir.
Tablo 8. IXORA-Q Çalışmasında Genital Psöriyazisli Yetişkinlerde 12. Haftada Etkililik Bulguları; NRI
Sonlanım noktaları | COPELLOR | Plasebo | Plaseboya kıyasla fark (%95 GA) |
Randomize edilen hasta sayısı (N) | N=75 | N=74 |
|
Genital organlarda sPGA “0†veya “1†| %73 | %8 | %65 (%53, %77) |
sPGA “0†veya “1†| %73 | %3 | %71 (%60, %81) |
DLQI 0,1 | %45 | %3 | %43 (%31, %55) |
Başlangıçta GPSS Kaşıntı NRS Skoru ≥3 olan N | N=62 | N=60 |
|
GPSS Genital Kaşıntı (≥3 puan iyileşme) | %60 | %8 | %51 (%37, %65) |
Başlangıçta SFQ Madde 2 Skoru ≥2 olan N | N=37 | N=42 |
|
SFQ madde 2 skoru, “0†(hiç etkilenmedi) veya “1†(nadiren etkilendi) | %78 | %21 | %57 (%39, %75) |
Psöriyatik artrit
COPELLOR aktif psöriyatik artrit (≥3 şiş eklem ve ≥3 hassas eklem) bulunan 780 hastanın yer aldığı randomize, çift kör, plasebo kontrollü iki faz III çalışmada değerlendirilmiştir. Hastalarda medyan 5,33 yıldır psöriyatik artrit tanısı (Psöriyatik Artrit Sınıflandırma Kriterleri [CASPAR]) olduğu kaydedilmiştir ve mevcut plak psöriyazis deri lezyonları (%94,0) veya belgelenmiş plak psöriyazis öyküsü olduğu, hastaların %12,1'inde başlangıçta orta ila şiddetli plak psöriyazis bulunduğu belirlenmiştir. Psöriyatik artrit hastalarının sırasıyla %58,9 ve
%22,3'ünden fazlasında başlangıçta entezit ve daktilit olduğu saptanmıştır. Her iki çalışmada da primer sonlanım noktası olarak 24. haftadaki Amerikan Romatoloji Derneği (ACR) 20 yanıtı değerlendirilmiştir değerlendirilmiştir ve bunu 24. haftadan 156. haftaya (3 yıl) kadar bir uzatma dönemi takip etmiştir.
Psöriyatik Artrit Çalışması 1'de (SPIRIT-P1), aktif psöriyatik artrit bulunan ve biyolojik tedavi almamış hastalar; plasebo, 2 haftada bir 40 mg adalimumab (aktif kontrol referans kolu), 2 haftada bir (Q2W) 80 mg COPELLOR veya 4 haftada bir (Q4W) 80 mg COPELLOR almak üzere randomize edilmiştir. Her iki COPELLOR rejimine 160 mg'lik bir başlangıç dozu dahil edilmiştir. Bu çalışmada hastaların %85,3'ü önceden ≥1 cDMARD tedavisi almıştır. Eş
zamanlı MTX, hastaların %53'ünde haftalık ortalama 15,8 mg dozda kullanılmıştır. Eş zamanlı
MTX kullanan hastaların %67'sinde dozun 15 mg ya da daha fazla olduğu görülmüştür. 16. haftada yetersiz yanıt alınan hastalar kurtarma tedavisi almıştır (arka plan tedavisinde modifikasyon). COPELLOR Q2W veya Q4W alan hastalar orijinal olarak atandıkları COPELLOR dozuna devam etmişlerdir. Adalimumab veya plasebo alan hastalar, yanıt verme durumlarına göre 16. ya da 24. haftada COPELLOR Q2W veya Q4W almak üzere 1:1 oranında yeniden randomize edilmiştir. Copellor'da 243 hasta 3 yıllık uzatma dönemini tamamlamıştır.
Psöriyatik Artrit Çalışması 2'ye (SPIRIT-P2) önceden bir anti-TNF ajanıyla tedavi alan ve etkisizlik ya da intolerans sebebiyle anti-TNF ajanı kullanımına devam etmeyen hastalar (anti- TNF-IR hastalar) alınmıştır. Hastalar plasebo, 2 haftada bir (Q2W) 80 mg COPELLOR veya 4 haftada bir (Q4W) 80 mg COPELLOR almak üzere randomize edilmiştir. Her iki COPELLOR rejimine 160 mg'lik bir başlangıç dozu dahil edilmiştir. Hastaların sırasıyla %56 ve %35'i 1 anti-TNF'ye veya 2 anti-TNF'ye yetersiz yanıt almıştır. SPIRIT-P2 çalışmasında 363 hasta değerlendirilmiş; hastaların %41'inde haftalık ortalama doz 16,1 mg olmak üzere eş zamanlı MTX kullanımı kaydedilmiştir. Eş zamanlı MTX, hastaların %73,2'sinde 15 mg ya da daha fazla dozda kullanılmıştır. 16. haftada yetersiz yanıt alınan hastalar kurtarma tedavisi almıştır (arka plan tedavisinde modifikasyon). COPELLOR Q2W ya da Q4W alan hastalar orijinal olarak atandıkları COPELLOR dozuna devam etmişlerdir. Plasebo alan hastalar, yanıt verme durumlarına göre 16. ya da 24. haftada COPELLOR Q2W veya Q4W almak üzere 1:1 oranında yeniden randomize edilmiştir. Copellor'da 168 hasta 3 yıllık uzatma dönemini tamamlamıştır.
Bulgu ve semptomlar
COPELLOR tedavisi 24. haftada hastalık aktivitesi ölçütlerinde plaseboya kıyasla anlamlı iyileşmeyle sonuçlanmıştır (bkz. Tablo 9).
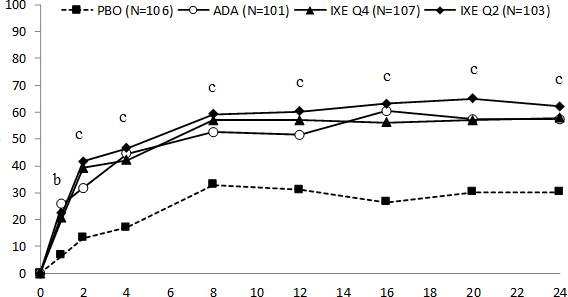
Tablo 9. 24. Haftada SPIRIT-P1 ve SPIRIT-P2 Etkililik Bulguları
| SPIRIT-P1 | SPIRIT-P2 | |||||||||
Sonlanım noktaları |
|
|
|
| Yanıt Oranında Plaseboya Kıyasla Fark (%95 GA) |
|
|
| Yanıt Oranında Plaseboya Kıyasla Fark (%95 GA) | ||
| PBO (n = 106) | COPELL OR Q4W (N = 107) | COPELL OR Q2W (N = 103) | ADA (N = 101) | COPEL LOR Q4W | COPEL LOR Q2W | PBO (N = 118) | COPELL OR Q4W (N = 122) | COPELL OR Q2W (N = 123) | COPEL LOR Q4W | COPEL LOR Q2W |
ACR 20 yanıtı, n (%) | |||||||||||
24. Hafta |
32 (30,2) |
62 (57,9) |
64 (62,1) |
58 (57,4) | 27,8 (15 ; 40,6) | 31,9 (19,1 ; 44,8) |
23 (19,5) |
65 (53,3) |
59 (48) | 33,8 (22,4 ; 45,2) | 28,5 (17,1 ; 39,8) |
ACR 50 yanıtı, n (%) | |||||||||||
24. Hafta |
16 (15,1) |
43 (40,2) |
48 (46,6) |
39 (38,6) | 25,1 (13,6 ; 36,6) | 31,5 (19,7 ; 43,3) |
6 (5,1) |
43 (35,2) |
41 (33,3) | 30,2 (20,8 ; 39,5) | 28,3 (19 ; 37,5) |
ACR 70 yanıtı, n (%) | |||||||||||
24. Hafta |
6 (5,7) |
25 (23,4) |
35 (34) |
26 (25,7) | 17,7 (8,6 ; 26,8) | 28,3 (18,2 ; 38,5) |
0 |
27 (22,1) |
15 (12,2) | 22,1 (14,8 ; 29,5) | 12,2 (6,4 ; 18) |
Minimal Hastalık Aktivitesi (MHA) n (%) | |||||||||||
24. Hafta |
16 (15,1) |
32 (29,9) |
42 (40,8) |
32 (31,7) | 14,8 (3,8 ; 25,8) | 25,7 (14 ; 37,4) |
4 (3,4) |
34 (27,9) |
29 (23,6) | 24,5 (15,9 ; 33,1) | 20,2 (12 ; 28,4) |
Başlangıçta psöriyazis deri tutulumu VYA ≥%3 olan hastalarda ACR 50 ve PASI 100, n (%) | |||||||||||
24. Hafta |
1 (1,5) |
21 (28,8) |
19 (32,2) |
9 (13,2) | 27,3 (16,5 ; 38,1) | 30,7 (18,4 ; 43) |
0 (0) |
12 (17,6) |
10 (14,7) | 17,6 (8,6 ; 26,7) | 14,7 (6,3 ; 23,1) |
Kısaltmalar: ACR 20/50/70=AmerikanRomatoloji Derneği%20/%50/%70 yanıt oranı; ADA
= adalimumab; VYA = vücut yüzey alanı; GA = güven aralığı; Q4W = 4 haftada bir COPELLOR 80 mg; Q2W = 2 haftada bir COPELLOR 80 mg; N = analiz popülasyonundaki hasta sayısı; n = belirlenen kategorideki hasta sayısı; NRI = yanıt vermeyen impütasyonu; PASI 100 = psöriyazis alan şiddet indeksinde %100 iyileşme; PBO = plasebo.
Not: 16. haftada kurtarma tedavisi uygulanan, tedaviyi bırakan ya da verileri eksik olan hastalar için 24. hafta analizlerinde yanıt vermeyenler olarak impütasyon yapılmıştır.
Eş zamanlı cDMARD'lar arasında MTX, leflunomid ve sülfasalazin yer almıştır.
Önceden var olan daktilit veya entezit bulunan hastalarda, COPELLOR Q4W tedavisi plaseboya kıyasla 24. haftada daktilit ve entezitte iyileşmeyle sonuçlanmıştır (düzelme: sırasıyla %78'e %24; p<0,001 ve %39'a %21; p<0,01).
VYA ≥%3 olan hastalarda 12. hafta PASI 75 ölçümüne göre, derinin temizlenmesindeki iyileşmenin Q4W rejimi ile tedavi edilenler için %67 (94/141), plasebo ile tedavi edilenler için
%9 (12/134) olmuştur (p<0,001). 24. haftada PASI 75, PASI 90 ve PASI 100 yanıtı elde eden hastaların oranı, COPELLOR Q4W ile plaseboya kıyasla daha yüksek olmuştur (p<0,001). Eş zamanlı orta ila şiddetli psöriyazis ve psöriyatik artrit bulunan hastalarda COPELLOR Q2W, plaseboya kıyasla PASI 75, PASI 90 ve PASI 100 için anlamlı derecede daha yüksek yanıt oranı sergilemiş (p<0,001) ve Q4W rejimine kıyasla klinik açıdan anlamlı yarar sağlamıştır.
COPELLOR tedavisi sırasındaki tedavi yanıtları plaseboya kıyasla, ACR 20 için 1. hafta gibi erken bir zamanda, ACR 50 için 4. haftada ve ACR 70 için 8. haftada anlamlı derecede yüksek olmuş ve 24 hafta süresince korunmuştur; çalışmada kalan hastalar için etkiler 3 yıl boyunca devam etmiştir.
Şekil 3. SPIRIT-P1 Çalışmasında 24. Haftaya Kadar Zaman İçindeki ACR 20 Yanıtları
% ACR20 Yanıt verenler |
|
| Tedavi haftası |
COPELLOR Q2W ve Q4W için: plaseboya kıyasla p<0,01 ve c p<0,001.
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında psöriyatik artrit hastalarında MTX tedavisi dahil eş zamanlı cDMARD kullanımı olup olmamasından bağımsız şekilde ACR 20/50/70 yanıtları benzerdir.
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında hastanın ağrı değerlendirmesi dahil ACR yanıtlarının tüm bileşenlerinde iyileşmeler gösterilmiştir. 24. haftada modifiye Psöriyatik Artrit Yanıt Kriterleri (PsARC) yanıtı elde eden hastaların oranı, COPELLOR tedavisi alan hastalarda plasebo alanlara kıyasla daha yüksek olmuştur.
SPIRIT-P1 çalışmasında ACR 20/50/70, MDA, entezitin giderilmesi, daktillitin giderilmesi ve PASI 75/90/100 yanıt oranlarıyla değerlendirilen etkililik 52. haftaya kadar korunmuştur.
COPELLOR'un etkililik ve güvenliliği yaş, cinsiyet, ırk, hastalık süresi, başlangıçtaki vücut ağırlığı, başlangıçtaki psöriyazis tutulumu, başlangıçtaki CRP, başlangıçtaki DAS28-CRP; eş zamanlı kortikosteroid kullanımı ve önceden uygulanan biyolojik tedaviden bağımsız olarak ortaya konmuştur. COPELLOR; biyolojik kullanmamış, biyolojik maruziyeti bulunan ve biyolojik tedavinin başarısız olduğu hastalarda etkili bulunmuştur.
SPIRIT-P1'de 63 hasta 3 yıllık Q4W ixekizumab tedavisini tamamlamıştır. İxekizumab Q4W'ye (ITT popülasyonunda NRI analizi) randomize edilen 107 hastanın 54'ünde (%50), 41'inde (%38), 29'unda (%27) ve 36'sında (%34) 156. haftada sırasıyla ACR20, ACR50, ACR70 ve MDA yanıtı gözlenmiştir.
SPIRIT-P2'de 70 hasta 3 yıllık Q4W ixekizumab tedavisini tamamlamıştır. İxekizumab Q4W'ye (ITT popülasyonunda NRI analizi) randomize edilen 122 hastanın 56'sında (%46), 39'unda (%32), 24'ünde (%20) ve 33'ünde (%27) 156. haftada sırasıyla ACR20, ACR50, ACR70 ve MDA yanıtı gözlenmiştir.
Radyografik yanıt
SPIRIT-P1 çalışmasında, yapısal hasar progresyonunun inhibisyonu radyografik olarak değerlendirilmiş ve modifiye toplam Sharp Skorunda (mTSS) ve skorun bileşenleri, Erozyon Skoru (ES) ve Eklem Boşluğu Daralması (JSN) skoru bakımından 24. ve 52. haftada başlangıca göre görülen değişiklik olarak ifade edilmiştir. 24. hafta verileri Tablo 10'da sunulmuştur.
Tablo 10. SPIRIT-P1'de modifiye Toplam Sharp Skorundaki Değişiklik
|
| Plaseboya kıyasla fark (%95 GA) | ||||
PBO (n = 106) | COPELLOR Q4W (N = 107) | COPELLOR Q2W (N = 103) | ADA (N = 101) | COPELLOR Q4W | COPELLOR Q2W | |
Başlangıç skoru, ortalama (SS) |
17,6 (28,62) |
19,2 (32,68) |
15,2 (28,86) |
15,9 (27,37) |
NA |
NA |
24. Haftada başlangıca göre değişiklik, LSM (SH) |
0,51 (0,092) |
0,18 (0,090) |
0,09 (0,091) |
0,13 (0,093) |
-0,33 (-0,57,-0,09) |
-0,42 (-0,66,-0,19) |
Kısaltmalar: ADA = adalimumab; GA = güven aralığı; Q4W = 4 haftada bir COPELLOR 80 mg; Q2W = 2 haftada bir COPELLOR 80 mg; LSM = en küçük kareler ortalaması; N = analiz popülasyonundaki hasta sayısı; PBO = plasebo; SH = standart hata; SS = standart sapma.
b plaseboya kıyasla p<0,01; c p<0,001.
COPELLOR, radyografik eklem hasarı progresyonunu 24.haftada inhibe etmiş (Tablo 10) ve
randomizasyondan 24.haftaya kadar radyografik eklem hasarı progresyonu (başlangıca göre
≤0,5 mTSS değişikliği olarak tanımlanmıştır) bulunmayan hastaların oranı, COPELLOR Q2W için %94,8 (p<0,001), COPELLOR Q4W için %89 (p=0.026), adalimumab için %95,8 (p<0,001) olurken, bunlara kıyasla plasebo için %77,4'tür. Elli ikinci haftada mTSS'de başlangıca göre ortalama değişiklik plasebo/COPELLOR için 0,27, COPELLOR Q2W/COPELLOR Q4W için 0,54, adalimumab/COPELLOR Q4W için 0,32 olmuştur. Randomizasyondan 52. haftaya kadar radyografik eklem hasarı progresyonu olmayan hastaların oranı, plasebo/COPELLOR Q4W için %90,9, COPELLOR Q2W/COPELLOR Q4W için %85,6, adalimumab/COPELLOR Q4W için %89,4'tür. Hastalarda başlangıca göre (mTSS≤0,5 olarak tanımlanan) aşağıdaki tedavi kollarında yapısal ilerleme olmamıştır: Plasebo/Copellor Q4W %81,5 (N=22/27), Copellor Q4W/Copellor Q4W %73,6 (N=53/72), ve adalimumab/Copellor Q4W %88,2 (N=30/34).
Fiziksel fonksiyon ve sağlıkla ilgili yaşam kalitesi
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında COPELLOR Q2W (p<0,001) ve Q4W (p<0,001)
tedavisi alan ve Sağlık Değerlendirme Anketi-Engellilik İndeksi (HAQ-DI) ile fiziksel fonksiyon bakımından değerlendirilen hastalar 24. haftada, plasebo tedavisi alanlara kıyasla anlamlı iyileşme göstermiş ve bu iyileşmeler SPIRIT-P1 çalışmasında 52. haftaya kadar korunmuştur.
COPELLOR tedavisi alan hastalarda Kısa Form-36 Sağlık Anketi'nin (SF-36 PCS) Fiziksel Bileşenler Özeti skoruyla ölçülen sağlıkla ilgili yaşam kalitesinde iyileşmeler bildirilmiştir (p<0,001). Ayrıca Yorgunluk şiddeti NRS skorlarıyla değerlendirilen yorgunluk bakımından da iyileşmeler olduğu görülmüştür (p<0,001).
Pazarlama sonrası Faz 4, doğrudan karşılaştırmalı çalışma
COPELLOR'un etkililik ve güvenliliği daha önce biyolojik hastalık modifiye edici antiromatizmal ilaç (bDMARD) almamış PsA'lı 566 hastada adalimumaba (ADA) kıyasla yürütülen çok merkezli, randomize, açık etiketli, kör değerlendiricili, paralel grup çalışmasında (SPIRIT-H2H) araştırılmıştır. Hastalar başlangıçta eşzamanlı cDMARD kullanımı ve orta dereceli ile şiddetli psöriyazis varlığına (PASI≥12, BSA≥10 ve sPGA≥3) göre gruplandırılmıştır.
COPELLOR, çalışmanın primer sonlanım noktasında ADA'ya üstünlük göstermiştir: 24. haftada aynı anda ACR 50 ve PASI 100 yanıtının elde edilmesi (COPELLOR %36 ve ADA
%27,9; p=0,036; %95 güven aralığı [%0,5, %15,8]). COPELLOR aynı zamanda ADA'ya kıyasla 24. haftada çalışmadaki temel sekonder sonlanım noktaları olan ACR 50'de benzer etkililik (önceden belirlenmiş sınır -%12) (ITT analiz: COPELLOR %50,5 ve ADA %46,6; ADA'ya göre %3,9 fark; %95 güven aralığı [-%4,3; %12,1]; PPS analiz COPELLOR: %52,3,
ADA: %53,1, fark: -%0,8 [GA: -%10,3; %8,7]) ve PASI 100'de üstünlük (COPELLOR: %60,1
ve ADA: %46,6, p=0,001) göstermiştir. Elli ikinci haftada, ADA'ya kıyasla Copellor ile tedavi edilen hastaların daha yüksek bir oranı aynı anda ACR50 ve PASI 100'e [%39 (111/283) kıyasla %26 (74/283)] ve PASI 100'e [%64 (182/283) kıyasla %41 (117/283)] ulaşmıştır. Copellor ve ADA tedavisi, ACR50 için benzer yanıtlarla sonuçlanmıştır [%49,8 (141/283) kıyasla %49,8 (141/283)]. Copellor'a verilen yanıtlar, monoterapi olarak veya metotreksat ile birlikte kullanıldığında tutarlı olmuştur.
Şekil 4: 0-24. Hafta Primer Sonlanım Noktası (Aynı anda ACR 50 ve PASI 100) ve Başlıca Sekonder Sonlanım Noktaları (ACR 50; PASI 100) Yanıt Oranları [ITT popülasyon, NRI]**
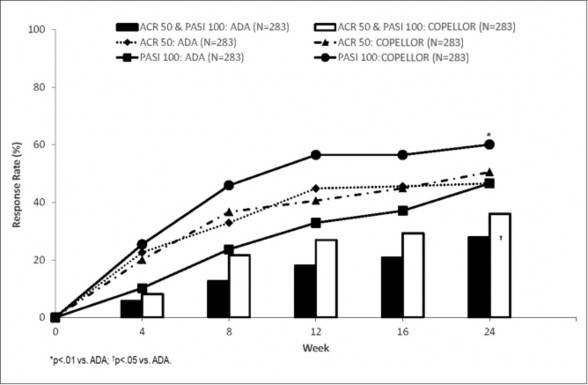
** COPELLOR: Orta ila şiddetli plak psöriyazisli hastalarda 0. haftada 160 mg ve sonrasında
12. haftaya kadar 2 haftada bir, daha sonra 4 haftada bir 80 mg ya da diğer hastalarda 0. haftada 160 mg, sonra 4 haftada bir 80 mg; ADA: orta ila şiddetli plak psöriyazisli hastalarda
0. haftada 80 mg, sonra 1. haftadan itibaren 2 haftada bir 40 mg ya da diğer hastalarda 0.
haftada 40 mg, sonra 2 haftada bir 40 mg.
Yalnızca önceden tanımlanmış ve çoklu aralığa göre test edilmiş sonlanım noktası için anlamlılık düzeyi verilmiştir.
Aksiyel spondiloartrit
COPELLOR aksiyel spondiloartritli toplam 960 yetişkin hastanın yer aldığı randomize, plasebo kontrollü üç çalışmada (ikisi radyografik ve biri non-radyografik aksiyel spondiloartrit) değerlendirilmiştir.
Radyografik aksiyel spondiloartrit
COPELLOR aksiyel spondiloartritli toplam 657 yetişkin hastanın yer aldığı randomize, çift kör, plasebo kontrollü iki çalışmada (COAST-V ve COAST-W) değerlendirilmiştir. Hastalar, NSAİİ tedavisine rağmen, Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index - BASDAI) ≥4 ve sayısal derecelendirme ölçeğinde toplam bel ağrısı ≥4 ile tanımlanmış aktif hastalığa sahiptir. Başlangıçta her iki çalışmada da, hastalar ortalama 17 yıl boyunca (medyan 16 yıl) semptomlara sahiptir. Başlangıçta, hastaların yaklaşık %32'si eşzamanlı cDMARD kullanmaktadır. COAST-V'de 0. haftada COPELLOR 80 mg veya 160 mg ardından 2 haftada bir (Q2W) veya 4 haftada bir (Q4W) 80 mg, 2 haftada bir adalimumab 40 mg veya plasebo ile tedavi edilen 341 biyolojik
ürün kullanmamış hasta değerlendirilmiştir. Plasebo alan hastalar 16. haftada COPELLOR
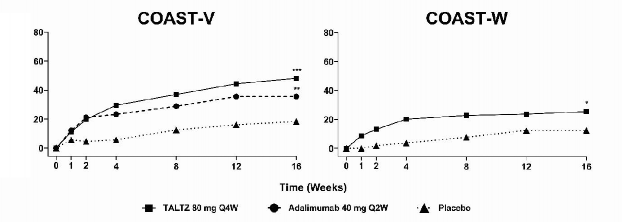
(160 mg başlangıç dozu ardından 80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. Adalimumab alan hastalar 16. haftada COPELLOR (80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. COAST-W'da 1 veya 2 TNF inhibitörü ile daha önce deneyimi olan 316 hasta değerlendirilmiştir (%90'ı yetersiz yanıt verenlerdir ve %10'u TNF inhibitörlerine intolerans gösterenlerdir). Tüm hastalar 0. haftada COPELLOR 80 mg veya 160 mg ve ardından 80 mg Q2W veya Q4W ile veya plasebo ile tedavi edilmiştir. Plasebo alan hastalar 16. haftada COPELLOR (160 mg başlangıç dozu ardından 80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. Her iki çalışmada da birincil sonlanım noktası, 16. haftada Spondiloartrit Değerlendirme Uluslararası Çalışma Grubu 40 (Assessment of Spondyloarthritis International Society 40 - ASAS40) yanıtı elde eden hastaların yüzdesidir.
Klinik yanıt
Her iki çalışmada da COPELLOR 80 mg Q2W veya 80 mg Q4W ile tedavi edilen hastalar, 16. haftada plaseboya kıyasla ASAS40 ve ASAS20 yanıtlarında daha fazla iyileşme göstermiştir (Tablo 11). Eşzamanlı tedavilerden bağımsız olarak hastalarda yanıtlar benzerdir. COAST- W'da, önceki TNF inhibitörlerinin sayısına bakılmaksızın yanıtlar görülmüştür.
Tablo 11. 16. Haftada COAST-V ve COAST-W'da Etkililik Sonuçları
| COAST-V, biyolojik ürün kullanmamış | COAST-W, TNF-inhibitorü kullanmış | |||||
COPELLOR 80 mg Q4W (N=81) |
Plasebo (N=87) | Plasebodan farkı g | Adalimumab 40 mg Q2W (N=90) | COPELLOR 80 mg Q4W (N=114) |
Plasebo (N=104) |
Plasebodan fark g | |
ASAS20 | 52 (%64,2) | 35 | 24 (9,3 ; | 53 (%58,9) | 55 (%48,2) | 31 | 18,4 (5,7 ; |
yanıt, n (%), |
| (%40,2) | 38,6) |
|
| (%29,8) | 31,1) |
NRI |
|
|
|
|
|
|
|
ASAS40 | 39 (%48,1) | 16 | 29,8 (16,2 ; | 32 (%35,6) | 29 (%25,4) | 13 | 12,9 (2,7 ; |
yanıt, n (%), |
| (%18,4) | 43,3) |
|
| (%12,5) | 23,2) |
NRI |
|
|
|
|
|
|
|
ASDAS | |||||||
Başlangıca | -1,4 | -0,5 | -1 (-1,3 ; - | -1,3*** | -1,2 | -0,1 | -1,1 (-1,3 ; - |
göre değişiklik | 3,7 | 3,9 | 0,7) *** | 3,7 | 4,2 | 4,1 | 0,8) *** |
Başlangıç |
|
|
|
|
|
|
|
BASDAI Skoru | |||||||
Başlangıca | -2,9 | -1,4 | -1,5 (-2,1 ; - | -2,5*** | -2,2 | -0,9 | -1,2 (-1,8 ; - |
göre değişiklik | 6,8 | 6,8 | 0,9) *** | 6,7 | 7,5 | 7,3 | 0,7) *** |
Başlangıç |
|
|
|
|
|
|
|
MRI Spine SPARCC | |||||||
Başlangıca | -11 | -1,5 | -9,5 (-12,6 ; | -11,6*** | -3 | 3,3 | -6,3 (-10 ; - |
göre değişiklik | 14,5 | 15,8 | -6,4) *** | 20 | 8,3 | 6,4 | 2,5) ** |
Başlangıç |
|
|
|
|
|
|
|
BASDAI50 n | 34 (%42) | 15 | 24,7 (11,4 ; | 29 (%32,2)* | 25 (%21,9)i | 10 | 12,3 (2,8 ; |
(%), NRI |
| (%17,2) | 38,1) *** |
|
| (%9,6)i | 21,8)* |
ASDAS <2,1, | 35 (%43,2) | 11 | 30,6 (17,7 ; | 34 (%37,8)*** | 20 (%17,5) | 5 (%4,8) | 12,7 ( 4,6 ; |
n (%) (Düşük |
| (%12,6) | 43,4) *** |
|
| 20,8) ** | |
hastalık |
|
|
|
|
|
|
|
aktivitesi), |
|
|
|
|
|
|
|
NRI |
|
|
|
|
|
|
|
ASDAS <1,3, n (%) (İnaktif hastalık), NRI | 13 (%16) | 2 (%2,3) | 13,8 (5,2 ; 22,3) ** | 14 (%15,6)** | 4 (%3,5)i | 1 (%1)i | 2,5 (-1,3 ; 6,4) |
ASAS HI |
|
|
|
|
|
|
|
Başlangıca | -2,4 | -1,3 | -1,1 (-2 ; - | -2,3* | -1,9 | -0,9 | -1 (-1,9 ; - |
göre değişiklik | 7,5 | 8,1 | 0,3) * | 8,2 | 10 | 9 | 0,1) * |
Başlangıç |
|
|
|
|
|
|
|
SF-36 PCS |
|
|
|
|
|
|
|
Başlangıca | 7,7 | 3,6 | 4,1 (1,9 ; | 6,9** | 6,6 | 1,4 | 5,2 (3 ; 7,4) |
göre değişiklik | 34 | 32 | 6,2) *** | 33,5 | 27,5 | 30,6 | *** |
Başlangıç |
|
|
|
|
|
|
|
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı; NRI = yanıt vermeyen impütasyonu; Eksik veriye sahip olan hastalar yanıt vermeyen olarak sayılmıştır. ASAS HI = Spondiloartrit Değerlendirme Uluslararası Çalışma Grubu Sağlık İndeksi (Assessment of SpondyloArthritis International Society Health Index); ASDAS = Ankilozan Spondilit Hastalık Aktivite Skoru (Ankylosing Spondylitis Disease Activity Score); BASDAI = Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index); CFB = 16. haftada başlangıca göre en küçük kareler ortalaması değişimi; MRI Spine SPARCC = Kanada MRI Omurga Spondiloartrit Skorlama Konsorsiyumu (Spondyloarthritis Research Consortium of Canada Magnetic Resonance Imaging Scoring of the Spine) (23 discovertebral birim ölçeği)
ASAS40 yanıtı, ≥%40 iyileşme ve geri kalan alanlarda herhangi bir kötüleşme olmaksızın 4 alanın
≥3'ünde başlangıca göre ≥2 birimlik mutlak iyileşme olarak tanımlanır.
* p<0,05; ** p <0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
16. haftada ASAS40 yanıt kriterlerinin ana bileşenlerinde (spinal ağrı, BASFI, hasta global değerlendirmesi, sertlik) ve CRP dahil olmak üzere diğer hastalık aktivitesi ölçümlerinde düzelmeler olmuştur.
Zaman (Hafta)
Yanıt verenlerin yüzdesi
Şekil 5. COAST-V ve COAST-W'da 16. Haftaya Kadar ASAS40 Yanıtına Ulaşan Hastaların Yüzdeleri, NRI
* p<0,05; ** p<0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
Hastalarda, başlangıçtaki CRP seviyeleri, başlangıç ASDAS skorları ve MRI Spine SPARCC skorlarından bağımsız olarak benzer ASAS40 yanıtı görülmüştür. ASAS40 yanıtı yaş, cinsiyet, ırk, hastalık süresi, başlangıç vücut ağırlığı, başlangıç BASDAI skoru ve önceki biyolojik tedavilerden bağımsız olarak gösterilmiştir.
COAST-V ve COAST-W'da etkililik, ASAS20, ASAS40, ASDAS, BASDAI ve ASAS HI
yanıt oranları dahil olmak üzere Tablo 11'de sunulan sonlanım noktaları ile değerlendirildiği üzere 52. haftaya kadar korunmuştur.
Sağlıkla ilişkili sonuçlar
Spinal ağrı, 1. hafta kadar erken bir sürede plaseboya göre iyileşme göstermiştir ve 16. haftaya kadar sürmüştür (COPELLOR vs plasebo: COAST-V -3,2 vs -1,7; COAST-W -2,4 vs -1,0); yorgunluk ve omurga mobilitesi plaseboya göre 16. haftada iyileşme göstermiştir. Spinal ağrı,
yorgunluk ve omurga mobilitesindeki iyileşmeler 52 hafta boyunca sürdürülmüştür.
Non-radyografik aksiyel spondiloartrit
COPELLOR en az 3 ay boyunca aktif aksiyel spondiloartritli 303 yetişkin hastanın yer aldığı randomize, 52 haftalık periyotta plasebo kontrollü çift kör bir çalışmada (COAST-X) değerlendirilmiştir. Hastalar, yüksek CRP ve/veya MRI'de sakroiliit ile gösterilen objektif inflamasyon belirtilerine sahip olmalı ve sakroiliak eklemlerde yapısal hasara ilişkin kesin radyografik kanıt olmamalıdır. Hastalar, NSAİİ tedavisine rağmen BASDAI ≥4 ve 0 ila 10 arasında NRS ≥4 olan spinal ağrı ile tanımlanan aktif hastalığa sahiptir. Hastalar, 0. haftada COPELLOR 80 mg veya 160 mg, ardından 2 haftada bir (Q2W) 80 mg veya 4 haftada bir (Q4W) 80 mg, veya plasebo ile tedavi edilmiştir. Doz ayarlaması ve/veya eşzamanlı ilaçların (NSAİİ'ler, cDMARD'lar, kortikosteroidler, analjezikler) başlatılmasına 16. haftadan itibaren izin verilmiştir.
Başlangıçta, hastalar ortalama 11 yıldır non-radyografik aksiyel spondiloartrit semptomlarına sahiptir. Hastaların yaklaşık %39'u eşzamanlı bir cDMARD kullanmaktaydı.
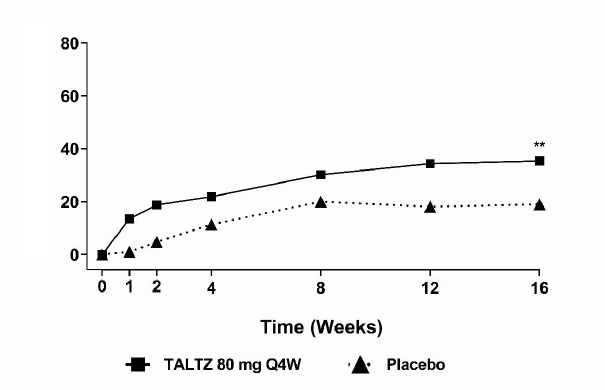
Birincil sonlanım noktası, 16. haftada ASAS40 yanıtı elde eden hastaların yüzdesidir.
Klinik yanıt
16. haftada plaseboya kıyasla COPELLOR 80 mg Q4W ile tedavi edilen hastalarda daha yüksek oranda, ASAS40 yanıtı elde edilmiştir. (Tablo 12). Yanıtlar, eşlik eden tedavilerden bağımsız olarak benzerdir.
Tablo 12. COAST-X'de 16. Haftada Etkililik Sonuçları, NRI
| COPELLOR 80 mg Q4W (N=96) | Plasebo (N=105) |
Plasebodan fark |
ASAS20 yanıt, n (%), NRI | 52 (%54,2) | 41 (%39) | 15,1 (1,5 ; 28,8)* |
ASAS40 yanıt, n (%), NRI | 34 (%35,4) | 20 (%19) | 16,4 (4,2 ; 28,5)** |
ASDAS | |||
Başlangıca göre değişiklik Başlangıç | -1,1 3,8 | -0,6 3,8 | -0,5 (-0,8 ; -0,3) *** |
BASDAI Skoru | |||
Başlangıca göre değişiklik Başlangıç | -2,2 7 | -1,5 7,2 | -0,7 (-1,3 ; -0,1) * |
MRI SIJ SPARCC | |||
Başlangıca göre değişiklik Başlangıç | -3,4 5,1 | -0,3 6,3 | -3,1 (-4,6 ; -1,6) *** |
ASDAS <2,1, n (%) (Düşük hastalık aktivitesi), NRI | 26 (%27,7) | 13 (%12,4) | 15,3 (4,3 ; 26,3) ** |
SF-36 PCS | |||
Başlangıca göre değişiklik Başlangıç | 8,1 33,5 | 5,2 32,6 | 2,9 (0,6 ; 5,1) * |
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı; NRI = yanıt vermeyen impütasyonu. ASDAS = Ankilozan Spondilit Hastalık Aktivite Skoru (Ankylosing Spondylitis Disease Activity Score); BASDAI = Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index); Başlangıca göre değişiklik = 16. haftada başlangıca göre en küçük kareler ortalaması değişimi; MRI SIJ SPARCC = Sakroiliak eklemin Kanada MRI Omurga Spondiloartrit Skorlama Konsorsiyumu (Spondyloarthritis Research Consortium of CanadaMagneticResonanceImaging Scoring).
* p<0,05; ** p <0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
16. haftada ASAS40 yanıt kriterlerinin ana bileşenlerinde (spinal ağrı, BASFI, hasta genel değerlendirmesi, sertlik) ve diğer hastalık aktivitesi ölçümlerinde önemli klinik düzelmeler olmuştur.
Şekil 6. COAST-X'de 16. Haftaya Kadar ASAS40 Yanıtına Ulaşan Hastaların Yüzdeleri,
COPELLOR 80 mg Q4W
Zaman (Hafta)
Plasebo
Yanıt verenlerin yüzdesi
NRI
** Plasebo ile karşılaştırıldığında p<0,01
Etkililik Tablo 12'de sunulan sonlanım noktaları ile değerlendirildiği üzere 52. haftaya kadar
sürdürülmüştür.
Sağlıkla ilişkili sonuçlar
Spinal ağrı, 1. hafta kadar erken bir sürede plaseboya kıyasla iyileşme göstermiştir ve bu iyileşme 16. haftaya kadar sürmüştür (COPELLOR vs plasebo: COAST-X: -2,4 vs -1,5). Ek olarak, plaseboya kıyasla COPELLOR kullanan daha fazla hasta, 16. ve 52. haftalarda ASAS Sağlık İndeksi'ne göre iyi sağlık durumuna (ASAS HI ≤5) ulaşmıştır.
Uzun vadeli sonuçlar aksiyal spondiloartrit
Üç önemli COAST-V/W/X çalışmasından (52 hafta) birini tamamlayan hastalara, uzun vadeli bir uzatma ve randomize geri çekme çalışmasına katılması teklif edilmiştir (COAST-Y, Copellor Q4W ve Q2W'ye kayıtlı sırasıyla 350 ve 423 hasta ile). Remisyon 157/773 (%20,3) elde edenler arasında (16. ve 20. haftalarda Ankilozan Spondilit Hastalığı Aktivite Skoru [ASDAS] en az bir kez <1,3 ve ≥2,1 ASDAS skoru mevcut değildir), 76 haftaya kadar Copellor'a maruz kalan 155 hasta COAST-Y çalışmasının 24. haftasında randomize edilmiştir (Plasebo, N=53; Copellor Q4W, N=48; ve Copellor Q2W, N=54); bunlardan 148'i (%95,5) 64. hafta ziyaretini tamamlamıştır (Plasebo, N=50; Copellor Q4W, N=47; Copellor Q2W, N=51). Primer sonlanım noktası, randomize yoksunluk popülasyonunda 24-64. haftalarda alevlenme yaşamayan hastaların oranıdır (plaseboya karşı kombine Copellor Q2W ve Copellor Q4W grupları). Kombine Copellor gruplarında (%83,3 (85/102), p<0,001) ve Copellor Q4W'de (%83,3 (40/48), p=0,003) hastaların anlamlı ölçüde daha yüksek bir oranında (NRI), Copellor'dan plaseboya geçenlerle (%54,7 (29/53)) karşılaştırıldığında 24-64. haftalarda alevlenme olmamıştır. Copellor (hem kombine Copellor gruplarında hem de Copellor Q4W grubunda), plasebo ile karşılaştırıldığında alevlenme süresini önemli ölçüde geciktirmiştir (sırasıyla Log-Rank Testi p<0,001 ve p<0,01).
Sürekli olarak Copellor Q4W alan hastalarda (N=157), ASAS40, ASDAS <2,1 ve BASDAI50 yanıtları 116. haftaya kadar korunmuştur.
İmmünizasyon
Sağlıklı gönüllülerde yapılan bir çalışmada, iki doz ixekizumab sonrasında alınan (160 mg'ı takiben ikinci doz olarak 2 hafta sonra 80 mg) iki inaktif aşıda (tetanoz ve pnömokok) herhangi bir güvenlilik endişesi belirlenmemiştir. Ancak, COPELLOR uygulandıktan sonra bu aşılara karşı yeterli immün yanıt hakkında karar vermek için immünizasyon ile ilgili veriler yeterli değildir.
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Psöriyazis hastalarında tek subkütan ixekizumab dozunun ardından ortalama en yüksek konsantrasyonlara 5 ila 160 mg doz aralığında 4 ila 7. günlerde ulaşılmıştır. 160 mg başlangıç dozundan sonra ixekizumabın ortalama (SS) maksimum plazma konsantrasyonu (C) 19,9 (8,15) mcg/ml olarak bulunmuştur.
160 mg başlama dozundan sonra 80 mg Q2W doz rejimiyle kararlı durum (kd) 8. haftada elde edilmiştir. Ortalama (SS) Cve C tahminleri, 21,5 (9,16) mcg/ml ve 5,23 (3,19) µg/ml'dir.
On ikinci haftada 80 mg Q2W doz rejiminden 80 mg Q4W doz rejimine geçildikten sonra kararlı duruma yaklaşık 10 haftadan sonra ulaşılacaktır. Ortalama (SS) Cve Ctahminleri 14,6 (6,04) mcg/ml ve 1,87 (1,30) µg/ml'dir.
Subkütan uygulama sonrası ixekizumabın ortalama biyoyararlanım analizlerde %54 ile %90 arasında hesaplanmıştır.
Dağılım:
Popülasyon farmakokinetiği analizlerine göre, kararlı durumdaki ortalama total dağılım hacmi 7,11 L'dir.
Biyotransformasyon:
Ixekizumab bir monoklonal antikordur ve aynı endojen immünoglobulinler gibi katabolik yolaklarla küçük peptitlere ve aminoasitlere degrade olması beklenir.
Eliminasyon:
Popülasyon farmakokinetik analizinde, ortalama serum klirensi 0,0161 L/sa olmuştur. Klirens dozdan bağımsızdır. Popülasyon farmakokinetiği analizlerinden hesaplanan ortalama eliminasyon yarılanma ömrü, plak tipi psöriyazisi olanlarda 13 gündür.
Doğrusallık/doğrusal olmayan durum:
Subkütan enjeksiyonla uygulanan 5 ila 160 mg doz aralığında maruziyet (EAA) orantılı olarak artmıştır.
Endikasyonlardaki farmakokinetik özellikler
COPELLOR'un farmakokinetik özellikleri, plak psöriyazis, psöriyatik artrit, radyografik aksiyel spondiloartrit ve non-radyografik aksiyel spondilartrit endikasyonlarında benzerdir.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Klinik geliştirme çalışmalarında COPELLOR'a maruz kalmış 4204 plak tipi psöriyazis hastasından toplam 301'inin 65 yaş veya üstü ve 36'sının 75 yaş veya üzerinde olduğu kaydedilmiştir. Yaşlı hasta sayısının sınırlı olduğu (≥65 yaş için n = 94 ve ≥75 yaş için n = 12) popülasyon farmakokinetiği analizlerine dayanılarak, ileri yaştaki hastalar ile 65 yaşın altındakilerde klirens aynı bulunmuştur.
Sınırlı sayıda yaşlı hastanın yer aldığı bir popülasyon farmakokinetiği analizine göre (≥65 yaş
için n = 94, ≥75 yaş için n = 12), yaşlı hastalardaki ve 65 yaş altındakilerdeki klirens benzer bulunmuştur.
Böbrek yetmezliği:
Böbrek yetmezliğinin ixekizumabın farmakokinetiği üzerindeki etkilerini değerlendirmeye yönelik spesifik klinik farmakoloji çalışması yapılmamıştır. Bir IgG MAb olan bozulmamış ixekizumabın renal eliminasyonunun düşük ve önemsiz olması beklenir.
Karaciğer yetmezliği:
Karaciğer yetmezliğinin ixekizumabın farmakokinetiği üzerindeki etkilerini değerlendirmeye yönelik spesifik klinik farmakoloji çalışması yapılmamıştır. IgG MAb'ler başlıca intraselüler katabolizmayla elimine olur ve karaciğer yetmezliğinin ixekizumab klirensini etkilemesi beklenmez.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlanan doz çalışmaları, güvenlilik farmakoloji değerlendirmeleri ve üremeyle ilgili ve gelişimsel toksisite çalışmalarına göre sinomolgus maymunlarından elde edilen klinik dışı veriler insanlar için spesifik bir risk göstermemiştir.
Otuz dokuz hafta süresince subkütan dozlarda 50 mg/kg'a kadar ixekizumab uygulaması organ toksisitesi ya da immün fonksiyon üzerinde istenmeyen etki (örn. T hücresine bağlı antikor yanıtı ve NK hücre aktivitesi) oluşturmamıştır. Maymunlara uygulanan haftalık 50 mg/kg subkütan doz 160 mg olan COPELLOR başlangıç dozunun yaklaşık 19 katıdır ve maymunlarda, önerilen doz rejimiyle insanlar için öngörülen kararlı durum maruziyetinin yaklaşık 61 katı maruziyet (EAA) oluşturmuştur.
Ixekizumabın karsinojenik veya mutajenik potansiyeline yönelik klinik dışı çalışma yapılmamıştır.
On üç hafta boyunca haftada 50 mg/kg subkütan dozda ixekizumab verilen cinsel olgunluğa sahip sinomolgus maymunlarında üreme organları, menstrüel döngüler ya da sperm üzerinde herhangi bir etki görülmemiştir.
Gelişimsel toksisite çalışmalarında, ixekizumabın plasentayı geçtiği ve yavrunun kanında 6 aya kadar bulunduğu gösterilmiştir. Yüksek postnatal mortalite insidansı eş zamanlı kontrollere kıyasla ixekizumab verilen yavru maymunlarda görülmüştür. Bu öncelikle erken doğum veya yavruların anne tarafından ihmali, insan olmayan primat çalışmalarındaki yaygın bulgular ile ilişkilidir ve klinik olarak konu dışı olarak değerlendirilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum sitrat dihidrat Sitrik asit, anhidr Sodyum klorür Polisorbat 80 Enjeksiyonluk su
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında (2 ºC – 8 ºC'de) saklayınız. COPELLOR 30°C'yi aşmayan sıcaklıklarda buzdolabı dışında 5 güne kadar saklanabilir. Dondurmayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Tip I berrak cam enjektör içinde 1 ml çözelti. 1, 2 ya da 3 kullanıma hazır enjektör içeren ambalajlar. Tüm ambalaj boyutları pazarlanmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmelikâ€'lerine uygun olarak imha edilmedir.
Kullanma kılavuzu
Ambalaj içinde yer alan enjektörlerle ilgili kullanma kılavuzlarına dikkatlice uyulmalıdır. Kullanıma hazır enjektör yalnızca tek kullanımlıktır.
Partiküller görülmesi halinde ya da çözelti bulanıksa ve/veya kahverengi renk almışsa COPELLOR kullanılmamalıdır. Dondurulmuş COPELLOR kullanılmamalıdır.
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A17439 |
| Satış Fiyatı | 76379.52 TL [ 17 Mar 2025 ] |
| Önceki Satış Fiyatı | 76379.52 TL [ 7 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699673954677 |
| Etkin Madde | Iksekizumab |
| ATC Kodu | L04AC13 |
| Birim Miktar | 80 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 3 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |