DAPADAP 10 mg film kaplı tablet (28 tablet) Kısa Ürün Bilgisi
{ Dapagliflozin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
DAPADAP 10 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Dapagliflozin 10 mg
Yardımcı maddeler
Laktoz (sığır kaynaklı laktoz) 50 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Sarı, oblong film kaplı tabletlerdir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Tip 2 diabetes mellitus
DAPADAP erişkinlerde yetersiz kontrol edilen tip 2 diabetes mellitus tedavisi için diyet ve egzersize yardımcı olarak endikedir.
İntolerans nedeniyle metformin uygun görülmediğinde monoterapi olarak
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
Tip 2 diabetes mellitus
Önerilen doz günde bir defa 10 mg dapagliflozindir.
Dapagliflozin ile insülin veya sülfonilüre gibi insülin salgılatıcı bir ilaç kombinasyon halinde kullanıldığında, hipoglisemi riskini azaltmak için insülinin veya insülin salgılatıcı ilacın daha düşük bir dozu düşünülebilir (bkz. Bölüm 4.5 ve 4.8).
Kalp yetersizliği
Önerilen doz günde bir defa 10 mg dapagliflozindir.
DAPA-HF çalışmasında dapagliflozin başka kalp yetersizliği tedavileriyle birlikte uygulanmıştır (bkz. Bölüm 5.1).
Kronik böbrek hastalığı
Önerilen doz günde bir defa 10 mg dapagliflozindir.
Uygulama şekli:
DAPADAP günün herhangi bir saatinde yemeklerle birlikte veya aç karnına günde bir defa oral yolla alınabilir. Tabletler bütün olarak yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek fonksiyonuna göre herhangi bir doz ayarlaması yapılması gerekli değildir.
Sınırlı deneyim nedeniyle, tüm endikasyonlarda GFR <25 mL/dak olan hastalarda dapagliflozin tedavisine başlanması önerilmez.
Diyabetli hastalarda, glomerüler filtrasyon hızı (GFR) <45 mL/dak olduğunda dapagliflozinin glikoz düşürücü etkililiği azalır ve şiddetli böbrek yetmezliği bulunan hastalarda etkililik göstermemesi olasıdır. Bu nedenle, GFR'nin 45 mL/dak'ın altına düşmesi durumunda, diyabet hastalarında ek glikoz düşürücü tedavi düşünülmelidir (bkz. Bölüm 4.4, 4.8, 5.1 ve 5.2).
Tablo 1. Tüm endikasyonlar için eGFR değerlerine göre kullanım önerileri
eGFR (mL/dak/1,73 m) | Kullanım önerisi |
eGFR ≥45 | Günde bir kez 10 mg ağızdan |
25<eGFR<45 | Günde bir kez 10 mg ağızdan Dapagliflozinin glikoz düşürücü etkililiği azalır. |
eGFR <25 | Tedavi başlanması önerilmez; ancak, hastalar KBH'na progresyonu yavaşlatmak, kalp yetersizliği için hastaneye yatış veya kardiyovasküler ölüm riskini azaltmak, tüm nedenlere bağlı mortalite riskini azaltmak için günde bir kez ağızdan alınan 10 mg dapagliflozine devam edebilir. Muhtemelen dapagliflozinin glikoz düşürücü etkililiği yoktur. |
Karaciğer yetmezliği:
Hafif veya orta derecede karaciğer yetmezliği olan hastalar için herhangi bir doz ayarlamasına gerek duyulmamaktadır. Ağır derecede karaciğer yetmezliği olan hastalarda 5 mg başlangıç dozu önerilmektedir. İyi tolere edildiği takdirde, belirtildiğinde doz 10 mg'a çıkarılabilir (bkz. Bölüm
4.4 ve 5.2).
Pediyatrik popülasyon:
Dapagliflozinin 18 yaş altında güvenliliği ve etkililiği belirlenmemiştir. Herhangi bir veri bulunmamaktadır.
Geriyatrik popülasyon (≥ 65 yaş):
Yaşa bağlı olarak herhangi bir doz ayarlamasının yapılması önerilmemektedir.
4.3. Kontrendikasyonlar
Dapagliflozin etkin maddesine veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık durumunda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Böbrek yetmezliği
Sınırlı deneyim nedeniyle, GFR <25 mL/dak olan hastalarda dapagliflozin tedavisine başlanması önerilmez.
Dapagliflozinin glikoz düşürücü etkililiği böbrek fonksiyonuna bağlı olup, GFR <45 mL/dak olan hastalarda azalmaktadır ve ağır derecede böbrek yetmezliği olan hastalarda ise etkililik göstermemesi olasıdır (bkz. Bölüm 4.2, 5.1 ve 5.2).
Orta derecede böbrek yetmezliği olan (GFR < 60 mL/dak) tip 2 diyabet hastalarında yapılan bir çalışmada, plasebo ile karşılaştırıldığında, dapagliflozin ile tedavi edilen hastaların daha büyük bir kısmında kreatinin, fosfor ve paratiroit hormonu (PTH) artışı ve hipotansiyon gibi advers reaksiyonlar gözlenmiştir.
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda gerçekleştirilen klinik çalışmalardan elde edilen deneyim sınırlıdır. Dapagliflozin maruziyeti, ağır derecede karaciğer yetmezliği olan bireylerde artmaktadır (bkz. Bölüm 4.2 ve 5.2).
Vücut sıvı dengesinin bozulması ve/veya hipotansiyon riski olan hastalarda kullanımı Dapagliflozin etki mekanizmasına bağlı olarak, diürezi arttırır ve bu da klinik çalışmalarda gözlenen hafif kan basıncı düşüşüne yol açabilir (bkz. Bölüm 5.1). Bu etki, kan glukoz konsantrasyonları çok yüksek olan bireylerde daha belirgin olabilir.
Anti-hipertansif tedavi almakta olup hipotansiyon öyküsü olan hastalar ya da yaşlı hastalar gibi, kan basıncında dapagliflozin kaynaklı bir düşüşün risk oluşturabileceği hastalarda dikkatli olunmalıdır.
Vücut sıvı dengesini bozabilen eşzamanlı durumlar (örneğin gastrointestinal hastalık) mevcut olduğunda, vücut sıvı dengesinin (örn., fiziksel muayene, kan basıncı ölçümleri, hematokrit ve elektrolitleri içeren laboratuvar testleri) dikkatle izlenmesi önerilmektedir. Vücut sıvı dengesinde bozulmaların geliştiği hastalarda, kayıp düzeltilene kadar dapagliflozin tedavisine geçici olarak ara verilmesi önerilmektedir (bkz. Bölüm 4.8).
Diyabetik ketoasidoz
Dapagliflozin dahil olmak üzere sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleri ile tedavi edilen hastalarda yaşamı tehdit eden ya da ölümcül vakalar dahil olmak üzere nadir diyabetik ketoasidoz (DKA) vakaları bildirilmiştir. Bazı vakalarda bu durumun ortaya çıkış biçimi atipik
olup, kan glukozu değerleri 14 mmol/L (250 mg/dL) altında olmak üzere sadece orta düzeyde artış göstermiştir.
Bulantı, kusma, anoreksi, karın ağrısı, aşırı susama, nefes alma güçlüğü, konfüzyon, alışılmadık yorgunluk ya da uyuklama gibi spesifik olmayan semptomların ortaya çıkması durumunda diyabetik ketoasidoz riski dikkate alınmalıdır. Eğer bu semptomlar ortaya çıkarsa, kan glukoz düzeyinden bağımsız olarak hastalar derhal ketoasidoz açısından değerlendirilmelidir.
Hastalarda DKA şüphesi ya da tanısı olduğunda derhal dapagliflozin tedavisi kesilmelidir.
Majör cerrahi prosedürler ya da akut ciddi tıbbi hastalıklar nedeniyle hastaneye yatırılan hastalarda tedavi kesilmelidir. Bu hastalarda ketonların izlenmesi önerilir. Kan keton düzeylerinin ölçümü idrara tercih edilir. Dapagliflozin tedavisi, keton değerleri normal olduğunda ve hastanın durumu stabilize olduğunda yeniden başlatılabilir.
Dapagliflozin tedavisine başlamadan önce, hastanın öyküsündeki ketoasidoza yatkınlık oluşturabilecek faktörler göz önünde bulundurulmalıdır.
Daha yüksek DKA riski altında olabilecek hastalar, düşük beta-hücresi fonksiyonu rezervi olan hastaları (ör. düşük C-peptid bulunan tip 2 diyabet hastaları ya da erişkinlerde latent otoimmün diyabet (LADA) ya da pankreatit öyküsü bulunan hastalar), kısıtlı gıda alımına neden olan hastalıkları ya da ciddi dehidratasyon bulunan hastaları, insülin dozları azaltılan hastaları ve akut tıbbi hastalık, cerrahi ya da alkol kullanımına bağlı olarak insülin gereksinimleri fazla olan hastaları kapsar. SGLT2 inhibitörleri bu hastalarda dikkatli şekilde kullanılmalıdır.
SGLT2 inhibitörü tedavisi altındayken bir DKA yaşayan hastalarda, başka bir açık hızlandırıcı faktör belirlenmedikçe ve düzeltilmedikçe yeniden SGLT2 inhibitörü tedavisine başlanması önerilmez.
Dapagliflozin ile tip 1 diabetes mellitus çalışmalarında, DKA yaygın sıklıkta bildirilmiştir. Tip 1 diyabeti bulunan hastaların tedavisinde dapagliflozin kullanılmamalıdır.
Perineal nekrotizan fasiit (Fournier kangreni)
SGLT2 inhibitörleri kullanan kadın ve erkek hastalarda pazarlama sonrasında perineal nekrotizan fasiit (Fournier kangreni olarak da bilinir) vakaları bildirilmiştir (bkz. Bölüm 4.8). Bu acil cerrahi müdahale ve antibiyotik tedavisi gerektiren nadir ancak ciddi ve potansiyel olarak yaşamı tehdit edici bir olaydır.
Hastalara, ateş veya halsizlik ile birlikte, genital veya perineal bölgede ağrı, hassasiyet, eritem veya şişlik semptomlarının bir kombinasyonunu yaşamaları durumunda tıbbi yardım almaları önerilmelidir. Nekrotizan fasiitin öncesinde ürogenital enfeksiyon veya perineal apse ortaya çıkabileceği bilinmelidir. Fournier kangreninden şüphelenildiği takdirde DAPADAP kesilmeli ve acil tedavi (antibiyotikler ve cerrahi debridman dahil) başlatılmalıdır.
İdrar yolu enfeksiyonları
İdrarla glukoz atılımı, idrar yolu enfeksiyonu riskinde artış ile ilişkili olabilir; bu nedenle piyelonefrit veya ürosepsis tedavisi sırasında dapagliflozine geçici olarak ara verilmesi düşünülmelidir.
Yaşlı hastalar (≥65)
Yaşlı hastalarda vücut sıvı dengesini bozulma riski daha fazladır ve diüretiklerle tedavi edilme
olasılıkları daha yüksektir.
Yaşlı hastalarda böbrek işlev bozukluğunun olma olasılığı ve/veya bu hastaların böbrek fonksiyonlarında değişikliklere neden olabilecek anjiyotensin dönüştürücü enzim inhibitörleri (ACE-I) ve anjiyotensin II tip I reseptör blokerleri (ARB) gibi anti-hipertansif tıbbi ürünlerle tedavi görüyor olma olasılığı daha yüksektir. Tüm hastalarda olduğu gibi yaşlı hastalarda da böbrek fonksiyonu ile ilgili aynı öneriler geçerlidir (bkz. Bölüm 4.2, 4.4, 4.8 ve 5.1).
Kalp yetersizliği
NYHA sınıf IV'te dapagliflozin ile deneyim sınırlıdır.
Kronik böbrek hastalığı
Albümünirisi olmayan non-diyabetik hastalarda kronik böbrek hastalığının tedavisi için dapagliflozin ile ilgili deneyim bulunmamaktadır. Albüminürisi olan hastalar dapagliflozin tedavisinden daha fazla yarar görebilir.
Alt ekstremite ampütasyonları
Bir başka SGLT2 inhibitörüyle tip 2 diyabette yapılan uzun süreli klinik çalışmalarda, alt ekstremite ampütasyon vakalarında (esas olarak ayak başparmağı) bir artış gözlenmiştir. Bunun bir sınıf etkisi oluşturup oluşturmadığ![]() ı bilinmemektedir. Diyabetli hastalara rutin önleyici ayak bakımı konusunda bilgi verilmesi önemlidir.
ı bilinmemektedir. Diyabetli hastalara rutin önleyici ayak bakımı konusunda bilgi verilmesi önemlidir.
İdrar laboratuvar değerlendirmeleri
Etki mekanizması nedeniyle, dapagliflozin almakta olan hastaların idrarlarında glukoz testi pozitif sonuç verecektir.
Laktoz
DAPADAP film kaplı tablet laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakodinamik etkileşimler
Diüretikler
Dapagliflozin; tiazid ve loop diüretiklerin diüretik etkilerine katkıda bulunabilir ve dehidratasyon ve hipotansiyon riskini artırabilir (bkz. Bölüm 4.4).
İnsülin ve insülin salgılatıcı ilaçlar
İnsülin ve sülfonilüreler gibi insülin salgılatıcı ilaçlar hipoglisemiye neden olur. Bu nedenle, tip 2 diyabetli hastalarda dapagliflozin ile kombinasyon halinde kullanıldığında, hipoglisemi riskinin azaltılması için insülin veya insülin salgılatıcı ilacın daha düşük dozunun kullanılması gerekebilir (bkz. Bölüm 4.2 ve 4.8).
Farmakokinetik etkileşimler
Dapagliflozin metabolizması başlıca UDP glukuronoziltransferaz 1A9 (UGT1A9) aracılı glukuronit konjugasyonu yoluyladır.
İn vitro çalışmalarda dapagliflozin; sitokrom P450 (CYP) 1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4'ü inhibe etmemiş ya da CYP1A2, CYP2B6,
CYP3A4'ü indüklememiştir. Bu nedenle, dapagliflozinin, bu enzimler tarafından metabolize olan
eşzamanlı uygulanan tıbbi ürünlerin metabolik klirensini değiştirmesi beklenmemektedir.
Diğer tıbbi ürünlerin dapagliflozin üzerindeki etkisi
Sağlıklı bireylerle gerçekleştirilen, özellikle tek doz tasarımın kullanıldığı etkileşim çalışmaları, dapagliflozinin farmakokinetiğinin metformin, pioglitazon, sitagliptin, glimepirid, vogliboz, hidroklorotiazit, bumetanid, valsartan ya da simvastatin tarafından değiştirilmediğini göstermektedir.
Dapagliflozin ile rifampisinin (çeşitli aktif taşıyıcı ve ilaç metabolize edici enzimlerin indükleyicisi) eşzamanlı uygulanmasını takiben sistemik dapagliflozin maruziyetinde (EAA)
%22'lik bir düşüş gözlenmiş, ancak 24 saatlik üriner glukoz atılımında klinik olarak anlamlı bir etkisi olmamıştır. Herhangi bir doz ayarlaması önerilmemektedir. Diğer indükleyicilerle (örneğin; karbamazepin, fenitoin, fenobarbital) klinik olarak anlamlı bir etki beklenmemektedir.
Dapagliflozin ile mefenamik asidin (UGT1A9 inhibitörü) eşzamanlı uygulanmasını takiben sistemik dapagliflozin maruziyetinde %55'lik bir artış gözlenmiştir; ancak 24 saatlik üriner glukoz atılımında klinik olarak anlamlı bir etkisi olmamıştır. Herhangi bir doz ayarlaması önerilmemektedir.
Dapagliflozinin diğer tıbbi ürünler üzerindeki etkisi
Sağlıklı bireylerle gerçekleştirilmiş olan, özellikle tek doz tasarımın kullanıldığı etkileşim çalışmalarında, dapagliflozin metformin, pioglitazon, sitagliptin, glimepirid, hidroklorotiazit, bumetanid, valsartan, digoksin (P-gp substratı) ya da varfarinin farmakokinetiğini (S-varfarin; CYP2C9 substratı), veya varfarinin INR ile ölçüldüğü üzere antikoagülan etkilerini değiştirmemiştir. Tek doz 20 mg dapagliflozin ile simvastatin (CYP3A4 substratı) kombinasyonu simvastatinin EAA değerinde %19 artış ve simvastatin asidin EAA değerinde
%31 artış ile sonuçlanmıştır. Simvastatin ve simvastatin asit maruziyetlerindeki artışların klinikte
anlamlı olduğu düşünülmemektedir.
![]()
1,5-anhidroglusitol (1,5.-AG) Tayini ile Etkileşim
SGLT2 inhibitörleri alan hastalarda glisemik kontrolün değerlendirilmesinde 1,5-AG ölçümleri güvenilir sonuçlar vermediğinden glisemik kontrolün 1,5-AG tayini ile izlenmesi önerilmez. Glisemik kontrolü izlemek için alternatif yöntemlerin kullanımı önerilmektedir.
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
Etkileşim çalışmaları sadece erişkinlerde gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Dapagliflozin ve östrojen/progesteron içeren kontraseptifler arasında, özel bir ilaç etkileşim çalışması yapılmamıştır. Ancak, metabolizma verisine göre, dapagliflozinin östrojen/progesteron içeren kontraseptiflerin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi beklenmemektedir. Çocuk doğurma potansiyeli olan kadınlarda özel bir önleme gerek yoktur.
Gebelik dönemi
Gebe kadınlarda dapagliflozin kullanımına ilişkin veri bulunmamaktadır. Sıçanlar üzerindeki
çalışmalarda, insanlardaki gebeliğin ikinci ve üçüncü trimesterlerine karşılık gelen dönemde gelişme sürecindeki böbreklerde toksisite gözlenmiştir (bkz. Bölüm 5.3). Bu nedenle gebeliğin ikinci ve üçüncü trimesterlerinde dapagliflozinin kullanılması önerilmemektedir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebelik saptandığında dapagliflozin tedavisi durdurulmalıdır.
Laktasyon dönemi
Dapagliflozin ve/veya metabolitlerinin insan sütü ile atılıp atılmadığı bilinmemektedir. Hayvanlardaki mevcut farmakodinamik/toksikolojik veriler, dapagliflozin/metabolitlerinin süt ile atıldığını, ayrıca emzirilen yavrularda farmakoloji aracılı etkilerin olduğunu göstermiştir (bkz. Bölüm 5.3). Yenidoğanlar/bebekler için risk olasılık dışı bırakılamamaktadır. Dapagliflozin, emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/Fertilite
Dapagliflozinin insanda fertilite üzerindeki etkisi incelenmemiştir. Erkek ve dişi sıçanlarda dapagliflozin, test edilen herhangi bir dozda fertilite üzerinde bir etki göstermemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
DAPADAP'ın, araç ve makine kullanma becerisi üzerinde herhangi bir etkisi bulunmamakta ya da ihmal edilebilir düzeyde etkileri olabilmektedir. Dapagliflozin, bir sülfonilüre veya insülin ile kombinasyon halinde kullanıldığında, hastalara, hipoglisemi riskine karşı dikkatli olmaları önerilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti Tip 2 diabetes mellitusTip 2 diyabet konulu klinik çalışmalarda, 15.000'den fazla hasta dapagliflozin ile tedavi edilmiştir.
![]()
Güvenliliğin ve tolere edilebilirliğin birincil değerlendirmesi, plasebo kontrollü 13 kısa süreli (24 haftaya kadar) çalışmanın önceden tanımlanmış olan birleştirilmiş analizinde 2.360 hasta 10 mg dapagliflozin ile tedavi edilmiş, 2.295 hastaya plasebo uygulanmıştır.
Tip 2 diyabet konulu dapagliflozin kardiyovasküler sonlanımlar çalışmasında (DECLARE çalışması, bkz. Bölüm 5.1), 48 aylık bir medyan maruziyet süresi ile 8.574 hasta 10 mg dapagliflozin, 8.569 hasta ise plasebo almıştır. Toplamda dapagliflozin maruziyeti 30.623 hasta yılı olmuştur.
Klinik çalışmalarda en sık bildirilen advers reaksiyon genital enfeksiyonlar olmuştur.
Kalp yetersizliği
Düşük ejeksiyon fraksiyonuyla seyreden kalp yetersizliği hastalarında yürütülen dapagliflozin kardiyovasküler sonuç çalışmasında (DAPA-HF çalışması), 18 aylık bir medyan maruziyet süresi boyunca 2368 hasta 10 mg dapagliflozin, 2368 hasta ise plasebo almıştır. Hasta popülasyonu, tip 2 diyabeti olan ve olmayan hastaları ve eGFR değeri ≥ 30 mL/dak/1,73 m olan hastaları içermiştir.
Dapagliflozinin kalp yetersizliği görülen hastalardaki genel güvenlilik profilinin dapagliflozinin
bilinen güvenlilik profili ile tutarlı olduğu görülmüştür.
Kronik böbrek hastalığı
Kronik böbrek hastalığı bulunan hastalarda yapılan dapagliflozin renal sonuç çalışmasında (DPA- CKD), ortanca 27 aylık maruziyette 2.149 hasta dapagliflozin 10 mg ve 2.149 hasta plasebo ile tedavi edilmiştir. Hasta popülasyonu >25 ile ≤75 mL/dak/1.73 m eGFR'ye sahip tip 2 diyabeti bulunan ve bulunmayan hastalardan ve albüminürisi (idrarda albümin kreatinin oranı [UACR]
≥200 ve ≤5000 mg/g) olan hastalardan oluşmaktaydı. Tedavi, eğer eGFR 25 mL/dak/1.73 m düzeyinin altına düşmüşse devam ettirilmiştir.
Kronik böbrek hastalığı bulunan hastalarda dapagliflozinin genel güvenlilik profili dapagliflozinin bilinen güvenlilik profili ile uyumlu idi.
Aşağıdaki advers reaksiyonlar plasebo kontrollü klinik çalışmalarda ve pazarlama sonrası gözlemde tespit edilmiştir. Bu advers reaksiyonlardan herhangi birinin dozla bağlantılı olduğu bulunmamıştır. Advers reaksiyonlar sistem organ sınıfına ve sıklığa göre listelenmektedir. Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Plasebo kontrollü klinik çalışmada ve pazarlama sonrası ortaya çıkan advers reaksiyonlar Enfeksiyonlar ve enfestasyonlar
Yaygın: Vulvovajinit, balanit ve bağlantılı genital enfeksiyonlar, idrar yolu enfeksiyonu
Yaygın olmayan: Mantar enfeksiyonu
Çok seyrek: Perineal nekrotizan fasiit (Fournier Kangreni)
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hipoglisemi (SU veya insülin ile birlikte kullanıldığında)
Yaygın olmayan: Volüm kaybı , susama hissi
Seyrek: Diyabetik ketoasidoz (tip 2 diyabette kullanıldığında)
Sinir sistemi hastalıkları
Yaygın : Baş dönmesi de içeren sersemlik hali
Gastrointestinal hastalıklar
kuruluğu
Deri ve deri altı doku hastalıkları
Yaygın : Döküntü
Çok seyrek: Anjiyoödem
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Sırt ağrısı
Böbrek ve idrar yolu hastalıkları
Yaygın: Disüri, poliüri
Yaygın olmayan: Noktüri
Üreme sistemi ve meme hastalıkları
Yaygın olmayan : Vulvovajinal kaşıntı , genital kaşıntı
Araştırmalar
yükselmesi başlangıç tedavisi sırasında renal kreatinin
klirensinde azalma
Yaygın olmayan: Başlangıç tedavisi sırasında kanda kreatinin yükselmesi, kanda üre
yükselmesi
, kilo verme
Glisemik kurtarmadan bağımsız olarak, 24 haftaya kadarki (kısa süreli) veriler
Ek bilgi için aşağıda karşılık gelen bölüme bakınız.
Vulvovajinit, balanit ve bağlantılı genital enfeksiyonlar şunları içerir. Örneğin; ön tanımlı
tercih edilen terimler: vulvovajinal mikotik enfeksiyon, vajinal enfeksiyon, balanit, genital fungal enfeksiyon, vulvovajinal kandidiyazis, vulvovajinit, balanit kandida, genital kandidiyazis, genital enfeksiyon, erkek genital enfeksiyonu, penil enfeksiyon, vulvit, bakteriyel
vajinit, vulval apse.
Üriner sistem enfeksiyonu bildirilme sıklığına göre sıralanmış şu tercih edilen terimleri içermektedir: üriner sistem enfeksiyonu, sistit, Escherichia üriner sistem enfeksiyonu,
genitoüriner sistem enfeksiyonu, piyelonefrit, trigonit, üretrit, böbrek enfeksiyonu ve prostatit.
Volüm kaybı kapsamında şunları içerir, ön tanımlı tercih edilen terimler: dehidratasyon, hipovolemi, hipotansiyon.
Poliüri şu tercih edilen terimleri içermektedir: pollakiüri, poliüri ve idrar çıkışında artış.
Hematokritte başlangıca göre ortalama değişiklik 10 mg dapagliflozin için %2,3 karşısında
plasebo için -%0,33'tür. Dapagliflozin 10 mg ile tedavi edilen kişilerin %1,3'ünde >%55'lik hematokrit değerleri bildirilirken, plasebo alan kişilerin %0,4'ünde bu düzey bildirilmiştir.
Plaseboya kıyasla dapagliflozin 10 mg ile başlangıca göre ortalama değişim yüzdesi şu şekilde olmuştur: total kolesterol %0'a karşı %2,5; HDL kolesterol % 2,7'ye karşı %6; LDL kolesterol -
%1'e karşı %2,9; trigliseridler -%0,7'ye karşı -%2,7.
Bakınız Bölüm 4.4
Advers reaksiyon, pazarlama sonrası gözlem yoluyla tespit edildi. Döküntü, aşağıdaki tercih
edilen terimleri içerir, klinik çalışmalardaki sıklığa göre sıralanmıştır: döküntü, yaygınlaşmış döküntü, kaşıntılı döküntü, maküler döküntü, makülopapüler döküntü, döküntü püstüler, döküntü veziküller ve eritemli döküntü. Aktif ve plasebo kontrollü klinik çalışmalarda (dapagliflozin, N: 5.936, tüm kontrol, N: 3.403), döküntü sıklığı sırasıyla dapagliflozin (%1,4) ve tüm kontroller (%1,4) için benzerdi.
Tip 2 diyabetli hastalar üzerinde gerçekleştirilen kardiyovasküler sonuçlar çalışmasında (DECLARE) bildirilmiştir. Sıklık, yıllık oranı temel almaktadır.
Hastaların ≥ % 2'sinde ve plaseboya kıyasla dapagliflozin 10 mg ile tedavi edilen hastaların
≥%1'inde ve en az 3 hastada daha raporlanmıştır.
Araştırıcı tarafından hastaların ≥ %0,2'sinde çalışma tedavisiyle ilişkisi muhtemel, ilişkisi olası ya da ilişkili olarak bildirilmiştir ve plaseboya kıyasla ≥ %1 fazla ve en az 3 fazla kişi dapagliflozin 10 mg ile tedavi edilmiştir.
Seçili advers reaksiyonların tanımı
Vulvovajinit, balanit ve ilişkili genital enfeksiyonlar
13 çalışmalık güvenlilik havuzunda vulvovajinit, balanit ve ilişkili genital enfeksiyonlar 10 mg dapagliflozin ve plasebo alan gönüllülerin sırasıyla %5,5 ve %0,6'sında bildirilmiştir. Enfeksiyonların çoğunun hafif ila orta şiddetli olduğu görülmüştür ve gönüllüler ilk standart tedavi kürüne yanıt vermiştir. Enfeksiyonlar nadiren dapagliflozin tedavisinin kesilmesine neden olmuştur. Bu enfeksiyonların kadınlarda daha sık ortaya çıktığı gözlenmiştir (dapagliflozin ve plasebo ile sırasıyla %8,4 ve %1,2) ve geçmiş öyküye sahip gönüllülerin rekürren enfeksiyon yaşama olasılığının daha yüksek olduğu belirlenmiştir.
DECLARE çalışmasında, ciddi genital enfeksiyon advers olayları yaşayan hastaların sayılarının düşük ve dengeli olduğu görülmüştür: dapagliflozin ve plasebo gruplarının her birinde 2 hasta.
DAPA-HF çalışmasında, dapagliflozin grubunda hiçbir hasta, ciddi genital enfeksiyonuna bağlı advers olay bildirmemiş, plasebo grubunda ise bir hasta böyle bir bildirimde bulunmuştur. Dapagliflozin grubunda genital enfeksiyonlara bağlı olarak tedavinin bırakılmasına neden olan advers olaylar 7 (%0,3) hastada görülmüştür, plasebo grubunda ise böyle bir olay gözlenmemiştir.
DAPA-CKD çalışmasında, dapagligflozin grubunda genital enfeksiyonlardan oluşan ciddi advers olay bulunan 3 hasta (%0,1) varken, plasebo grubunda yoktur. Dapagliflozin grubunda genital enfeksiyonlar nedeniyle tedavinin bırakılmasına yol açan advers olay bulunan 3 hasta (%0,1) varken, plasebo grubunda yoktur. Diyabeti olmayan hiçbir hastada genital enfeksiyonların ciddi yan etkileri veya genital enfeksiyonlar nedeniyle tedavinin kesilmesine neden olan yan etkiler bildirilmemiştir.
Perineumda nekrotizan fasiit (Fournier gangreni)
Dapagliflozin de dahil olmak üzere SGLT2 inhibitörleri alan hastalarda pazarlama sonrasında Fournier gangreni olguları bildirilmiştir (bkz. Bölüm 4.4).
Tip 2 diabetes mellitus bulunan 17.160 hasta ile yapılan ve medyan maruziyet süresinin 48 ay olduğu DECLARE çalışmasında, biri dapagliflozin ile tedavi edilen grupta ve 5'i plasebo grubunda olmak üzere 6 Fournier gangreni olgusu bildirilmiştir.
Hipoglisemi
Hipoglisemi sıklığının diyabet konulu klinik çalışmalarda arka plan tedavisinin tipine bağlı olduğu görülmüştür.
Monoterapide, metformine ilave ya da sitagliptine ilave (metforminle veya metforminsiz) dapagliflozin çalışmaları için, minör hipoglisemi epizodlarının sıklıkları tedavinin 102. haftasına kadar plasebo dahil tedavi grupları arasında benzer olmuştur (<%5). Tüm çalışmalarda majör hipoglisemi olayları yaygın olmayan sıklıkta gözlenmiştir ve dapagliflozin ya da plasebo uygulanan gruplar arasında benzer olmuştur. İlave sülfonilüre ve ilave insülin tedavilerinin kullanıldığı çalışmalarda hipoglisemi oranları daha yüksek olmuştur (bkz. Bölüm 4.5).
Glimepiride ilave tedavi çalışmasında, 24 ve 48. haftalarda minör hipoglisemi epizodları, plasebo ile glimepirid uygulanan kombinasyon grup (sırasıyla %2,1 ve %2,1) ile karşılaştırıldığında 10 mg dapagliflozin ile glimepirid kombinasyonu uygulanan grupta daha sık (sırasıyla %6,0 ve
%7,9) bildirilmiştir.
İnsüline ilave çalışmasında, majör hipoglisemi epizodları, 24. ve 104. haftalarda 10 mg dapagliflozin ve insülin ile tedavi edilen bireylerin sırasıyla %0,5'i ve %1'i ve 24. ve
104. haftalarda plasebo ve insülin ile tedavi edilen bireylerin %0,5'inde bildirilmiştir. 24. ve
104. haftalarda, minör hipoglisemi epizodları 10 mg dapagliflozin ve insülin alan bireylerin sırasıyla %40,3'ü ve %53,1'i ve plasebo ile insülin alan bireylerin %34,0'ında ve %41,6'sında bildirilmiştir.
24 haftaya kadar olan, metformin ve bir sülfonilüreye ekleme çalışmasında, majör hipoglisemi epizodu bildirilmemiştir. 10 mg dapagliflozine ek olarak metformin ve bir sülfonilüre alan deneklerin %12,8'inde ve plaseboya ek olarak metformin ve bir sülfonilüre alan deneklerin
%3,7'sinde minör hipoglisemi epizodları bildirilmiştir.
DECLARE çalışmasında plasebo ile karşılaştırıldığında dapagliflozin tedavisiyle majör hipoglisemi riskinde artış gözlenmemiştir. Majör hipoglisemi olayları dapagliflozinle tedavi uygulanan 58 (%0,7) hastada ve plaseboyla tedavi uygulanan 83 (%1) hastada bildirilmiştir.
DAPA-HF çalışmasında, yalnızca tip 2 diyabetli hastalarda olmak üzere, hem dapagliflozin hem de plasebo tedavisi gruplarında 4 (%0,2) hastada majör hipoglisemi olayları gözlemlenmiştir.
DAPA-CKD çalışmasında, hipoglisemi majör olayları dapagliflozin grubunda 14 hastada (%0,7) ve plasebo grubunda 28 hastada (%1,3) bildirilmiş ve sadece tip 2 diyabet bulunan hastalarda gözlenmiştir.
Vücut sıvı dengesi
13 çalışmalık güvenlilik havuzunda, vücut sıvı dengesine işaret eden reaksiyonlar (dehidratasyon, hipovolemi ya da hipotansiyon bildirimlerini içerir) 10 mg dapagliflozin ve plasebo alan bireylerin sırasıyla %1,1'inde ve %0,7'sinde bildirilmiştir; ciddi olaylar bireylerin
<%0,2'sinde meydana gelmiş olup 10 mg dapagliflozin ve plasebo arasında dengelidir (bkz. Bölüm 4.4).
DECLARE çalışmasında vücut sıvı dengesine işaret eden olaylar yaşayan hastaların sayısının tedavi grupları arasında dengeli olduğu görülmüştür: dapagliflozin ve plasebo gruplarında sırasıyla 213 (%2,5) ve 207 (%2,4). Ciddi advers olaylar dapagliflozin ve plasebo grubunda sırasıyla 81 (%0,9) ve 70 (%0,8) gönüllüde bildirilmiştir. Yaş, diüretik kullanımı, kan basıncı ve anjiyotensin dönüştürücü enzim inhibitörleri (ACE-I)/anjiyotensin II tip 1 reseptör blokerleri (A![]() RB
RB![]() ) kullanımı alt gruplarında olayların genel olarak tedavi grupları arasında dengeli olduğu görülmüştür. Başlangıçta eGFR değeri <60 mL/dak/1,73 m olan hastalarda dapagliflozin grubunda vücut sıvı dengesine işaret eden 19 ciddi advers olay, plasebo grubunda ise 13 olay ortaya çıkmıştır.
) kullanımı alt gruplarında olayların genel olarak tedavi grupları arasında dengeli olduğu görülmüştür. Başlangıçta eGFR değeri <60 mL/dak/1,73 m olan hastalarda dapagliflozin grubunda vücut sıvı dengesine işaret eden 19 ciddi advers olay, plasebo grubunda ise 13 olay ortaya çıkmıştır.
DAPA-HF çalışmasında volüm sıvı dengesine işaret eden olayların görüldüğü hastaların sayısı dapagliflozin grubunda 170 (%7,2), plasebo grubunda ise 153 (%6,5) olmuştur. Volüm sıvı dengesine işaret eden ciddi olaylar yaşayan hastaların sayısının, dapagliflozin grubunda (23 [%1]) plasebo grubundakine kıyasla (38 [%1,6]) daha düşük olduğu gözlenmiştir. Sonuçların başlangıçta diyabet var olup olmamasından ve başlangıçtaki eGFR düzeyinden bağımsız şekilde birbirine yakın olduğu gözlenmiştir.
DAPA-CKD çalışmasında, volüm sıvı dengesine işaret eden olayların görüldüğü hastaların sayısı dapagliflozin grubunda 120 (%5,6), plasebo grubunda ise 84 (%3,9) olmuştur. Dapagliflozin grubunda volüm sıvı dengesine işaret eden ciddi olay semptomlara sahip16 hasta
(%0,7) varken, plasebo grubunda 15 hasta (%0,7) vardı.
Tip 2 diyabette diyabetik ketoasidoz
Medyan maruziyet süresinin 48 ay olduğu DECLARE çalışmasında, dapagliflozin 10 mg grubunda 27 hastada, plasebo grubunda ise 12 hastada DKA olayları rapor edilmiştir. Olaylar çalışma periyodu boyunca eşit dağılımlı olarak gerçekleşmiştir. Dapagliflozin grubunda DKA olaylarının görüldüğü 27 hastanın 22'sinin olay sırasında eşzamanlı insülin tedavisi almakta olduğu saptanmıştır. DKA için hızlandırıcı faktörler, bir tip 2 diabetes mellitus popülasyonunda beklendiği şekilde olmuştur (bkz. Bölüm 4.4).
DAPA-HF çalışmasında DKA olayları dapagliflozin grubunda tip 2 diyabetli 3 hastada bildirilmiş, plasebo grubunda ise hiçbir hastada bildirilmemiştir.
DAPA-CKD çalışmasında DKA olayları dapagliflozin grubunda hiçbir hastada bildirilmezken, plasebo grubunda tip 2 diyabeti bulunan 2 hastada bildirilmiştir.
İdrar yolu enfeksiyonları
13 çalışmalık güvenlilik havuzunda, idrar yolu enfeksiyonları 10 mg dapagliflozin için plaseboya kıyasla daha sık bildirilmiştir (sırasıyla %4,7 karşısında %3,5; bkz. Bölüm 4.4). Enfeksiyonların çoğu hafif ila orta derecede olmuş ve bireyler ilk standart tedavi kürüne yanıt vermiş, nadir durumlarda dapagliflozin tedavisinin kesilmesi gerekmiştir. Bu enfeksiyonlar kadınlar arasında daha sık gözlenmiştir ve öyküsü olan hastaların enfeksiyon nüksü geliştirme olasılığı daha yüksek olmuştur.
DECLARE çalışmasında ciddi idrar yolu enfeksiyonu olayları 10 mg dapagliflozin ile plasebo ile olandan daha düşük sıklıkta bildirilmiştir; sırasıyla 79 (%0,9) olaya karşılık 109 (%1,3) olay ortaya çıkmıştır.
DAPA-HF çalışmasında ciddi idrar yolu enfeksiyonu advers olaylarının görüldüğü hastaların sayısı dapagliflozin grubunda 14 (%0,6), plasebo grubunda ise 17 (%0,7) olmuştur. Dapagliflozin ve plasebo gruplarının her birinde idrar yolu enfeksiyonlarına bağlı olarak tedavinin bırakılmasına neden olan advers olaylar 5 (%0,2) hastada görülmüştür.
DAPA-CKD çalışmasında, ciddi idrar yolu enfeksiyonu advers olaylarının görüldüğü hastaların sayısı dapagliflozin grubunda 29 (%1,3), plasebo grubunda ise 18 (%0,8) olmuştur. Dapagliflozin grubunda idrar yolu enfeksiyonlarına bağlı olarak tedavinin bırakılmasına neden olan advers olaylar 8 hastada (%0,4) görülürken, plasebo grubunda ise 3 hastada (%0,1) görülmüştür. İdrar yolu enfeksiyonlarına bağlı ciddi advers olaylar veya idrar yolu enfeksiyonları nedeniyle tedavinin kesilmesine yol açan advers olaylar bildiren diyabeti olmayan hastaların sayısı, tedavi grupları arasında benzerdir (dapagliflozin ve plasebo gruplarında sırasıyla ciddi advers olaylar için 6 [%0,9]'a karşı 4 [%0,6] ve tedavinin kesilmesine neden olan advers olaylar için 1 [%0,1]'e karşı 0).
Kreatinin artışı
Kreatinin artışıyla ilişkili advers reaksiyonlar gruplanmıştır (örn. Renal kreatinin klirensinde azalma, böbrek fonksiyon bozukluğu, kan kreatininde artış ve glomerüler filtrasyon hızında azalma). 13 çalışmalık güvenlilik havuzunda, bu reaksiyon gruplaması dapagliflozin 10 mg ve plasebo alan hastaların sırasıyla %3,2 ve %1,8'inde bildirilmiştir. Normal böbrek fonksiyonu olan ya da hafif böbrek bozukluğu bulunan hastalarda (başlangıçta eGFR ≥ 60 mL/dak/1,73m) bu reaksiyon gruplaması dapagliflozin 10 mg ve plasebo alan hastaların sırasıyla %1,3 ve %0,8'inde bildirilmiştir. Bu reaksiyonlar, başlangıçta eGFR ≥ 30 ve < 60
mL/dak/1,73 m hastalarda daha yaygın olmuştur (dapagliflozin 10 mg ile %1,85 ve plasebo ile %9,3).
Böbrek ile ilişkili advers olaylar yaşamış olan hastaların ileri değerlendirmesi bunların çoğunda başlangıca kıyasla ≤ 0,5 mg/dL kreatinin değişiklikleri olduğunu göstermiştir. Kreatinin artışları sürekli tedavi sırasında genellikle geçici ya da tedavi bırakıldıktan sonra geri dönüşlü olmuştur.
Yaşlı hastaları ve böbrek fonksiyon bozukluğu (60 mL/dak/1,73 m'den az eGFR) bulunan hastaları içeren DECLARE çalışmasında, eGFR her iki tedavi grubunda zamanla azalmıştır. Plasebo grubu ile karşılaştırıldığında, dapagliflozin grubunda 1. yılda ortalama eGFR biraz daha düşük olurken, 4. yılda ortalama eGFR biraz daha yüksek olmuştur.
DAPA-HF çalışmasında hem dapagliflozin grubunda hem de plasebo grubunda eGFR zaman içinde düşmüştür. Ortalama eGFR'de başlangıçta gözlenen azalma dapagliflozin grubunda - 4,3 mL/dak/1,73 m, plasebo grubunda ise -1,1 mL/dak/1,73 m olmuştur. Tedavi gruplarında eGFR'de başlangıca kıyasla 20. ayda gözlenen farkın birbirine yakın olduğu görülmüştür: dapagliflozinle -5,3 mL/dak/1,73 m, plaseboyla -4,5 mL/dak/1,73 m.
DAPA-CKD çalışmasında, hem dapagliflozin grubunda hem de plasebo grubunda eGFR zaman içinde düşmüştür. Ortalama eGFR'deki ilk gözlenen azalma (14. gün) dapagliflozin grubunda - 4,0 mL/dak/1,73 m, plasebo grubunda ise -0,8 mL/dak/1,73 m olmuştur. 28. ayda, başlangıç eGFR'ye göre değişim, dapagliflozin grubunda -7,4 ml/dk/1,73 m ve plasebo grubunda ise -8,6 ml/dk/1,73 m'dir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi'ne (TÜFAM) bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Dapagliflozin, 500 mg'a (maksimum önerilen insan dozunun 50 katı) varan tek oral dozlarda sağlıklı bireylerde herhangi bir toksisite göstermemiştir. Bu bireylerin idrarında, bir süre boyunca dozla ilişkili olarak (500 mg doz için en az 5 gün) tespit edilir glukoz düzeyleri gözlenmiş, dehidratasyon, hipotansiyon ya da elektrolit dengesizliği bildirimi olmamış ve QTc aralığında klinik açıdan anlamlı herhangi bir etki söz konusu olmamıştır. Hipoglisemi insidansı plasebo ile benzer olmuştur. Sağlıklı bireylerde ve tip 2 diabetes mellitusu olan bireylere 2 hafta süreyle 100 mg'a (maksimum önerilen insan dozunun 10 katı) varan günde tek doz rejiminin uygulandığı klinik çalışmalarda, hipoglisemi insidansı plaseboya göre hafif derecede daha yüksek olmuş ve dozla ilişkili olmadığı görülmüştür. Dehidratasyon, hipotansiyon dahil advers reaksiyonların oranları plasebo ile benzer olmuş, böbrek fonksiyonu biyolojik göstergeleri ve serum elektrolitleri gibi laboratuvar parametrelerinde klinik olarak anlamlı, dozla bağlantılı değişiklikler olmamıştır.
Doz aşımı durumunda, hastanın klinik durumunun gerektirdiği şekilde uygun destekleyici tedavi başlatılmalıdır. Dapagliflozinin hemodiyaliz ile vücuttan uzaklaştırılması çalışılmamıştır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diyabet tedavisinde kullanılan ilaçlar, sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleri
ATC kodu: A10BK01
Etki mekanizması
Dapagliflozin yüksek derecede potent (Ki: 0,55 nM), selektif ve geri dönüşümlü SGLT2 inhibitörüdür.
Dapagliflozinle sağlanan SGLT2 inhibisyonu, sodyum reabsorbsiyonunda eşzamanlı bir azalmayla, proksimal renal tübülde glomerüler filtrattan glukoz reabsorbsiyonunu azaltır ve üriner glukoz ekskresyonu ve ozmotik diürez ortaya çıkarır. Dolayısıyla dapagliflozin distal tübüle sodyum taşınmasını arttırır ve bu da tübüloglomerüler geribildirimi arttırır ve intraglomeruler basıncı azaltır. Bu, ozmotik diürez ile birlikte, aşırı volüm yüklemesinde azalma, kan basıncında düşüş ve ön yük ve son yükte azalma sağlar ve bunlar kardiyak yeniden modelleme ve renal fonksiyonu koruma üzerinde yararlı etkiler ortaya çıkarabilir. Diğer etkiler arasında hematokrit artışı ve vücut ağırlığında azalma bulunur. DAPA-HF ve DAPA-CKD çalışmalarında ortaya konmuş olduğu gibi, dapagliflozinin kardiyak ve renal faydaları yalnızca kan glukozu düşürücü etkiye bağımlı değildir ve diyabet hastaları ile sınırlı değildir.
Dapagliflozin, böbreklerden glukoz reabsorpsiyonunu azaltarak gerek açlık gerekse post- prandiyal glukoz düzeylerini düşürür, idrarla glukoz atılımı sağlar. Bu glukoz atılımı (glukuretik etki) ilk dozdan sonra gözlenir, 24 saatlik doz uygulama aralığı boyunca süreklidir ve tedavi süresince bu etki korunur. Böbrek tarafından bu mekanizma ile uzaklaştırılan glukoz miktarı, kan glukoz konsantrasyonu ve glomerüler filtrasyon hızına bağlıdır. Dolayısıyla glukoz düzeyi normal olan gönüllülerde dapagliflozinin hipoglisemiye yol açma eğilimi düşüktür. Dapagliflozin hipoglisemiye cevaben normal endojen glukoz üretimini bozmaz. Dapagliflozin, insülin sekresyonunundan ve insülin etkisinden bağımsız etki gösterir. Dapagliflozin ile yürütülen klinik çalışmalarda beta hücre fonksiyonu için homeostaz model değerlendirmesinde (HOMA beta hücre) düzelme gözlenmiştir.
SGLT2 selektif şekilde böbrekte eksprese olur. Dapagliflozin, periferik dokulara glukoz taşınmasında önemli diğer glukoz taşıyıcılarını inhibe etmez ve glukoz absorpsiyonundan sorumlu, bağırsaktaki başlıca taşıyıcı olan SGLT1'e göre SGLT2 için >1400 kat daha seçicidir.
Farmakodinamik etkiler
Sağlıklı bireylerde ve tip 2 diabetes mellitusu olan bireylerde dapagliflozin uygulamasından sonra idrarla atılan glukoz miktarında artışlar görülmüştür. 12 hafta süreyle tip 2 diabetes mellitusu olan bireylere uygulanan 10 mg/gün dapagliflozin dozunda gün başına yaklaşık 70 g glukoz atılmıştır (280 kilokalori/gün'e eşdeğer). İki yıl boyunca 10 mg/gün dapagliflozin verilen tip 2 diabetes mellitusu olan bireylerde glukoz atılımının korunduğu yönünde kanıtlar görülmüştür.
Tip 2 diabetes mellitusu olan bireylerde dapagliflozin ile sağlanan üriner glukoz atılımı ayrıca ozmotik diüreze ve idrar hacminde artışa neden olur. 10 mg dapagliflozin ile tedavi edilen tip 2 diabetes mellitusu olan bireylerdeki idrar hacmi artışları 12 hafta süreyle korunmuştur ve yaklaşık 375 mL/gün düzeyinde olmuştur. İdrar hacmindeki artış, idrarla sodyum atılımında, serum sodyum konsantrasyonlarında değişiklikler ile bağlantılı olmayan küçük ve geçici bir artış ile ilişkilendirilmiştir.
Ayrıca idrarla ürik asit atılımı da geçici olarak artmış (3 - 7 gün) ve buna, serum ürik asit konsantrasyonunda sürekli bir azalma eşlik etmiştir. 24. haftada serum ürik asit konsantrasyonlarındaki düşüşler -48,3 mikromol/L ila -18,3 mikromol/L (-0,87 mg/dL ila -0,33 mg/dL) aralığında olmuştur.
Klinik etkililik ve güvenlilik Tip 2 diabetes mellitus
Glisemik kontrolün iyileşmesi hem de kardiyovasküler ve renal morbidite ve mortalitenin azalması tip 2 diyabet tedavisinin bütünleyici parçalarıdır.
Dapagliflozinin glisemik etkililiğini ve güvenliliğini değerlendirmek üzere 7.056 tip 2 diyabeti olan bireyler ile on dört adet çift kör, randomize, kontrollü klinik çalışma gerçekleştirilmiştir: bu çalışmalarda 4.737 birey dapagliflozin ile tedavi edilmiştir. On iki çalışmada tedavi süresi 24 hafta olup; sekizinde 24 ila 80 haftalık uzatma dönemleri yer almıştır (toplamda 104 haftaya kadar çalışma süresi), bir çalışma 28 hafta tedavi süresi ve bir çalışma süresi 52 hafta olup; 52 haftalık ve 104 haftalık uzatma dönemleri yer almıştır (toplam çalışma süresi 208 hafta). Ortalama diyabet süresi 1,4 ila 16,9 yıl aralığında olmuştur. Çalışmaya katılan bireylerin
%50'sinde hafif derecede böbrek yetmezliği ve %11'inde orta derecede böbrek yetmezliği olmuştur. Bireylerin %51'i erkek, %84'ü Beyaz, %8'i Asyalı, %4'ü Siyah ve %4'ü diğer etnik gruplardandır. Bireylerin %81'inde vücut kitle indeksi (VKİ) ≥ 27'dir. Ayrıca, yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu olan hastalarda iki adet 12-haftalık, plasebo- kontrollü çalışma yürütülmüştür.
Kardiyovasküler ve renal olaylar üzerindeki etkinin değerlendirilmesi amacıyla, kanıtlanmış kardiyovasküler hastalığı bulunan veya bulunmayan, tip 2 diyabetli 17.160 hasta üzerinde plaseboyla karşılaştırmalı şekilde 10 mg dapagliflozin ile bir kardiyovasküler sonuç çalışması (DECLARE) gerçekleştirilmiştir.
Glisemik kontrol Monoterapi
Yeterli derecede kontrol edilemeyen tip 2 diabetes mellitusu olan bireylerde dapagliflozin ile monoterapinin güvenliliğini ve etkililiğini değerlendirme amacıyla çift kör, plasebo kontrollü, 24 hafta süreli (ek uzatma süreli) bir çalışma gerçekleştirilmiştir. Dapagliflozin ile günde bir kez tedavi sonucunda HbA1c'de plasebo ile karşılaştırıldığında istatistiksel olarak anlamlı düşüşler sağlanmıştır (p < 0,0001) (Tablo 2).
Uzatma döneminde HbA1c düşüşü 102. haftaya kadar sürmüştür. (10 mg dapagliflozin ve
plasebo için düzeltilmiş başlangıca göre ortalama değişiklik sırasıyla -%0,61 ve -%0,17).
Tablo 2. Monoterapi olarak dapagliflozinin plasebo kontrollü çalışmasının 24. hafta
![]()
sonuçları (LOCF)
![]()
Dapagliflozin 10 mg
Monoterapi
Plasebo
N | 70 | 75 |
HbA1c (%) |
|
|
Başlangıç (ortalama) | 8,01 | 7,79 |
Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) | -0,89 -0,66 (-0,96, -0,36) | -0,23 |
![]()
Başlangıca göre düzeltilen | 50,8 | 31,6 |
Vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 94,13 | 88,77 |
Başlangıca göre değişiklik | -3,16 | -2,19 |
Plaseboya göre fark | -0,97 |
|
(%95 GA) | (-2,2, 0,25) |
|
HbA1c < %7'ye ulaşan gönüllü yüzdesi
LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan bireylerde kurtarma öncesinde)
Kısa süreli çift kör dönemde, çift kör çalışma ilacından en az bir doz almış tüm randomize
bireyler
Başlangıçtaki değere göre düzeltilen küçük kareler ortalaması
p değeri < 0,0001; plasebo karşısında
İkincil sonlanma noktaları için ardışık test prosedürü nedeniyle istatistiksel anlamlılık
açısından değerlendirilmemiştir.
GA: Güven Aralığı
İlave kombinasyon tedavisi
52 haftalık, aktif kontrollü bir eşdeğerlik çalışmasında (52 ve 104 haftalık uzatma periyoduna sahip), glisemik kontrolün yetersiz olduğu bireylerde (HbA1c > %6,5 ve ≤ %10) metformine ilave tedavi olarak bir sülfonilüreye (glipizid) karşı, metformine ilave tedavi olarak dapagliflozin değerlendirilmiştir. Bulgular, glipizide kıyasla HbA1c'de başlangıçtan 52. haftaya kadar benzer bir ortalama azalmayı ve böylece eşdeğerliği göstermiştir (Tablo 3). 104. haftada, HbA1c'de başlangıca göre düzeltilmiş ortalama değişiklik dapagliflozin için -%0,32 ve glipizid için -
%0,14'tür. 208. haftada, Hb1Ac'de başlangıca göre düzeltilmiş ortalama değişiklik dapagliflozin için -%0,1 ve glipizid için %0,2'dir. 52. ve 104. ve 208. haftalarda, glipizid ile tedavi edilen grup ile (sırasıyla %40,8, %47, %50) karşılaştırıldığında dapagliflozin ile tedavi edilen grupta (sırasıyla %3,5, %4,3 ve %5) anlamlı olarak daha düşük bir birey oranında en az bir hipoglisemi olayı yaşanmıştır. 104. ve 208. haftada çalışmaya devam eden birey oranı dapagliflozin ile tedavi edilen grup için %56,2 ve %39,7 ve glipizid ile tedavi edilen grup için
%50 ve %34,6'dir.
![]()
Tablo 3. Metformine ilave tedavi olarak dapagliflozin ile glipizidi karşılaştıran aktif kontrollü çalışmanın 52. hafta sonuçları (LOCF)
Parametre
Dapagliflozin
+ metformin
Glipizid
+ metformin
N 400 401
HbA1c (%) Başlangıç (ortalama) |
7,69 |
7,74 |
Başlangıca göre değişiklik Glipizid + metforminden farkı (%95 GA) | -0,52 0,00 (-0,11, 0,11) | -0,52 |
Vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 88,44 | 87,60 |
Başlangıca göre değişiklik Glipizid + metforminden farkı (%95 GA) | -3,22 -4,65 (-5,14, -4,17) | 1,44 |
![]()
LOCF: İleri aktarılan son gözlem
Başlangıçta ve başlangıçtan sonra en az bir etkililik ölçümü olan randomize ve tedavi
edilmiş bireyler
Başlangıçtaki değere göre düzeltilen ek küçük kareler ortalaması
Glipizid + metformin ile eşit etkililik
p değeri < 0,0001
GA: Güven Aralığı
Metformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak dapagliflozin, plasebo alan bireyler ile karşılaştırıldığında 24 haftada HbA1c'de istatistiksel olarak anlamlı düşüşler sağlamıştır (p < 0,0001; Tablo 4, 5 ve 6).
24. haftada HbA1c'de gözlenen azalmalar, 48 haftalık verilere (glimepirid) ve 104 haftalık verilere (insülin) sahip ilave tedavi kombinasyonu çalışmalarında (glimepirid ve insülin) korunmuştur. 48. haftada sitagliptine ilave edildiğinde (metforminle veya metforminsiz), 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -
%0,3'tür ve %0,38'dir. Metformine ilave edilme çalışması için, HbA1c'deki azalmalar
102. haftaya kadar korunmuştur (10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -%0,78 ve %0,02). İnsülin için 104. haftada (ilave oral glukoz düşürücü tıbbi ürünler varlığında veya yokluğunda), HbA1c'deki azalmalara ilişkin olarak 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -%0,71 ve
-%0,06'dır. 48 ve 104. haftalarda insülin dozu 76 IU/gün'lük ortalama bir dozda 10 mg dapagliflozin ile tedavi edilen bireylerde başlangıca göre stabil kalmıştır. Plasebo grubunda 48 ve
104. haftalarda başlangıca göre sırasıyla 10,5 IU/gün ve 18,3 IU/gün'lük (ortalama doz 84 ve 92 IU/gün) ortalama bir artış söz konusudur. 104. haftada çalışmada kalan birey oranı 10 mg dapagliflozin ile tedavi edilen grup için %72,4'tür ve plasebo grubu için %54,8'dir.
Tablo 4. Metformin ya da sitagliptin (metforminle veya metforminsiz) ile ilave kombinasyon tedavi olarak dapagliflozine yönelik plasebo kontrollü çalışmaların 24 haftalık sonuçları (LOCF)
![]()
İlave kombinasyon tedavisi
MetforminDPP-4 inhibitör (sitagliptin) ± metformin
Plaseboya göre fark
-0,54 -0,48
|
| Dapagliflozin 10 mg | Plasebo | Dapagliflozin 10 mg | Plasebo |
N |
| 135 | 137 | 223 | 224 |
HbA1c (%) Başlangıç (ortalama) |
|
7,92 |
8,11 |
7,90 |
7,97 |
Başlangıca göre değişiklik | -0,84 | -0,30 | -0,45 | 0,04 |
(-0,74, -0,34) (-0,62, -0,34)
![]()
HbA1c < %7'ye ulaşan gönüllü yüzdesi
Başlangıca göre düzeltilen 40,6** 25,9
Vücut ağırlığı (kg) Başlangıç (ortalama) | 86,28 | 87,74 | 91,02 | 89,23 |
-2,86 -1,97 | -0,89 | -2,14 | -0,26 | |
Başlangıca göre değişiklik | ||||
Plaseboya göre fark | (-2,63, -1,31) |
| (-2,37, -1,40) |
|
Metformin ≥ 1.500 mg/gün
Sitagliptin 100 mg/gün
LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan gönüllülerde kurtarma
öncesinde)
Kısa süreli çift kör dönemde çift kör çalışma ilacından en az bir doz almış olan tüm randomize bireyler
Başlangıçtaki değere göre düzeltilen küçük kareler ortalaması
GA: Güven Aralığı
Tablo 5. 24 haftalık, plasebo-kontrollü, ek sülfonilüre (glimepirid) ya da metformin ve bir sülfonilüre ile kombine dapagliflozin çalışmalarının sonuçları
| Ek kombinasyon | |||
Sülfonilüre (glimepirid |
) | Sülfonilüre +metformin | ||
Dapagliflozin 10 mg | Plasebo | Dapagliflozin 10 mg | Plasebo | |
N | 151 | 145 | 108 | 108 |
HbA1c (%)
|
|
|
|
|
Başlangıç değeri | 8,07 | 8,15 | 8,08 | 8,24 |
(ortalama) |
|
|
|
|
Başlangıç seviyesine | -0,82 | -0,13 | -0,86 | -0,17 |
göre değişim |
|
|
|
|
Plaseboya göre farkı | -0,68 |
| -0,69 |
|
(%95 güven aralığı) | (-0,86,-0,51) |
| (-0,89,-0,49) |
|
HbA1c < 7% (LOCF)
ulaşan denekler (%) Başlangıç değerine göre düzeltilmiş |
31,7 |
13,0 |
31,8 |
11,1 |
Vücut ağırlığı (kg) |
|
|
|
|
(LOCF) |
|
|
|
|
Başlangıç değeri | 80,56 | 80,94 | 88,57 | 90,07 |
(ortalama) |
|
|
|
|
Başlangıç seviyesine | -2,26 | -0,72 | -2,65 | -0,58 |
göre değişim |
|
|
|
|
Plaseboya göre farkı | -1,54 |
| -2,07 |
|
(%95 güven aralığı) | (-2,17, -0,92) |
| (-2,79, -1,35) |
|
glimepirid 4 mg/gün;
Metformin (çabuk- ya da uzatılmış-salımlı formülasyonlar) >1500 mg/gün, ek olarak, deneye katılmadan önce en az 8 hafta boyunca, maksimum dozun en az yarısı olacak şekilde, maksimum tolere edilebilir dozda bir sülfonilüre
Başlangıç seviyesi ve en az 1 başlangıç sonrası etkinlik ölçümü olan randomize ve tedavi edilen hastalar
1. ve 2. kolonlar; LOCF metoduyla analiz edilmiş HbA1c (bkz. dipnot d); 3. ve 4. kolonlar
LRM metoduyla analiz edilmiş HbA1c (bkz. dipnot e)
Başlangıç değerine göre düzeltilmiş en küçük kareler ortalaması
LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan bireylerde kurtarma öncesinde)
BTÖ: Boylamsal tekrarlanmış ölçümler analizi
plasebo + oral glukoz-düşürücü tıbbi ürün(ler)e göre p-değeri < 0,0001
![]()
Tablo 6. İnsülin ile kombinasyon halinde (tek başına veya oral glukoz düşürücü tıbbi ürünlerle birlikte) dapagliflozine yönelik plasebo kontrollü çalışmada 24. hafta sonuçları (LOCF)
Parametre
10 mg dapagliflozin
+ insülin
± oral glukoz düşürücü
tıbbi ürünler
Plasebo
+ insülin
± oral glukoz düşürücü tıbbi
ürünler
![]()
HbA1c (%) Başlangıç (ortalama) |
8,58 |
8,46 |
Başlangıca göre değişiklik Plaseboya göre fark | -0,9
-0,6 | -0,3 |
(%95 GA) | (-0,74, -0,45) |
|
Vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 94,63 | 94,21 |
Başlangıca göre değişiklik Plaseboya göre fark | -1,67
-1,68 | 0,02 |
(%95 GA) | (-2,19, -1,18) |
|
N 194 193
Ortalama + günlük
insülin dozu (IU) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark
(%95 GA)
Ortalama günlük insülin dozunda en az %10 düşüş olan bireyler (%)
![]()
77,96
-1,16
-6,23
(-8,84, -3,63)
19,7**
73,96
5,08
11,0
LOCF: İleri aktarılan son gözlem (eğer gerekmişse ilk insülin dozu yükseltiminden önce veya yükseltildiği gün)
Kısa süreli çift kör dönemde, çift kör çalışma ilacından en az bir doz almış olan tüm randomize bireyler
Oral glukoz düşürücü tıbbi ürün varlığı ve başlangıçtaki değere düzeltilen küçük kareler ortalaması
p değeri < 0,0001; plasebo + insülin ± oral glukoz düşürücü tıbbi ürüne karşı
p değeri < 0,05; plasebo + insülin ± oral glukoz düşürücü tıbbi ürüne karşı
İnsülin rejimlerinde (kısa etkili, orta etkili ve bazal insülin dahil) dozun yükseltilmesine yalnızca
bireylerin önceden belirlenmiş olan açlık plazma glukozu (AKŞ) kriterlerini karşılaması halinde
izin verilmiştir.)
Bireylerin %50'si başlangıçta insülin monoterapisindedir; %50'si insüline ilave olarak 1 veya 2 oral glukoz düşürücü tıbbi ürün(ler) kullanmaktadır. İkinci olarak tanımlanan gruptakilerin
%80'i tek başına metformin, %12'si metformin + sülfonilüre tedavisindedir ve kalanlar diğer oral glukoz düşürücü tıbbi ürünler kullanmaktadır.
İlaç-naif hastalarda metformin ile kombinasyon halinde
İlaç-naif hastalarda metformin ile kombinasyon halinde dapagliflozin'in (5 mg veya 10 mg) etkililik ve güvenliliğini her iki ilacın tek başına uygulanmasına kıyasla değerlendirmek üzere iki
aktif kontrollü, 24 haftalık çalışmaya yeterli düzeyde kontrol altına alınmayan tip 2 diyabetli (HbA1c
≥ %7,5 ve ≤ %12) toplam 1.236 ilaç-naif hasta katılmıştır.
Metformin (günde 2000 mg'a kadar) ile kombinasyon halinde dapagliflozin 10 mg tedavisi, kombinasyonun ayrı ayrı bileşenlerine kıyasla HbA1c'de anlamlı iyileşme sağlamış (Tablo 7) ve açlık plazma glukozunda (AKŞ) (kombinasyonun ayrı ayrı bileşenlerine kıyasla) ve vücut ağırlığında (metformine kıyasla) daha fazla düşüşle sonuçlanmıştır.
![]()
Tablo 7: İlaç-naif hastalarda dapagliflozin ve metformin kombinasyonunu araştıran aktif kontrollü bir çalışmada 24. hafta sonuçları (LOCF)
Parametre
Dapagliflozin 10 mg + metformin
Dapagliflozin 10 mg
Metformin
N | 211 | 219 | 208 |
HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 9,10 | 9,03 | 9,03 |
Başlangıçtan itibaren | -1,98 | -1,45 | -1,44 |
değişime Dapagliflozine kıyasla fark |
| â0,53 (â0,74, â0,32) |
|
(%95 GA) Metformine kıyasla fark (%95 CGA) |
| â0,54 (â0,75, â0,33) | â0,01 (â0,22, 0,20) |
LOCF: son gözlemin ileriye taşınması (kurtarılan hastalar için kurtarma tedavisinden önce).
Kısa süreli çift kör periyotta en az bir doz çift kör çalışma ilacı alan tüm randomize hastalar.
Başlangıç değerleri için ayarlanan en küçük kareler ortalaması.
*p-değeri <0,0001.
Uzatılmış salımlı eksenatid ile kombinasyon tedavisi
Yirmi sekiz haftalık çift kör, aktif komparatör-kontrollü bir çalışmada, dapagliflozin ve uzatılmış salımlı eksenatid (bir GLP-1 reseptör agonisti) kombinasyonu, tek başına metformin ile yeterli glisemik kontrol sağlanamayan (HbA1c ≥%8 ve ≤ %12) hastalarda tek başına dapagliflozin ve uzatılmış salımlı eksenatid ile karşılaştırılmıştır. Tüm tedavi gruplarında başlangıca kıyasla HbA1c'de düşüş olmuştur. Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu uygulanan grupta, başlangıca göre HbA1c'de tek başına dapagliflozin ve uzatılmış salımlı eksenatid ile görülenden daha fazla düşüş gözlenmiştir (Tablo 8).
Tablo 8. Metformin ile kombinasyon halinde tek başına dapagliflozin ve uzatılmış salımlı eksenatide kıyasla dapagliflozin ve uzatılmış salımlı eksenatid kombinasyonunu araştıran 28 haftalık çalışma sonuçları (tedavi amaçlanmış hastalar)
| Dapagliflozin 10 mg QD | Dapagliflozin 10 mg QD | Uzatılmış salımlı eksenatid 2 mg |
| + | + | QW |
| uzatılmış salımlı | plasebo QW | + |
Parametre | eksenatid 2 mg QW |
| plasebo QD |
N | 228 | 230 | 227 |
HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 9,29 | 9,25 | 9,26 |
Başlangıçtan itibaren değişim |
-1,98 |
-1,39 |
-1,6 |
Kombinasyon ve tekli tıbbi ürün arasında başlangıçtan itibaren değişimde ortalama fark (%95 GA) |
| -0,59 (-0,84, -0,34) | -0,38 (-0,63, -0,13) |
HbA1c <%7'ye ulaşan |
|
|
|
gönüllüler (%) | 44,7 | 19,1 | 26,9 |
Vücut ağırlığı (kg) |
|
|
|
Başlangıç (ortalama) | 92,13 | 90,87 | 89,12 |
Başlangıçtan itibaren değişim |
-3,55 |
-2,22 |
-1,56 |
Kombinasyon ve tekli tıbbi |
|
|
|
ürün arasında başlangıçtan itibaren değişimde ortalama |
|
-1,33 |
-2 |
fark (%95 GA) |
| (-2,12, -0,55) | (-2,79, -1,2) |
QD=günde bir kez, QW=haftada bir kez, N=hasta sayısı, GA=güven aralığı.
Ayarlanmış en küçük kareler ortalamaları (LS Ortalamaları) ve 28. haftada başlangıç değerlerinden itibaren değişimde tedavi grupları arasındaki farklar, tekrarlı ölçümlere sahip bir karışık modelle (MMRM) modellenmiş ve bu modelde tedavi, bölge, başlangıç HbA1c grubu (< %9,0 veya ≥ %9,0), hafta ve hafta bazında tedavi etkileşimi sabit faktörler, başlangıç değerleri ise eşdeğişken olarak kullanılmıştır.
p < 0,001, p < 0,01.
P-değerlerinin tümü üst katlılık için ayarlanmış p-değerleridir.
Analizler kurtarma tedavisinden sonraki ölçümleri ve çalışma ilacının erken sonlandırılmasından sonra yapılan ölçümleri içermez.
Açlık plazma glukozu
Monoterapi olarak veya metformin, glimepiride, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak 10 mg dapagliflozin ile tedavi sonucunda, AKŞ düzeylerinde plasebo ile karşılaştırıldığında (-0,33 mmol/L ila 0,21 mmol/L [-6 mg/dL ila 3,8 mg/dL]) istatistiksel olarak anlamlı düşüşler meydana gelmiştir (-1,9 mmol/L ila -1,2 mmol/L [-34,2 mg/dL ila -21,7 mg/dL]). Bu etki, tedavinin birinci haftasında gözlenmiştir ve 104. haftaya kadar uzatılan çalışmalarda devam etmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu 28. hafta AKŞ'de anlamlı şekilde daha fazla düşüşle sonuçlanmıştır: -3,66 mmol/l (-65,8 mg/dl), tek başına dapagliflozin için -2,73 mmol/l (-49,2 mg/dl) ile (p < 0,001) ve tek başına eksenatid için - 2,54 mmol/l (- 45,8 mg/dl) ile (p < 0,001) karşılaştırılmalı.
Yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 m olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada FPG'de azalmalar ortaya çıkarmıştır: plaseboyla elde edilen -0,27 mmol/L'ye karşılık (-4,87 mg/dL) -1,19 mmol/L (- 21,46 mg/dL) (p=0,001).
Post-prandiyal glukoz
Glimepiride ilave olarak 10 mg dapagliflozin ile tedavi sonucunda 24. haftada 2 saatlik post- prandiyal glukoz değerinde istatistiksel olarak anlamlı düşüşler sağlanmış olup bu etki 48. haftaya kadar devam etmiştir.
Sitagliptine (metforminle veya metforminsiz) ilave olarak 10 mg dapagliflozin tedavisi, 24 haftada, 2 saatlik post-prandiyal glukoz düzeyinde azalmalar ile sonuçlanmış olup bu etki
48. haftaya kadar devam etmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla 28. haftada 2. saatlik post-prandiyal glukoz düzeyinde anlamlı şekilde daha fazla düşüşle sonuçlanmıştır.
Vücut ağırlığı
Metformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) veya insüline ilave olarak 10 mg dapagliflozin, 24. haftada vücut ağırlığında istatistiksel olarak anlamlı düşüş sağlamıştır (p < 0,0001, Tablo 4 ve 5). Bu etkiler uzun süreli çalışmalarda korunmuştur. 48. haftada, plaseboya kıyasla sitagliptine ilave tedavi olarak (metforminle veya metforminsiz) dapagliflozin için fark -2,22 kg'dır. 102. haftada, plaseboya kıyasla metformine ilave tedavi olarak veya plaseboya kıyasla insüline ilave olarak dapagliflozin için fark sırasıyla -2,14 ve -2,88 kg'dır.
Aktif kontrollü bir eşdeğerlik çalışmasında metformine ilave tedavi olarak dapagliflozin, glipizide kıyasla 52. haftada vücut ağırlığında -4,65 kg'lık istatistiksel olarak anlamlı bir azalma (p < 0,0001, Tablo 3) ile sonuçlanmış ve bu, 104. ve 208. haftada korunmuştur (sırasıyla -5,06 kg ve -4,38 kg ).
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla anlamlı şekilde daha fazla kilo kaybı ile sonuçlanmıştır (Tablo 8).
Vücut bileşimini değerlendirmek üzere çift enerjili X-ışını absorpsiyometrisinin (DXA) kullanıldığı, 182 diyabetik birey ile gerçekleştirilen 24 haftalık bir çalışma, yağsız doku veya sıvı kaybı yerine DXA ile ölçüldüğünde, plasebo ve metformin ile karşılaştırıldığında 10 mg dapagliflozin ve metformin ile sırasıyla vücut ağırlığında ve vücut yağ kütlesinde düşüşlerin olduğunu göstermiştir. Dapagliflozin ve metformin ile tedavi sonucunda, manyetik rezonans görüntüleme alt çalışmasında plasebo ve metformin tedavisi ile karşılaştırıldığında iç organ yağ dokusunda sayısal azalma gözlenmiştir.
Kan basıncı
13 plasebo kontrollü çalışmanın önceden tanımlanmış olan birleştirilmiş analizinde, 24. haftada 10 mg dapagliflozin ile tedavi, sistolik kan basıncında başlangıca göre -3,7 mmHg ve diyastolik kan basıncında başlangıca göre -1,8 mmHg değişiklik ile sonuçlanırken aynı değerler plasebo grubu için sırasıyla -0,5 mmHg ve -0,5 mmHg olmuştur. 104 haftaya kadar benzer azalmalar gözlenmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, tek başına dapagliflozin (- 1,8 mmHg, p < 0,05) ve tek başına uzatılmış salımlı eksenatide (-1,2 mmHg, p < 0,01) kıyasla
28. haftada sistolik kan basıncında anlamlı şekilde daha fazla düşüşle (-4,3 mmHg) sonuçlanmıştır.
Yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu (bir çalışmada bir ACE-I ya da ARB ile önceden mevcut stabil tedaviye ve diğer çalışmada ACE-I ya da ARB artı bir ilave antihipertansif tedaviye rağmen) olan toplam 1.062 hasta, iki adet 12-haftalık, plasebo- kontrollü çalışmada dapagliflozin 10 mg ya da plasebo ile tedavi edilmiştir. Her iki çalışmada,
12. haftada dapagliflozin 10 mg artı alışıldık antidiyabetik tedavi, HbA1c'de düzelme sağlamış ve plasebo açısından düzeltilmiş sistolik kan basıncında sırasıyla ortalama 3,1 ve 4,3 mmHg azalma sağlamıştır.
Yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 m olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada oturur pozisyondaki
sistolik kan basıncında azalmalar ortaya çıkarmıştır: plaseboyla elde edilen -1,7 mmHg'ye
karşılık -4,8 mmHg (p < 0,05).
Orta derecede böbrek yetmezliği görülen hastalarda glisemik kontrol KBH 3A (eGFR ≥ 45 ila
< 60 mL/dak/1,73 m)
Dapagliflozinin etkililiği yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila
< 60 mL/dak/1,73 m olan ve olağan bakımla yeterli glisemik kontrol sağlanamayan diyabetli hastalarda değerlendirilmiştir. Dapagliflozinle uygulanan tedavi HbA1c'de ve vücut ağırlığında plaseboya kıyasla azalmalar ortaya çıkarmıştır (Tablo 9).
Tablo 9. eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 m olan diyabetli hastalarda dapagliflozinle yapılan plasebo kontrollü bir çalışmanın 24. hafta sonuçları
![]()
Dapagliflozin 10 mg
Plasebo
N | 159 | 161 |
HbA1c (%) |
|
|
Başlangıç (ortalama) | 8,35 | 8,03 |
Başlangıca göre değişiklik Plaseboya kıyasla fark | -0,37 -0,34 | -0,03 |
(%95 GA) | (-0,53, -0,15) |
|
Vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 92,51 | 88,3 |
Başlangıca göre değişiklik yüzdesi Plaseboya kıyasla fark yüzdesindeki değişiklik (%95 GA) | -3,42 -1,43 (-2,15, -0,69) | -2,02 |
Başlangıç HbA1c değeri ≥%9 olan hastalar
Başlangıçta HbA1c değeri ≥%9 olan bireylerle gerçekleştirilen önceden tanımlanmış olan bir analizde 10 mg dapagliflozin ile tedavi sonucunda 24. haftada HbA1c'de istatistiksel olarak anlamlı düşüşler elde edilmiştir (monoterapi olarak: düzeltilmiş başlangıca göre ortalama değişiklik: 10 mg dapagliflozin ve plasebo için sırasıyla -%2,04 ve %0,19; metformine ilave tedavi olarak: düzeltilmiş başlangıca göre ortalama değişiklik: dapagliflozin ve plasebo için sırasıyla -%1,32 ve -%0,53).
Kardiyovasküler ve renal sonuçlar
Dapagliflozinin Kardiyovasküler Olaylar Üzerindeki Etkisi (DECLARE) çalışması, mevcut arka plan tedavisine eklendiğinde dapagliflozinin kardiyovasküler ve renal sonuçlar üzerinde plaseboya kıyasla etkisini belirlemek üzere gerçekleştirilmiş olan uluslararası, çok merkezli, randomize, çift kör, plasebo kontrollü bir klinik çalışmaydı. Tüm hastalarda tip 2 diyabet ve en az iki ilave kardiyovasküler risk faktörü (erkeklerde yaşın ≥55 olması veya kadınlarda yaşın
≥60 olması ve dislipidemi, hipertansiyon ya da eşzamanlı tütün kullanımı durumlarından bir veya daha fazlasının mevcut olması) ya da kanıtlanmış kardiyovasküler hastalık mevcuttu.
Randomize edilen 17.160 hastanın 6.974'ü (%40,6) kanıtlanmış kardiyovasküler hastalığa sahipti, 10.186'sında ise (%59,4) kanıtlanmış kardiyovasküler hastalık mevcut değildi. 8582 hasta 10 mg dapagliflozine, 8.578'i ise plasebo randomize edildi ve medyan 4,2 yıl süresince takip edildi.
Çalışma popülasyonunun ortalama yaşı 63,9'du ve %37,4'ü kadındı. Toplamda %22,4'ü ≤ 5 yıldır diyabetliydi ve diyabetin ortalama süresi 11,9 yıldı. Ortalama HbA1c %8,3, ortalama beden kütle indeksi (BKİ) ise 32,1 kg/m'ydi.
Başlangıçta hastaların %10'u kalp yetersizliği öyküsüne sahipti. Ortalama eGFR 85,2 mL/dak/1,73 m'ydi, hastaların %7,4'ünde eGFR <60 mL/dak/1,73 m'ydi, hastaların
%30,3'ünde ise mikroalbüminüri veya makroalbüminüri (UACR sırasıyla ≥ 30 ila ≤ 300 mg/g veya > 300 mg/g) mevcuttu.
Hastaların çoğu (%98) başlangıçta metformin (%82), insülin (%41) ve sülfonilüreyi (%43) içeren bir ya da daha fazla diyabetik ilaç kullanmıştır.
Birincil sonlanma noktaları, kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inmeden (MACE) oluşan ilk olaya kadar geçen süre ve kalp yetersizliği için hastane yatışı ya da kardiyovasküler ölümden oluşan ilk olaya kadar geçen süre olmuştur. İkincil sonlanma noktaları bir renal bileşik sonlanma noktası ve tüm nedenlere bağlı mortalite olmuştur.
Majör advers kardiyovasküler olaylar
Dapagliflozin 10 mg, plaseboya karşı kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inme bileşimi için daha kötü olmamıştır (tek-taraflı p < 0,001).
Kalp yetersizliği veya kardiyovasküler ölüm
Dapagliflozin 10 mg, kalp yetersizliğine bağlı hastane yatışı ya da kardiyovasküler ölüm bileşiminin önlenmesinde plaseboya karşı üstünlük göstermiştir (Şekil 1). Tedavi etkisindeki farklılığın kalp yetmezliği nedeniyle hastaneye yatıştan kaynaklandığına ve kardiyovasküler ölüm açısından açık bir farklılık olmadığına işaret etmektedir (Şekil 2).
Dapagliflozinin plaseboya kıyasla sahip olduğu tedavi yararı hem kanıtlanmış kardiyovasküler hastalığı bulunan hem de bulunmayan hastalarda ve hem başlangıçta kalp yetmezliği bulunan hem de bulunmayan hastalarda gözlenmiştir. Bu yarar yaş, cinsiyet, böbrek
fonksiyonu (eGFR) ve bölgenin aralarında olduğu kilit alt gruplarda tutarlılık sergilemiştir.
Şekil 1: Kalp yetersizliği nedeniyle ilk hastaneye yatışa veya kardiyovasküler ölüme kadar geçen süre
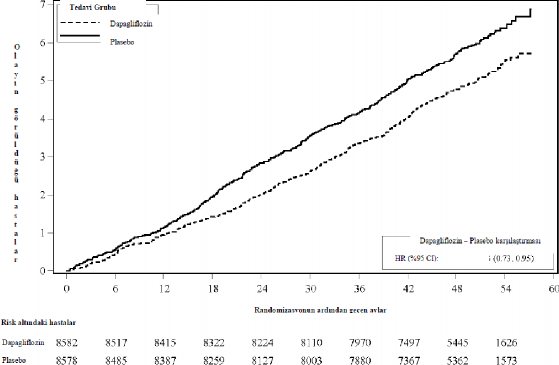
Risk altındaki hastalar periyodun başlangıcındaki risk altındaki hastaların sayısıdır. HR=Tehlike oranı GA=güven aralığı.
Birincil ve ikincil sonlanma noktalarının sonuçları Şekil 2'de gösterilmektedir. MACE için dapagliflozinin plasebo karşısındaki üstünlüğü gösterilmemiştir (p=0,172). Bu nedenle renal bileşik son nokta ve tüm nedenlere bağlı mortalite doğrulayıcı test prosedürünün bir parçası olarak test edilmemiştir.
Şekil 2: Primer birleşik sonlanma noktaları ile bunların bileşenleri ve sekonder sonlanma
noktaları ile bunların bileşenleri üzerindeki tedavi etkileri
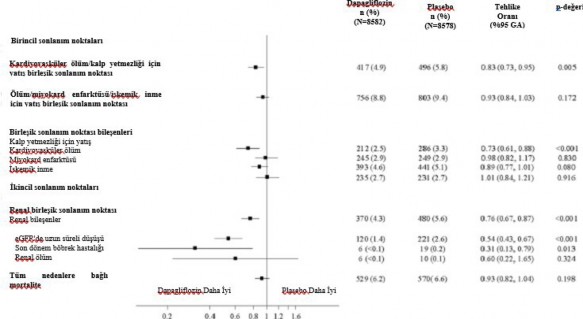
Renal birleşik sonlanma noktası şu şekilde tanımlanmıştır: eGFR'de devam eden doğrulanmış
≥ %40'lık düşüş (eGFR <60 mL/dak/1,73 m'ye) ve/veya son dönem böbrek hastalığı (≥ 90 gün diyaliz veya böbrek nakli, devam eden doğrulanmış eGFR < 15 mL/dak/1,73m) ve/veya renal ya da kardiyovasküler ölüm.
p değerleri primer sonlanma noktaları için iki yanlı p değerleridir, sekonder sonlanma noktaları ve tüm tekli bileşenler içinse nominal p değerleridir. İlk olay meydana gelene kadar geçen süre Cox orantılı tehlikeler modeli kullanılarak analiz edilmiştir. Tekli bileşenler için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısıdır ve birleşik sonlanma noktasındaki olayların sayısına eklenmez. GA=güven aralığı.
Nefropati
Dapagliflozin doğrulanmış devam eden eGFR düşüşü, son dönem böbrek hastalığı, renal veya kardiyovasküler ölüm birleşik olaylarının insidansını azaltmıştır. Gruplar arasındaki farklılık renal bileşenler olan devam eden eGFR düşüşü, son dönem böbrek hastalığı ve renal ölümde ortaya çıkan azalmalardan kaynaklanmıştır (Şekil 2).
Nefropatiye kadar geçen süre için tehlike oranı (HR) (sürekli eGFR azalması, son evre böbrek hastalığı ve renal ölüm) plaseboya karşı dapagliflozin için 0,53 (%95 GA 0,43, 0,66) olmuştur.
Ayrıca, plasebo ile karşılaştırıldığında dapagliflozin yeni başlangıçlı sürekli albüminüriyi azaltmış (HR 0,79 [%95 GA 0,72, 0,87]) ve makroalbüminüride daha fazla gerileme
sağlamıştır (HR 1,82 [%95 GA 1,51, 2,2]).
Kalp yetersizliği
Dapagliflozin ve Kalp Yetersizliğinde Advers Sonuçların Önlenmesi (DAPA-HF) çalışması, düşük ejeksiyon fraksiyonu (sol ventriküler ejeksiyon fraksiyonu [LVEF] ≤ %40) ile seyreden kalp yetmezliği (New York Kalp Birliği [NYHA] fonksiyonel sınıfı II-IV) görülen hastalar üzerinde arka plan standart tedaviye eklenen dapagliflozinin kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşme insidansı üzerinde plaseboya kıyasla etkisini belirlemek amacıyla gerçekleştirilmiş olan uluslararası, çok merkezli, randomize, çift kör, plasebo kontrollü bir
çalışmaydı.
4.744 hastanın 2.373'ü 10 mg dapagliflozine, 2.371'i ise plaseboya randomize edildi ve medyan 18 aylık bir süre boyunca takip edildi. Çalışma popülasyonunun medyan yaşı 66'ydı ve %77'si erkekti.
Başlangıçta hastaların %67,5'i NYHA sınıf II, %31,6'sı sınıf III, %0,9'u ise sınıf IV şeklinde sınıflandırıldı, medyan LVEF %32'ydi, kalp yetmezliklerinin %56'sının iskemik, %36'sının iskemik dışı olduğu görüldü, %8'inin ise etiyolojisi belirlenemedi. Her bir tedavi grubundaki hastaların %42'si tip 2 diyabet öyküsüne sahipti ve her bir gruptaki hastaların ilave bir %3'ü hem kayıt hem de randomizasyon sırasında ≥ %6,5 seviyesinde HbA1c değerine dayanılarak tip 2 diyabete sahip şeklinde sınıflandırıldı. Hastalara standart tedavi uygulanmaktaydı; hastaların
%94'ü ACE-I, ARB veya anjiyotensin reseptörü-neprilisin inhibitörü (ARNI, %11),
%96'sı beta-bloker, %71'i mineralokortikoid reseptör antagonisti (MRA), %93'ü diüretik ile tedavi görmekteydi, %26'sında ise implante edilebilir bir cihaz (defibrilatör fonksiyonu ile) bulunmaktaydı.
Kayıt sırasında eGFR değeri ≥ 30 mL/dak/1,73 m olan hastalar çalışmaya dahil edildi. Ortalama eGFR değeri 66 mL/dak/1,73 m'ydi, hastaların %41'inde eGFR < 60 mL/dak/1,73 m,
%15'inde ise eGFR < 45 mL/dak/1.73 m olarak tespit edildi.
![]()
Kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşme
Dapagliflozin, kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetersizliği nedeniyle acil servis ziyareti primer birleşik sonlanma noktasını önlemek konusunda plaseboya kıyasla üstünlük sergilemiştir (HR 0,74 [%95 GA 0,65, 0,85], p<0,0001). Bu etki erken dönemde gözlenmiştir ve çalışma süresince varlığını korumuştur (Şekil 3).
Şekil 3: Kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetmezliği nedeniyle acil hastane ziyaretini içeren primer birleşik sonlanma noktası ilk ortaya çıkana kadar geçen süre
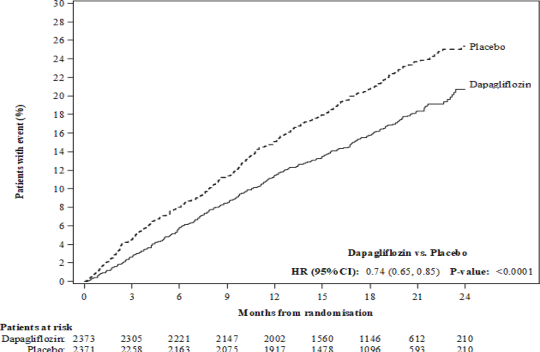
Kalp yetersizliği nedeniyle acil hastane ziyareti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavi gerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır.
Risk altındaki hastalar periyodun başlangıcında risk altında olan hastaların sayısıdır.
Primer birleşik sonlanma noktasının üç bileşeni de tedavi etkisine ayrı ayrı katkıda bulunmuştur (Şekil 4). Birkaç acil kalp yetmezliği ziyareti olmuştur.
Şekil 4. Primer birleşik sonlanma noktası, onun bileşenleri ve tüm nedenlerden kaynaklanan mortaliteye ilişkin tedavi etkileri
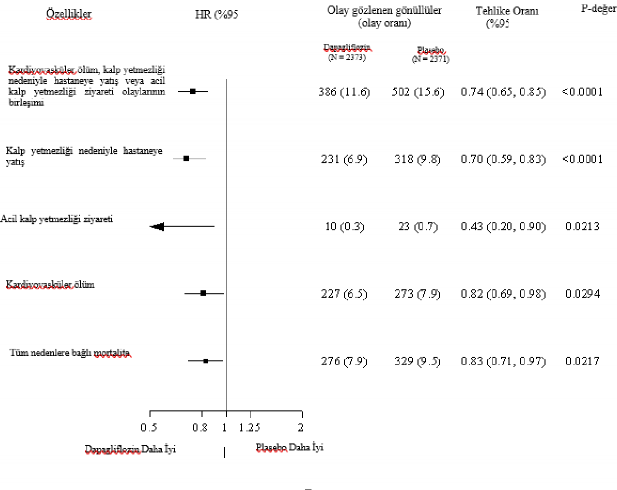
Kalp yetersizliği nedeniyle acil hastane ziyareti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavi gerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır.
İlk olayların sayısı, her bir bileşene ilişkin ilk olayların gerçek sayısıdır ve toplamı birleşik sonlanma noktasındaki olay sayısına eşit değildir.
Olay oranları, 100 hasta yılı takip başına olay gözlenen gönüllülerin sayısı şeklinde sunulmaktadır.
Tek tek bileşenlere ve tüm nedenlerden kaynaklanan mortaliteye ilişkin p değerleri nominaldir.
Dapagliflozin, aynı zamanda kalp yetersizliği nedeniyle hastaneye yatış (ilk ve rekürren) ve kardiyovasküler ölüm olaylarının toplam sayısını düşürmüştür; dapagliflozin grubunda 567
olay, plasebo grubunda ise 742 olay ortaya çıkmıştır (Olay Oranı 0,75 [%95 GA 0,65, 0,88], p
< 0,0002).
Dapagliflozinin ortaya çıkardığı tedavi yararı, tip 2 diyabeti olan ve olmayan kalp yetersizliği hastalarında gözlenmiştir. Dapagliflozin, kardiyovasküler ölüm insidansı ve kalp yetersizliğinde kötüleşme primer birleşik sonlanma noktasını diyabet hastalarında 0,75'lik (%95 GA 0,63, 0,90), diyabeti olmayan hastalarda ise 0,73'lük (%95 GA 0,60, 0,88) bir HR değeri ile düşürmüştür.
Dapagliflozinin primer sonlanma noktası üzerinde plaseboya kıyasla sergilediği tedavi faydası, eşzamanlı kalp yetersizliği tedavisi, böbrek fonksiyonu (eGFR), yaş, cinsiyet ve bölgenin de aralarında olduğu diğer kilit alt gruplarda da tutarlılık göstermiştir.
Hasta tarafından bildirilen sonuç kalp yetersizliği semptomları
Dapagliflozinin kalp yetersizliği semptomları üzerinde ortaya çıkardığı tedavi etkisi, bitkinlik, periferik ödem, dispne ve ortopneyi içeren kalp yetersizliği semptomlarının sıklığını ve şiddetini ölçen Kansas City Kardiyomiyopati Anketi Toplam Semptom Skoru (KCCQ-TSS) ile değerlendirilmiştir. Skor 0 ile 100 arasında değişmektedir ve daha yüksek skorlar sağlık durumunun daha iyi olduğunu göstermektedir.
Dapagliflozinle uygulanan tedavi, KCCQ-TSS'de başlangıçtan 8. aya kadar meydana gelen değişiklikle ölçüldüğü üzere, kalp yetersizliği semptomları üzerinde plaseboya kıyasla istatistiksel![]() ve klinik açıdan anlama sahip olan bir yarar ortaya çıkarmıştır (Kazanç Oranı 1,18 [%95 GA 1,11, 1,26]; p < 0,0001). Hem semptom sıklığı hem de semptom yükü sonuçlara katkıda bulunmuştur. Hem kalp yetersizliği semptomlarında iyileşme sağlanması hem de kalp yetersizliği semptomlarındaki kötüleşmenin önlenmesi konusunda yarar gözlenmiştir.
ve klinik açıdan anlama sahip olan bir yarar ortaya çıkarmıştır (Kazanç Oranı 1,18 [%95 GA 1,11, 1,26]; p < 0,0001). Hem semptom sıklığı hem de semptom yükü sonuçlara katkıda bulunmuştur. Hem kalp yetersizliği semptomlarında iyileşme sağlanması hem de kalp yetersizliği semptomlarındaki kötüleşmenin önlenmesi konusunda yarar gözlenmiştir.
Yanıt veren analizlerinde KCCQ-TSS'de başlangıçtan 8. aya 5 puan veya daha fazla artış şeklinde tanımlanan klinik açıdan anlamlı bir iyileşme gözlenen hastaların oranının dapagliflozin tedavisi grubunda plaseboya kıyasla daha yüksek olduğu görülmüştür. 5 puan veya daha fazla düşüş şeklinde tanımlanan klinik açıdan anlamlı kötüleşme gözlenen hastaların oranının dapagliflozin tedavisi grubunda plaseboya kıyasla daha düşük olduğu görülmüştür. Dapagliflozin ile elde edilen yararlar, klinik açıdan anlamlı daha büyük değişiklik için daha konservatif kesmeler uygulandığında da varlığını korumuştur (Tablo 10).
Tablo 10. KCCQ-TSS'de 8 ayda klinik açıdan anlamlı iyileşme ve kötüleşme yaşayan hastaların sayısı ve yüzdesi
Başlangıçtan 8. aya kadar meydana gelen değişiklik:
Dapagliflozin
10 mg n=2.08
Plasebo n=2.062
İyileşme İyileşen n
|
|
| GA) |
|
≥ 5 puan | 933 (44,7) | 794 (38,5) | 1,14 | 0,0002 |
|
|
| (1,06, 1,22) |
|
≥ 10 puan | 689 (33,0) | 579 (28,1) | 1,13 | 0,0018 |
|
|
| (1,05, 1,22) |
|
≥ 15 puan | 474 (22,7) | 406 (19,7) | 1,10 | 0,0300 |
|
|
| (1,01,1,19) |
|
(%)
İyileşen n (%)
Olasılık oranı(%95
p
değeri
Kötüleşme | Kötüleşen n (%) | Kötüleşen n (%) | Olasılık oranı(%95 GA) | p değeri |
≥ 5 puan | 537 (25,7) | 693 (33,6) | 0,84 | <0,0001 |
|
|
| (0,78, 0,89) |
|
≥ 10 puan | 395 (18,9) | 506 (24,5) | 0,85 | <0,0001 |
|
|
| (0,79, 0,92) |
|
Başlangıca kıyasla en az 5, 10 veya 15 puan iyileşme gözlenen hastaların sayısı.
Belirtilen zaman noktasından önce ölen hastalar iyileşme kaydetmemiş sayılmıştır.
İyileşme açısından > 1'lik bir olasılık oranı 10 mg dapagliflozin lehinedir.
Başlangıca kıyasla en az 5 veya 10 puan kötüleşme gözlenen hastaların sayısı. Belirtilen
zaman noktasından önce ölen hastalar kötüleşmiş sayılmıştır.
Kötüleşme açısından < 1'lik bir olasılık oranı 10 mg dapagliflozin lehinedir.
p değerleri nominaldir.
Nefropati
Renal birleşik sonlanma noktası olaylarının (doğrulanmış uzun süreli ≥%50 eGFR düşüşü, SDBY veya renal ölüm) sayısının az olduğu gözlenmiştir; insidansın dapagliflozin grubunda
%1,2, plasebo grubunda ise %1,6 olduğu görülmüştür.
Kronik böbrek hastalığı
Kronik Böbrek Hastalığı Bulunan Hastalarda Renal Sonuçlar ve Kardiyovasküler Mortaliteye Dapagliflozinin Etkilerinin İncelenmesi (DAPA-CKD) çalışması kronik böbrek hastalığı ile birlikte ≥25 ile ≤75 mL/dak/1,73 m ve albüminüri (UACR ≥200 ve ≤5000 mg/g) bulunan hastalarda, standart tedaviye eklendiğinde plaseboya kıyasla dapagliflozinin eGFR'de ≥%50 uzun süreli düşüşten oluşan birleşik sonlanım görülme sıklığı, son dönem böbrek hastalığı (SDBH; eGFR'de 15 mL/dak/1,73 m düzeyinin altına uzun süreli düşüş, kronik diyaliz tedavisi veya böbrek nakli), kardiyovasküler ölüm ve renal ölüm üzerine etkisini belirlemek üzere yapılan uluslararası, çok-merkezli, randomize, çift-kör, plasebo-kontrollü çalışmadır.
4.304 hastadan 2.152'si 10 mg dapagliflozin, 2.152'si plaseboya randomize edilmiş ve medyan 28,5 ay boyunca takip edilmiştir. Çalışma süresince eGFR seviyesi 25 mL/dak/1,73 m düzeyinin altına düştüğünde de tedaviye devam edilmiş ve diyalize gereksinim duyulan durumlarda dahi tedavi devam ettirilebilmiştir.
Çalışma popülasyonun ortalama yaşı 61,8 olup, %66,9'u erkekti. Başlangıçta ortalama eGFR 43,1 mL/dak/1,73 m ve medyan UACR 949,3 mg/g idi ve eGFR hastaların %44,1'inde 30 ile
<45 mL/dak/1,73 m ve %14,5'inde <30 mL/dak/1,73 m idi; hastaların %67,5'inde tip 2 diyabet vardı. Hastalar standart tedavi alıyordu; %97,0'ı anjiyotenssin dönüştürücü enzim (ACE) inhibitörü veya anjiyotensin reseptör blokörü (ARB) ile tedavi ediliyordu.
Çalışma, Bağımsız Veri İzleme Komitesinin tavsiyesi üzerine planlanan analizden önce etkililik için erken durdurulmuştur. Dapagliflozin eGFR'de uzun süreli ≥%50 düşüşten oluşan birincil bileşik sonlanım noktasını, son dönem böbrek hastalığına ilerleme ve renal ölümü önlemede plasebodan üstündür. Birincil bileşik sonlanım noktasının ilk ortaya çıkışına kadar geçen süre için Kaplan-Meier grafiğine göre, tedavi etkisi 4 aydan itibaren belirgindir ve çalışmanın sonuna kadar sürdürülmüştür (Şekil 5).
Şekil 5: Primer birleşik sonlanma noktası, eGFR'de >50 veya daha fazla uzun süreli düşüşün ilk oluşumuna veya kardiyovasküler ölüm veya renal ölüme dek geçen süre
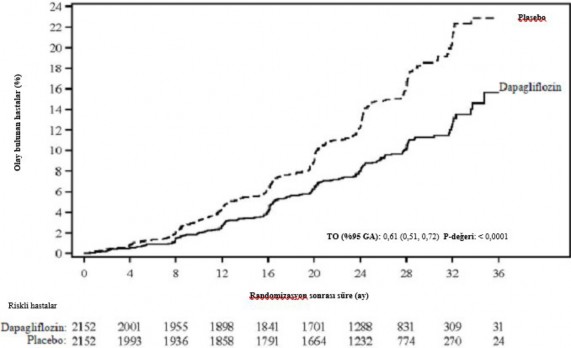
Risk altındaki hastalar çalışma periyodunun başında risk altında bulunan hastaların sayısıdır. Primer birleşik sonlanım noktasının 4 bileşeninin tümü tedavi etkisine katkıda bulunmuştur.
Dapagliflozin ayrıca eGFR, son dönem böbrek hastalığı veya böbrek ölümünde uzun süreli
≥%50 düşüş olan birleşik sonlanma noktasının görülme sıklığını ve kardiyovasküler ölüm ve kalp yetersizliği nedeniyle hastaneye yatış birleşik sonlanma noktasının görülme sıklığını da azaltmıştır. Dapagliflozin ile tedavi, tüm nedenlere bağlı mortalitede önemli bir azalma ile kronik böbrek hastalığı hastalarında genel sağkalımı iyileştirmiştir. (Şekil 6).
Şekil 6: Primer ve sekonder birleşik sonlanma noktaları, onun bileşenleri ve tüm nedenlere bağlı mortalite için tedavi etkileri
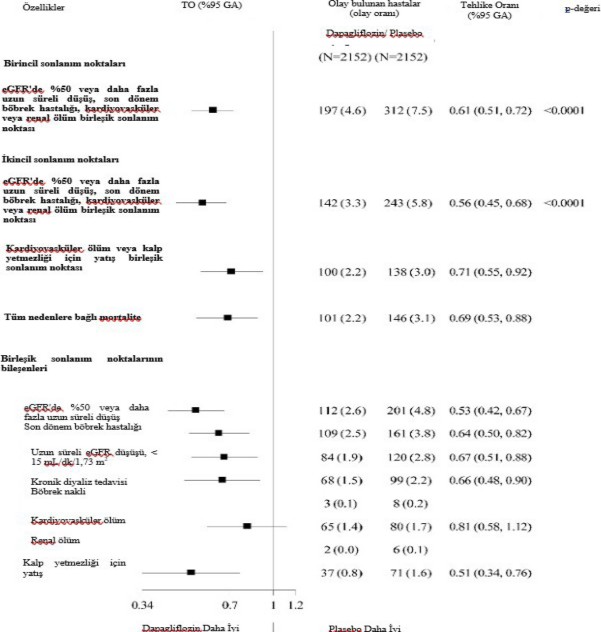
Tek bileşen için ilk olay sayısı her bir bileşenin ilk olaylarının gerçek sayısıdır ve birleşik sonlanım noktasındaki olay sayısının toplamından oluşmaz.
Olay oranları 100 hasta yılı takip başına olay gelişen hasta sayısı olarak verilmiştir.
Tehlike oranı hesaplamaları toplamda 15'ten az olay bulunan alt gruplar için sunulmamıştır; her iki kol birleştirilmiştir.
Dapagliflozinin tedavi faydası tip 2 diyabet bulunan ve diyabet bulunmayan kronik böbrek hastalığı hastalarında benzerdir. Dapagliflozin eGFR'de %50 veya daha fazla uzun süreli düşüş, son dönem böbrek hastalığı, kardiyovasküler ölüm veya renal ölüm birincil birleşik sonlanım noktasını tip 2 diyabet bulunan hastalarda 0,64 TO (%95 GA: 0,52 - 0,79) ve diyabet
bulunmayan hastalarda 0,50 TO (%95 GA: 0,35 - 0,72) ile düşürmüştür.
Birincil sonlanım noktasında dapagliflozinin plasebodan daha yüksek olan tedavi faydası da eGFR, yaş, cinsiyet ve bölge dahil diğer önemli alt gruplarda tutarlıdır.
5.2. Farmakokinetik özellikler
Genel Özellikler
Emilim:
Dapagliflozin, oral uygulama sonrasında hızla ve iyi absorbe edilmektedir. Maksimum dapagliflozin plazma konsantrasyonlarına (C) genellikle aç karnına uygulamadan sonraki iki saat içerisinde ulaşılmaktadır. Günde bir kez 10 mg dapagliflozin dozlarından sonra geometrik ortalama kararlı durum dapagliflozin Cve EAAÏ değerleri sırasıyla 158 ng/mL ve 628 ng s/mL olmuştur. 10 mg dozunun uygulanmasından sonra dapagliflozinin mutlak oral biyoyararlanımı %78 olmaktadır. Yüksek oranda yağ içeren bir öğünle birlikte verildiğinde dapagliflozinin Cdeğeri %50'ye kadar azalmış ve Tdeğeri yaklaşık 1 saat uzamış; ancak açlık durumu ile karşılaştırıldığında EAA değeri değişmemiştir. Bu değişiklikler klinik olarak anlamlı kabul edilmemektedir. Bu nedenle DAPADAP aç veya tok karnına alınabilir.
Dağılım:
Dapagliflozin yaklaşık %91 oranında proteine bağlanmaktadır. Proteine bağlanma oranı farklı hastalık durumlarından etkilenmemektedir (örn. böbrek veya karaciğer yetmezliği). Dapagliflozinin ortalama kararlı durum dağılım hacmi 118 L'dir.
Biyotransformasyon:
Dapagliflozin büyük ölçüde metabolize olarak, başlıca inaktif bir metabolit olan dapagliflozin 3-O-glukuronide metabolize olmaktadır. Dapagliflozin 3-O-glukuronid veya diğer metabolitler glukoz düşürücü etkilere katkıda bulunmamaktadır. Dapagliflozin 3-O- glukuronid oluşumuna karaciğer ve böbrekte bulunan bir enzim olan UGT1A9 aracılık eder ve CYP'nin aracılık ettiği metabolizma insanda minör bir klerens yolağıdır.
Eliminasyon:
Dapagliflozinin ortalama plazma terminal yarı ömrü (t) sağlıklı bireylere tek oral 10 mg dapagliflozin dozunun uygulanmasından sonra 12,9 saattir. İntravenöz uygulanan dapagliflozinin ortalama toplam sistemik klerensi 207 mL/dak olarak ölçülmüştür. Dapagliflozin ve ilgili metabolitleri başlıca idrar yolu ile elimine olur ve bunun %2'den azı değişmemiş dapagliflozin şeklindedir. 50 mg [C]-dapagliflozin dozunun uygulanmasından sonra %96'sı geri kazanılmış olup, bunun %75'i idrarda ve %21'i feçestedir. Feçeste dozun yaklaşık %15'i ana ilaç olarak atılmıştır.
Doğrusal/doğrusalolmayan durum:
Dapagliflozin maruziyeti, 0,1 mg ila 500 mg aralığında dapagliflozin dozundaki artış ile orantılı olarak artmıştır ve 24 haftaya kadarki tekrarlı günlük doz uygulamaları ile farmakokinetiğinde zaman içinde değişiklik olmamıştır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Kararlı durumda (7 gün süreyle günde bir kez 20 mg dapagliflozin), tip 2 diabetes mellitusu ve hafif, orta veya ağır derecede böbrek yetmezliği olan bireylerde (ioheksol plazma klerensi ile belirlenmiştir) ortalama sistemik dapagliflozin maruziyeti, böbrek fonksiyonu normal olan tip 2 diabetes mellitusu olan bireylere göre sırasıyla %32, %60 ve %87 daha yüksek olmuştur. Kararlı durumda 24 saatlik üriner glukoz atılımı, böbrek fonksiyonu ile yüksek derecede ilişkili olup tip 2 diabetes mellitusu ve normal böbrek fonksiyonu olan bireylerde veya hafif, orta veya ağır derecede böbrek yetmezliği olan hastalarda sırasıyla 85, 52, 18 ve 11 g
glukoz/gün atılımı tespit edilmiştir. Hemodiyalizin dapagliflozin maruziyetine etkisi bilinmemektedir. Böbrek fonksiyonundaki azalmanın sistemik maruziyet üzerindeki etkisi, bir popülasyon farmakokinetik modelinde incelenmiştir. Önceki sonuçlarla tutarlı olarak, modelin tahmini AUC değeri normal böbrek fonksiyonuna sahip hastalara kıyasla kronik böbrek hastalığı bulunan hastalarda daha yüksektir ve tip 2 diyabeti bulunan ve bulunmayan kronik böbrek hastaları arasında anlamlı fark yoktur.
Karaciğer yetmezliği:
Hafif veya orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf A ve B), ortalama dapagliflozin Cve EAA değerleri, sağlıklı, benzer özelliklere sahip kontrol bireylere kıyasla sırasıyla %12'ye ve %36'ya kadar daha yüksek olmuştur. Bu farklılıkların klinik olarak anlamlı olmadığı kabul edilmiştir. Ağır derecede karaciğer yetmezliği olan bireylerde (Child-Pugh sınıf C) dapagliflozinin ortalama Cve EAA değerleri, benzer özelliklere sahip sağlıklı kontrollerden sırasıyla %40 ve %67 daha yüksek bulunmuştur.
Geriyatrik hastalarda (≥65yaş):
70 yaşına kadarki bireylerde tek başına yaşa bağlı maruziyette klinik olarak anlamlı bir artış olmamaktadır. Bununla birlikte, böbrek fonksiyonunda yaşa bağlı düşüş nedeniyle artmış maruziyet beklenebilir. 70 yaşın üzerindeki hastalarda maruziyet ile ilgili sonuçlara varabilmek için yeterli veri bulunmamaktadır.
Pediyatrik popülasyon
Pediyatrik popülasyonda farmakokinetik henüz çalışılmamıştır.
Cinsiyet
Kadınlarda ortalama dapagliflozin EAAdeğerinin erkeklere oranla %22 daha yüksek olduğu tahmin edilmektedir.
Irk
Beyaz, Siyah veya Asyalı ırklar arasında sistemik maruziyet açısından klinik olarak anlamlı herhangi bir farklılık bulunmamaktadır.
Vücut ağırlığı
Dapagliflozin maruziyetinin, artan ağırlıkla düştüğü bulunmuştur. Bu nedenle düşük vücut ağırlığına sahip hastalarda maruziyet biraz daha yüksek olabilir ve yüksek vücut ağırlığına sahip hastalarda ise maruziyet biraz daha düşük olabilir. Bununla birlikte maruziyetteki farklılıklar klinik açıdan önemli kabul edilmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler; güvenlilik farmakolojisi, tekrarlı doz toksisitesi, genotoksisite, karsinojenik potansiyel ve fertiliteyi kapsayan standart çalışmalar doğrultusunda insanlar için özel bir tehlike ortaya koymamıştır. Dapagliflozin farelerde veya sıçanlarda, iki yıllık karsinojenisite çalışmalarında değerlendirilen dozların herhangi birinde tümör oluşumuna neden olmamıştır.
Üremetoksisitesi ve gelişimsel toksisite
Yeni sütten kesilen jüvenil sıçanlara doğrudan dapagliflozin uygulaması ve gebelik (insanda böbrek matürasyonu açısından gebeliğin ikinci ve üçüncü trimesterlerine karşılık gelen dönemler) ile emzirme dönemi sırasındaki dolaylı maruziyet, ayrı ayrı, yavrularda böbrek pelvis ve tübüler dilatasyon insidans ve/veya şiddetinde artış ile ilişkilidir.
Jüvenil toksisite çalışmasında, dapagliflozin genç sıçanlara 21. postnatal günden itibaren
postnatal 90. güne kadar doğrudan uygulandığında tüm doz düzeylerinde renal pelvis ve
tübüler dilatasyonlar bildirilmiştir; yavrularda, test edilen en düşük dozda maruziyet, maksimum önerilen insan dozunun ≥ 15 katı olmuştur. Bu bulgular, tüm dozlarda gözlenen dozla ilişkili böbrek ağırlığı artışı ve makroskobik böbrek büyümesi ile ilişkilendirilmiştir. Jüvenil hayvanlarda gözlenen renal pelvik ve tübüler dilatasyonlar yaklaşık 1 aylık iyileşme döneminde tamamen geri dönüşümlü olmamıştır.
Başka bir prenatal ve postnatal gelişim çalışmasında anne sıçanlara gebeliğin 6. gününden postnatal 21. güne kadar doz uygulanmıştır ve yavrular intra uterin ve emzirme yoluyla ilaca dolaylı olarak maruz bırakılmıştır (sütte ve yavrularda dapagliflozin maruziyetini değerlendirme amaçlı bir ek çalışma gerçekleştirilmiştir). İlaç uygulanan dişi hayvanların erişkin yavrularında renal pelvis dilatasyon insidansında veya şiddetinde artış görülmüş; ancak bu etkiler sadece test edilen en yüksek dozda meydana gelmiştir (karşılık gelen maternal ve yavru dapagliflozin maruziyetleri maksimum önerilen insan dozunda insan değerinin sırasıyla
1.415 ve 137 kat üstü olmuştur). Bunlar dışındaki gelişimsel toksisite etkileri yavruların vücut ağırlıklarında dozla ilgili düşüşleri ile sınırlı olmuş ve sadece ≥15 mg/kg/gün dozlarında görülmüştür (maksimum önerilen insan dozunda insan değerlerinin ≥29 katı olan yavru maruziyetleri ile ilişkili). Maternal toksisite sadece test edilen en yüksek dozda görülmüş ve vücut ağırlığında ve dozla birlikte yem tüketiminde geçici azalmalar ile sınırlı kalmıştır. Gelişimsel toksisite açısından advers etkinin görülmediği düzey (NOAEL), yani test edilen en düşük doz, maksimum önerilen insan dozunda insan değerinin yaklaşık 19 katı olan maternal sistemik maruziyet ile ilişkilidir.
Sıçanlar ve tavşanlardaki ek embriyo-fetal gelişim çalışmalarında dapagliflozin, her türde başlıca organogenez dönemlerine denk gelen aralıklarda uygulanmıştır. Tavşanlarda test edilen dozların herhangi birinde maternal ya da gelişimsel toksisite gözlenmemiştir; test edilen en yüksek doz, maksimum önerilen insan dozunun yaklaşık 1.191 katı sistemik maruziyet ile ilişkilidir. Dapagliflozin, sıçanlarda, maksimum önerilen insan dozunun
1.441 katına kadarki maruziyetlerde embriyoletal ya da teratojenik etki göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mikrokristalin selüloz PH 112 Laktoz (sığır kaynaklı laktoz) Krospovidon CLKolloidal silikon dioksit Magnezyum stearat Polivinil alkol Polietilen glikol
Talk
Titanyum dioksit (E171) Sarı demir oksit (E172)
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
28 veya 90 film kaplı tablet içeren Al/Al folyo blister ve karton kutu ambalaj
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| DAPADAP | 8681428091713 | 567.67TL |
| DAPGEON | 8699293097334 | 567.67TL |
| DAPITUS | 8680972609160 | 593.80TL |
| DAPLIG | 8699511099171 | 596.98TL |
| FORZIGA | 8699786092730 | 596.98TL |
| Diğer Eşdeğer İlaçlar |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Sandoz İlaç San. ve Tic. A.Ş.
| Satış Fiyatı | 567.67 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 567.67 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681428091713 |
| Etkin Madde | Dapagliflozin |
| ATC Kodu | A10BK01 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Sindirim Sistemi ve Metabolizma > Oral Antidiyabetik İlaçlar |
| Yerli ve Beşeri bir ilaçdır. |