DAPLIG 10 mg film kaplı tablet (28 tablet) Farmakolojik Özellikler
{ Dapagliflozin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diyabet tedavisinde kullanılan ilaçlar, sodyum-glukoz ko-transporter 2 (SGLT2) inhibitörleri
ATC kodu: A10BK01
Etki mekanizması
Dapagliflozin yüksek derecede potent (Ki: 0,55 nM), selektif ve geri dönüşümlü SGLT2 inhibitörüdür.
Dapagliflozinle sağlanan SGLT2 inhibisyonu, sodyum reabsorbsiyonunda eşzamanlı bir azalmayla, proksimal renal tübülde glomerüler filtrattan glukoz reabsorbsiyonunu azaltır ve üriner glukoz ekskresyonu ve ozmotik diürez ortaya çıkarır. Dolayısıyla dapagliflozin distal tübüle sodyum taşınmasını arttırır ve bu da tübüloglomerüler geribildirimi arttırır ve intraglomeruler basıncı azaltır. Bu, ozmotik diürez ile birlikte, aşırı volüm yüklemesinde azalma, kan basıncında düşüş ve ön yük ve son yükte azalma sağlar ve bunlar kardiyak yeniden modelleme üzerinde yararlı etkiler ortaya çıkarabilir. Diğer etkiler arasında hematokrit artışı ve vücut ağırlığında azalma bulunur. DAPA-HF çalışmalarında ortaya konmuş olduğu gibi, dapagliflozinin kardiyak faydaları yalnızca kan glukozu düşürücü etkiye bağımlı değildir.
Dapagliflozin, böbreklerden glukoz reabsorpsiyonunu azaltarak gerek açlık gerekse post-
(glukuretik etki) ilk dozdan sonra gözlenir, 24 saatlik doz uygulama aralığı boyunca süreklidir ve tedavi süresince bu etki korunur. Böbrek tarafından bu mekanizma ile uzaklaştırılan glukoz miktarı, kan glukoz konsantrasyonu ve glomerüler filtrasyon hızına bağlıdır. Dolayısıyla glukoz düzeyi normal olan gönüllülerde dapagliflozinin hipoglisemiye yol açma eğilimi düşüktür. Dapagliflozin hipoglisemiye cevaben normal endojen glukoz üretimini bozmaz. Dapagliflozin, insülin sekresyonunundan ve insülin etkisinden bağımsız etki gösterir. Dapagliflozin ile yürütülen klinik çalışmalarda beta hücre fonksiyonu için homeostaz model değerlendirmesinde (HOMA beta hücre) düzelme gözlenmiştir.
SGLT2 selektif şekilde böbrekte eksprese olur. Dapagliflozin, periferik dokulara glukoz taşınmasında önemli diğer glukoz taşıyıcılarını inhibe etmez ve glukoz absorpsiyonundan sorumlu, bağırsaktaki başlıca taşıyıcı olan SGLT1'e göre SGLT2 için >1400 kat daha seçicidir.
Farmakodinamik etkiler
Sağlıklı bireylerde ve tip 2 diabetes mellitusu olan bireylerde dapagliflozin uygulamasından sonra idrarla atılan glukoz miktarında artışlar görülmüştür. 12 hafta süreyle tip 2 diabetes mellitusu olan bireylere uygulanan 10 mg/gün dapagliflozin dozunda gün başına yaklaşık 70 g glukoz atılmıştır (280 kilokalori/gün'e eşdeğer). İki yıl boyunca 10 mg/gün dapagliflozin verilen tip 2 diabetes mellitusu olan bireylerde glukoz atılımının korunduğu yönünde kanıtlar görülmüştür.
Tip 2 diabetes mellitusu olan bireylerde dapagliflozin ile sağlanan üriner glukoz atılımı ayrıca ozmotik diüreze ve idrar hacminde artışa neden olur. 10 mg dapagliflozin ile tedavi edilen tip 2 diabetes mellitusu olan bireylerdeki idrar hacmi artışları 12 hafta süreyle korunmuştur ve yaklaşık 375 mL/gün düzeyinde olmuştur. İdrar hacmindeki artış, idrarla sodyum atılımında, serum sodyum konsantrasyonlarında değişiklikler ile bağlantılı olmayan küçük ve geçici bir artış ile ilişkilendirilmiştir.
Ayrıca idrarla ürik asit atılımı da geçici olarak artmış (3-7 gün) ve buna, serum ürik asit konsantrasyonunda sürekli bir azalma eşlik etmiştir. 24. haftada serum ürik asit konsantrasyonlarındaki düşüşler -48,3 mikromol/L ila -18,3 mikromol/L (-0,87 mg/dL ila - 0,33 mg/dL) aralığında olmuştur.
Klinik etkililik ve güvenlilik
Tip 2 diabetes mellitus
Glisemik kontrolünün iyileşmesi ve kardiyovasküler morbidite ve mortalitenin azalması tip 2 diyabet tedavisinin bütünleyici parçalarıdır.
Dapagliflozinin glisemik etkililiğini ve güvenliliğini değerlendirmek üzere 7056 tip 2 diyabeti olan bireyler ile on dört adet çift kör, randomize, kontrollü klinik çalışma gerçekleştirilmiştir: bu çalışmalarda 4737 birey dapagliflozin ile tedavi edilmiştir. On iki çalışmada tedavi süresi 24
kadar çalışma süresi), bir çalışma 28 hafta tedavi süresi ve bir çalışma süresi 52 hafta olup; 52 haftalık ve 104 haftalık uzatma dönemleri yer almıştır (toplam çalışma süresi 208 hafta). Ortalama diyabet süresi 1,4 ila 16,9 yıl aralığında olmuştur. Çalışmaya katılan bireylerin
%50'sinde hafif derecede böbrek yetmezliği ve %11'inde orta derecede böbrek yetmezliği olmuştur. Bireylerin %51'i erkek, %84'ü Beyaz, %8'i Asyalı, %4'ü Siyah ve %4'ü diğer etnik gruplardandır. Bireylerin %81'inde vücut kitle indeksi (VKİ) ï³ 27'dir. Ayrıca, yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu olan hastalarda iki adet 12-haftalık, plasebo-kontrollü çalışma yürütülmüştür.
Kardiyovasküler ve renal olaylar üzerindeki etkinin değerlendirilmesi amacıyla, kanıtlanmış kardiyovasküler hastalığı bulunan veya bulunmayan, tip 2 diyabetli 17160 hasta üzerinde plaseboyla karşılaştırmalı şekilde 10 mg dapagliflozin ile bir kardiyovasküler sonuç çalışması (DECLARE) gerçekleştirilmiştir.
Glisemik kontrol
Monoterapi
Yeterli derecede kontrol edilemeyen tip 2 diabetes mellitusu olan bireylerde dapagliflozin ile monoterapinin güvenliliğini ve etkililiğini değerlendirme amacıyla çift kör, plasebo kontrollü, 24 hafta süreli (ek uzatma süreli) bir çalışma gerçekleştirilmiştir. Dapagliflozin ile günde bir kez tedavi sonucunda HbA1c'de plasebo ile karşılaştırıldığında istatistiksel olarak anlamlı düşüşler sağlanmıştır (p < 0,0001) (Tablo 2).
Uzatma döneminde HbA1c düşüşü 102. haftaya kadar sürmüştür. (10 mg dapagliflozin ve plasebo için düzeltilmiş başlangıca göre ortalama değişiklik sırasıyla -%0,61 ve -%0,17).
Tablo 2. Monoterapi olarak dapagliflozinin plasebo kontrollü çalışmasının 24. hafta sonuçları (LOCF)
Monoterapi | ||
| Dapagliflozin 10 mg | Plasebo |
N | 70 | 75 |
HbA1c (%) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) |
8,01 -0,89 -0,66 (-0,96, -0,36) |
7,79 -0,23 |
HbA1c < %7'ye ulaşan gönüllü yüzdesi Başlangıca göre düzeltilen |
50,8 |
31,6 |
Vücut ağırlığı (kg) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) |
94,13 -3,16 -0,97 (-2,20, 0,25) |
88,77 -2,19 |
![]()
İlave kombinasyon tedavisi
52 haftalık, aktif kontrollü bir eşdeğerlik çalışmasında (52 ve 104 haftalık uzatma periyoduna sahip), glisemik kontrolün yetersiz olduğu bireylerde (HbA1c > %6,5 ve ≤ %10) metformine ilave tedavi olarak bir sülfonilüreye (glipizid) karşı, metformine ilave tedavi olarak dapagliflozin değerlendirilmiştir. Bulgular, glipizide kıyasla HbA1c'de başlangıçtan 52. haftaya kadar benzer bir ortalama azalmayı ve böylece eşdeğerliği göstermiştir (Tablo 3). 104. haftada, HbA1c'de başlangıca göre düzeltilmiş ortalama değişiklik dapagliflozin için -%0,32 ve glipizid için -%0,14'tür. 208. haftada, Hb1Ac'de başlangıca göre düzeltilmiş ortalama değişiklik dapagliflozin için %-0,10 ve glipizid için 0,20% dir. 52. ve 104. ve 208. haftalarda, glipizid ile tedavi edilen grup ile (sırasıyla %40,8, %47,0, %50,0) karşılaştırıldığında dapagliflozin ile tedavi edilen grupta (sırasıyla %3,5, %4,3 ve %5,0) anlamlı olarak daha düşük bir birey oranında en az bir hipoglisemi olayı yaşanmıştır.104. ve 208. haftada çalışmaya devam eden birey oranı dapagliflozin ile tedavi edilen grup için %56,2 ve %39,7 ve glipizid ile tedavi edilen grup için %50,0 ve %34,6'dir.
Tablo 3. Metformine ilave tedavi olarak dapagliflozin ile glipizidi karşılaştıran aktif kontrollü çalışmanın 52. hafta sonuçları (LOCF)
Parametre | Dapagliflozin + metformin | Glipizid + metformin |
N | 400 | 401 |
HbA1c (%) Başlangıç (ortalama) Başlangıca göre değişiklik Glipizid + metforminden farkı (%95 GA) |
7,69 -0,52 0,00 (-0,11, 0,11) |
7,74 -0,52 |
Vücut ağırlığı (kg) Başlangıç (ortalama) Başlangıca göre değişiklik Glipizid + metforminden farkı (%95 GA) |
88,44 -3,22 -4,65 (-5,14, -4,17) |
87,60 1,44 |
![]()
Metformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak dapagliflozin, plasebo alan bireyler ile karşılaştırıldığında 24 haftada HbA1c'de istatistiksel olarak anlamlı düşüşler sağlamıştır (p < 0,0001; Tablo 4, 5 ve 6).
24. haftada HbA1c'de gözlenen azalmalar, 48 haftalık verilere (glimepirid) ve 104 haftalık verilere (insülin) sahip ilave tedavi kombinasyonu çalışmalarında (glimepirid ve insülin) korunmuştur. 48. haftada sitagliptine ilave edildiğinde (metforminle veya metforminsiz), 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -
%0,30'dur ve %0,38'dir. Metformine ilave edilme çalışması için, HbA1c'deki azalmalar 102. haftaya kadar korunmuştur (10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -%0,78 ve %0,02). İnsülin için 104. haftada (ilave oral glukoz düşürücü tıbbi ürünler varlığında veya yokluğunda), HbA1c'deki azalmalara ilişkin olarak 10 mg dapagliflozin ve plasebo için başlangıca göre düzeltilmiş ortalama değişiklik sırasıyla -
%0,71 ve -%0,06'dır. 48 ve 104. haftalarda insülin dozu 76 IU/gün'lük ortalama bir dozda 10 mg dapagliflozin ile tedavi edilen bireylerde başlangıca göre stabil kalmıştır. Plasebo grubunda 48 ve 104. haftalarda başlangıca göre sırasıyla 10,5 IU/gün ve 18,3 IU/gün'lük (ortalama doz 84 ve 92 IU/gün) ortalama bir artış söz konusudur. 104. haftada çalışmada kalan birey oranı 10 mg dapagliflozin ile tedavi edilen grup için %72,4'tür ve plasebo grubu için %54,8'dir.
Tablo 4. Metformin ya da sitagliptin (metforminle veya metforminsiz) ile ilave kombinasyon tedavi olarak dapagliflozine yönelik plasebo kontrollü çalışmaların 24 haftalık sonuçları (LOCF)
İlave kombinasyon tedavisi | ||||
| Metformin | DPP-4 inhibitör (sitagliptin) ± metformin | ||
| Dapagliflozin 10 mg | Plasebo | Dapagliflozin 10 mg | Plasebo |
N | 135 | 137 | 223 | 224 |
HbA1c (%) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA ) |
7,92 -0,84 -0,54* (-0,74, -0,34) |
8,11 -0,30 |
7,90 -0,45 -0,48* (-0,62, -0,34) |
7,97 0,04 |
HbA1c < %7'ye ulaşan gönüllü yüzdesi Başlangıca göre düzeltilen |
|
|
|
|
Vücut ağırlığı (kg) |
|
|
|
|
Başlangıç (ortalama) | 86,28 | 87,74 | 91,02 | 89,23 |
Başlangıca göre değişiklik | -2,86 | -0,89 | -2,14 | -0,26 |
Plaseboya göre fark | -1,97* |
| -1,89* |
|
(%95 GA ) | (-2,63, -1,31) |
| (-2,37, -1,40) |
|
*p değeri < 0,0001; plasebo + oral glukoz düşürücü tıbbi ürüne karşı **p değeri < 0,05; plasebo + oral glukoz düşürücü tıbbi ürüne karşı
| ||||

Tablo 5. 24 haftalık, plasebo-kontrollü, ek sülfonilüre (glimepirid) ya da metformin ve bir sülfonilüre ile kombine dapagliflozin çalışmalarının sonuçları
Ek kombinasyon
Sülfonilüre (glimepirid)
Sülfonilüre
+metformin
Dapagliflozin 10 mg
Plasebo Dapagliflozin
10 mg
Plasebo
N | 151 | 145 | 108 | 108 |
HbA1c (%) |
|
|
|
|
Başlangıç değeri | 8,07 | 8,15 | 8,08 | 8,24 |
(ortalama) Başlangıç seviyesine |
-0,82 |
-0,13 |
-0,86 |
-0,17 |
göre değişim Plaseboya göre farkı |
-0,68* |
|
-0,69* |
|
(%95 güven aralığı) | (-0,86,-0,51) |
| (-0,89,-0,49) |
|
HbA1c < 7% (LOCF) |
|
|
|
|
ulaşan denekler (%) Başlangıç değerine |
31,7* |
13,0 |
31,8* |
11,1 |
göre düzeltilmiş |
|
|
|
|
Vücut ağırlığı (kg) (LOCF) Başlangıç değeri |
80,56 |
80,94 |
88,57 |
90,07 |
(ortalama) |
|
|
|
|
Başlangıç seviyesine göre değişim Plaseboya göre farkı | -2,26
-1,54* | -0,72 | -2,65
-2,07* | -0,58 |
(%95 güven aralığı) | (-2,17, -0,92) |
| (-2,79, -1,35) |
|
glimepirid 4 mg/gün; 2Metformin (çabuk- ya da uzatılmış-salımlı formülasyonlar) >1500 mg/gün, ek olarak, deneye katılmadan önce en az 8 hafta boyunca, maksimum dozun en az yarısı olacak şekilde, maksimumtolereedilebilir dozdabir sülfonilüre
Başlangıç seviyesi ve en az 1 başlangıç sonrası etkinlik ölçümü olan randomize ve tedavi
edilen hastalar
1. ve 2. kolonlar; LOCF metoduyla analiz edilmiş HbA1c (bkz. dipnot d); 3. ve 4. kolonlar
LRM metoduyla analiz edilmiş HbA1c (bkz. dipnot e)
Başlangıç değerine göre düzeltilmiş en küçük kareler ortalaması
LOCF: İleri aktarılan son gözlem (kurtarma tedavisi yapılan bireylerde kurtarma öncesinde)
BTÖ: Boylamsal tekrarlanmış ölçümler analizi
*plasebo + oral glukoz-düşürücü tıbbi ürün(ler)e göre p-değeri < 0,0001
Tablo 6. İnsülin ile kombinasyon halinde (tek başına veya oral glukoz düşürücü tıbbi ürünlerle birlikte) dapagliflozine yönelik plasebo kontrollü çalışmada 24. hafta sonuçları (LOCF)
Parametre | 10 mg dapagliflozin + insülin ± oral glukoz düşürücü tıbbi ürünler | Plasebo + insülin ± oral glukoz düşürücü tıbbi ürünler |
N | 194 | 193 |
HbA1c (%) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) |
8,58 |
8,46 |
-0,90 | -0,30 | |
-0,60 |
| |
(-0,74, -0,45) |
| |
Vücut ağırlığı (kg) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) |
94,63 |
94,21 |
-1,67 | 0,02 | |
-1,68 |
| |
(-2,19, -1,18) |
| |
Ortalama + günlük insülin dozu (IU) Başlangıç (ortalama) Başlangıca göre değişiklik Plaseboya göre fark (%95 GA) Ortalama günlük insülin dozunda en az %10 düşüş olan bireyler (%) |
77,96 |
73,96 |
-1,16 | 5,08 | |
-6,23 |
| |
(-8,84, -3,63) |
| |
19,7 |
11,0 |
![]()
%80'i tek başına metformin, %12'si metformin + sülfonilüre tedavisindedir ve kalanlar diğer oral glukoz düşürücü tıbbi ürünler kullanmaktadır.
İlaç-naif hastalarda metformin ile kombinasyon halinde
İlaç-naif hastalarda metformin ile kombinasyon halinde dapagliflozin'in (5 mg veya 10 mg) etkililik ve güvenliliğini her iki ilacın tek başına uygulanmasına kıyasla değerlendirmek üzere iki aktif kontrollü, 24 haftalık çalışmaya yeterli düzeyde kontrol altına alınmayan tip 2 diyabetli (HbA1c ≥ %7,5 ve ≤ %12) toplam 1236 ilaç-naif hasta katılmıştır.
Metformin (günde 2000 mg'a kadar) ile kombinasyon halinde dapagliflozin 10 mg tedavisi, kombinasyonun ayrı ayrı bileşenlerine kıyasla HbA1c'de anlamlı iyileşme sağlamış (Tablo 7) ve açlık plazma glukozunda (AKŞ) (kombinasyonun ayrı ayrı bileşenlerine kıyasla) ve vücut ağırlığında (metformine kıyasla) daha fazla düşüşle sonuçlanmıştır.
Tablo 7: İlaç-naif hastalarda dapagliflozin ve metformin kombinasyonunu araştıran aktif kontrollü bir çalışmada 24. hafta sonuçları (LOCF)
| Dapagliflozin 10 mg + metformin | Dapagliflozin 10 mg | Metformin |
Parametre |
|
| |
N | 211 | 219 | 208 |
HbA1c (%) Başlangıç (ortalama) Başlangıçtan itibaren değişime Dapagliflozine kıyasla fark (%95 GA) Metformine kıyasla fark (%95 CGA) |
9,10 |
9,03 |
9,03 |
-1,98 | -1,45 | -1,44 | |
â0,53 |
|
| |
(â0,74, â0,32) |
|
| |
â0,54 | â0,01 |
| |
(â0,75, â0,33) | (â0,22, 0,20) |
|
![]()
Uzatılmış salımlı eksenatid ile kombinasyon tedavisi
Yirmi sekiz haftalık çift kör, aktif komparatör-kontrollü bir çalışmada, dapagliflozin ve uzatılmış salımlı eksenatid (bir GLP-1 reseptör agonisti) kombinasyonu, tek başına metformin ile yeterli glisemik kontrol sağlanamayan (HbA1c ≥%8 ve ≤ %12) hastalarda tek başına dapagliflozin ve uzatılmış salımlı eksenatid ile karşılaştırılmıştır. Tüm tedavi gruplarında başlangıca kıyasla HbA1c'de düşüş olmuştur. Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu uygulanan grupta, başlangıca göre HbA1c'de tek başına dapagliflozin ve uzatılmış salımlı eksenatid ile görülenden daha fazla düşüş gözlenmiştir (Tablo 8).
Tablo 8. Metformin ile kombinasyon halinde tek başına dapagliflozin ve uzatılmış salımlı eksenatide kıyasla dapagliflozin ve uzatılmış salımlı eksenatid kombinasyonunu araştıran 28 haftalık çalışma sonuçları (tedavi amaçlanmış hastalar)
| Dapagliflozin 10 mg QD + uzatılmış salımlı eksenatid 2 mg QW | Dapagliflozin 10 mg QD + plasebo QW | Uzatılmış salımlı eksenatid 2 mg QW + plasebo QD |
Parametre |
| ||
N | 228 | 230 | 227 |
HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 9,29 | 9,25 | 9,26 |
Başlangıçtan itibaren değişim | -1,98 | -1,39 | -1,60 |
Kombinasyon ve tekli tıbbi ürün arasında başlangıçtan itibaren değişimde ortalama fark (%95 GA) |
|
-0,59* (-0,84, -0,34) |
-0,38** (-0,63, -0,13) |
44,7 | 19,1 | 26,9 | |
Vücut ağırlığı (kg) |
|
|
|
Başlangıç (ortalama) | 92,13 | 90,87 | 89,12 |
Başlangıçtan itibaren değişim | -3,55 | -2,22 | -1,56 |
Kombinasyon ve tekli tıbbi ürün arasında başlangıçtan itibaren değişimde ortalama fark (%95 GA) |
|
-1,33* (-2,12, -0,55) |
-2,00* (-2,79, -1,20) |
![]()
QD=günde bir kez, QW=haftada bir kez, N=hasta sayısı, GA=güven aralığı.
a Ayarlanmış en küçük kareler ortalamaları (LS Ortalamaları) ve 28. haftada başlangıç değerlerinden itibaren değişimde tedavi grupları arasındaki farklar, tekrarlı ölçümlere sahip bir karışık modelle (MMRM) modellenmiş ve bu modelde tedavi, bölge, başlangıç HbA1c grubu (< %9,0 veya ≥% 9,0), hafta ve hafta bazında tedavi etkileşimi sabit faktörler, başlangıç değerleri ise eşdeğişken olarak kullanılmıştır.
*p < 0,001, **p < 0,01.
P-değerlerinin tümü üst katlılık için ayarlanmış p-değerleridir.
Analizler kurtarma tedavisinden sonraki ölçümleri ve çalışma ilacının erken sonlandırılmasından sonra yapılan ölçümleri içermez.
Açlık plazma glukozu
Monoterapi olarak veya metformin, glimepiride, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) ya da insüline ilave tedavi olarak 10 mg dapagliflozin ile tedavi sonucunda, AKŞ düzeylerinde plasebo ile karşılaştırıldığında (-0,33 mmol/L ila 0,21 mmol/L [-6,0 mg/dL ila 3,8 mg/dL]) istatistiksel olarak anlamlı düşüşler meydana gelmiştir (- 1,90 mmol/L ila -1,20 mmol/L [-34,2 mg/dL ila -21,7 mg/dL]). Bu etki, tedavinin birinci haftasında gözlenmiştir ve 104. haftaya kadar uzatılan çalışmalarda devam etmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu 28. hafta AKŞ'de anlamlı şekilde daha fazla düşüşle sonuçlanmıştır: -3,66 mmol/l (-65,8 mg/dl), tek başına dapagliflozin için -2,73 mmol/l (-49,2 mg/dl) ile (p < 0,001) ve tek başına eksenatid için -2,54 mmol/L (-45,8 mg/dl) ile (p < 0,001) karşılaştırılmalı.
Yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 m olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada FPG'de azalmalar ortaya çıkarmıştır: plaseboyla elde edilen -0,27 mmol/L'ye karşılık (-4,87 mg/dL) -1,19 mmol/L (- 21,46 mg/dL) (p=0,001).
Post-prandiyal glukoz
Glimepiride ilave olarak 10 mg dapagliflozin ile tedavi sonucunda 24. haftada 2 saatlik post- prandiyal glukoz değerinde istatistiksel olarak anlamlı düşüşler sağlanmış olup bu etki 48. haftaya kadar devam etmiştir.
Sitagliptine (metforminle veya metforminsiz) ilave olarak 10 mg dapagliflozin tedavisi, 24 haftada, 2 saatlik post-prandiyal glukoz düzeyinde azalmalar ile sonuçlanmış olup bu etki 48. haftaya kadar devam etmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla 28. haftada 2. saatlik post-prandiyal glukoz düzeyinde anlamlı şekilde daha fazla düşüşle sonuçlanmıştır.
Vücut ağırlığı
Metformin, glimepirid, metformin ve bir sülfonilüre, sitagliptin (metforminle veya metforminsiz) veya insüline ilave olarak 10 mg dapagliflozin, 24. haftada vücut ağırlığında istatistiksel olarak anlamlı düşüş sağlamıştır (p < 0,0001, Tablo 4 ve 5). Bu etkiler uzun süreli çalışmalarda korunmuştur. 48. haftada, plaseboya kıyasla sitagliptine ilave tedavi olarak (metforminle veya metforminsiz) dapagliflozin için fark -2,22 kg'dır. 102. haftada, plaseboya kıyasla metformine ilave tedavi olarak veya plaseboya kıyasla insüline ilave olarak dapagliflozin için fark sırasıyla -2,14 ve -2,88 kg'dır.
Aktif kontrollü bir eşdeğerlik çalışmasında metformine ilave tedavi olarak dapagliflozin, glipizide kıyasla 52. haftada vücut ağırlığında -4,65 kg'lık istatistiksel olarak anlamlı bir azalma (p < 0,0001, Tablo 3) ile sonuçlanmış ve bu, 104. ve 208. haftada korunmuştur (sırasıyla -5,06 kg ve -4,38 kg ).
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, her iki tıbbi ürünün tek başına uygulamasına kıyasla anlamlı şekilde daha fazla kilo kaybı ile sonuçlanmıştır (Tablo 8).
Vücut bileşimini değerlendirmek üzere çift enerjili X-ışını absorpsiyometrisinin (DXA) kullanıldığı, 182 diyabetik birey ile gerçekleştirilen 24 haftalık bir çalışma, yağsız doku veya sıvı kaybı yerine DXA ile ölçüldüğünde, plasebo ve metformin ile karşılaştırıldığında 10 mg dapagliflozin ve metformin ile sırasıyla vücut ağırlığında ve vücut yağ kütlesinde düşüşlerin olduğunu göstermiştir. Dapagliflozin ve metformin ile tedavi sonucunda, manyetik rezonans görüntüleme alt çalışmasında plasebo ve metformin tedavisi ile karşılaştırıldığında iç organ yağ dokusunda sayısal azalma gözlenmiştir.
Kan basıncı
13 plasebo kontrollü çalışmanın önceden tanımlanmış olan birleştirilmiş analizinde, 24. haftada 10 mg dapagliflozin ile tedavi, sistolik kan basıncında başlangıca göre -3,7 mmHg ve diyastolik kan basıncında başlangıca göre -1,8 mmHg değişiklik ile sonuçlanırken aynı değerler plasebo grubu için sırasıyla -0,5 mmHg ve -0,5 mmHg olmuştur. 104 haftaya kadar benzer azalmalar gözlenmiştir.
Dapagliflozin 10 mg ve uzatılmış salımlı eksenatid kombinasyonu, tek başına dapagliflozin (- 1,8 mmHg, p < 0,05) ve tek başına uzatılmış salımlı eksenatide (-1,2 mmHg, p < 0,01) kıyasla
28. haftada sistolik kan basıncında anlamlı şekilde daha fazla düşüşle (-4,3 mmHg) sonuçlanmıştır.
Yeterince kontrol altına alınamayan tip 2 diyabeti ve hipertansiyonu (bir çalışmada bir ACE-I ya da ARB ile önceden mevcut stabil tedaviye ve diğer çalışmada ACE-I ya da ARB artı bir ilave antihipertansif tedaviye rağmen) olan toplam 1062 hasta, iki adet 12-haftalık, plasebo- kontrollü çalışmada dapagliflozin 10 mg ya da plasebo ile tedavi edilmiştir. Her iki çalışmada,
12. haftada dapagliflozin 10 mg artı alışıldık antidiyabetik tedavi, HbA1c'de düzelme sağlamış
ve plasebo açısından düzeltilmiş sistolik kan basıncında sırasıyla ortalama 3,1 ve 4,3 mmHg
Yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 m olan diyabetli hastalarda dapagliflozin ile uygulanan tedavi 24 haftada oturur pozisyondaki sistolik kan basıncında azalmalar ortaya çıkarmıştır: plaseboyla elde edilen -1,7 mmHgâye karşılık -4,8 mmHg (p < 0,05).
Orta derecede böbrek yetmezliği görülen hastalarda glisemik kontrol KBH 3A (eGFR ≥ 45 ila
![]()
< 60 mL/dak/1,73 m)
Dapagliflozinin etkililiği yalnızca bu konunun araştırıldığı bir çalışmada eGFR değeri ≥ 45 ila
< 60 mL/dak/1,73 m olan ve olağan bakımla yeterli glisemik kontrol sağlanamayan diyabetli hastalarda değerlendirilmiştir. Dapagliflozinle uygulanan tedavi HbA1c'de ve vücut ağırlığında plaseboya kıyasla azalmalar ortaya çıkarmıştır (Tablo 9).
Tablo 9. eGFR değeri ≥ 45 ila < 60 mL/dak/1,73 molan diyabetli hastalarda dapagliflozinle yapılan plasebo kontrollü bir çalışmanın 24. Hafta sonuçları
| Dapagliflozin 10 mg | Plasebo |
N | 159 | 161 |
HbA1c (%) |
|
|
Başlangıç (ortalama) | 8,35 | 8,03 |
Başlangıca göre değişiklik | -0,37 | -0,03 |
Plaseboya kıyasla fark (%95 GA) | -0,34* (-0,53, -0,15) |
|
Vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 92,51 | 88,30 |
Başlangıca göre değişiklik yüzdesi | -3,42 | -2,02 |
Plaseboya kıyasla fark yüzdesindeki değişiklik (%95 GA) | -1,43* (-2,15, -0,69) |
|
a .Metformin veya metformin hidroklorür dapagliflozin ve plasebo gruplarında hastaların sırasıyla %69,4'ünde ve %64,0'ında olağan bakımın bir parçasıydı b Başlangıç değerine göre ayarlanmış en küçük kareler ortalaması c Başlangıç değerine göre ayarlanmış en küçük kareler ortalamasından elde edilmiştir * p<0,001 | ||
Başlangıç HbA1c değeri ≥ %9 olan hastalar
Başlangıçta HbA1c değeri ≥ %9,0 olan bireylerle gerçekleştirilen önceden tanımlanmış olan bir analizde 10 mg dapagliflozin ile tedavi sonucunda 24. haftada HbA1c'de istatistiksel olarak anlamlı düşüşler elde edilmiştir (monoterapi olarak: düzeltilmiş başlangıca göre ortalama değişiklik: 10 mg dapagliflozin ve plasebo için sırasıyla -%2,04 ve %0,19; metformine ilave tedavi olarak: düzeltilmiş başlangıca göre ortalama değişiklik: dapagliflozin ve plasebo için sırasıyla -%1,32% ve -%0,53).
Kardiyovasküler ve renal sonuçlar
Dapagliflozinin Kardiyovasküler Olaylar Üzerindeki Etkisi (DECLARE) çalışması, mevcut
plaseboya kıyasla etkisini belirlemek üzere gerçekleştirilmiş olan uluslararası, çok merkezli, randomize, çift kör, plasebo kontrollü bir klinik çalışmaydı. Tüm hastalarda tip 2 diyabet ve en az iki ilave kardiyovasküler risk faktörü (erkeklerde yaşın ≥ 55 olması veya kadınlarda yaşın ≥ 60 olması ve dislipidemi, hipertansiyon ya da eşzamanlı tütün kullanımı durumlarından bir veya daha fazlasının mevcut olması) ya da kanıtlanmış kardiyovasküler hastalık mevcuttu.
Randomize edilen 17160 hastanın 6974'ü (%40,6) kanıtlanmış kardiyovasküler hastalığa sahipti, 10186'sında ise (%59,4) kanıtlanmış kardiyovasküler hastalık mevcut değildi. 8582 hasta 10 mg dapagliflozine, 8578'i ise plasebo randomize edildi ve medyan 4,2 yıl süresince takip edildi.
Çalışma popülasyonunun ortalama yaşı 63,9'du ve %37,4'ü kadındı. Toplamda %22,4'ü ≤ 5 yıldır diyabetliydi ve diyabetin ortalama süresi 11,9 yıldı. Ortalama HbA1c %8,3, ortalama beden kütle indeksi (BKİ) ise 32,1 kg/m'ydi.
Başlangıçta hastaların %10,0'ı kalp yetersizliği öyküsüne sahipti. Ortalama eGFR 85,2 mL/dak/1,73 m'ydi, hastaların %7,4'ünde eGFR < 60 mL/dak/1,73 m'ydi, hastaların
%30,3'ünde ise mikroalbüminüri veya makroalbüminüri (UACR sırasıyla ≥ 30 ila ≤ 300 mg/g veya > 300 mg/g) mevcuttu.
Hastaların çoğu (%98) başlangıçta metformin (%82), insülin (%41) ve sülfonilüreyi (%43) içeren bir ya da daha fazla diyabetik ilaç kullanmıştır.
Birincil sonlanım noktaları, kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inmeden (MACE) oluşan ilk olaya kadar geçen süre ve kalp yetersizliği için hastane yatışı ya da kardiyovasküler ölümden oluşan ilk olaya kadar geçen süre olmuştur. İkincil sonlanım noktaları bir renal bileşik sonlanım noktası ve tüm nedenlere bağlı mortalite olmuştur.
Majör advers kardiyovasküler olaylar
Dapagliflozin 10 mg, plaseboya karşı kardiyovasküler ölüm, miyokard infarktüsü ya da iskemik inme bileşimi için daha kötü olmamıştır (tek-taraflı p < 0,001).
Kalp yetersizliği veya kardiyovasküler ölüm
Dapagliflozin 10 mg, kalp yetersizliğine bağlı hastane yatışı ya da kardiyovasküler ölüm bileşiminin önlenmesinde plaseboya karşı üstünlük göstermiştir (Şekil 1). Tedavi etkisindeki farklılığın kalp yetersizliği nedeniyle hastaneye yatıştan kaynaklandığına ve kardiyovasküler ölüm açısından açık bir farklılık olmadığına işaret etmektedir (Şekil 2).
Dapagliflozinin plaseboya kıyasla sahip olduğu tedavi yararı hem kanıtlanmış kardiyovasküler hastalığı bulunan hem de bulunmayan hastalarda ve hem başlangıçta kalp yetersizliği bulunan hem de bulunmayan hastalarda gözlenmiştir. Bu yarar yaş, cinsiyet, böbrek fonksiyonu (eGFR) ve bölgenin aralarında olduğu kilit alt gruplarda tutarlılık sergilemiştir.
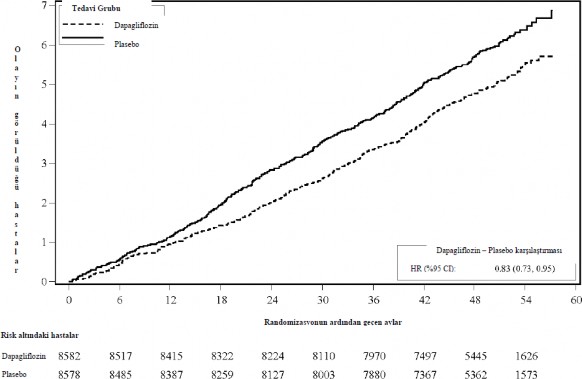
Şekil 1: Kalp yetersizliği nedeniyle ilk hastaneye yatışa veya kardiyovasküler ölüme kadar geçen süre
Risk altındaki hastalar periyodun başlangıcındaki risk altındaki hastaların sayısıdır. HR=Tehlike oranı GA=güven aralığı.
Birincil ve ikincil sonlanım noktalarının sonuçları Şekil 2'de gösterilmektedir. MACE için dapagliflozinin plasebo karşısındaki üstünlüğü gösterilmemiştir (p=0,172). Bu nedenle renal bileşik son nokta ve tüm nedenlere bağlı mortalite doğrulayıcı test prosedürünün bir parçası olarak test edilmemiştir.
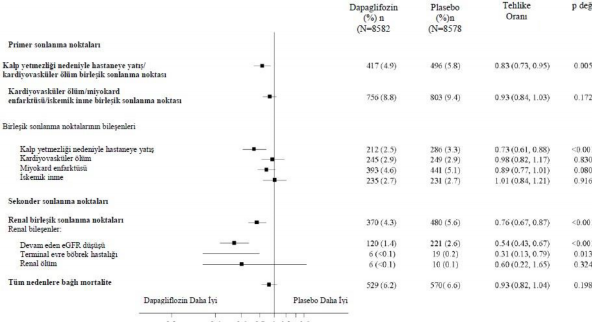
Şekil 2: Primer birleşik sonlanım noktaları ile bunların bileşenleri ve sekonder sonlanım noktaları ile bunların bileşenleri üzerindeki tedavi etkileri
Renal birleşik sonlanım noktası şu şekilde tanımlanmıştır: eGFR'de devam eden doğrulanmış
≥ %40'lık düşüş (eGFR <60 mL/dak/1,73m'ye) ve/veya son dönem böbrek hastalığı (≥ 90 gün diyaliz veya böbrek nakli, devam eden doğrulanmış eGFR < 15 mL/dak/1,73m) ve/veya renal ya da kardiyovasküler ölüm.
p değerleri primer sonlanım noktaları için iki yanlı p değerleridir, sekonder sonlanma noktaları ve tüm tekli bileşenler içinse nominal p değerleridir. İlk olay meydana gelene kadar geçen süre Cox orantılı tehlikeler modeli kullanılarak analiz edilmiştir. Tekli bileşenler için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısıdır ve birleşik sonlanım noktasındaki olayların sayısına eklenmez. GA=güven aralığı.
Nefropati
Dapagliflozin doğrulanmış devam eden eGFR düşüşü, son dönem böbrek hastalığı, renal veya kardiyovasküler ölüm birleşik olaylarının insidansını azaltmıştır. Gruplar arasındaki farklılık renal bileşenler olan devam eden eGFR düşüşü, son dönem böbrek hastalığı ve renal ölümde ortaya çıkan azalmalardan kaynaklanmıştır (Şekil 2).
Nefropatiye kadar geçen süre için tehlike oranı (HR) (sürekli eGFR azalması, son evre böbrek hastalığı ve renal ölüm) plaseboya karşı dapagliflozin için 0,53 (%95 GA 0,43, 0,66) olmuştur.
Ayrıca, plasebo ile karşılaştırıldığında dapagliflozin yeni başlangıçlı sürekli albüminüriyi azaltmış (HR 0,79 [%95 GA 0,72, 0,87]) ve makroalbüminüride daha fazla gerileme sağlamıştır
(HR 1,82 [%95 GA 1,51, 2,20]).
Kalp yetersizliği
Dapagliflozin ve Kalp Yetersizliğinde Advers Sonuçların Önlenmesi (DAPA-HF) çalışması, düşük ejeksiyon fraksiyonu (sol ventriküler ejeksiyon fraksiyonu [LVEF] ≤ %40) ile seyreden kalp yetersizliği (New York Kalp Birliği [NYHA] fonksiyonel sınıfı II-IV) görülen hastalar üzerinde arka plan standart tedaviye eklenen dapagliflozinin kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşme insidansı üzerinde plaseboya kıyasla etkisini belirlemek amacıyla gerçekleştirilmiş olan uluslararası, çok merkezli, randomize, çift kör, plasebo kontrollü bir çalışmaydı.
4744 hastanın 2373'ü 10 mg dapagliflozine, 2371'i ise plaseboya randomize edildi ve medyan 18 aylık bir süre boyunca takip edildi. Çalışma popülasyonunun medyan yaşı 66'ydı ve %77'si erkekti.
Başlangıçta hastaların %67,5'i NYHA sınıf II, %31,6'sı sınıf III, %0,9'u ise sınıf IV şeklinde sınıflandırıldı, medyan LVEF %32'ydi, kalp yetmezliklerinin %56'sının iskemik, %36'sının iskemik dışı olduğu görüldü, %8'inin ise etiyolojisi belirlenemedi. Her bir tedavi grubundaki hastaların %42'si tip 2 diyabet öyküsüne sahipti ve her bir gruptaki hastaların ilave bir %3'ü hem kayıt hem de randomizasyon sırasında ≥ %6,5 seviyesinde HbA1c değerine dayanılarak tip 2 diyabete sahip şeklinde sınıflandırıldı. Hastalara standart tedavi uygulanmaktaydı; hastaların %94'ü ACE-I, ARB veya anjiyotensin reseptörü-neprilisin inhibitörü (ARNI, %11),
%96'sı beta-bloker, %71'i mineralokortikoid reseptör antagonisti (MRA), %93'ü diüretik ile tedavi görmekteydi, %26'sında ise implante edilebilir bir cihaz (defibrilatör fonksiyonu ile) bulunmaktaydı.
Kayıt sırasında eGFR değeri ≥ 30 mL/dak/1,73 m olan hastalar çalışmaya dahil edildi. Ortalama eGFR değeri 66 mL/dak/1,73 m'ydi, hastaların %41'inde eGFR < 60mL/dak/1,73 m, %15'inde ise eGFR < 45 mL/dak/1.73 m olarak tespit edildi.
Kardiyovasküler ölüm ve kalp yetersizliğinde kötüleşme
Dapagliflozin, kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetersizliği nedeniyle acil servis ziyareti primer birleşik sonlanma noktasını önlemek konusunda plaseboya kıyasla üstünlük sergilemiştir (HR 0,74 [%95 GA 0,65, 0,85], p < 0,0001). Bu etki erken dönemde gözlenmiştir ve çalışma süresince varlığını korumuştur (Şekil 3).
Şekil 3: Kardiyovasküler ölüm, kalp yetersizliği nedeniyle hastaneye yatış veya kalp yetersizliği nedeniyle acil hastane ziyaretini içeren primer birleşik sonlanma noktası ilk ortaya çıkana kadar geçen süre
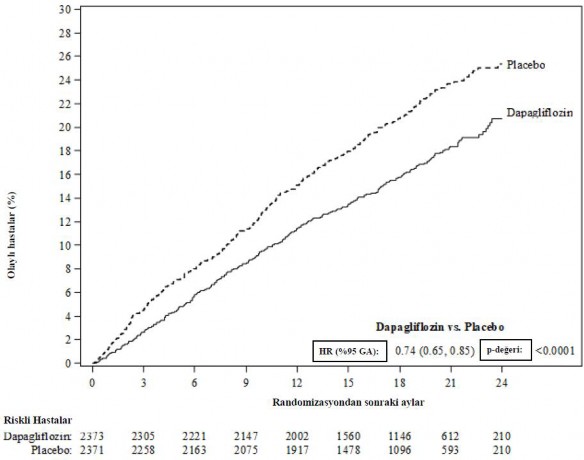
Kalp yetersizliği nedeniyle acil hastane ziyareti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavi gerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır.
Risk altındaki hastalar periyodun başlangıcında risk altında olan hastaların sayısıdır.
Primer birleşik sonlanma noktasının üç bileşeni de tedavi etkisine ayrı ayrı katkıda bulunmuştur (Şekil 4). Birkaç acil kalp yetersizliği ziyareti olmuştur.
Şekil 4: Primer birleşik sonlanma noktası, onun bileşenleri ve tüm nedenlerden kaynaklanan mortaliteye ilişkin tedavi etkileri
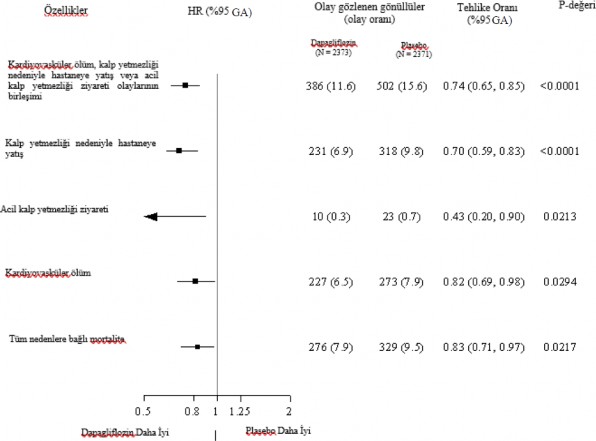
Kalp yetersizliği nedeniyle acil hastane ziyareti, örneğin bir acil serviste gerçekleştirilen ve kalp yetersizliğinde kötüleşme (yalnızca oral diüretiklerde bir artış şeklinde değil) nedeniyle tedavi gerektiren, acil, planlı olmayan bir doktor değerlendirmesi şeklinde tanımlanmıştır.
İlk olayların sayısı, her bir bileşene ilişkin ilk olayların gerçek sayısıdır ve toplamı birleşik sonlanma noktasındaki olay sayısına eşit değildir.
Olay oranları, 100 hasta yılı takip başına olay gözlenen gönüllülerin sayısı şeklinde sunulmaktadır.
Tek tek bileşenlere ve tüm nedenlerden kaynaklanan mortaliteye ilişkin p değerleri nominaldir.
Dapagliflozin, aynı zamanda kalp yetersizliği nedeniyle hastaneye yatış (ilk ve rekürren) ve kardiyovasküler ölüm olaylarının toplam sayısını düşürmüştür; dapagliflozin grubunda 567 olay, plasebo grubunda ise 742 olay ortaya çıkmıştır (Olay Oranı 0,75 [%95 GA 0,65, 0,88], p
< 0,0002).
Dapagliflozinin ortaya çıkardığı tedavi yararı, tip 2 diyabeti olan ve olmayan kalp yetersizliği hastalarında gözlenmiştir. Dapagliflozin, kardiyovasküler ölüm insidansı ve kalp yetersizliğinde kötüleşme primer birleşik sonlanma noktasını diyabet hastalarında 0,75'lik (%95 GA 0,63, 0,90), bir HRdeğeriiledüşürmüştür.
Dapagliflozinin primer sonlanma noktası üzerinde plaseboya kıyasla sergilediği tedavi faydası, eşzamanlı kalp yetersizliği tedavisi, böbrek fonksiyonu (eGFR), yaş, cinsiyet ve bölgenin de aralarında olduğu diğer kilit alt gruplarda da tutarlılık göstermiştir.
Hasta tarafından bildirilen sonuç â kalp yetersizliği semptomları
Dapagliflozinin kalp yetersizliği semptomları üzerinde ortaya çıkardığı tedavi etkisi, bitkinlik, periferik ödem, dispne ve ortopneyi içeren kalp yetersizliği semptomlarının sıklığını ve şiddetini ölçen Kansas City Kardiyomiyopati Anketi Toplam Semptom Skoru (KCCQ-TSS) ile değerlendirilmiştir. Skor 0 ile 100 arasında değişmektedir ve daha yüksek skorlar sağlık durumunun daha iyi olduğunu göstermektedir.
Dapagliflozinle uygulanan tedavi, KCCQ-TSS'de başlangıçtan 8. aya kadar meydana gelen değişiklikle ölçüldüğü üzere, kalp yetersizliği semptomları üzerinde plaseboya kıyasla istatistiksel ve klinik açıdan anlama sahip olan bir yarar ortaya çıkarmıştır (Kazanç Oranı 1,18 [%95 GA 1,11, 1,26]; p < 0,0001). Hem semptom sıklığı hem de semptom yükü sonuçlara katkıda bulunmuştur. Hem kalp yetersizliği semptomlarında iyileşme sağlanması hem de kalp yetersizliği semptomlarındaki kötüleşmenin önlenmesi konusunda yarar gözlenmiştir.
Yanıt veren analizlerinde KCCQ-TSS'de başlangıçtan 8. aya 5 puan veya daha fazla artış şeklinde tanımlanan klinik açıdan anlamlı bir iyileşme gözlenen hastaların oranının dapagliflozin tedavisi grubunda plaseboya kıyasla daha yüksek olduğu görülmüştür. 5 puan veya daha fazla düşüş şeklinde tanımlanan klinik açıdan anlamlı kötüleşme gözlenen hastaların oranının dapagliflozin tedavisi grubunda plaseboya kıyasla daha düşük olduğu görülmüştür. Dapagliflozin ile elde edilen yararlar, klinik açıdan anlamlı daha büyük değişiklik için daha konservatif kesmeler uygulandığında da varlığını korumuştur (Tablo 10).
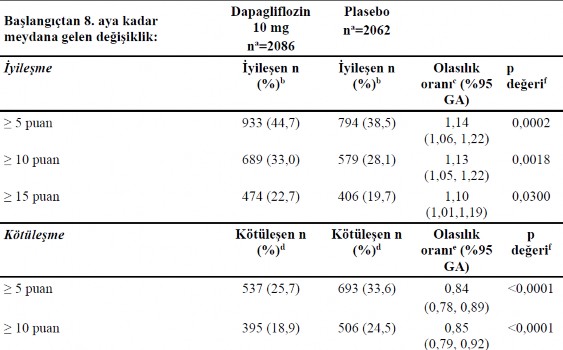
Tablo 10. KCCQ-TSS'de 8 ayda klinik açıdan anlamlı iyileşme ve kötüleşme yaşayan hastaların sayısı ve yüzdesi
5.2. Farmakokinetik özellikler
Genel Özellikler
Emilim:
Dapagliflozin, oral uygulama sonrasında hızla ve iyi absorbe edilmektedir. Maksimum dapagliflozin plazma konsantrasyonlarına (C) genellikle aç karnına uygulamadan sonraki iki saat içerisinde ulaşılmaktadır. Günde bir kez 10 mg dapagliflozin dozlarından sonra geometrik ortalama kararlı durum dapagliflozin Cve EAAdeğerleri sırasıyla 158 ng/mL ve 628 ng s/mL olmuştur. 10 mg dozunun uygulanmasından sonra dapagliflozinin mutlak oral biyoyararlanımı %78 olmaktadır. Yüksek oranda yağ içeren bir öğünle birlikte verildiğinde dapagliflozinin Cdeğeri %50'ye kadar azalmış ve Tdeğeri yaklaşık 1 saat uzamış; ancak açlık durumu ile karşılaştırıldığında EAA değeri değişmemiştir. Bu değişiklikler klinik olarak anlamlı kabul edilmemektedir. Bu nedenle DAPLİG aç veya tok karnına alınabilir.
Dağılım:
Dapagliflozin yaklaşık %91 oranında proteine bağlanmaktadır. Proteine bağlanma oranı farklı hastalık durumlarından etkilenmemektedir (örn. böbrek veya karaciğer yetmezliği). Dapagliflozinin ortalama kararlı durum dağılım hacmi 118 L'dir.
Biyotransformasyon:
Dapagliflozin büyük ölçüde metabolize olarak, başlıca inaktif bir metabolit olan dapagliflozin 3-O-glukuronide metabolize olmaktadır. Dapagliflozin 3-O-glukuronid veya diğer metabolitler glukoz düşürücü etkilere katkıda bulunmamaktadır. Dapagliflozin 3-O-glukuronid oluşumuna karaciğer ve böbrekte bulunan bir enzim olan UGT1A9 aracılık eder ve CYP'nin aracılık ettiği metabolizma insanda minör bir klerens yolağıdır.
Eliminasyon:
Dapagliflozinin ortalama plazma terminal yarı ömrü (t) sağlıklı bireylere tek oral 10 mg dapagliflozin dozunun uygulanmasından sonra 12,9 saattir. İntravenöz uygulanan dapagliflozinin ortalama toplam sistemik klerensi 207 mL/dak olarak ölçülmüştür. Dapagliflozin ve ilgili metabolitleri başlıca idrar yolu ile elimine olur ve bunun %2'den azı değişmemiş dapagliflozin şeklindedir. 50 mg [C]-dapagliflozin dozunun uygulanmasından sonra %96'sı geri kazanılmış olup, bunun %75'i idrarda ve %21'i feçestedir. Feçeste dozun yaklaşık %15'i ana ilaç olarak atılmıştır.
Doğrusal/doğrusal olmayan durum:
Dapagliflozin maruziyeti, 0,1 mg ila 500 mg aralığında dapagliflozin dozundaki artış ile orantılı olarak artmıştır ve 24 haftaya kadarki tekrarlı günlük doz uygulamaları ile farmakokinetiğinde zaman içinde değişiklik olmamıştır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Kararlı durumda (7 gün süreyle günde bir kez 20 mg dapagliflozin), tip 2 diabetes mellitusu ve hafif, orta veya ağır derecede böbrek yetmezliği olan bireylerde (ioheksol plazma klerensi ile belirlenmiştir) ortalama sistemik dapagliflozin maruziyeti, böbrek fonksiyonu normal olan tip 2 diabetes mellitusu olan bireylere göre sırasıyla %32, %60 ve %87 daha yüksek olmuştur. Kararlı durumda 24 saatlik üriner glukoz atılımı, böbrek fonksiyonu ile yüksek derecede ilişkili olup tip 2 diabetes mellitusu ve normal böbrek fonksiyonu olan bireylerde veya hafif, orta veya ağır derecede böbrek yetmezliği olan hastalarda sırasıyla 85, 52, 18 ve 11 g glukoz/gün atılımı tespit edilmiştir. Hemodiyalizin dapagliflozin maruziyetine etkisi bilinmemektedir. Böbrek fonksiyonundaki azalmanın sistemik maruziyet üzerindeki etkisi, bir popülasyon farmakokinetik modelinde incelenmiştir. Önceki sonuçlarla tutarlı olarak, modelin tahmini AUC değeri normal böbrek fonksiyonuna sahip hastalara kıyasla kronik böbrek hastalığı bulunan hastalarda daha yüksektir ve tip 2 diyabeti bulunan ve bulunmayan kronik böbrek hastaları arasında anlamlı fark yoktur.
Karaciğer yetmezliği:
Hafif veya orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf A ve B), ortalama dapagliflozin Cve EAA değerleri, sağlıklı, benzer özelliklere sahip kontrol bireylere kıyasla sırasıyla %12'ye ve %36'ya kadar daha yüksek olmuştur. Bu farklılıkların klinik olarak anlamlı olmadığı kabul edilmiştir. Ağır derecede karaciğer yetmezliği olan bireylerde (Child-Pugh sınıf C) dapagliflozinin ortalama Cve EAA değerleri, benzer özelliklere sahip sağlıklı kontrollerden sırasıyla %40 ve %67 daha yüksek bulunmuştur.
Geriyatrik hastalarda (≥ 65 yaş):
70 yaşına kadarki bireylerde tek başına yaşa bağlı maruziyette klinik olarak anlamlı bir artış olmamaktadır. Bununla birlikte, böbrek fonksiyonunda yaşa bağlı düşüş nedeniyle artmış maruziyet beklenebilir. 70 yaşın üzerindeki hastalarda maruziyet ile ilgili sonuçlara varabilmek için yeterli veri bulunmamaktadır.
Pediyatrik popülasyon
Pediyatrik popülasyonda farmakokinetik henüz çalışılmamıştır.
Cinsiyet
Kadınlarda ortalama dapagliflozin EAAdeğerinin erkeklere oranla %22 daha yüksek olduğu tahmin edilmektedir.
Irk
Beyaz, Siyah veya Asyalı ırklar arasında sistemik maruziyet açısından klinik olarak anlamlı herhangi bir farklılık bulunmamaktadır.
Vücut ağırlığı
Dapagliflozin maruziyetinin, artan ağırlıkla düştüğü bulunmuştur. Bu nedenle düşük vücut ağırlığına sahip hastalarda maruziyet biraz daha yüksek olabilir ve yüksek vücut ağırlığına sahip hastalarda ise maruziyet biraz daha düşük olabilir. Bununla birlikte maruziyetteki farklılıklar klinik açıdan önemli kabul edilmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler; güvenlilik farmakolojisi, tekrarlı doz toksisitesi, genotoksisite, karsinojenik potansiyel ve fertiliteyi kapsayan standart çalışmalar doğrultusunda insanlar için özel bir tehlike ortaya koymamıştır. Dapagliflozin farelerde veya sıçanlarda, iki yıllık karsinojenisite çalışmalarında değerlendirilen dozların herhangi birinde tümör oluşumuna neden olmamıştır.
Üreme toksisitesi ve gelişimsel toksisite
Yeni sütten kesilen jüvenil sıçanlara doğrudan dapagliflozin uygulaması ve gebelik (insanda böbrek matürasyonu açısından gebeliğin ikinci ve üçüncü trimesterlerine karşılık gelen dönemler) ile emzirme dönemi sırasındaki dolaylı maruziyet, ayrı ayrı, yavrularda böbrek pelvis ve tübüler dilatasyon insidans ve/veya şiddetinde artış ile ilişkilidir.
Jüvenil toksisite çalışmasında, dapagliflozin genç sıçanlara 21. postnatal günden itibaren postnatal 90. güne kadar doğrudan uygulandığında tüm doz düzeylerinde renal pelvis ve tübüler dilatasyonlar bildirilmiştir; yavrularda, test edilen en düşük dozda maruziyet, maksimum önerilen insan dozunun ≥ 15 katı olmuştur. Bu bulgular, tüm dozlarda gözlenen dozla ilişkili böbrek ağırlığı artışı ve makroskobik böbrek büyümesi ile ilişkilendirilmiştir. Jüvenil hayvanlarda gözlenen renal pelvik ve tübüler dilatasyonlar yaklaşık 1 aylık iyileşme döneminde tamamen geri dönüşümlü olmamıştır.
Başka bir prenatal ve postnatal gelişim çalışmasında anne sıçanlara gebeliğin 6. gününden postnatal 21. güne kadar doz uygulanmıştır ve yavrular intra uterin ve emzirme yoluyla ilaca dolaylı olarak maruz bırakılmıştır (sütte ve yavrularda dapagliflozin maruziyetini değerlendirme amaçlı bir ek çalışma gerçekleştirilmiştir). İlaç uygulanan dişi hayvanların erişkin yavrularında renal pelvis dilatasyon insidansında veya şiddetinde artış görülmüş; ancak bu etkiler sadece test edilen en yüksek dozda meydana gelmiştir (karşılık gelen maternal ve yavru dapagliflozin maruziyetleri maksimum önerilen insan dozunda insan değerinin sırasıyla 1415 ve 137 kat üstü olmuştur). Bunlar dışındaki gelişimsel toksisite etkileri yavruların vücut ağırlıklarında dozla ilgili düşüşleri ile sınırlı olmuş ve sadece ≥ 15 mg/kg/gün dozlarında görülmüştür (maksimum önerilen insan dozunda insan değerlerinin ≥ 29 katı olan yavru maruziyetleri ile ilişkili). Maternal toksisite sadece test edilen en yüksek dozda görülmüş ve vücut ağırlığında ve dozla birlikte yem tüketiminde geçici azalmalar ile sınırlı kalmıştır. Gelişimsel toksisite açısından advers etkinin görülmediği düzey (NOAEL), yani test edilen en düşük doz, maksimum önerilen insan dozunda insan değerinin yaklaşık 19 katı olan maternal sistemik maruziyet ile ilişkilidir.
Sıçanlar ve tavşanlardaki ek embriyo-fetal gelişim çalışmalarında dapagliflozin, her türde başlıca organogenez dönemlerine denk gelen aralıklarda uygulanmıştır. Tavşanlarda test edilen dozların herhangi birinde maternal ya da gelişimsel toksisite gözlenmemiştir; test edilen en yüksek doz, maksimum önerilen insan dozunun yaklaşık 1191 katı sistemik maruziyet ile ilişkilidir. Dapagliflozin, sıçanlarda, maksimum önerilen insan dozunun 1441 katına kadarki maruziyetlerde embriyoletal ya da teratojenik etki göstermemiştir.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Saba İlaç Sanayi ve Ticaret A.Ş.
| Satış Fiyatı | 596.98 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 596.98 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699511099171 |
| Etkin Madde | Dapagliflozin |
| ATC Kodu | A10BK01 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Sindirim Sistemi ve Metabolizma > Oral Antidiyabetik İlaçlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |