DEMOXIF %0.5 steril oftalmik çözelti 5 ml Klinik Özellikler
{ Moksifloksasin }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
DEMOXİF gözün ön segmentinde moksifloksasine hassas suşların sebep olduğu bakteriyel infeksiyonların topikal tedavisinde endikedir (bölüm 5.1'e bakınız).
Antibakteriyel ajanların uygun kullanımına yönelik resmi kılavuzlar dikkate alınmalıdır.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
Erişkinlerde ve yaşlılarda kullanım:
İnfekte göz(ler)e günde 3 kez 1 damla damlatılır.
İnfeksiyon normal olarak 5 günden sonra geçmektedir. Tedaviye devamındaki 2-3 gün boyunca da devam edilmelidir.
Uygulama şekli:
Oküler kullanım içindir.
Damlalık ucunun ve çözeltinin kontaminasyonunun önlenmesi açısından, şişenin damlalık ucunun göz kapaklarına, göz çevresine veya diğer yüzeylerine değdirilmemesine dikkat edilmelidir.
Damlatma ucunun ve çözeltinin temiz kalmasını sağlamak için, şişenin damlatma ucunun göz kapaklarına, göz çevresine veya diğer yüzeylerine değdirilmemesine dikkat edilmelidir. Kullanmadığınız zaman şişenin kapağını sıkıca kapalı tutunuz.
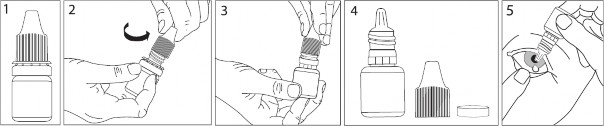
Elinize DEMOXİF göz damlasını ve bir ayna alınız.
Ellerinizi yıkayınız.
Şişenin kapağını açınız (bkz. resim 2).
Kapağın altında bulunan halkayı çıkarınız (bkz. resim 3 ve resim 4).
Damlatma ucuna değmemeye dikkat ederek şişenin kapağını açınız. Baş ve işaret parmağınızın arasında ucu aşağıya bakacak şekilde şişeyi tutunuz.
Başınızı arkaya doğru itiniz. Gözünüz ve göz kapağınız arasında bir alan oluşuncaya kadar temiz bir parmağınızın yardımıyla göz kapağınızı aşağıya doğru çekiniz. (bkz. resim 5) Damla bu alana damlatılacaktır.
Şişenin ucunu gözünüze yakın bir noktaya getiriniz. Yardımı olacaksa bir ayna kullanınız.
Gözünüze ya da göz kapağınıza, etrafındaki alanlara veya diğer bölgelere şişenin ucunu dokundurmayınız. Damlayı etkileyebilir.
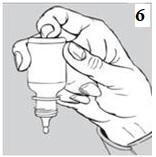
Bir damla DEMOXİF damlatmak için şişeyi hafifçe sıkınız(bkz. resim 6).
Eğer uygulamayı iki gözünüze de yapacaksanız, aynı basamakları diğer gözünüz için de uygulayınız.
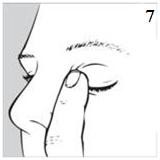
Özellikle yeni doğan bebeklerde veya küçük çocuklarda nazal mukoza yolu ile damlaların emilimini önlemek için, damlanın uygulanmasının ardından gözyaşı kanalları parmaklar yardımıyla 2-3 dakika kapalı tutulmalıdır (bkz. resim 7).
Kullandıktan sonra şişenin kapağını sıkıca kapatınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Oral moksifloksasinin farmakokinetik parametreleri hafif ve orta derecede karaciğer ve böbrek yetmezliği olan hastalarda anlamlı farklılıklar göstermedi. Ciddi karaciğer yetmezliği olan hastalarda çalışma yapılmadı. Topikal yolla uygulamada sistemik maruziyetin düşük olmasından dolayı karaciğer yetmezliği olan hastalarda DEMOXİF için doz ayarlamasına gerek görülmez.
Oral moksifloksasinin farmakokinetik parametreleri hafif, orta ve ileri derecede böbrek yetmezliği olanlarda anlamlı bir farklılık göstermemektedir. Böbrek yetmezliği olan
Pediyatrik popülasyon:
Doz ayarlanması gerekmemektedir. (Detaylı bilgi için bkz. bölüm Özel kullanım uyarıları ve önlemleri)
Geriyatrik popülasyon:
Yaşlılar ve diğer erişkinler arasında etkililik ve güvenilirlik açısından herhangi bir farklılık gözlenmemiştir.
4.3. Kontrendikasyonlar
DEMOXİF moksifloksasine, diğer kinolonlara ya da bu ürünün içeriğinde bulunan maddelerden herhangi birine aşırı duyarlılığı olan kişilerde kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Sadece oküler kullanım içindir. Enjeksiyon ile uygulanmaz. DEMOXİF subkonjonktival olarak ya da gözün ön kamarasına doğrudan enjekte edilemez.
Sistemik kinolon tedavisi gören hastaların bazılarında ilk dozu müteakip olmak üzere ciddi ve bazen öldürücü aşırı hassasiyet (anafilaktik) reaksiyonları bildirilmiştir. Bazı reaksiyonların yanında kardiyovasküler kolaps, bilinç kaybı, anjiyoödem (larenjeal, farenjeal ve yüz ödemi dahil), hava yolu tıkanması, nefes darlığı, ürtiker ve kaşıntı oluşmuştur.
DEMOXİF'e karşı alerjik bir reaksiyon oluşursa, ilacın kullanımı kesilmelidir. Moksifloksasine veya ürünün içindeki herhangi bir diğer maddeye karşı oluşan ciddi akut aşırı duyarlılık reaksiyonları derhal acil müdahale gerektirebilir. Oksijen ve hava yolu uygulaması klinik olarak belirtildiği şekilde tatbik edilmelidir.
Özellikle kortikosteroidlerle eş zamanlı olarak tedavi edilenler ve yaşlı hastalar olmak üzere moksifloksasin dahil sistemik florokinolon tedavisinde tendon enflamasyonu ve ruptür oluşabilir. Bu nedenle tendon enflamasyonun ilk belirtisinde DEMOXİF tedavisi kesilmelidir. Diğer antibakteriyel preparatlar gibi, moksifloksasinin de uzun süre kullanılması, mantar da dahil olmak üzere ilaca hassas olmayan organizmaların aşırı üremesi ile sonuçlanabilir. Eğer süper enfeksiyon oluşursa, kullanım kesilmeli ve alternatif bir tedavi başlatılmalıdır.
Yeni doğanların konjonktivit tedavisinde DEMOXİF'in etkililik ve güvenliliği ile ilgili bilgiler kısıtlıdır. Bu nedenle yeni doğanların konjonktivit tedavisinde DEMOXİF'in kullanımı önerilmez.
Florokinolon dirençli neisseria gonorrhoeae prevelansı nedeniyle, gonokokkal oftalmia neonatorum dahil gonokokkal konjonktivitin profilaksisinde veya empirik tedavisinde DEMOXİF kullanılmamalıdır.
yaşından küçük hastaların chlamydia trachomatis tedavisinde DEMOXİF bu yaş grubundaki hastalarda değerlendirilmediğiiçinkullanımıönerilmez. 2 yaşından büyük
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
DEMOXİF ile ilaç etkileşme çalışmaları yapılmamış olmakla birlikte, oral moksifloksasin ile topikal oküler dozun çok fazla üzerindeki dozlarda sistemik çalışmalar yapılmıştır. Diğer bazı florokinolonlardan farklı olarak, sistemik moksifloksasin ile itrakonazol, teofilin, varfarin, digoksin, oral kontraseptifler, probenicid, ranitidin veya gliburid arasında klinik açıdan anlamlı bir ilaç etkileşimi gözlenmemiştir.
Eğer birden fazla topikal oftalmik tıbbi ürün kullanılıyorsa, ilaçlar en az 5 dakika ara ile göze uygulanmalıdır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
Pediyatrik popülasyon ile ilgili veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Yeterli bilgi bulunmamaktadır.
Gebelik dönemi
DEMOXİF'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan deneysel çalışmalar sistemik uygulamanın ardından üreme toksisitesinin bulunduğunu göstermiştir (bölüm 5.3'e bakınız). DEMOXİF, sadece beklenen yarar fetüsün potansiyel riskinden daha fazla ise gebelik sırasında kullanılmalıdır.
Laktasyon dönemi
Hayvanlarda oral uygulamadan sonra moksifloksasin anne sütüne geçmektedir. Moksifloksasinin insan sütüyle atılıp atılmadığı bilinmemektedir. Diğer kinolonlar gibi, moksifloksasin de gelişmekte olan hayvanların ağırlık taşıyan eklem kıkırdaklarında hasara yol açabilir (bölüm 5.3'e bakınız).Laktasyondönemindeki annelerde, gözlerine yapılan
uygulamadan sonra sadece çok az sistemik maruziyet beklenmesine rağmen, DEMOXİF laktasyon süresince beklenen yarar potansiyel riskinden daha fazla ise kullanılabilir.
Üreme yeteneği/Fertilite
Yeterli bilgi bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Diğer tüm göz damlalarında olduğu gibi, geçici görme bulanıklığı veya diğer görme rahatsızlıkları araba kullanma veya diğer makinelerin kullanımını etkileyebilir. Damlatma sonrası görmede bulanıklık olursa, hasta tekrar açık görüşü sağlanana kadar araba veya diğer bir makine kullanımına ara vermelidir.
4.8. İstenmeyen etkiler
2252 hastayı içeren klinik çalışmalarda, bu hastaların 1900'üne Moksifloksasin günde üç kez olmak üzere Moksifloksasin günde sekiz kere kadar uygulanmıştır. Bu müstahzarın toplam güvenlilik popülasyonu Amerika Birleşik Devletleri'nde ve Kanada'da 1389 hasta, Japonya'dan 586 hasta ve Hindistan'daki 277 hastadan oluşmaktadır. Klinik çalışmalarda Moksifloksasin ile ilgili olarak ciddi oftalmik veya sistemik istenmeyen etki rapor edilmemiştir. Bu ilaçla ilgili bildirilen en yaygın istenmeyen etkiler %1 ila %2 insidansında gözde ağrı ve gözde tahrişti. Bu istenmeyen etkilere maruz kalan hastaların %96'sında bu istenmeyen etkilerin şiddeti hafif idi ve sadece 1 hastada istenmeyen etkiye bağlı olarak tedavi kesilmişti.
Gözlemlenen istenmeyen etkiler şu şekilde sınıflandırılmıştır:
Çok yaygın (≥1/10); yaygın (˃1/100 ila < 1/10); yaygın olmayan (˃1/1.000 ila ≤1/100); seyrek (˃1/10.000 ila ≤1/1.000), çok seyrek (≤ 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Yaygın olmayan: Hemoglobin azalması
Bağışıklık sistemi hastalıkları
Bilinmiyor: Hipersensitivite
Sinir sistemi hastalıkları
Yaygın: Disgözi
Yaygın olmayan: Baş ağrısı, parestezi Bilinmiyor: Sersemlik
Göz hastalıkları
Yaygın: Gözde ağrı, gözde iritasyon, göz kuruluğu, göz kaşıntısı, konjonktival hiperemi, oküler hiperemi
Yaygın olmayan: Korneal epiteldefekti,punktatkeratiti,korneal lekelenme, konjonktival
keskinliğinde azalma, göz kapağı hastalığı, göz kapağı ödemi, göz kapağı eritemi, gözde anormal hassasiyet
Bilinmiyor: Endoftalmi, ülseratif keratit, korneal erezyon, korneal abrazyon, göz içi basıncında yükselme, korneal opaklık, korneal infiltratlar, korneal birikintiler, gözde alerji, keratit, korneal ödem, fotofobi, korneal bozukluk, blefarit, göz kapağında ödem, lakrimasyonda artış, gözde akıntı, gözde yabancı cisim hissi,
Kardiyak hastalıklar
Bilinmiyor: Palpitasyon
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Yaygın olmayan: Nazal rahatsızlık, faringolaringal ağrı, boğazda yabancı cisim hissi Bilinmiyor: Dispne
Gastrointestinal hastalıklar Yaygın olmayan: Kusma Bilinmiyor: Bulantı
Hepato-bilier hastalıklar
Yaygın olmayan: Alanin aminotransferaz artışı, gama-glutamiltransferaz artışı
Deri ve deri altı doku hastalıkları
Bilinmiyor: Eritem, pruritus, döküntü, ürtiker
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon
Yenidoğanlar dahil, pediyatrik hastaları içeren klinik çalışmalardan elde edilen verilere göre (bkz. bölüm 5.1) pediyatrik popülasyondaki istenmeyen etkilerin türü ve şiddeti yetişkinlerde görülenlerle aynıdır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0800 314 0008; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Konjonktival kesenin oftalmik ürünleri sınırlı bir düzeyde tutabilme kapasitesi DEMOXİF'in pratik olarak doz aşımı durumunu devre dışı bırakır.
Üründeki moksifloksasin dozu, kaza ile alınması neticesinde yan etki oluşturmayacak kadar düşüktür.
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Geri Ödeme Kodu | A16008 |
| Satış Fiyatı | 89.15 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 89.15 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525610119 |
| Etkin Madde | Moksifloksasin |
| ATC Kodu | S01AE07 |
| Birim Miktar | 0.5 |
| Birim Cinsi | % |
| Ambalaj Miktarı | 5 |
| Duyu Organları > Antienfektifler |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |