DESOLETT 150 mcg/30 mcg tablet Klinik Özellikler
{ Desogestrel + Etinilestradiol }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Oral kontrasepsiyon (Doğum kontrolü)
DESOLETT reçetelenme kararında kadının mevcut risk faktörleri, özellikle venöz tromboembolizm (VTE) için risk faktörleri ve DESOLETT kullanımıyla VTE riskinin diğer kombine hormonal kontraseptiflerle (KHK) karşılaştırması göz önünde bulundurulmalıdır (bkz. bölüm 4.3 ve 4.4).
4.2. Pozoloji ve uygulama şekli
DESOLETT nasıl kullanılmalıdır
Tabletler paketin üzerinde belirtilen sırayla, her gün yaklaşık aynı saatlerde yeterli miktarda su ile alınmalıdır. 21 ardışık gün boyunca günde bir tablet alınacaktır. Bir sonraki pakete, genellikle çekilme kanamasının gerçekleştiği 7 günlük tablet alınmayan aradan sonra başlanacaktır. Kanama genellikle son tablet alındıktan 2-3 gün sonra başlar ve bir sonraki pakete başlandığında bitmemiş olabilir.
DESOLETT kullanmaya nasıl başlanacaktır
Daha önce hormonal doğum kontrolü uygulanmamışsa (geçen ay içerisinde)
Tercihen ilk paketten tablet alımına adet döneminin birinci gününde (adet kanamasının ilk günü) başlanması önerilir; bu durumda ilave doğum kontrol önlemlerine gerek yoktur.
Eğer adet kanaması başlamışsa (2, 3 veya 4 gün önce), tablet alımına menstrüal periyodun 5. günü başlanmalıdır. Bu durumda tablet kullanılan ilk 7 gün süresince ilave doğum kontrol önlemlerinin alınması önerilmektedir.
Eğer adet kanaması başlayalı 5 günden fazla zaman olmuşsa, hastaya DESOLETT tableti
almadan önce bir sonraki adet dönemine kadar beklemesi söylenmelidir.
21 günlük hap veya başka bir 22 günlük haptan DESOLETT'e geçiş:
Eski paketteki tüm tabletler bitirilmelidir. İlk DESOLETT tablet ertesi gün alınmalıdır; yani tabletlerin alımı arasında hiç boşluk bırakılmaz ve hastanın adet döneminin başlamasını beklemesine gerek yoktur. Tabletler âDESOLETT nasıl kullanılmalıdırâ başlığı altında verilen talimatlara göre alınmalıdır. İlave doğum kontrol önlemlerinin alınması gerekmez. Hasta ilk DESOLETT paketinin sonuna kadar adet kanaması yaşamayacaktır; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Başka bir kombine her gün alınan haptan (28 günlük tabletler) DESOLETT'e geçiş: DESOLETT'e her gün alınan hap paketindeki son aktif tablet alındıktan sonra (yani 21 veya 22 tablet alındıktan sonra) başlanmalıdır. İlk DESOLETT tablet ertesi gün alınır; yani tabletlerin alımı arasında hiç boşluk bırakılmaz ve hastanın adet döneminin başlamasını beklemesine gerek yoktur. Kesintisiz olarak 21 gün boyunca her gün yaklaşık aynı saatte bir tablet alınır ve bunu 7 günlük tabletsiz dönem izler. Sonraki her pakete 7 günlük tabletsiz dönem bitince başlanır. İlave doğum kontrol önlemlerinin alınması gerekmez. Her gün alınan hap paketinde kalan tabletler atılmalıdır. Hasta ilk DESOLETT paketinin sonuna kadar adet kanaması yaşamayacaktır; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Sadece progestojen içeren bir tabletten (Mini Hap) DESOLETT'e geçiş:
İlk DESOLETT tablet, adet kanamasının ilk gününde (o gün kadın bir mini hap almış olsa bile) alınmalıdır. Kesintisiz olarak 21 gün boyunca her gün yaklaşık aynı saatte bir tablet alınır ve bunu 7 günlük tabletsiz dönem izler. Sonraki her pakete 7 günlük tabletsiz dönem dolduktan sonra başlanır. Daha sonra ilave doğum kontrol önlemlerinin alınması gerekmez. Mini hap paketinde kalan tüm sadece progestojen içeren haplar atılmalıdır.
Eğer kadın bir mini hap almaktaysa, her zaman adet kanaması yaşamayabilir (özellikle emzirme döneminde). İlk DESOLETT tablet, mini hapın bırakıldığı günün ertesi günü alınmalıdır. Mini hap paketinde kalan tüm haplar atılmalıdır. İlk 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Sadece progestojen içeren enjeksiyon, implant veya progestojen salan bir rahim içi sistemden geçiş
Kadın implanttan herhangi bir günde, rahim içi sistemden bu sistemin bırakıldığı gün ve enjektabl bir üründen sonraki enjeksiyon zamanı geldiğinde geçiş yapabilir. İlk 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Doğumdan Sonra Uygulama
Bebek doğduktan sonra, emzirmeyen annelere hormonal kontraseptif uygulamasına doğumdan 21 gün sonra başlanmalıdır; bu durumda hiçbir ilave doğum kontrol önlemine gerek yoktur. Eğer doğumdan sonra cinsel ilişki gerçekleşmişse, hormonal kontraseptif kullanımı adet kanamasının ilk gününe kadar ertelenmelidir.
DESOLETT'in doğum sonrası uygulanmasına doğumun ardından 21 günden sonra başlanırsa, ilk 7 gün ilave kontraseptif önlemler gereklidir.
Not: Emziren annelere kombine hap kullanmamaları tavsiye edilmelidir; çünkü kombine hap anne sütünün miktarını azaltabilir; onun yerine sadece progestojen içeren bir hap kullanmaları önerilmelidir.
Düşük veya kürtajdan sonra uygulamaya derhal başlanmalıdır; bu durumda hiçbir ilave doğum kontrol önlemine gerek yoktur.
İlave doğum kontrol önlemleri
İlave doğum kontrol önlemleri gerekirse, hastaya ya hiç cinsel ilişkiye girmemesi ya da diyafram ile birlikte spermisit kullanması ya da eşinin prezervatif kullanması tavsiye edilmelidir.
Takvim yöntemleri önerilmemelidir çünkü hap doğal menstrüasyon döngüsüyle ilişkili olağan siklus değişikliklerini (örn., servikal mukusta ve vücut sıcaklığında değişiklikler) olumsuz etkiler.
Bir adet dönemi nasıl atlanır?
Bir adet dönemini atlamak için, yeni DESOLETT paketine mevcut paket bitirildikten sonraki gün başlanmalıdır (hasta tabletsiz günleri atlar). Tablet alımına olağan şekilde devam edilmelidir. İkinci paketin kullanımı sırasında kadın hafif lekelenme veya ara kanama yaşayabilir; ancak hiçbir tablet atlanmadığı sürece ilave doğum kontrol yöntemine ihtiyaç yoktur. Sonraki DESOLETT paketine, adet kanaması tamamen bitmiş olsun veya olmasın, olağan 7 günlük tabletsiz dönemden sonra başlanır.
Tablet kullanımı unutulduğunda yapılması gerekenler:
Tablet alımının unutulması durumunda öneriler
Tabletlerin alımı unutulursa DESOLETT'in güvenilirliği azalabilir:
Unutulan tablet 12 saat içerisinde alınırsa, ilave hiçbir önleme gerek yoktur; sonraki tabletler
normal zamanında alınmalıdır.
Kullanıcının tablet almayı unutmasından itibaren 12 saatten fazla bir süre geçmişse, gebeliğe karşı koruyucu etki azalmış olabilir. Kadın, almayı unuttuğu son tableti almalı (aynı gün iki tablet alınması anlamına gelse bile) ve ardından tabletleri normal zamanında almaya devam etmelidir. Sonraki 7 gün boyunca ilave doğum kontrol önlemleri alınmalı ve hasta â7 gün kuralınıâ uygulamalıdır.
7 Gün Kuralı
Herhangi bir tabletin alımı 12 saatten uzun süre unutulursa, Kadın 12 saatten daha uzun süren kusma veya diyare yaşarsa,
Kadın âDiğer tıbbi ürünler ile etkileşimlerâ bölümünde listelenen ilaçlardan herhangi birini alıyorsa:
Kadın tabletleri olağan şekilde almaya devam etmeli ve sonraki 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Ancak, bu 7 günlük süre mevcut paketin bitiminden sonrasına uzarsa, sonraki pakete mevcut paket bittiği anda başlanmalıdır; yani paketler arasında hiç boşluk bırakılmamalıdır (Bu, tablet alımında oluşacak uzun süreli bir arayı önler; uzun süreli ara ovülasyon riskini arttırabilir ve dolayısıyla kontraseptif korumayı azaltabilir). Kadın 2 paket bitene kadar adet kanaması yaşamayabilir; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Kusma veya şiddetli diyare durumunda öneriler
Şiddetli gastrointestinal bozukluklarda, emilim tam olarak gerçekleşmeyebilir ve ilave doğum kontrol hapı almak gerekebilir. Diyare aşırı derecede şiddetli olmadıkça, steroid emilimini etkilemez.
Tablet alındıktan sonra 3-4 saat içerisinde kusma meydana gelirse veya şiddetli veya uzun süreli diyare durumlarında, unutulan tabletlerle ilgili önerilere uyulması gerekmektedir. Normal tablet alım takviminin değiştirilmesi arzu edilmiyorsa başka bir paketten ekstra tablet(ler)in alınması gerekmektedir.
Uygulama şekli:
Ağızdan yeterli miktarda su ile alınmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Herhangi bir etkililik ve güvenlilik çalışması yapılmamıştır.
Karaciğer fonksiyon testlerinin sonuçları anormal olursa, tedavi bırakılmalıdır. İlave bilgi için bkz. bölüm 4.3. ve bölüm 4.4.
Pediyatrik popülasyon:
18 yaşın altındaki adölesanlarda desogestrelin güvenliliği ve etkililiği bilinmemektedir. Herhangi bir veri mevcut değildir. Pediyatrik popülasyonda kullanımı uygun değildir.
Geriyatrik popülasyon:
Herhangi bir etkililik ve güvenlilik çalışması yapılmamıştır.
4.3. Kontrendikasyonlar
KHK'ler aşağıda listelenen durumların herhangi birinin varlığında kullanılmamalıdır. Aşağıda belirtilen durumlardan herhangi biri KHK kullanımı sırasında ilk defa ortaya çıkarsa, ürün kullanımı hemen durdurulmalıdır:
Mevcut venöz tromboembolizm (VTE) veya VTE riski
VTE â mevcut VTE (antikoagülan kullanırken) veya VTE öyküsü (örn. derin ven trombozu [DVT] veya pulmoner emboli [PE])
APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi venöz tromboembolizm için bilinen kalıtsal veya edinilmiş predispozisyon
4.4. Özel kullanım uyarıları ve önlemleri
Uyarılar:
Aşağıda değinilen durum ya da risk faktörlerinden herhangi birinin varlığında, DESOLETT'in uygunluğu kadın ile tartışılmalıdır.
Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk kez görülmesi durumunda, DESOLETT kullanımının durdurulup durdurulmayacağına karar vermek için derhal doktoru ile temasa geçmesi kadına tavsiye edilmelidir.
âDolaşım Bozuklukları
Dolaşım bozuklukları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir.
VTE riski
Herhangi bir KHK kullanımı hiç kullanım olmamasına kıyasla VTE riskini artırır. Levonorgestrel, norgestimat veya noretisteron en düşük VTE riskiyle ilişkilendirilmiştir. DESOLETT gibi diğer ürünlerde risk seviyesi bunun iki katına kadar olabilir. En düşük VTE riski olan ürün dışında herhangi bir ürünün kullanılmasına, DESOLETT'le VTE riskinin ne olduğu, mevcut risk faktörlerinin riski nasıl etkilediği ve kullanımın ilk yılında VTE riskinin en fazla olduğu kadınla konuşulduktan sonra karar verilmelidir. Buna ek olarak, 4 hafta veya daha uzun süre KHK kullanımından sonra ara verilip tekrar başlandığından, riskin arttığına dair bulgular vardır.
KHK kullanmayan veya hamile olmayan kadınlarda, bir yıl içinde 10.000 kadından 2'sinde VTE gerçekleşir. Ancak, altta yatan risk faktörlerine (bkz. aşağıdaki bölüm) bağlı olarak, bir kadındaki kişisel risk çok daha yüksek olabilir.
Desogestrel içeren KHK kullanan 10.000 kadından yaklaşık 9 ila 12'sinde bir yıl içerisinde VTE gelişeceği tahmin edilmektedir; bu, bir yılda levonorgestrel içeren KHK kullanan
10.000 kadından 6'sına karşılık gelmektedir.
Her iki durumda da bir yıldaki VTE sayısı, hamile olan veya postpartum dönemdeki kadınlarda beklenen sayıdan daha düşüktür.
Vakaların %1 ila 2'sinde VTE ölümcül olabilir.
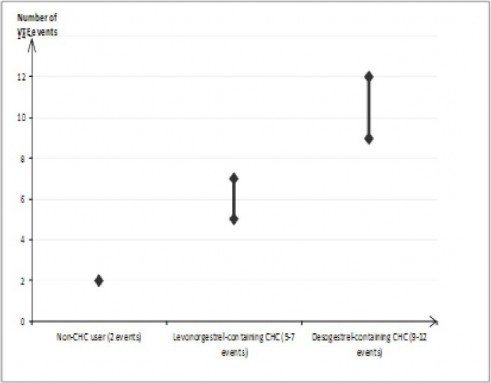
Bir yılda 10.000 kadında VTE olaylarının sayısı
KHK kullanıcılarında hepatik, mezenterik, renal ya da retinal venler ve arterler gibi diğer kan damarlarında son derece seyrek olarak tromboz bildirilmiştir.
VTE için risk faktörleri
KHK kullanan, ilave risk faktörleri olan bir kadında, özellikle birden fazla risk faktörü varsa (bkz. aşağıdaki tablo) venöz tromboembolik komplikasyon riski büyük oranda artabilir.
Birden fazla risk faktörü nedeniyle yüksek venöz tromboembolizm riski olan kadınlarda DESOLETT kontrendikedir (bkz. bölüm 4.3). Bir kadında birden fazla risk faktörü varsa, risk artışı, faktörlerin teker teker risk toplamından daha yüksek olabilir â bu durumda kadının toplam VTE riski değerlendirilmelidir. Risk yarar dengesi negatif olarak değerlendiriliyorsa, KHK reçetelenmemelidir (bkz. bölüm 4.3).
Tablo: VTE için risk faktörleri
Risk faktörü | Yorum |
Obezite (vücut kitle indeksi [VKİ] 30 kg/m'nin üzerinde) | VKİ arttıkça risk büyük oranda artar. Diğer risk faktörleri de mevcutsa özellikle göz önünde bulundurulması önemlidir. |
Uzun süreli hareketsiz kalma, majör cerrahi, bacak veya pelvise yapılan herhangi bir | Bu durumlarda bant/tablet/halkanın bırakılması (elektif cerrahi durumunda en |
cerrahi müdahale, nöroşirürji veya majör travma.
Not: Özellikle diğer risk faktörleri de mevcutsa, 4 saatten uzun havayolu seyahati dahil geçici hareketsiz kalma, VTE için bir risk faktörü olabilir. | azından 4 hafta önceden bırakılması) ve tekrar hareketlilik sağlandıktan 2 hafta sonrasına kadar başlanmaması tavsiye edilir. İstenmeyen gebeliği engellemek için başka bir doğum kontrol yöntemi kullanılmalıdır.
DESOLETT önceden bırakılmadıysa antitrombotik tedavi düşünülmelidir. |
Pozitif aile öyküsü (kardeş veya ebeveynlerde VTE, özellikle 50 yaş öncesi gibi erken yaşlarda) | Kalıtsal predispozisyondan şüpheleniliyorsa, KHK kullanımına karar vermeden önce kadın bir uzmana yönlendirilmelidir. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematozus, hemolitik üremik sendrom, kronik inflamatuar barsak hastalığı (Crohn hastalığı veya ülseratif kolit) ve orak hücre anemisi |
Artan yaş | Özellikle 35 yaş üzeri |
Venöz trombozun başlangıcı veya progresyonunda varikoz venlerin veya süperfisyal tromboflebitin olası rolü hakkında fikir birliği yoktur.
Hamilelik sırasında, özellikle doğum sonrası 6 haftalık dönemde, artmış tromboembolizm riski
göz önünde bulundurulmalıdır (gebelik ve laktasyon bilgileri için bkz. bölüm 4.6).
VTE'nin semptomları (derin ven trombozu ve pulmoner emboli)
Kadınlara semptomlar görüldüğü takdirde acil tıbbi yardıma başvurmaları ve ilgili sağlık çalışanına KHK kullandıklarını belirtmeleri gerektiği söylenmelidir.
Derin ven trombozunun (DVT) semptomları aşağıdakileri içerir:
Her iki bacak ve/veya ayakta ya da bacakta bir vende şişme;
Bacakta, yalnızca ayağa kalkarken veya yürürken hissedilebilen ağrı veya hassasiyet;
âDiğer durumlar
Hipertrigliseridemisi veya bu rahatsızlığa ilişkin bir aile öyküsü olan kadınlarda, KHK
kullanıldığında pankreatit riskinde artış olabilmektedir.
Eksojen östrojenler, kalıtsal ve edinilmiş anjiyoödem semptomlarını indükleyebilir veya
şiddetlendirebilir.
KHK kullanan birçok kadının kan basıncında küçük artışlar görülmekle birlikte, klinik açıdan anlamlı artışlar nadirdir. KHK kullanımı ile klinik hipertansiyon arasında herhangi bir ilişki saptanmamıştır. Fakat KHK kullanımı sırasında klinik açıdan anlamlı, kalıcı bir hipertansiyon gelişirse, doktorun KHK kullanımını kesmesi ve hipertansiyona yönelik tedavi uygulaması tedbirli bir davranış olacaktır. Uygun olduğu düşünüldüğünde, antihipertansif tedavi ile normal kan basıncı değerlerine ulaşıldıktan sonra KHK kullanımına tekrar başlanabilir.
Aşağıda sıralanan durumların hem gebelik hem de KHK kullanımı ile birlikte oluştuğu veya kötüleştiği bildirilmiştir, ancak KHK kullanımı ile bağlantısı kanıtlanmamıştır: Kolestaza bağlı sarılık ve/veya kaşıntı; safra taşı oluşumu; porfiri; sistemik lupus eritematozus; hemolitik-üremik sendromu; Sydenham's kore; herpes gestationis; otoskleroza bağlı işitme kaybı.
KHK'lerin periferik insülin direnci ve glukoz toleransı üzerinde bir etkisi olmakla birlikte, KHK kullanan diyabetik hastaların tedavi rejiminin değiştirilmesi gerektiğine dair hiçbir kanıt mevcut değildir. Fakat diyabetik kadınlar KHK kullanırken dikkatli bir şekilde gözlem altında tutulmalıdırlar.
Karaciğer fonksiyonunun akut veya kronik rahatsızlıkları, kararaciğer fonksiyonu normale dönene kadar KHK kullanımının kesilmesini gerekterebilir. Daha önceden gebelik sırasında ya da seks hormonlarının kullanımı sırasında meydana gelen kolestatik sarılığın tekrarlanması KHK kullanımının durdurulmasını gerektirir.
Ülseratif kolit ve Crohn hastalığı, KHK kullanımı ile ilişkilendirilmiştir.
Özellikle kloazma gravidarum (gebelik maskesi) öyküsü olan kadınlarda nadiren kloazma oluşabilir. Kloazmaya eğilimi olan kadınlar, bu ilacı kullanırken güneş veya ultraviyole ışınlarına maruz kalmamaya özen göstermelidirler.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Etkileşimler:
Oral kontraseptifler ile diğer medikal ürünler arasındaki etkileşimler ani kanamalara ve/veya yetersiz kontrasepsiyona yol açabilir. Aşağıdaki etkileşimler bildirilmiştir:
Karaciğer metabolizması:
Seks hormonlarının plazma konsantrasyonlarını düşürücü artmış klerense sebep olan mikrozomal enzimleri, özellikle sitokrom P450 enzimlerini (CYP) indükleyen medikal veya bitkisel ürünlerle etkileşimler ortaya çıkabilir ve DESOLETT de dahil, kombine oral kontraseptiflerin etkililiğini azaltabilir. Bu ürünler, fenitoin, fenobarbital, primidon, bosentan, karbamazepin, rifampisin, rifabutin ve muhtemelen de okskarbazepin, modafinil, topiramat, felbamat, griseofulvin, bazı HIV proteaz inhibitörleri (örn., ritonavir) ve nonnükleosit revers transkriptaz inhibitörleri (örn. efavirenz) ve bitkisel bir ilaç olan St. John's wort (Sarı Kantaron Otu) içeren ürünleri içerir.
Enzim indüksiyonu tedaviden birkaç gün sonra gerçekleşebilir. Maksimal enzim indüksiyonu genellikle birkaç hafta içinde gözlemlenir. İlaç tedavisinin bitiminden sonra enzim indüksiyonu 28 gün kadar sürebilir.
Yukarıda bahsedilen herhangi bir hepatik enzim-indükleyici medikal veya bitkisel ürün kullanan kadınlara DESOLETT'in etkililiğin azalabileceği konusunda bilgi verilmelidir. Hepatik enzim-indükleyici medikal ürünün kullanılması sırasında ve hepatik enzim-indükleyici medikal ürünün tedavi bitiminden sonra 28 gün için, DESOLETT'e ek olarak bir bariyer doğum kontrol yöntemi kullanılmalıdır.
Eğer, birlikte ilaç kullanımına mevcut KHK paketindeki tabletlerin bitişinden sonra başlanırsa, bir sonraki KHK paketine genellikle yapılan, tabletin alınmadığı aralık yapılmadan başlanmalıdır.
Enzim indükleyici medikal ürünlerle uzun süreli terapi alan kadınlar için, enzim indükleyici medikal ürünlerden etkilenmeyen alternatif bir kontrasepsiyon yöntemi düşünülmelidir.
Hormonal kontraseptifler, HIV proteaz inhibitörleri (örn., Nelfinavir) ve non-nükleozid revers transkriptaz inhibitörlerinin (örn., Nevirapin) birçok kombinasyonu ve / veya Hepatit C virüsü (HCV) tıbbi ürünleri (örn., Boceprevir, telaprevir) ile kombinasyonları birlikte uygulandığında, etonogestrel, desogestrelin aktif metaboliti veya östrojenler dahil olmak üzere progestinlerin plazma konsantrasyonlarını artırabilir veya azaltabilir. Bu değişikliklerin net etkisi, bazı vakalarda klinik olarak ilişkili olabilir.
-Güçlü CYP3A4 inhibitörlerinin (örn., ketokonazol, itrakonazol, klaritromisin) veya orta
dereceli CYP3A4 inhibitörlerinin (örn., flukonazol, diltiazem, eritromisin) birlikte
uygulanması desogestrelin aktif metaboliti etonogestrel dahil östrojen veya progesteron serum konsantrasyonlarını yükseltebilir.
-Oral kontraseptifler diğer ilaçların metabolizması ile etkileşebilir. Buna göre, plazma ve doku konsantrasyonları hem artabilir (örn. siklosporin) hem de azalabilir (örn. lamotrigin).
Not: Potansiyel etkileşimleri tanımlamak için eş zamanlı kullanılan ilaçların ürün bilgisine
başvurulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
18 yaşından küçük adolesanlarda etkililik ve güvenliliğe ilişkin hiçbir klinik veri mevcut değildir.
Farmakodinamik etkileşimler
Ribavirin veya glekaprevir / pibrentasvir içeren veya içermeyen, ombitasvir / paritaprevir / ritonavir ve dasabuvir içeren tıbbi ürünlerle eş zamanlı kullanım, ALT yükselme riskini artırabilir (bkz. Bölüm 4.3 ve 4.4). Bu nedenle, DESOLETT kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örn., sadece progestojen kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. DESOLETT, bu kombinasyon ilaç rejimi ile tedavinin tamamlanmasından 2 hafta sonra yeniden başlatılabilir.
Laboratuvar Testleri:
Kontraseptif steroidlerin kullanılması, karaciğer, tiroid, adrenal ve renal fonksiyonlara ilişkin biyokimyasal parametreleri, kortikosteroid bağlayıcı globülin ve lipit/lipoprotein fransiyonları gibi taşıyıcı proteinlerin plazma düzeylerini, karbohidrat metabolizması parametrelerini ile koagülasyon ve fibrinoliz parametreleride dahil olmak üzere bazı laboratuvar tetkiklerinin sonuçlarını etkileyebilmektedir. Değişiklikler genellikle normal laboratuvar sınırları içerisinde kalır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi X'tir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
DESOLETT, doğum kontrolü amacıyla kullanılmaktadır.
Gebelik dönemi
DESOLETT'in gebelik süresince kullanımı endike değildir. DESOLETT kullanımı sırasında
gebelik gerçekleşirse kullanıma devam edilmemelidir.
Ancak çoğu epidemiyolojik çalışmalar, ne gebelik öncesinde KHK kullanan kadınların çocuklarında doğum kusurlarında bir yükselme, ne de KHK'lerin erken gebelik döneminde yanlışlıkla alınması neticesinde herhangi bir teratojenik etki görülmediğini ortaya koymuştur.
Doğum sonrası dönemde DESOLETT kullanımına tekrar başlanırken VTE riskinin artışı göz önünde bulundurulmalıdır (bkz. Bölüm 4.2 ve 4.4).
Laktasyon dönemi
KHK'ler, anne sütünün kalitesini azalttıkları ve bileşimini değiştirdikleri için emzirme etkilenebilir. Dolayısıyla KHK kullanımı genel olarak bebeğin tamamen sütten kesilmesine
kadar önerilmemektedir. Süt ile birlikte küçük miktarlarda kontraseptif steroidlerin ve/veya bunların metabolitlerinin salgılanması mümkün olmakla birlikte, bu durumun bebeğin sağlığı üzerinde olumsuz bir etkiye sahip olduğuna ilişkin herhangi bir kanıt mevcut değildir.
Üreme yeteneği/Fertilite
Bu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için bu başlık geçerli değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine herhangi bir etkisi gözlenmemiştir.
4.8. İstenmeyen etkiler
Seçilmiş advers reaksiyonların tanımı
Tüm KHK'lardaki gibi, özellikle kullanımın ilk aylarında, vajinal kanama düzeninde değişiklik görülebilir. Bu değişiklikler kanama sıklığında (hiç, az, daha sık veya devamlı), yoğunluğunda (azalan veya artan) ve süresindeki değişiklikleri içerebilir.
KHK kullanan kadınlarda, miyokard infarktüsü, inme, geçici iskemik atak, venöz tromboz ve pulmoner emboli dahil, arteriyel ve venöz trombotik ve tromboembolik olay riskinde artış gözlenmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir.
DESOLETT veya KHK kullanıcılarında genel olarak raporlanmış muhtemelen bağlantılı istenmeyen etkiler aşağıda listelenmiştir. İstenmeyen olaylar aşağıda sistem organ sınıfına göre listelenmiştir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ila
≤1/10); yaygın olmayan (≥1/1.000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); çok seyrek
(≤1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları:
Seyrek: Hipersensitivite
Bilinmiyor: Kalıtsal ve edinilmiş anjiyoödem semptomlarının şiddetlenmesi
Metabolizma ve beslenme hastalıkları:
Yaygın olmayan: Sıvı tutulumu
Psikiyatrik hastalıklar:
Yaygın: Depresif ruh hali, değişken ruh hali
Yaygın olmayan: Libido azalması Seyrek: Libido artışı
Sinir sistemi hastalıkları:
Yaygın: Baş ağrısı Yaygın olmayan: Migren
Göz hastalıkları:
Seyrek: Kontakt lens intoleransı
Vasküler hastalıklar:
Seyrek: Venöz tromboembolizm, arteriyel tromboembolizm
Gastrointestinal hastalıklar: Yaygın: Bulantı, karında ağrı Yaygın olmayan: Kusma, diyare
Deri ve deri altı doku hastalıkları:
Yaygın olmayan: Döküntü, ürtiker
Seyrek: Eritema nodosum, eritema multiforme
Üreme sistemi ve meme hastalıkları:
Yaygın: Memede ağrı, meme hassasiyeti Yaygın olmayan: Memede büyüme Seyrek: Vajinal akıntı, memede akıntı
Araştırmalar:
Yaygın: Kiloda artış Seyrek: Kiloda azalma
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Doz aşımına bağlı ciddi zararlı etkilere ilişkin herhangi bir rapor mevcut değildir. Bu duruma bağlı olarak oluşabilen semptomlar şunlardır: Bulantı, kusma ve hafif bir vajinal kanama. Antidot mevcut değildir ve semptomatik tedavi uygulanmalıdır.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Organon Turkey İlaçları Ltd. Şti.
| Satış Fiyatı | 66.89 TL [ 13 May 2022 ] |
| Önceki Satış Fiyatı | 66.89 TL [ 6 May 2022 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 683280337077 |
| Etkin Madde | Desogestrel + Etinilestradiol |
| ATC Kodu | G03AA09 |
| Birim Miktar | 0,15+0,03 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Sistemik Hormonal Gebeliği Önleyici İlaçlar > Desogestrel + etinilestradiol |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |