DIANEFROL 4 %1.36 glükoz içeren PERITON diyaliz çözeltisi tekli torba 6000 ml Kısa Ürün Bilgisi
{ Peritonal Diyaliz Solüsyonu }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
DİANEFROL 4 % 3.86 glukoz içeren periton diyaliz çözeltisi Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Glukoz anhidroz 38,6 g/L (42,5 g/L Glukoz monohidrat) Sodyum klorür 5,38 g/L
Sodyum laktat 4,48 g/L Kalsiyum klorür, 2H2O 0,184 g/L Magnezyum klorür, 6H2O 0,051 g/L
Elektrolit bileşimi:
Sodyum: 132 mmol/litre (132 mEq/litre)
Kalsiyum: 1,25 mmol/litre (2,5 mEq/litre)
Magnezyum: 0,25 mmol/litre (0,5 mEq/litre)
Laktat: 40 mmol/litre (40 mEq/litre)
Klorür: 95 mmol/litre (95 mEq/litre)
Ozmolarite: 483 mOsm/litre 25°C sıcaklıktaki pH: 5,5
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Renksiz, berrak periton diyalizi çözeltisi.
Mini kapağı ambalajından alınız.
Ara setin uç kısmını aşağıya doğru pozisyonda tutunuz. Mini kapağı dikkatlice kavrayıp elinizle saat yönünde sıkarakiyicesabitlenene kadar ara seti üzerine (Şekle
bakınız) derhal yerleştiriniz. Not: Mini kapağı çok sıkmayınız.
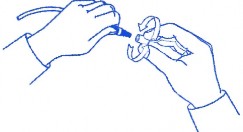
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
DİANEFROL 4 periton diyalizinin gerekli olduğu şu durumlarda endikedir:
Akut ve kronik böbrek yetmezliği;
4.2. Pozoloji ve uygulama şekli
Pozoloji / Uygulama sıklığı ve süresi:Tedavi şekli, sıklığı, kullanılacak çözeltinin hacmi, karın boşluğunda kalacağı süre ve toplam diyaliz süresi hastanın doktoru tarafından kararlaştırılır.
18 yaş altı hastalarda her bir değişimde 800-1400 ml/m² (maksimum 2000 ml) dolum hacmi önerilir. 2 yaş altı hastalarda her bir değişimde 500-1000 ml/m² dolum hacmi önerilir.
Hastanın vücut ağırlığı ideal kuru ağırlığa yaklaştıkça, düşük konsantrasyonlardaki
DİANEFROL 4'lerin tercih edilmesi önerilir.
Şiddetli dehidratasyon ve hipovolemi tehlikesiyle karşılaşmamak ve protein kaybını olabildiğince azaltmak amacıyla, her bir değişimde kullanılacak diyaliz sıvısının ozmolaritesinin, hastanın gereksinimine yanıt veren en düşük ozmolariteye sahip olacak şekilde seçilmesi önerilebilir.
Uygulama şekli:
İlacı kullanma ve uygulama öncesi alınması gereken önlemler
DİANEFROL 4 yalnızca periton içine uygulama içindir; intravenöz yoldan kullanılmaz.
4.3. Kontrendikasyonlar
DİANEFROL 4, ürün içeriğindeki etkin maddelere ya da 6.1 bölümünde listelenen
4.4. Özel kullanım uyarıları ve önlemleri
Periton diyalizi şu durumlarda dikkatle uygulanmalıdır:
İyileşme tamamlanana kadar cerrahi girişimler, konjenital anomaliler ya da travma sonucu periton membranı ve diyaframın bütünlüğünün bozulması, abdominal tümör, karın duvarının enfeksiyonu, herniler, fekal fistül, kolostomi veya ileostomi, sık divertikül iltihabı episodları, iflamatuvar ya da iskemik barsak hastalığı, büyük polikistik böbreklerin olması ya da karın duvarı, karın yüzeyi ya da karın boşluğunun bütünlüğünü bozan bir başka rahatsızlığın bulunduğu abdominal durumlar.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
DİANEFROL 4 ile diğer tıbbi ürünlerin etkileşimini araştıran bir çalışma bulunmamaktadır. Diyaliz işlemi sırasında, diyalizle uzaklaştırılan diğer ilaçların kan konsantrasyonları azalabilir.
Kardiyak glikozitleri kullanan hastalarda plazmadaki potasyum, kalsiyum ve magnezyum seviyeleri dijital intoksikasyonu riskine karşı dikkatle izlenmelidir.
4.6. Gebelik ve laktasyon
:Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (kontrasepsiyon) DİANEFROL 4'ün çocuk doğurma potansiyeli bulunan kadınlarda kullanımı ve doğum kontrolü üzerindeki etkilerine ilişkin veri yoktur. DİANEFROL 4 kullanılırken herhangi bir doğum kontrol yönteminin kullanılmasının gerekli olup olmadığına ilişkin bir çalışma yapılmamıştır.
Gebelik dönemi
DİANEFROL 4'ün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve- veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Hastanın başka bir diyaliz yöntemi ile tedavi edilemediği durumlar dışında gebelerde kullanılmamalıdır.
DİANEFROL 4 doktor tarafından gerekli görülmediği sürece gebe kadınlarda kullanılmamalıdır. Gebe kadınlara verilirken tedbirli olunmalıdır.
Gebelik döneminde periton diyalizi yöntemi tercih edilecekse, elde edilecek faydalar, olası komplikasyonlarla bir arada değerlendirildikten sonra tedaviye karar verilmelidir.
Laktasyon dönemi
Emziren kadınlarda DİANEFROL 4 kullanımı ile ilgili deneyimler yeterli değildir. DİANEFROL 4 reçetelemeden önce emzirmenin durdurulup durdurulmayacağına tedaviyi düzenleyen hekim tarafından karar verilmelidir.
Üreme yeteneği / fertilite
DİANEFROL 4'ün üreme yeteneği / fertilite üzerindeki etkisini araştıran bir çalışma bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Periton diyalizi tedavisi gören Son Dönem Böbrek Yetmezlikli (SDBY) hastalarda, araç ve makine kullanımını etkileyebilecek istenmeyen etkiler görülebilir (halsizlik, hipovolemi gibi).
4.8. İstenmeyen etkiler
Bu bölümdeki advers etkiler, DİANEFROL 4 ile veya periton diyalizi prosedürünün uygulanmasıyla bağlantılı olarak sunulmaktadır.
Klinik çalışmalar ve pazarlama sonrası deneyim sırasında hastalarda bildirilen advers etkiler aşağıda sıralanmıştır. Bildirilen advers ilaç reaksiyonlarının sıklık sınıflandırması şu şekildedir: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Metabolizma ve beslenme hastalıkları
Bilinmiyor: Hipokalemi, sıvı retansiyonu, hipervolemi, hipovolemi, hiponatremi, dehidratasyon, hipokloremi.
Vasküler hastalıklar
Bilinmiyor: Hipertansiyon, hipotansiyon.
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Bilinmiyor: Dispne.
Gastrointestinal hastalıklar
Bilinmiyor: Enkapsülan periton sklerozu (EPS), peritonit, peritoneal sıvıda bulanıklık, kusma, diyare, bulantı, kabızlık, karınağr ısı,karındadistansiyon,karında rahatsızlık hissi.
Deri ve deri altı doku hastalıkları
Bilinmiyor: Stevens-Johnson sendromu, ürtiker, döküntü (kaşıntılı, eritematöz ve yaygın döküntü dahil), kaşıntı.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Bilinmiyor: Miyalji, kas spazmları, kas-iskelet ağrıları.
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Bilinmiyor: Yaygın ödem, ateş, halsizlik, infüzyon bölgesi ağrısı.
Periton diyalizi sırasında görülen diğer prosedürel istenmeyen reaksiyonlar: Fungal peritonitler, bakteriyel peritonitler, kateterle ilişkili enfeksiyonlar, kateterle ilişkili komplikasyonlar.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Doz aşımının potansiyel sonuçları arasında hipervolemi, hipovolemi, elektrolit bozuklukları ya da hiperglisemi (diyabetik hastalarda) yer alır.
Doz aşımının tedavisi:
Hipervolemi durumu hipertonik periton diyalizi çözeltilerinin kullanımı ve sıvı kısıtlaması ile tedavi edilir.
Hipovolemi durumu dehidratasyonun derecesine göre oral veya intravenöz sıvı replasmanıyla tedavi edilir.
Elektrolit dengesindeki bozulmalar, azalan ya da artan elektrolit kan testleriyle belirlendikten sonra spesifik olarak bozukluğa yönelik olarak düzeltilmelidir. En olası bozukluk olan hipokalemi durumu potasyumun oral olarak uygulanmasıyla ya da diyaliz çözeltisine hekim önerisiyle potasyum klorür eklenmesiyle tedavi edilir.
Hiperglisemi (diyabetik hastalarda), insülin ya da diğer oral olarak kullanılan ilaçların dozunun hekim tarafından düzenlenen insülin şemasına göre ayarlanmasıyla tedavi edilebilir.
Ara setin uç kısmını aşağıya doğru pozisyonda tutunuz. Mini kapağı dikkatlice kavrayıp elinizle saat yönünde sıkarakiyicesabitlenene kadar ara seti üzerine (Şekle
bakınız) derhal yerleştiriniz. Not: Mini kapağı çok sıkmayınız.

5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Periton diyalizi çözeltileri ATC kodu: B05D
Periton diyalizi, böbrek yetmezliği olan hastalarda azot metabolizması sonucu oluşarak normalde böbrekler yoluyla atılan toksik maddelerin vücuttan uzaklaştırılmasını sağlayan ve bozulmuş olan asit-baz dengesi yanında sıvı ve elektrolit dengesizliklerinin düzeltilmesine de yardımcı olan bir yöntemdir.
membranı boyunca gerçekleşir. Bir kaç saatlik bekleme süresinden sonra, çözelti toksik maddeler açısından doygun duruma gelir ve değiştirilmesi gerekir. Diyaliz sıvısının elektrolit yoğunlukları, bikarbonat ön-maddesi olarak eklenmiş laktat hariç, plazmanın elektrolit konsantrasyonunu normalleştirmek amacıyla formüle edilmiştir. Kanda yüksek konsantrasyonda bulunan azotlu atık maddeler, periton membranından diyaliz sıvısına doğru geçerler.
Çözeltideki glukoz, çözeltinin plazmaya göre hiperozmolar olmasını sağlar ve böylece ozmotik bir fark yaratarak, kronik böbrek yetmezlikli hastalarda görülen aşırı hidrasyon durumunu düzeltmek için gerekli olan plazmadan, diyaliz çözeltisine doğru sıvı çekilmesi işlemini kolaylaştırır.
5.2. Farmakokinetik özellikler
Genel özelliklerPeriton membranı üzerindeki etkisini gösterebilmesi için çözelti periton boşluğuna uygulanır ve hekimin belirlediği bir bekleme süresinden sonra geri alınır.
Emilim:
Çözeltinin bileşimine, hiperozmolar yapmak amacıyla katılan glukoz, vücutta doğal olarak bulunan bir maddedir. Periton diyalizi uygulaması sırasında glukoz periton membranından absorbe olabilir.
Benzer şekilde çözelti içindeki sodyum, klorür, laktat, kalsiyum ve magnezyum iyonları da vücutta doğal olarak bulunan maddelerdir ve periton diyalizi uygulaması sırasında periton membranından absorbe olabilirler.
Dağılım:
Absorbe olan glukoz, normal beslenmede tüketilen karbonhidratların ya da yağın metabolizasyonuyla vücutta oluşan glukozla aynı şekilde dağılıma uğrar.
Benzer şekilde çözelti içindeki sodyum, klorür, laktat, kalsiyum ve magnezyum iyonları da vücutta doğal olarak bulunan maddelerdir ve absorbe olduklarında vücutta normalde bulunan bu iyonların fizyolojik dağılımına benzer bir dağılım sergilerler.
Biyotransformasyon:
Absorbe olan glukoz, normal beslenmede tüketilen karbonhidratların ya da yağın metabolizasyonuyla vücutta oluşan glukozla aynı şekilde biyotransformasyona uğrar.
Laktat, bikarbonatın biyolojik prekürsörüdür; vücutta bikarbonata dönüşür. Diğer elektrolitler olan sodyum, klorür, kalsiyum ve magnezyum iyonları ise herhangi bir biyotransformasyona uğramazlar.
Eliminasyon:
Böbrek yetmezliği durumunda böbreklerin eliminasyon yeteneği kaybolduğundan, vücutta biyotransformasyona uğramış glukoz periton diyalizi ile uzaklaştırılır.
Vücutta bikarbonata dönüşen laktat ile diğer elektrolitler olan sodyum, klorür, kalsiyum ve magnezyum iyonları böbreklerin eliminasyon yeteneği kaybolduğundan periton diyaliziyle ve diğer böbrek dışı fizyolojik eliminasyon mekanizmalarıyla uzaklaştırılır.
Doğrusallık / doğrusal olmayan durum:
DİANEFROL 4'ün bileşimindeki glukoz ve elektrolitlerin periton membranından emilimi, çözeltinin periton boşluğunda kalış süresi, hastanın periton membranının geçirgenlik özelliği, hastanın kan elektrolit ve glukoz konsantrasyonu gibi birçok parametre tarafından belirlendiğinden, doğrudan uygulanan dozla doğrusal bir ilişkiden bahsedilemez.
5.3. Klinik öncesi güvenlilik verileri
Bu konuda yapılan herhangi bir çalışma bulunmamaktadır.
Değişim sırasında, Mini kapağı saat yönünün tersine çevirerek ara seti bağlantısından çıkarınız.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum hidroksit ve/veya hidroklorik asit (pH ayarlayıcı olarak) Enjeksiyonluk su
6.2. Geçimsizlikler
Katkı maddeleri kullanıldığında, geçimsizlikler kontrol edilmelidir.
Potasyumun Eklenmesi
DİANEFROL 4'de potasyum kullanılmamaktadır çünkü diyaliz tedavisi hiperkalemiyi düzeltmek için kullanılmaktadır. Normal serum düzeyi ya da hipokalemi varsa, potasyum klorür eklenmesi (4mEq/L konsantrasyona kadar) şiddetli hipokalemiyi önlemede kullanılır. Potasyum klorür eklenmesi kararı, serum potasyum düzeylerinin dikkatli değerlendirilmesi sonucunda doktor tarafından verilmelidir.
6.3. Raf ömrü
24 ay.
Dış ambalajından çıkarılan ürün hemen kullanılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında korunarak saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Çözelti PVC torba içinde sunulmaktadır. Torba, ya uygun bir uygulama setine bağlanabilecek şekilde iliştirilmiş bir port ile ya da dahili bir uygulama seti ve boş drenaj torbasına bağlı olarak sunulmuştur. Torbada ayrıca, uygun olduğu durumlarda çözeltinin içine ilaç ekleyebilmek amacıyla iliştirilmiş lateksten bir enjeksiyon portu da bulunmaktadır.
Daha sonra torba lineer yüksek yoğunluklu polietilen koruyucu torba ile kaplanmıştır.
Tek torbalı olan formları 1, 2, 2,5, 5 ve 6 litre, çift torbalı olan formları ise 1, 2 ve 2.5 litre çözelti içermektedir. Tek torbalı 6 litrelik olan form aletli periton diyaliz cihaz seti ile birlikte ve çift torbalı olan formlar, mini kapakla birlikte kullanıma sunulmuştur
Ayrıca tek ve çift torbalı ambalajlarda sunulan % 1.36 ve % 2.27 Glukozlu formları da bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Uygulamayla ilgili ayrıntılar için bölüm 4.2'ye bakınız.
Sürekli Ayaktan Periton Diyalizi (SAPD) sırasında torba değişim prosedürleri hastalara özel eğitimlerle ve Kullanım Talimatıaracılığıylaverilmektedir.
Çözeltinin kullanılmayan bölümü atılmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.
Mini Kapak (Povidon İyotlu):
Tanım
Bu ürün periton diyalizi tedavisinde kullanılan plastik bir kapaktır ve ara setini
kontaminasyondan korumak üzere povidon-iyot içerir.
4.3. Kontrendikasyonlar
İyoda karşı bilinen alerjik reaksiyon öyküsü varsa bu ürünü kullanmayınız. Daha fazla bilgi için
doktorunuza başvurunuz.
Uyarılar
Aseptik teknik kullanınız. Sıvı yolunun herhangi bir kısmında kontaminasyon olması peritonit ile sonuçlanabilir.
Ambalajı daha önceden açılmış, hasar görmüş veya lekelenmişse ya da iç kısımda bulunan povidon-iyotlu sünger kuruysa kullanmayınız. Ürün kullanılmışsa atınız.
Oda sıcaklığında saklayınız. Aşırı ısıdan koruyunuz.
Bu ürün tek kullanımlıktır. Tek kullanımlık bir ürünün yeniden kullanılması veya yeniden işlemden geçirilmesi, kontaminasyona ve ürünün işlevinin veya yapısal bütünlüğünün zarar görmesine neden olabilir.
Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Kazara yutulması halinde, derhal doktorunuza danışınız.
Küçük peritoneal diyalizat dolum hacmi olan hastalarda, özellikle bebek ve çocuklarda, tiroid fonksiyonunun izlenmesi tavsiye edilmektedir. İyot maruziyetini minimuma indirmek için, klinik olarak mümkün olduğunda, bir sonraki dolum döngüsünü başlatmadan önce periton boşluğundaki sıvı drenaj torbasına boşaltılmalıdır.
Diğer üreticilerden temin edilebilen pek çok diyaliz ürünü, Polifarma periton diyaliz ekipmanı veya tek kullanımlık ürünleriyle birlikte kullanılması durumunda bu ürünlerdeki değişkenlik, toleranslar, mekanik kuvvet veya zaman zaman yapılabilecek değişiklikler Polifarma'nın kontrolü dışındadır. Bundan dolayı Polifarma, başka üreticilerin diyaliz ürünlerinin, kendi ürünleri ile kullanıldığında tatmin edici ve güvenli bir şekilde işleyeceğini garanti edemez.
Kullanım Talimatı
Dikkat: Aseptik teknik kullanınız.
Doktorunuz tarafından verilen talimatlara uyunuz. Bir yüz maskesi takınız. Ellerinizi dezenfektan özelliği olan sabun ile yıkayıp tamamen kurutunuz. Ellerinize antiseptik uygulayınız.
Yerel atık imha kılavuzları doğrultusunda atınız.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BALANCE | 8699684675202 | 537.22TL |
| BIOPERITONAL | 8699788673029 | |
| BIOPERITONEAL | 8699788676013 | |
| CAPD | 8699684671723 | 706.00TL |
| DIA. | 8699556675132 | |
| Diğer Eşdeğer İlaçlar |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Polifarma İlaç San.ve Tic. A.Ş.
| Geri Ödeme Kodu | A17045 |
| Satış Fiyatı | 932.54 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 932.54 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699606675884 |
| Etkin Madde | Peritonal Diyaliz Solüsyonu |
| Yerli ve Beşeri bir ilaçdır. |