DIVINA 21 tablet Kısa Ürün Bilgisi
{ Estradiol Valerat + Medroksiprojesteron }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
DİVİNA 2 mg + 2 mg / 10 mg tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
DİVİNA ambalajı içindeki beher beyaz tablet, 2 mg östradiol valerat; beher mavi tablet ise 2 mg östradiol valerat ve 10 mg medroksiprogesteron asetat içerir.
Yardımcı maddeler
Mavi tablette 72 mg, beyaz tablette ise 86,62 mg Laktoz bulunur. Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Tablet.
Beyaz Tablet: Beyaz veya hemen hemen beyaz, 7 mm çapında, yuvarlak ve konveks tablettir. Mavi Tablet: Açık mavi, 7 mm çapında, düz ve konik kenarlı tablettir.
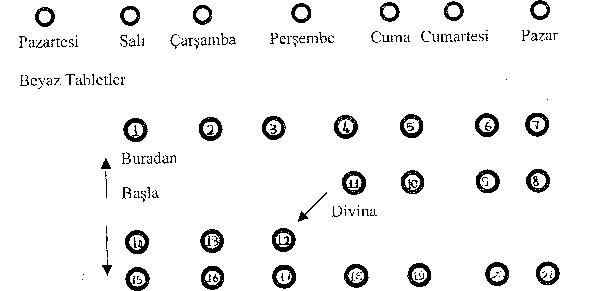
Bunu izleyen tabletler baskılı blister folyonun üzerinde gösterilen sırayla alınır. Önce ilk 11 gün beyaz tablet; daha sonra 10 gün mavi tablet kullanılıp, bitiminde 7 günlük bir ara verilir. Çoğunlukla, bu ara verme döneminde menstrüasyona benzer bir kanama görülebilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
DİVİNA tablet;
Postmenopozal kadınlarda östrojen eksikliğinin neden olduğu semptomların hormon replasman tedavisi olarak.
4.2. Pozoloji ve uygulama şekli
DİVİNA; çift fazlı insan menstrüel siklusunu taklit eden bir preparat olduğundan; 11 gün beyaz tablet, günde bir kez olmak üzere (östrojen fazı) ve 10 gün mavi tablet, günde bir kez olmak üzere (kombine östrojen ve progestin fazı) uygulanır.
21 günlük bir tedaviden sonra 7 gün ara verilir (ilaçsız devre).
Daha önce hormon replasman tedavisi kullanmamış veya sürekli kombinasyon tedavisinden DİVİNA'ya geçen kadınlar DİVİNA tedavisine herhangi bir günde başlayabilirler. Ardışık veya diğer siklik hormon replasman tedavisinden DİVİNA'ya geçenler son tedavi periyodunun sonundan (28-gün) sonra DİVİNAtedavisinebaşlayabilirler.
Postmenopozal semptomların başlangıç ve sürdürme tedavisinde en düşük etkin doz kullanılmalıdır ve tedavi süresi mümkün olduğu kadar kısa olmalıdır (ayrıca bölüm 4.4'e bakınız).
Hastalar bir tableti almayı unuttukları takdirde unutulan tablet bir sonraki gün alınmamalıdır. Atlanan tablet ara kanama ve nokta şeklinde kanama gözlenmesini artırabilir.
Uygulama şekli:
İlk gün
Blisterlerin Kontrolü
Mavi Tabletler
Blister folyonun baskılı yüzünün, en üst bölümünde haftanın günlerini gösteren küçük daireler bulunmaktadır. İlaca başlanan ilk gün o güne ait küçük daire delinir. Bu işlem gerektiğinde ilaca başlanan günü hatırlamak içindir.
İkinci kutuya, birinci kutuya başlanan gün başlanır.
4.3. Kontrendikasyonlar
Bilinen, şüphelenilen veya geçmişteki meme kanseri
4.4. Özel kullanım uyarıları ve önlemleri
Hormon replasman tedavisi (HRT), yalnızca, yaşam kalitesini olumsuz etkileyen postmenopozal semptomların tedavisinde kullanılmalıdır. Her iki endikasyon için, en azından yılda bir kez dikkatli bir yarar-zarar oranı değerlendirmesi yapılmalı ve hormon replasman tedavisi yalnızca faydası risklerine ağır bastığı müddetçe sürdürülmelidir.
Erken menopozda hormon replasman tedavisi ile ilişkili advers etkiler hakkındaki bilgiler sınırlıdır. Bununla birlikte, daha genç kadınlardaki düşük mutlak advers etki riski nedeniyle, bu kadınlar için yarar-zarar oranı, daha yaşlı kadınlardakinden daha elverişli olabilir.
Tıbbi değerlendirme/izleme
HRT'ye başlanması ya da tedaviye devam kararından önce hastanın kişisel ve ailesel tıbbi hikayesi alınmalıdır. Bu bilgiler, kontredikasyonlar ve önlemler, fizik muayeneye (pelvis ve memeyi de kapsayan) yön vermelidir.
Tedavi sırasında, düzenli kontrollerin sıklık ve kapsamı hastaya göre belirlenir. Hastalara memelerde fark edecekleri hangi değişiklikleri doktor ya da hemşireye bildirmeleri gerektiği açıklanmalıdır (Bkz. Meme kanseri). Bireysel klinik gereksinime göre, mamografiyi de içeren incelemeler geçerli yöntemler uyarınca yapılmalıdır.
Yakın gözetim gerektiren durumlar:
Aşağıdaki hastalık durumlarına sahip veya geçmişte sahip olan ya da gebelikte veya önceki hormon tedavisi sırasında söz konusu durumunda alevlenme olan hastalar tedavi sırasında özel bir dikkatle izlenmelidir. Bu hastalık durumları nadir durumlarda DİVİNA ile tedavi sırasında nüksedebilir veya alevlenebilir; bu durumlar şunlardır:
Leiomyoma (uterus fibroidi) veya endometriozis
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Karaciğer enzimlerini, özellikle tıbbi ajanları metabolize eden sitokrom P450 enzimlerini indükleyen ajanlarla birlikte kullanılmaları durumunda östrojen ve progestojen metabolizması artabilir. Bu ajanlar antikonvülsanlar (örneğin fenobarbital, fenitoin, karbamazepin) ve anti enfeksiyon ilaçlarını (örneğin rifampisin, rifabutin, neviparin, efavirenz) içermektedir.
Güçlü inhibitörler olarak bilinen ritonavir ve nelfinavir steroid hormonlarla birlikte kullanıldıklarında indükleyici olarak etki ederler.
Cinsiyet hormonları ile birlikte uygulandığında, HCV inhibitörleri ile kombinasyonlar dahil olmak üzere HIV proteaz inhibitörlerinin ve nükleosit olmayan ters transkriptaz inhibitörlerinin birçok kombinasyonu, östrojenin plazma konsantrasyonlarını artırabilir veya azaltabilir. Bu değişikliklerin net etkisi bazı durumlarda klinik olarak anlamlı olabilir.
Bu nedenle, olası etkileşimleriv eilgiliönerileri b elirlemek için HIV/HCV antiviraller dahil
Sarı kantaron (Hypericum perforatum) içeren bitkisel preparatlar östrojen ve progestojen metabolizmasını indükleyebilir.
Artmış östrojen ve progestojen metabolizması, klinik etkinliklerini olumsuz etkileyebilir ve kanama profilinde değişikliğe neden olabilir.
Farmakodinamik etkileşimler
Hepatit C virüsü (HCV) için tek başına ombitasvir/paritaprevir/ritonavir kombinasyonu veya dasabuvir ile tedavi edilen hastalarla yapılan klinik çalışmalarda, normalin üst sınırının (ULN) 5 katından daha fazla ALT yükselmeleri, etinilöstradiol içeren tıbbi ürünler (kombine hormonal kontraseptifler [CHCs] gibi) kullanan kadınlarda önemli ölçüde daha yaygındır. Etiniloestradiol dışında östrojen içeren tıbbi ürünler kullanan kadınlar, örn. östradiol, herhangi bir östrojen almayan kadınlara benzer bir ALT yükselme oranına sahiptir. Ancak, bu diğer östrojenleri kullanan kadın sayısının az olması nedeniyle, ombitasvir/paritaprevir/ritonavir kombinasyonunun tek başına veya dasabuvir ile birlikte kullanımı veya glekaprevir/pibrentasvir kombinasyonunun kullanımı için dikkatli olunmalıdır (bkz.bölüm 4.4).
4.6. Gebelik ve laktasyon
Gebelik kategorisi X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Kontraseptif amaçla kullanımı yoktur. Bugüne kadar yapılmış epidemiyolojik çalışmaların çoğunda; östrodiol valerat ve medroksiprogesteron asetat ile oluşan istem dışı fetal maruziyet, teratojenik veya fetotoksik etkiye yol açmıştır. İnsanlara yönelik potansiyel risk bilinmemektedir.
DİVİNA gebelik döneminde kontrendikedir (bkz. Bölüm 4.3).
Gebelik dönemi
Gebelik döneminde kullanılmamalıdır. DİVİNA kullanımı sırasında gebelik oluşursa tedavi hemen kesilmelidir. Sınırlı sayıda gebelik maruziyetinden elde edilen sonuçlar medroksiprogesteron asetatın (MPA) fetuste herhangi bir advers etkiye neden olduğunu göstermemektedir.
Laktasyon dönemi
Östradiol valerat ve medroksiprogesteron asetatın insan ya da hayvan sütü ile atıldığına ilişkin yetersiz/sınırlı bilgi mevcuttur. Östradiol valerat ve medroksiprogesteron asetatın süt ile atılmasına yönelik fizikokimyasal ve eldeki farmakodinamik/toksikolojik veriler nedeniyle memedeki çocuk açısından bir risk olduğu göz ardı edilemez. DİVİNA emzirme döneminde kullanılmamalıdır.
Üreme yeteneği /Fertilite
İnsanda üreme yeteneği/fertiliteye etkisi bildirilmemiştir. Hayvan çalışmalarında reproduktif toksisite gözlenmiştir. İnsanlardaki potansiyel risk bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine herhangi bir etki gözlenmemiştir.
4.8. İstenmeyen etkiler
Advers etkiler en sık tedavinin birinci ayında oluşur. Genellikle hafiftir ve tedaviye devam etmekle genellikle ortadan kaybolurlar.
Klinik çalışmalarda DİVİNA tedavisi sırasında en sık bildirilen istenmeyen etki, kullanıcıların
%10,6'sında meydana gelen göğüs hassasiyetidir. Aşağıda belirtilen advers etkiler klinik çalışmalarda görülen ve pazarlama sonrası bildirilen advers etkileri sunmaktadır. Hastaların
%76'sında hormon replasman tedavisi sırasında advers etki gelişmesi beklenmektedir. Advers etkiler üç klinik faz III çalışmadan (n=611) toplanmıştır. Östradiol tedavisi ile en azından bir mümkün nedensellik ilişkisine sahip olan advers etkiler aşağıdaki tabloya dahil edilmiştir.
Östrodiol valerat ve medroksiprogesteron asetat ile gözlenen yan etkiler, vücut sistemlerinde aşağıdaki gibi sınıflandırılmıştır, çok yaygın (1/10); yaygın (1/100 ila <1/10); yaygın olmayan (1/1.000 ila <1/100); seyrek (1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
İyi huylu, kötü huylu ve belirtilmemiş neoplazmalar (Kistler ve polipler de dahil olmak üzere)
Yaygın olmayan: İyi huylu meme tümörü, iyi huylu endometrial tümör Bilinmiyor: Uterin fibroid
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Hipersensitivite reaksiyonu Bilinmiyor: Anjiyoödem alevlenmesi (kalıtsal ve edinsel)
Metabolizma ve beslenme hastalıkları
Yaygın: Ödem, kilo artışı/azalması
Yaygın olmayan: İştah artması, hiperkolesterolemi
Psikiyatrik hastalıklar
Yaygın: Depresyon, sinirlilik, letarji
Yaygın olmayan: Anksiyete, uykusuzluk, apati, mizaçta dalgalanmalar, konsantre olamama, mizaç veya libido değişiklikleri, öfori, ajitasyon
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı, baş dönmesi
Yaygın olmayan: Migren, paresteziler, tremor
Göz hastalıkları
Yaygın olmayan: Görme bozuklukları, kuru göz
Yaygın olmayan: Kontakt lensi yeterince tolere edememe
Kardiyak hastalıklar
Yaygın olmayan: Çarpıntı
Vasküler hastalıklar
Yaygın:Sıcak basmaları
Yaygın olmayan: Kan basıncı artışı, yüzeysel flebit, purpura
Seyrek: Venöz tromboemboli (bir bacağın derin veninde veya pelvik vende ya da pulmoner embolizm)
Bilinmiyor: Serebral iskemi
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: Nefes darlığı, rinit
Gastrointestinal hastalıklar
Yaygın: Bulantı, kusma, abdominal kramplar, flatulans
Yaygın olmayan: Konstipasyon, dispepsi, diyare, rektal bozukluklar Bilinmiyor: Abdominal ağrı, şişkinlik
Hepato-biliyer hastalıklar
Seyrek: Karaciğer fonksiyonunda ve biliyer akışta değişiklikler Bilinmiyor: Kolestatik sarılık
Deri ve derialtı doku hastalıkları
Yaygın olmayan: Akne, saç kaybı, kuru cilt, tırnak bozuklukları, deri nodülleri, hirsutizm, eritema nodozum, ürtiker
Seyrek: Döküntü Bilinmiyor: Egzema
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın olmayan: Eklem bozuklukları, bacak krampları
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: İdrar sıklığında artış, üriner inkontinans, sistit, idrar renginin değişmesi, hematüri
Üreme sistemi ve meme hastalıkları:
Yaygın: Meme ağrısı/gerginliği, düzensiz vajinal kanama veya lekelenme, vajinal akıntı, vulva/vajina bozuklukları, menstrüel bozukluklar
Yaygın olmayan: Memede büyüme, meme hassasiyeti, endometriyal hiperplazi, uterus bozuklukları
Seyrek: Dismenore, PMS benzeri sendrom
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın: Artmış terleme
Yaygın olmayan: Yorgunluk, anormal laboratuar değerleri, asteni, ateş grip-benzeri semptomlar, halsizlik
Östrojen-projestojen tedavisi ile bağlantılı olarak bildirilen diğer advers etkiler:
Miyokard enfarktüsü
4.9. Doz aşımı ve tedavisi
Östrojenin aşırı dozu bulantı, baş ağrısı ve kanama yapabilir. Aşırı doz östrojen ve progesteronun küçük çocuklarda kullanılması ile ilgili ciddi hasta etkileri belirtilmemiştir. Tedavi gerekirse semptomatik olabilir. Kanser tedavisinde kullanılan yüksek dozda medroksiprogesteron asetatın istenmeyen ciddi etkileri gözlenmemiştir.
DİVİNA tercihen akşam alınır. Unutulduğu takdirde ertesi sabah alınır ve aynı gün akşamı normal doz ile tedavi sürdürülür. Eğer hem akşam hem sabah alınması unutulursa tedaviye normal doz ile devam edilir ancak hafif bir kanama görülebilir.
5. FARMAKOLOJİK ÖZELLİKLER
İ
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Progestojenler ve östrojenler (sabit kombinasyonlar) ATC Kodu: G03FB06
DİVİNA iki-fazlı bir östrojen-progestojen ürünüdür. Aktif madde östradiol valerat bir sentetik 17ï¢ östradiol'dür; endojen insan östradiol'ü ile kimyasal ve biyolojik olarak aynıdır. Postmenopozal kadınlarda, endojen östrojen üretimindeki azalmayı yerine koyar ve menopozal semptomları giderir. Östrojenler menopoz ve ovariektomi sonrası osteoporozu önler.
Östrojenler endometriyal büyümeyi destekler, progesteron olmaksızın verilen östrojen endometriyal hiperplazi ve kanser riskini artırır. Progesteronun eklenmesi, sağlam uterusu olan kadınlarda östrojenin neden olduğu endometriyal hiperplazi riskini belirgin derecede azaltır.
Medroksiprojesteron asetat (MPA), doğal projestojenin bir 17 alfa-hidroksi 6-metilprojesteron türevi olup, noretisteron asetat gibi 19-norprojestojen türevlerinden daha az androjenik etkilidir. MPA projestojen-spesifik reseptörlere bağlanır ve endometriyumda proliferatif fazdan sekretuar faza doğru bir değişime neden olur.
Klinik çalışma sonuçları
Östrojen eksikliğinin neden olduğu semptomların azaltılması ve kanama profili
Tedavinin ilk haftalarında menopoz semptomları azalmıştır. Kadınların %86'sında ortalama 5 gün süren çekilme kanaması (düzenli menstrüasyon-benzeri kanama) olmuştur. Çekilme kanaması genellikle son 2 mg EV + 10 mg MPA kombinasyon tabletini aldıktan 2-3 gün sonra başlamıştır.
Ara kanama ve/veya lekelenme tedavinin ilk üç ayında kadınların %24'ünde, 10-12 ay tedavi alan kadınların %34'ünde gerçekleşmiştir. Tedavinin ilk yılında kadınların %10'unda amenore gelişmiştir.
Osteoporozun önlenmesi
Menopoza bağlı östrojen eksikliği kemik yıkımında artmaya ve kemik kütlesinde azalmaya neden olur. Kemik mineral yoğunluğu (KMY) üzerine östrojenlerin etkisi doz-bağımlıdır. Koruma tedavi sürdürüldüğü müddetçe etkili görünmektedir. Hormon replasman tedavisi kesildiğinde, kemik kütlesi hormon tedavisi kullanmayanlarda olduğu gibi azalır.
KSG çalışması ve meta analizler sağlıklı kadınlarda hormon replasman tedavisinin (hem tek başına östrojen hem de kombinasyon tedavisi) kalça ve lomber omurga kırıklarını ve diğer osteoporotik kırıkları azalttığını göstermektedir. Hormon replasman tedavisi düşük kemik mineral dansitesi veya osteoporozu olan kadınlardaki kemik kırıklarını da önleyebilir, ancak şimdilik kanıtlar sınırlıdır.
Bir yıllık DİVİNA tedavisinden sonra lomber omurga kemik mineral yoğunluğu (KMY) %4,5 (± 2.9), 2 yıl sonra %6,5 (±3,1) artmıştır. Tedavi sırasında lomber omurga KMY düzeyi aynı kalan veya artan kadın yüzdesi bir yıl sonra %95,8 ve iki yıl sonra %95,7 idi.
DİVİNA kalça KMY düzeyini de etkilemiştir. Femur boynunda artış bir yıl sonra %1,0 (±3,2) ve 2 yıl sonra %1,8 (± 3,9) idi. Tedavi sırasında femur boynu KMY düzeyi aynı kalan veya artan kadın yüzdesi bir yıl sonra %58,3 ve iki yıl sonra %60,9 idi. Ward üçgeni için karşılık gelen değerler %4,7 (±5,9) ve %7,0 (±5,1) idi ve Ward üçgenindeki KMY düzeyinin tedavi sırasında aynı kaldığı veya arttığı kadın yüzdesi %83,3 ve %100 idi.
5.2. Farmakokinetik özellikler
Emilim: Östradiol valerat oral uygulama sonrası iyi emilir ve hızlı şekilde serbest östradiol'e metabolize olur. DİVİNA ile yapılan farmakokinetik çalışmada, östradiolün maksimum plazma düzeylerine 6,7±2,9 saat (t) ulaşmıştır. Bir çoklu-doz çalışmasında, 2 mg'lık bir dozu takiben doruk plazma konsantrasyonu (C) yaklaşık 234 ± 99 pmol/L, ortalama düzey (C) 180
± 81 pmol/L ve vadi düzeyi (C) 135 ± 75 pmol/L idi. Sonuçlar ortalama değer ± SD (standart sapma) olarak sunulmaktadır.
Vücutta östradiol, seks hormonu bağlayıcı globuline ve albümine bağlanır. Serbest östradiol, karaciğerde kısmen östron gibi daha az aktif östrojenlere metabolize edilir. Östronun doruk plazma konsantrasyonu, bir tabletin uygulanmasından 5,9 ± 1,9 saat sonra görülebilir. Östronun C'ı yaklaşık 1,660 ± 871 pmol/l, C819 + 519 pmol/l ve Kaverage 1,120 ± 674 pmol/l idi. Sonuçlar ortalama değerler ± SD olarak sunulmuştur. Östrojenlerin çoğu, konjugatlar (sülfatlar ve glukuronidler) olarak böbrekler yoluyla atılır.
Medroksiprogesteron asetat, gastrointestinal kanaldan kolayca absorbe edilirek dolaşımdan ekstravasküler dokuya dağılır. DİVİNA uygulanmasını takiben MPA maksimum plazma konsantrasyonuna 2,9±1,8 saatte ulaşır. 10 mg'lık bir MPA dozundan sonra, Cdeğeri yaklaşık 720 ± 285 pg/mL, C212 + 82 pg/mL ve C311 + 117 pg/mL idi. Sonuçlar ortalama değer ± SD olarak sunulmaktadır. Terminal eliminasyon yarı ömrü 50 ila 60 saattir. Metabolizma hakkında sınırlı dokümantasyon vardır. MPA karaciğerde metabolize edilir ve esas olarak feçes (dışkı) ve ayrıca kısmen idrar ve safrada glukuronidler olarak atılır. Medroksiprogesteronun metabolitlerinin farmakolojik aktivitesi ile ilgili bir bilgi bulunmamaktadır.
Dağılım:
Östradiol dolaşımda, seks hormonu bağlayıcı globulinlere ve albumine bağlı olarak bulunur. Medroksiprogesteron asetat %70 oranında plazma proteinlerine bağlanır.
Biyotransformasyon:
Serbest östradiol karaciğerde metabolize edilerek, kısmen daha az aktif olan östron olan östrojenlere çevrilir.
Medroksiprogesteron asetat karaciğerde metabolize edilir.
Eliminasyon:
Östron enterohepatik döngüye girer ve yarı ömrü 15 ila 20 saattir. Östrojenlerin çoğunluğu, konjugatları (sülfatlar veya glukuronitler) olarak böbrek yoluyla itrah edilirler. Medroksiprogesteron asetat eliminasyon yarı ömrü 50 – 60 saattir, glukuronit şeklinde idrar ve safra yoluyla itrah edilir.
5.3. Klinik öncesi güvenlilik verileri
Hayvan çalışmaları, östradiol ve medroksiprojesteron asetatın beklenen östrojen ve projestojen etkilere sahip olduğunu göstermiştir.
7 günlük ara sırasında kanama görülebilir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Her bir Mavi Tablet; Laktoz (sığır sütü) Mısır Nişastası İndigokarmin (E 132) Jelatin Polivinilpirolidon K 25 Saf Su
Talk
Magnezyum Stearat
Her bir Beyaz Tablet; Laktoz (sığır sütü) Mısır Nişastası Jelatin
Saf Su Talk
Magnezyum Stearat
6.2. Geçimsizlikler
Bildirilmemiştir.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
25C'nin altında, oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
11 adet beyaz ve 10 adet mavi tabletlik PVC/PVDC/Al blister ambalajlarda sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıkları Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Abdi İbrahim İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A02438 |
| Satış Fiyatı | 127.65 TL [ 7 Apr 2025 ] |
| Önceki Satış Fiyatı | 127.65 TL [ 24 Mar 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699514016717 |
| Etkin Madde | Estradiol Valerat + Medroksiprojesteron |
| ATC Kodu | G03FB06 |
| Birim Miktar | 4+10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Progestogen Estrogen Kombinasyonları > Estradiol valerat + medroksiprojesteron |
| İthal ve Beşeri bir ilaçdır. |