EMGALITY 120 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır kalem (1 kalem) Kısa Ürün Bilgisi
{ Galkanezumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
EMGALITY 120 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Kalem Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kullanıma hazır kalem 1 ml içerisinde 120 mg galcanezumab içerir.
Galcanezumab Çin hamster overi (CHO) hücrelerinde üretilen bir rekombinant insan monoklonal antikordur.
Yardımcı maddeler
Yardımcı maddelerin tamamı için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti içeren kullanıma hazır kalem
EMGALITY berrak cam şırınga içinde çözelti olarak sunulur. İlaç renksiz ya da hafif sarı olabilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
EMGALITY bir ayda en az 4 migrenli gün geçiren yetişkinlerde migren profilaksisi için endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji / uygulama sıklığı ve süresi:Tedavi, migren tanı ve tedavisinde deneyimli hekimler tarafından başlatılmalıdır.
Önerilen doz; ilk olarak 240 mg'lık yükleme dozunu takiben ayda bir kez subkütan yoldan enjekte edilen 120 mg'dır.
Hastalara bir dozu atladıkları takdirde mümkün olan en kısa süre içinde enjeksiyon yapmaları ve sonrasında aylık dozlamaya devam etmeleri gerektiği söylenmelidir.
Tedavinin yararı tedavi başlanmasından 3 ay sonra değerlendirilmelidir. Tedavinin devamına ait karar hasta bazında verilmelidir. Tedavinin sürdürülmesi gerekliliğinin daha sonra düzenli olarak değerlendirilmesi önerilir.
Uygulama şekli:
Subkütan kullanım içindir.
Hasta, Kullanma Kılavuzunu takip ederek kendi kendine galcanezumab enjeksiyonu yapabilir. Galcanezumab abdomen, uyluk, üst kolun arka kısmı veya gluteal bölgeye subkütan yoldan enjekte edilir. Hastalar galcanezumabı eğitim aldıktan sonra ve sağlık personeli bunun uygun olacağını belirlerse kendilerine enjekte edebilirler. Uygulama için kapsamlı yönlendirmeler Kullanma Kılavuzu'nda verilmektedir.
Özel popülasyona ilişkin ek bilgiler:
Böbrek yetmezliği
Hafif ile orta dereceli böbrek yetmezliği bulunan hastalarda doz ayarlaması yapılması gerekmemektedir (bkz. Bölüm 5.2).
Karaciğer yetmezliği
Hafif ile orta dereceli karaciğer yetmezliği bulunan hastalarda doz ayarlaması yapılması gerekmemektedir (bkz. Bölüm 5.2).
Pediyatrik popülasyon
Galcanezumab'ın 6 ila 18 yaş arası çocuklarda güvenlilik ve etkililiği henüz belirlenmemiştir. Bu konuyla ilgili veri yoktur.
Galcanezumab'ın 6 yaşından küçük çocuklardaki migrenin önlenmesi ile ilgili kullanımı bulunmamaktadır.
Geriyatrik Popülasyon
Galcanezumab yaşlı hastalarda (>65 yaş) çalışılmamıştır. Galcanezumabın farmakokinetiği yaştan etkilenmediği için doz ayarlamasına gerek bulunmamaktadır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Kardiyovasküler risk
Ciddi majör kardiyovasküler hastalığı olan hastalar, klinik çalışmalara dahil edilmemiştir (bkz. Bölüm 5.1). Bu hastalar için güvenlilik verisi bulunmamaktadır.
Ciddi aşırı duyarlılık
Anafilaksi, anjiyoödem ve ürtiker vakalarının da dahil olduğu ciddi aşırı duyarlılık reaksiyonları bildirilmiştir. Ciddi aşırı duyarlılık reaksiyonu gelişmesi halinde, galcanezumab uygulaması hemen durdurulmalı ve uygun tedavi başlatılmalıdır. Galcanezumab uygulamasından sonraki 1 gün içinde ciddi aşırı duyarlılık reaksiyonları meydana gelebilir, bununla birlikte geç başlangıçlı vakalar da bildirilmiştir.
Bu tıbbi ürün her 120 mg dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında “sodyum içermezâ€.
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınların tedavi sırasında ve tedaviden sonra en az 5 ay süreyle etkili bir kontrasepsiyon yöntemi kullanmaları önerilir.
Gebelik dönemi
Gebe kadınlarda galcanezumab kullanımıyla ilgili veriler sınırlıdır. Hayvan çalışmalarında üreme toksisitesi ile ilgili doğrudan veya dolaylı herhangi bir zararlı etki gösterilmemiştir (bkz. Bölüm 5.3). İnsanlarda immünoglobulinin (IgG) plasentaya geçtiği bilinmektedir. Tedbir amaçlı bir önlem olarak, gebelikte galcanezumab kullanımından kaçınılması tercih edilmelidir.
Laktasyon dönemi
Galcanezumabın insanlarda anne sütüne geçip geçmediği bilinmemektedir. İnsanlarda IgG'nin doğumdan sonraki ilk birkaç günde anne sütüne geçtiği ve sonrasında kısa süre içinde düşük konsantrasyonlara indiği bilinmektedir; sonuç olarak, bu kısa süre zarfında anne sütü alan bebekler için bir risk olduğu göz önüne alınmalıdır. Daha sonra, emzirme döneminde galcanezumab kullanımı yalnızca klinik açıdan ihtiyaç duyulduğu durumlarda düşünülebilir.
Üreme yeteneği / Fertilite
Galcanezumabın insanlarda fertilite üzerine etkisi değerlendirilmemiştir. Hayvan çalışmalarında erkek ve dişi fertilitesi ile ilgili doğrudan veya dolaylı herhangi bir zararlı etki gösterilmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Galcanezumabın araç ve makine kullanımı üzerinde minör etkileri olabilir. Galcanezumab uygulaması sonrasında vertigo görülebilir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Migren profilaksisi ile ilgili klinik çalışmalarda 2500'ün üzerinde hasta galcanezumaba maruz kalmıştır. Plasebo kontrollü çift-kör faz 3 tedavi çalışmalarında, 1400'den fazla hasta galcanezumaba maruz kalmıştır. 279 hasta 12 ay maruz kalmıştır.
Migren klinik çalışmalarında 120 mg ve 240 mg dozunda raporlanan advers reaksiyonlar enjeksiyon bölgesinde ağrı (%10,1 / %11,6), enjeksiyon bölgesi reaksiyonları (%9,9 / %14,5),
vertigo (%0,7 / %1,2), kabızlık (%1,0 / %1,5), kaşıntı (% 0,7 / %1,2) ve ürtiker (%0,3 / %0,1) şeklindedir. Reaksiyonların çoğu hafif veya orta şiddettedir. Advers reaksiyonlar sebebi ile tedaviye devam etmeyen hastaların oranı % 2,5'den azdır.
Advers reaksiyonların tablo halindeki listesi
Tablo 1. Klinik çalışmalardaki ve pazarlama sonrası raporlardaki advers reaksiyon listesi
Sıklık tahmini: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila
<1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubunda istenmeyen etkiler azalan ciddiyet sıralaması ile sunulmaktadır.
Sistem Organ Sınıfı | Çok yaygın | Yaygın | Yaygın olmayan | Seyrek |
Bağışıklık sistemi hastalıkları |
|
|
| Anafilaksi Anjiyoödem |
Kulak ve iç kulak hastalıkları |
| Vertigo |
|
|
Gastrointestinal hastalıkları |
| Kabızlık |
|
|
Deri ve deri altı doku hastalıkları |
| Kaşıntı Döküntü | Ürtiker |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Enjeksiyon bölgesinde ağrı Enjeksiyon bölgesi reaksiyonları |
|
|
|
Seçili advers reaksiyonların tanımı
Enjeksiyon bölgesinde ağrı veya enjeksiyon bölgesi reaksiyonları
Enjeksiyon bölgesiyle ilgili olayların çoğu hafif ila orta şiddette olmuş ve faz 3 çalışmalar sırasında galcanezumab maruziyeti kaydedilen hastaların %0,5'inden azı enjeksiyon bölgesi reaksiyonu nedeniyle tedaviye devam etmemiştir. Enjeksiyon bölgesi reaksiyonlarının büyük bölümü 1 gün içinde bildirilmiş ve ortalama 5 gün içerisinde düzelmiştir. Enjeksiyon bölgesinde ağrı bildiren hastaların %86'sında olay enjeksiyondan sonraki 1 saat içinde meydana gelmiş ve ortalama 1 gün içerisinde düzelmiştir. Faz 3 çalışmalar sırasında galcanezumaba maruz kalan hastaların yüzde birinde enjeksiyon bölgesinde şiddetli ağrı tecrübe edilmiştir.
Ürtiker
Ürtiker yaygın olarak gözükmese de, galcanezumab ile ilgili klinik çalışmalarda ciddi ürtiker vakaları bildirilmiştir.
İmmünojenisite
Klinik çalışmalarda, ayda bir kez galcanezumab alan hastalarda çift-kör tedavi fazında, ilaca karşı antikor gelişme insidansı %4,8'dir (Biri hariç hepsinde in-vitro nötralizan aktivite görülmüştür).
12 ay tedaviyle, galcanezumab tedavisi alan hastaların %12,5'inde anti-ilaç antikorları gelişmiş, bunların çoğunun düşük titreli olduğu ve in vitro koşullarda nötralizan aktivite testinin pozitif bulunduğu kaydedilmiştir. Bununla birlikte, anti-ilaç antikorlarının varlığı galcanezumabın farmakokinetik özelliklerini, etkililiğini veya güvenliliğini etkilememiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İnsanlarda 600 mg'a varan dozlar doz sınırlayıcı toksisite olmaksızın subkütan olarak uygulanmıştır. Doz aşımı olduğu takdirde, hastanın advers reaksiyonlar ile ilgili her türlü bulgu ya da semptom bakımından izlenmesi ve derhal uygun semptomatik tedavinin başlatılması önerilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Analjezikler, anti migren preparatları, kalsitonin geni ilişkili peptid (CGRP) antagonistleri
ATC kodu: N02CD02
Etki mekanizması
Galcanezumab, kalsitonin gen ilişkili peptide (CGRP) bağlanarak biyolojik aktivitesini engelleyen bir insan IgG4 monoklonal antikorudur. Kandaki yüksek CGRP konsantrasyonları migren ataklarıyla ilişkilendirilmiştir.
Galcanezumab CGRP'ye yüksek afinite (K= 31 pM) ve yüksek özgüllükle bağlanmaktadır (ilgili peptidler adrenomedullin, amilin, kalsitonin ve intermedine kıyasla >10.000 kat).
Klinik etkililik ve güvenlilik
Galcanezumabın etkililiği ve güvenliliği yetişkin hastaların (N=2886) yer aldığı 3 faz 3, randomize, plasebo kontrollü, çift kör çalışmada incelenmiştir. İki epizodik migren çalışmasına (EVOLVE-1 ve EVOLVE-2), auralı veya aurasız migren tanısı için Baş Ağrısı Bozukluklarına İlişkin Uluslararası Sınıflandırma (ICHD) kriterlerini karşılayan, ayda 4-14 gün migren tipi baş ağrısı olan hastalar alınmıştır. Kronik migren çalışmasına (REGAIN), ICHD kriterlerini
karşılayan, en az 8'i migren özellikleri sergilemek üzere ayda en az 15 gün kronik migreni olan hastalar dahil edilmiştir. Yakın zamanda akut kardiyovasküler olay (miyokardiyal enfarktüs, stabil olmayan anjina, koroner arter by-pass ameliyatı, inme, derin ven trombozu dahil) gelişmiş olan ve/veya ciddi kardiyovasküler risk altında olduğu değerlendirilen hastalar galcanezumab klinik çalışmalarına dahil edilmemiştir. Ayrıca, 65 yaş üzeri hastalar da dahil edilmemiştir.
Hastalara plasebo veya galcanezumab 120 mg/ay (ilk ay için başlangıç yükleme dozu olarak 240 mg verildikten sonra) veya galcanezumab 240 mg/ay verilmiş ve migrenin akut tedavisi için ilaç kullanmalarına izin verilmiştir. Bu 3 çalışma genelinde, ortalama migren öyküsü süresi 20 ila 21 yıl olan ve ortalama yaşı 41 olan kadın hastalar ağırlıklıdır (>%83). Çalışmalar genelinde, hastaların üçte biri önceden en az 1 profilaktik migren tedavisinin etkililiğinde başarısızlık yaşamış ve hastaların yaklaşık %16'sı önceden en az 2 profilaktik migren tedavisinin etkililiğinde başarısızlık yaşamıştır.
Üç çalışmanın tamamında primer etkililik ölçütü, başlangıca göre aylık migren baş ağrısı olan günlerin sayısındaki (MBG) ortalama değişikliktir. Yanıt oranı, çift kör tedavi dönemi boyunca aylık migren baş ağrısı olan günlerin sayısında azalmaya ilişkin önceden tanılı bir eşiği (≥%50,
≥%75 ve %100) karşılayan hastaların ortalama yüzdesidir. Migrenin fonksiyonel etkisi Migren Spesifik Yaşam Kalitesi Anketi (MSQ) versiyon 2.1 Rol Fonksiyonu-Kısıtlayıcı alanıyla ve Migren Yeti Yitimi Değerlendirme Ölçeği (MIDAS) ile değerlendirilmiştir. MSQ, migrenin iş veya günlük aktiviteler, aile ve arkadaşlarla ilişkiler, boş zaman aktiviteleri, verimlilik, konsantrasyon, enerji ve yorgunluk üzerine etkisini ölçer. Skorlama 0 ile 100 arasında değişmekte olup, yüksek puanlar daha az bozukluk anlamına gelmektedir, yani hastalar günlük aktivitelerine ilişkin performansta daha az kısıtlılık yaşamaktadır. MIDAS için, daha yüksek skorlar daha fazla yeti yitimine işaret eder. Başlangıçtaki MIDAS skorları EVOLVE-1 ve EVOLVE-2 çalışmalarındaki hastalarda migrenle ilgili şiddetli yeti yitimi (ortalama 33,1) ve REGAIN popülasyonunda migrenle ilgili çok şiddetli yeti yitimi (ortalama 67,2) olduğunu yansıtmıştır.
Epizodik migren
EVOLVE-1 ve EVOLVE-2 çalışmalarında 6 aylık, çift kör, plasebo kontrollü bir tedavi dönemi değerlendirilmiştir. Galcanezumab alan hastaların çift kör tedavi fazını tamamlama oranları
%82,8 ila %87,7 arasında değişmiştir.
Galcanezumab 120 mg ve 240 mg tedavi grupları başlangıca göre MBG sayısında ortalama değişiklikte plaseboya kıyasla istatistiksel olarak anlamlı ve klinik açıdan önemli iyileşmeler sergilemiştir (bkz. Tablo 2). Galcanezumab tedavisi alan hastalarda yanıt oranları ve akut ilaç tedavisi gerektiren aylık MBG sayısındaki azalma, plasebo tedavisi uygulanan hastalara kıyasla daha yüksek olmuştur. Galcanezumab tedavisi alan hastalarda (MSQ Rol Fonksiyonu-Kısıtlayıcı alan skoruyla ölçülen) fonksiyonlar bakımından plasebo tedavisi alanlara kıyasla 1. aydan itibaren daha fazla iyileşme görülmüştür. Fonksiyonlarda klinik açıdan anlamlı iyileşme (yanıt verenlerin oranı MSQ Rol Fonksiyonu-Kısıtlayıcı alanına dayalıdır), plasebo tedavisi uygulanan hastalara kıyasla, galcanezumab tedavisi alan daha fazla sayıda hastada görülmüştür. 120 mg
dozu, plaseboya göre istatistiksel olarak anlamlı derecede yeti yitimi azalmasıyla ilişkilendirilmiştir.
Plasebo tedavisi alan hastalara kıyasla galcanezumab 120 mg veya 240 mg tedavisi alan hastalarda aylık MBG sayısı, 1. ayda ve 6. aya kadar takip eden tüm aylarda, başlangıca göre anlamlı derecede daha fazla azalmıştır (bkz. Şekil 1). Ayrıca, galcanezumab tedavisi alan hastalarda (yükleme dozu 240 mg) 1.ay içerisinde, 1.haftada ve takip eden tüm haftalarda plasebo tedavisi alanlara kıyasla anlamlı derecede daha az sayıda haftalık MBG bildirmiştir.
Şekil 1 EVOLVE-1 ve EVOLVE-2 çalışmalarında aylık migren baş ağrısı olan günlerde zaman içindeki azalma
Migren Baş Ağrısı Olan Günler Başlangıca Göre Ortalama
Değişiklik (SH)
EVOLVE-1 Çalışması (Epizodik Migren)
EVOLVE-2 Çalışması (Epizodik Migren)
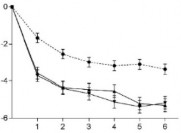
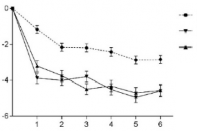
Migren Baş Ağrısı Olan Günler Başlangıca Göre Ortalama
Değişiklik (SH)
Ay Ay
GMB 120 mg ve 240 mg için plaseboya kıyasla tüm aylarda p<,001
GMB 120 mg ve 240 mg için plaseboya kıyasla tüm aylarda p<,001
Tablo 2. Etkililik ve hasta tarafından bildirilen sonuç ölçütleri
EVOLVE-1 – Epizodik Migren EVOLVE-2 – Epizodik Migren
| ||||||
EMGALITY EMGALITY
Plasebo Plasebo
120 mg 240 mg 120 mg 240 mg N = 210 N = 208 N = 425 N = 226 N = 220 N = 450 | ||||||
Etkililik Sonuçları
| ||||||
MBG | ||||||
Başlangıç | 9,21 | 9,14 | 9,08 | 9,07 | 9,06 | 9,19 |
Ortalama Değişiklik | -4,73 | -4,57 | -2,81 | -4,29 | -4,18 | -2,28 |
Tedavi Farkı | -1,92 | -1,76 |
| -2,02 | -1,90 |
|
%95 GA | (-2,48, - 1,37) | (-2,31, - 1,20) |
| (-2,55, - 1,48) | (-2,44, - 1,36) |
|
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
≥%50 MBG Yanıtı Verenler | ||||||
Yüzde oran, % | 62,3 | 60,9 | 38,6 | 59,3 | 56,5 | 36,0 |
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
≥%75 MBG Yanıtı Verenler | ||||||
Yüzde oran, % | 38,8 | 38,5 | 19,3 | 33,5 | 34,3 | 17,8 |
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
%100 MBG Yanıtı Verenler | ||||||
Yüzde oran, % | 15,6 | 14,6 | 6,2 | 11,5 | 13,8 | 5,7 |
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
Akut İlaç Kullanılan MBG |
|
|
|
|
|
|
Başlangıç | 7,42 | 7,34 | 7,38 | 7,47 | 7,47 | 7,62 |
Ortalama Değişiklik | -3,96 | -3,76 | -2,15 | -3,67 | -3,63 | -1,85 |
Tedavi Farkı | -1,81 | -1,61 |
| -1,82 | -1,78 |
|
%95 GA | (-2,28, - 1,33) | (-2,09, - 1,14) |
| (-2,29, - 1,36) | (-2,25, - 1,31) |
|
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
Hasta Tarafından Bildirilen Sonuç Ölçütleri | ||||||
MSQ Rol Fonksiyonu- Kısıtlayıcı Alan |
|
|
|
|
|
|
N | 189 | 184 | 377 | 213 | 210 | 396 |
Başlangıç | 51,39 | 48,76 | 52,92 | 52,47 | 51,71 | 51,35 |
Ortalama Değişiklik | 32,43 | 32,09 | 24,69 | 28,47 | 27,04 | 19,65 |
Tedavi Farkı | 7,74 | 7,40 |
| 8,82 | 7,39 |
|
%95 GA | (5,20, 10,28) | (4,83, 9,97) |
| (6,33, 11,31) | (4,88, 9,90) |
|
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
MSQ Rol Fonksiyonu Kısıtlayıcı Alan Yanıtı Verenler |
|
|
|
|
|
|
N | 189 | 184 | 377 | 213 | 210 | 396 |
Yüzde oran, % | 63,5 | 69,6 | 47,2 | 58,2 | 60,0 | 43,4 |
P değeri | < ,001 | < ,001 |
| < ,001 | < ,001 |
|
MIDAS Toplam Skoru |
|
|
|
|
|
|
N | 177 | 170 | 345 | 202 | 194 | 374 |
Başlangıç | 32,93 | 36,09 | 31,84 | 30,87 | 32,75 | 34,25 |
Ortalama Değişiklik | -21,16 | -20,06 | -14,87 | -21,17 | -20,24 | -12,02 |
Tedavi Farkı | -6,29 | -5,19 |
| -9,15 | -8,22 |
|
%95 GA | (-9,45, - 3,13) | (-8,39, - 1,98) |
| (-12,61, - 5,69) | (-11,71, - 4,72) |
|
P değeri | < ,001 | < ,002 |
| < ,001 | < ,001 |
|
N = hasta sayısı; %95GA= %95 güven aralığı. Etkililik sonuçları 1-6. aylarda değerlendirilmiştir. 4-6. aylarda değerlendirilmiştir.
EVOLVE-1 ve EVOLVE-2 çalışmalarının birleştirilmiş verilerine göre, etkililik nedenleriyle bir veya daha fazla profilaktik tedavinin başarısız olduğu hastalarda ortalama aylık MBG azalması için galcanezumab 120 mg ve plasebo arasında gözlenen tedavi farkı -2,69 gün (p<0,001) iken, galcanezumab 240 mg ve plasebo arasında gözlenen fark -2,78 gündür (p<0,001). İki veya daha fazla profilaktik tedavinin başarısız olduğu hastalarda galcanezumab 120 mg ve plasebo
arasındaki tedavi farkı -2,64 gün (p<0,001) iken, galcanezumab 240 mg ve plasebo arasındaki fark -3,04 gündür (p<0,001).
Kronik Migren
REGAIN çalışması, 3 aylık, çift kör, plasebo kontrollü bir tedavi döneminin ardından 9 aylık açık etiketli uzatma döneminden oluşmaktadır. Hastaların yaklaşık %15'i protokolün migren profilaksisi için izin verdiği şekilde topiramat veya propranolol ile eşzamanlı tedaviye devam etmiştir. Galcanezumab alan hastaların çift kör tedavi fazını tamamlama oranları %95,3'dür.
Galcanezumab 120 mg ve 240 mg tedavi grupları başlangıca göre plaseboya kıyasla MBG'de ortalama değişiklikte istatistiksel olarak ve klinik açıdan anlamlı iyileşmeler sergilemiştir (bkz. Tablo 3). Galcanezumab tedavisi alan hastalarda yanıt oranları plasebo tedavisi uygulanan hastalara kıyasla daha yüksek ve akut ilaç tedavisi alınan aylık MBG sayısındaki azalma daha büyük olmuştur. Galcanezumab tedavisi alan hastalarda (MSQ Rol Fonksiyonu-Kısıtlayıcı alan skoruyla ölçülen) fonksiyonlar bakımından plasebo tedavisi alanlara kıyasla 1. aydan itibaren daha fazla iyileşme kaydedilmiştir. Plasebo tedavisi uygulanan hastalara kıyasla galcanezumab tedavisi alan daha fazla sayıda hasta fonksiyonlarda klinik açıdan anlamlı düzeyde iyileşme elde etmiştir (yanıt verenlerin oranı MSQ Rol Fonksiyonu-Kısıtlayıcı alanına dayalıdır). 120 mg'lık doz, plaseboya kıyasla istatistiksel olarak anlamlı derecede yeti yitimi azalmasıyla ilişkilendirilmiştir.
Plasebo tedavisi alan hastalara kıyasla galcanezumab, 120 mg veya 240 mg tedavisi alanlarda 1. aydan 3. aya kadar her ay için aylık MBG sayısında başlangıca göre ortalama azalmalar anlamlı derecede daha fazladır (bkz. Şekil 2). Ayrıca, galcanezumab tedavisi alan hastalar (yükleme dozu 240 mg) plasebo tedavisi alanlara kıyasla 1. aydaki 1. haftada ve sonraki tüm haftalarda anlamlı derecede daha az sayıda haftalık MBG göstermiştir.
Şekil 2 REGAIN çalışmasında aylık migren baş ağrısı olan günlerde zaman içindeki
azalma
REGAIN Çalışması (Kronik Migren)
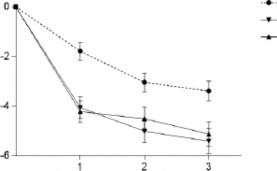
Migren Baş Ağrısı Olan Günler Başlangıca Göre Ortalama Değişiklik (SH)
Ay
2. ayda GMB 240 mg için plaseboya kıyasla p=,002 hariç, GMB 120 mg ve 240 mg için plaseboya kıyasla tüm aylarda p<,001
Tablo 3. Etkililik ve hasta tarafından bildirilen sonuç ölçütleri
| REGAIN – Kronik Migren | |||
Emgality | Plasebo N=538 | |||
120 mg 240 mg N = 273 N = 274 | ||||
Etkililik Sonuçları
| ||||
MBG |
|
|
|
|
Başlangıç |
| 19,36 | 19,17 | 19,55 |
Ortalama Değişiklik |
| -4,83 | -4,62 | -2,74 |
Tedavi Farkı |
| -2,09 | -1,88 |
|
%95 GA | (-2,92, -1,26) | (-2,71, -1,05) |
| |
P değeri | < ,001 | < ,001 |
| |
≥%50 MBG Yanıtı Verenler | ||||
Yüzde oran, % |
| 27,6 | 27,5 | 15,4 |
P değeri | < ,001 | < ,001 |
| |
≥%75 MBG Yanıtı Verenler | ||||
Yüzde oran, % |
| 7,0 | 8,8 | 4,5 |
P değeri |
| ,031 | < ,001 |
|
%100 MBG Yanıtı Verenler | ||||
Yüzde oran, % |
| 0,7 | 1,3 | 0,5 |
P değeri |
| > ,05 | > ,05 |
|
Akut İlaç Kullanılan MBG | ||||
Başlangıç |
| 15,12 | 14,49 | 15,51 |
Ortalama Değişiklik |
| -4,74 | -4,25 | -2,23 |
Tedavi Farkı |
| -2,51 | -2,01 |
|
%95 GA | (-3,27, -1,76) | (-2,77, -1,26) |
| |
P değeri | < ,001 | < ,001 |
| |
Hasta Tarafından Bildirilen Sonuç Ölçütleri | ||||
MSQ Rol Fonksiyonu-Kısıtlayıcı Alan | ||||
N |
| 252 | 253 | 494 |
Başlangıç |
| 39,29 | 38,93 | 38,37 |
Ortalama Değişiklik |
| 21,81 | 23,05 | 16,76 |
Tedavi Farkı |
| 5,06 | 6,29 |
|
%95 GA | (2,12, 7,99) | (3,03, 9,55) |
| |
P değeri | < ,001 | < ,001 |
| |
MSQ Rol Fonksiyonu Kısıtlayıcı Alan Yanıtı Verenler | ||||
N |
| 252 | 253 | 494 |
Yüzde oran, % |
| 64,3 | 64,8 | 54,1 |
P değeri |
| ,003 | ,002 |
|
MIDAS Toplam Skoru |
|
|
|
|
N |
| 254 | 258 | 504 |
Başlangıç |
| 62,46 | 69,17 | 68,66 |
Ortalama Değişiklik | -20,27 | -17,02 | -11,53 | |
Tedavi Farkı |
| -8,74 | -5,49 |
|
%95 GA | (-16,39, -1,08) | (-13,10, 2,12) |
| |
P değeri |
| ,025 | > ,05 |
|
N = hasta sayısı; %95GA= %95 güven aralığı.
Etkililik nedenleriyle bir veya daha fazla profilaktik tedavinin başarısız olduğu hastalarda ortalama aylık MBG azalması için galcanezumab 120 mg ve plasebo arasında gözlenen tedavi farkı -3,54 gün (p<0,001) olurken, galcanezumab 240 mg ve plasebo arasında gözlenen fark - 1,37 gündür (p<0,05). İki veya daha fazla profilaktik tedavinin başarısız olduğu hastalarda galcanezumab 120 mg ve plasebo arasındaki tedavi farkı 4,48 gün (p<0,001) iken, galcanezumab 240 mg ve plasebo arasındaki fark -1,86 gündür (p<0,01).
Aşırı miktarda akut baş ağrısı ilacı kullanımı görülen hasta oranı başlangıçta %64'dür. Bu hastalarda MBG sayısındaki azalma bakımından galcanezumab 120 mg ve plasebo arasında gözlenen tedavi farkı -2,53 gün (p<0,001) iken, galcanezumab 240 mg ve plasebo arasında gözlenen fark -2,26 gündür (p<0,001).
Uzun süreli etkililik
Etkililik, epizodik veya kronik migrenli hastalara (başlangıçtaki ortalama aylık MBG sayısı 10,6 olmak üzere) galcanezumabın 120 mg/ay (ilk ay için başlangıç yükleme dozu olarak 240 mg verildikten sonra) veya 240 mg/ay verildiği açık etiketli bir çalışmada 1 yıla kadar korunmuştur. Hastaların %77,8'i tedavi dönemini tamamlamıştır. Aylık MBG sayısında başlangıca göre genel ortalama azalmanın tedavi fazı süresince 120 mg doz grubu için ortalama 5,6 gün, 240 mg doz grubu için ortalama 6,5 gündür. Çalışmayı tamamlayan hastaların %72'sinden fazlası 12. ayda MBG bakımından %50 azalma bildirmiştir. EVOLVE-1 ve EVOLVE-2 çalışmalarının birleştirilmiş verilerinde, galcanezumab tedavisi alan hastaların %19'undan fazlasında ≥%50 yanıt, 1. aydan 6. aya kadar korunurken, plasebo uygulanan hastalar için bu oran %8 olmuştur (p<0,001).
Daha önce 2 ila 4 migren önleyici ilaç kategorisinde başarısız olan popülasyonda Faz 3 çalışması
CONQUER çalışması, son 10 yılda 2 ila 4 profilaktik ilaç kategorisinde daha önce başarısızlık yaşamış epizodik ve kronik migren hastalarında, önceki migren etkililik çalışmalarının ana bulgularını desteklemektedir, yani galcanezumab tedavisi aylık MBG sayısında ortalama bir azalmaya yol açmıştır (plasebo grubunda 1,0 güne kıyasla 4,1 gün; p<0,0001). Aylık MBG sayısındaki ortalama azalma, epizodik migren (plasebo için 0,3 güne kıyasla galcanezumab için 2,9 gündür; p<0,0001) ve kronik migren (plasebo için 2,2 güne kıyasla galcanezumab için 5,9 gündür; p<0,0001) alt popülasyonlarında da gözlenmiştir.
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Popülasyon farmakokinetiği (FK) analizine göre, 240 mg'lık bir yükleme dozunu takiben galcanezumabın maksimum serum konsantrasyonu (C) yaklaşık 30 μg/ml (%27 değişim katsayısı [CV]) ve C'a kadar geçen süre doz sonrası 5 gündür.
Aylık 120 mg veya 240 mg dozlarıyla ulaşılan kararlı durum C(C) sırasıyla yaklaşık 28 μg/ml (%35 CV) ve 54 μg/ml (%31 CV) olmuştur. 240 mg'lık yükleme dozundan sonra, 120 mg'lık aylık dozlamalar ile, galcanezumab C'a ulaşılmaktadır.
Enjeksiyon bölgesinin yeri (karın, uyluk, kalça ve kol) galcanezumabın emilimini anlamlı derecede etkilememiştir.
Dağılım:
Popülasyon FK analizine göre, galcanezumabın belirgin dağılım hacmi 7,3 L olmuştur. Biyotransformasyon:
İnsan IgG4 monoklonal antikoru olan galcanezumabın, endojen IgG ile aynı şekilde katabolik yolaklar üzerinden küçük peptidlere ve amino asitlere parçalanması beklenir.
Eliminasyon:
Popülasyon FK analizine göre, galcanezumabın belirgin klerensi yaklaşık 0,008 L/saat, yarılanma ömrü ise 27 gündür.
Doğrusallık/doğrusal olmayan durum:
Galcanezumab maruziyeti dozla orantılı şekilde artar.
Dozların 5-300 mg aralığında değiştiği bir popülasyon FK analizine göre emilim, belirgin klerens ve belirgin dağılım hacminin dozdan bağımsız olduğu saptanmıştır.
Hastalardaki karakteristik özellikler
Yaş, Cinsiyet, Vücut Ağırlığı, Irk, Etnik Köken
Galcanezumabın belirgin klerensi veya belirgin dağılım hacmi üzerinde yaş (18'den 65 yaşa kadar), cinsiyet, vücut ağırlığı, ırk veya etnik köken kaynaklı ve klinik açıdan anlamlı etki görülmediği için, bu faktörlere göre doz ayarlama yapılması gerekli değildir.
Böbrek veya karaciğer yetmezliği
Böbrek veya karaciğer yetmezliğinin galcanezumabın farmakokinetiği üzerindeki etkilerini değerlendirmeye yönelik spesifik klinik farmakoloji çalışması yapılmamıştır. IgG monoklonal antikorunun renal eliminasyonu düşük düzeydedir. Benzer şekilde, IgG monoklonal antikorları temel olarak intraselüler katabolizmayla elimine edilir ve karaciğer yetmezliğinin galcanezumab klerensini etkilemesi beklenmemektedir. Popülasyon FK analizine göre, bilirubin konsantrasyonu veya Cockcroft-Gault kreatinin klerensi (aralık: 24 ila 308 mL/dk) galcanezumabın belirgin klerensini anlamlı derecede etkilememiştir.
5.3. Klinik öncesi güvenlilik verileri
Sıçanlarda ve sinomolgus maymunlarında tekrarlanan doz toksisite çalışmaları ve 240 mg dozunu alan hastalardaki klinik maruziyetin yaklaşık 10 ila 80 katı maruziyet düzeylerinin olduğu sinomolgus maymunlarıyla yapılan güvenlilik farmakoloji değerlendirmeleri, klinik dışı veriler insanlar için spesifik bir risk olduğunu göstermemiştir.
Galcanezumabın karsinojenik veya mutajenik potansiyelinin değerlendirilmesi için klinik dışı çalışma yapılmamıştır. Galcanezumab ile ilgili farmakoloji ve kronik toksikoloji çalışmalarında elde edilen veriler ve CGRP ile ilgili literatür değerlendirmesi doğrultusunda, galcanezumab ile kronik tedavinin karsinogenez riskini arttıracağını düşündürecek herhangi bir kanıt yoktur.
Galcanezumab uygulanan sıçanlarda östrus döngüsü, sperm analizi veya çiftleşme ya da üreme performansı gibi fertilite parametreleri üzerinde etki gözlenmemiştir (insanlarda 240 mg ile kaydedilen maruziyetin yaklaşık 4 ila 20 katı maruziyet düzeylerinde). Erkek fertilitesi çalışmasında, insanlarda 240 mg ile kaydedilen maruziyetin 4 katı maruziyetle sağ testis ağırlığı anlamlı derecede azalmıştır.
Sıçanlarda yapılan embriyo-fetal gelişimsel toksisite çalışmasında, insanlarda 240 mg ile kaydedilen maruziyetin yaklaşık 20 katı maruziyetle gestasyonun 20. gününde kısa kaburgalı fetus ve yavru sayısında artış, osifiye kaudal vertebraların ortalama sayısında azalma olmuştur. Bu bulgular maternal toksisite olmaksızın gözlenmiş ve galcanezumab ile ilgili olmakla birlikte advers olmayan etkiler kapsamında değerlendirilmiştir.
Tavşanlarda yapılan embriyo-fetal gelişimsel toksisite çalışmasında, insanlarda 240 mg ile kaydedilen maruziyetin yaklaşık 33 katı maruziyetle galcanezumab tedavisi uygulanan bir annenin erkek fetusunda gestasyonun 29. gününde kafatası anomalisi olduğu belirlenmiştir.
Sıçanlara postnatal 21 günden 90 güne kadar haftada iki kez galcanezumab uygulanan bir jüvenil toksikoloji çalışmasında, insanlarda 240 mg ile kaydedilen maruziyetin yaklaşık 50 katı maruziyetle ilişkilendirilen sistemik etkiler toplam kemik mineral içeriğinde ve kemik mineral yoğunluğunda geri dönüşümlü, minimal, advers olmayan azalmalarla sınırlı olmuştur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-histidin
L-histidin hidroklorür monohidrat Polisorbat 80
Sodyum klorür Enjeksiyonluk su
6.2. Geçimsizlikler
Hiçbir geçimsizlik çalışması yapılmamıştır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında (2 ºC – 8 ºC'de) saklayınız. Dondurmayınız.Işıktan korumak için orijinal ambalajında saklayınız. Çalkalamayınız.
EMGALITY 30°C'yi aşmayan sıcaklıklarda buzdolabı dışında 7 güne kadar saklanabilir. Bu koşulların aşılması halinde, kullanıma hazır kalem kullanılmayıp, atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
Tip I berrak cam şırınga içinde 1 ml steril çözelti. Şırınga tek kullanımlık, tek dozluk bir enjeksiyon kalemi içindedir. Kullanıma hazır 1, 2 veya 3 kalem içeren ambalajları mevcuttur.
Kutu içerisinde yer alan iğne sadece subkütan enjeksiyon için uygundur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanma Kılavuzu
Ambalaj içinde yer alan enjeksiyon kalemiyle ilgili kullanma talimatlarına dikkatlice uyulmalıdır.
Kullanıma hazır kalem yalnızca tek kullanımlıktır.
Kullanıma hazır kalem, uygulama öncesinde görsel olarak incelenmelidir. Bulanıklık, renk değişimi ve partikül madde olması durumunda veya cihazın herhangi bir parçasının hasarlı olması durumunda, EMGALITY kullanılmamalıdır.
Çalkalamayınız.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikâ€lerine uygun olarak imha edilmedir.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Satış Fiyatı | 10247.13 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 10247.13 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699673954714 |
| Etkin Madde | Galkanezumab |
| ATC Kodu | N02CD02 |
| Birim Miktar | 120 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Sinir Sistemi > Migren İlaçları |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |