EVRENZO 20 mg film kaplı tablet (12 adet) Kısa Ürün Bilgisi
{ Roksadustat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
EVRENZO 20 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tablet 20 mg roksadustat içermektedir.
Yardımcı maddeler
Laktoz monohidrat (sığır kaynaklı) 42,6 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bir tarafında â20' baskısı olan kırmızı, oval tabletler (8 mm à 4 mm).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
EVRENZO, kronik böbrek hastalığı (KBH) ile ilişkili semptomatik anemisi olan yetişkin hastaların tedavisi için endikedir.
4.2. Pozoloji ve uygulama şekli
Roksadustat tedavisi, anemi tedavisinde deneyimli bir hekim tarafından başlatılmalıdır. EVRENZO ile tedaviye başlamadan önce ve doz arttırılmasına karar verilirken diğer tüm anemi nedenleri değerlendirilmelidir.
Anemi semptomları ve sekelleri yaşa, cinsiyete ve genel hastalık yüküne göre değişebilir; her bir hastanın klinik seyrinin ve durumunun bir hekim tarafından değerlendirilmesi gerekir. Anemi semptomlarının varlığına ilave olarak; hemoglobin (Hb) konsantrasyonundaki düşme hızı, demir tedavisine önceki yanıt ve kırmızı kan hücresi (RBC) transfüzyonu ihtiyacı riski gibi kriterler, her bir hastanın klinik seyri ve durumunun değerlendirilmesinde önemli olabilir.
Pozoloji/uygulama sıklığı ve süresi:
Uygun roksadustat dozu, haftada üç kez oral yoldan alınmalıdır ve birbirini izleyen günlerde alınmamalıdır.
Doz, 10 ila 12 g/dL'lik hedef hemoglobin seviyelerine ulaşmak ve bu seviyeyi korumak için aşağıda tarif edildiği şekildebirey egöreayarlanmalıdır.
![]()
Hb seviyelerinde klinik olarak anlamlı bir artış sağlanamazsa, roksadustat tedavisine 24 haftalık tedaviden sonra devam edilmemelidir. Yetersiz yanıt için alternatif nedenler araştırılmalı ve EVRENZO ile tedaviye başlamadan önce tedavi edilmelidir.
Tedavi başlangıcındaki başlangıç dozu
Tedaviye başlamadan önce demir depolarının yeterli olması sağlanmalıdır.
Mevcut durumda eritropoez uyarıcı ajan (ESA) tedavisi almayan hastalar
Daha önce ESA ile tedavi edilmemiş anemi tedavisine yeni başlayan hastalar için önerilen roksadustat başlangıç dozu, ağırlığı 100 kg'dan az olan hastalarda haftada üç kez 70 mg ve ağırlığı 100 kg ve üzeri hastalarda haftada üç kez 100 mg'dır.
Bir ESA'dan geçiş yapan hastalar
Mevcut durumda bir ESA tedavisi alan hastalar roksadustat tedavisine geçiş yapabilir; fakat diğer taraftan ESA tedavisi alırken durumu stabil olan diyaliz hastalarının tedavi geçişi, yalnızca geçerli bir klinik neden olduğunda değerlendirilmelidir (bkz. bölüm 4.4 ve 5.1).
Diğer taraftan, diyalize girmeyen ve ESA tedavisi alırken stabil olan hastaların tedavi geçişi araştırılmamıştır. Bu hastaların roksadustat ile tedavi edilmesine ilişkin karar, her bir hasta için yarar risk değerlendirmesine göre verilmelidir.
Önerilen başlangıç roksadustat dozu, geçişten önceki 4 haftada reçete edilen ortalama ESA dozuna bağlıdır (bkz. Tablo 1). İlk roksadustat dozu, mevcut ESA'nın bir sonraki planlan dozunun yerini almalıdır.
Tablo 1: ESA'dan geçiş yapan hastalarda haftada üç kez alınacak roksadustatın başlangıç dozları
Darbepoetin alfa intravenöz veya subkütan doz (mikrogram/hafta) | Epoetin intravenöz veya subkütan doz (IU/hafta) | Metoksi polietilen glikol- epoetin beta intravenöz veya subkütan doz (mikrogram/aylık) | Roksadustat dozu (miligram/haftada üç kez) |
25'ten az | 5000'den az | 80'den az | 70 |
25 ila 40'tan az | 5000 ila 8000 arasında | 80 ila 120 (dahil) arasında | 100 |
40 ila 80 (dahil) arasında | 8000'den fazla ve 16000 (dahil) arasında | 120'den fazla ve 200 (dahil) arasında | 150 |
80'den fazla | 16000'den fazla | 200'den fazla | 200 |
ESA: eritropoez-uyarıcı ajan
Doz ayarlaması ve Hb izleme
Hastaya göre belirlenen idame dozu haftada üç kez 20 mg ila 400 mg arasında değişmektedir (önerilen maksimum doz bölümüne bakınız). Hb seviyeleri, arzu edilen 10-12 g/dL Hb seviyesine ulaşılana ve stabil hale gelene kadar her iki haftada bir ve sonrasında her 4 haftada bir veya klinik olarak gerekli görüldüğü şekilde izlenmelidir.
Roksadustat dozu, dozun bir basamak azaltılmasını gerektiren 2 g/dL'den fazla Hb artışları durumu hariç, tedavinin başlangıcından 4 hafta sonra ve daha sonra her 4 haftada bir başlangıç dozundan kademeli olarak yukarı veya aşağı doğru ayarlanabilir. Roksadustat dozunu
ayarlarken, mevcut Hb seviyesi ve son 4 hafta içinde Hb seviyesindeki son değişiklik oranı göz
önünde bulundurulmalıdır ve Tablo 2'de açıklanan doz ayarlama algoritmasına göre doz
ayarlama adımlarını izlenmelidir.
Yukarı veya aşağı kademeli doz ayarlamaları mevcut dozların sekansını izlemelidir:
20 mg-40 mg-50 mg-70 mg-100 mg-150 mg-200 mg-250 mg-300 mg-400 mg (sadece diyalizdeki KBH hastaları için).
Tablo 2: Doz ayarlama kuralları
Önceki 4 hafta boyunca Hb'deki değişim | Mevcut Hb seviyesi (g/dL): | |||
10,5'ten düşük | 10,5 â 11,9 | 12 â 12,9 | 13 veya daha yüksek | |
+1 g/dL'den fazla değer değişikliği | Değişiklik yapmayın | Dozu bir adım azaltın | Dozu bir adım azaltın | Dozu vermeyin, Hb seviyesini izleyin ve Hb 12 g/dL'den az olduğunda, iki adım kadar azaltılmış bir dozda dozlamaya devam edin |
-1 ve +1 g/dL arasında değer değişikliği | Dozu bir adım arttırın | Değişiklik yapmayın | Dozu bir adım azaltın | |
-1 g/dL'den az değer değişikliği | Dozu bir adım arttırın | Dozu bir adım arttırın | Değişiklik yapmayın | |
Roksadustat dozu, 4 haftalık bir dönemde herhangi bir zamanda Hb 2 g/dL'den fazla artması hariç (bu durumda doz derhal bir basamak azaltılmalıdır), her 4 haftada bir defadan daha sık ayarlanmamalıdır. Önceki 4 hafta boyunca hemoglobin (Hb)'deki değişim= (mevcut Hb değeri) (4 hafta önce bakılan Hb değeri).
Halihazırda en düşük dozda (haftada üç kez 20 mg) olan bir hasta için ek doz azaltılması gerekiyorsa, 20 mg dozu tableti kırarak azaltılmamalı, ancak doz sıklığı haftada iki kez olarak düşürülmelidir. Dozun daha fazla azaltılması gerekiyorsa, doz sıklığı haftada bire düşürülebilir.
İdame dozu
Hb seviyeleri, değerler 10 ila 12 g/dL arasında stabilize edildikten sonra düzenli olarak izlenmeye devam edilmelidir ve doz ayarlaması kurallarına uyulmalıdır (bkz. Tablo 2).
Roksadustat tedavisi sırasında diyalize başlayan hastalar
Roksadustat tedavisi sırasında diyalize başlayan KBH hastaları için spesifik bir doz ayarlamasına gerek yoktur. Normal doz ayarlama kurallarına uyulmalıdır (bkz. Tablo 2).
İndükleyiciler veya inhibitörlerle birlikte eşzamanlı roksadustat tedavisi
Güçlü CYP2C8 inhibitörleri (örn. gemfibrozil) veya indükleyicileri (örn. rifampisin) veya UGT1A9 inhibitörleri (örn. probenesid) ile eşzamanlı tedaviye başlanırken veya tedavi kesilirken: Hb seviyeleri düzenli olarak izlenmelidir ve doz ayarlama kurallarına uyulmalıdır (bkz. Tablo 2; ayrıca bkz. bölüm 4.5 ve 5.2).
Önerilen maksimum doz
Diyalize girmeyen hastalar, haftada üç kez 3 mg/kg vücut ağırlığı veya 300 mg'lık roksadustat dozunu, hangisi daha düşükse, aşmamalıdır.
Diyalizdeki hastalar, haftada üç kez 3 mg/kg vücut ağırlığı veya 400 mg'lık roksadustat dozunu, hangisi daha düşükse, aşmamalıdır.
Unutulan doz
Bir doz unutulursa ve bir sonraki planlanan doza 1 günden fazla bir süre varsa, unutulan doz
üre
mümkün olan en kısa sürede alınmalıdır. Bir sonraki planlanan doza bir gün veya daha az s
kalırsa, unutulan doz atlanmalı ve bir sonraki doz bir sonraki planlanan günde alınmalıdır. Her durumda, daha sonra düzenli doz programına devam edilmelidir.
Uygulama şekli:
EVRENZO film kaplı tabletler, yiyecekle birlikte veya yiyecek olmadan oral yoldan alınır.
Tabletler, ilgili koşullar hakkında klinik veri bulunmaması nedeniyle ve ışığa duyarlı tablet çekirdeğini fotodegradasyondan korumak için, bütün olarak yutulmalı ve çiğnenmemeli, kırılmamalı veya ezilmemelidir.
Tabletler, fosfat bağlayıcıların (lantan hariç) veya kalsiyum, demir, magnezyum veya alüminyum gibi çok değerlikli katyonlar içeren diğer tıbbi ürünlerin uygulanmasından en az 1 saat önce veya 1 saat sonra alınmalıdır (bkz. bölüm 4.5 ve 5.2).
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer yetmezliği:
Hafif karaciğer yetmezliği (Child-Pugh sınıf A) olan hastalarda başlangıç dozu seviyesinin
ayarlanması gerekmemektedir (bkz. bölüm 4.4 ve 5.2).
Orta dereceli karaciğer yetmezliği olan hastalara roksadustat reçete edilirken dikkatli olunmalıdır. Orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf B) tedaviye başlarken başlangıç dozu yarı yarıya veya başlangıç dozunun yarısına en yakın doz seviyesine düşürülmelidir. Bu popülasyonda etkililiği ve güvenliliği değerlendirilmediği için, şiddetli karaciğer yetmezliği olan hastalarda (Child-Pugh sınıf C) EVRENZO kullanımı tavsiye edilmemektedir. (bkz. bölüm 4.4 ve 5.2).
Pediyatrik popülasyon:
18 yaş altındaki pediyatrik hastalarda roksadustatın güvenliliği ve etkililiği belirlenmemiştir. Veri mevcut değildir.
Geriyatrik popülasyon:
Yaşlı hastalarda başlangıç dozunun ayarlanması gerekmemektedir (bkz. bölüm 5.2).
4.3. Kontrendikasyonlar
EVRENZO aşağıdaki durumlarda kontrendikedir:
Etkin madde
herhangi birine karşı aşırı duyarlılık.
Gebeliğin üçüncü trimesterinde (bkz. bölüm 4.4 ve 4.6).
Emzirme (bkz. bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
Kardiyovasküler risk ve mortalite riski
Genel olarak, roksadustat ile tedavi için kardiyovasküler risk ve mortalite riskinin ESA tedavisi için kardiyovasküler risk ve mortalite riski ile karşılaştırılabilir olduğu, her iki tedavinin doğrudan karşılaştırılmasından elde edilen verilere dayalı olarak değerlendirilmektedir (bkz. bölüm 5.1). Diyalize girmeyen ve KBH ile ilişkili anemisi olan hastalar için bu risk plaseboya karşı yeterli güven ile tahmin edilemediğinden, bu hastaları roksadustat ile tedavi etme kararı,
bir ESA ile tedavi edilmeden önce uygulanacak benzer değerlendirmelere dayandırılmalıdır.
Ayrıca, tedaviye yanıt vermeme ve ESA ile tedavileri stabil seyreden diyaliz hastalarının tedavi
kz.
değişikliği dahil, bu riski etkileyebilecek çeşitli katkıda bulunan faktörler tanımlanmıştır (b
bölüm 4.2 ve 5.1). Yanıtsızlık durumunda, roksadustat tedavisine, tedavinin başlangıcından sonraki 24 haftadan sonra devam edilmemelidir (bkz. bölüm 4.2). Diğer taraftan, ESA tedavisi ile stabil durumda olan diyaliz hastalarının tedavi değişikliği, yalnızca geçerli bir klinik neden olduğunda değerlendirilmelidir (bkz. bölüm 4.2). Diyalize girmeyen, KBH ile ilişkili anemisi olan ve ESA tedavisi ile stabil durumda olan hastalar için, bu hastalar üzerinde çalışma gerçekleştirilmediğinden bu risk tahmin edilememiştir. Bu hastaları roksadustat ile tedavi etme kararı, her bir hastanın bireysel yarar risk değerlendirmesine dayanmalıdır.
Trombotik vasküler olaylar
Rapor edilen trombotik vasküler olaylar (TVO'lar) riski, özellikle obezite ve önceden var olan TVO öyküsü (örn. derin ven trombozu ïDVTï ve pulmoner emboli [PE]) dahil, TVO için önceden var olan risk faktörlerine sahip hastalarda roksadustat ile tedaviden elde edilecek yararlara karşı dikkatli bir şekilde ölçülmelidir. Klinik çalışmalardaki hastalarda derin ven trombozu yaygın ve pulmoner emboli yaygın olmayan sıklıkta rapor edilmiştir. DVT ve PE olaylarının çoğunluğu ciddi olarak sınıflandırılmıştır.
Klinik çalışmalarda diyaliz uygulanan KBH hastalarında vasküler erişim trombozu (VET) çok yaygın olarak rapor edilmiştir (bkz. bölüm 4.8).
Diyalize giren KBH hastalarında, roksadustat ile tedavi edilen hastalarda VET oranları, tedavinin başlangıcını takiben ilk 12 haftada, 12 g/dL'den daha fazla Hb değerlerinde ve 4 hafta boyunca 2 g/dL'den daha fazla Hb yükselmesi durumunda en yüksek olarak gözlenmiştir. Hb seviyelerinin yakından izlenmesi ve 12 g/dL'den daha fazla Hb seviyelerini ve 4 hafta boyunca 2 g/dL'den daha fazla Hb yükselmesini önlemek için doz ayarlama kuralları (bkz. Tablo 2) kullanılarak dozun ayarlanması tavsiye edilir.
TVO bulgu ve belirtileri olan hastalar tedavi standardına göre hızla değerlendirilmeli ve tedavi edilmelidir. Tedaviye ara verme veya tedaviyi durdurma kararı, her bir hasta için yarar-risk değerlendirmesine dayandırılmalıdır.
Nöbetler
Klinik çalışmalarda roksadustat alan hastalar arasında nöbet yaygın olarak bildirilmiştir (bkz. bölüm 4.8). Roksadustat, nöbet öyküsü (konvülsiyonlar veya krizler), epilepsi veya merkezi sinir sistemi (MSS) enfeksiyonları gibi nöbet aktivitesine yatkınlıkla ilişkili tıbbi durumları olan hastalarda dikkatli kullanılmalıdır. Tedaviye ara verme veya tedaviyi durdurma kararı, her bir hasta için yarar-risk değerlendirmesine dayandırılmalıdır.
Ciddi enfeksiyonlar
En yaygın rapor edilen ciddi enfeksiyonlar, pnömoni ve idrar yolu enfeksiyonları olmuştur. Bir enfeksiyona ait bulgu ve belirtileri olan hastalar derhal tedavi standardına göre değerlendirilmeli ve tedavi edilmelidir.
Sepsis
Sepsis, en yaygın olarak rapor edilen ciddi enfeksiyonlardan biri olmuştur ve fatal olayları da içermiştir. Sepsis bulgu ve belirtileri olan hastalar (örneğin, tüm vücuda yayılan, düşük kan basıncı ve organ yetmezliği potansiyeli ile bir enfeksiyon) derhal standart bakım koşullarına göre değerlendirilmeli ve tedavi edilmelidir.
Sekonder hipotiroidizm
Roksadustat kullanımıyla sekonder hipotiroidizm vakaları bildirilmiştir (bkz. bölüm 4.8). Bu
reaksiyonlar, roksadustatın kesilmesi üzerine tersine çevrilebilir olmuşlardır. Tiroid
fonksiyonlarının klinik olarak belirtildiği şekilde izlenmesi önerilir.
Tedaviye yetersiz yanıt
Roksadustat tedavisine yetersiz yanıta neden olan faktörlerin derhal araştırılması gerektirmektedir. Besin eksiklikleri giderilmelidir. Eşzamanlı başka enfeksiyonlar, gizli kan kaybı, hemoliz, şiddetli alüminyum toksisitesi, altta yatan hematolojik hastalıklar veya kemik iliği fibrozu da eritropoetik yanıtı kötüleştirebilir. Retikülosit sayımı, değerlendirmenin bir parçası olarak dikkate alınmalıdır. Tipik yanıtsızlık nedenleri hariç tutulursa ve hastada retikülositopeni varsa; kemik iliği incelemesi değerlendirilmelidir. Tedaviye yetersiz yanıt için ele alınabilir bir neden mevcut değilse, 24 haftalık tedaviden sonra EVRENZO'ya devam edilmemelidir.
Karaciğer yetmezliği
Orta derecede karaciğer yetmezliği (Child-Pugh sınıf B) olan hastalara roksadustat uygulanırken dikkatli olunmalıdır. Şiddetli karaciğer yetmezliği (Child-Pugh sınıf C) olan hastalarda EVRENZO kullanımı tavsiye edilmemektedir (bkz. bölüm 5.2).
Gebelik ve kontrasepsiyon
Hamile kalmayı planlayan kadınlarda, gebelik döneminde veya gebelik sırasında KBH ile ilişkili anemi teşhisi konduğunda, roksadustat tedavisine başlanmamalıdır. Bu tür durumlarda, uygunsa, alternatif tedavi başlatılmalıdır. Roksadustat tedavisi uygulanırken gebelik meydana gelirse, tedavi kesilmeli ve uygunsa alternatif tedavi başlatılmalıdır. Çocuk doğurma potansiyeli olan kadınlar, tedavi sırasında ve son EVRENZO dozundan sonra en az bir hafta süreyle yüksek etkili kontrasepsiyon yöntemleri kullanmalıdır (bkz. bölüm 4.3 ve 4.6).
Yanlış kullanım
Yanlış kullanım, şekilli hücre hacminde (packed cell volume-PCV) aşırı bir artışa neden olabilir. Bu, kardiyovasküler sistemin hayatı tehdit eden komplikasyonları ile ilişkili olabilir.
Yardımcı maddeler
EVRENZO laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, total laktaz yetmezliği ya da
glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
EVRENZO, alerjik reaksiyonlara neden olabilecek Allura Kırmızısı AC alüminyum lake içerir (bkz. bölüm 6.1).
EVRENZO eser miktarda soya lesitini içerir. Yer fıstığı veya soyaya karşı alerjisi olan hastalar bu tıbbi ürünü kullanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlerin roksadustat üzerindeki etkisi
Fosfat bağlayıcılar ve çok değerlikli katyonlar içeren diğer ürünler
Sağlıklı gönüllülerde roksadustatın fosfat bağlayıcılar sevelamer karbonat veya kalsiyum asetat
ile birlikte uygulanması, roksadustat EAAânı sırasıyla %67 ve %46, Câı da sırasıyla %66 ve
%52 oranında azaltmıştır. Roksadustat, fosfat bağlayıcılar veya kalsiyum, demir, magnezyum veya alüminyum içeren diğer ürünler gibi çok değerlikli katyonlarla şelat oluşturabilir. Fosfat bağlayıcıların kademeli olarak uygulanmasının (en az 1 saat arayla), KBH'si olan hastalarda roksadustat maruziyeti üzerinde klinik olarak anlamlı bir etkisi olmamıştır. Roksadustat, fosfat bağlayıcıların veya çok değerlikli katyonlar içeren diğer tıbbi ürünlerin veya takviyelerin uygulanmasından en az 1 saat sonra alınmalıdır (bkz. bölüm 4.2). Bu kısıtlama lantan karbonat için geçerli değildir çünkü roksadustatınlantankarbonatilebirlikte uygulanması roksadustatın
plazma maruziyetinde klinik olarak anlamlı bir değişikliğe yol açmamıştır.
CYP2C8 veya UGT1A9 aktivitesi değiştiricileri
Roksadustat CYP2C8 ve UGT1A9'un bir substratıdır. Roksadustatın gemfibrozil (CYP2C8 ve OATP1B1 inhibitörü) veya probenesid (UGT ve OAT1/OAT3 inhibitörü) ile birlikte uygulanması, sağlıklı gönüllülerde roksadustat EAA'ını 2,3 kat ve C'ını 1,4 kat arttırmıştır. Gemfibrozil, probenesid, CYP2C8'in diğer güçlü inhibitörleri veya indükleyicileri veya UGT1A9'un diğer güçlü inhibitörleri ile eşzamanlı tedaviye başlanırken veya tedavi kesilirken Hb düzeyleri izlenmelidir. Hb izlemine göre doz ayarlama kuralları (bkz. Tablo 2) takip edilerek roksadustat dozu ayarlanmalıdır.
Roksadustatın diğer tıbbi ürünler üzerindeki etkileri
OATP1B1 veya BCRP substratları
Roksadustat bir BCRP ve OATP1B1 inhibitörüdür. Bu taşıyıcılar statinlerin bağırsak ve hepatik alımı ve atımında önemli bir rol oynamaktadır. 200 mg roksadustatın simvastatin ile eş zamanlı uygulanması, sağlıklı gönüllülerde simvastatin EAA ve C'ını sırasıyla 1,8 kat ve 1,9 kat ve simvastatin asit (simvastatinin aktif metaboliti) EAA ve C'ını ise sırasıyla 1,9 kat ve 2,8 kat artırmıştır. Simvastatin ve simvastatin asit konsantrasyonları, simvastatin roksadustattan 2 saat önce veya 4 veya 10 saat sonra uygulandığında da artmıştır.
200 mg roksadustatın rosuvastatin ile eşzamanlı uygulanması, rosuvastatin EAA ve C'ını sırasıyla 2,9 kat ve 4,5 kat artırmıştır. 200 mg roksadustatın atorvastatin ile eşzamanlı uygulanması, atorvastatin EAA ve C'ını sırasıyla 2 kat ve 1,3 kat artırmıştır.
Diğer statinler ile etkileşimler de beklenmektedir. Roksadustat ile eşzamanlı uygulandıklarında, bu etkileşim göz önünde bulundurulmalıdır, statinlerle ilişkili advers reaksiyonlar ve statin dozunun azaltılması ihtiyacı izlenmelidir. Her bir hasta için uygun statin dozuna karar verirken statin reçeteleme bilgilerine bakınız.
Roksadustat, BCRP veya OATP1B1 substratları olan diğer tıbbi ürünlerin plazma maruziyetini artırabilir. Eşzamanlı uygulanan tıbbi ürünlerin olası advers reaksiyonları izlenmelidir ve doz buna göre ayarlanmalıdır.
Roksadustat ve ESA'lar
Roksadustat, ESA'larla kombinasyon halinde incelenmediği için, birlikte uygulanmaları tavsiye
edilmez.
Özel popülasyonlara ilişkin ek bilgiler:
Etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
boyunca yüksek etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Roksadustat gebeliğin üçüncü trimesterinde kontrendikedir (bkz. bölüm 4.3 ve bölüm 4.4).
Roksadustat gebeliğin birinci ve ikinci trimesteri sırasında tavsiye edilmemektedir (bkz. bölüm 4.4). EVRENZO kullanırken gebelik meydana gelirse, tedavi durdurulmalı ve uygunsa alternatif tedavilere geçilmelidir (bkz. bölüm 4.3).
Gebe kadınlarda roksadustat kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar
üzerinde yapılan çalışmalarda üreme toksisitesi gözlenmiştir (bkz. bölüm 5.3).
Laktasyon dönemi
Roksadustatın/metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir.
Mevcut hayvan verileri, roksadustatın süte geçtiğini göstermiştir (detaylar için bkz. bölüm 5.3). EVRENZO laktasyon döneminde kontrendikedir (bkz. bölüm 4.3 ve 5.3).
Üreme yeteneği/Fertilite
Hayvanlar üzerinde yapılan çalışmalarda üreme toksisitesi gözlenmiştir (bkz. bölüm 5.3). İnsanlar için potansiyel risk bilinmemektedir.
Hayvan çalışmalarında, roksadustatın erkek ve dişi fertilitesi üzerine hiçbir etkisi bulunmamıştır. Bununla birlikte, erkek sıçan üreme organlarında değişiklikler gözlenmiştir. Roksadustatın insanlarda erkek fertilitesi üzerindeki potansiyel etkileri halihazırda bilinmemektedir. Maternal olarak toksik bir dozda, embriyonik kayıpta artış gözlemlenmiştir (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Roksadustatın araç ve makine kullanma yeteneği üzerinde minör bir etkisi vardır. EVRENZO ile tedavi sırasında nöbetler rapor edilmiştir (bkz. bölüm 4.4.). Bu nedenle araç veya makine kullanırken dikkatli olunmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
EVRENZO'nun güvenliliği, en az bir doz roksadustat tedavisi almış, anemi ve KBH'si olan diyalize girmeyen 3542 (NDD) ve diyalize giren 3353 (DD) hastada değerlendirilmiştir.
Roksadustat ile ilişkili en sık (≥%10) advers reaksiyonlar hipertansiyon (%13,9), vasküler erişim trombozu (%12,8), diyare (%11,8), periferik ödem (%11,7), hiperkalemi (%10,9) ve
mide bulantısıdır (%10,2).
Roksadustat ile ilişkili en sık (≥%1) ciddi advers reaksiyonlar sepsis (%3,4), hiperkalemi
(%2,5), hipertansiyon (%1,4), ve derin ven trombozudur (%1,2).
Advers reaksiyonların tablo halinde listesi
Bu bölümde, klinik çalışmalar sırasında ve/veya pazarlama sonrası deneyimlerde gözlenen advers reaksiyonlar sıklık kategorisine göre listelenmiştir.
bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 3. Advers reaksiyonlar
MedDRA Sistem organ sınıfı (SOC) | Sıklık kategorisi | Advers reaksiyon |
Enfeksiyonlar ve enfestasyonlar | Yaygın | Sepsis |
Endokrin hastalıkları | Bilinmiyor | Sekonder hipotiroidizm |
Metabolizma ve beslenme hastalıkları | Çok yaygın | Hiperkalemi |
Psikiyatrik hastalıklar | Yaygın | Insomnia |
Sinir sistemi hastalıkları | Yaygın | Nöbetler, baş ağrısı |
Vasküler hastalıklar | Çok yaygın | Hipertansiyon, vasküler erişim trombozu (VET) |
Yaygın | Derin ven trombozu (DVT) | |
Gastrointestinal hastalıklar | Çok yaygın | Bulantı, diyare |
Yaygın | Konstipasyon, kusma | |
Deri ve deri altı doku hastalıkları | Bilinmiyor | Jeneralize Dermatit Eksfolyatif (DEG) |
Hepatobiliyer hastalıklar | Yaygın olmayan | Hiperbilirubinemi |
Solunum, göğüs hastalıkları, mediastinal hastalıklar | Yaygın olmayan | Pulmoner embolizm |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Çok yaygın | Periferik ödem |
Araştırmalar | Bilinmiyor | Kan tiroid uyarıcı hormon (TSH) azalması |
Seçilmiş advers reaksiyonların tanımı
Trombotik vasküler olaylar
Diyalize girmeyen KBH hastalarında DVT olayları, roksadustat grubunda %1 oranı (100 hasta maruziyet yılı başına olay yaşayan 0,6 hasta) ve plasebo grubunda %0,2 oranı ile (100 hasta maruziyet yılı başına olay yaşayan 0,2 hasta), yaygın olmayan sıklıkta olmuştur. Diyalize giren KBH hastalarında, DVT olayları roksadustat grubunda %1,3 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,8 hasta) ve ESA grubunda %0,3 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,1 hasta) meydana gelmiştir (bkz. bölüm 4.4).
Diyalize girmeyen KBH hastalarında pulmoner emboli roksadustat grubunda %0,4 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,2 hasta) gözlenirken, plasebo grubunda %0,2 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,1 hasta) gözlenmiştir. Diyalize giren KBH hastalarında pulmoner emboli roksadustat grubunda %0,6 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,3 hasta) gözlenirken, ESA grubunda %0,5 oranında (100 hasta maruziyet yılı başına olay yaşayan 0,3 hasta) gözlenmiştir (bkz. bölüm 4.4).
Diyalize giren KBH hastalarında, vasküler erişim trombozu ESA grubunun %10,2'si (100 hasta maruziyet yılı başına olay yaşayan 5,4 hasta) ile karşılaştırıldığında, roksadustat grubunun
%12,8'inde (100 hasta maruziyet yılı başına olay yaşayan 7,6 hasta) gözlemlenmiştir (bkz. bölüm 4.4).
Diyalize girmeyen KBH hastalarında nöbetler, roksadustat grubunun %1,1'inde (100 hasta maruziyet yılı başına olay yaşayan 0,6 hasta) ve plasebo grubunun %0,2'sinde (100 hasta maruziyet yılı başına olay yaşayan 0,2 hasta) meydana gelmiştir.
Diyalize giren KBH hastalarında nöbetler, roksadustat grubunun %2'sinde (100 hasta maruziyet yılı başına olay yaşayan 1,2 hasta) ve ESA grubunun %1,6'sında (100 hasta maruziyet yılı başına olay yaşayan 0,8 hasta) meydana gelmiştir (bkz. bölüm 4.4).
Sepsis
Diyalize girmeyen KBH hastalarında, sepsis roksadustat grubunun %2,1'inde (100 hasta maruziyet yılı başına olay yaşayan 1,3 hasta) ve plasebo grubunun %0,4'ünde (100 hasta maruziyet yılı başına olay yaşayan 0,3 hasta) meydana gelmiştir. Diyaliz hastalarında, sepsis roksadustat grubunun %3,4'ünde (100 hasta maruziyet yılı başına olay yaşayan 2 hasta) ve ESA grubunun %3,4'ünde (100 hasta maruziyet yılı başına olay yaşayan 1,8 hasta) gözlenmiştir (bkz. bölüm 4.4).
Deri reaksiyonları
Pazarlama sonrası sürveyans sırasında şiddetli kutanöz advers reaksiyonların (SCAR'lar) bir parçası olan jeneralize eksfolyatif dermatit bildirilmiştir ve roksadustat tedavisi ile bir ilişki göstermiştir (sıklık bilinmemektedir).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Sağlıklı gönüllülerde roksadustat 5 mg/kg'lık (510 mg'a kadar) tek supraterapötik dozlar, kalp hızında geçici bir artış, hafif ila orta şiddette kas-iskelet ağrısı sıklığında artış, baş ağrısı, sinüs taşikardisi ve daha az sıklıkla düşük kan basıncı ile ilişkili bulunmuştur ve bu bulguların hiçbiri ciddi seviyede olmamıştır. Roksadustat doz aşımı, Hb seviyelerini istenen seviyenin (10-12 g/dL) üzerine çıkarabilir; bu, roksadustat dozunun kesilmesi veya azaltılması (bkz. bölüm 4.2) ve dikkatli izlem ve klinik olarak gerekli görülen şekilde tedavi ile yönetilmelidir. Roksadustat ve metabolitleri hemodiyaliz ile anlamlı ölçüde uzaklaştırılmaz (bkz. bölüm 5.2).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: anti-anemik preparatlar, diğer anti-anemik preparatlar ATC kodu: B03XA05
Etki mekanizması
(EPO) seviyelerinin artmasını, demir taşıyıcı proteinlerin düzenlenmesini ve hepsidin
(KBH'de inflamasyon sırasında artan bir demir regülatör proteini) azaltılmasını kapsayan koordineli bir eritropoetik yanıtı uyarır. Bu uyarı, demir biyoyararlanımında iyileşmeye, Hb üretiminde artışa ve kırmızı hücre kütlesinde artışa neden olur.
Farmakodinamik etkiler
QTc ve kalp atış hızı üzerine etkileri
Sağlıklı gönüllülerde 2,75 mg/kg'lık tek terapötik dozda ve 5 mg/kg'lık (510 mg'a kadar) tek supraterapötik dozda roksadustat ile yapılan kapsamlı bir QT (TQT) çalışması, QTc aralığında bir uzama göstermemiştir. Aynı kapsamlı QT çalışması, 2,75 mg/kg doz için dozdan 8 ila 12 saat sonra, dakikada 9 ila 10 atıma kadar ve 5 mg/kg doz için dozdan 6 ila 12 saat sonra dakikada 15 ila 18 atıma kadar plasebo ile düzeltilmiş bir kalp atış hızı artışı göstermiştir.
Klinik etkililik ve güvenlilik
KBH ile anemide gelişim programı
Roksadustatın etkililiği ve güvenliliği, anemisi olan, diyalize bağımlı olmayan (NDD) ve diyalize bağımlı (DD) KBH hastalarında çok merkezli ve randomize 8 çalışmadan oluşan küresel olarak yürütülen bir faz 3 programında en az 52 hafta boyunca değerlendirilmiştir (bkz. Tablo 4).
Evre 3-5 KBH'li NDD hastalarında yapılan üç çalışma; çift kör ve plasebo kontrollü çalışmalardır (ALPS, 1517-CL-0608; ANDES, FGCL-4592-060; OLYMPUS, D5740C00001)
ve bir çalışma karşılaştırıcı olarak darbepoetin alfa kullanılarak yapılan açık etiketli ESA kontrollü çalışmadır (DOLOMITES, 1517-CL-0610). Tüm NDD çalışmaları ESA ile tedavi edilmemiş hastalarda etkililiği ve güvenliliği, Hb'yi 10 ila 12 g/dL hedef aralığında düzelterek ve daha sonra koruyarak (Hb düzeltme yaklaşımı) değerlendirmiştir.
Hemodiyaliz veya periton diyalizi alan hastalarda açık etiketli ESA kontrollü 4 DD çalışması (kontrol: epoetin alfa ve/veya darbepoetin alfa) aşağıdaki farklı durumlarda etkililiği ve güvenliliği değerlendirmiştir:
Hb düzeltmesi yaklaşımı (HIMALAYAS, FGCL-4592-063).
Hb'yi hedef aralıkta tutmak için hastaların bir ESA ile tedaviden geçiş yaptığı bir ESA'dan geçiş yaklaşımı (PYRENEES, 1517-CL-0613; SIERRAS, FGCL-4592-064).
veya Hb düzeltmesi ve ESA geçiş yaklaşımlarının kombinasyonu (ROCKIES,
D5740C00002).
NDD çalışmalarındaki hastalar evre 3 ila 5 KBH'ye sahiptir ve diyalize girmemişlerdir. Ortalama Hb seviyesinin ≤10,5 g/dL olmasına olanak sağlayan DOLOMITES çalışmasındaki (1517 CL 0610) hastalar hariç, tüm hastalarda randomizasyonda ortalama Hb seviyesi ≤10 g/dL'dir. Ferritin seviyelerinin ≥30 ng/mL (ALPS, 1517 CL 0608; ANDES, FGCL 4592 060),
≥50 ng/mL (OLYMPUS, D5740C00001) veya ≥100 ng/mL (DOLOMITES, 1517 CL 0610)
olması gerekmektedir. Randomizasyondan 6 hafta öncesine kadar ESA tedavisine olanak sağlayan çalışmadakiler (OLYMPUS, D5740C00001) hariç, hastalara randomizasyondan sonraki 12 hafta içinde herhangi bir ESA tedavisi uygulanmamıştır.
DD çalışmalarında hastaların diyalize giriyor olması gerekmektedir: 4 aydan uzun diyaliz olarak tanımlanan PYRENEES çalışmasındaki (1517 CL 0613) hastalar için stabil DD; ≥2 hafta ve ≤4 ay diyaliz olarak tanımlanan HIMALAYAS çalışmasındaki (FGCL 4592 063) hastalar için insidental (ID), DD. SIERRAS (FGCL-4592-064) ve ROCKIES çalışmalarına
(D5740C00002) hem stabil (yaklaşık %80 ila %90) hem de ID (yaklaşık %10 ila %20) DD
hastaları dahil edilmiştir. Tüm hastalarda ferritinin ≥100 ng/mL olması gerekmektedir.
Randomizasyondan önceki 12 hafta içinde herhangi bir ESA tedavisi almış olan hastalar
alınmadığı HIMALAYAS çalışmasındaki (FGCL 4592 063) hastalar hariç, tüm hastalara randomizasyondan en az 8 hafta önce intravenöz veya subkutan ESA uygulanması gerekmektedir.
Roksadustat ile tedavi için, bölüm 4.2'de tarif edildiği gibi dozaj talimat esasları izlenmiştir. Her bir çalışmanın demografileri ve tüm başlangıç özellikleri, roksadustat ve kontrol grupları arasında karşılaştırılabilir niteliktedir. Randomizasyondaki medyan yaş 55 â 69 yıl olup; hastaların %16,6 ila %31,1'i 65-74 yaş aralığında, %6,8 ila %35'i ise ≥75 yaşındadır. Kadın hastaların yüzdesi %40,5 ila %60,7 arasında değişmektedir. Çalışmalar arasında en yaygın olarak temsil edilen ırklar Beyaz, Siyahi veya Afrika kökenli Amerikan ve Asyalı olmuştur. En yaygın KBH etiyolojileri diyabetik ve hipertansif nefropatidir. Medyan Hb seviyeleri 8,6 ila 10,78 g/dL arasında değişmektedir. NDD hastalarının yaklaşık %50-60'ının ve DD hastalarının
%80-90'ının demir depoları başlangıçta doludur.
Yedi faz 3 çalışmadan elde edilen veriler, iki ayrı popülasyonda (üç NDD ve dört DD olmak üzere) havuzlanmıştır (bkz. Tablo 4).
Üç plasebo kontrollü NDD çalışması (roksadustatta 2.386 hasta, plaseboda 1.884 hasta) NDD havuzuna dahil edilmiştir. ESA kontrollü NDD DOLOMITES Faz 3 çalışması (1517-CL-0610; roksadustatta 323 hasta ve darbepoetin alfada 293 hasta) verileri, bu çalışma NDD popülasyonundaki tek açık etiketli, aktif kontrollü çalışma olduğundan, havuzlanmış NDD analizlerine dahil edilmemiştir.
Dört ESA kontrollü DD çalışması (roksadustatta 2.354 hasta, ESA'da [epoetin alfa ve/veya darbepoetin alfa] 2.360 hasta) DD havuzuna dahil edilmiştir. DD havuzunda, iki farklı tedavi durumunu yansıtmak için iki alt havuz kurulmuştur:
DD popülasyonunda 2 haftadan uzun ve 4 aydan kısa bir süre diyalize giren hastalara Hb düzeltmesi yaklaşımını yansıtan insidental (ID) DD hastaları (ID DD havuzu) adı verildi.
Bu dört aylık eşik değerinden sonra diyalize girmeye devam etmiş DD hastalarına, ESA geçiş yaklaşımını yansıtan stabil DD hastaları (Stabil DD havuzu) adı verildi.
Tablo 4: KBH anemisinde roksadustat faz 3 geliştirme programına genel bakış
NDD hastalarda yapılan çalışmalar | ||||
| Plasebo kontrollü çalışmalar (NDD havuzu) | ESA kontrollü (Darbepoetin alfa) | ||
Yaklaşım | Hb düzeltmesi | |||
Çalışma | ALPS (1517-CL- 0608) | ANDES (FGCL- 4592-060) | OLYMPUS (D5740C 00001) | DOLOMITES (1517-CL-0610) |
Randomizasyon (Roksadustat/karşılaştırma) | 594 (391/203) | 916 (611/305) | 2760 (1384/1376) | 616 (323/293) |
DD hastalarında yapılan çalışmalar | ||||
| ESA kontrollü çalışmalar (DD havuzu) (Epoetin alfa veya Darbepoetin alfa) | |||
Yaklaşım | ESA dönüşümü | Hb düzeltmesi | ESA dönüşümü ve Hb düzeltmesi | |
Çalışma | CL-0613) | (FGCL-45 92-064) | 063) | ROCKIES |
Randomizasyon (Roksadustat/karşılaştırma) | 834 (414/420) | 740 (370/370) | 1039 (522/517) | 2101 (1048/1053) |
DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; Hb: hemoglobin; NDD: diyalize bağımlı olmayan.
NDD KHB hastaları
Etkililik sonuçları
Tedavi sırasında Hb seyri
Klinik çalışmalarda roksadustat, diyalize girmeyen KBH anemisi olan hastalarda hedef Hb
seviyelerini (10-12 g/dL) elde etmede ve sürdürmede etkili olmuştur (bkz. Şekil 1).
Şekil 1: 52. haftaya kadar geçen süre boyunca ortalama (SE) Hb (g/dL) (FAS); NDD
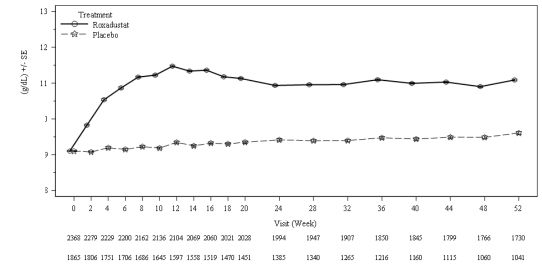
Roksadustat
Plasebo
havuzu (Hb düzeltmesi)
FAS: tam analiz seti; Hb: hemoglobin; NDD: diyalize bağımlı olmayan; SE: standart hata.
NDD KHB hastalarında başlıca Hb etkililiği sonlanım noktaları
Hb düzeltmesi için anemi tedavisine ihtiyaç duyan NDD hastalarında, ilk 24 hafta boyunca Hb yanıtı elde eden hastaların oranı, plasebo (%8,7) ile karşılaştırıldığında roksadustat grubunda (%80,2) daha yüksek olmuştur. Başlangıçtan 28 ila 36. haftaya kadar Hb seviyelerinde plaseboya (0,14 g/dL) kıyasla roksadustat grubunda (1,91 g/dL) istatistiksel olarak anlamlı bir artış olmuştur ve %95 güven aralığının alt limiti 1'in üzerindedir. NDD çalışmalarında, medyan 4,1 hafta süre ile Hb'de en az 1 g/dL artış sağlanmıştır (bkz. Tablo 5).
Açık-etiketli ESA kontrollü NDD DOLOMITES (1517-CL-0610) çalışmasında, ilk 24 hafta içinde Hb yanıtına ulaşan hastaların oranı, darbepoetin alfa (%78) ile karşılaştırıldığında roksadustat grubunda (%89,5) non-inferior olmuştur (bkz. Tablo 5).
Popülasyon | NDD KHB hastaları | |||
Yaklaşım | Hb düzeltmesi | Hb düzeltmesi | ||
Sonlanım noktası/ Parametre | NDD havuzu (FAS) | DOLOMITES (PPS) 1517-CL-0610 | ||
n= 2368 | n= 1865 | n= 286 | alfa | |
Tablo 5: Önemli Hb etkililiği sonlanım noktaları (NDD)
Hb yanıtı elde eden hastaların oranı | ||||
Yanıt verenler, n (%) [%95 GA] | 1.899 (80,2) [78,5; 81,8] | 163 (8,7) [7,5; 10,1] | 256 (89,5) [85,4; 92,8] | 213 (78) [72,6; 82,8] |
Oranların farkı [%95 GA] | 71,5 [69,4;, 73,51] | 11,51 [5,66; 17,36] | ||
Olasılık oranı [%95 GA] | 40,49 [33,01; 49,67] | 2,48 [1,53; 4,04] | ||
P değeri | <0,0001 | ND | ||
Hb'de başlangıçtan itibaren değişim (g/dL) | ||||
Ortalama (SD) başlangıç | 9,1 (0,74) | 9,1 (0,73) | 9,55 (0,76) | 9,54 (0,69) |
Ortalama (SD) CFB | 1,85 (1,07) | 0,17 (1,08) | 1,85 (1,08) | 1,84 (0,97) |
LS ortalaması | 1,91 | 0,14 | 1,85 | 1,84 |
LS ortalaması farkı [%95 GA] | 1,77 [1,69; 1,84] | 0,02 [-0,13; 0,16] | ||
P değeri | <0,0001 | 0,844 | ||
CFB: başlangıçtan itibaren değişim; GA: güven aralığı; KBH: kronik böbrek hastalığı; FAS: tam analiz seti; Hb: hemoglobin; LS: en küçük kare; ND: yapılmadı; NDD: diyalize bağımlı olmayan; PPS: her bir protokol seti; SD: standart sapma.
DD KHB hastaları
Tedavi boyunca Hb seyri
Klinik çalışmalarda, roksadustat, önceki ESA tedavisinden bağımsız olarak, diyalize giren KBH hastalarında hedef Hb seviyelerine (10-12 g/dL) ulaşılması ve sürdürülmesinde etkili olmuştur (bkz. Şekil 2 ve 3).
Şekil 2: 52. haftaya kadar ortalama (SE) Hb (FAS); ID DD alt havuzu (Hb düzeltmesi)


![]()
Roxadustat
Active Control
![]()
|
| ||||||||||||||||||
| |||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
DD: diyalize bağımlı; FAS: tam analiz seti; Hb: hemoglobin; ID: insidental diyaliz; SE: standart hata.
5
![]()
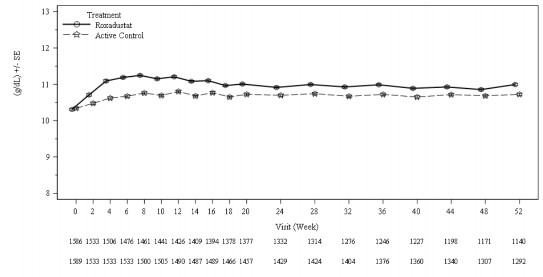
Roksadustat
Aktif kontrol
Şekil 3: 52. haftaya kadar geçen süre boyunca ortalama (SE) Hb (g/dL) (FAS); stabil DD alt havuz (ESA geçişli)
DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; Hb: hemoglobin; SE: standart
hata
DD KHB hastalarında önemli Hb etkililik sonlanım noktaları
Hb düzeltmesi için anemi tedavisine ihtiyaç duyan ve ESA tedavisinden geçiş yapan DD hastalarında, roksadustat grubunda Hb'de başlangıçtan 28. ila 36. haftaya kadar bir artış olmuştur, bu artış ESA grubunda gözlemlenenle benzerdir ve -0,75 g/dL'lik önceden belirlenmiş non-inferiorite marjının üzerinde olmuştur. İlk 24 hafta boyunca Hb yanıtı elde eden hastaların oranı roksadustat ve ESA gruplarında benzerdir (bkz. Tablo 6).
Popülasyon | DD hastaları | |||
Yaklaşım | Hb Düzeltmesi | ESA Geçişi | ||
Sonlanım noktası/ Parametre | ID DD havuzu (FAS/PPS) | Stabil DD havuzu (PPS) | ||
Roksadustat n = 756 | ESA n = 759 | Roksadustat n = 1379 | ESA n = 1417 | |
Hb'de başlangıçtan itibaren değişim(g/dL) | ||||
Ortalama (SD) başlangıç | 8,77 (1,2) | 8,82 (1,2) | 10,32 (0,99) | 10,37 (0,99) |
Ortalama (SD) CFB | 2,37 (1,57) | 2,12 (1,46) | 0,65 (1,15) | 0,36 (1,23) |
LS ortalaması | 2,17 | 1,89 | 0,58 | 0,28 |
LS ortalaması farkı [%95 GA] | 0,28 [0,11; 0,451] | 0,3 [0,228; 0,373] | ||
P değeri | 0,0013 | <0,0001 | ||
Hb yanıtı elde eden hastaların oranı | ||||
Yanıt verenler, n (%) [%95 GA] | 453 (59,9) [56,3; 63,4] | 452 (59,6) [56; 63,1] | 978 (70,9) [68,4; 73,3] | 959 (67,7) [65,2; 70,1] |
Oranların farkı [%95 GA] | 0,3 | 2,7 [-0,7; 6] | ||
Olasılıkornı [%95GA] | ||||
P değeri | ND | ND | ||
Tablo 6: Önemli Hb etkililik sonlanım noktaları (DD)
Popülasyon | NDD KHB hastaları | |||
Müdahale | Düzeltme | Düzeltme | ||
Sonlanım noktası/Parametre | NDD havuzu (FAS) | DOLOMITES (1517-CL- 0610) | ||
Roksadustat n=2368 | Plasebo n= 1865 | Roksadustat n=322 | Darbepoetin alfa n= 292 | |
Kurtarma tedavisi alan hastaların sayısı, n (%) | 211 (8,9) | 580 (31,1) |
ND | |
RBC | 118 (5) | 240 (12,9) | ||
IV demir | 50 (2,1) | 90 (4,8) | ||
ESA | 48 (2) | 257 (13,8) | ||
IR | 10,4 | 41 | ||
Tehlike oranı | 0,19 |
ND | ||
%95 GA | 0,16; 0,23 | |||
P değeri | <0,0001 | |||
IV demir alan hastaların sayısı, n (%) |
ND | 20 (6,2) | 37 (12,7) | |
IR | 9,9 | 21,2 | ||
Tehlike oranı | 0,45 | |||
%95 GA | 0,26; 0,78 | |||
P değeri | 0,004 | |||
LDL kolesterolde başlangıçtan 12-28.haftaya kadar olan değişim (mmol/L) | ||||
ANCOVA kullanılarak analiz | ||||
Ortalama LS | -0,446 | 0,066 | -0,356 | 0,047 |
%95 GA | 0,484; -0,409 | 0,017; 0,116 | -0,432; -0,28 | -0,033; 0,127 |
-0,513 | -0,403 | |||
%95 GA | -0,573; -0,453 | :https://www.turkiye.gov.tr/saglik-titck-ebys -0,51; -0,296 | ||
P değeri | <0,0001 | <0,001 | ||
CFB: başlangıçtan itibaren değişim; GA: güven aralığı; KBH: kronik böbrek hastalığı; DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; Hb: hemoglobin; ID: insidental diyaliz; LS: en küçük kare; ND: yapılmadı; PPS: her bir protokol seti; SD: standart sapma.
almadan 28 ila 36. haftada 10 ila 12 g/dL'lik hedef aralığındadır.
Kurtarma tedavisi, RBC transfüzyonu ve intravenöz demir
Roksadustat ile tedavinin kurtarma tedavisi, RBC transfüzyonu ve intravenöz demir kullanımı üzerindeki etkileri Tablo 7 (NDD) ve Tablo 8'de (DD) sunulmaktadır. Klinik çalışmalarda, transferrrin satürasyonu sabitken, roksadustat, hepsidini (demir metabolizmasının regülatörü), ferritini azaltmış, serum demirini arttırmıştır, tüm bu değerler zaman içinde demir durumunun indikatörleri olarak değerlendirilmiştir.
Düşük dansiteli lipoprotein (LDL) kolesterol
Roksadustat tedavisinin LDL kolesterol üzerindeki etkileri Tablo 7 ve Tablo 8'de sunulmaktadır. Roksadustat ile tedavi edilen hastalarda plasebo veya ESA ile tedavi edilen hastalara kıyasla ortalama LDL ve yüksek dansite lipoprotein (HDL) kolesterol seviyelerinde azalma olmuştur. LDL kolesterol üzerindeki etki daha belirgindir, bu da LDL/HDL oranının azalmasına yol açmıştır ve statin kullanımına bakılmaksızın gözlemlenmiştir.
Tablo 7: Diğer etkililik sonlanım noktaları: kurtarma tedavisinin kullanımı, aylık intravenöz demir kullanımı ve LDL kolesterolde başlangıçtan itibaren değişim (NDD)
NDD havuzu için sunulan P değerleri nominal p değerleridir.
ANCOVA: kovaryans analizi; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; GA: güven aralığı; IR: insidans oranı (risk altındaki 100 hasta yılı başına); IV: intravenöz; LDL: düşük yoğunluklu lipoprotein; LS: en küçük kare; ND: yapılmadı; NDD: diyalize bağımlı olmayan; R: roksadustat; RBC: kırmızı kan hücresi.
hafta boyunca değerlendirilmiştir.
Tablo 8: Diğer etkililik sonlanım noktaları: kurtarma tedavisinin kullanımı, aylık intravenöz demir kullanımı ve LDL kolesterolde başlangıçtan itibaren değişim (DD)
Popülasyon | DD KBH hastaları | |||
Müdahale | Düzeltme | Düzeltme | ||
Sonlanım noktası/Parametre | ID DD havuzu (FAS) | Stabil DD havuzu (FAS) | ||
Roksadustat n=756 | ESA n= 759 | Roksadustat n=1586 | ESA n= 1589 | |
28 â 52 hafta boyunca ortalama aylık IV demir (mg) | ||||
N | 606 | 621 | 1414 | 1486 |
Ortalama (SD) | 53,57 (143,097) | 70,22 (173,33) | 42,45 (229,8) | 61,99 (148,02) |
LDL kolesterolde başlangıçtan 12-28.haftaya kadar olan değişim (mmol/L) | ||||
ANCOVA kullanılarak analiz | ||||
Ortalama LS | -0,61 | -0,157 | -0,408 | -0,035 |
%95 GA | -0,7; -0,52 | -0,245; -0,069 | -0,449; -0,368 | -0,074; 0,003 |
Ortalama LS farkı (R- karşılaştırıcı) | -0,453 | -0,373 | ||
%95 GA | -0,575; -0,331 | -0,418; -0,328 | ||
P değeri | <0,0001 | <0,0001 | ||
ID DD ve stabil DD havuzları için sunulan P değerleri nominal p değerleridir.
ANCOVA: kovaryans analizi; DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; GA: güven aralığı; ID: insidental diyaliz; IV: intravenöz; KHB: kronik böbrek hastalığı; LDL: düşük yoğunluklu lipoprotein; LS: en küçük kare
SIERRAS (FGCL-4592-064) diyaliz çalışmasında, EPO-alfa grubuna kıyasla roksadustat grubunda tedavi sırasında hastaların anlamlı derecede daha düşük bir oranına kırmızı kan hücresi transfüzyonu uygulanmıştır (%21,1'e karşı %12,5); ROCKIES (D5740C00002) çalışmasında sayısal azalma istatistiksel olarak anlamlı değildir (%13,2'ye karşı %9,8).
Diyalizde olmayan hastanın bildirdiği sonuçlar
DOLOMITES (1517-CL-0610) çalışmasında, SF-36 PF ve SF-36 VT ile ilgili olarak
roksadustatın darbepoetine non-inferior olduğu belirlenmiştir.
Diyaliz alan hastanın bildirdiği sonuçlar
PYRENEES (1517-CL-0613) çalışmasında, başlangıçtan 12 â 28.haftaya kadar SF-36 PF ve SF-36 VT değişiklikleri ile ilgili olarak, roksadustatın ESA'lara non-inferior olduğu belirlenmiştir.
![]()
Klinik güvenlilik
5
Havuzlanmış, hükümlendirilmiş kardiyovasküler olayların meta-analizi
Faz 3 çalışma programından hükümlendirilmiş majör advers kardiyovasküler olayların (MACE; tüm nedenlere bağlı mortalite [ACM], miyokard infarktüsü, inmeden oluşan bileşik) ve MACE+'nin (tüm nedenlere bağlı mortalite [ACM], miyokard infarktüsü, inme ve hastaneye yatmayı gerektiren stabil olmayan anjinadan oluşan bileşik) meta analizi 8984 hastada gerçekleştirilmiştir.
MACE, MACE+ ve ACM sonuçları, havuzlanmış tehlike oranı (HR) ve bunun %95 güven aralığı (GA) kullanılarak üç veri seti için sunulmaktadır. Üç veri seti şunları içermektedir:
NDD hastalarında havuzlanmış bir plasebo kontrollü Hb düzeltmesi veri seti [OLYMPUS
(D5740C00001), ANDES (FGCL-4592-060) ve ALPS (1517-CL-0608) çalışmalarına dahil
edilen hastaları içerir; bkz. Tablo 4]
NDD ve ID-DD hastalarında havuzlanmış bir ESA kontrollü Hb düzeltmesi veri seti
[DOLOMITES (1517-CL-0610), HIMALAYAS (FGCL-4592-063) çalışmalarına dahil
edilen hastaları ve SIERRAS (FGCL-4592-064) ve ROCKIES (D5740C00002);
çalışmalarının ID-DD hastalarını içerir; bkz. Tablo 4]
Stabil DD hastalarında havuzlanmış bir ESA kontrollü ESA geçişli veri seti [PYRENEES
(1517-CL-0613) çalışmasındaki ve ROCKIES (D5740C00002) ve SIERRAS (FGCL-4592-
064) çalışmalarının Stabil DD hastalarını içerir; bkz. Tablo 4]
Diyalize bağımlı olmayan KHB hastalarında plasebo-kontrollü Hb düzeltme setinde MACE,
MACE+ ve ACM
NDD hastalarında, tedavi esnasındaki analizlerin, MACE, MACE+ ve ACM analizi, çalışma tedavisi başlangıcından tedavi takibinin bitişinin itibaren 28. güne kadar olan tüm verileri içermiştir. Tedavi sırasındaki analizlerde, sansürleme olasılığı için ters ağırlıklı bir Cox modeli kullanılmıştır (IPCW yöntemi); bu model, özellikle başlangıçta ve zamanla tahmini glomerüler filtrasyon hızı (eGFR) tayinleri ve Hb dahil olmak üzere, risk artışlarına ve tedavinin erken sonlandırılmasına katkı sağlayanlar dahil, roksadustat ve plasebo arasındaki takip süresi farklılıklarını düzeltmeyi amaçlar. Bu modelde herhangi bir çelişki kalıp kalmadığı belirsizliğini korumaktadır. Tedavi sırasındaki analizler için HR'ler 1,26; 1,17 ve 1,16'dır (bkz. Tablo 9). ITT (tedaviye niyetlenilen) analizleri, çalışma tedavisinin başlangıcından tedavi sonrası güvenlilik takibinin sonuna kadar tüm verileri içermiştir. ITT analizi, tedavi sırasındaki analizde plasebo lehine risk dağılımındaki dengesizliği göstermek için dahil edilmiştir, fakat ITT analizleri genellikle çalışma ilacı tedavisi etkisinde bir seyrelme gösterir ve bu ITT analizlerindeki bias, özellikle çalışma tedavisinin sonlandırılmasından sonra ESA kurtarma tedavisi uygulandığı için, tamamen hariç tutulamaz. HR'ler sırasıyla 1,1; 1,07 ve 1,08 %95 GA üst limitleri de sırasıyla 1,27; 1,21 ve 1,26 olmuştur.
| MACE | MACE+ | ACM | |||
Roksadustat n= 2386 | Plasebo n = 1884 | Roksadustat n= 2386 | Plasebo n = 1884 | Roksadustat n= 2386 | Plasebo n = 1884 | |
Tedavi esnasında | ||||||
Olay yaşayan hasta sayısı (%) | 344 (14,4) | 166 (8,8) | 448 (18,8) | 242 (12,8) | 260 (10,9) | 122 (6,5) |
FAIR | 8,7 | 6,8 | 11,6 | 10,1 | 6,4 | 5 |
HR (%95 GA) | 1,26 (1,02; 1,55) | 1,17 (0,99; 1,4) | 1,16 (0,9; 1,5) | |||
ITT | ||||||
Olay yaşayan hastasayısı(%) | 480 | (24,2) | 400 | 301 | ||
FAIR | 10,6 | 10,3 | 13,2 | 13,2 | 8,3 | 8,1 |
Tablo 9: NDD havuzunda plasebo-kontrollü Hb düzeltmesinde KV güvenlilik ve mortalite
HR (%95 GA) | 1,1 (0,96; 1,27) | 1,07 (0,94; 1,21) | 1,08 (0,93; 1,26) |
| MACE | MACE+ | ACM | |||
n= 1594 | n= 1594 | n= 1594 | n= 1594 | n= 1594 | n= 1594 | |
Tedavi esnasında | ||||||
ACM: tüm nedenlere bağlı mortalite; ACM, MACE/MACE+'nın bir bileşenidir. GA: güven aralığı; FAIR: takip ayarlı insidans oranı (olay yaşayan hasta sayısı/100 hasta yılı); HR: tehlike oranı; ITT: tedaviye niyetlenilen; MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan miyokard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği için hastaneye yatış dahil olmak üzere majör advers kardiyovasküler olay.
Diyalize bağımlı olmayan ve diyalize bağımlı KBH hastalarından oluşan ESA kontrollü Hb düzeltme setindeki MACE, MACE+ ve ACM
NDD ve ID-DD hastalarının Hb düzeltme setinde, başlangıç özellikleri ve tedaviyi bırakma oranları, havuzlanmış roksadustat ve havuzlanmış ESA hastaları arasında karşılaştırılabilir olmuştur. Tedavide gözlemlenen MACE, MACE+ ve ACM analizi, sırasıyla 1;02, 0,98 ve 1,05'lik %95 GA üst limiti ile 0,79; 0,78 ve 0,78 HR değerleri sunmuştur (bkz. Tablo 10). Tedavi sırasındaki analizler, Hb düzeltmesi gerektiren KBH hastalarında ESA ile karşılaştırıldığında roksadustat ile kardiyovasküler güvenlilik veya mortalite riskinde artışa ilişkin hiçbir kanıtı desteklememektedir.
Tablo 10: ESA-kontrollü Hb düzeltme havuzunda KV güvenlilik ve mortalite
| MACE | MACE+ | ACM | |||
Roksadustat N = 1083 | ESA N = 1059 | Roksadustat N = 1083 | ESA N = 1059 | Roksadustat N= 1083 | ESA N= 1059 | |
Tedavi esnasında |
|
| ||||
Olay |
|
|
|
|
|
|
yaşayan | 105 | 136 | 134 | 171 | 74 | 99 |
hasta sayısı | (9,7) | (12,8) | (12,4) | (16,1) | (6,8) | (9,3) |
(%) |
|
|
|
|
|
|
IR | 6,5 | 8,2 | 8,3 | 10,3 | 4,6 | 6 |
HR (%95 GA) | 0,79 (0,61; 1,02) | 0,78 (0,62; 0,98) | 0,78 (0,57; 1,05) | |||
ACM: tüm nedenlere bağlı mortalite; ACM, MACE/MACE+'nın bir bileşenidir. ESA: eritropoez uyarıcı ajan; GA: güven aralığı; HR: tehlike oranı; IR: insidans oranı (olay yaşayan hasta sayısı/100 hasta yılı); MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan miyokard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği nedeniyle hastaneye yatışlar dahil majör advers kardiyovasküler olay.
Stabil Diyalize bağımlı KBH hastalarında ESA kontrollü ESA geçiş setinde MACE ve MACE+
ve ACM
ESA'dan geçiş yapan stabil DD hastalarında, tedavi sırasında gözlemlenen MACE, MACE+ ve ACM için analiz sonuçları, sırasıyla 1,38; 1,19 ve 1,49 %95 GA üst sınırlarıyla 1,18; 1,03 ve 1,23 HR değerleri sunmuştur (bkz. Tablo 11). Roksadustat tedavisine randomize edilen hastaların çalışmanın başlangıcında ESA'dan geçiş yapmış olmaları ve stabilize Hb değerleri ile tedavide devam etmeye kıyasla herhangi bir yeni tedaviye geçmenin kendi içinde risk etkisi barındırması nedeniyle, gözlemlenen sonuçlar karmaşıklaşabilir; dolayısıyla tedavi etkisi tahminlerinin herhangi bir karşılaştırmasının güvenilir bir şekilde ortaya konması mümkün olmayacağından, Tablo 11'deki sonuçlar dikkatli bir şekilde yorumlanmalıdır.
Tablo 11: ESA-kontrollü ESA geçişi stabil DD havuzunda KV güvenlilik ve mortalite
Olay yaşayan hastaların sayısı (%) | 297 (18,6) | 301 (18,9) | 357 (22,4) | 403 (25,3) |
212 (13,3) |
207 (13) |
IR | 10,4 | 9,2 | 12,5 | 12,3 | 7,4 | 6,3 |
HR (%95 GA) | 1,18 (1; 1,38) | 1,03 (0,9; 1,19) | 1,23 (1,02; 1,49) | |||
ACM: tüm nedenlere bağlı ölüm; ACM, MACE/MACE+ bileşenidir. GA: güven aralığı; ESA: eritropoiez uyarıcı ajan; HR: tehlike oranı; IR: insidans oranı (100 hasta yılında olay yaşayan hastaların sayısı); MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan mikoyard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği için hastaneye yatışlar dahil, majör advers kardiyovasküler olay
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Maksimum plazma konsantrasyonları (C) genellikle açlık durumunda dozdan 2 saat sonra elde edilir. Roksadustatın yiyecekle uygulanması, açlık durumuna kıyasla C'ı %25 düşürmüştür, ancak EAA'yı değiştirmemiştir. Bu nedenle, roksadustat yiyecekle veya yiyecek olmadan alınabilir (bkz. bölüm 4.2).
Dağılım:
Roksadustat, ağırlıklı olarak albümin olmak üzere insan plazma proteinlerine yüksek oranda (yaklaşık %99) bağlanır. Roksadustatın kan-plazma oranı 0,6'dır. Kararlı durumda görünür dağılım hacmi 24 L'dir.
Biyotransformasyon:
İn vitro verilere dayanarak, roksadustat CYP2C8 ve UGT1A9 enzimlerinin yanı sıra BCRP, OATP1B1, OAT1 ve OAT3'ün bir substratıdır. Roksadustat OATP1B3 veya P-gp'nin bir substratı değildir. Roksadustat öncelikle hidroksi-roksadustat ve roksadustat-O-glukuronide metabolize edilir.
İnsan plazmasındaki ana dolaşım bileşeni değişmemiş roksadustattır, insan plazmasında hiçbir saptanabilir metabolit, toplam ilaca bağlı materyal maruziyetinin %10'undan fazlasını oluşturmamıştır ve insana özgü metabolitler gözlemlenmemiştir.
Eliminasyon:
Roksadustatın ortalama etkili yarılanma ömrü (t), KBH hastalarında yaklaşık 15 saattir. Roksadustatın görünür toplam vücut klirensi (CL/F) diyalizde olmayan KBH hastalarında 1,1 L/s ve diyalizdeki KBH hastalarında 1,4 L/s'dir. Roksadustat ve metabolitleri hemodiyaliz ile önemli ölçüde uzaklaştırılmamaktadır.
Atılım:
Radyoaktif işaretli roksadustat sağlıklı gönüllülerde oral yoldan uygulandığında, radyoaktivitenin ortalama geri kazanımı %96 (dışkıda %50, idrarda %46) idi. Dışkıda, dozun
%28'i değişmemiş roksadustat olarak atılmıştır. Dozun %2'sinden azı değişmemiş roksadustat olarak idrarda geri kazanılmıştır.
Doğrusallık/doğrusal olmayandurum:
[EAA] ve maksimum plazma konsantrasyonları (C)) önerilen terapötik doz aralığında doz
orantılıdır. Haftada üç kez dozlama rejiminde kararlı durum roksadustat plazma konsantrasyonları, minimum birikim ile bir haftada (3 doz) elde edilir. Roksadustatın farmakokinetiği zamanla değişmemektedir.
Hastalardaki karakteristik özellikler
Yaş, cinsiyet, vücut ağırlığı ve ırk etkileri:
KBH'ye bağlı anemisi olan yetişkin hastalarda yaş (≥18), cinsiyet, ırk, vücut ağırlığı, böbrek fonksiyonu (eGFR) veya diyaliz durumuna bağlı olarak roksadustat farmakokinetiğinde klinik olarak anlamlı bir fark gözlemlenmemiştir.
Hemodiyaliz:
Diyalize bağımlı KBH'li hastalarda, roksadustat hemodiyalizden 2 saat önce veya 1 saat sonra uygulandığında farmakokinetik parametre değerlerinde belirgin bir fark gözlemlenmemiştir. Diyaliz, genel olarak önemsiz bir roksadustat klirens yoludur.
Karaciğer Yetmezliği
Tek bir 100 mg roksadustat dozunu takiben, normal karaciğer ve böbrek fonksiyonları olan gönüllülere kıyasla orta derecede karaciğer yetmezliği (Child-Pugh Sınıf B) ve normal böbrek fonksiyonu olan gönüllülerde ortalama roksadustat EAA değeri %23 daha yüksek ve ortalama C%16 daha düşüktür. Orta derecede karaciğer yetmezliği (Child-Pugh Sınıf B) ve normal böbrek fonksiyonu olan gönüllüler, sağlıklı gönüllülere kıyasla bağlanmamış roksadustat EAA'da (+%70) bir artış göstermiştir.
Şiddetli karaciğer yetmezliği (Child-Pugh Sınıf C) olan hastalarda roksadustatın farmakokinetiği araştırılmamıştır.
Farmakokinetik/farmakodinamik ilişki(ler)
İlaç etkileşimleri
İn vitro verilere dayanarak, roksadustat, CYP2C8, BCRP, OATP1B1 ve OAT3'ün bir inhibitörüdür (bkz. bölüm 4.5). Rosiglitazon (orta derecede duyarlı CYP2C8 substratı) farmakokinetiği, roksadustat ile birlikte uygulamadan etkilenmemiştir. Roksadustat, intestinal UGT1A1 inhibitörü olabilir, fakat hepatik UGT1A1 inhibitörü değildir ve klinik olarak geçerli konsantrasyonlarda diğer CYP metabolize edici enzimlerin veya taşıyıcıların inhibisyonunu veya CYP enzimlerinin indüksiyonunu göstermemiştir. Oral adsorptif kömür veya omeprazolün roksadustat farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur. Klopidogrel, KBH'si olan hastalarda roksadustat maruziyeti üzerinde herhangi bir etkiye sahip değildir.
Diğer tıbbi ürünlerin roksadustat üzerindeki etkileri
Sağlıklı gönüllülerde gemfibrozil (CYP2C8 ve OATP1B1 inhibitörü) veya probenesid (UGT ve OAT inhibitörü) ile birlikte uygulama, roksadustat EAA'sını 2,3 kat ve C'ı 1,4 kat artırmıştır (bkz. bölüm 4.5).
Sağlıklı deneklerde roksadustatın fosfat bağlayıcılar sevelamer karbonat veya kalsiyum asetat ile birlikte uygulanması, roksadustat EAA'sını sırasıyla %67 ve %46 ve C'ı sırasıyla %66 ve %52 oranında azaltmıştır. Roksadustat, fosfat bağlayıcılar veya kalsiyum, demir, magnezyum veya alüminyum içeren diğer ürünler gibi çok değerlikli katyonlarla bir şelat oluşturabilir. Fosfat bağlayıcıların aşamalı olarak uygulanması (en az 1 saat arayla), sağlıklı gönüllülerde ve KBH'li hastalardabirpopülasyon farmakokinetik analizine dayalı olarak,
roksadustat maruziyeti üzerinde klinik olarak anlamlı bir etkiye sahip değildir.
Sağlıklı gönüllülerde yürütülen ilaç etkileşimi çalışmaları, lantanyum karbonat, oral adsorptif kömür veya omeprazolün roksadustat farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir. KBH'li hastalarda popülasyon farmakokinetik analizi, klopidogrelin roksadustat maruziyeti üzerinde hiçbir etkisi olmadığını göstermiştir.
Roksadustatın diğer tıbbi ürünler üzerindeki etkileri
Sağlıklı gönüllülerde roksadustatın simvastatin ile birlikte uygulanması simvastatinin EAA ve Cdeğerlerini sırasıyla 1,8 ve 1,9 kat ve simvastatin asidin (simvastatinin aktif metaboliti) EAA ve Cdeğerlerini sırasıyla 1,9 ve 2,8 kat artırmıştır. Roksadustattan 2 saat önce veya 4 veya 10 saat sonra simvastatin uygulandığında da simvastatin ve simvastatin asit konsantrasyonları artmıştır. Roksadustatın rosuvastatin ile birlikte uygulanması, rosuvastatinin EAA ve Cdeğerlerini sırasıyla 2,9 ve 4,5 kat artırmıştır. Roksadustatın atorvastatin ile birlikte uygulanması, atorvastatinin EAA ve Cdeğerlerini sırasıyla 2ve 1,3 kat artırmıştır.
Roksadustat, diğer statinlerin maruziyetini de artırabilir (bkz. bölüm 4.5).
Bupropion, rosiglitazon ve S-varfarinin (sırasıyla CYP2B6, CYP2C8 ve CYP2C9 için prob substratları) farmakokinetiği roksadustat ile birlikte uygulamadan etkilenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlı doz toksisite çalışmaları
Sprague-Dawley veya Fisher sıçanlarında yapılan 26 haftalık aralıklı tekrarlı doz çalışmasında, Maksimum Tavsiye Edilen İnsan Dozunda (MRHD) toplam EAA'nın yaklaşık 4-6 katı olan dozda roksadustat, aort ve atriyoventriküler kapakçık (A-V) valvülopatileri dahil olmak üzere histopatolojik bulgularla sonuçlanmıştır. Bu bulgular, sonlandırma sırasında hayatta kalan hayvanlarda ve aynı zamanda ölmek üzere olduğu için hayatı erken sonlandırılan hayvanlarda görülmüştür. Ayrıca, 30 günlük bir iyileşme döneminin sonundaki hayvanlarda da mevcut olduğu için, bulgular tamamen geri dönüşümlü olmamıştır.
Sağlıklı hayvanlarda tekrarlı doz toksisite çalışmalarında, aşırı eritropoez ile sonuçlanan aşırı farmakoloji gözlemlenmiştir.
Sıçanlarda, MRHD'deki toplam EAA'nın yaklaşık 2 katında, dolaşımdaki trombositlerde azalmaların yanı sıra, aktif haldeki kısmi tromboplastin zamanı ve protrombin zamanında artışlar gibi hematolojik değişiklikler gözlenmiştir. Kemik iliğinde (sıçanlarda MRHD'de toplam EAA'nın yaklaşık 7 katı sistemik maruziyet), böbreklerde (sıçanlarda MRHD'de toplam EAA'nın yaklaşık 5 ila 6 katı sistemik maruziyet), akciğerlerde (sıçanlarda ve Cynomolgus maymunlarda MRH'de toplam EAA'nın sırasıyla 8 ve 2 katı sistemik maruziyet) ve kalpte (sıçanlarda MRHD'de toplam EAA'nın yaklaşık 4 ila 6 katı sistemik maruziyet) pıhtılar gözlenmiştir.
Beyin güvenliliği
Sprague-Dawley sıçanlarında gerçekleştirilen 26-haftalık aralıklı tekrar doz çalışmasında, MRHD'de toplam EAA'nın yaklaşık 6 katında bir hayvanda beyin nekrozu ve glioz histolojik bulgusu görülmüştür. Aynı süre boyunca tedavi edilen Fisher sıçanlarında, MRHD toplam EAA'nın yaklaşık 3 â 5 katında toplam dört hayvanda beyin/hipokampal nekroz gözlenmiştir.
22 veya 52 hafta süreyle aralıklı olarak roksadustat uygulanan Cynomolgus maymunları, MRHD'de toplam EAA'nın yaklaşık 2 katına kadar sistemik maruziyetlerde benzer bulgular göstermemiştir.
Karsinojenisite ve mutajenisite
Roksadustat, insan eşdeğer dozuna dayanarak MRHD'nin 40 katında farelerde in vitro Ames mutajenisite testinde, insan periferik kan lenfositlerinde in vitro kromozom anomalisi testinde ve in vivo mikronükleus testinde negatif olmuştur.
Fare ve sıçan karsinojenisite çalışmalarında, hayvanlara haftada üç defa klinik doz rejimi ile roksadustat uygulanmıştır. Roksadustatın kemirgenlerde hızlı klirensi nedeniyle, dozlama periyodu boyunca sistemik maruziyetler kesintisiz olmamıştır. Bu nedenle, olası hedef dışı karsinojenik etkiler göz ardı edilmiş olabilir.
2 yıllık fare karsinojenisite çalışmasında, düşük ve yüksek doz gruplarında (sistemik maruziyetler MRHD'de toplam EAA'nın yaklaşık 1 katı ve yaklaşık 3 katı) akciğer bronkoalveolar karsinoma insidansında anlamlı artışlar kaydedilmiştir. Yüksek doz grubundaki dişilerde (sistemik maruziyetler MRHD'de toplam EAA'nın yaklaşık 3 katı) subkutis fibrosarkomunda anlamlı bir artış görülmüştür.
2 yıllık sıçan karsinojenisite çalışmasında, orta doz seviyesinde (sistemik maruziyet MRHD'de toplam EAA'nın 1 katından daha az) meme bezi adenomu insidansında anlamlı bir artış gözlenmiştir. Bununla birlikte, bulgu doza bağlı değildir ve bu tümör tipinin insidansı test edilen en yüksek doz seviyesinde (sistemik maruziyet MRHD'de toplam EAA'nın yaklaşık 2 katı) daha düşük olmuştur ve bu nedenle bahsi geçen test ilacı ile ilgili olarak değerlendirilmemiştir.
Fare ve sıçan karsinojenisite çalışmalarından elde edilen benzer bulgular klinik çalışmalarda gözlenmemiştir.
Üreme ve gelişimsel toksisite
Roksadustatın tedavi edilen erkek veya dişi sıçanlarda MRHD'deki insan maruziyetinin yaklaşık 4 katında çiftleşme veya fertilite üzerinde hiçbir etkisi olmamıştır. Bununla birlikte, erkek sıçanlarda NOAEL'de, erkek fertilitesi üzerinde herhangi bir etki olmaksızın epididimis ve seminal veziküllerin (sıvı dolu) ağırlıklarında azalmalar olmuştur. Erkek üreme organı ile ilgili herhangi bir bulgu için NOEL MRHD'nin 1,6 katı olmuştur. Dişi sıçanlarda bu doz seviyesinde, kontrol hayvanlarına kıyasla cansız embriyoların sayısında ve implantasyon sonrası kayıplarda artış olmuştur.
Sıçan ve tavşanlarda üreme ve gelişimsel toksisite çalışmalarından elde edilen sonuçlar, ortalama fetal veya yavru vücut ağırlığının azaldığını, plasental ağırlık artışının, kürtaj ve yavru ölümlerinin ortalama düzeyde olduğunu göstermiştir.
İmplantasyondan sert damağın kapanmasına kadar (gebeliğin 7 â 17. günleri) roksadustat uygulanan hamile Sprague-Dawley sıçanları, MRHD'deki toplam EAA'nın yaklaşık 6 katında, fetal vücut ağırlığında azalma ve iskelet değişikliklerinde artış göstermiştir. Roksadustatın implant sonrası fetal sağkalım üzerinde herhangi bir etkisi olmamıştır.
Hamile Yeni Zelanda tavşanlarına, gebeliğin 7. gününden 19. gününe kadar günlük olarak roksadustat uygulanmıştır ve gebeliğin 29. gününde sezaryen işlemi gerçekleştirilmiştir. MRHD'deki toplam EAA'nın yaklaşık 3 katına kadar sistemik maruziyetlerde roksadustat uygulaması, hiçbir embriyo-fetal bulgu göstermemiştir. Bununla birlikte, bir tavşan MRHD'deki toplam EAA'nın yaklaşık 1 katında ve 2 dişi ise MRHD'deki toplam EAA'nın yaklaşık 3 katında düşük yapmıştır. Düşük doğum yapan tavşanlar zayıf vücut yapısında oldukları gözlenmiştir.
![]()
Sprague-Dawley sıçanlarında gerçekleştirilen perinatal/postnatal gelişim çalışmasında, gebe
ır.
5
dişilere gebeliğin 7. gününden emzirmenin 20. gününe kadar günlük roksadustat uygulanmışt
Laktasyon döneminde, MRHD'deki toplam C'ın yaklaşık 2 katı roksadustat uygulanan dişilerin doğurduğu yavrular, sütten kesim öncesi dönemde yüksek mortalite oranı göstermiştir ve sütten kesimde sakrifiye edilmiştir. MRHD'de insan maruziyetinin yaklaşık 3 katı ile sonuçlanan sistemik maruziyet dozlarında roksadustat uygulanan dişilerin doğurduğu yavrular, kontrol grubundaki dişilerin doğurduğu yavrularla karşılaştırıldığında, doğumdan sonraki 21- günlük hayatta kalma süresinde (laktasyon indeksi) anlamlı bir düşüş gösterilmiştir.
Çapraz-besleme çalışmasında, sıçan yavrularının canlılığı üzerindeki en belirgin etkiler, yalnızca doğum sonrası roksadustata maruz bırakılan yavrularda kaydedilmiştir ve doğuma kadar roksadustata maruz bırakılan yavruların canlılığı, maruz kalmayan yavrularınkinden daha düşük olmuştur.
Maruz bırakılmayan sıçanlardan elde edilen yavruların roksadustat (insan eşdeğer dozu yaklaşık 2 katı MRHD) ile tedavi edilen anne sıçanlarla çapraz beslendiği çapraz besleme çalışmasında, yavru plazmasında roksadustat görülmüş olup, bu durum ilacın süt yoluyla transfer edildiğini göstermektedir. Bu anne sıçanlardan elde edilen sütlerde roksadustat mevcuttur. Roksadustat içeren süte maruz bırakılan yavrular, tedavi edilmeyen anne sıçanlarla çapraz beslenen anne sıçanlardan elde edilen yavrulara kıyasla (%98,5), daha düşük bir sağkalım oranı (%85,1) göstermiştir. Laktasyon döneminde roksadustata maruz kalan ve sağkalan yavruların ortalama vücut ağırlığı da kontrol yavrularınınkinden daha düşük olmuştur (uterus içi maruziyet yok â süt maruziyeti yok).
Kardiyovasküler güvenlilik
Bir kardiyovasküler güvenlilik farmakolojisi çalışmasında, maymunlara tek bir 100 mg/kg roksadustat uygulamasının ardından kalp atım hızı artışları gösterilmiştir. hERG veya EKG üzerinde hiçbir etkisi olmamıştır. Sıçanlarda yapılan ek güvenlilik farmakolojisi çalışmaları, roksadustatın MRHD'deki maruziyetin yaklaşık altı katından itibaren, total periferik direnci azalttığını ve ardından kalp atım hızında refleks bir artış olduğunu göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır kaynaklı) Mikrokristalin selüloz Kroskarmeloz sodyum
Povidon Magnezyum stearat
Polivinil alkol (E1203) Talk (E553b) Makrogol (E1521)
Allura Kırmızısı AC alüminyum lake (E129)
Titanyum dioksit (E171) Lesitin (soya) (E322)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
48 ay
6.4. Saklamaya yönelik özel tedbirler
30°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Bir karton ambalajda 12 film kaplı tablet içeren PVC/alüminyum blisterler.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
İmhası ile ilgili özel bir gereklilik yoktur.
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Ürünlerin Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmelikleri"ne uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Astellas Pharma İlaç Ticaret Ve Sanayi A.Ş
| Satış Fiyatı | 870.14 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 1142.96 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699043890475 |
| Etkin Madde | Roksadustat |
| ATC Kodu | B03XA05 |
| Birim Miktar | 20 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 12 |
| Kan ve Kan Yapıcı Organlar > Diğer Anemi İlaçları |
| İthal ( ref. ülke : Hollanda ) ve Beşeri bir ilaçdır. |