EZETROL 10 mg tablet (28 tablet) Kısa Ürün Bilgisi
{ Ezetimib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
EZETROL® 10 mg tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Ezetimib 10 mg
Yardımcı maddeler
Laktoz monohidrat (ineklerden elde edilir) 55 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Bir tarafında â414â işareti bulunan beyaz-beyazımtrak renkte, kapsül biçiminde tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Primer Hiperkolesterolemi MonoterapiEZETROL tek başına uygulandığında primer hiperkolesterolemik (heterozigot ailesel ve ailesel olmayan) hastalarda diyete ek olarak yükselmiş total kolesterolün (toplam-K), düşük dansiteli lipoprotein kolesterol (LDL-K) ve apolipoprotein B (Apo B)'nin düşürülmesinde endikedir.
HMG-CoA redüktaz inhibitörleri (statinler) ile kombinasyon tedavisi
EZETROL, ile 3-hidroksi-3-metilglutaril-koenzim A (HMG-CoA) redüktaz inhibitörleri (statinler) birlikte uygulandığında primer (heterozigot ailesel ve ailesel olmayan) hiperkolesterolemik hastalarda diyete ek olarak yükselmiş toplam-K'nın, (LDL-K) ve Apo B'nin düşürülmesinde endikedir.
Kardiyovasküler Hastalığın Önlenmesi
EZETROL, devam eden statin tedavisine ilave edildiğinde veya tedaviye bir statin ile eş zamanlı başlatıldığında koroner kalp hastalığı (KKH) olan hastalarda kardiyovasküler olayların riskini azaltmak için endikedir (bkz. Bölüm 5.1).
Homozigot Ailevi Hiperkolesterolemi (HoFH)
EZETROL bir statin ile birlikte verildiğinde HoFH'li hastalarda diğer lipid düşürücü tedavilere (örneğin LDL aferezis) ek olarak veya bu tedavilerin mevcut olmadığı durumlarda yükselmiş toplam-K ve LDL-K seviyelerinin düşürülmesinde endikedir.
Homozigot Sitosterolemi
EZETROL, homozigot ailevi sitosterolemili hastalarda yükselmiş sitosterol ve kampesterol düzeylerinin düşürülmesinde endikedir.
4.2. Pozoloji ve uygulama şekli
Hasta lipid düşürücü bir diyet uygulamalıdır ve EZETROL ile tedavi sırasında diyete devam
etmelidir.
Pozoloji:
Tavsiye edilen doz günde 1 defa EZETROL 10 mg tablettir. EZETROL yiyeceklerle birlikte veya aç karnına günün herhangi bir saatinde alınabilir.
EZETROL bir statin ile birlikte uygulanabilir (primer hiperlipidemili hastalarda) veya fenofibratlarla birlikte (karışık hiperlipidemili hastalarda) aşamalı etki için uygulanabilir. Daha güvenilir olması için ardışık kullanılan ilaçların doz önerilerine göre EZETROL'ün günlük dozu statinle eş zamanlı olarak alınmalıdır.
EZETROL bir statine eklendiğinde, statinin endike olan olağan başlangıç dozuna veya daha önceden başlanan yüksek statin dozuna devam edilmelidir. Bu uygulamada, kullanılan belirli statinin dozaj talimatlarına başvurulmalıdır.
Koroner Kalp Hastalığı olan Hastalarda Kullanım
Koroner kalp hastalığı olan hastalarda artan kardiyovasküler olayları azaltmak amacıyla, EZETROL 10 mg, kardiyovasküler yararı kanıtlanmış bir statin ile birlikte uygulanabilir.
Uygulama şekli:
Oral yolla alınır.
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:
Böbrek bozukluğu olan hastalarda doz ayarlanması gerekmez (bkz. bölüm 5.2).
Karaciğer yetmezliği:
Hafif karaciğer yetmezliği olan hastalarda dozaj ayarlaması gerekmez (Child Pugh skoru 5-6). Orta ve şiddetli karaciğer yetmezliğinde (Child Pugh skoru 7-9 ve 9 un üstü) ezetimibe maruz kalmaya bağlı etkiler bilinmediğinden, EZETROL bu hastalara önerilmemektedir (bkz. bölüm 4.4. ve 5.2).
Pediyatrik popülasyon:
Tedavinin başlatılması uzman incelemesi altında yürütülmelidir.
Çocuklar ve ergenler ≥ 6: Ezetimibin 6 ila 17 yaş arasındaki çocuklarda güvenlilik ve etkililiği kanıtlanmamıştır. Mevcut veriler 4.4, 4.8, 5.1 ve 5.2 bölümlerinde açıklanmaktadır, ancak pozoloji için bir tavsiye yapılamamaktadır.
EZETROL bir statin ile birlikte uygulandığında, çocuklar için statin dozaj talimatlarına başvurulmalıdır.
Çocuklar < 6: EZETROL'ün 6 yaşından küçük çocuklarda uygulanmasının güvenliliği ve
etkililiği kanıtlanmamıştır.
Geriyatrik popülasyon:
Yaşlı hastalarda dozun ayarlanması gerekmez (bkz. bölüm 5.2).
Diğer:
Safra asidi sekestranları ile birlikte uygulama:
EZETROL dozu bir safra asidi sekestranı uygulanmadan önce (≥ 2 saat geçmeli) veya ≥ 4 saat sonra verilmelidir.
4.3. Kontrendikasyonlar
EZETROL, etkin maddeye veya bileşimindeki yardımcı maddelerden herhangi birine aşırı duyarlılığı olanlarda kontrendikedir.
EZETROL ile bir statinin birlikte kullanıldığı durumlarda o ilacın KÜB'üne de bakılmalıdır.
Gebelik ve emzirme dönemlerinde bir statin ile birlikte EZETROL uygulanması
kontrendikedir.
EZETROL ile bir statinin kombinasyonu aktif karaciğer hastalığı olan hastalarda ve serum transaminazlarında açıklanamayan, sürekli yükselmeler olan hastalarda kontrendikedir.
EZETROL 6 yaşından küçük ÇOCUKLARDA KULLANILMAMALIDIR. Bu yaş grubu ile ilgili bilgi bulunmamamaktadır.
4.4. Özel kullanım uyarıları ve önlemleri
EZETROL ile bir statinin birlikte kullanıldığı durumlarda o ilacın KÜB'üne de bakılmalıdır.
Karaciğer enzimleri
Bir statinle eş zamanlı olarak EZETROL uygulanan hastalarda yürütülen kontrollü çalışmalarda karaciğer transaminaz seviyelerinde ardışık yükselmeler (≥3 X normal üst sınırın (NÜS) 3 katı ve daha yüksek), gözlenmiştir. EZETROL bir statin ile birlikte uygulanırken, tedaviye başlanmadan önce statinlerin uyarılarına uygun olarak karaciğer testleri yapılmalıdır (bkz. bölüm 4.8).
Sonuçlarda Azalmanın İyileştirilmesi: Uluslararası Vytorin Etkinlik Çalışmasında (IMPROVE-IT), KKH ve AKS olay öyküsü olan 18144 hasta günde bir kez ezetimib/simvastatin 10/40 mg (n = 9067) veya günde bir kez simvastatin 40 mg (n= 9077 ) almak üzere randomize edilmiştir. Medyan 6,0 yıllık takip döneminde, transaminazlarda ardışık yükselmelerin (>3 X NÜS) insidansı, ezetimib/simvastatin için %2,5 ve simvastatin için %2,3 olmuştur (bkz. bölüm 4.8).
Kronik böbrek hastalığına sahip 9000'den fazla hastanın günlük 20 mg simvastatin ile birlikte EZETROL 10 mg (n = 4650) veya plasebo (n = 4620) alacak şekilde randomize edildiği kontrollü bir klinik çalışmada (medyan takip süresi 4,9 yıl), ardışık transaminaz artışlarının insidansı (> 3 X NÜS) simvastatin ile birlikte EZETROL için %0,7 ve plasebo için %0,6 olarak saptanmıştır (bkz. bölüm 4.8).
İskelet kası
EZETROL ile pazarlama sonrası deneyimde, miyopati ve rabdomiyoliz vakaları bildirilmiştir. Rabdomiyoliz gelişen hastaların çoğu EZETROL'e başlamadan önce birlikte bir statin almıştır. Ancak rabdomiyoliz EZETROL monoterapisi ile çok seyrek olarak ve EZETROL ile rabdomiyoliz riskinde artışla ilişkili olduğu bilinen başka ajanların birlikte kullanımında da çok seyrek olarak bildirilmiştir. Kas semptomlarına dayanarak miyopatiden kuşkulanılırsa veya miyopati normalin üst sınırının 10 katı kreatin fosfokinaz (CPK) düzeyi ile doğrulanırsa, EZETROL, hastanın eş zamanlı aldığı statin veya rabdomiyoliz riskini arttıran bu ajanlardan herhangi biri derhal kesilmelidir. EZETROL tedavisine başlayan tüm hastalara miyopati riski konusunda bilgi verilmeli ve kaslarda açıklanamayan ağrı, hassasiyet veya güçsüzlük olduğunda bunu derhal bildirmeleri söylenmelidir (bkz. bölüm 4.8).
IMPROVE-IT çalışmasında, KKH ve AKS olay öyküsü olan 18144 hasta günde bir kez ezetimib/simvastatin 10/40 mg (n = 9067) veya günde bir kez simvastatin 40 mg (n = 9077) almak üzere randomize edilmiştir. Medyan 6,0 yıllık takip döneminde, miyopati insidansı ezetimib/simvastatin için %0,2 ve simvastatin için %0,1 olmuştur. Miyopati kaslarda açıklanamayan güçsüzlük veya ağrı ile birlikte bir serum CK (kreatin kinaz) değerinde üst normal sınırın ≥ 10 katı yükselme veya peşpeşe iki ölçümde CK ≥ 5 ve < 10 x NÜS yükselme gözlenmesi şeklinde tanımlanmıştır. Rabdomiyoliz insidansı ezetimib/simvastatin için %0,1 ve simvastatin için %0,2 olarak saptanmıştır; rabdomiyoliz kaslarda açıklanamayan güçsüzlük veya ağrı ile birlikte bir serum CK değerinde ≥ 10 x NÜS yükselmeye eşlik eden böbrek hasarı kanıtları veya CK ≥ 10000 mU/mL olarak tanımlanmıştır (bkz. bölüm 4.8.).
Kronik böbrek hastalığına sahip 9000'den fazla hastanın günlük 20 mg simvastatin ile birlikte EZETROL 10 mg (n= 4650 ) veya plasebo (n= 4620 ) alacak şekilde randomize edildiği kontrollü bir klinik çalışmada (medyan takip süresi 4,9 yıl), miyopati/rabdomiyoliz insidansı simvastatin ile birlikte EZETROL için %0,2 ve plasebo için %0,1 olarak belirlenmiştir (bkz. bölüm 4.8).
Karaciğer yetmezliği
Orta ve şiddetli karaciğer yetmezliğinde ezetimibe maruz kalmaya bağlı etkiler
bilinmediğinden, EZETROL bu hastalara önerilmemektedir (bkz. bölüm 5.2).
Pediyatrik popülasyon
Heterozigot ailesel veya ailesel olmayan hiperkolesterolemisi olan 6 ila 10 yaşındaki hastalarda EZETROL'ün etkililik ve güvenliliği 12 haftalık plasebo-kontrollü klinik bir çalışmada değerlendirilmiştir. 12 haftadan uzun tedavi sürelerinde ezetimibin etkileri bu yaş grubunda incelenmemiştir (bkz. bölüm 4.2, 4.8, 5.1 ve 5.2).
EZETROL 6 yaşından küçük hastalarda incelenmemiştir (bkz. bölüm 4.2 ve 4.8).
Heterozigot ailevi hiperkolesterolemili 10-17 yaş arası hastalarda simvastatin ile birlikte EZETROL uygulanmasının etkililik ve güvenliliği adolesan erkekler (Tanner Evre II veya üzeri) ve mensleri en az 1 yıl önce başlamış kızlarda yürütülen kontrollü bir klinik çalışmada değerlendirilmiştir.
Bu sınırlı kontrollü çalışmada, adolesan erkeklerde veya kızlarda genel olarak büyüme veya cinsel olgunlaşma üzerinde ölçülebilir bir etki ve kızlarda menstrüel siklus uzunluğu üzerinde herhangi bir etki gözlenmemiştir. Ancak 33 haftadan uzun süren tedavi döneminde ezetimibin büyüme ve cinsel olgunlaşma üzerindeki etkileri çalışılmamıştır (bkz. bölüm 4.2 ve 4.8).
Günde 40 mg'dan yüksek simvastatin dozlarıyla birlikte uygulanan EZETROL'ün güvenlilik ve etkililiği 10-17 yaş arası pediyatrik hastalarda incelenmemiştir.
Simvastatin ile birlikte uygulanan EZETROL'ün güvenlilik ve etkililiği 10 yaşından küçük
pediyatrik hastalarda çalışılmamıştır (bkz. bölüm 4.2 ve 4.8).
17 yaşından küçük hastalarda EZETROL ile uzun süreli tedavinin erişkin çağda morbidite ve
mortaliteyi azaltmadaki etkinliği incelenmemiştir.
Fibratlar:
Fibratlarla birlikte EZETROL uygulanmasının güvenliliği ve etkililiği kanıtlanmamıştır.
EZETROL ve fenofibrat alan hastada safra taşından kuşkulanılırsa safra kesesi tetkikleri
gerekir ve bu tedavi kesilmelidir (bkz.bölüm 4.5 ve 4.8).
Siklosporin:
Siklosporin kullanımı sırasında hastaya EZETROL başlarken dikkatli olunmalıdır. EZETROL ve siklosporin alan hastalarda siklosporin konsantrasyonları izlenmelidir (bkz. bölüm 4.5).
Antikoagülanlar
EZETROL varfarin, diğer kumarin tipi antikoagülanlar veya fluindion ile birlikte kullanıldığında Uluslararası Normalize Oran (INR) uygun şekilde izlenmelidir (bkz. bölüm 4.5).
Yardımcı maddeler
Bu ürün 55 mg laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz eksikliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
EZETROL, her bir tablet başına 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani
aslında âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Klinik öncesi çalışmalarda, ezetimibin sitokrom P450 ilaç metabolizma enzimlerini indüklemediği gösterilmiştir. Sitokrom P450 1A2, 2D6, 2C8, 2C9 ve 3A4 veya N- asetiltransferaz ile metabolize edildiği bilinen ilaçlar ile ezetimib arasında klinik yönden anlamlı farmakokinetik etkileşimler gözlenmemiştir.
Klinik etkileşim çalışmalarında ezetimib, birlikte uygulama sırasında dapson, dekstrometorfan, digoksin, oral kontraseptifler (etinil östradiol ve levonorgestrel), glipizid, tolbutamid veya midazolamın farmakokinetikleri üzerinde hiçbir etki göstermemiştir. Ezetimib ile birlikte uygulanan simetidinin ezetimibin biyoyararlanımı üzerinde hiçbir etkisi olmamıştır.
Antasitler
Eş zamanlı antasit uygulanması ezetimibin emilim hızını azaltmış ancak ezetimibin biyoyararlanımını etkilememiştir. Emilim hızındaki bu azalma klinik yönden anlamlı kabul edilmemektedir.
Kolestiramin
Eş zamanlı kolestiramin uygulanması total ezetimibin (ezetimib + ezetimib- glukuronidi) eğri altında kalan ortalama alanını (EAA) yaklaşık %55 azaltmıştır. Kolestiramine EZETROL eklenmesiyle düşük dansiteli lipoprotein kolesteroldeki (LDL-K) yüksek düşüş bu etkileşim nedeniyle azalabilir (bkz. bölüm 4.2).
Fibratlar
Fenofibrat ve EZETROL alan hastalarda, hekimler muhtemel kolelitiyazis ve safra kesesi
hastalığı riskine karşı dikkatli olmalıdır (bkz. bölüm 4.4 ve 4.8).
Fenofibrat ve EZETROL alan bir hastada kolelitiyazisden şüphelenilirse, safra kesesi tetkikleri gerekmekte ve bu tedavi kesilmelidir (bkz. bölüm 4.8).
Eş zamanlı fenofibrat veya gemfibrozil uygulanması total ezetimib konsantrasyonlarını hafifçe yükseltmiştir (sırasıyla yaklaşık 1,5 ve 1,7 kat).
EZETROL'ün diğer fibratlarla kombine uygulanması incelenmemiştir.
Fibratlar safraya kolesterol atılımını arttırarak kolelitiyazise neden olabilir. Hayvan çalışmalarında ezetimib tüm türlerde olmamakla birlikte safra kesesindeki kolesterol miktarını bazen yükseltmiştir (bkz. bölüm 5.3). EZETROL'ün terapötik kullanımıyla ilişkili litojenik (taş oluşumu) risk dışlanamaz.
Statinler
Ezetimib atorvastatin, simvastatin, pravastatin, lovastatin, fluvastatin veya rosuvastatin ile
birlikte uygulandığında klinik yönden anlamlı farmakokinetik etkileşimler görülmemiştir.
Siklosporin
Siklosporinin stabil bir dozunu alan ve kreatinin klerensi > 50 mL/dak olan böbrek transplantasyonu yapılmış sekiz hastadaki bir çalışmada, EZETROL'ün tekli 10 mg dozu başka bir çalışmada (n = 17) tek başına ezetimib alan sağlıklı bir kontrol popülasyonuna göre total ezetimibin ortalama EAA'sında 3.4 kat (aralık 2,3-7,9 kat) artışa yol açmıştır. Farklı bir çalışmada, siklosporin ile birlikte başka birçok ilaç alan böbrek transplantasyonu yapılmış, ciddi böbrek yetmezliği olan bir hastanın total ezetimib maruz kalımında tek başına ezetimib alan benzer kontrollere göre 12 kat artış görülmüştür. Sağlıklı 12 gönüllüde yapılan iki dönemli, çapraz tasarımlı bir çalışmada, 8 gün süreyle günde 20 mg ezetimib ve 7. günde siklosporinin tekli 100 mg dozunun uygulanması tek başına siklosporin 100 mg dozuna göre siklosporinin EAA'sında ortalama %15 artışa (aralık: %10 azalmadan %51 artışa kadar) yol açmıştır. Böbrek transplantasyonu yapılmış hastalarda birlikte uygulanan ezetimibin siklosporin maruz kalımına etkisini inceleyen kontrollü bir çalışma yapılmamıştır. Siklosporin tedavisi sırasında EZETROL'e başlanırken dikkatli olunmalıdır. EZETROL ve siklosporin alan hastalarda siklosporin konsantrasyonları izlenmelidir (bkz. bölüm 4.4).
Antikoagülanlar
Eş zamanlı ezetimib uygulanması (günde 10 mg) sağlıklı 12 erişkin erkekte yapılan bir çalışmada varfarinin biyoyararlanımını ve protrombin zamanını anlamlı olarak etkilememiştir. EZETROL'ün varfarin veya fluindiona eklendiği hastalarda INR'de artışa ilişkin pazarlama sonrası raporlar alınmıştır. EZETROL varfarin, diğer kumarin türevi antikoagülanlar veya fluindion ile birlikte kullanıldığında INR uygun şekilde izlenmelidir (bkz. bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon
Etkileşim çalışmaları yalnızca yetişkinlerde yapılmıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi:C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü(Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda üreme etkilerini değerlendirmek için klinik çalışma yoktur.
Gebelik dönemi
Gebe kadınlara EZETROL yalnızca kesin bir gereklilik olduğunda verilmelidir. Gebelik döneminde EZETROL kullanımına ilişkin hiçbir klinik veri yoktur.
Monoterapi şeklinde uygulanan ezetimib ile yürütülen hayvan çalışmaları gebelik, embriyofetal gelişim, doğum veya doğum sonrası gelişim üzerinde doğrudan veya dolaylı zararlı etkilere dair bulgular göstermemiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebelik ve emzirme döneminde EZETROL ile bir statinin birlikte uygulanması
kontrendikedir (bkz. bölüm 4.3); lütfen statinin Kısa Ürün Bilgisine bakınız.
Laktasyon dönemi:
EZETROL emzirme döneminde kullanılmamalıdır. Sıçanlarda yapılan çalışmalar ezetimibin anne sütüne geçtiğini göstermektedir. Ezetimibin insanlarda anne sütüne geçip geçmediği bilinmemektedir.
Üreme yeteneği (fertilite)
Ezetimibin insan fertilitesi üzerindeki etkisi hakkında klinik çalışma verisi bulunmamaktadır. Ezetimibin erkek veya dişi sıçanların fertilitesi üzerinde etkisi bulunmamaktadır (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Ezetimibin araç ve makine kullanımına etkisi üzerine yapılmış çalışma yoktur. Ancak araç ve makine kullanırken, baş dönmesinin rapor edildiği göz önünde bulundurulmalıdır.
4.8. İstenmeyen etkiler
İstenmeyen etkilerin listesi (klinik çalışmalar ve pazarlama sonrası deneyim)
112 haftaya kadar devam eden klinik çalışmalarda günde 10 mg EZETROL tek başına 2396 hastaya, bir statin ile birlikte 11308 hastaya veya fenofibrat ile birlikte 185 hastaya uygulanmıştır. İstenmeyen reaksiyonlar genellikle hafif ve geçici olarak belirlenmiştir. EZETROL ile bildirilen istenmeyen olayların genel insidansı plaseboyla bildirilen ile benzerdir. İstenmeyen olaylar nedeniyle tedaviyi bırakma oranı da EZETROL ve plasebo için benzer bulunmuştur.
EZETROL tek başına veya bir statin ile birlikte uygulandığında:
Aşağıdaki istenmeyen reaksiyonlar tek başına EZETROL alan hastalarda (n = 2396) plaseboya (n = 1159) veya bir statin ile birlikte EZETROL (n = 11308) alan hastalarda birlikte uygulanan statine (n = 9361) göre daha yüksek insidansla bildirilmiştir. EZETROL'ün (monoterapi olarak veya bir statin ile birlikte uygulanan) klinik çalışmalarında gözlenen veya pazarlama sonrası kullanımda EZETROL'ün tek başına veya bir statinle uygulanması sonucu bildirilen advers reaksiyonlar Tablo 1'de listelenmiştir. Bu reaksiyonlar sistem organ sınıfına ve görülme sıklığına göre sunulmaktadır.
Sıklıklar şöyle tanımlanır: Çok yaygın ( ï³1/10); yaygın (ï³ 1/100 ila <1/10); yaygın olmayan (ï³1/1.000 ila <1/100); seyrek (ï³1/10.000 ila <1/1,000), çok seyrek (<1/10.000) ve bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1
Advers Reaksiyonlar
Sistem Organ Sınıfı Sıklık | Advers Reaksiyonlar |
Kan ve lenf sistemi hastalıkları | |
Bilinmiyor | Trombositopeni |
Bağışıklık sistemi hastalıkları | |
Bilinmiyor | Döküntü, ürtiker, anaflaksi ve anjiyoödem dahil aşırı duyarlılık |
Metabolizma ve beslenme hastalıkları | |
Yaygın olmayan | İştah azalması |
Psikiyatrik hastalıklar | |
Bilinmiyor | Depresyon |
Sinir sistemi hastalıkları | |
Yaygın | Baş ağrısı |
Yaygın olmayan | Parestezi |
Bilinmiyor | Baş dönmesi |
Vasküler hastalıklar | |
Yaygın olmayan | Sıcak basması, hipertansiyon |
Solunum, göğüs ve mediastinal hastalıklar | |
Yaygın olmayan | Öksürük |
Bilinmiyor | Dispne |
Gastrointestinal hastalıklar | |
Yaygın | Karın ağrısı, ishal, karında şişkinlik |
Yaygın olmayan | Hazımsızlık, gastroözofageal reflü hastalığı, bulantı, ağız kuruluğu, gastrit |
Bilinmiyor | Pankreatit, kabızlık |
Hepato-bilier hastalıklar | |
Bilinmiyor | Hepatit, kolelitiyazis, kolesistit |
Deri ve deri altı doku hastalıkları | |
Yaygın olmayan | Kaşıntı, döküntü, ürtiker |
Bilinmiyor | Eritema multiforme |
Kas, iskelet bozuklukları, bağ doku ve kemik hastalıkları | |
Yaygın | Miyalji |
Yaygın olmayan | Eklem ağrısı, kas spazmları, boyun ağrısı, sırt ağrısı, kas güçsüzlüğü, uzuvlarda ağrı |
Bilinmiyor | Miyopati/ rabdomiyoliz (bkz. bölüm 4.4) |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |
Yaygın | Bitkinlik |
Yaygın olmayan | Göğüs ağrısı, ağrı, asteni, periferik ödem |
Araştırmalar | |
Yaygın | ALT ve/veya AST yükselmesi |
Yaygın omayan | CPK düzeyinde artış; gamaglutamil transferaz artışı; anormal karaciğer fonksiyon testi |
EZETROL ve fenofibrat birlikte uygulandığında:
Gastrointestinal hastalıklar:
Yaygın: Karın ağrısı
Çok-merkezli, çift-kör, plasebo-kontrollü klinik bir çalışma, karışık hiperlipidemili hastalarda yapılmıştır. 625 hasta 12 haftaya kadar tedavi edilirken 576 hasta 1 yıla kadar tedavi görmüştür. Bu çalışmada 172 hasta EZETROL ve fenofibrat ile aldıkları tedaviyi 12 haftada tamamlamışlar ve 230 hasta EZETROL ve fenofibratla aldıkları tedaviyi (109 hasta tedavinin ilk 12 haftasında sadece EZETROL almıştır) 1 yılda tamamlamıştır. Bu çalışma tedavi grupları arasındaki sık görülmeyen durumları karşılaştırmak üzere tasarlanmamıştır. Serum transaminazlarındaki klinik olarak önemli (>3 X NÜS, ardışık) yükselmelerin insidansı (%95 GA (güven aralığı)) fenofibrat monoterapisi ve EZETROL ile birlikte fenofibrat tedavisinde
%4,5 (1,9, 8,8) ve %2,7 (1,2, 5,4)'tür. Kolesistektomi için karşılık gelen insidansı, fenofibrat monoterapisi için ve EZETROL ile birlikte fenofibrat için sırasıyla %0,6 (0,0, 3,1) ve %1,7 (0,6, 4,0)'dir (bkz. bölüm 4.4 ve 4.5).
Pediyatrik (6-17 yaş arası) Hastalar
Heterozigot ailesel veya ailesel olmayan hiperkolesterolemisi olan pediyatrik (6 ila 10 yaş) hastaları kapsayan bir çalışmada (n = 138), ALT ve/veya AST artışları (≥ 3X NÜS, ardışık), plasebo grubundaki %0 ile karşılaştırıldığında ezetimib hastalarında %1,1 (1 hasta) olarak gözlenmiştir. CPK artışı (≥ 10X NÜS) söz konusu olmamıştır. Miyopati vakası rapor edilmemiştir.
Heterozigot ailevi hiperkolesterolemili adolesan (10-17 yaş arası) hastalarda (n =248) yürütülen bir çalışmada ALT ve/veya AST'de (≥3 X NÜS, ardışık) yükselmeler ezetimib/simvastatin alan hastaların %3'ünde (4 hasta) ve simvastatin monoterapi grubundaki hastaların %2'sinde (2 hasta) gözlenmiştir; CPK'de (≥10X NÜS) yükselme için rakamlar sırasıyla %2 (2 hasta) ve %0'dır. Hiçbir miyopati vakası bildirilmemiştir.
Bu çalışma seyrek istenmeyen ilaç reaksiyonları karşılaştırılacak şekilde tasarlanmamıştır. Koroner Kalp Hastalığı ve AKS Olay Öyküsü olan Hastalar
Ezetimib/simvastatin 10/40 mg (n=9067; bunlardan %6'sı ezetimib/simvastatin dozu 10/80 mg'ye titre edilmiştir) veya simvastatin 40 mg (n=9077; bunlardan %27'sinde simvastatin dozu 80 mg'ye titre edilmiştir) ile tedavi edilen 18144 hastayı içeren IMPROVE-IT çalışmasında (bkz. bölüm 5.1), güvenlilik profillerinin medyan 6,0 yıllık takip döneminde benzer olduğu saptanmıştır. İstenmeyen olaylar nedeniyle tedaviyi bırakma oranları ezetimib/simvastatin tedavisi alan hastalarda %10,6 ve simvastatin ile tedavi edilen hastalarda
%10,1'dir. Miyopati insidansı ezetimib/simvastatin için %0,2 ve simvastatin için %0,1'dir; miyopati kaslarda açıklanamayan güçsüzlük veya ağrı ile birlikte bir serum CK değerinde normal üst sınırın (NÜS) ≥10 katı yükselme veya peşpeşe iki ölçümde CK ≥5 ve <10 x NÜS yükselme gözlenmesi şeklinde tanımlanmıştır. Rabdomiyoliz insidansı ezetimib/simvastatin için %0,1 ve simvastatin için %0,2 olarak belirlenmiştir; rabdomiyoliz kaslarda açıklanamayan güçsüzlük veya ağrı ile birlikte bir serum CK değerinde ≥10 x NÜS yükselmeye eşlik eden böbrek hasarı kanıtları veya CK ≥10000 mU/mL olarak tanımlanmıştır. Transaminazlarda ardışık yükselmelerin (>3 X NÜS) insidansı ezetimib/simvastatin için %2,5 ve simvastatin için %2,3'dür (bkz. bölüm 4.4.) Safra kesesiyle ilişkili istenmeyen etkiler ezetimib/simvastatin tedavisine yerleştirilen hastaların %3,1'inde ve simvastatin tedavisine yerleştirilen hastaların %3,5'inde bildirilmiştir. Kolesistektomi nedeniyle hospitalizasyonların insidansı her iki tedavi grubunda %1,5'dir. Ezetimib/simvastatin veya simvastatin alan hastaların sırasıyla %9,4 ve %9,5'ine çalışma döneminde kanser (herhangi yeni malignite olarak tanımlanmıştır) tanısı konmuştur.
Kronik Böbrek Hastalığına Sahip Hastalar
Günlük EZETROL 10 mg ve simvastatin 20 mg sabit doz kombinasyonu (n = 4650) veya plasebo (n = 4620) ile tedavi edilen 9000'den fazla hastayı kapsayan Kalp ve Böbrek Koruma Çalışmasında (SHARP) güvenlilik profilleri 4,9 yıllık medyan takip süresince karşılaştırılabilirdir. Bu klinik çalışmada, yalnızca ciddi advers olaylar ve herhangi bir advers olay nedeniyle tedavi kesintileri kaydedilmiştir. Advers olaylar nedeniyle tedavinin bırakılma oranı benzerdir (simvastatin ile birlikte EZETROL ile tedavi edilen hastalarda %10,4, plasebo ile tedavi edilen hastalarda %9,8). Miyopati/rabdomiyoliz insidansı, simvastatin ile birlikte EZETROL ile tedavi edilen hastalarda %0,2 ve plasebo ile tedavi edilen hastalarda %0,1'di. Transaminazların ardışık artışları (> 3X NÜS), simvastatin ile birlikte EZETROL ile tedavi edilen hastalarda %0,7 iken plasebo ile tedavi edilen hastalarda %0,6 olarak bulunmuştur (bkz. bölüm 4.4). Bu klinik çalışmada, kanser (simvastatin ile birlikte EZETROL için %9,4, plasebo için %9,5), hepatit, kolesistektomi veya safra taşı komplikasyonları veya pankreatit dahil olmak üzere önceden belirlenmiş advers olayların insidansında istatistiki olarak anlamlı artışlar olmamıştır.
Laboratuvar değerleri
Kontrollü klinik monoterapi çalışmalarında serum transaminazlarında (ALT ve/veya AST
≥X3 NÜS) klinik olarak gözlenen önemli artışların insidansı, EZETROL (%0,5) ile plasebo (%0,3) arasında benzer bulunmuştur. Birlikte uygulama çalışmalarında statinle birlikte EZETROL uygulanan hastalarda insidans %1,3 iken, sadece statinle tedavi edilen hastalarda insidans %0,4'tür. Bu yükselişler genellikle asemptomatik, kolestazla ilişkisi olmayan ve tedavinin sona erdirilmesiyle veya tedavinin devamında son bulan etkilerdir (bkz. bölüm 4.4).
Klinik çalışmalarda CPK>10 X NÜS tek başına EZETROL uygulanan 1674 hastanın 4'ünde (%0,2) rapor edilmesine karşın plasebo uygulanan 786 hastanın 1'inde (%0,1) ve EZETROL ile birlikte statin uygulanan 917 hastanın 1'inde (%0,1) ve yalnızca statin uygulanan 929 hastanın 4'ünde (%0,4) rapor edilmiştir. İlgili kontrol kolu (plasebo veya yalnız statin) ile karşılaştırıldığında EZETROL ile ilişkili miyopati ve rabdomiyolizde artış gözlemlenmemiştir (bkz. bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0312 218 35 99).
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda günde 50 mg ezetimibin 15 sağlıklı bireye 14 güne kadar uygulanması veya günde 40 mg ezetimibin primer hiperkolesterolemili 18 hastaya 56 güne kadar uygulanması genel olarak iyi tolere edilmiştir. Hayvanlarda: sıçanlarda ve farelerde ezetimibin tekli oral 5000 mg/kg dozları ve 3000 mg/kg dozlarından sonra toksisite gözlenmemiştir.
EZETROL ile çok az sayıda doz aşımı olgusu bildirilmiştir; bunların çoğu istenmeyen olaylar ile ilişkili olmamıştır. Bildirilen istenmeyen olaylar ciddi değildir. Doz aşımı halinde, semptomatik ve destekleyici önlemler alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmasötik grubu: Diğer lipid düşürücü ajanlar
ATC kodu: C10AX09
Etki mekanizması
EZETROL kolesterol ve ilişkili bitki sterollerinin barsaktan emilimini seçici olarak inhibe eden yeni bir lipid düşürücü bileşik sınıfına mensuptur. Ezetimib oral olarak aktiftir ve diğer kolesterol düşürücü ilaçlardan (HMG-KoA redüktaz inhibitörleri (statinler), safra asidi sekestranları [reçineler], fibrik asit türevleri ve bitki stenolleri) farklı bir etki mekanizmasına sahiptir. Ezetimibin moleküler hedefinin sterol taşıyıcısı Niemann- Pick C1-benzeri 1 (NPC1L1) molekülü olduğu gösterilmiştir; NPC1L1 kolesterol ve fitosterollerin barsaktan uptake'inde rol oynar.
Ezetimib ince barsağın fırçamsı kenarına lokalize olur ve kolesterol emilimini inhibe ederek karaciğere giden barsak kolesterolünü azaltır; statinler ise karaciğerde kolesterol sentezini azaltır. Birlikte bu iki mekanizma komplementer kolesterol azaltımı sağlar. Hiperkolesterolemili 18 hastada yapılan 2 haftalık klinik bir çalışmada EZETROL barsaktan kolesterol emilimini plaseboya göre %54 inhibe etmiştir.
Farmakodinamik etkiler
Ezetimibin kolesterol emilimini inhibe etmede seçiciliğini belirlemek amacıyla bir dizi klinik öncesi çalışma yapılmıştır. Ezetimib, [14C]-kolesterol emilimini inhibe ederken trigliseridler, yağ asitleri, safra asitleri, progesteron, etinil östradiol veya yağda çözünen vitaminlerin (A ve D) emilimi üzerinde hiçbir etki göstermemiştir.
Epidemiyolojik çalışmalar kardiyovasküler morbidite ve mortalitenin total-K ve LDL-K düzeyiyle doğru orantılı ve HDL-K düzeyiyle ters orantılı şekilde değiştiğini ortaya koymuştur.
EZETROL'ün bir statin ile birlikte uygulanması KKH ve AKS olay öyküsü olan hastalarda
kardiyovasküler olayların riskini azaltmada etkilidir.
Klinik etkililik ve güvenlilik
Kontrollü klinik çalışmalarda, monoterapi şeklinde veya bir statin ile birlikte uygulanan EZETROL hiperkolesterolemili hastalarda total kolesterol (total-K), düşük dansiteli lipoprotein kolesterol (LDL-K), apolipoprotein B (Apo B) ve trigliseridleri (TG) anlamlı olarak düşürmüş ve yüksek dansiteli lipoprotein kolesterolü (HDL-K) yükseltmiştir.
Primer Hiperkolesterolemi
Sekiz haftalık çift-kör, plasebo-kontrollü bir çalışmada, statin monoterapisi alan ve Ulusal Kolesterol Eğitim Programının (NCEP) LDL-K hedefinde olmayan (başlangıç özelliklerine bağlı olarak 2,6 - 4,1 mmol/L [100 - 160 mg/dL]) 769 hiperkolesterolemili hasta devam eden statin tedavisine ek olarak EZETROL 10 mg veya plasebo almak üzere randomize edilmişlerdir.
Başlangıçta LDL-K hedefinde olmayan, statin tedavisi alan hastalarda (~%82), EZETROL'e randomize edilenlerde çalışmanın son noktasında LDL-K hedefine ulaşanların oranı plaseboya randomize edilenlere göre anlamlı olarak daha yüksektir (sırasıyla %72 ve %19). LDL-K azaltımları birbirinden anlamlı olarak farklıdır (EZETROL için %25, plasebo için
%4). Ayrıca, devam eden statin tedavisine eklenen EZETROL total-K, Apo B, TG'yi plaseboya göre anlamlı olarak düşürürken HDL-K'yı yükseltmiştir. Statin tedavisine eklenen EZETROL veya plasebo medyan C-reaktif proteini başlangıca göre sırasıyla %10 ve %0 azaltmıştır.
Primer hiperkolesterolemili 1719 hastada yürütülen iki çift-kör, randomize, plasebo-kontrollü, 12 haftalık çalışmada EZETROL 10 mg, total-K (%13), LDL-K (%19), Apo B (%14) ve TG'yi (%8) plaseboya göre anlamlı olarak düşürmüş ve HDL-K'yı yükseltmiştir (%3). Ayrıca, EZETROL yağda eriyen vitaminlerin (A, D ve E) plazma konsantrasyonları ve protrombin zamanı üzerinde hiçbir etki göstermemiş ve diğer lipid düşürücü ajanlar gibi adrenokortikal steroid hormon üretimini bozmamıştır.
Çok-merkezli, çift-kör, kontrollü bir klinik çalışmada (ENHANCE), heterozigot ailevi hiperkolesterolemili 720 hasta 2 yıl süreyle ezetimib 10 mg ile simvastatin 80 mg kombinasyonu (n = 357) veya sadece simvastatin 80 mg (n = 363) almak üzere randomize edilmiştir. Çalışmanın birincil amacı, ezetimib/simvastatin kombinasyon tedavisinin karotid arter intima-media kalınlığı (İMK) üzerindeki etkisini simvastatin monoterapisiyle karşılaştırmaktır. Bu dolaylı markerin kardiyovasküler morbidite ve mortalite üzerindeki etkisi henüz gösterilmemiştir.
Birincil son nokta olan altı karotid segmentinin tümünde ortalama İMK değişimi B-mod ultrasonla ölçüldüğünde iki tedavi grubu arasında anlamlı olarak farklı bulunmamıştır (p=0,29). Ezetimib 10 mg ile simvastatin 80 mg kombinasyonu veya tek başına simvastatin 80 mg ile intima-media kalınlığı çalışmanın 2 yılında sırasıyla 0,0111 mm ve 0,0058 mm artmıştır (başlangıçtaki ortalama karotid İMK sırasıyla 0,68 mm ve 0,69 mm).
Ezetimib 10 mg ile simvastatin 80 mg kombinasyonu LDL-K, total-K, Apo B ve TG'yi simvastatin 80 mg'ye göre anlamlı olarak daha fazla düşürmüştür. HDL-K'de yüzde artış iki tedavi grubunda benzerdir. Ezetimib 10 mg ile simvastatin 80 mg kombinasyonu için bildirilen istenmeyen olaylar onun bilinen güvenlilik profiliyle uyumludur.
Pediyatrik popülasyon
Çok merkezli, çift kör, kontrollü çalışmada, 6 ila 10 yaşında olan (ortalama yaş 8,3), heterozigot ailesel veya ailesel olmayan hiperkolesterolemisi (HeFH) olan ve başlangıç LDL- K düzeyleri 3,74 ila 9,92 mmol/l olan 138 hasta (59 erkek ve 79 kız), 12 hafta boyunca EZETROL 10 mg veya plaseboya randomize edilmiştir.
12. haftada EZETROL, plasebo ile karşılaştırıldığında total-K (-%21 vs. %0), LDL-C (-%28
vs. -%1), Apo-B (-%22 vs. -%1) ve non-HDL-K'yı (-%26 vs. %0) anlamlı derecede düşürmüştür. İki tedavi grubuna yönelik sonuçlar TG ve HDL-K için benzerdir (sırasıyla -%6 vs. +%8, +%2 vs. +%1).
Çok-merkezli, çift-kör, kontrollü bir çalışmada, başlangıçtaki LDL-K düzeyleri 4,1 ile 10,4 mmol/L arasında olan, heterozigot ailevi hiperkolesterolemili (HeFH) 10-17 yaş arası (ortalama yaş 14,2) 142 erkek (Tanner evresi II ve üzeri) ve menarş sonrası 106 kız 6 hafta boyunca EZETROL 10 mg ile birlikte simvastatin (10, 20 veya 40 mg) ya da tek başına simvastatin (10, 20 veya 40 mg); sonraki 27 haftada EZETROL ile birlikte 40 mg simvastatin veya tek başına 40 mg simvastatin ve sonraki 20 hafta boyunca açık etiketli olarak birlikte uygulanan EZETROL ve simvastatin (10 mg, 20 mg veya 40 mg) tedavisine randomize edilmiştir.
Altıncı haftada, EZETROL ile birlikte simvastatin uygulanması (tüm dozlar) total-K (%38'e karşı %26), LDL-K (%49'a karşı %34), Apo B (%39'a karşı %27) ve non-HDL-K'yi (%47'ye karşı %33) tek başına simvastatine (tüm dozlar) göre anlamlı olarak düşürmüştür. İki tedavi grubunda TG ve HDL-K sonuçları benzerdir (-%17'ye karşı -%12 ve + %7'ye karşı +%6). 33. haftadaki sonuçlar 6. haftadakilerle benzerdir ve NCEP AAP'nin ideal LDL-K hedefine (< 2,8 mmol/L [110 mg/dL]) ulaşanların sayısı EZETROL ile 40 mg simvastatin alan (%62) hastalarda 40 mg simvastatin (%25) alanlara kıyasla anlamlı olarak daha fazla bulunmuştur. Açık etiketli fazın sonu olan 53. haftada lipid parametreleri üzerindeki etkiler korunmuştur.
Günde 40 mg'dan yüksek simvastatin dozlarıyla birlikte uygulanan EZETROL'ün güvenlilik ve etkililiği 10-17 yaş arası pediyatrik hastalarda çalışılmamıştır. Simvastatin ile birlikte uygulanan EZETROL'ün güvenliliği ve etkililiği 10 yaşından küçük pediyatrik hastalarda çalışılmamıştır. 17 yaşından küçük hastalarda EZETROL ile uzun süreli tedavinin erişkin çağda morbidite ve mortaliteyi azaltmadaki etkililiği incelenmemiştir.
Kardiyovasküler Hastalığın Önlenmesi
![]()
Sonuçlarda Azaltımın İyileştirilmesi: Uluslararası Vytorin Etkinlik Çalışması (IMPROVE-IT) akut koroner sendrom (AKS; akut miyokard enfarktüsü [ME] veya kararsız angina [KA]) nedeniyle hospitalizasyondan sonraki 10 gün içinde çalışmaya dahil edilen 18144 hastada yürütülen çok-merkezli, randomize, çift-kör, aktif-kontrollü bir çalışmadır. AKS ile başvurdukları tarihte hastaların LDL-K değeri eğer lipid düşürücü tedavi almamışlarsa ≤ 125 mg/dL (≤ 3,2 mmol/L) ve lipid düşürücü tedavi almışlarsa ≤100 mg/dL'dır (≤ 2,6 mmol/L). Tüm hastalar ezetimib/simvastatin 10/40 mg (n=9067) veya simvastatin 40 mg (n=9077) almak üzere 1:1 oranında randomize edilmiş ve medyan 6,0 yıl boyunca takip edilmiştir.
Hastaların ortalama yaşı 63,6'dır; %76'sı erkek, %84'ü beyaz ve %27'si diyabetiktir. Çalışmaya giriş için kriter olan olay tarihinde ortalama LDL-K değeri lipid düşürücü tedavi (n=6390) alanlarda 80 mg/dL (2,1 mmol/L) ve daha önce lipid düşürücü tedavi almamış olanlarda 101 mg/dL'dir (2,6 mmol/L) (n=11594). Çalışmaya giriş kriteri olan AKS olayı için hospitalizasyondan önce, hastaların %34'ü statin tedavisi almaktadır. Birinci yılda, tedaviye devam eden hastalarda ortalama LDL-K ezetimib/simvastatin grubunda 53,2 mg/dL (1,4 mmol/L) ve simvastatin monoterapisi alan grupta 69,9 mg/dL'dir (1,8 mmol/L). Lipid değerleri genellikle çalışma tedavisine devam eden hastalardan elde edilmiştir.
Birincil son nokta, kardiyovasküler ölüm, majör koroner olaylar (MKO'lar; randomize tedaviye yerleşimden en az 30 gün sonra meydana gelen ölümcül olmayan miyokard enfarktüsü, hospitalizasyon gerektiren belgelenmiş kararsız angina veya herhangi bir koroner revaskülarizasyon prosedürü olarak tanımlanmıştır) ve ölümcül olmayan inmenin bileşimidir. Çalışma, simvastatine eklenen ezetimib tedavisinin kardiyovasküler ölüm, MKO ve ölümcül olmayan inmeyi içeren birincil birleşik son noktayı tek başına simvastatine göre azaltmada ilave yarar sağladığını göstermiştir (relatif risk azaltımı %6,4, p=0,016). Birincil son nokta ezetimib/simvastatin grubunda yer alan 9067 hastadan 2572'sinde (7 yıllık Kaplan-Meier [KM] oranı %32,72) ve tek başına simvastatin grubundaki 9077 hastadan 2742'sinde ortaya çıkmıştır (7 yıllık KM oranı %34,67) (bkz. Şekil 1 ve Tablo 1) Bu ilave yararın, kardiyovasküler olayların riskini azaltmada etkin oldukları gösterilmiş diğer statinlerin eş zamanlı uygulanmasıyla benzer olması beklenmektedir (bkz. Tablo 1).
Ezetimib/simvastatinin tedavi etkisi cinsiyet, yaş, ırk, tıbbi öyküde diabetes mellitus varlığı, başlangıçtaki lipid düzeyleri, önceki statin tedavisi, geçirilmiş inme veya hipertansiyonu içeren pek çok alt grupta tüm sonuçlarla genellikle uyumlu bulunmuştur.
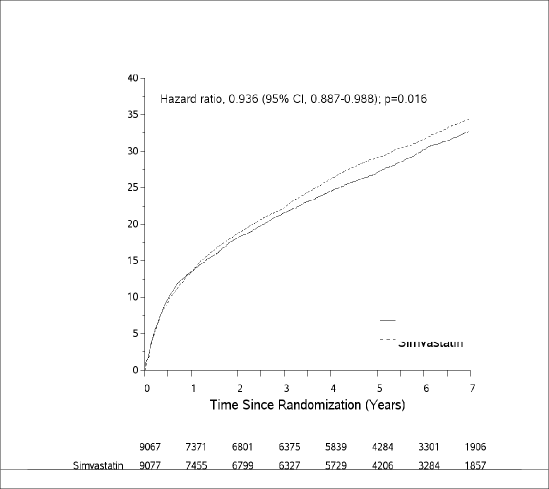
Randomizasyondan Sonra Geçen Zaman (Yıllar)
Hazard oranı, 0,936 (%95 GA, 0,887-0,988); p=0,016
Kümülatif %
Şekil 1: Ezetimib/simvastatinin kardiyovasküler ölüm, major koroner olay veya ölümcül olmayan inmeyi içeren birincil birleşik son nokta üzerindeki etkisi
Tablo 2
IMPROVE-IT'e Randomize Edilen Tüm Hastalarda Tedavi Grubuna göre Majör
Kardiyovasküler Olaylar
|
|
| ||||
|
|
|
|
|
| |
|
|
|
|
|
| |
|
|
|
| |||
|
|
|
|
|
| |
|
|
|
|
|
| |
Kronik Böbrek Hastalığında (KBH) Majör Vasküler Olayların Önlenmesi
Kalp ve Böbrek Koruma (SHARP) çalışması kronik böbrek hastalığı olan 9438 hastada (üçte biri başlangıçta diyaliz tedavisi almaktaydı) yürütülen çok-uluslu, randomize, plasebo- kontrollü, çift-kör bir çalışmadır. Toplam 4650 hasta EZETROL 10 mg ile simvastatin 20 mg'nin sabit dozlu bir kombinasyonunu ve 4620 hasta plasebo almak üzere randomize edilmiş ve medyan 4,9 yıl izlenmiştir. Hastaların ortalama yaşı 62'dir, %63'ü erkek, %72'si beyaz ve %23'ü diyabetiktir. Diyalize girmeyen hastalarda hesaplanmış ortalama glomerüler filtrasyon hızı (eGFR) 26,5 mL/dak/1,73 m2'dir. Lipidler için hiçbir giriş kriteri yoktu. Başlangıçta ortalama LDL-K 108 mg/dL'dir. Bir yıl sonra, çalışma ilacını artık almayan
hastalar dahil olmak üzere, tek başına simvastatin ile LDL-K plaseboya göre %26 azalırken,
EZETROL 10 mg ve simvastatin 20 mg kombinasyonuyla %38 oranında azalmıştır.
SHARP protokolünde tanımlanan birincil karşılaştırma sadece başlangıçta EZETROL ile kombine simvastatin grubuna (n = 4193) veya plasebo (n = 4191) grubuna randomize edilen hastalarda "majör vasküler olayların" (MVO; ölümcül olmayan miyokard enfarktüsü veya kardiyak ölüm, inme ya da herhangi bir revaskülarizasyon prosedürü şeklinde tanımlanmıştır) tedavi amaçlı analizidir. İkincil analizler EZETROL ile simvastatin kombinasyonuna (n = 4650) veya plaseboya (n = 4620) randomize edilen (çalışmanın başlangıcında veya 1.yılda) tüm kohort için analiz edilen aynı birleşik son noktayı ve ayrıca bu birleşik son noktanın bileşenlerini içermiştir.
Birincil son nokta analizi EZETROL ile simvastatin kombinasyonunun majör vasküler olayların riskini (plasebo grubunda olayların görüldüğü 749 hastaya karşılık EZETROL ile kombine simvastatin grubunda 639 hasta) relatif riskte %16 azalmayla birlikte anlamlı düzeyde azalttığını göstermiştir (p = 0,001).
Bununla birlikte, bu çalışma KKH hastalarında majör vasküler olayların riskini anlamlı düzeyde azaltmadaki etkinliğe tek bir bileşenin (ezetimib) katkısını ayrı olarak incelemek amacıyla tasarlanmamıştır.
Tüm randomize edilmiş hastalarda majör vasküler olayların her bir bileşeni Tablo 2'de sunulmaktadır. EZETROL ile simvastatin kombinasyonu inme ve herhangi bir revaskülarizasyonun riskini anlamlı düzeyde azaltmış ve ölümcül olmayan ME ve kardiyak ölüm açısından EZETROL ile simvastatin kombinasyonu lehine anlamlı olmayan rakamsal farklar gözlenmiştir.
Tablo 3
SHARP'da randomize edilen tüm hastalarda Tedavi Grubuna göre Majör Vasküler Olaylar a
Sonuç | EZETROL 10 mg ile simvastatin 20 mg kombinasyonu (n=4650) | Plasebo (n=4620) | Risk Oranı (%95 GA - güven aralığı) | P-değeri |
Majör Vasküler Olaylar | 701 (%151) | 814 (%176) | 0,85 (077-094) | 0001 |
Ölümcül olmayan ME (miyokard enfarktüsü) | 134 (%29) | 159 (%34) | 0,84 (0,66-1,05) | 0,12 |
Kardiyak Ölüm | 253 (%5,4) | 272 (%5,9) | 0,93 (0,78-110) | 0,38 |
İnme | 171 (%3,7) | 210 (%4,5) | 0,81 (0,66-0,99) | 0,038 |
Hemorajik olmayan İnme | 131 (28%) | 174 (%3,8) | 075 (060-094) | 0,011 |
Hemorajik İnme | 45 (%1,0) | 37 (%0,8) | 1,21 (0,78-1,86) | 0,40 |
Revaskülarizasyon | 284 (%6,1) | 352 (%76) | 0,79 (068-0,93) | 0,004 |
Majör Aterosklerotik Olaylar (MAO) | 526(%113) | 619 (%13,4) | 0,83 (074-0,94) | 0002 |
EZETROL ve simvastatin kombinasyonuyla LDL kolesterolde sağlanan mutlak azalma başlangıçta LDL-K değeri düşük olan hastalarda (<2,5 mmol/L) ve başlangıçta diyaliz tedavisi almakta olan hastalarda diğer hastalara göre daha düşüktür ve bu iki grupta karşılık gelen risk azaltımları zayıflamıştır.
Homozigot Ailesel Hiperkolesterolemi (HoFH)
Çift-kör, randomize, 12 haftalık bir çalışma klinik ve/veya genotipik HoFH tanısı koyulmuş, eş zamanlı LDL afereziyle birlikte veya aferez olmaksızın atorvastatin veya simvastatin (40 mg) alan 50 hastayı incelemiştir. Atorvastatin (40 veya 80 mg) veya simvastatin (40 veya 80 mg) ile birlikte uygulanan EZETROL LDL-K'yı simvastatin veya atorvastatin monoterapi dozunun 40 mg'den 80 mg'ye yükseltilmesine göre %15 oranında anlamlı olarak düşürmüştür.
Homozigot Sitosterolemi (Fitosterolemi)
Çift-kör, plasebo-kontrollü, 8 haftalık bir çalışmada homozigot sitosterolemili 37 hasta EZETROL 10 mg (n = 30) veya plasebo (n = 7) almak üzere randomize edilmiştir. Bazı hastalar başka tedaviler alıyorlardı (örn. statinler, reçineler). EZETROL iki önemli bitki sterolünü (sitosterol ve kampesterol) başlangıca göre sırasıyla % 21 ve % 24 oranında azaltmıştır. Bu popülasyonda sitosterol düşürümünün morbidite ve mortalite üzerindeki etkileri bilinmemektedir.
Aort Stenozu
Aort Stenozunda Simvastatin ve Ezetimib (SEAS) çalışması, Doppler ile ölçülen 2,5 - 4,0 m/s aralığında aort pik akış hızıyla belgelenen asemptomatik aort stenozu (AS) olan 1873 hastada ortalama 4,4 yıl yürütülen çok-merkezli, çift-kör, plasebo-kontrollü bir çalışmadır. Çalışmaya sadece, statin tedavisinin aterosklerotik kardiyovasküler hastalık riskini azaltmak amacıyla gerekli olduğu düşünülmeyen hastalar dahil edilmiştir. Hastalar plasebo veya ezetimib 10 mg ile birlikte uygulanan simvastatin 40 mg/gün tedavisi almak üzere randomize edilmiştir.
Birincil son nokta kardiyovasküler ölüm, aort kapağı değiştirme (AVR) cerrahisi, AS'nin ilerlemesine bağlı konjestif kalp yetmezliği (KKY), ölümcül olmayan miyokard enfarktüsü, koroner arter bypass graftı (CABG), perkutan koroner girişim (PCI), kararsız angina nedeniyle hospitalizasyon ve hemorajik olmayan inmeyi içeren majör kardiyovasküler olayların bir bileşimidir. Önemli ikincil son noktalar, birincil son nokta olay kategorilerinin alt kümelerinin bileşimleridir.
Plaseboya kıyasla, ezetimib/simvastatin 10/40 mg majör kardiyovasküler olayların riskini anlamlı olarak azaltmamıştır. Birincil sonuç ezetimib / simvastatin grubunda 333 hastada (%35,3) ve plasebo grubunda 355 hastada (%28,3) görülmüştür (ezetimib / simvastatin grubunda risk oranı (HR), 0,96; %95 güven aralığı, 0,83 - 1,12; p = 0,59). Aort kapağı değişimi ezetimib / simvastatin grubunda 267 hastada (%28,3) ve plasebo grubunda 278 hastada (%29,9) yapılmıştır (tehlike oranı, 1,00; %95 GA, 0,84 - 1,18; p = 0,97). Ezetimib / simvastatin grubunda iskemik kardiyovasküler olaylar (n=148) plasebo grubuna kıyasla (n = 187) daha az hastada görülmüştür (tehlike oranı, 0,78; %95 GA, 0,63 - 0,97; p = 0,02); bunun ana nedeni, koroner arter bypass graftı yapılan hasta sayısının daha az olmasıdır.
Ezetimib / simvastatin grubunda kanser daha sıklıkla görülmüştür (105'e karşı 70, p=0,01). Daha büyük SHARP çalışmasında herhangi bir kanser vakası olan toplam hasta sayısı (438
ezetimib/simvastatine göre 439 plasebo grup) farklı olmadığı için bu gözlemin klinik önemi bilinmemektedir. Ek olarak, IMPROVE-IT çalışmasında herhangi bir yeni malignitesi olan (853 ezetimib/simvastatin gruba göre 863 simvastatin grup) toplam hasta sayısı anlamlı olarak farklılık yaratmamaktadır ve bu yüzden SEAS çalışmasının bulguları SHARP ya da IMPROVE-IT tarafından konfirme edilememiştir.
5.2. Farmakokinetik özellikler
Emilim:
Oral uygulamadan sonra ezetimib hızla emilir ve farmakolojik yönden aktif bir fenolik glukuronata (ezetimib-glukuronat) kapsamlı biçimde konjuge olur. Ortalama pik plazma konsantrasyonlarına (C) ezetimib ile 4- 12 saatte ve ezetimib-glukuronat ile 1-2 saatte ulaşılır. Ezetimibin mutlak biyoyararlanımı belirlenemez, çünkü bileşik enjeksiyon için uygun olan sulu ortamda neredeyse hiç çözünmemektedir.
Ezetimib EZETROL 10 mg tabletler şeklinde uygulandığında eş zamanlı gıda alımı (yüksek oranda yağ içeren veya yağ içermeyen öğünler) ezetimibin emilim derecesini etkilememiştir. EZETROL gıdalarla birlikte veya ayrı alınabilir.
Dağılım:
Ezetimib ve ezetimib-glukuronat insan plazma proteinlerine sırasıyla %99,7 ve %88-92 oranında bağlanır.
Biyotransformasyon:
Ezetimib, ince barsakta ve karaciğerde glukuronik asit konjugasyonu (faz II reaksiyonu) ile metabolize olur; daha sonra safrayla atılır. İncelenen tüm türlerde minimal oksidatif metabolizma (faz I reaksiyon) gözlemlenmiştir. Ezetimib ve ezetimib-glukuronat plazmada total ilacın sırayla %10 ila %20'si ve %80 ila %90'ını teşkil eder.
Eliminasyon:
Hem ezetimib hem de ezetimib-glukuronat anlamlı enterohepatik geridolaşım kanıtıyla
plazmadan elimine edilirler. Ezetimib ve ezetimib- glukuronatın yarılanma ömrü 22 saattir.
İnsan deneklere 14C-ezetimibin (20 mg) oral uygulanmasından sonra, total ezetimib plazmadaki toplam radyoaktivitenin yaklaşık %93'ünü oluşturmuştur.
10 günlük bir toplama periyodunun ardından, uygulanan radyoaktivitenin yaklaşık %78 ve
%11'i, sırasıyla üre ve feçesten geri kazanılmıştır. 48 saat sonra plazmada radyoaktivite
ölçülemeyecek düzeylerde bulunmuştur.
Hastalardaki karakteristik özellikler
Pediyatrik hastalar:
6 yaşındaki ve daha büyük çocuklarda ezetimibin farmakokinetiği erişkinlerle benzerdir. 6 yaşından küçük pediyatrik popülasyonda farmakokinetik veri mevcut değildir. Pediyatrik ve adolesan hastalarda klinik deneyim HoFH, HeFH ve sitosterolemili hastaları içerir.
Geriyatrik hastalar:
Total ezetimibin plazma konsantrasyonları yaşlı kişilerde (≥65 yaş) genç kişilere (18- 45 yaş arası) göre yaklaşık 2 kat daha yüksektir. EZETROL ile tedavi edilen yaşlı ve genç gönüllülerde LDL-K düşürümü ve güvenlilik profili benzerdir. Dolayısıyla yaşlılarda doz ayarlamasına gerek yoktur.
Karaciğer yetmezliği:
Ezetimibin tekli 10 mg dozundan sonra, total ezetimibin eğri altında kalan ortalama alanı (EAA) hafif karaciğer yetmezliği olan hastalarda (Child-Pugh skoru 5 ila 6) sağlıklı bireylere göre yaklaşık 1,7 kat artmıştır. Orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh skoru 7 ila 9) 14 gün süren bir çoklu-doz çalışmasında (günde 10 mg) total ezetimibin ortalama EAA değeri 1. günde ve 14. günde sağlıklı bireylere göre yaklaşık 4 kat artmıştır. Orta derecede veya şiddetli (Child-Pugh skoru > 9) karaciğer yetmezliği olan hastalarda artmış ezetimib maruziyetinin etkileri bilinmediğinden, ezetimib bu hastalara önerilmez (bkz. bölüm 4.4).
Böbrek yetmezliği:
Şiddetli böbrek yetmezliği olan hastalarda (n=8; ortalama kreatin klerensi ≤ 30 mL/dak/1,73 m2) 10 mg lık tekli dozu sonrasında eğrinin altında kalan alanın (EAA) sağlıklı bireylere (n=9) oranla yaklaşık 1,5 kat arttığı görülmüştür. Bu sonuç klinik olarak anlamlı olmadığı için, böbrek yetersizliği olan hastalarda doz ayarlamasına gerek yoktur. Bu çalışmadaki başka bir hastada (böbrek transplantasyonu yapılmış, siklosporin dahil pek çok ilaç alan) total ezetimibe maruz kalım 12 kat daha yüksektir.
Cinsiyet:
Total ezetimibin plazma konsantrasyonları erkeklere göre kadınlarda biraz daha yüksektir (yaklaşık %20). EZETROL ile tedavi edilen erkekler ve kadınlarda LDL-K azaltımı ve güvenlilik profili benzerdir. Dolayısıyla cinsiyete göre doz ayarlaması gerekmez.
5.3. Klinik öncesi güvenlilik verileri
Ezetimibin kronik toksisitesini inceleyen hayvan çalışmaları toksik etkiler için hiçbir hedef organ ortaya koymamıştır. Dört hafta süreyle ezetimib (≥ 0,03 mg/kg/gün) ile tedavi edilen köpeklerde sistik kanaldaki kolesterol konsantrasyonu 2,5 - 3,5 kat yükselmiştir. Ancak günde 300 mg/kg'a kadar dozların verildiği köpeklerle yapılan bir 1 yıllık çalışmada kolelitiyazis veya diğer hepatobiliyer etkilerin insidansında artış gözlenmemiştir. Bu verilerin insanlardaki anlamı bilinmemektedir. EZETROL'ün terapötik kullanımıyla ilişkili litojenik (taş oluşumu) risk dışlanamaz.
Ezetimib ve statinlerin kombine uygulandığı çalışmalarda gözlenen toksik etkiler statinler ile tipik olarak gözlenen etkilerdi. Toksik etkilerin bazıları tek başına statinlerle tedavi sırasında gözlenenlerden daha çarpıcıydı. Bu durum kombine tedavide farmakokinetik ve farmakodinamik etkileşimlere bağlanmaktadır. Bu tip etkileşimler klinik çalışmalarda ortaya çıkmamıştır. Miyopatiler sıçanlarda yalnızca insanlardaki terapötik dozun birkaç kat üzerindeki dozlara (statinlerin EAA düzeyinin yaklaşık 20 katı ve aktif metabolitlerin EAA düzeyinin 500-2000 katı) maruz kalımdan sonra gözlenmiştir.
Bir dizi in vivo ve in vitro çalışmada, tek başına veya statinler ile birlikte uygulanan ezetimib genotoksik potansiyel sergilememiştir. Ezetimib ile yapılan uzun süreli karsinojenite testleri negatiftir.
Ezetimibin dişi veya erkek sıçanların üreme yeteneği üzerinde hiçbir etkisi bulunmamıştır; ayrıca ezetimib sıçanlarda veya tavşanlarda teratojenik değildir ve doğum öncesi ve sonrası gelişimi etkilememiştir. Ezetimib günde 1000 mg/kg çoklu dozların verildiği gebe sıçanlarda ve tavşanlarda plasenta bariyerinden geçmiştir. Sıçanlarda ezetimib ve statinlerin birlikte uygulanması teratojenik değildir. Gebe tavşanlarda az sayıda iskelet deformitesi (toraks ve
kaudal omurlarda füzyon, kaudal omurların sayısında azalma) gözlenmiştir. Ezetimib ile lovastatinin birlikte uygulanması embriyo üzerinde ölümcül etkilere yol açmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kroskarmeloz sodyum
Laktoz monohidrat (ineklerden elde edilir)
Magnezyum stearat Mikrokristalin selüloz Povidon
Sodyum laurilsülfat
6.2. Geçimsizlikler
Yeterli veri yoktur.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25oC'nin altındaki oda sıcaklığında, çocukların göremeyeceği ve erişemeyeceği yerlerde ve
ambalajında saklayınız.
Blisterleri nemden korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda 28 tabletlik Poliklorotrifloroetilen/Al/PVC blister ambalajlarda.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğiâ'ne uygun olarak imha edilmelidir.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| EZELIPIN | 8697929013154 | 374.57TL |
| EZETEC | 8697930010067 | |
| EZETROL | 8699636010181 | |
| KOLEZ | 8699578012229 | |
| Diğer Eşdeğer İlaçlar |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Organon Turkey İlaçları Ltd. Şti.
| Satış Fiyatı | 374.57 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 374.57 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8683280337169 |
| Etkin Madde | Ezetimib |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |