FASENRA 30 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör (1 adet) Kısa Ürün Bilgisi
{ Benralizumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FASENRA® 30 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör
Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her kullanıma hazır enjektör ml'de 30 mg benralizumab içerir.
Benralizumab, rekombinant DNA teknolojisi ile memeli (Çin hamsterı overi) hücrelerinde üretilen bir insan immünoglobulin monoklonal antikordur.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti içeren kullanıma hazır enjektör
Berrak ila opak arası, renksiz ila hafif sarı renkli, beyaz ila beyazımsı gözle görülebilir partiküller içerebilen çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
FASENRA®, yüksek doz inhale kortikosteroidleri ve ek olarak bir veya daha fazla kontrol ajanı kullanan ( örneğin LABA vb.), önceki yıl içerisinde en az iki alevlenme öyküsü olan ( en az 3 gün sistemik kortikosteroid tedavisi gereken) ve kandaki eozinofil sayımı ≥300 hücre/μl olan şiddetli eozinofilik astımı olan yetişkin hastalarda ek idame tedavisi olarak endikedir (bkz. Bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
FASENRA® ağır astımın tanısı ve tedavisinde deneyimli doktorlar tarafından reçete edilmelidir.
Pozoloji/uygulama sıklığı ve süresi:
Önerilen FASENRA® dozu, ilk 3 doz için 4 haftada bir ve ondan sonra 8 haftada bir subkütan enjeksiyon yoluyla 30 mg'dır. Planlanmış tarihte bir enjeksiyon kaçırılırsa, doz uygulaması belirtilmiş rejimde mümkün olan en kısa sürede yeniden başlatılmalıdır; çift doz uygulanmamalıdır.
FASENRA® uzun süreli tedaviye yöneliktir. Hastalık şiddetine, alevlenme kontrol düzeyine ve kan eozinofil sayımlarına dayalı olarak en az yılda bir kez tedaviye devam etme kararı değerlendirilmelidir.
Uygulama şekli:
FASENRA®, bir sağlık mesleği mensubu tarafından subkütan enjeksiyon yoluyla uygulanır.
Üst kol, uyluk ya da karına enjekte edilmelidir. Derinin hassas, morarmış, eritemli ya da sertleşmiş alanlarına enjekte edilmemelidir (bkz. Bölüm 6.6).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
FASENRA®'nın güvenlilik ve etkililiği, 6 ila 18 yaşları arasındaki ergenlerde ve çocuklarda belirlenmemiştir.
6 ila 11 yaşlarındaki çocuklar için mevcut veri bulunmamaktadır. 12 ila 18 yaşından küçük ergenlerde elde edilmiş mevcut veriler, Bölüm 4.8, 5.1 ve 5.2'de verilmektedir; fakat pozoloji ile ilgili olarak bir öneride bulunulamamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
FASENRA®, benralizumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
FASENRA® akut astım semptomları veya alevlenmelerinin tedavisi için kullanılmamalıdır. FASENRA'yı akut bronkospazmı veya status astımatikus tedavi etmek için kullanmayın.
Hastalara, tedaviye başlandıktan sonra astımları kontrol altına alınmaz ya da kötüleşirse tıbbi yardım almaları söylenmelidir.
FASENRA® tedavisinin başlatılmasından sonra kortikosteroidlerin hızlı bir şekilde bırakılması önerilmemektedir. Uygun olduğu durumlarda kortikosteroid dozlarındaki azaltma aşamalı olmalı ve bir hekimin gözetiminde gerçekleştirilmelidir.
Aşırı duyarlılık reaksiyonları
Benralizumab uygulamasının ardından anaflaktik reaksiyonlar ve aşırı duyarlılık reaksiyonlarını (örn. Ürtiker, papüler ürtiker, döküntü) içeren akut sistemik reaksiyonlar ortaya çıkmıştır (bkz. bölüm 4.8). Bu reaksiyonlar uygulamadan sonra birkaç saat içinde ortaya çıkabilir, ancak bazı durumlarda başlaması daha uzun sürebilir (örn. günler).
Benralizumab ile ilişkili olmayan bir anaflaksi öyküsü, Fasenra uygulamasının ardından anaflaksi için bir risk faktörü olabilir (bkz. bölüm 4.3). Klinik uygulamaya paralel olarak, hastalar Fasenra uygulamasaından sonra uygun bir süre takip edilmelidir.
Aşrı duyarlılık reaksiyonu olması durumunda, Fasenra kalıcı olarak bırakılmalı ve uygun tedaviye başlanmalıdır.
Parazitik (Helmint) Enfeksiyonu
Eozinofiller, bazı helmint enfeksiyonlarına verilen immünolojik yanıtta görev alabilir. Helmint enfeksiyonları olduğu bilinen hastalar klinik çalışmalardan çıkarılmışlardır. FASENRA®'nın bir hastanın helmint enfeksiyonlarına vereceği yanıtı etkileyip etkilemediği bilinmemektedir.
Daha önceden var olan helmint enfeksiyonları bulunan hastalar, FASENRA® tedavisine başlamadan önce tedavi edilmelidir. Hastalar, FASENRA® tedavisi alırken enfekte hale gelirse ve anti-helmint tedavisine yanıt vermezse, enfeksiyon geçene kadar FASENRA® tedavisi bırakılmalıdır.
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Yaşları 12 ve 21 arasında olan ciddi astımlı 103 hastada yapılan bir randomize, çift-kör paralel- grup çalışmasında, mevsimsel influenza virüsü aşılaması ile uyarılan humoral antikor yanıtı, benralizumab tedavisinden etkileniyor gibi görünmemektedir. Benralizumabın, eşzamanlı uygulanan tıbbi ürünlerin farmakokinetiği üzerinde bir etki yapması beklenmemektedir (bkz. Bölüm 5.2).
Benralizumabın klerensinde; sitokrom P450 enzimleri, eflüks pompaları ve protein bağlama mekanizmaları rol almamaktadır. Hepatositler üzerinde IL-5Rα ekspresyonuna dair kanıt bulunmamaktadır. Eozinofil deplesyonu, proenflamatuar sitokinlerin kronik sistemik değişimlerine neden olmamaktadır.
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir ilaç etkileşimi çalışması yapılmamıştır.
Pediyatrik popülasyon
Yukarıda referans verilen influenza aşılama çalışması dışında, herhangi bir ilaç etkileşimi çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) FASENRA®'nın gebe kadınlarda kullanımına ilişkin veri bulunmadığından çocuk doğurma potansiyeli bulunan kadınlar için doğum kontrol yöntemi kullanımı önerilmektedir.
Gebelik dönemi
FASENRA® için, gebeliklerde maruz kalmaya ilişkin klinik yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelisim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır.
Benralizumab gibi monoklonal antikorlar, gebelik ilerledikçe plasentadan doğrusal bir şekilde geçmektedir dolayısıyla fetüse maruziyet gebeliğin ikinci ve üçüncü trimesterinde büyük olasılıkla daha yüksek olacaktır.
Gebelik sırasında FASENRA® kullanımından kaçınılması tercih edilmelidir. Gebe kadınlara uygulama yalnızca, anne için beklenen faydanın fetüsün maruz kalacağı olası risklerden daha yüksek olması durumunda düşünülmelidir.
Laktasyon dönemi
Benraluzimabın veya metabolitlerinin insan veya hayvan sütüyle atılıp atılmadığı bilinmemektedir. Bununla birlikte benralizumab, bir humanize monoklonal antikordur (IgG1/κ- sınıfı) ve insan sütünde küçük miktarlarda immünoglobülin G (IgG) bulunur. Eğer benralizumab insan sütüne geçerse, bebekte benralizumabın gastrointestinal sistemdeki lokal maruziyetinin ve potansiyel sınırlı sistemik maruziyetin etkileri bilinmemektedir. Bu nedenle, memedeki çocuk açısından bir risk olduğu göz ardı edilemez.
Çocuk açısından emzirmenin faydası ve kadın açısından tedavinin faydası göz önüne alınarak emzirmeyi bırakma ya da FASENRA® kullanmayı bırakma/kullanmaktan kaçınma kararı verilmelidir.
Üreme yeteneği/Fertilite
İnsanlarda fertilite verisi bulunmamaktadır. Hayvan çalışmalarında benralizumab tedavisinin fertilite üzerinde advers etkileri gözlenmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
FASENRA®'nın araç ve makine kullanımı üzerinde etkisi bulunmamakta ya da etkisi ihmal edilebilecek kadar azdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Tedavi sırasında en yaygın şekilde bildirilen advers reaksiyonlar baş ağrısı (%8) ve farenjittir (%3). Anaflaktik reaksiyonlar bildirilmiştir.
Advers reaksiyonların tablolaştırılmış özeti
1663'ü şiddetli kontrol edilemeyen eozinofilik astım hastası olmak üzere, toplam 2514 hasta 48 ila 56 haftalık süreli klinik çalışmalar sırasında FASENRA® almıştır.
Advers reaksiyonların sıklığı şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1: Advers reaksiyonların tablo haline getirilmiş listesi
Sistem organ sınıfı | Advers reaksiyon | Sıklık |
Enfeksiyonlar ve enfestasyonlar | Farenjit* | Yaygın |
Bağışıklık sistemi hastalıkları | Aşırı duyarlılık reaksiyonları** Anaflaktik reaksiyon | Yaygın Bilinmiyor |
Sinir sistemi hastalıkları | Baş ağrısı | Yaygın |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Pireksi Uygulama yeri reaksiyonu | Yaygın |
* Farenjit, aşağıdaki gruplanmış tercih edilen terimlerle tanımlanmıştır: ‘Farenjit', ‘Bakteriyel farenjit', ‘Viral farenjit', ‘Streptokok farenjiti'.
** Aşırı duyarlılık reaksiyonları aşağıdaki gruplanmış tercih edilen terimlerle tanımlanmıştır: ‘Ürtiker', ‘Papular ürtiker' ve ‘Deri döküntüsü'. Bildirilen ilgili klinik tabloların örnekleri ve başlangıca kadar geçen süre ile ilgili bir açıklama için bkz. Bölüm 4.4.
>10%: İmmünolojik: Antikor gelişimi (13%; nötrleştirme: 12%)
Seçilmiş advers reaksiyon ile ilgili açıklama
Enjeksiyon yeri reaksiyonları
Plasebo kontrollü çalışmalarda enjeksiyon yeri reaksiyonlarının oranı (örn., ağrı, eritem, prurit, papül), plasebo ile tedavi edilmiş hastalarda %1,9'ken önerilen benralizumab dozu ile tedavi edilmiş hastalarda %2,2 olmuştur.
Uzun-vadeli güvenlilik
Çalışma 1, 2 ve 3'deki astımlı hastaların yer aldığı 56 haftalık bir uzatma çalışmasında, 842 hasta önerilen dozda Fasenra ile tedavi edilmiş ve çalışmada kalmışlardır. Genel advers olay profili yukarıda tanımlanan astım çalışmalarına benzer olmuştur.
![]()
Pediyatrik popülasyon
Pediyatrik hastalarla ilgili veriler sınırlıdır (bkz. Bölüm 5.1). Ergen popülasyonda advers reaksiyonların sıklığı, tipi ve şiddeti, yetişkinlerde gözlenenlere benzerdir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
200 mg'a kadar olan dozlar, dozla ilişkili toksisite kanıtı olmaksızın eozinofilik astımı olan hastalara klinik çalışmalarda subkütan yoldan uygulanmıştır.
Benralizumab ile doz aşımı için spesifik bir tedavi bulunmamaktadır. Eğer doz aşımı meydana gelirse, hasta gerektiği gibi uygun izlemle birlikte destekleyici şekilde tedavi edilmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan diğer sistemik ilaçlar
ATC kodu: R03DX10
Etki mekanizması:
Benralizumab, bir anti-eozinofil, hümanize afukozile monoklonal antikordur (IgG1, kappa). İnsan interlökin-5 reseptörünün (IL-5Rα) alfa alt birimine yüksek afinite ve özgünlükte bağlanır. IL-5 reseptörü, özellikle eozinofillerin ve bazofillerin yüzeyinde spesifik olarak eksprese edilir. Benralizumabın Fc bölgesinde fukozun olmaması, doğal öldürücü (NK) hücreler gibi bağışıklık efektör hücreleri üzerindeki FcyRIII reseptörlerine yüksek afinite göstermesi ile sonuçlanır. Bu da, eozinofilik inflamasyonu azaltan, antikor bağımlı hücre aracılı sitotoksisite (ABHS) yoluyla eozinofil ve bazofillerin apoptozuna yol açar.
Enflamasyon astım patogenezinin önemli bir bileşenidir. Çok sayıda hücre tipi (örn. mast hücreleri, eozinofiller, nötrofiller, makrofajlar, lenfositler) ve aracılar (örn. histamin, eikosanoidler, lökotrienler, sitokinler) enflamasyona katılırlar. Benralizumab, IL-5Rα zincirine bağlanarak, eozinofilleri ADCC (antikor bağımlı hücresel sitotoksisite) aracılığıyla azaltır; bununla birlikte, benralizumabın astımdaki etki mekanizması tam olarak ortaya konmamıştır.
Farmakodinamik etkiler:
Kan eozinofilleri üzerindeki etkisi
Benralizumab ile tedavi, ilk dozu takiben 24 saat içinde meydana gelen ve tedavi boyunca sürdürülen hemen hemen tam bir kan eozinofili deplesyonu ile sonuçlanır. Kan eozinofillerinin deplesyonu; serum eozinofil granül proteinleri, eozinofil kökenli nörotoksin (EKN) ve eozinofil katyonik proteinde (EHP) ve kandaki bazofil düzeylerinde bir azalma ile birlikte görülür.
Solunum yolu mukozasında eozinofiller üzerindeki etkisi
Benralizumabın, yüksek balgam eozinofil sayımları olan (en az %2,5) astımlı hastaların solunum yolu mukozasındaki eozinofiller üzerindeki etkisi, 100 ya da 200 mg benralizumabın subkütan olarak uygulandığı 12 haftalık, faz 1, randomize, çift kör, plasebo kontrollü bir klinik çalışmada değerlendirilmiştir. Bu çalışmada solunum yolu mukozası eozinofillerinde başlangıca göre medyan azalma plasebo grubundaki % 47'lik düşüşe kıyasla benralizumab ile tedavi edilmiş grupta %96 olmuştur (p=0,039).
Klinik etkililik:
FASENRA®'nın etkililiği, 12 ila 75 yaşları arasındaki hastalarda 28 ila 56 hafta süreyle gerçekleştirilen 3 randomize, çift kör, paralel gruplu, plasebo kontrollü klinik çalışmada değerlendirilmiştir.
Bu çalışmalarda FASENRA®, arka plan tedaviye ek olarak ilk 3 doz için 4 haftada bir kere ve daha sonra 4 ya da 8 haftada bir kere 30 mg dozda uygulanmış ve plasebo ile karşılaştırılarak değerlendirilmiştir.
İki alevlenme çalışması olan SIROCCO (Çalışma 1) ve CALIMA'ya (Çalışma 2) %64'ü kadın ve yaş ortalaması 49 olan şiddetli kontrol altına alınamayan astımlı toplam 2510 hasta kaydedilmiştir. Hastaların son 12 ayda oral veya sistemik kortikosteroid tedavisi gerektiren 2
ya da daha fazla astım alevlenmesi öyküsü vardır (ortalama 3), hastaların taramada Astım Kontrol Anketi-6 (ACQ-6) skoru 1,5 ya da daha yüksektir ve yüksek doz inhale kortikosteroid (İKS) (Çalışma 1) ile ya da orta veya yüksek doz İKS (Çalışma 2) ve uzun etkili bir β-agoniste rağmen (UEBA) başlangıçta akciğer fonksiyonu düşüktür (ortalama öngörülen 1 saniye içinde pre-bronkodilatör zorlu ekspiratuar hacim [FEV] %57,5) ve bu hastalara sırasıyla %51 ve
%41'ine en az bir ilave kontrol ilacı uygulanmıştır.
Oral kortikosteroid (OKS) azaltma çalışması ZONDA (Çalışma 3) için toplam 220 astım hastası (%61 kadın; ortalama yaş 51) kaydedilmiştir; bu hastalar normalyüksek doz İKS ve UEBA kullanımına ek olarak günlük OKS (gün başına 8 ila 40 mg; medyan 10 mg) ile tedavi edilmişlerdir ve vakaların %53'ünde astım kontrolünün sürdürülmesi için en az bir ilave kontrol ilacı gerekli olmuştur. Çalışma, astım kontrolü kaybedilmeden OKS'nin minimum etkili doza titre edildiği 8 haftalık bir alıştırma dönemini içermiştir. Hastaların kan eozinofil sayımları
≥150 hücre/µL'dir ve son 12 ayda en az bir alevlenme öyküsü vardır.
Çalışma 1, 2 ve 3'te 2 doz rejimi incelenirken, daha sık doz uygulaması ile ilave fayda gözlenmemiş olduğundan, önerilen doz uygulaması rejimi, ilk 3 doz için 4 haftada bir ve daha sonra 8 haftada bir FASENRA®'dır (bkz. Bölüm 4.2). Aşağıda özetlenen bulgular önerilen doz rejimi için elde edilmiştir.
Alevlenme çalışmaları
Birincil sonlanım noktası, yüksek doz İKS ve UEBA alan, başlangıç kan eozinofil sayımları
≥300 hücre/µL olan hastalarda klinik açıdan anlamlı astım alevlenmelerinin yıllık oranıdır.
Klinik açıdan anlamlı astım alevlenmesi, en az 3 gün boyunca oral/sistemik oral kortikosteroid kullanımı gerektiren astım kötüleşmesi ve/veya oral/sistemik kortikosteroid gerektiren acil servis viziti ve/veya hastaneye yatış olarak tanımlanmıştır. İdame oral kortikosteroidler alan hastalar için bu, en az 3 gün boyunca stabil oral/sistemik kortikosteroidlerde geçici bir artış ya da tek bir depo-enjektabl kortikosteroid dozu olarak tanımlanmıştır.
Her iki çalışmada, kan eozinofilleri ≥300 hücre/µL olan FASENRA® alan hastalar, plasebo hastaları karşılaştırıldığında yıllık alevlenme oranlarında anlamlı azalmalar yaşamıştır. Buna ek olarak, çalışma sonuna kadar korunan ortalama FEV'de başlangıca göre değişim 4. hafta gibi kısa bir sürede yarar göstermiştir (Tablo 2).
Başlangıç eozinofil sayımından bağımsız olarak alevlenme oranlarında azalmalar gözlenmiştir; diğer yandan, başlangıç eozinofil sayımlarının yükselmesi, özellikle FEViçin tedavi yanıtındaki iyileşme açısından potansiyel bir öngörücü olarak belirlenmiştir.
Tablo 2: Eozinofil sayımlarına göre Çalışma 1 ve 2 tedavisinin sonunda yıllık alevlenme oranı ve akciğer fonksiyonu bulguları
| Çalışma 1 | Çalışma 2 | ||
| FASENRA | Plasebo | FASENRA | Plasebo |
Kan eozinofil sayımı ≥300 hücre/µL | n = 267 | n = 267 | n = 239 | n = 248 |
Klinik olarak anlamlı alevlenmeler | ||||
Sıklık | 0,74 | 1,52 | 0,73 | 1,01 |
Farklılık | -0,78 | -0,29 | ||
Sıklık oranı (%95 GA) | 0,49 (0,37, 0,64) | 0,72 (0,54, 0,95) | ||
p-değeri | <0,001 | 0,019 | ||
Pre-bronkodilatör FEV (L) | ||||
Ortalama başlangıç | 1,660 | 1,654 | 1,758 | 1,815 |
Başlangıca göre iyileşme | 0,398 | 0,239 | 0,330 | 0,215 |
Farklılık (%95 GA) | 0,159 (0,068, 0,249) | 0,116 (0.028, 0,204) | ||
p-değeri | 0,001 | 0,010 | ||
Kan eozinofil sayımı <300 hücre/µL | n=131 | n=140 | n=125 | n=122 |
Klinik olarak anlamlı alevlenmeler | ||||
Sıklık | 1,11 | 1,34 | 0,83 | 1,38 |
Farklılık | -0,23 | -0,55 | ||
Sıklık oranı (%95 GA) | 0,83 (0,59, 1,16) | 0,60 (0,42, 0,869) | ||
Pre-bronkodilatör FEV (L) | ||||
Ortalama değişim | 0,248 | 0,145 | 0,140 | 0,156 |
Farklılık (%95 GA) | 0,102 (-0,003, 0,208) | -0,015 (-0,127, 0,096) | ||
Birlikte değerlendirildiğinde Çalışma 1 ve 2'de, başlangıç kan eozinofillerindeki artışla paralel olarak sayısal olarak daha yüksek bir alevlenme sıklığı azalması ve FEV1'de daha fazla iyileşmeler gözlenmiştir.
Çalışma 1 için plasebo ile karşılaştırıldığında FASENRA® alan hastalarda hastaneye yatış ve/veya acil servis vizitleri gerektiren alevlenme oranı 0,25'e karşı 0,09 (sıklık oranı 0,37,
%95 GA: 0,20, 0,67, p= <0,001) ve Çalışma 2 için 0,10'a karşı 0,12'dir (sıklık oranı 1,23,
%95 GA: 0,64, 2,35, p= 0,538). Çalışma 2'de plasebo tedavi kolunda hastaneye yatış ya da acil servis vizitleri gerektiren alevlenmeler için sonuca varılmasına izin verecek kadar olay meydana gelmemiştir.
Hem Çalışma 1 hem de Çalışma 2'de FASENRA® alan hastalar, plasebo alan hastalarla karşılaştırıldığında astım semptomlarında (Toplam Astım Skoru) istatistiksel olarak anlamlı azalmalar yaşamışlardır. Astım Kontrol Anketi-6 (ACQ-6) ve 12 Yaş ve Üzeri Standardize Astım Yaşam Kalitesi Anketi (AQLQ(S)+12) için Fasenra lehine benzer iyileşmeler gözlenmiştir (Tablo 3).
Tablo 3: Tedavi sonunda toplam astım semptom skorunda, ACQ-6'da ve AQLQ(s)+12'de başlangıca göre ortalama değişimdeki tedavi farklılığı – Yüksek doz İKS alan ve kan eozinofil değerleri ≥300 hücre/µL olan hastalar
| Çalışma 1 | Çalışma 2 | ||
| FASENRA (n=267) | Plasebo (n=267) | FASENRA (n=239) | Plasebo (n=248) |
Toplam astım semptom skoru | ||||
Ortalama başlangıç | 2,68 | 2,74 | 2,76 | 2,71 |
Başlangıca göre iyileşme | -1,30 | -1,04 | -1,40 | -1,16 |
Farklılık (%95 GA) | -0,25 (-0,45, -0,06) | -0,23 (-0,43, -0,04) | ||
p-değeri | 0,012 | 0,019 | ||
ACQ-6 | ||||
Ortalama başlangıç | 2,81 | 2,90 | 2,80 | 2,75 |
Başlangıca göre iyileşme | -1,46 | -1,17 | -1,44 | -1,19 |
Farklılık (%95 GA) | -0,29 (-0,48, -0,10) | -0,25 (-0,44, -0,07) | ||
AQLQ(S)+12 | ||||
Ortalama başlangıç | 3,93 | 3,87 | 3,87 | 3,93 |
Başlangıca göre iyileşme | 1,56 | 1,26 | 1,56 | 1,31 |
Farklılık (%95 GA) | 0,30 (0,10, 0,50) | 0,24 (0,04, 0,45) | ||
Daha önceki alevlenme öyküsüne göre alt grup analizleri
Çalışma 1 ve 2'de yapılan alt grup analizleri, daha iyi tedavi yanıtının potansiyel bir öngörücü olarak, daha önce daha yüksek alevlenme öyküsü olan hastaları belirlemiştir. Tek başına ya da başlangıç kan eozinofil sayımları ile kombinasyon halinde düşünüldüğünde, bu faktörler benralizumab tedavisinde daha yüksek yanıta ulaşabilecek hastaların daha iyi belirlenmesini sağlayabilir (Tablo 4).
Tablo 4: Bir önceki yıldaki alevlenmelerin sayısına göre tedavi sonunda alevlenme oranı ve pulmoner fonksiyon (FEV) - Yüksek doz İKS alan ve kan eozinofil değerleri
≥300 hücre/µL olan hastalar
| Çalışma 1 | Çalışma 2 | ||
| FASENRA (n=267) | Plasebo (n=267) | FASENRA (n=239) | Plasebo (n=248) |
Başlangıçta 2 alevlenme | ||||
n | 164 | 149 | 144 | 151 |
Alevlenme sıklığı | 0,57 | 1,04 | 0,63 | 0,62 |
Farklılık | -0,47 | 0,01 | ||
Sıklık oranı (%95 GA) | 0,55 (0,37, 0,80) | 1,01 (0,70, 1,46) | ||
Pre-bronkodilatör FEVortalama değişim | 0,343 | 0,230 | 0,266 | 0,236 |
Farklılık (%95 GA) | 0,113 (-0,002, 0,228) | 0,029 (-0,079, 0,137) | ||
Başlangıçta 3 ya da daha fazla alevlenme | ||||
n | 103 | 118 | 95 | 97 |
Alevlenme sıklığı | 0,95 | 2,23 | 0,82 | 1,65 |
Farklılık | -1,28 | -0,84 | ||
Sıklık oranı (%95 GA) | 0,43 (0,29, 0,63) | 0,49 (0,33, 0,74) | ||
Pre-bronkodilatör FEVortalama değişim | 0,486 | 0,251 | 0,440 | 0,174 |
Farklılık (%95 GA) | 0,235 (0,088, 0,382) | 0,265 (0,115, 0,415) | ||
Oral kortikosteroid doz azaltma çalışması
Çalışma 3, idame amaçlı oral kortikosteroidlerin azaltılması üzerinde FASENRA®'nın etkisini değerlendirmiştir. Birincil sonlanım noktası, astım kontrolü sürdürülürken 24. ila 28. haftalar arasında nihai OKS dozunda başlangıca göre yüzde azalmadır. Tablo 5'te Çalışma 3 için çalışma bulguları özetlenmektedir.
Tablo 5: FASENRA'nın OKS dozunun azaltılması üzerindeki etkisi, Çalışma 3
| FASENRA (N=73) | Plasebo (N=75) |
Wilcoxon sıra toplam testi (birincil analiz yöntemi) |
|
|
Başlangıca göre günlük OKS dozunda ortalama % azalma (%95 GA) | 75 (60, 88) | 25 (0, 33) |
Wilcoxon sıra toplam testi p-değeri | <0,001 |
|
Oransal olasılıklar modeli (duyarlılık analizi) |
|
|
28. Haftada başlangıca göre OKS'de yüzde azalma |
|
|
≥%90 azalma | 27 (%37) | 9 (%12) |
≥%75 azalma | 37 (%51) | 15 (%20) |
≥%50 azalma | 48 (%66) | 28 (%37) |
>%0 azalma | 58 (%79) | 40 (%53) |
OKS'de değişim ya da azalma olmaması | 15 (%21) | 35 (%47) |
Olasılıklar oranı (%95 GA) | 4,12 (2,22, 7,63) |
|
Günlük OKS dozunda 0 mg/gün'e azalma* | 22 (%52) | 8 (%19) |
Olasılıklar oranı (%95 GA) | 4,19 (1,58, 11,12) |
|
Günlük OKS dozunda ≤5 mg/gün'e azalma | 43 (%59) | 25 (%33) |
Olasılıklar oranı (%95 GA) | 2,74 (1,41, 5,31) |
|
Alevlenme sıklığı | 0,54 | 1,83 |
Sıklık oranı (%95 GA) | 0,30 (0,17, 0,53) |
|
Hastaneye yatış / acil servis viziti gerektiren alevlenme sıklığı | 0,02 | 0,32 |
Sıklık oranı (%95 GA) | 0,07 (0,01, 0,63) |
|
* Yalnızca 12,5 mg ya da daha düşük bir optimize başlangıç OKS dozu olan hastalar, çalışma sırasında OKS dozunda %100'lük bir azalmaya ulaşmaya uygundur.
Akciğer fonksiyonu, astım semptom skoru, ACQ-6 ve AQLQ(S)+12 de Çalışma 3'te değerlendirilmiş ve Çalışma 1 ve 2'dekine benzer sonuçlar elde edilmiştir.
Uzun vadeli uzatma çalışması
Fasenra'nın uzun vadeli etkililik ve güvenliliği 56-haftalık bir faz 3 uzatma çalışması olan BORA'da (çalışma 4) değerlendirilmiştir. Çalışma, 2037 erişkin ve 86 adolesan hasta (12 yaş ve üzeri) olmak üzere Çalışma 1, 2 ve 3'den 2123 hastayı kaydetmiştir. Çalışma 4, Fasenra'nın yıllık alevlenme oranı, akciğer fonksiyonu, ACQ-6, AQLQ(S)+12 üzerindeki uzun vadeli etkilerini ve önceki çalışmalarda incelenen 2 doz rejimindeki OKS azalmasının devamlılığını değerlendirmiştir.
Önerilen doz rejiminde, daha önceki plasebo-kontrollü Çalışma 1 ve 2'de gözlemlenen yıllık alevlenme oranı azalması (başlangıçta kan eozinofili sayısı ≥300 hücre/μL olan ve yüksek dozda İKS alan hastalarda) tedavinin ikinci yılında da devam etmiştir (Tablo 6). Uzatma çalışması Çalışma 4'de, daha önceki Çalışma 1 ve 2'de Fasenra almış olan hastaların %73'ünde alevlenme olmamıştır.
Tablo 6. Uzatılmış bir tedavi tedavi periyodunda alevlenmeler
| Plasebo (N=338) | Fasenra (N=318) | ||
Çalıma 1 & 2 | Çalışma 1 & 2 | Çalışma 4 | Çalışma 1, 2 & 4 | |
Oran | 1,23 | 0,65 | 0,48 | 0,56 |
Çalışma 4 boyunca, akciğer fonksiyonu, ACQ-6 ve AQLQ(S)+12 açılarından benzer idame etkisi gözlenmiştir (Tablo 7).
Tablo 7. Akciğer fonksiyonu, ACQ-6 ve AQLQ(S)+12 açılarından başlangıca göre değişim
| Çalışma 1 & 2 Başlangıç | Çalışma 1 & 2 EOT | Çalışma 4 EOT |
Bronkodilatatör-öncesi FEV1 (L) | |||
n | 318 | 305 | 290 |
Ortalama başlangıç (SS) | 1,741 (0,621) | -- | -- |
Başlangıca göre değişim (SS) e | -- | 0,343 (0,507) | 0,404 (0,555) |
ACQ-6 | |||
N | 318 | 315 | 296 |
Ortalama başlangıç (SS) | 2,74 (0,90) | -- | -- |
Başlangıca göre değişim (SS) | -- | -1,44 (1,13) | -1,47 (1,05) |
AQLQ(S)+12 |
| ||
n | 307 | 306 | 287 |
Ortalama başlangıç (SS) | 3,90 (0,99) | -- | -- |
Başlangıca göre değişim (SS) | -- | 1,58 (1,23) | 1,61 (1,21) |
n= zaman noktasında verileri bulunan hasta sayısı. SS = standart sapma
Başlangıç kan eozinofil sayısı ≥300 hücre/μL olan ve yüksek doz İKS alanlar: Fasenra önerilen doz rejiminde uygulanmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-histidin
L-histidin hidroklorür monohidrat α,α-Trehaloz dihidrat
Polisorbat 20 (bitkisel kaynaklı) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimsizlik çalışmaları olmadığından bu tıbbi ürün başka tıbbi ürünler ile karıştırılmamalıdır.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
2ºC - 8ºC arasında buzdolabında saklayınız.
Kullanıma hazır enjektörü ışıktan korumak için orijinal ambalajında saklayınız. Dondurmayınız.
Çalkalamayınız.
6.5. Ambalajın niteliği ve içeriği
Pasif bir güvenlik cihazı içinde, bir 29-gauge ½-inç paslanmaz çelik iğne ucu, sert iğne muhafazası ve Fluorotec-kaplı piston tıpası ile birlikte Tip I camdan yapılmış tek kullanımlık kullanıma hazır dolu enjektör içindeki bir ml çözelti. Tek kullanımlık 1 kullanıma hazır dolu enjektörlük ambalaj büyüklüğü
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmelikâ€lerine uygun olarak imha edilmelidir.
Fasenra enjeksiyonluk çözelti, bireysel kullanıma yönelik olan steril, tek kullanımlık, kullanıma hazır dolu enjektörler içinde tedarik edilmektedir. Çalkalamayınız. Donmuşsa kullanmayınız.
Uygulama talimatları
Uygulamadan önce, kartonundan çıkararak FASENRA'yı oda sıcaklığında ısıtınız. Bu genellikle 30 dakika sürer. 24 saat içinde uygulayın ya da kesici-delici aletler atık kutusuna atınız.
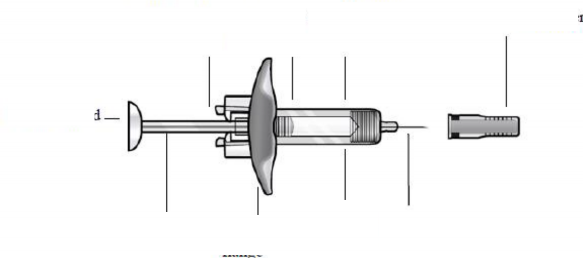
İğne Güvenlik Muhafazası olan Kullanıma Hazır Enjektör için Talimatlar Uygulama adımlarında kullanılacak kullanıma hazır enjektör bileşenlerini belirlemek için aşağıdaki Şekil 2'e bakın.
Şekil 2 İğne muhafazası aktivasyon Enjektör Son kullanma tarihini klipsleri gövdesi gösteren etiket
Piston başı
Gösterge Piston Parmak flanşı penceresi İğne
İğne güvenlik muhafazasının erken aktivasyonunu engellemek için iğne muhafazası aktivasyon klipslerine dokunmayınız. 1 Kullanıma hazır enjektörü tabladan ayırırken pistondan değil enjektör gövdesinden tutunuz. Enjektör üzerindeki son kullanma tarihini kontrol ediniz. Uygulamadan önce FASENRA'yı partiküllü madde ve renk değişimi açısından kontrol ediniz. FASENRA berrak ila opalesan, renksiz ila sarı renktedir ve şeffaf ya da beyaz ila beyazımsı partiküller içerebilir. Sıvı bulanık ya da rengi değişmişse ya da büyük partiküller veya yabancı partiküller madde içeriyorsa FASENRA'yı kullanmayınız. Enjektör hava kabarcığı içerebilir; bu normaldir. Uygulamadan önce hava kabarcığını dışarı atmayınız. | |
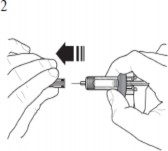
| Enjeksiyona hazır hale gelene kadar iğne başlığını çıkarmayınız. Enjektör gövdesini tutun ve tereddüt etmeden çekerek iğne başlığını çıkarınız. İğne başlığını çıkarırken pistonu ya da piston başını tutmayınız; aksi takdirde piston oynayabilir. Eğer kullanıma hazır enjektör hasar görürse ya da kontamine olursa (örneğin, iğne başlığı yerine takılı değilken düşerse), enjektörü atıp yeni bir kullanıma hazır enjektör kullanınız. |
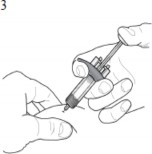
| Deriyi hafifçe parmaklarınız arasında sıkıştırınız ve önerilen enjeksiyon yerine iğneyi batırınız (yani, üst kol, uyluklar ya da karın) |
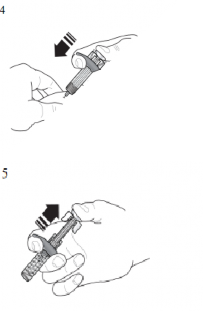
| Piston başı tam olarak iğne muhafazası aktivasyon klipsleri arasına gelene kadar, pistonu sonuna kadar bastırarak tüm çözeltiyi enjekte ediniz. Bu uygulama, iğne muhafazasını aktive etmek için gereklidir. |
| Enjeksiyondan sonra piston başına bastırmayı sürdürün ve iğneyi derinden çıkarınız. İğne muhafazasının iğneyi kapatması için piston başı üzerindeki basıncı kaldırınız. Kullanıma hazır enjektörün başlığını tekrar takmayınız. |
6. Kullanılmış enjektörü kesici-delici aletler atık kutusuna atınız. | |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 50422.85 TL [ 21 Jul 2025 ] |
| Önceki Satış Fiyatı | 50422.85 TL [ 14 Jul 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699786950047 |
| Etkin Madde | Benralizumab |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |