FIXRIVA 27.5 mcg burun spreyI.süspansiyon (120 doz) Klinik Özellikler
{ Flutikazon Furoate }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yetişkinler ve 12 yaşından büyük ergenlerde:
Mevsimsel alerjik rinitin nazal ve oküler belirtilerinin tedavisinde endikedir. Yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir.
Çocuklar (2- 11 yaş):
Mevsimsel ve yıl boyu devam eden alerjik rinitin nazal belirtilerinin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji:Yetişkinlerde ve 12 yaşından büyük ergenlerde:
Önerilen başlangıç dozu, her burun deliğine günde bir kez uygulanan iki spreydir (her spreyde 27,5 mikrogram flutikazon furoat, günlük toplam doz 110 mikrogram). Belirtiler yeterince kontrol altına alındıktan sonra her burun deliğine günde bir kez uygulanan birer sprey (toplam günlük doz 55 mikrogram), idame tedavisinde etkilidir.
Uygulama sıklığı ve süresi:
Tedavi süresi hekim tarafından belirlenmelidir.
Tam terapötik fayda sağlanması için, düzenli kullanım önerilir. Etkisi, başlangıçtaki uygulamayı izleyen 8. saat gibi erken bir dönemde gözlenmiştir. En üst düzeyde fayda sağlayabilmek için, daha uzun süreli tedavi gerekmektedir. Düzenli kullanım ile belirtilerin düzeleceği konusunda hasta bilgilendirilmelidir. Tedavi süresi alerjene maruz kalınan süre ile sınırlı olmalıdır.
Uygulama şekli:
FIXRIVA burun spreyi, sadece intranazal uygulama içindir.
Burun spreyinin kullanıma hazırlanması:
Burun spreyinin kullanıma hazırlanması: FIXRIVA mcg Burun Spreyi'nde burnu koruyan ve temiz kalmasını sağlayan plastik kapak ve emniyet anahtarı vardır. Spreyi kullanmadan önce bu kapağı ve emniyet anahtarını çıkarınız ve kullandıktan sonra takınız. Sprey pompasının ucunu delmeyiniz.
İlk kullanımda, sprey pompasını ayarlamak için, ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar, genellikle 10 kez püskürtülmelidir:
Her kullanımdan önce iyice çalkalanmalıdır.
Burnunuzdan yavaşça nefes almaya başlayınız ve nefesinizi içeri çekerken parmaklarınızla bir kere bastırarak burnunuza püskürtünüz. (Şekil 3)
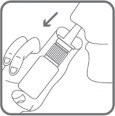
Şekil 3
4.3. Kontrendikasyonlar
FIXRIVA Burun Spreyi'ndeki etkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Sistemik kortikosteroid etkileri
Özellikle uzun periyotlarda ve yüksek dozlarda reçete edilen nazal kortikosteroidlerle sistemik etkiler meydana gelebilir. Oral kortikosteroidlerle kıyaslandığında bu etkilerin meydana gelme ihtimali çok daha düşüktür ve bu etkiler her hastada ve çeşitli kortikosteroid preparatları arasında değişiklik gösterebilir. Potansiyel sistemik etkiler Cushing sendromu, Cushingoid özellikler, adrenal supresyon, çocuklarda ve ergenlerde büyüme geriliği, katarakt, glokom ve daha seyrek olarak psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon veya agresyon (özellikle çocuklarda) içeren bir dizi psikolojik veya davranışsal etkileri içerebilir. Önerilenden daha yüksek dozlarda kullanılan nazal kortikosteroidler klinik olarak anlamlı adrenal supresyon ile sonuçlanabilir. Önerilenden yüksek dozların kullanıldığına dair bir kanıt varsa, stres veya elektif ameliyat dönemlerinde ilave sistemik kortikosteroid ile takviye düşünülmelidir. Günde bir kez flutikazon furoat 110 mikrogram yetişkin, ergen veya pediyatrik gönüllülerde hipotalamus-hipofiz-böbreküstü (HPA) aksı baskılanması ile ilişkilendirilmemiştir. Bununla birlikte intranazal flutikazon furoat dozu rinit semptomlarının etkili kontrolünün korunduğu en düşük doza azaltılmalıdır. Tüm intranazal kortikosteroidler ile olduğu gibi, eşzamanlı olarak diğer kortikosteroid tedavisi formlarının reçete edildiği her seferinde kortikosteroidlerin toplam sistemik yükü dikkate alınmalıdır.
Böbreküstü bezi fonksiyonunun bozulduğundan şüphe etmek için bir neden varsa, hastalar sistemik steroid tedavisinden flutikazon furoata geçirilirken dikkatli olunmalıdır.
Görme bozukluğu
Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Bir hasta bulanık görme veya diğer görme bozuklukları gibi semptomlarla başvurursa, hastanın sistemik ve topikal kortikosteroidlerin kullanımından sonra bildirilmiş katarakt, glokom veya santral seröz koryoretinopati (CSCR) gibi nadir hastalıkları içerebilecek olası nedenlerin değerlendirilmesi için bir oftalmoloji uzmanına sevki düşünülmelidir.
Büyüme geriliği
Ruhsatlı dozlarda nazal kortikosteroid alan çocuklarda büyüme geriliği bildirilmiştir. Bir yıl boyunca günde bir kez 110 mikrogram flutikazon furoat ile tedavi edilen çocuklarda büyüme hızında bir azalma gözlenmiştir (Bkz. Bölüm 4.8 ve 5.1). Bu nedenle çocuklar yeterli semptom kontrolü sağlayan en düşük olası etkili dozda idame ettirilmelidir (Bkz. Bölüm 4.2). Nazal kortikosteroidlerle uzun süreli tedavi alan çocukların büyümesinin düzenli olarak izlenmesi önerilir. Büyüme yavaşlarsa, mümkün olduğunda nazal kortikosteroid dozunun semptomların etkili kontrolünün sürdürüldüğü en düşük doza azaltılması amacıyla tedavi gözden geçirilmelidir. Buna ilaveten, hastanın bir pediyatri uzmanına sevk edilmesi düşünülmelidir (Bkz. Bölüm 5.1).
Ritonavir kullanan hastalar
Artmış sistemik flutikazon furoat maruziyeti riskinden dolayı ritonavir ile eşzamanlı uygulama önerilmemektedir (Bkz. Bölüm 4.5).
FIXRIVA benzalkonyum klorür içerir. Bu nedenle iritan, deri reaksiyonlarına sebep olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
CYP3A inhibitörleri ile etkileşim
Flutikazon furoat, karaciğerdeki sitokrom P450 3A4 izoenzimi tarafından gerçekleştirilen ilk geçiş metabolizmasıyla dolaşımdan hızla temizlenir.
CYP3A4 tarafından metabolize edilen başka bir glukokortikoidin (flutikazon propiyonat) elde edilen verilere dayalı olarak, ritonavir ile eşzamanlı uygulama, flutikazon furoata artmış sistemik maruziyet riski nedeniyle önerilmemektedir.
Sistemik yan etki riskinde bir artış beklendiğinden, flutikazon furoatın, kobisistat içeren ürünler dahil olmak üzere potent CYP3A inhibitörleri ile eşzamanlı uygulanması sırasında dikkatli olunması önerilmektedir. Fayda, sistemik kortikosteroid yan etkileri riskindeki artıştan daha ağır basmadıkça eşzamanlı uygulamadan kaçınılmalıdır; eşzamanlı uygulama durumunda hastalar sistemik kortikosteroid yan etkileri açısından takip edilmelidir. İntranazal flutikazon furoat ile potent CYP3A4 inhibitörü ketokonazolün incelendiği bir ilaç etkileşimi çalışmasında, plasebo (20 gönüllünün 1'inde) ile karşılaştırıldığında ketokonazol grubunda (20 gönüllünün 6'sında) ölçülebilir flutikazon furoat konsantrasyonlarının olduğu gönüllü sayısı daha fazla olmuştur. Maruziyetteki bu küçük artış, iki grup arasında 24 saatlik serum kortizol düzeylerinde istatistiksel olarak anlamlı bir farklılığa yol açmamıştır.
Enzim inhibisyonu ve indüksiyonu verilerine göre klinikte kullanılan dozlarda flutikazon furoat ile diğer bileşiklerin sitokrom P450 enzimleri tarafından gerçekleştirilen metabolizmaları arasında teorik olarak ilaç-ilaç etkileşimi beklenmez. Bu nedenle flutikazon furoatın diğer ilaçlar üzerindeki etkilerini araştırmak için klinik çalışmalar yürütülmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Bu yaş grubunda herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
Bu yaş grubunda herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Veri bulunmamaktadır.
Gebelik dönemi
Flutikazon furoatın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik, / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Hayvan çalışmalarında glukokortikoidlerin yarık damak ve intrauterin büyüme geriliği dahil malformasyonları indüklediği gösterilmiştir. Bu durum, minimum sistemik maruziyetle sonuçlanan önerilen nazal dozlar verilen insanlar için ilişkili değildir (Bkz. Bölüm 5.2).
Flutikazon furoat hamilelik sırasında yalnızca anne adayında elde edilmesi beklenen faydalar, fetusun karşılaşabileceği risklerden fazlaysa kullanılmalıdır.
FIXRIVA gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Nazal olarak uygulanan flutikazon furoatın anne sütüyle atılıp atılmadığı bilinmemektedir.
Emziren kadınlarda flutikazon furoat kullanımı, yalnızca annede elde edilmesi beklenen fayda çocukta oluşturduğu herhangi bir olası risklerden fazla olduğunda düşünülmelidir.
Üreme yeteneği/Fertilite
İnsanlarda fertilite verisi bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
FIXRIVA'nın araç veya makine kullanma yeteneği üzerinde bir etkisi yoktur ya da önemsiz düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Flutikazon furoat tedavisi sırasında en yaygın bildirilen advers reaksiyonlar epistaksis, nazal ülserasyon ve baş ağrısıdır. En ciddi istenmeyen etkiler seyrek olarak bildirilen anafilaksi dahil aşırı duyarlılık reaksiyonlarıdır (1000 hastada 1 vakadan daha az).
Advers reaksiyonların listesi
Flutikazon furoatın güvenlilik ve etkililik çalışmalarında mevsimsel ve pereniyal alerjik rinit için tedavi gören 2700'den fazla hasta yer almıştır. Flutikazon furoatın güvenlilik ve etkililik çalışmalarında mevsimsel ve pereniyal alerjik rinitte pediyatrik maruziyet, 12 ila <18 yaşta 243 hasta, 6 ila <12 yaşta 790 hasta ve 2 ila <6 yaşta 241 hasta olmuştur.
Advers reaksiyonlarının sıklığını belirlemek amacıyla, büyük klinik çalışmalarda elde edilen veriler kullanılmıştır. Advers olay sıklığı, aşağıdaki gibi değerlendirilmiştir:
Çok yaygın (≥1/10); yaygın (≥ 1/100, <1/10); yaygın olmayan (≥ 1/1.000, <1/100); seyrek (≥1/10.000, <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Seyrek: Anaflaksi, anjiyoödem, deri döküntüsü ve ürtikeri de kapsayan aşırı duyarlılık reaksiyonları,
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Göz hastalıkları
Bilinmiyor: Gözle ilgili geçici değişiklikler (Bkz. Bölüm 5.1), bulanık görme (Bkz. Bölüm 4.4)
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok yaygın: Burun kanaması*
Yaygın: Nazal ülserasyon, dispne**
Yaygın olmayan: Rinalji, burun rahatsızlıkları (burunda yanma, burunda tahriş ve burunda ağrı gibi), burun kuruluğu
Çok seyrek: Nazal septal perforasyon
Bilinmiyor: Bronkospazm
*Burun kanaması, genellikle hafif-orta şiddette olmuştur. Burun kanamasının yetişkinlerdeki ve ergenlerdeki insidansı uzun süreli (>6 hafta) kullanımda, kısa süreli (≤6 hafta) kullanıma kıyasla daha yüksek olmuştur. Pediatrik hastalarda yapılan süresi 12 haftaya varan çalışmalardaki burun kanaması insidansı, flutikazon furoat veya plasebo kullanan hastalarda birbirine yakın bulunmuştur.
**Flutikazon furoat ile yapılan klinik çalışmalar sırasında hastaların %1'inden fazlasında
dispne vakaları bildirilmiştir; benzer oranlar plasebo gruplarında da gözlenmiştir.
Kas iskelet bozuklukları, bağ doku ve kemik hastalıkları
Bilinmiyor: Çocuklarda büyüme geriliği*** (Bkz. Bölüm 5.1)
***Puberte öncesi günde bir kez 110 mikrogram flutikazon furoat kullanan çocuklarda büyümeyi değerlendiren bir yıllık klinik çalışmada, plasebo ile karşılaştırıldığında ortalama yıllık büyüme hızı farkı-0.27 cm olarak gözlenmiştir. (Bkz. Bölüm 5.1)
Pediyatrik popülasyon
6 yaşın altındaki çocuklarda güvenlilik tam olarak belirlenmemiştir. Pediyatrik popülasyonda gözlemlenen advers reaksiyonların sıklığı, tipi ve ciddiyeti yetişkin popülasyondakilere benzerdir.
Sistemik etkiler
Nazal kortikosteroidlerin sistemik etkileri özellikle uzun periyotlarda yüksek dozlarda reçete edildiğinde meydana gelebilir (Bkz. Bölüm 4.4). Nazal kortikosteroidleri alan çocuklarda büyüme geriliği bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Bir biyoyararlanım çalışmasında, günde 2640 mikrograma varan intranazal dozların 3 gün içerisinde kullanılmasına eşlik eden hiçbir advers sistemik etki gözlenmemiştir (Bkz. Bölüm 5.2). Akut doz aşımının, hastanın gözlem altında tutulmasının dışında genellikle herhangi bir tedavi gerektirmez.
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Neutec İlaç San. Tic.A.Ş.
| Satış Fiyatı | 93.85 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 93.85 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8697936544610 |
| Etkin Madde | Flutikazon Furoate |
| ATC Kodu | R01AD12 |
| Birim Miktar | 27.5 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 120 |
| Solunum Sistemi > Topikal Dekonjestanlar ve Diğer Nazal İlaçlar > Flucticasone furoate |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |