FLIXOTIDE diskus 250 mcg 60 doz diskus Kısa Ürün Bilgisi
{ Flutikazon Propiyonat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FLIXOTIDE Diskus 250 mcg inhalasyon için toz
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her uygulamada:
Flutikazon propiyonat (INN) 250 mikrogram
Yardımcı maddeler
Laktoz (inek sütünden elde edilir.) 12,5 mg
3. FARMASÖTİK FORMU
İnhalasyon için toz
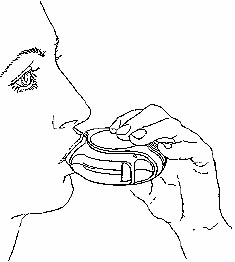
İçine çekme
İçine çekme
İlacı içinize çekmeden önce bu bölümü dikkatli bir şekilde okuyunuz.
Diskus'u ağzınızdan uzakta tutunuz. Nefesinizi rahatça yapabildiğiniz kadar dışarı veriniz. Unutmayınız – asla Diskus'un içine nefes vermeyiniz.
Ağızlığı dudaklarınıza yaslayınız. Devamlı ve derin bir nefes alınız - nefesi burnunuzdan değil Diskus'un içinden alınız.
Diskus'u ağzınızdan uzaklaştırınız.
10 saniye veya rahatça tutabildiğiniz kadar uzun bir süre nefesinizi tutunuz. Yavaşça nefes veriniz.
DISKUS'u doğru şekilde kullanmış olsanız da dilinizde tozu hissetmeyebilirsiniz veya tadını alamayabilirsiniz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astımın tüm basamaklarında antienflamatuar, bronkodilatör, semptom kontrolü ve oral steroid ihtiyacını azaltmak amaçlı kullanılır. FLIXOTIDE, uzun etkili bronkodilatörlerle (örn. uzun etkili beta agonistleri (LABAs)) birlikte kullanıldığında KOAH tedavisinde endikedir.
KOAH'ta monoterapi olarak kullanılması önerilmez.
4.2. Pozoloji ve uygulama şekli
Hastalar inhale FLIXOTIDE tedavisinin profilaktik özelliğinden haberdar olmalı ve belirtileri olmadığında dahi düzenli kullanmaları gerektiği konusunda uyarılmalıdır.
Astım
Terapötik etki 4-7 günde başlar, ancak daha önceden inhale steroid almamış olan hastalarda 24 saat içinde belirli bir düzelme görülebilir.
Eğer hasta, kısa etki süreli bronkodilatörlerin daha az etkili olmaya başladığını fark ederse veya normalden daha fazla inhalasyona ihtiyaç duyuyorsa bir doktora danışılmalıdır.
Yetişkinler ve 16 yaş üzeri çocuklar: Günde 2 kez 100-1000 mikrogram.
Hastalara hastalığın şiddetine uygun inhale FLIXOTIDE başlangıç dozu verilmelidir: Hafif astım: Günde 2 kez 100-250 mikrogram
Orta şiddetli astım: Günde 2 kez 250-500 mikrogram
Şiddetli astım: Günde 2 kez 500-1000 mikrogram (yüksek doz inhale kortikosteroid tedavisi, astım tedavisinde deneyimli hekimler taraf ından reçete edilmelidir.)
Doz daha sonra, bireysel yanıtlara göre kontrol sağlanana kadar ayarlanabilir veya etkili en düşük doza indirilebilir.
Alternatif olarak, flutikazon propiyonatın başlangıç dozu toplam günlük beklometazon dipropiyonat dozunun yarısı olacak şekilde veya ölçülü dozlu inhalerle verilen doza eşdeğer olacak şekilde hesaplanabilir.
4.3. Kontrendikasyonlar
İlacın bileşenlerinden herhangi birine karşı aşırı duyarlılığı olanlarda veya şiddetli süt proteini alerjisi olanlarda kontrendikedir (bkz. Bölüm 6.1).
4.4. Özel kullanım uyarıları ve önlemleri
Astım tedavisinde kademeli bir program uygulanmalı ve hastanın yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir.
Akut astım belirtilerini kontrol etmek için kullanılmaz. Akut astım belirtilerini kontrol etmek için kısa etkili inhale beta-agonistlerin kullanımının artması, astım kontrolünün bozulduğunu gösterir. Böyle bir durumda hastanın tedavi planı yeniden gözden geçirilmelidir.
Astım kontrolünde ani olarak meydana gelen ve ilerleyen kötüleşmeler potansiyel olarak yaşamı tehdit edicidir ve böyle bir durumda kortikosteroid dozunun artırılması göz önünde bulundurulmalıdır. Risk altında olduğu düşünülen hastaların günlük doruk akım ("peak flow") değeri izlenebilir.
FLIXOTIDE akut astım atakları için değil, rutin uzun süreli tedavide kullanılmak içindir. Akut astım belirtilerini gidermek için hastaların hızlı ve kısa etkili inhale bronkodilatöre ihtiyaçları olacaktır. Hastalara bu kurtarma ilaçlarını bulundurmaları tavsiye edilmelidir.
Şiddetli astım, solunum fonksiyon testleri dahil, düzenli medikal takip gerektirir, çünkü hastalarda şiddetli atak ve ölüm riski bulunmaktadır. Akut astım belirtilerini kontrol etmek için kısa etkili inhale beta2-agonistlerin kullanımının artması, astım kontrolünün bozulduğunu gösterir. Hastalara, kısa etkili kurtarıcı bronkodilatör tedavisinin etkisinin azaldığını hissetiklerinde veya normalden daha fazla inhalasyona ihtiyaç duyduklarında, doktorlarına danışmaları gerektiği belirtilmelidir. Bu gibi durumlarda hastalar yeniden değerlendirilmeli ve anti-inflamatuvar tedavinin artırılması (örn. inhale kortikosteroid dozunun artırılması veya oral kortikosteroid kürü) düşünülmelidir. Şiddetli astım alevlenmeleri normal şekilde tedavi edilmelidir.
Diğer inhalasyon tedavilerinde olduğu gibi uygulamadan sonra ani ortaya çıkan hırıltılı solunumla birlikte paradoksal bronkospazm oluşabilir. Bu durum hızlı etkili inhale bronkodilatörlerle hemen tedavi edilmelidir. FLIXOTIDE kullanımı hemen kesilmeli, hasta kontrol edilmeli ve gerekirse alternatif tedavi uygulanmalıdır.
Yanıt eksikliği veya şiddetli astım alevlenmeleri inhale FLIXOTIDE dozu artırılarak ve gerekli olduğunda sistemik steroid ve/veya enfeksiyon varsa antibiyotik kullanılarak tedavi edilmelidir.
Herhangi bir inhale kortikosteroid ile, özellikle uzun süre yüksek dozda uygulandığında, sistemik etkiler oluşabilir; bu etkilerin oluşma olasılığı oral kortikosteroidlere göre daha azdır (bkz. Bölüm 4.9). Olası sistemik etkilere Cushing sendromu, Cushingoid özellikler, adrenal supresyon, çocuklarda ve adolesanlarda büyümede gecikme, kemik mineral dansitesinde
azalma, katarakt, glokom ve santral seröz korioretinopati ile daha seyrek olarak psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon ya da agresyonu (özellikle çocuklarda) içeren psikolojik ya da davranışsal etkiler dahildir. Bu nedenle, inhale kortikosteroid dozunun etkili kontrolün sağlandığı en düşük doza titre edilmesi önemlidir (bkz. Bölüm 4.8).
Uzun süreli ve yüksek doz inhale kortikosteroid uygulaması adrenal supresyon ve akut adrenal krize yol açabilir. Onaylı dozdan yüksek doz flutikazon propiyonat kullanan (tipik olarak ≥1000 mikrogram/gün) 16 yaşın altındaki çocuklar özellikle risk altındadır. Akut adrenal krizi tetikleme potansiyeli olan durumlar travma, cerrahi, infeksiyon ya da dozun ani azaltılmasını içerir. Semptomlar tipik olarak belirgin olmayıp anoreksi, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, bilinç bulanıklığı, hipoglisemi ve nöbetleri içerir. Stres ya da elektif cerrahi periyotlarında ek sistemik kortikosteroid desteği düşünülmelidir.
Uzun süreli inhale kortikosteroid tedavisi gören çocukların boylarının düzenli olarak izlenmesi önerilmektedir. Büyüme yavaşladığında, inhale kortikosteroid dozunun azaltılması amacıyla tedavi gözden geçirilmeli ve astım kontrolünü etkili biçimde sağlayan en düşük doza düşürülmelidir. Ek olarak, hastanın pediyatrik solunum hastalıkları uzmanına sevk edilmesi düşünülmelidir.
Kuru toz inhalerden ölçülü doz inhalere geçerken, ağız ve boğazdaki yan etkileri azaltmak için, yüksek dozların (günde 1000 mcg'nin üzeri) bir ara inhalasyonu cihazı ile uygulanması önerilmektedir. Bununla birlikte, bu durum akciğerlere iletilen ilacın miktarını artırabilir. Sistemik absopsiyonun büyük oranda akciğerler ile olması nedeniyle, sistemik yan etkilerin riskinde bir artış olabilir. Daha düşük bir doz gerekebilir.
İnhale flutikazon propiyonatın yararları oral steroid ihtiyacını en aza indirmelidir. Buna karşın, oral steroidlerden geçiş yapan hastalar inhale flutikazon propiyonata geçiş yaptıktan sonra önemli bir süre boyunca bozulmuş adrenal rezerv açısından risk altında olmaya devam eder. Advers etkilerin olasılığı bir süre daha devam edebilir. Bu hastalar, elektif prosedürlerden önce adrenal bozukluğun boyutunu belirlemek için özel danışmaya ihtiyaç duyabilir. Rezidüel bozulmuş adrenal yanıtın olasılığı acil durumlarda (tıbbi veya cerrahi) ve strese yol açabilecek elektif durumlarda mutlaka göz önünde bulundurulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir.
Bazı bireyler birçok hastaya göre inhale kortikosteroid etkilerine karşı daha fazla duyarlılık gösterebilir.
FLIXOTIDE ile tedavi aniden kesilmemelidir.
Diabetes mellitus öyküsü olan ya da olmayan hastalarda çok nadir kan glukoz düzeylerinde artış bildirilmiştir (bkz. Bölüm 4.8) ve diabetes mellitus hikayesi olan hastalara reçete edilirken bu durum göz önünde bulundurulmalıdır.
Tüm inhale kortikosteroidlerde olduğu gibi, aktif veya pasif pulmoner tüberkülozu olan hastalara özel dikkat gösterilmelidir.
Pazarlama sonrası kullanım sırasında flutikazon propiyonat ve ritonavir alan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemik kortikosteroid etkilere neden olan klinik olarak önemli ilaç etkileşimleri bildirilmiştir. Bu nedenle hastaya sağlayacağı
potansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazla değilse flutikazon propiyonat ve ritonavirin birlikte kullanımından kaçınılmalıdır (bkz. Bölüm 4.5).
Adrenal yanıt bozukluğu ihtimali ameliyat dahil acil durumlarda ve stres yaratabilecek elektif durumlarda, özellikle uzun süre boyunca yüksek dozlar kullanan hastalarda, daima akılda tutulmalı ve mevcut klinik duruma uygun ek kortikosteroid tedavisi düşünülmelidir ( bkz. Bölüm 4.9).
FLIXOTIDE tedavisinin önerilen dozlarında adrenal fonksiyon ve adrenal rezerv genellikle normal sınırlarda kalır. İnhale FLIXOTIDE tedavisinin faydası oral steroid ihtiyacını en aza indirmektir. Bununla birlikte bazı hastalarda oral steroidlerle aralıklı ve önceden yapılmış tedaviler sonucu advers etkilerin oluşma olasılığı bir süre için devam edebilir. Adrenal bozukluğun boyutu, elektif prosedürlerden önce uzman tavsiyesi gerektirebilir. Adrenal yanıt bozukluğu ihtimali stres yaratma ihtimali olan ameliyat dahil acil durumlarda daima akılda tutulmalı ve uygun kortikosteroid tedavisi düşünülmelidir.
KOAH hastalarında pnömoni:
Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.
Kortikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır.
Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatli olmalıdırlar.
KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır.
Oral kortikosteroid ile tedavi edilen hastanın FLIXOTIDE tedavisine geçirilmesi:
Oral kortikosteroide bağımlı hastalarda FLIXOTIDE tedavisine geçişte dikkatli olunmalıdır. Uzun süreli sistemik steroid tedavisinin neden olduğu adrenokortikal işlev bozukluğunun düzelmesi zaman alabilir.
Uzun süreli ve yüksek doz sistemik steroid kullanan hastalarda adrenokortikal supresyon gelişebilir. Bu hastalarda adrenokortikal işlev düzenli izlenmeli ve sistemik steroid dozu dikkatli biçimde azaltılmalıdır.
Yaklaşık bir hafta sonra sistemik steroid dozu azaltılmaya başlanmalıdır. Doz azaltılması sistemik steroidin idame dozuna uygun olmalı ve haftalık aralıklarla azaltılmalıdır. Genel olarak, günlük 10 mg veya daha az prednizolon (ya da eşdeğeri) idame dozu azaltılırken en az haftalık aralıklarla, en fazla günde 1 mg olarak azaltılmalıdır. Günlük prednizolon idame dozunun 10 mg'ın üzerinde olduğu durumlarda haftalık aralıklarla daha fazla doz azaltılması uygun olabilir.
Adrenal yanıt bozukluğu olasılığından dolayı oral steroid tedavisinden inhale FLIXOTIDE tedavisine geçen hastalar özel dikkat gösterilerek tedavi edilmeli ve adrenokortikal fonksiyonları düzenli olarak izlenmelidir.
Bazı hastalar tedavi kesilmesi sırasında solunum işlevlerinin düzelmesine karşın kendini iyi hissetmeyebilir. Adrenal yetmezliğe ilişkin nesnel belirti bulunmuyor ise, hastalar flutikazon propiyonat tedavisine devam edip sistemik steroidi kesme konusunda desteklenmelidir.
İnhale FLIXOTIDE tedavisine başlamayı takiben sistemik tedavinin bırakılması kademeli olmalıdır ve hastalar astım ataklarının kötüleşmesi, göğüs enfeksiyonu, majör hastalık, cerrahi ve travma gibi stres oluştuğunda ek tedaviye ihtiyaçları olabileceğini belirten uyarıcı steroid kartı taşımaları konusunda teşvik edilmelidir.
Benzer olarak sistemik steroid tedavisinin inhale tedavi ile yer değiştirmesi, önceden sistemik ilaç tarafından kontrol edilen, alerjik rinit veya egzama gibi alerjilerin ortaya çıkmasına neden olabilir. Bu alerjiler antihistaminik ve/veya topikal steroidler dahil topikal preparatlarla semptomatik olarak tedavi edilmelidir.
FLIXOTIDE Diskus, bazı sporcular tarafından suistimal edilen ve tablet veya enjeksiyon yoluyla alınan anabolik steroidler gibi steroidlerle karıştırılmamalıdır.
Görme bozukluğu
Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Eğer hasta bulanık görme veya diğer görme bozuklukları gibi semptomlarla başvurursa, sistemik ve topikal kortikosteroidlerin kullanımından sonra bildirilmiş katarakt, glokom veya santral seröz koryoretinopati (CSCR) gibi nadir hastalıkları içerebilecek olası nedenlerin değerlendirilmesi için hastanın bir oftalmoloji uzmanına sevki düşünülmelidir.
Ritonavir, plazmadaki flutikazon propiyonat konsantrasyonunu önemli miktarda artırabilir. Bu nedenle, hastaya olan olası yarar sistemik kortikosteroidlere bağlı yan etkilerin riskinden fazla değilse birlikte kullanımından kaçınılmalıdır. Ek olarak, flutikazon propiyonatın diğer potent CYP3A inhibitörleri ile kombine edilmesi durumunda sistemik yan etkilerin riski artar (bkz. Bölüm 4.5).
Yardımcı maddeler
FLIXOTIDE Diskus'un her bir dozu 12,5 miligrama kadar laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Karaciğer ve bağırsakta gerçekleşen sitokrom P450 3A4 aracılı geniş ölçüdeki ilk geçiş metabolizması ve yüksek sistemik klerens nedeniyle normal şartlarda flutikazon propiyonatın plazma konsantrasyonları inhale dozu takiben düşük olur. Bu nedenle, flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimleri beklenmemektedir.
Sağlıklı gönüllülerle yapılan bir ilaç etkileşim çalışmasında, 100 mg b.i.d. ritonavirin (yüksek derecede güçlü sitokrom P450 3A4 inhibitörü) intranasal uygulanan flutikazon propiyonatın plazma konsantrasyonlarını büyük ölçüde arttırdığı ve bunun da serum kortizol konsantrasyonlarında belirgin derecede azalmaya neden olduğu gösterilmiştir. Pazarlama
sonrası kullanım sırasında intranazal veya inhalasyon yolu ile flutikazon propiyonat ve ritonavir alan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemik kortikosteroid etkilere yol açan klinik olarak önemli ilaç etkileşimleri bildirilmiştir. Bu nedenle, hastaya sağlayacağı potansiyel fayda sistemik kortikosteroid yan etki riskinden fazla olmadıkça, flutikazon propiyonat ve ritonavirin birlikte kullanımından kaçınılmalıdır.
Sağlıklı gönüllülerle yapılan küçük bir çalışmada, hafifçe daha az potent bir CYP3A inhibitörü olan ketokonazol, tek inhalasyonun ardından flutikazon propiyonatın maruziyetini
%150 artırmıştır. Tek başına flutikazon propiyonat uygulamasına kıyasla plazma kortizol düzeyi daha fazla düşmüştür. Itrakonazol gibi diğer güçlü CYP3A inhibitörleri ile eş zamanlı tedavinin, sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini artırması beklenir. Bu duruma karşı dikkatli olunmalı ve bu tür ilaçlarla uzun süreli tedaviden mümkün olduğunca kaçınılmalıdır.
Kobisistat içeren ürünler dahil diğer güçlü CYP3A4 inhibitörleriyle birlikte kullanımının yan etki riskini artırması beklenmektedir.
Diğer sitokrom CYP3A4 inhibitörleri, serum kortizol konsantrasyonlarında dikkate değer bir azalma olmadan sistemik flutikazon propiyonat maruziyetinde önemsiz (eritromisin) ve minör (ketokonazol) artışlara neden olur. Buna karşın, flutikazon propiyonata karşı sistemik maruziyette artış olasılığı nedeniyle, güçlü sitokrom P450 3A4 inhibitörlerinin (örneğin, ketokonazol) birlikte kullanım durumunda dikkatli olunmalıdır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi:C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) FLIXOTIDE'ın çocuk doğurma potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimi bildirilmemiştir.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
FLIXOTIDE gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Gebe kadınlarda kullanıma ilişkin sınırlı veri mevcuttur. Gebelik döneminde flutikazon propiyonatın kullanımı yalnızca anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir.
Retrospektif bir epidemiyolojik çalışmadan elde edilen sonuçlarda, diğer inhale kortikosteroidlerle karşılaştırıldığında, gebeliğin ilk trimesteri süresince flutikazon propiyonata maruziyeti takiben majör konjenital malformasyon riskinde bir artış bulunmamıştır (bkz. Bölüm 5.1).
Hayvanlarda yapılan üreme çalışmaları, önerilen inhale terapötik dozda görülen lerden daha fazla sistemik maruziyetlerde sadece glukokortikosteroidlerin karakteristik etkilerini göstermiştir.
Gebe hayvanlara kortikosteroid uygulanması yarık damak ve intra-uterin büyüme geriliği dahil fetal gelişim anormalliklerine neden olabilir. Çok düşük de olsa bu gibi etkilerin insan fetusunda görülme riski bulunmaktadır. Ancak, hayvanlarda fetal değişikliklerin yüksek sistemik maruziyetlerde gerçekleştiği göz önünde bulundurulmalıdır. Flutikazon propiyonat, FLIXOTIDE aracılığıyla direkt olarak akciğerlere iletildiğinden, kortikosteroidlerin sistemik yollardan verildiği durumlarda oluşan yüksek seviyedeki maruziyet gerçekleşmemektedir.
Laktasyon dönemi
Flutikazon propiyonatın anne sütü ile atılımı araştırılmamıştır. Laktasyondaki laboratuvar sıçanlarında subkütan uygulamayı takiben ölçülebilir plazma seviyesi sağlandığında, anne sütünde flutikazon propiyonat varlığı kanıtlanmıştır. Bununla birlikte, flutikazon propiyonatın hastalara önerilen dozlarda inhalasyon şeklinde uygulamasını takiben plazma seviyelerinin düşük olması beklenir.
Emzirme döneminde flutikazon propiyonatın kullanımı yalnızca anneye sağlaması beklenen yararı bebeğe olan olası bir riskten fazla ise düşünülmelidir.
Üreme yeteneği/Fertilite
İnsan fertilitesine dair veri bulunmamaktadır. Hayvan çalışmaları flutikazon propiyonatın erkek veya dişi fertilitesi üzerinde etkisi olmadığını göstermiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
FLIXOTIDE'ın bir etki oluşturması olası değildir.
4.8. İstenmeyen etkiler
Aşağıdaki advers etkiler sistemik organ sistemi sınıfı ve sıklığa göre verilmiştir. Sıklık sınıflandırması şu şekildedir:
Çok yaygın (≥1/10), yaygın (≥1/100 ve <1/10), yaygın olmayan (≥1/1000 ve <1/100), seyrek
(≥1/10.000 ve <1/1000) ve izole raporlar dahil çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Çok yaygın, yaygın ve yaygın olmayan olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır.
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Ağızda ve boğazda kandidiyazis.
Bazı hastalarda ağızda ve boğazda kandidiyazis (pamukçuk) oluşur. Böyle hastaların ilaçlarını kullandıktan sonra ağızlarını su ile çalkalamaları yararlı olabilir. Semptomatik kandidiyazis, FLIXOTIDE kullanımına devam edilirken topikal antifungal ajanlarla tedavi edilebilir.
Yaygın: Pnömoni (KOAH'lı hastalarda)
Seyrek: Özefajiyal kandidiyazis
Bağışıklık sistemi hastalıkları
Aşağıdaki belirtilerle aşırı duyarlılık reaksiyonları bildirilmiştir:
Yaygın olmayan: Deride aşırı duyarlılık reaksiyonları
Çok seyrek: Anjiyoödem (başlıca yüzde ve orofarinkste ödem), solunum belirtileri (dispne ve/veya bronkospazm) ve anafilaktik reaksiyonlar
Endokrin hastalıkları
Olası sistemik etkiler şunları içermektedir:
Çok seyrek: Cushing sendromu, Cushingoid özellikler, adrenal supresyon, büyümede gecikme (çocuklarda ve adölesanlarda), kemik mineral yoğunluğunda azalma, katarakt, glokom
Göz hastalıkları
Bilinmiyor: Bulanık görme (bkz. Bölüm 4.4)
Metabolizma ve beslenme hastalıkları
Çok seyrek: Hiperglisemi
Psikiyatrik hastalıkları
Çok seyrek: Anksiyete, uyku bozuklukları ve hiperaktivite ve irritabilite dahil davranış değişiklikleri (genelde çocuklarda)
Bilinmiyor: Depresyon, agresyon (çoğunlukla çocuklarda)
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Yaygın: Ses kısıklığı
Çok seyrek: Paradoksal bronkospazm Bilinmiyor: Epistaksis
Gastrointestinal hastalıkları
Çok seyrek: Dispepsi
Deri ve derialtı dokusu hastalıkları
Yaygın: Kontüzyon
Kas iskelet bozukluklar, bağ doku ve kemik hastalıkları
Çok seyrek: Artralji
Bazı hastalarda ses kısıklığı ve ağız ve boğazda kandidiyaz (pamukçuk) oluşur. Bu gibi hastalar, inhaleri kullandıktan sonra ağızlarını suyla çalkaladıklarında fayda görebilir. FLIXOTIDE Diskus tedavisine devam edilirken semptomatik kandidiyaz topikal antifungal tedavi ile tedavi edilebilir.
Olası sistemik etkiler Cushing sendromu, Cushingoid özellikler, adrenal supresyon, büyümede gecikme, kemik mineral dansitesinde azalma, katarakt, glokom gibi etkileri içerir (bkz. Bölüm 4.4).
Diğer inhalasyon tedavisinde olduğu gibi, paradoksal bronkospazm oluşabilir (bkz. Bölüm 4.4). Bu durum hızlı etkili inhale bronkodilatörlerle hemen tedavi edilmelidir. FLIXOTIDE
Diskus kullanımı hemen kesilmeli, hasta kontrol edilmeli ve gerekirse alternatif tedavi uygulanmalıdır.
FLIXOTIDE 500 mcg alan KOAH hastalarında yapılan çalışmalarda pnömoni bildiriminde artış olmuştur. Pnömoni ve alevlenmenin klinik özellikleri sıklıkla örtüştüğünden , hekimler KOAH'lı hastalarda olası pnömoni gelişimine karşı dikkatli olmalıdır.
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Akut:
FLIXOTIDE'ın tavsiye edilen dozlarının üzerindeki dozlarda akut inhalasyonu adrenal fonksiyonların geçici supresyonuna neden olabilir. Bu durum acil önlem alınmasını gerektirmez; bu hastalarda flutikazon propiyonat tedavisi astımı kontrol edecek düzeyde sürdürülmelidir. Adrenal fonksiyonların birkaç gün içinde eski haline döndüğü plazma kortizolü ölçülerek saptanabilir.
Uzun süreli olarak önerilenden daha yüksek dozlarda kullanılırsa, ciddi adrenokortikal supresyon olabilir. Uzun süreli olarak (birkaç ay veya yıl) önerilenden daha yüksek dozlara (genellikle günde 1000 mikrogram ve daha fazla) maruz kalan çocuklarda çok seyrek olarak akut adrenal kriz rapor edilmiştir; hipoglisemi ve sekel bırakan azalmış bilinç ve/veya konvülziyon görülmüştür. Akut adrenal krizi tetikleyebilecek durumlara travma, cerrahi girişim, enfeksiyon veya dozda herhangi bir hızlı azalma dahildir.
Kronik:
Önerilenin üzerindeki dozların alınmasına uzun süre devam edilirse bir miktar adrenal supresyon oluşabilir (adrenal supresyon riski için bkz. Bölüm 4.4). Adrenal rezervin izlenmesi gerekebilir. FLIXOTIDE aşırı doz vakalarında tedaviye semptom kontrolünü sağlayan uygun dozlarda devam edilebilir.
Önerilenden fazla doz alan hastalar yakından kontrol edilmeli ve doz kademeli olarak azaltılmalıdır.
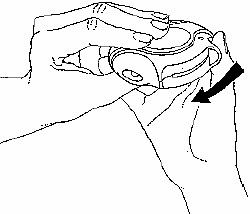
Kapatma
Kapatma
Diskus'u kapatmak için baş parmağınızı baş parmak yerine koyup geriye kendinize doğru sonuna kadar kaydırınız.
Diskus kapanınca bir “klik†sesi duyulur. Hareket kolu otomatik olarak eski yerine döner ve yeniden kurulur. Diskus yeniden kullanıma hazır hale gelmiştir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: kortikosteroidler ATC Kodu: R03BA05
Etki mekanizması:
Flutikazon propiyonat inhalasyon yoluyla tavsiye edilen dozlarda verildiğinde akciğerlerde güçlü bir glukokortikoid anti-enflamatuvar etki göstererek astım belirtilerini ve alevlenmelerini azaltır.
Yaşa, cinsiyete, başlangıç akciğer fonksiyonlarına, sigara içme veya alerji durumuna bağlı olmaksızın akciğer fonksiyonlarında iyileşme sağlar. Bu durum yaşam kalitesinde belirgin bir artışa yol açar.
Klinik Çalışmalar KOAH:
Hasta yaşı, cinsiyet, başlangıç akciğer fonksiyonu, sigara içme durumu veya atopi durumundan bağımsız olarak; yaşam kalitesinde anlamlı iyileşme ile sonuçlanabilecek akciğer fonksiyonunda iyileşme ve KOAH semptomlarında anlamlı azalma sözkonusudur.
TORCH çalışması:
TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru): TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram Seretide Diskus, günde 2 kez 50 mikrogram salmeterol Diskus, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) Diskus veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkis ini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç (bronkodilatörden önce) FEV'i beklenen normal değerin %60'ından az olan orta-şiddetli ve şiddetli KOAH hastaları çif t-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süredir kullanılan sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayattta kalma durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Primer sonlanım noktası, plaseboya kıyasla Seretide için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır.
| Plasebo N = 1524 | Salmeterol 50 N = 1521 | FP 500 N = 1534 | Seretide 50/500 N = 1533 |
3 yılda tüm nedenlere bağlı ölüm | ||||
Ölüm sayısı | 231 | 205 | 246 | 193 |
(%) | (%15,2) | (%13,5) | (%16,0) | (%12,6) |
Plaseboya karşı |
|
|
|
|
risk oranı | Geçerli değil | 0,879 | 1,060 | 0,825 |
(GA) |
| (0,73, 1,06) | (0,89, 1,27) | (0,68, 1,00) |
p değeri |
| 0,180 | 0,525 | 0,052 |
Risk oranı, | Geçerli değil | 0,932 | 0,774 | Geçerli değil |
komponentlerine |
|
|
|
|
karşı Seretide |
|
|
|
|
50/500 (GA) |
| (0,77, 1,13) | (0,64, 0,93) |
|
p değeri |
| 0,481 | 0,007 |
|
Seretide, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini %17,5 oranında azaltmıştır (Risk Oranı 0,825 (%95 GA 0,68, 1,00, p=0,052; tümü ara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamanda herhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile %12 azalma (p=0,180) ve FP ile %6 artış (p=0,525) olmuştur.
Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde %19 azalma gösteren Seretide için 0,811'lik (%95 GA 0,670, 0,982, p=0,031) bir risk oranı olduğunu göstermiştir. Model önemli faktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEV ve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur.
Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için %6,0, salmeterol için %6,1, FP için %6,9 ve Seretide için %4,7'dir.
Plaseboya kıyasla Seretide, orta şiddetli ve şiddetli alevlenmeleri %25 (%95 GA: %19 ve 31 arasında; p<0,001) oranında azaltmıştır. Seretide alevlenme oranını, salmeterol ile karşılaştırıldığında %12 (%95 GA: %5 ve %19 arasında; p=0,002), FP ile karşılaştırıld ığında da % 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla %15 (%95 GA: %7 ve %22 arasında; p<0,001) ve %18 (%95 GA: %11 ve %24 arasında; p<0,001) oranında azaltmıştır.
St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca Seretide ile sağlanan ortalama düzelme plaseboya kıyasla – 3,1 birim (%95 GA: -4,1 ve –2,1 arasında; p<0 ,001 ), salmeterole kıyasla – 2,2 birim (p<0,001) ve FP'ye kıyasla -1,2 birimdir (p=0,017).
Üç yıllık tedavi süresi boyunca, FEV değerleri Seretide ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 ml, %95 GA: 75 -108 ml; p<0,001). FEV'i düzeltmede Seretide salmeterolden veya FP'den daha etkilidir (salmeterol için ortalama fark 50 ml, p<0,001 ve FP için 44 mL'dir, p<0,001).
Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için %12,3, salmeterol için %13,3, FP için %18,3 ve Seretide için %19,6'dır (Seretide'ın plaseboya karşı risk oranı: 1,64, %95 GA: 1,33 ve 2,01 arasında, p<0,001). Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincil olarak pnömoniye bağlı oldukları düşünülen ölümler plasebo için 7, salmeterol için 9, FP için 13 ve Seretide için 8 olarak tespit edilmiştir. Kemik kırılma olasılığında anlamlı farklılık yoktur (plasebo %5,1, salmeterol %5,1, FP %5,4 ve Seretide %6,3; plaseboya karşı Seretide için risk oranı: 1,22, %95 GA: 0,87 ve 1,72 arasında, p=0,248). Göz bozuklukları, kemik bozuklukları ve hipotalamus-hipofiz-adrenal eksen bozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler arasında farklılık gözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur.
Gebelik sırasında astım için flutikazon propiyonat içeren ilaçların kullanımı
Flutikazon propiyonat içermeyen inhale kortikosteroidlerle karşılaştırıldığında tek başına flutikazon propiyonat ve salmeterol-flutikazon propiyonat kombinasyonunun majör konjenital malformasyon (MKM) riskini değerlendirmek için Birleşik Krallık'ta bulunan elektronik sağlık kayıtlarının kullanıldığı gözlemsel retrospektif epidemiyolojik kohort çalışma yürütülmüştür. Bu çalışmaya plasebo karşılaştırıcı dahil edilmemiştir.
Birinci trimesterde inhale kortikosteroid maruziyeti olan 5362 astım hastası kohortunda, tanı koyulan 131 MKM tespit edilmiştir; 1612'si (%30) flutikazon propiyonat veya salmeterol+flutikazon propiyonata maruz kalmış olup bunlardan 42'sinde MKM tespit edilmiştir. Flutikazon propiyonat maruziyeti olan kadınlar ile flutikazon propiyonat içermeyen inhale kortikosteroid maruziyeti olan kadınlar karşılaştırıldığında, 1 yıl sonunda tespit edilen
MKM'lerin ayarlanmış olasılık oranı, orta şiddette astımı olan kadınlar için 1,1 (%95 GA: 0,5-2,3), şiddetli astımı olan kadınlar için 1,2 (%95 GA: 0,7-2,0) olmuştur. Birinci trimesterde tek başına flutikazon propiyonat ile salmeterol+flutikazon propiyonat maruziyeti karşılaştırıldığında MKM riskinde fark tespit edilmemiştir. Farklı astım şiddet seviyeleri arasında mutlak MKM riski her 100 flutikazon propiyonat maruziyetinde 2,0 ile 2,9 arasında değişmiştir. Bu sonuç, Pratisyen Hekim Araştırma Veribankası'nda (General Practice Research Database) astım tedavisine maruziyeti olmayan 15.840 gebelikte yürütülen çalışmadan elde edilen sonuçlarla (100 gebelikte 2,8 MKM vakası) karşılaştırılabilir olmuştur.
5.2. Farmakokinetik özellikler
Genel Özellikler
Emilim:
Her bir inhaler cihazı için flutikazon propiyonatın mutlak biyoyararlanımı inhalasyon ve intravenöz farmakokinetik verilerin çalışma içerisinde ve çalışmalar arasında karşılaştırılma sı ile hesaplanmıştır. Sağlıklı erişkin deneklerde mutlak biyoyararlanım flutikazon propiyonat Accuhaler/Diskus (%7,8), flutikazon propiyonat Diskhaler (%9,0), flutikazon propiyonat Evohaler (%10,9), salmeterol-flutikazon propiyonat Evohaler (%5,3) ve salmeterol-flutikazon propiyonat Accuhaler/Diskus (5,5%) için belirlenmiştir. Astım ya da KOAH hastalarında flutikazon propiyonata sistemik maruziyetin daha az derecede olduğu görülmüştür. Sistemik absorpsiyon başlıca akciğerlerden gerçekleşir ve başlangıçta hızlı olup daha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşük çözünürlüğü ve %1'den daha az oral biyoyararlanımla sonuçlanan sistemik absorpsiyon öncesi metabolizmasından dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozun artırılmasıyla sistemik maruziyette doğrusal artış olur.
Dağılım:
Flutikazon propiyonat kararlı durumda geniş bir dağılım hacmine (yaklaşık 300 L) sahiptir. Plazma proteinlerine bağlanma oranı yüksektir (%91).
Biyotransformasyon:
Flutikazon propiyonat başlıca sitokrom P450 enzimi olan CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolize olarak sistemik dolaşımdan çok hızlı temizlenir. Flutikazon propiyonatın sistemik maruziyetinde artış potansiyeli olduğundan bilinen CYP3A4 inhibitörleri ile birlikte uygulanırken dikkat edilmelidir.
Eliminasyon:
Flutikazon propiyonatın dispozisyonu yüksek plazma klerensi (1150 ml/dak) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın renal klerensi ihmal edilebilir düzeydedir (%0,2'den az) ve metabolit olarak %5'ten azdır.
Doğrusallık/doğrusal olmayan durum:
Veri bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
Toksikoloji, sadece güçlü kortikosteroidlerin önerilen terapötik dozlardan çok daha yüksek dozlarda uygulandıklarında gösterdikleri tipteki sınıf etkileri şeklinde görülür. Mükerrer doz toksisite çalışmalarında, üreme çalışmalarında veya teratoloji çalışmalarında yeni bir etki tanımlanmamıştır.
Flutikazon propiyonatın in vitro ve in vivo olarak mutajenik aktivitesi yoktur ve kemirgenlerde tümorojenik etki göstermemiştir. Hayvan modelleri üzerinde iritan veya hassasiyet yaratıcı değildir.
Fare ve sıçanlarda sırasıyla 45 ve 100 mcg/kg'da (sırasıyla 486 ve 710 pg/ml fare ve sıçan plazma seviyelerine dayanarak yetişkinlerde günde iki kez 500 mcg olan maksimum önerilen günlük inhale dozun yaklaşık 4 ve 6 katına eşdeğer) yapılan subkutan embriyofetal gelişim çalışmaları, yarık damak ve embriyonik fetal büyüme geriliği dahil olmak üzere, maternal toksisiteye yol açan dozlarda bir potent kortikosteroidin fetal gelişimsel toksisite karakteristiğini göstermiştir. Sıçanlardaki bu bulgular için etki olmayan seviye, 310 pg/ml olan sıçan plazma seviyesine dayanarak en yüksek klinik maruziyetin yaklaşık 3 katı sistemik maruziyetlerle bağlantılı olmuştur. Tavşanlarda, fetal kilo azalması ve yarık damak oluşumu 4 mcg/kg olan maternal toksik subkutan dozda görülmüştür (149 pg/ml tavşan plazma seviyesine dayanarak günde iki kez 500 mcg olan maksimum önerilen günlük inhale dozun 1,4 katından daha az). Buna karşın, sıçanlara inhalasyon yoluyla uygulanan flutikazon propiyonat, 1890 pg/ml sıçan plazma seviyesine dayanarak maksimum önerilen günlük inhale doz ile insanlarda erişilen maruziyetin 17 katı maruziyetle bağlantılı maternal toksik dozlarda teratojenisiteyi indüklememiştir.
Erkek ve dişi sıçanlarda 50 mcg/kg/güne kadar subkutan flutikazon propiyonat dozlarında (günde iki kez önerilen maksimum günlük 500 mcg solunan dozla ilişkili insan maruziyetinin yaklaşık 6 katı (110 pg/mL), yaklaşık 650 pg/mL'lik sıçan plazma seviyelerine göre) fertilite çalışmalarında doğurganlığın bozulduğuna dair hiçbir kanıt görülmemiştir.
Ağzı çalkalama
Ağzı çalkalama
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz (inek sütünden elde edilmiştir.)
6.2. Geçimsizlikler
Herhangi bir geçimsizlik bildirilmemiştir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30C'nin altındaki oda sıcaklığında, kuru bir yerde saklanmalıdır.
Direkt ısıdan veya güneş ışığından uzak tutulmalıdır. Banyo gibi nemli ortamlarda saklanmamalıdır.
FLIXOTIDE Diskus folyo poşet ile ambalajlanmıştır ve folyo poşet yalnızca ilk kez kullanıma başlanacağı zaman açılmalıdır. Açıldıktan sonra folyo poşet atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
Toz haldeki flutikazon propiyonat ve laktoz karışımı şekil verilmiş folyodan oluşan ve soyulabilen folyo kapağı olan blister şeritlere doldurulmuştur.
Folyo şerit Diskus içinde bulunmaktadır. Diskus, folyo poşet ile ambalajlanmıştır.
FLIXOTIDE Diskus, her uygulamada 250 mikrogram flutikazon propiyonat salıveren 28 veya 60 dozluk bir cihazdır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
FLIXOTIDE Diskus'un kullanım talimatları:Diskus'la ilgili:
Diskus, folyo poşet ile ambalajlanmıştır. Folyo poşet neme karşı koruma sağlamaktadır ve yalnızca ilk kullanıma başlanacağı zaman açılmalıdır. Açıldıktan sonra folyo poşet atılmalıdır.
KAPALI:
Diskus'u kutusundan çıkardığınızda bir folyo ambalaj içinde ve kapalı durumda olacaktır.
AÇIK:
Kullanılmamış bir Diskus içinde 28 veya 60 dozluk ilaç bulunur. Doz göstergesi size Diskus içinde kaç doz kaldığını gösterir.
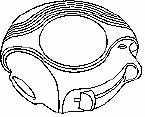
Diskus içinde korunmuş olarak 28 veya 60 ayrı doz ilaç toz halde bulunur.
Her bir doz tam olarak ölçülmüş olup hijyenik şartlara uygun olarak korunmaktadır. Bakıma ve yeniden doldurmaya gerek yoktur.
Diskus'un üst kısmındaki doz göstergesi size kaç doz kaldığını gösterir. İlaç miktarı azaldığında sizi uyarmak üzere 5-0 arasındaki rakamlar kırmızı renkte yazılmıştır.
Diskus'u kullanmak kolaydır. İlacı alacağınız zaman yapacaklarınız aşağıdaki beş basamakta gösterilmiştir:
Açma
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BRETHAL | 8699517520402 | |
| BRETICASONE | 8699606527107 | 109.41TL |
| CUTIVATE | 8699522385041 | 76.99TL |
| DALMAN | 8699580540017 | 140.79TL |
| FLIXAIR | 8680184520215 | 111.40TL |
| Diğer Eşdeğer İlaçlar |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A03065 |
| Satış Fiyatı | 164.09 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 164.09 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522553594 |
| Etkin Madde | Flutikazon Propiyonat |
| ATC Kodu | R03BA05 |
| Birim Miktar | 250 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 60 |
| Solunum Sistemi > Diğer İnhalanlar (solukla içeri çekilen ilaçlar) > Flutikazon |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |