FOREBEC 100 mcg/ 6 mcg inhilasyon tozu sert kapsül (120 kapsül) Kısa Ürün Bilgisi
{ Beklometazon Dipropiyonat + Formoterol Fumarat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FOREBEC 100 mcg/6 mcg inhalasyon tozu, sert kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir sert kapsül;
Etkin madde
Beklometazon dipropiyonat 100 mikrogram Formoterol fumarat dihidrat 6 mikrogram
Her inhalasyonda hastaya 81,9 mcg beklometazon dipropiyonat ve 5 mcg formoterol fumarat dihidrat ulaşır.
Yardımcı maddeler
Laktoz monohidrat (Inhalac 250) (sığır sütü kaynaklı) 11,9 mg Laktoz monohidrat (Inhalac 400) (sığır sütü kaynaklı) 2,9 mg
Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnhalasyon tozu, sert kapsül
Beyaz veya beyazımsı toz içeren şeffaf pembe kapsüller
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.
4.2. Pozoloji ve uygulama şekli
FOREBEC sadece inhalasyon yolu ile uygulanır.
Pozoloji/uygulama sıklığı ve süresi:
Astım
FOREBEC, astımın başlangıç tedavisine yönelik değildir.
FOREBEC ile tedavi bireyseldir ve tedavi dozu, hastalığın bireydeki şiddetine göre ayarlanmalıdır. Bu uygulama sadece kombinasyon tedavisi başlangıcında değil, doz ayarlaması sırasında da uygulanmalıdır. Eğer hasta, bu kombinasyon inhalerindeki dozlardan daha farklı tedavi dozlarına ihtiyaç gösteriyorsa, hastaya beta-agonistler ve/veya kortikosteroidlerin uygun dozunu içeren bireysel inhalerler reçetelenmelidir.
Ekstra ince olmayan partikül dağılımına sahip bir formülasyondan, FOREBEC tedavisine geçildiğinde, inhalerin ekstra ince partikül büyüklüğü dağılımından dolayı hastalarda doz
ayarlaması yapılması gereklidir. Hastaların daha önce almakta olduğu tedavi değiştirildiğinde, FOREBEC için önerilen günlük toplam beklometazon dipropiyonat dozunun beklometazon dipropiyonat içeren ve ekstra ince olmayan mevcut ürün için verilen dozun altında olmasına ve dozun her bir hastanın ihtiyacına göre ayarlanmasına dikkat edilmelidir. Ancak, beklometazon dipropiyonat/formoterol kombinasyonu basınçlı ölçülü doz inhaler tedavisinden, FOREBEC kuru toz inhaler tedavisine geçirilen hastalarda doz ayarlamasına gerek yoktur.
18 yaş ve üstü erişkinler için
FOREBEC ile idame tedavi: Düzenli idame tedavi olarak FOREBEC ile birlikte kurtarıcı nitelikte bir hızlı etkili bronkodilatör kullanılır.
Ayrı bir hızlı etkili bronkodilatör kullanımının gerekliliği her zaman göz önünde bulundurulmalı ve hastalar bu konuda bilgilendirilmelidir.
Günde bir ya da iki inhalasyon halinde uygulanır. Maksimum günlük doz dört inhalasyondur.
Bu hastalar tekrar değerlendirilmeli ve idame tedavileri tekrar gözden geçirilmelidir.
Hastalar, tedavinin etkililiği açısından doktor tarafından düzenli olarak değerlendirilmelidir. Böylece kullanılan FOREBEC dozu en uygun doz olarak devam eder ve yalnızca doktor tavsiyesiyle değiştirilir. Tedavi dozu, semptomların etkili bir şekilde kontrol edildiği en düşük doza ayarlanmalıdır. Semptomlar tavsiye edilen en düşük dozla kontrol edildiğinde, bir sonraki adım inhale kortikosteroidin tek başına kullanılması olabilir.
Hastalara, asemptomatik olduklarında dahi düzenli olarak önerilen dozdaki FOREBEC'i kullanmaları tavsiye edilmelidir.
KOAH:
Günde iki kez iki inhalasyon halinde uygulanır.
Uygulama şekli:
Tedavinin başarılı olması için inhalerinin doğru kullanılması gerekir. Hastalara “Kullanma Talimatıâ€nı dikkatli bir şekilde okumaları ve kullanım talimatlarına uymaları tavsiye edilmelidir.
Hastalar, inhaler cihazdan ilacı solurken mümkünse dik vücut pozisyonunda ayakta durmalı veya oturdukları durumda sırtlarını dik pozisyonda tutmalıdırlar.
Akciğerlere optimum doz ulaşmasını sağlayabilmek için doz ağızlığından hızlı ve derin bir nefes çekilmelidir. Doz solunduktan sonra nefesin 5-10 saniye veya hastanın kendini rahat
hissettiği süre boyunca tutulması ve sonrasında yavaşça burnundan nefes vermesi önerilmelidir.
Hastalar, soluma öncesinde veya sonrasında cihaz içine nefes vermemeleri konusunda -cihaz performansı etkileneceğinden- uyarılmalıdırlar.
Doz alımı sonrasında hastaların su ile ağızlarını çalkalamaları veya dişlerini fırçalamaları hatırlatılmalıdır (bkz. Bölüm 4.4).
İnhaler'in Kullanma Talimatları Ambalaj İçeriği
Bu ambalajda aşağıdakiler bulunmaktadır:
120 adet kapsül
Bir adet Monodoz inhaler kuru toz dolum cihazı
1 adet kullanma talimatı
Ambalaj içeriği bununla aynı değilse, inhaler onu tedarik eden kişiye iade edilmeli ve yenisi alınmalıdır.
Genel Uyarılar ve Önlemler
İnhaler yalnızca belirtildiği şekilde kullanılmalıdır.
Hasta doz solunmasından emin değilse, bir sonraki doz alımına dek beklenmeli ve bu normal şekilde alınmalıdır. Hasta fazladan doz almamalıdır.
İnhalerden bir doz alınması gerekene dek kapağı kapalı tutulmalıdır.
İnhaler kullanılmıyorken temiz ve kuru bir yerde saklanmalıdır.
Ne sebepten olursa olsun inhaler parçalara ayrılmamalıdır.
Aşağıdaki durumlarda inhaler kullanılmamalıdır:
Son kullanma tarihinden sonra
İnhaler cihazı kırıksa
Bu durumlarda, inhaler imha edilmeli ya da onu tedarik eden kişiye iade edilmelidir ve yenisi alınmalıdır.
Artık ihtiyaç duyulmayan inhalerlerin nasıl imha edildiğini hastanın eczacıya sorması için bilgilendirilmelidir.
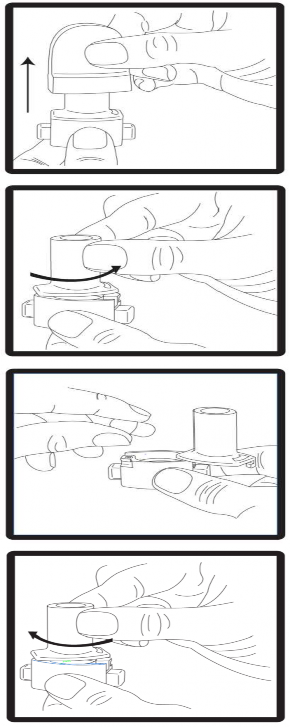
Kullanıma ilişkin talimatlar:
|
1. Kapak çekerek çıkartılmalıdır. |
|
2. Cihazın alt kısmı sıkıca tutulurken ağız parçası ok yönünde çevrilerek açılmalıdır. |
|
3. Kapsül, ambalajından kullanmadan hemen önce çıkartılmalıdır. Cihazın tabanındaki kapsül şeklindeki hazneye bir kapsül yerleştirilmelidir. |
|
4. Ağız parçasını kapalı konuma getirmek için çevrilmelidir. |
|
5. Cihaz dik tutulmalı (ağız parçası yukarıda olacak şekilde) ve kenardaki çıkıntılara eş zamanlı olarak SADECE BİR KEZ basılmalıdır. Bu şekilde kapsül delindikten sonra kenar çıkıntıları bırakılmalıdır. Lütfen dikkat: Bu işlem yapılırken kapsül parçalanabilir ve soluma sırasında küçük kapsül parçalarının ağız ve boğaza kaçma olasılığı vardır. Kapsül parçaları zararsızdır. Kapsülün kullanımdan hemen önce ambalajından çıkarılması ve kapsülü patlatmak için kenar çıkıntılarına sadece bir kez basılması kapsülün parçalanma riskini en aza indirir (bkz. 3. basamak). |
|
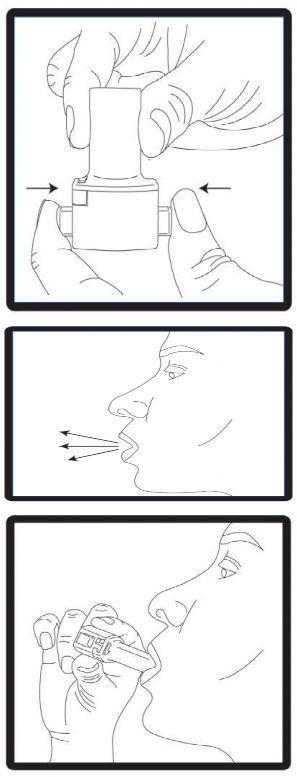
6. Nefes kuvvetlice dışarı verilmelidir. |
| 7. Ağız parçası ağza yerleştirilmeli ve baş hafifçe geriye eğilmelidir. Ağız parçası etrafında dudaklar sıkıca kapatılmalıdır ve olabildiğince hızlı ve derin bir nefes alınmalıdır. Toz dağılırken kapsülün bölmesinde dönmesinden kaynaklanan bir ‘‘vızıltı'' sesi duyulacaktır. Bu ses duyulmadıysa kapsül bölmesinde sıkışmış olabilir. Bu durumda cihaz açılmalıdır ve kapsül bölmesinde oynatılarak gevşetilmelidir. Kapsülü gevşetmek için düğmelere birden fazla BASILMAMALIDIR. |
8. Nefes tutulmalıdır: İnhalasyon cihazı ağızdan çıkartılırken, 5-10 saniye ya da mümkün olduğunca uzun süre nefes tutulmalıdır. Daha sonra nefes verilmelidir.
Kapsül içinde toz kalıp kalmadığını kontrol etmek için inhalasyon cihazı açılmalıdır. Eğer kapsülde toz kalmışsa inhalasyon cihazı kapatılmalı ve 6., 7. ve 8. adımlar tekrarlanmalıdır. Hastaların büyük kısmı bir ya da iki inhalasyonda kapsülü boşaltabilmektedir. | |
9. Kullanıldıktan sonra boş kapsül atılmalı ve ağız parçası kapatılmalıdır.
Bazı kişiler ilacı inhalasyon yoluyla aldıktan sonra nadiren kısa süre öksürebilmektedir. Eğer öksürme olursa endişelenmeyin. Kapsül boş olduğu sürece ilaç tam dozunda alınmış olacaktır.
Olası bir kandida enfeksiyonu riskini azaltmak için her uygulamadan sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir.
İlave bilgiler:
Nadiren kapsülün küçük parçacıkları eleği geçerek ağza gelebilir. Bu durumda parçacıklar dilin üzerinde hissedilebilir. Bu parçacıkların yutulması ya da solunması zararlı değildir. Eğer kapsül birden çok kez delinirse (bkz.5.Adım) kapsülün parçalanma olasılığı artacaktır.
Temizlik
Normalde inhalerinizin temizlenmesi gerekmez.
Gerekirse inhalerinizi kullanımdan sonra kuru bir bez ya da kağıt mendil ile temizleyebilirsiniz.
İnhalerinizi su veya diğer sıvılarla temizlemeyiniz. Kuru tutunuz.
Saklama
4.3. Kontrendikasyonlar
Beklometazon dipropiyonat, formoterol fumarat dihidrat ve/veya ürün içeriğindeki maddelerden herhangi birine (bkz. Bölüm 6.1) karşı bilinen aşırı duyarlılık halinde FOREBEC kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Tedavi sonlandırılacaksa, tedavi dozunun tedrici olarak azaltılarak sonlandırılması tavsiye edilir. Tedavi ani olarak sonlandırılmamalıdır.
Astım tedavisi, basamaklı bir tedavi programını takip etmelidir ve belli aralıklarla hastanın tedaviye verdiği yanıt, akciğer fonksiyon testleri ile klinik açıdan değerlendirilmelidir.
Hasta tedaviyi etkisiz bulursa sağlık kurumuna başvurmalıdır. “Kurtarıcı†bronkodilatörlerin kullanımının artması altta yatan hastalığın kötüleştiğine işaret eder ve bu durumda astım tedavisinin yeniden değerlendirilmesi gerekir. Astım kontrolünde ani ve ilerleyici bir bozulma potansiyel olarak hayatı tehdit eder niteliktedir ve bu durumda hasta acil olarak tıbbi değerlendirmeden geçirilmeli, gerek inhale gerekse oral kortikosteroidler ile tedavinin arttırılması gerekliliği veya enfeksiyon varsa antibiyotik ihtiyacı değerlendirilmelidir.
Hastalığın alevlenme dönemlerinde veya astımın akut olarak kötüleştiği durumlarda FOREBEC tedavisine başlanmamalıdır. FOREBEC ile yapılan tedavi esnasında astımla ilişkili ciddi advers olaylar ve alevlenmeler ortaya çıkabilir. Hastalardan tedaviye devam etmeleri ancak FOREBEC başlandıktan sonra astım semptomları hala kontrol edilemiyor veya kötüleşiyorsa doktora başvurmaları istenmelidir.
Diğer inhalasyon tedavilerinde olduğu gibi, doz alımı sonrasında hırıltılı solunum, öksürük ve nefes darlığında ani bir artışla beraber paradoksal bronkospazm gelişebilir. Bu durumda, hızlı etkili bir inhale bronkodilatör uygulanmalıdır. FOREBEC alımı hemen kesilmeli, hasta değerlendirilmeli ve gerekirse alternatif bir tedaviye başlanmalıdır.
FOREBEC, astımın başlangıç tedavisi için uygun değildir.
Akut astım ataklarının tedavisi için hastalara her zaman kısa etki süreli “kurtarıcı†bronkodilatörlerini yanlarında bulundurmaları tavsiye edilmelidir.
Hastalara, asemptomatik oldukları durumda dahi reçete edildiği şekilde düzenli olarak FOREBEC'i kullanmaları gerektiği hatırlatılmalıdır.
Astım semptomları kontrol altına alındığında, FOREBEC dozu kademeli olarak azaltılmalıdır. Tedavide alt basamaklara doğru inildikçe hastaların düzenli olarak kontrol edilmeleri önem kazanır. Bu dönemde FOREBEC'in en düşük etkin dozu kullanılmalıdır (bkz. Bölüm 4.2).
KOAH hastalarında pnömoni
Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil, pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.
Kortikosteroid içeren inhale ilaçlar arasında pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık bakımından kesin klinik kanıt bulunmamaktadır.
Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatli olmalıdır.
KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içilmesi, ileri yaş, düşük vücut kitle indeksi ve ağır KOAH bulunmaktadır.
İnhale kortikosteroidlerin, özellikle uzun süre ile reçete edilen yüksek dozlarında, sistemik etkileri ortaya çıkabilir. Bu etkilerin ortaya çıkma olasılığı oral kortikosteroidlere göre daha azdır. Olası sistemik etkiler; Cushing sendromu, Cushingoid belirtiler, adrenal supresyon, çocuklarda ve ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt, glokom ve daha nadiren psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon veya agresyon (özellikle çocuklarda) dahil bir dizi psikolojik bozukluk veya davranış bozukluklarıdır. Bu nedenle inhale kortikosteroid dozunun, astımın etkili bir şekilde kontrol edildiği en düşük doza ayarlanması önemlidir.
Hastaların inhale kortikosteroidlerle uzun süre ile tedavi edilmeleri adrenal supresyon ve akut adrenal krizle sonuçlanabilir. Tavsiye edilen beklometazon dipropiyonat dozundan daha yüksek dozları inhale eden çocuklar ve 16 yaşından küçük hastalar potansiyel risk altında olabilirler. Potansiyel olarak akut adrenal krizi tetikleyen durumlar; travma, ameliyat, enfeksiyon veya dozun herhangi bir nedenle hızla azaltılması olabilir. Ortaya çıkan semptomlar genellikle belirsizdir ve anoreksiya, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, mide bulantısı, kusma, hipotansiyon, azalmış bilinç düzeyi, hipoglisemi ve nöbetler halinde görülebilir. Stres dönemlerinde veya elektif cerrahi esnasında tedaviye ilave kortikosteroid eklenmesi düşünülmelidir.
Oral kortikosteroidlerden, inhale kortikosteroidlere geçirilen hastalar kayda değer bir süre boyunca bozulmuş adrenal rezerv yönünden risk altında olabilirler. Geçmişte yüksek doz acil kortikosteroid tedavisi görmüş veya uzun süreli yüksek doz inhale kortikosteroid tedavisi alan hastalar da risk altında olabilirler. Stres yaratması muhtemel acil ve elektif durumlarda, ilgili rezidüel bozukluk olasılığı daima akılda tutulmalı ve uygun kortikosteroid tedavisi düşünülmelidir. Elektif prosedürlerden önce adrenal bozukluk derecesinin tespiti için ilgili uzmana danışılmalıdır.
FOREBEC aktif veya latent akciğer tüberkülozu, hava yollarında fungal veya viral enfeksiyon izlenen hastalarda dikkatle uygulanmalıdır.
FOREBEC; kardiyak aritmi, özellikle üçüncü derece atriyoventriküler blok ve taşiaritmiler, idiyopatik subvalvular aortik stenoz, hipertrofik obstrüktif kardiyomiyopati, iskemik kalp hastalığı, ağır kalp yetersizliği, şiddetli arteriyel hipertansiyon ve anevrizma geçirmiş hastalarda dikkatle kullanılmalı, hasta monitorize edilmelidir.
Konjenital veya ilaçla indüklenen, bilinen veya şüpheli QTc aralığı uzaması (QTc > 0,44 saniye) izlenen hastalar tedavi edilirken dikkatli olunmalıdır. Formoterol, QTc aralığının uzamasını indükleyebilir.
FOREBEC; tirotoksikoz, diabetes mellitus, feokromositoma ve tedavi edilmemiş hipokalemi izlenen hastalarda dikkatli kullanılmalıdır.
Ciddi hipokalemi, potansiyel olarak beta-agonisti tedavisinden ileri gelebilir. Hipokalemi şiddeti hipoksi ile artabileceğinden ağır astımda bu duruma özel olarak dikkat edilmesi tavsiye edilir. Hipokaleminin şiddeti; hipokalemiyi indükleyen ksantin türevleri, steroidler ve diüretikler gibi diğer ilaçlarla yapılan eşzamanlı tedavi ile de artabilir (Bkz. Bölüm 4.5). Birden fazla sayıda “kurtarıcı†bronkodilatörün tüketilebildiği stabil olmayan astımda da dikkatli olunması tavsiye edilir. Bu gibi durumlarda hastanın serum potasyum düzeyleri düzenli olarak izlenmelidir.
Formoterol inhalasyonu kan şekeri düzeylerinde yükselmeye neden olabilir. Bu nedenle diyabet hastalarında kan glukozu yakından izlenmelidir.
Halojenli anestezikler ile anestezi planlandığında, kardiyak aritmi riski nedeniyle anestezi başlamadan en az 12 saat öncesinde FOREBEC kullanılmamış olması gerekmektedir.
Hastalara, orofarengeal fungal enfeksiyon ve disfoni riskini azaltmak için inhaler kullanımından sonra ağızlarını su ile çalkalamaları veya gargara yapmaları veya dişlerini fırçalamaları gerektiği hatırlatılmalıdır.
Uzun etkili beta-agonisti preparatlarına bağlı olarak nadiren de olsa, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri görülebilir.
Uzun etkili beta-agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolü sağlandığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici düzenli bir tedaviyle idamesi sağlanmalıdır.
İnhale kortikosteroide ek olarak uzun etkili beta-agonist kullanan ergen hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hemde uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir.
Hastalar alevlenme dönemlerinde ise ya da önemli veya akut olarak kötüye giden astım
şikayetleri varsa, uzun etkili beta-agonistlerle tedaviye başlanmamalıdır.
Sistemik ve topikal kortikosteroid kullanımına bağlı görme bozuklukları bildirilebilir. Eğer hastada bulanık görme veya diğer görme bozuklukları meydana gelirse hasta; katarakt, glokom veya sistemik ve topikal kortikosteroid kullanımdan sonra bildirilen santral seröz korioretinopati (SSKR) gibi nadir hastalıkları da içerebilen olası nedenleri değerlendirmek üzere bir göz doktoruna yönlendirilmelidir.
FOREBEC laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakokinetik etkileşimler
Beklometazon dipropiyonat, sitokrom P-450 sisteminin katkısı olmaksızın esteraz enzimleri aracılığı ile hızla metabolize olarak aktif metaboliti olan beklometazon monopropiyonata dönüşür.
Beklometazon diğer bazı kortikosteroidlere göre CYP3A metabolizmasına daha az bağımlıdır ve genel olarak etkileşimler olası değildir; ancak güçlü CYP3A inhibitörlerinin (örneğin ritonavir, kobisistat) birlikte kullanımı ile sistemik etkilerin olma ihtimali göz ardı edilemez ve bu nedenle bu tür ajanlar kullanılması durumunda dikkatli olunması ve hastanın uygun bir şekilde gözlemlenmesi önerilir.
Farmakodinamik etkileşimler
Astımlı hastalarda beta-blokörlerin (göz damlaları dahil) kullanımından kaçınılmalıdır. Mecburi beta-blokör kullanımı, formoterol'ün etkisini azaltır veya ortadan kaldırır.
Diğer beta-adrenerjik ilaçların kullanımı potansiyel olarak aditif etkiler oluşturabilir, bu nedenle teofilin veya diğer beta-adrenerjik ilaçlar formoterol ile eşzamanlı olarak reçete edilecekse dikkatli olunmalıdır.
Kinidin, disopiramid, prokainamid, fenotiyazinler, belli antihistaminikler (örn., terfenadin), monoaminoksidaz inhibitörleri ve trisiklik antidepresanlar ile yapılan eş zamanlı tedavi, QTc aralığını uzatabilir ve ventriküler aritmi riskini artırabilir.
Ayrıca L-dopa, L-tiroksin, oksitosin ve alkol; kalbin beta-sempatomimetiklere duyarlılığını artırabilir.
Furazolidon ve prokarbazin gibi benzer özellikler gösteren monoaminoksidaz inhibitörleri (MAOİ) ile eş zamanlı tedavi, hipertansif reaksiyonları başlatabilir.
Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artabilir.
Ksantin türevleri, steroidler veya diüretiklerle yapılan eşzamanlı tedavi beta-agonistlerinin olası hipokalemik etkisinin şiddetini artırabilir (Bkz. Bölüm 4.4). Hipokalemi, dijital glikozitlerle tedavi altında olan hastalarda aritmiye olan yatkınlığı artırabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği halinde beklometazon dipropiyonat/formoterol fumarat dihidrat ile yapılmış etkileşim çalışması bulunmamaktadır.
Pediyatrik popülasyon:
18 yaşın altındaki astım ve KOAH hastalarında beklometazon dipropiyonat/formoterol fumarat dihidrat ile yapılmış etkileşim çalışması bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın çocuk doğurma potansiyeli olan kadınlarda ve doğum kontrolünde kullanımına ilişkin yeterli veri bulunmamaktadır.
Gebelik dönemi
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebe hayvanlara uygulanan yüksek kortikosteroid dozlarının, yarık damak ve rahim içi büyüme geriliği gibi fötal gelişim anomalilerine neden olduğu bilinmektedir. Beta- sempatomimetik ajanların tokolitik etkisinden dolayı doğumun yaklaşmasında gerekli önlemler alınmalıdır. Belirlenmiş farklı ve daha güvenli tedavi alternatifi varsa, formoterol'ün gebelik esnasında ve özellikle gebeliğin sonunda veya doğum esnasında kullanımı tavsiye edilmemektedir.
FOREBEC'in gebelik esnasında uygulanması yalnızca beklenen faydalar potansiyel risklerden fazla ise düşünülmelidir.
Laktasyon dönemi
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın insanlarda emzirme esnasında kullanımına dair klinik veriler bulunmamaktadır.
Hayvan deneylerinden herhangi bir veri elde edilmemiş de olsa, beklometazon dipropiyonat'ın diğer kortikosteroidler gibi anne sütüne geçtiğinin varsayılması anlamlıdır. Formoterol'ün insanda anne sütüne geçip geçmediğinin bilinmemesine karşın, emziren hayvanların sütünde formoterol tespit edilmiştir.
FOREBEC'in emziren kadınlara uygulanması yalnızca beklenen faydalar potansiyel risklerden fazla ise düşünülmelidir. Çocuk için emzirmenin ve anne için tedavinin faydası
dikkate alınarak, emzirmenin veya FOREBEC ile tedavinin kesilip kesilmemesi konusunda bir karar verilmelidir.
Üreme yeteneği/Fertilite
İnsanlarda hiçbir veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalarda, sıçanlarda, beklometazon dipropiyonat'ın yüksek dozlarda kombinasyon halinde bulunması azalmış dişi üreme yeteneği ve embriyotoksisite ile ilişkilendirilmiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
FOREBEC'in araç ve makine kullanma yeteneği üzerine etkisi yoktur veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Tremor, en yaygın görülen advers reaksiyondur. Beklometazon dipropiyonat/formoterol fumarat dihidrat ile yapılan 12 haftalık bir klinik çalışmada; tremor, yalnızca maksimum doz uygulamasında (2 inhalasyon halinde günde 2 kez) görülmüş, sıklıkla da tedavinin başlangıcında ortaya çıkmış ve hafif seyirli olarak gözlenmiştir. Hiçbir hasta, tremorun bir sonucu olarak çalışmadan çekilmemiştir.
Astım Hastalarında Klinik Çalışmalar
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın güvenliliği, değişen şiddette astımı olan 12 yaş ve üzeri 719 hastanın ilaca maruz bırakıldığı aktif ve plasebo kontrollü klinik çalışmalarda değerlendirilmiştir. Aşağıda bulunan advers reaksiyon insidansı, 12 yaş ve üzeri astımlı hastalarla ilişkilidir ve beklometazon dipropiyonat/formoterol fumarat dihidrat'ın tavsiye edilen dozlarında, 8-12 haftalık bir süre boyunca uygulandığı iki pivot klinik çalışmanın güvenlilik bulgularına dayanmaktadır.
Beklometazon dipropiyonat/formoterol fumarat dihidrat ile yapılan klinik çalışmalarda psikiyatrik bozukluklar gözlenmemiştir ancak inhale kortikosteroidlerin potansiyel bir sınıf etkisi olarak eklenmişlerdir.
Klinik çalışmalardan elde edilen istenmeyen etki görülme sıklıkları MedDRA sistemine göre sınıflandırılmıştır:
Çok yaygın: ≥ 1/10; Yaygın: ≥ 1/100 ila < 1/10; Yaygın olmayan: ≥ 1/1.000 ila < 1/100; Seyrek: ≥ 1/10.000 ila <1/1.000; Çok seyrek: < 1/10.000; Bilinmiyor (mevcut verilerden tahmin edilemiyor).
Plasebo insidansları dikkate alınmamıştır.
Enfeksiyon ve enfestasyonlar
Yaygın :Pnömoni (KOAH'lı hastalarda) Yaygın olmayan :Nazofarenjit, oral kandidiyazis
Metabolizma ve beslenme hastalıkları
Yaygın olmayan :Hipertrigliseridemi
Psikiyatrik hastalıklar
Bilinmiyor :Psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon, agresyon, davranış değişiklikleri (daha çok çocuklarda)
Sinir sistemi hastalıkları Yaygın :Tremor Yaygın olmayan :Baş ağrısı
Göz hastalıkları
Bilinmiyor :Bulanık görme (bkz. Bölüm 4.4)
Kardiyak hastalıklar
Yaygın olmayan :Taşikardi, sinus bradikardisi, angina pektoris, miyokardiyal iskemi
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan :Boğazda tahriş, astımın alevlenmesi, dispne, orofarengeal ağrı, disfoni, öksürük
Gastrointestinal hastalıklar
Yaygın olmayan :Bulantı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın olmayan :Yorgunluk, sinirlilik
Araştırmalar
Yaygın olmayan :Elektrokardiyogramda QT uzaması, serbest kortizolün idrarda azalması, azalmış kan kortizolü, artmış kan potasyumu, artmış kan glukozu, zayıf r-dalga ilerlemeli elektrokardiyogram
Formoterol ile ilişkili gözlemlenen advers olaylar şunlardır:
Tremor, baş ağrısı, taşikardi, sinüs bradikardisi, angina pektoris, miyokardiyal iskemi ve QTc aralığı uzaması.
Beklometazon dipropiyonat ile ilişkilendirilen advers reaksiyonlar genellikle şunlardır: Nazofarenjit, oral kandidiazis, disfoni, boğazda tahriş, huzursuzluk, kortizol içermeyen idrarda azalma, azalmış kan kortizolü, artmış kan glukozu.
Beklometazon dipropiyonat/formoterol fumarat dihidrat ile yapılan klinik deneyimlerde gözlenmeyen ancak genellikle beklometazon dipropiyonat'ın inhalasyon yoluyla uygulanmasıyla ilişkilendirilen ilave advers reaksiyonlar, diğer oral fungal enfeksiyonlar ve pnömonidir. İnhale kortikosteroid tedavisi esnasında bazen tat bozuklukları bildirilmiştir.
Oral fungal enfeksiyonlar, oral kandidiyazis ve disfoniyi azaltmaya yönelik önlemler için Bölüm 4.4'e bakınız.
İnhale kortikosteroidlerin (örn., beklometazon dipropiyonat) sistemik etkileri özellikle uzun süreli kullanım için reçetelenen yüksek doz uygulamalarında ortaya çıkabilir. Bunlar; Cushing Sendromu, Cushingoid belirtiler, adrenal supresyon, kemik mineral yoğunluğunda azalma, ergenlerde büyüme geriliği, katarakt ve glokom olarak görülebilir (bkz. Bölüm 4.4).
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın terapötik dozlarıyla elde edilen klinik deneyimlerde gözlenmeyen ancak genellikle formoterol gibi uzun etkili beta- agonistinin uygulanmasıyla ilişkilendirilen ilave advers reaksiyonlar; palpitasyon, atriyal fibrilasyon, ventriküler ekstrasistol, taşiaritmi, potansiyel olarak ciddi hipokalemi ve artmış/azalmış kan basıncıdır. İnhale formoterol tedavisi esnasında bazen uykusuzluk, baş dönmesi, huzursuzluk ve anksiyete bildirilmiştir. Formoterol kas kramplarını, miyaljiyi de artırabilir.
Döküntü, ürtiker, pruritus ve eritem; göz, yüz, dudak ve boğazda ödem (anjiyoödem) dahil aşırı duyarlılık reaksiyonları bildirilmiştir.
Diğer inhaler tedavilerde olduğu gibi doz alımı sonrasında hırıltılı solunum, öksürük ve nefes darlığında ani bir artışla beraber paradoksal bronkospazm oluşabilir (ayrıca bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın 11 yaşına kadar olan çocuklardaki güvenliliği ile ilgili hiçbir bilgi bulunmamakta, yalnızca 12-17 yaş arasındaki ergenlerde sınırlı bilgiler bulunmaktadır. Erişkinler ve ergenler üzerinde yapılan 12 haftalık randomize bir klinik çalışmada, orta-ağır şiddetli astımı olan 12-17 yaş arası 162 hasta, Beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhaler veya beklometazon dipropiyonat/formoterol kombinasyonu basınçlı ölçülü doz inhaler formülasyonunu günde 2 kez 1 veya 2 inhalasyon şeklinde kullanmışlardır. Ergenlerdeki advers ilaç reaksiyonlarının sıklığı, türü ve şiddetinin erişkinlerden farklı olmadığı gözlenmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; eposta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
FOREBEC'in tek bir uygulama için tavsiye edilen en yüksek dozu 2 inhalasyondur. Astım hastalarında FOREBEC'in kümülatif 4 inhalasyonu (tek bir doz şeklinde verilen toplam beklometazon dipropiyonat 400 mikrogram, formoterol 24 mikrogram) çalışılmıştır.
Kümülatif tedavi uygulaması, hayati belirtiler üzerinde anormal klinik etkilere neden olmamış ve ciddi veya şiddetli advers reaksiyonlar gözlenmemiştir (ayrıca bkz. Bölüm 4.8).
Beklometazon dipropiyonat/formoterol kombinasyonu basınçlı ölçülü doz inhaler formülasyonunda, astım hastalarında 12 inhale doza kadar kümülatif inhalasyon araştırılmıştır (toplam beklometazon dipropiyonat 1200 mikrogram, formoterol 72 mikrogram). Kümülatif tedaviler hayati belirtiler üzerinde anormal etkiye neden olmamış ve ciddi veya şiddetli advers olaylar gözlenmemiştir.
Aşırı formoterol dozları beta-adrenerjik agonistler için tipik olan advers etkilerden; bulantı, kusma, baş ağrısı, tremor, uyku hali, çarpıntı, taşikardi, ventrikül aritmiler, QTc aralığının uzaması, metabolik asidoz, hipokalemi, hiperglisemiye neden olabilir.
Formoterol ile doz aşımı durumunda destekleyici ve semptomatik tedavi endikedir. Ciddi vakalar hastaneye yatırılmalıdır. Kardiyoselektif beta-adrenerjik blokörlerin uygulaması düşünülebilir ancak beta-adrenerjik blokör ilaç kullanımının bronkospazma neden olabileceği göz önünde bulundurulmalı, dikkatli olunmalı, hastaların serum potasyum düzeyleri izlenmelidir.
Önerilenden fazla akut beklometazon dipropiyonat dozlarının inhalasyonu, adrenal fonksiyonun geçici olarak baskılanmasına neden olabilir. Bu durum, plazma kortizol ölçümleri ile doğrulandığı üzere, baskılanma birkaç gün içinde ortadan kalkacağı için acil önlem gerektirmez. Bu hastalarda tedavi, astımın kontrol altına alınabildiği en uygun dozda sürdürülmelidir.
Kronik bir şekilde önerilenden fazla beklometazon dipropiyonat dozlarının inhalasyonu durumunda (bkz Bölüm 4.4), adrenal rezervin monitorizasyonu gerekebilir. Bu grup hastalarda da tedavi, astımın kontrol altına alınabildiği en uygun dozda sürdürülmelidir.
FOREBEC aracılığıyla 800 mikrogram beklometazon dipropiyonat ve 48 mikrogram formoterol'e kadar olan tek supra-terapötik dozlar genelde güvenli ve iyi tolere edilebilirdir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif hava yolu hastalıkları için kullanılan ilaçlar; Kortikosteroidler veya diğer ilaçlar ile kombine adrenerjikler (antikolinerjik kombinasyonları hariç).
ATC Kodu: R03AK08
Etki mekanizması
FOREBEC; 1,4-1,5 kütle medyan aerodinamik çapa (MMAD) sahip ekstra ince bir toz bulutunda; beklometazon dipropiyonat ve formoterol etkin maddelerinin kombinasyon halinde bulunduğu çoklu doz kuru toz inhalerdir. FOREBEC'in bulut partikülleri, ortalamada,
ekstra ince olmayan formülasyonlarda serbest bırakılan partikül boyutlarından çok daha küçük çaptadır.
Astım hastalarında radyoaktif olarak işaretlenmiş ilacın akciğer erişimi ile ilgili yapılan bir çalışmada; beklometazon dipropiyonat/formoterol fumarat dihidrat'ın, hava yollarında homojen olarak, yüksek oranda (nominal dozun tahminen %42'si) akciğerlere eriştiği gösterilmiştir. Beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhalerin, basınçlı ölçülü doz inhaler (bÖDİ) karşılığı olan ekstra ince beklometazon dipropiyonat/formoterol fumarat dihidrat (BDP/FF) formülasyonu ile eşit olduğu gösterilen bu iletim özellikleri, artmış lokal farmakodinamik etkilere sahip düşük kortikosteroid dozunun kullanımını desteklemektedir (Bkz. Klinik çalışma deneyimleri).
FOREBEC'in iki etkin maddesi farklı etki mekanizmalarına sahiptir. İnhale kortikosteroid ve beta-agonisti kombinasyonlarıyla ortak olduğu üzere, ilgili bileşenlerle de astım alevlenmelerinde azalmaya dair aditif etkiler görülmektedir. Bu bileşenler:
Beklometazon dipropiyonat
İnhalasyon yolu ile önerilen dozlarda uygulanan beklometazon dipropiyonat, akciğerlerde glukokortikoidlere özgü lokal antiinflamatuvar etki gösterir ve bu etki, astım belirtileri ve alevlenmelerinde azalma sağlarken, sistemik olarak uygulanan kortikosteroidlere nazaran potansiyel olarak daha az advers etki gösterir.
Formoterol
Formoterol, reversibl solunum yolu obstrüksiyonu izlenen hastalarda bronş düz kaslarının gevşemesini sağlayan uzun etki süreli selektif bir beta-adrenerjik agonistidir. Bronş genişletici etki hızlı bir şekilde, inhalasyondan 1-3 dakika sonra etkisini gösterir ve 12 saat sürer.
Klinik deneyim
Orta-ağır şiddetli persistan astım hastalarında beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhaler ve beklometazon dipropiyonat/formoterol kombinasyonu 100/6 mikrogram basınçlı ölçülü doz inhaler çözeltisinde bulunan iki bileşenin etkililiği; üç ayrı çalışmada karşılaştırılarak değerlendirilmiştir. Genellikle, klinik uygulamada iki inhalerin 1 ve 2 inhalasyon halinde günde iki kez dozundaki etkililiklerinin eşdeğer olması beklenmiştir.
Birinci çalışmada; primer amaç, bronkodilatasyonla ölçülen inhale kortikosteroid bileşeninin etkililiğinin değerlendirilmesidir (doz öncesi FEV). Her iki formülasyon günde iki kez 1 ve 2 inhalasyon şeklinde uygulandığında; 3 aylık tedavi süresinin sonunda, orta-ağır şiddetli semptomatik astımlı 696 hastanın FEVdeğerlerinde, başlangıç FEVdeğerlerine göre klinik açıdan belirgin olarak anlamlı bir iyileşme görülmüştür. FEV'de, başlangıç değerlerine göre en az 250 ml'lik bir ortalama artış gözlenmiştir. Her iki doz uygulamasında da, beklometazon dipropiyonat/formoterol kuru toz inhaler ve basınçlı inhalasyon çözeltisi formülasyonlarının doz öncesi FEVdeğerleri arasında klinik açıdan belirgin bir fark bulunmamıştır. Sabah tepe ekspiratuar akımı (PEF'i) için anlamlı bir doz-yanıt ilişkisi gözlenmiştir. Doz öncesi FEV'de
doz-yanıt ilişkisi için istatistiksel bir anlamlılık bulunmamıştır. Astım kontrolü ölçümlerinde; her iki formülasyonun yüksek dozlarında başlangıçtan itibaren tedavi dönemi boyunca sabah ve akşam astım semptom skoru ve semptomsuz günlerin yüzdeleri belirgin olarak düzelmiştir.
İkinci çalışmada primer amaç, beklometazon dipropiyonat/formoterol'ün kuru toz ve basınçlı ölçülü doz inhaler (bÖDİ) formülasyonlarındaki uzun etkili beta-agonist bileşeninin etkililik değerlendirmesidir. Bu çalışmada, başlangıçtaki bronkodilatasyon ve tek doz uygulamasından sonraki 12 saate kadar olan bronkodilatasyon, FEV'in bir dizi spirometrik değerlendirmesiyle ölçülmüştür (formoterolün etki süresinin en az %80'ine göre FEVEAA). Her iki beklometazon dipropiyonat/formoterol formülasyonu da, bir ve dört dozluk inhalasyonlarında, FEVEAA.'yi plaseboya göre anlamlı derecede düzeltmiştir. Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın kuru toz inhalerin 1 ve 4 dozluk uygulamalarındaki bronkodilatasyon, basınçlı ölçülü doz inhaler formülasyonundaki bronkodilatör etkinlik ile eşdeğerdedir. Her iki formülasyonun düşük ve yüksek dozları arasındaki doz-yanıt ilişkisi istatistiksel olarak anlamlı bulunmuştur.
Üçüncü çalışmada; beklometazon dipropiyonat/formoterol basınçlı ölçülü doz inhalasyon çözeltisi (günde 2 defa 1 inhalasyon) ile yapılan 4 haftalık bir hazırlık döneminden sonra kontrol altına alınan 755 astım hastasının tamamı, günde iki kez 1 inhalasyon şeklinde verilen aynı inhaler (bÖDİ), beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhaler veya doz başına 100 mikrogram beklometazon dipropiyonat inhalasyon tozu tedavi gruplarına 8 haftalık tedavi için randomize edilmişlerdir. Birincil hedef, başlangıçtan itibaren tüm tedavi süresince sabah tepe ekspiratuar akımında (PEF) tedavi başlangıcına göre görülen değişikliğin tespitidir. 8 haftalık tedaviden sonra, her iki beklometazon dipropiyonat/formoterol fumarat dihidrat formülasyonu (bÖDİ ve kuru toz inhaler), beklometazon dipropiyonat kuru toz monoterapisine göre belirgin olarak sabah tepe ekspiratuar akımında (PEF) daha iyi iyileşme sağlamış ve her iki kombinasyon inhalerinin birincil sonlanım noktaları arasında hiçbir fark bulunmamıştır. Her iki kombinasyon inhaleri arasında, astım kontrol anketi skoru ve kurtarıcı ilaçsız geçen gün sayısı gibi semptom ölçümleri değerlendirmelerinde herhangi bir farklılık bulunmamaktadır.
Pediyatrik popülasyon:
Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın 5-11 yaşındaki çocuklardaki güvenliliği ile ilgili klinik deneyim bulunmamakta, yalnızca 12-17 yaş arasındaki ergenler için sınırlı bilgiler bulunmaktadır.
3 aylık randomize bir klinik çalışmada, orta-ağır şiddetli astım tanısı konan 12-17 yaşlarındaki
162 ergen, günde iki kez 1 veya 2 inhalasyon olacak şekilde, Beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhaler veya karşılık gelen basınçlı inhalasyon çözeltisi formülasyonuna (bÖDİ) randomize edilmişlerdir. Tedavi süresi sonunda, doz öncesi FEV1'de görülen artış, erişkinlere göre ergenlerde daha yüksek bulunmuştur.
Pediyatrik kullanımına dair bilgi için ayrıca bölüm 4.2 ve 4.8'e bakınız.
5.2. Farmakokinetik özellikler
Genel özellikler Beklometazon dipropiyonat Emilim:İnhale edilen beklometazon dipropiyonat akciğerlerden hızlı bir şekilde emilir; absorpsiyondan önce, çoğu dokuda bulunan esteraz enzimleri aracılığıyla yoğun bir şekilde aktif metaboliti olan beklometazon-17-monopropiyonat'a hidrolize olur ve glukokortikoid reseptörüne güçlü bir şekilde bağlanır. Aktif metabolit olan beklometazon-17- monopropiyonat sistemik yararlanımı akciğerler ve yutulan dozun gastrointestinal absorpsiyonundan kaynaklanır. Yutulan beklometazon dipropiyonat'ın biyoyararlanımı önemsizdir. Bununla beraber, sistemik dolaşım öncesi beklometazon-17-monopropiyonat'a dönüşüm aktif metabolitin absorpsiyonu ile neticelenir.
Basınçlı bir ölçülü doz inhalerden inhalasyon sonrası mutlak biyoyararlanım, değişmemiş beklometazon dipropiyonat ve beklometazon-17-monopropiyonat için nominal dozun yaklaşık olarak, sırasıyla, %2'si ve %62'sidir.
Dağılım:
Dozun intravenöz olarak verilmesinden sonra, kararlı durumdaki dağılım hacminin beklometazon dipropiyonat için az (20 L) ve aktif metaboliti için daha fazla (424 L) olmasına karşın, beklometazon dipropiyonat ve aktif metabolitinin dağılımı yüksek plazma klirensi (sırasıyla 150 ve 120 litre/saat) ile tanımlanır.
Beklometazon dipropiyonat'ın metabolik olarak dağılımı esasen (%82) aktif metabolit olan beklometazon-17-monopropiyonat ile sonuçlanır. Plazma proteinlerine bağlanma kısmen yüksektir (%87).
Biyotransformasyon:
Ön ilaç olarak glukokortikoid reseptörlerine afinitesi zayıf olan beklometazon dipropiyonat, esteraz enzimleriyle hidrolize olarak, güçlü bir lokal antiinflamatuvar etkinliğe sahip aktif metaboliti olan beklometazon-17-monopropiyonat'a dönüşür.
Eliminasyon:
Beklometazon dipropiyonat'ın başlıca atılma şekli polar metabolitler şeklinde feçesle atılmadır. Beklometazon dipropiyonat ve metabolitlerinin idrarla atılımı önemsizdir. Beklometazon dipropiyonat ve beklometazon-17-monopropiyonat için terminal eliminasyon yarılanma ömrü sırasıyla 0,5 ve 2,7 saattir.
Doğrusallık/ Doğrusal Olmayan Durum:
İnhalasyon tozunun iki farklı yitiliği (beklometazon dipropiyonat/formoterol fumarat dihidrat 100 mcg/6 mcg ve beklometazon dipropiyonat/formoterol fumarat dihidrat 200 mcg/6 mcg) üzerinden iki bileşenin akciğer biyoyararlanımı ve toplam sistemik maruz kalımını değerlendirmek için bir klinik farmakoloji çalışması yapıldı. Bu parametreler, hem aktif kömür ile hem de aktif kömür olmadan, her formülasyonun tek bir dozundan (4 inhalasyon)
sonra değerlendirildi. Açık etiketli, 6 yönlü çapraz, tek dozlu dizayna sahip çalışmaya, tahmin edilen değerleri ≥ %70 FEVolan toplam 30 erişkin astımlı hasta dahil edildi ve bu hastalar günlük düşük inhale kortikosteroid dozları (örn., Budesonid veya eşdeğer ≤ 400 mcg / gün) veya düşük doz inhale kortikosteroid ve uzun etkili βagonistler içeren sabit kombinasyonlar ile tedavi edildi. Beklometazon dipropiyonatın aktif metaboliti olan B17MP'nin akciğer biyoyararlanımı ve toplam sistemik maruziyeti her iki çalışma koşulunda da (aktif kömür ile ve aktif kömür olmadan) 200/6 mikrogramlık yitilik ile 100/6 mikrogramlık yitilik arasında doz orantılı idi. Bu çalışmada akciğer biyoyararlanımı ve toplam sistemik maruziyet açısından formoterolün biyoeşdeğerliliği, iki yitilik karşılaştırıldığında C'ın güven aralığı %90'ın ve EAA'nin biyoeşdeğerlik sınırı %80'nin altında kaldığından tam olarak gösterilemedi. Sistemik etkilerde (glukoz, potasyum ve kardiyovasküler parametreler dahil) hiçbir fark gözlenmediğinden, bu azalmış sistemik maruziyet (Cve EAA'de% 20-14'tür) beklometazon dipropiyonat/formoterol fumarat dihidrat 200/6 mikrogramın en az beklometazon dipropiyonat/formoterol fumarat dihidrat 100/6 mikrogram kadar güvenli olduğunu göstermiştir. Akciğer birikimi açısından fark Cve EAAiçin sırasıyla % 20 ve% 22 olarak bulunmuştur. İki yitiliğin (100/6 mikrogram ve 200/6 mikrogram) bronkodilatasyon açısından eşdeğer etkinliği, spesifik bir farmakodinamik çalışmada gösterilmiştir (bkz. Bölüm 5.1).
Hastalardaki karakteristik özellikler
Beklometazon dipropiyonatın böbrek veya karaciğer yetmezliği izlenen hastalardaki farmakokinetikleri araştırılmamıştır. Bununla birlikte; beklometazon dipropiyonat, daha polar metabolitler olan beklometazon-21-monopropiyonat, beklometazon-17-monopropiyonat ve beklametazonu meydana getirmek üzere bağırsak sıvısı, serum, akciğer ve karaciğerde bulunan esteraz enzimleriyle çok hızlı bir şekilde metabolizasyona uğradığından, karaciğer yetmezliğinin beklometazon dipropiyonatın farmakokinetiğini ve güvenlilik profilini değiştirmesi beklenmez. Beklometazon dipropiyonat veya metabolitlerinin idrarda izi bulunmadığından, böbrek yetmezliği izlenen hastalarda sistemik maruz kalımda bir artış öngörülememiştir.
Formoterol Emilim:
Formoterol inhalasyonundan sonra, hem akciğerden hem de gastrointestinal kanaldan emilir. Ölçülü doz inhalerle (ÖDİ) uygulama sonrası yutulan solunan doz fraksiyonu %60 ile %90 arasında değişebilir. Yutulan kısmın en az %65'i gastrointestinal kanaldan emilir. Değişmemiş ilacın pik plazma konsantrasyonları oral uygulamadan sonraki 0,5 ila 1 saat içerisinde ortaya çıkar.
Dağılım:
Formoterol'ün plazma proteinlerine bağlanma oranı %61-64'tür. %34'ü albümine bağlanır. Terapötik dozlarla ulaşılan konsantrasyon aralığında, bağlanmada bir doygunluk bulunmamaktadır. Oral uygulama sonrası belirlenen eliminasyon yarılanma ömrü 2-3 saattir.
Biyotransformasyon:
Formoterol büyük ölçüde metabolize olur ve en önemli metabolizasyon yolağı fenolik hidroksil grubunun doğrudan konjugasyonunu gerektirir. Glukuronik asit konjugatı inaktiftir. İkinci önemli yolak, O-demetilasyonu takiben fenolik 2'-hidroksil grubundaki konjugasyonunu gerektirir. Sitokrom P450 izoenzimleri CYP2D6, CYP2C19 ve CYP2C9, formoterolün O-demetilasyonunda yer alır. Karaciğerin başlıca metabolizma yeri olduğu anlaşılmaktadır. Formoterol, terapötik açıdan ilgili konsantrasyonlarda CYP450 enzimlerini inhibe etmez.
Eliminasyon:
Kuru toz inhalerden tek bir inhalasyon sonrası formoterol'ün idrarla kümülatif itrahı 12 – 96 mikrogram doz aralığında doğrusal olarak artmıştır. Ortalamada, dozun %8'i ve %25'i sırasıyla değişmemiş ve toplam formoterol şeklinde atılmıştır. 12 sağlıklı gönüllünün inhale ettiği 120 mikrogramlık tek bir dozu takiben ölçülen plazma konsantrasyonlarına dayanarak, ortalama terminal eliminasyon yarılanma ömrü 10 saat olarak belirlenmiştir. (R,R)- ve (S,S)- enansiyomerler idrarla atılan değişmemiş ilacın, sırasıyla, yaklaşık %40 ve %60'ını temsil etmiştir. İki enantiyomerin bağıl oranı araştırılan doz aralığı üzerinde sabit kalmıştır ve tekrarlanan dozlamadan sonra bir enansiyomerin diğerine göre bağıl birikme belirtisi bulunmamaktadır.
Oral uygulamadan sonra (40 ila 80 mikrogram), dozun %6 ila %10'u sağlıklı gönüllülerde değişmemiş ilaç olarak idrardan geri kazanılmıştır; dozun %8'e kadarı glukuronür şeklinde geri kazanılmıştır.
Formoterol'ün oral dozunun toplamda %67'si idrarla (başlıca metabolitleri şeklinde) ve geri kalanı feçesle atılır. Formoterol'ün renal klirensi 150 ml/dk.'dır.
Doğrusallık/ Doğrusal Olmayan Durum:
Formoterol'ün absorpsiyonu, 12 ila 96 mcg formoterol fumarat'ın solunmasını takiben doğrusaldır.
Hastalardaki karakteristik özellikler
Karaciğer/Böbrek yetmezliği: karaciğer veya böbrek yetmezliği izlenen hastalarda formoterol'ün farmakokinetiği araştırılmamıştır. Ancak, formoterol esas olarak hepatik metabolizma yoluyla elimine edildiğinden şiddetli karaciğer sirozu olan hastalarda artmış maruziyet beklenebilir.
Klinik deneyim
Kombinasyon halindeki beklometazon dipropiyonat ve formoterol'e sistemik maruz kalım, tek başına bileşenlerle karşılaştırılmıştır. Beklometazon dipropiyonat ve formoterol arasında farmakokinetik ve farmakodinamik (sistemik) etkileşimler olduğuna dair hiçbir bulgu yoktur.
Beklometazon dipropiyonat/formoterol fumarat dihidrat inhalasyon tozunun farmakokinetiği, karşılık gelen basınçlı inhalasyon çözelti formülasyonun farmakokinetiğiyle karşılaştırılmıştır.
Steroid bileşenin analizi, beklometazon dipropiyonat'ın başlıca aktif metaboliti olan beklometazon-17- monopropiyonat'a odaklanmıştır.
Beklometazon dipropiyonat'ın sistemik absorpsiyonu ve metabolizması hızlıdır ve her iki tedavide C'a doz sonrası 5 dk'da ulaşılmıştır ancak beklometazon dipropiyonat/formoterol fumarat dihidrat inhalasyon tozuyla daha yüksektir (+ %68). EAAt, basınçlı inhalasyon çözeltisine kıyasla, beklometazon dipropiyonat/formoterol fumarat dihidrat'ın inhalasyondan sonra yaklaşık 3 kat daha yüksektir. Toplam kan düzeyinin yaklaşık %82'sini temsil eden başlıca aktif metabolit olan beklometazon-17-monopropiyonat için C'a kuru toz inahler ve basınçlı inhalasyon çözeltisi ile ortalamada, sırasıyla, 30 dk. ve 15 dk. Sonra ulaşılmıştır. Beklometazon-17-monopropiyonat'ın plazma konsantrasyonu, inhalasyon tozunun solunmasından sonra basınçlı inhalasyon çözeltisiyle solumaya göre daha düşüktür (C-
%49 ve EAA- %29). Beklometazon dipropiyonat/formoterol fumarat dihidrat'ın inhalasyonundan sonra formoterol'ün pik (doruk) konsantrasyonuna (C) 5 dakika içerisinde ulaşılmıştır. Formoterol'ün pik (doruk) konsantrasyonu inhalasyon tozu için daha yüksektir (+ %47) halbuki genel maruz kalım (EAA) iki tedavide benzerdir.
Çalışmalardan birinde bağıl akciğer erişimi, ilacın gastrointestinal kanaldan absorpsiyonunun dahil edilmemesi için kömür blokajı ve referans ürün (basınçlı inhalasyon çözeltisi) için onaylı bir spacer kullanılarak araştırılmıştır. Bu düzende, Beklometazon dipropiyonat/formoterol kuru toz inhaler ve basınçlı inhalasyon çözeltisinin hem beklometazon-17-monopropiyonat hem de formoterol'ün EAA‘si için eşit olduğu gösterilmiştir (inhalasyon tozu/basınçlı inhalasyon çözeltisinin oranı ve %90 güven aralıkları
%80-125 arasındadır); bununla birlikte, beklometazon-17- monopropiyonat'ın C'ı beklometazon dipropiyonat/formoterol fumarat dihidrat kuru toz inhalerden soluma sonrası daha düşüktür (-%38).
5.3. Klinik öncesi güvenlilik verileri
FOREBEC'te ayrı ayrı bulunan bileşenlerin klinik olmayan verileriyle, geleneksel güvenlilik farmakolojisi ve tekrarlanan doz toksisitesi çalışmalarına dayanarak insanlara yönelik özel bir risk olmadığı ortaya konmuştur. Kombinasyonun toksisite profili, toksisite ve beklenmeyen bulgularda artış olmamasıyla birlikte tek başına bileşenlerin toksisite profilini yansıtmıştır.
Karsinojenite
Önerilen kombinasyonla karsinojenisite çalışmaları gerçekleştirilmemiştir. Bununla birlikte, ayrı ayrı bileşenler için bildirilen hayvanlardan elde edilen veriler, insanlarda herhangi bir potansiyel karsinojenisite riskini akla getirmemektedir.
Mutajenite
Beklometazon dipropiyonat/formoterol kombinasyonuyla gerçekleştirilen genotoksisite çalışmaları mutajenik bir potansiyele işaret etmemektedir.
Üreme toksisitesi
Sıçanlarda yapılan üreme çalışmaları doza bağlı etkileri göstermiştir. Beklometazon dipropiyonat'ın yüksek dozlarda bulunması dişilerde azalmış doğurganlık, implantasyon sayısında azalma ve embriyofötal toksisite ile ilişkilendirilmiştir. Gebe hayvanlara göre yüksek kortikosteroid dozlarının, yarık damak ve rahim içi büyüme geriliği dahil fötal gelişim anomalilerine neden olduğu bilinmektedir ve beklometazon dipropiyonat/formoterol kombinasyonuyla görülen etkiler muhtemelen beklometazon dipropiyonattan ötürüdür. Bu etkiler yalnızca, aktif metabolit olan beklometazon-17-monopropiyonata yüksek sistemik maruz kalımla fark edilmiştir (hastalarda beklenen plazma düzeylerinin 200 katından daha fazla). Ayrıca, hayvanlarda yapılan çalışmalarda, beta-sempatomimetiklerin bilinen tokolitik etkilerine dayandırılabilen bir etki olan gebelik ve doğum süresinin uzaması görülmüştür. Bu etkiler, beklometazon dipropiyonat/formoterol fumarat dihidrat ile tedavi edilen hastalarda maternal plazma formoterol düzeyleri beklenen düzeylerin altında olduğunda fark edilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (Inhalac 250) (sığır sütü kaynaklı) Laktoz monohidrat (Inhalac 400) (sığır sütü kaynaklı)
HPMC Kapsül (No:3) Bileşimi Hipromelloz
Azorubine
6.2. Geçimsizlikler
Bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır.
Nemden korumak için orijinal ambalajında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Ürünümüz, OPA-Alu-PVC folyo ve alüminyum folyodan oluşan blister ile ambalajlanmaktadır. Blisterler karton kutu içerisinde paketlenir. Her bir karton kutu 120 adet kapsül, plastik seperatör içerisinde 1 adet cihaz (monodoz kuru toz inhaler) ve kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği†ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
Deva Holding A.Ş.
Halkalı Merkez Mah. Basın Ekspres Cad. No: 1 34303 Küçükçekmece/İSTANBUL
Tel: 0 212 692 92 92
Faks: 0 212 697 00 24
E-mail: deva@devaholding.com.tr
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BIOSFAR | 8699942520077 | |
| FASTAIR | 8680865270255 | 643.27TL |
| FORBEFIX | 8680741520306 | 539.53TL |
| FOREBEC | 8699525558930 | 587.52TL |
| FOSHAL | 8680865270118 | 643.27TL |
| Diğer Eşdeğer İlaçlar |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Satış Fiyatı | 587.52 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 587.52 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525558930 |
| Etkin Madde | Beklometazon Dipropiyonat + Formoterol Fumarat |
| ATC Kodu | R03AK08 |
| Birim Miktar | 100+6 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 120 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| Yerli ve Beşeri bir ilaçdır. |