FOSEMAZON 150 mg I.V. infüzyonluk çözelti Kısa Ürün Bilgisi
{ Fosaprepitant Dimeglumin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FOSEMAZON 150 mg IV infüzyonluk çözelti hazırlamada kullanılacak konsantre için toz Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her flakon, 150 mg fosaprepitanta eşdeğer (=130,5 mg aprepitant) 245,32 mg fosaprepitant dimeglumin içerir.
Çözünme ve seyreltme işlemleri sonrası 1 mL çözelti 1 mg fosaprepitant (1 mg/mL) içerir.
Yardımcı maddeler
Disodyum edetat 18,80 mg
Sodyum hidroksit k.m Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti hazırlamada kullanılacak konsantre için toz Beyaz ya da hemen hemen beyaz renkli liyofilize kek.
Flakondan tüm solüsyonu geri çekin ve toplam 150 mL hacim elde etmek için enjeksiyonluk 145 mL sodyum klorür 9 mg/mL (%0,9) solüsyonu içeren infüzyon torbasına aktarın. Çantayı 2-3 kez hafifçe ters çevirin.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yetişkinlerde ve 6 aylık ve daha büyük pediatrik hastalarda yüksek ve orta derecede emetojenik kanser kemoterapisi ile ilişkili bulantı ve kusmanın önlenmesinde endikedir.
FOSEMAZON kombinasyon tedavisinin bir parçası olarak verilir. (Bkz. Bölüm 4.2)
4.2. Pozoloji ve uygulama şekli
Pozoloji / Uygulama sıklığı ve süresi YetişkinlerdeÖnerilen doz, 1. günde kemoterapiden yaklaşık 30 dakika öncesinde, infüzyonla 150 mg'ı en az
20-30 dakikalık süre içinde uygulamaktır (Bkz. Bölüm 6.6).
FOSEMAZON, aşağıdaki tablolarda belirtildiği gibi bir kortikosteroid ve 5-HTantagonisti ile birlikte uygulanmalıdır.
Emetojenik kanser kemoterapisi ile ilişkili mide bulantısı ve kusmayı önlemek için aşağıdaki rejimler önerilir.
Yüksek Emetojenik Kemoterapi Rejimi
| 1. Gün | 2. Gün | 3. Gün | 4. Gün |
FOSEMAZON | 150 mg intravenöz olarak | Uygulanmaz | Uygulanmaz | Uygulanmaz |
Deksametazon |
12 mg oral olarak | 8 mg oral olarak | Günde 2 kez 8 mg oral olarak | Günde 2 kez 8 mg oral olarak |
5-HT antagonistleri | 5-HT antagonistlerinin standart dozu. Uygun doz bilgileri için seçilen 5-HTantagonistinin ürün bilgilerine bakınız. |
Uygulanmaz |
Uygulanmaz |
Uygulanmaz |
Deksametazon, 1. günde kemoterapi tedavisinden 30 dakika önce ve 2. Günden 4. Güne kadar sabah uygulanmalıdır. Deksametazon, 3. ve 4. günlerde akşam da uygulanmalıdır. Deksametazon dozu aktif maddenin etkileşimlerini açıklar.
Orta Derecede Emetojenik Kemoterapi Rejimi
| 1. Gün |
FOSEMAZON | İntravenöz olarak 150 mg |
Deksametazon | Oral olarak 12 mg |
5-HTantagonistleri | 5-HTantagonistlerinin standart dozu. Uygun doz bilgileri için seçilen 5-HTantagonistinin ürün bilgilerine bakınız. |
Deksametazon, 1. günde kemoterapi tedavisinden 30 dakika önce uygulanmalıdır. Deksametazon dozu aktif maddenin etkileşimlerini açıklar.
Pediatrik Popülasyonda
6 aylık ve daha büyük ve 6 kg'dan daha az olmayan pediatrik hastalar:
Yüksek derecede emetojenik kemoterapi (HEC) veya orta derecede emetojenik kemoterapinin (MEC) tek veya çok günlük rejimlerinin uygulanması ile ilişkili bulantı ve kusmanın önlenmesi için kortikosteroid içeren veya içermeyen bir 5-HTantagonisti ile birlikte uygulanması önerilen fosaprepitant dimegluminin doz rejimi Tablo 1'de gösterilmiştir. Tek günlük kemoterapi rejimleri, HEC veya MEC'nin sadece bir tek gün için uygulandığı rejimleri içerir. Çok günlük kemoterapi
rejimleri, HEC veya MEC'nin 2 veya daha fazla gün boyunca uygulandığı kemoterapi rejimlerini içerir.
Tek günlük kemoterapi rejimlerinde kullanılabilecek alternatif doz rejimi Tablo 2'de gösterilmiştir.
Tek veya Çok Günlük Kemoterapi Rejimleri için Dozlama
Tek veya çok günlük HEC veya MEC rejimleri alan pediatrik hastalar için, FOSEMAZON 1, 2 ve
3. günlerde santral venöz kateter yoluyla intravenöz infüzyon olarak uygulanır.
Tablo 1. HEC veya MEC'nin tek veya çok günlük rejimlerine bağlı bulantı ve kusmanın önlenmesi için önerilen dozlama
| Popülasyon | 1. Gün | 2. Gün | 3. Gün |
FOSEMAZON |
12 yaş veya daha büyük pediatrik hastalar |
115 mg intravenöz olarak |
80 mg intravenöz olarak |
80 mg intravenöz olarak |
6 aylık - 12 yaş arasında ve 6 kg'dan az olmayan pediatrik hastalar |
3 mg/kg intravenöz olarak
Maksimum doz 115 mg |
2 mg/kg intravenöz olarak
Maksimum doz 80 mg |
2 mg/kg intravenöz olarak
Maksimum doz 80 mg | |
Deksametazon | Bütün pediatrik hastalar | Deksametazon gibi bir kortikosteroid birlikte uygulandığında, 1 ile 4. günler arasında önerilen kortikosteroid dozunun %50'sini uygulayınız. | ||
5-HT antagonistleri | Bütün pediatrik hastalar | Önerilen doz için seçilmiş 5-HTantagonist reçete bilgilerine bakınız | ||
*12 yaş ve üstü pediatrik hastalar için, 30 dakikadan daha uzun sürede intravenöz olarak FOSEMAZON uygulayın ve kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayın. 12 yaşından küçük pediatrik hastalar için, kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayarak, FOSEMAZON'u 60 dakikadan daha uzun sürede intravenöz olarak uygulayın.
**Deksametazon, 1. gün kemoterapi tedavisinden 30 dakika önce uygulanmalıdır.
Tek Günlük Kemoterapi Rejimleri için Alternatif Dozlama
Tek günlük HEC veya MEC alan pediatrik hastalar için FOSEMAZON, 1. Günde bir santral venöz kateter yoluyla intravenöz infüzyon şeklinde uygulanabilir.
Tablo 2. HEC veya MEC'nin tek günlük rejimleriyle ilişkili bulantı ve kusmanın önlenmesi için alternatif dozlama
| Popülasyon | 1. Gün |
FOSEMAZON | 12 yaş ve üzeri pediatrik hastalar |
150 mg intravenöz olarak |
2 ile 12 yaş arasındaki pediatrik hastalar | 4 mg/kg intravenöz olarak Maksimum doz 150 mg | |
6 aylık ile 2 yaş arasındaki ve 6 kg'dan az olmayan pediatrik hastalar |
5 mg/kg intravenöz larak Maksimum doz 150 mg | |
Deksametazon |
Bütün pediatrik hastalar | Deksametazon gibi bir kortikosteroid birlikte uygulandığında, 1. ile 2. günlerde önerilen kortikosteroid dozunun %50'sini uygulayın. |
5-HT antagonistleri | Bütün pediatrik hastalar | Önerilen doz için seçilmiş 5-HTantagonist reçete bilgilerine bakınız. |
*12 yaş ve üstü pediatrik hastalar için, 30 dakikadan daha uzun sürede intravenöz olarak FOSEMAZON uygulayın ve kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayın. 12 yaşından küçük pediatrik hastalar için, kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayarak, FOSEMAZON'u 60 dakikadan daha uzun sürede intravenöz olarak uygulayın.
**Deksametazon, 1. günde kemoterapi tedavisinden 30 dakika önce uygulanmalıdır.
6 aylıktan küçük bebeklerde fosaprepitant dimegluminin güvenliliği ve etkililiği belirlenmemiştir.
Veri bulunmamaktadır.
Genel
Diğer kortikosteroidler ve 5-HTantagonistleri ile kombinasyon halinde etkinlik verileri sınırlıdır. Kortikosteroidlerle birlikte uygulama hakkında ek bilgi için Bölüm 4.5'e bakınız. Birlikte uygulanan 5-HT3 antagonisti tıbbi ürünleri için Kısa Ürün Bilgileri'ne bakınız.
Uygulama şekli
FOSEMAZON yalnızca intravenöz olarak uygulanmalı ve intramüsküler veya subkütan yolla verilmemelidir. Yetişkinlerde intravenöz uygulama, tercihen 20-30 dakikalık bir sürede intravenöz infüzyon yoluyla gerçekleştirilir. 6 aylık ve daha büyük yaştaki pediatrik hastalarda intravenöz uygulama, santral venöz kateter yoluyla önerilmektedir ve 12 yaş ve üzeri hastalarda 30 dakikadan
daha uzun bir sürede ya da 12 yaşından küçük pediatrik hastalarda ise 60 dakikanın üzerinde bir sürede uygulanmalıdır (Bkz. Bölüm 6.6). FOSEMAZON, bolus enjeksiyon veya seyreltilmemiş solüsyon olarak kullanılmaz.
Uygulamadan önce ürünün sulandırılması ve seyreltilmesi ile ilgili talimatlar için bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalar veya hemodiyalize giren son dönem böbrek yetmezliği hastaları için doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2).
Karaciğer yetmezliği
Hafif karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir. Orta dereceli karaciğer yetmezliği olan hastalarda sınırlı veri vardır ve ciddi karaciğer yetmezliği olan hastalarda veri yoktur. Bu hastalarda FOSEMAZON dikkatli kullanılmalıdır (Bkz. Bölüm 4.4 ve 5.2).
Geriyatrik popülasyon:
Yaşlılar için doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2).
Cinsiyet:
Cinsiyete göre doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Etkin madde
Pimozid, terfenadin, astemizol veya sisaprid ile birlikte uygulanması (Bkz. Bölüm 4.5).
4.4. Özel kullanım uyarıları ve önlemleri
Orta derece ve ciddi karaciğer yetmezliği olan hastalar
Orta dereceli karaciğer yetmezliği olan hastalarda sınırlı veri vardır ve ciddi karaciğer yetmezliği olan hastalarda veri yoktur. Bu hastalarda, FOSEMAZON dikkatli kullanılmalıdır (Bkz. Bölüm 5.2).
CYP3A4 etkileşimleri
FOSEMAZON, primer olarak CYP3A4 ile metabolize olan ve siklosporin, takrolimus, sirolimus, everolimus, alfentanil, ergot alkaloid türevleri, fentanil ve kinidin gibi terapötik aralığı dar olan aktif maddeleri alan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.5). Ayrıca, irinotekan ile eşzamanlı kullanımında, toksisitenin artmasına neden olabileceğinden, özellikle dikkatli olunmalıdır.
Varfarin (CYP2C9 substratı) ile birlikte uygulama
Kronik varfarin tedavisi gören hastalarda, fosaprepitant kullanımından sonra 14 gün boyunca Uluslararası Normalleştirilmiş Oran (INR) yakından izlenmelidir (Bkz. Bölüm 4.5).
Hormonal kontraseptifler ile birlikte uygulama
Fosaprepitant, uygulanması sırasında ve uygulanmasından sonraki 28 gün boyunca hormonal kontraseptiflerin etkinliğini, azaltabilir. Fosaprepitant tedavisi sırasında ve fosaprepitant kullanımını takiben 2 ay süreyle kontrasepsiyon için hormonal olmayan alternatif destekleyici yöntemler kullanılmalıdır (bkz. Bölüm 4.5).
Aşırı duyarlılık reaksiyonları
Fosaprepitantın infüzyonu sırasında veya sonrasında, kızarıklık, eritem, dispne ve anafilaksi/ anafilaktik şok dahil ani aşırı duyarlılık reaksiyonları ortaya çıkmıştır. Bu aşırı duyarlılık reaksiyonları genellikle infüzyonun kesilmesi ve uygun tedavinin uygulanması ile giderilmektedir. Aşırı duyarlılık reaksiyonları oluşan hastalarda infüzyonun yeniden başlatılması önerilmez.
Uygulama ve infüzyon bölgesi reaksiyonları
Fosaprepitant kullanımı ile infüzyon bölgesi reaksiyonları (İBR) bildirilmiştir (Bkz. Bölüm 4.8). Tromboflebit ve vaskülit de dahil olmak üzere ciddi İBR'lerin çoğunluğu, özellikle ekstravazasyonla ilişkili olduğunda, eşzamanlı vezikan kemoterapi (örn. antrasiklin bazlı) uygulaması ile bildirilmiştir. Eşzamanlı olarak vezikan kemoterapi alan bazı hastalarda nekroz da bildirilmiştir. Eşzamanlı vezikan kemoterapi olmadan, yüksek dozlarda uygulandığında hafif enjeksiyon bölgesi trombozu gözlenmiştir.
FOSEMAZON bolus enjeksiyonu ile uygulanmamalıdır, her zaman seyreltilerek ve yavaş intravenöz infüzyon şeklinde uygulanmalıdır (Bkz. Bölüm 4.2). FOSEMAZON intramüsküler veya subkütan yoldan uygulanmamalıdır (Bkz. Bölüm 5.3). Lokal tahriş işaretleri veya belirtileri ortaya çıkarsa, enjeksiyon veya infüzyon sonlandırılmalı ve başka damarda yeniden başlatılmalıdır.
Bu tıbbi ürün her mL'sinde 1 mmol (23 mg)'den daha az sodyum ihtiva eder; yani esasında “sodyum içermezâ€.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İntravenöz olarak uygulandığında, fosaprepitant hızla aprepitanta dönüşür.
Tek doz olarak verilen 150 mg fosaprepitant zayıf bir CYP3A4 inhibitörüdür. Oral aprepitant ile digoksin arasındaki etkileşim eksikliği ile gösterildiği gibi fosaprepitantın P-glikoprotein taşıyıcısı ile etkileşime girmemektedir. Fosaprepitantın CYP2C9, CYP3A4 ve glukuronidasyonun oral aprepitantın verilmesinden daha az veya daha fazla indüklenmesine neden olmayacağı öngörülmektedir. CYP2C8 ve CYP2C19 üzerindeki etkilerle ilgili veriler eksiktir.
İntravenöz fosaprepitant uygulamasını takiben diğer tıbbi ürünlerle olan etkileşimler, muhtemelen oral aprepitant ile etkileşen aktif maddelerle ortaya çıkabilir. Çok günlük fosaprepitant rejimleri ile
etkileşim potansiyelinin, oral aprepitant rejimlerinden daha fazla olmadığı tahmin edilmektedir. Bu nedenle, pediatrik hastalarda diğer tıbbi ürünlerle birlikte FOSEMAZON kullanımı önerileri, fosaprepitant ve aprepitant çalışmalarından elde edilen erişkin verilerine dayanmaktadır.
Aşağıdaki bilgiler, oral aprepitant ile yapılan araştırmalardan ve deksametazon, midazolam veya diltiazem ile birlikte uygulanan intravenöz fosaprepitant ile yapılan çalışmalardan elde edilmiştir.
Diğer aktif maddelerin farmakokinetiği üzerine fosaprepitantın etkisi CYP3A4 inhibisyonu
CYP3A4'ün zayıf bir inhibitörü olan fosaprepitantın 150 mg'lık tek dozu, CYP3A4 enzimi aracılığıyla metabolize edilen, birlikte uygulanan diğer aktif maddelerin plazma konsantrasyonlarında geçici bir artışa neden olabilir. CYP3A4 substratlarının toplam maruziyeti, tek bir 150 mg fosaprepitant dozu ile birlikte uygulandıktan sonra 1. ve 2. günlerde 2 katına kadar çıkabilir. Fosaprepitant aynı anda pimozid, terfenadin, astemizol veya sisaprid ile birlikte kullanılmamalıdır. CYP3A4'ün fosaprepitant tarafından inhibisyonu, bu aktif maddelerin plazma konsantrasyonlarının yükselmesine neden olacağından; potansiyel olarak ciddi ya da hayati risk taşıyan reaksiyonlara neden olabilir (Bkz. Bölüm 4.3). Öncelikle CYP3A4 ile metabolize olan ve siklosporin, takrolimus, sirolimus, everolimus, alfentanil, diergotamin, ergotamin, fentanil ve kinidin gibi terapötik aralığı dar olan aktif maddeler ile birlikte fosaprepitant uygulanması sırasında dikkat edilmesi önerilir (Bkz. Bölüm 4.4).
Kortikosteroidler
Deksametazon: Oral deksametazon dozu fosaprepitant ile birlikte verldiğinde yaklaşık % 50 oranında azaltılmalıdır. Birinci günde tek bir intravenöz doz olarak uygulanan 150 mg fosaprepitant, bir CYP3A4 substratı olan deksametazonun (1, 2 ve 3. günde 8 mg tek doz oral olarak) birlikte uygulanmasıyla, EAAo-24saat'i 1. günde %100, 2. günde %86 ve 3. günde %18 oranında artırmıştır.
Kemoterapötik ilaçlar
Fosaprepitant 150 mg'ın kemoterapötik ilaçlarla etkileşim çalışmaları yapılmamıştır; ancak, oral aprepitant ve dosetaksel ve vinorelbin ile yapılan çalışmalara dayanarak, intravenöz uygulanan dosetaksel ve vinorelbin fosaprepitant 150 mg ile klinik açıdan alakalı bir etkileşimi olmaması beklenmemektedir. CYP3A4 tarafından esas olarak veya kısmen metabolize edilen oral kemoterapötik tıbbi ürünlerle (örn., etoposid, vinorelbin) etkileşim gözardı edilemez. Primer veya kısmen CYP3A4 tarafından metabolize edilen tıbbi ürünleri alan hastalar için dikkatli olunması ve ilave izleme yapılması uygun olabilir (Bkz. Bölüm 4.4). İfosfamitin potansiyel bir advers reaksiyonu olan nörotoksisitenin pazarlama sonrası olayları, aprepitant ve ifosfamitin beraber uygulanmasından sonra rapor edilmeye başlanmıştır.
İmmünosupresanlar
Tek bir 150 mg fosaprepitant dozunu takiben, 2 günlük geçici orta dereceli bir artışın ardından, CYP3A4 (örn., siklosporin, takrolimus, everolimus ve sirolimus) tarafından metabolize edilen immünosüpresanların maruziyetinde küçük bir azalma beklenmektedir. Artmış maruziyetin süresinin kısalığı göz önüne alındığında, FOSEMAZON uygulamasının yapıldığı gün ve sonrasında Terapötik Doz İzlemeye dayalı immünosüpresan dozunda bir azaltma önerilmemektedir.
Midazolam
1. gün ve 4. günde 2 mg tek doz oral olarak uygulanan midazolam ile 1. günde tek bir intravenöz doz halinde uygulanan 150 mg fosaprepitant; 1. günde midazolamın EAAdeğerini %77 oranında artırmıştır ve 4. günde hiç etki göstermemiştir. Zayıf bir CYP3A4 inhibitörü olan fosaprepitant 150 mg, 1. günde tek doz olarak uygulandığında, 4. Günde gözlemlenen CYP3A4 inhibisyonu veya indüksiyonu olduğuna dair hiçbir kanıt bulunmamaktadır.
CYP3A4 ile metabolize edilen midazolam ve diğer benzodiazepinlerin (alprazolam, triazolam) plazma konsantrasyonlarındaki artışın potansiyel etkileri, FOSEMAZON'un bu tıbbi ürünlerle eş zamanlı uygulanması sırasında göz önünde bulundurulmalıdır.
Diltiazem
Fosaprepitant 150 mg ve diltiazem ile etkileşim çalışmaları henüz yapılmamıştır; bununla birlikte, diltiazem ile birlikte FOSEMAZON 150 mg kullanıldığında, 100 mg fosaprepitant ile yapılan aşağıdaki çalışma dikkate alınmalıdır. Hafif ve orta şiddette hipertansiyon hastalarında günde 3 kez diltiazem 120 mg ile 15 dakika boyunca 100 mg fosaprepitant verilmesi ile diltiazem'in EAA'ını 1,4 kat arttırmış ve kan basıncında klinik olarak anlamlı bir azalma ile sonuçlanmış olup, kalp hızında veya PR aralığında klinik olarak anlamlı bir değişiklikle sonuçlanmamıştır.
İndüksiyon
Fosaprepitant 150 mg tek doz, midazolam etkileşim çalışmasında 1. ve 4. günlerde CYP3A4'ü indüklememiştir. Fosaprepitantın, ilk aprepitant dozundan 6-8 gün sonra maksimum etki ile geçici bir indüksiyonun gözlemlendiği 3 günlük oral aprepitant rejiminin uygulanmasından daha az veya daha fazla CYP2C9, CYP3A4 ve glukuronidasyon indüksiyonuna neden olmayacağı öngörülmektedir. 3 günlük oral aprepitant rejimi, CYP2C9 substratlarının EAA'sında %30-35'lik bir azalma ve etinil estradiol konsantrasyonlarında %64'e kadar bir azalma olmasını sağladı. CYP2C8 ve CYP2C19 üzerindeki etkilerle ilgili veriler eksiktir. Varfarin, asenokumarol, tolbutamid, fenitoin veya CYP2C9 tarafından metabolize edildiği bilinen diğer aktif maddeler FOSEMAZON ile uygulandığında dikkatli olunmalıdır.
Varfarin
Kronik varfarin tedavisi gören hastalarda, kemoterapinin neden olduğu bulantı ve kusmayı önleme amaçlı FOSEMAZON kullanımı sırasında ve tedavi sonrasında 14 gün boyunca protrombin zamanı (INR) yakından izlenmelidir (Bkz. Bölüm 4.4).
Hormonal kontraseptifler
Fosaprepitantın uygulanması sırasında ve uygulanmasından sonraki 28 gün boyunca hormonal kontraseptiflerin etkinliği azalabilir. Fosaprepitant tedavisi sırasında ve fosaprepitantın son dozunu takiben 2 ay süreyle alternatif hormon içermeyen destekleyici kontrasepsiyon yöntemleri kullanılmalıdır.
5-HTantagonistleri
Fosaprepitant 150 mg ve 5-HTantagonistleri ile etkileşim çalışmaları henüz yapılmamıştır, ancak klinik etkileşim çalışmalarında oral aprepitant rejiminin ondansetron, granisetron veya hidrodolasetronun (dolasetronun aktif metaboliti) farmakokinetiği üzerinde klinik olarak önemli etkisi olmamıştır. Bu nedenle, FOSEMAZON 150 mg ve 5-HTantagonistlerinin birlikte kullanımı ile etkileşime dair bir kanıt bulunmamaktadır.
150 mg fosaprepitantın uygulanması sonucu aprepitantın farmakokinetiği üzerine diğer tıbbi ürünlerin etkisi
Kombinasyonda aprepitantın plazma konsantrasyonlarının birkaç kat artması beklendiği için, fosaprepitantın, CYP3A4 aktivitesini inhibe eden aktif maddelerle (örn., Ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromisin, telitromisin, nefazodon ve proteaz inhibitörleri) beraber uygulanmasında dikkatli olunmalıdır (Bkz. Bölüm 4.4). Ketokonazol oral aprepitantın terminal yarı ömrünü yaklaşık 3 kat arttırmıştır.
Fosaprepitantın CYP3A4 aktivitesini kuvvetli olarak indükleyen aktif maddelerle (örn., Rifampisin, fenitoin, karbamazepin, fenobarbital) birlikte kullanılmasından kaçınılmalıdır. Çünkü bu kombinasyonlar aprepitantın plazma konsantrasyonlarında azalmaya yol açar ve Fosaprepitanın etkinliğinde azalmaya neden olabilir. Fosaprepitantın St. John's Wort (Hypericum perforatum) içeren bitkisel müstahzarlarla birlikte uygulanması önerilmemektedir. Rifampisin oral aprepitantın ortalama terminal yarı ömrünü, %68 azaltmıştır.
Diltiazem
Fosaprepitant 150 mg ve diltiazem ile etkileşim çalışmaları henüz yapılmamıştır; ancak FOSEMAZON 150 mg'ı diltiazem ile birlikte kullanırken, 100 mg fosaprepitant ile yapılan aşağıdaki çalışma dikkate alınmalıdır. 100 mg fosaprepitantın 15 dakikada diltiazem ile 120 mg 3 kez infüzyonu, aprepitant EAA'nın 1,5 kat artmasına neden olmuştur. Bu etki klinik olarak önemli sayılmamıştır.
Özel popülasyonlara ilişkin ek bilgiler
Ek bilgi bulunmamaktadır.
Pediatrik popülasyon
Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hormonal kontraseptiflerin etkinliği, fosaprepitantın verilmesinden sonra ve 28 gün boyunca azalabilir. Fosaprepitant tedavisi srasında ve son fosaprepitant dozunu takiben 2 ay süreyle kontraseptif için alternatif, hormon içermeyen alternatif yöntemler kullanılmalıdır (Bkz. Bölüm 4.4 ve 4.5).
Gebelik dönemi
Fosaprepitant ve aprepitant için gebelikte maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik, embriyonal / fetal gelişim, doğum ya da doğum sonrası gelişim açısından doğrudan ya da dolaylı olarak zararlı etkiler göstermemektedir (Bkz. Bölüm 5.3).
FOSEMAZON çok gerekli olmadıkça gebelik sırasında kullanılmamalıdır. Gebe kadınlara uygulanırken tedbirli olunmalıdır.
Laktasyon dönemi
Aprepitant, fosaprepitantın intravenöz uygulanmasından sonra ve aynı zamanda aprepitantın oral uygulamasından sonra sıçanların sütüne geçmiştir. Aprepitantın insan sütüne geçip geçmediği bilinmemektedir.
FOSEMAZON ile tedavisi sırasında emzirme önerilmemektedir.
Üreme yeteneği/Fertilite
Fosaprepitant ve aprepitant'ın doğurganlık üzerindeki potansiyeli tam olarak karakterize edilmemiştir, çünkü insanlarda gözlenen terapötik maruziyetin üzerindeki maruziyet düzeylerine hayvan çalışmalarında ulaşılmamıştır. Bu doğurganlık çalışmaları çiftleşme performansı, doğurganlık, embriyonik / fetal gelişim veya sperm sayımı ve motilite açısından doğrudan veya dolaylı zararlı etkiler göstermemiştir (Bkz. Bölüm 5.3). Fosaprepitant ve aprepitantın üreme toksisiteleri potansiyeli tam olarak karakterize edilmemiştir çünkü insanlardaki terapötik maruziyetin üzerindeki maruz kalma seviyeleri hayvan çalışmalarında elde edilememiştir. Nörokinin düzenlenmesindeki değişikliklerin üreme üzerine potansiyel etkileri bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
FOSEMAZON, makine sürme ve kullanma becerisinde hafif bir etki oluşturabilir. Baş dönmesi ve yorgunluk, FOSEMAZON uygulamasının ardından ortaya çıkabilir (Bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlik profilinin özeti
Klinik araştırmalarda 371 sağlıklı kişi ve 2.084 hasta ve 199 çocuk ve adolesan kemoterapi kaynaklı bulantı ve kusma (CINV) hastası olmak üzere toplam 2.687 kişiye çeşitli fosaprepitant formülasyonları uygulandı. Fosaprepitant aprepitanta dönüştürüldüğünden, aprepitant ile ilişkili bu advers reaksiyonların fosaprepitant ile oluşması beklenir. Aprepitantın güvenlik profili yaklaşık
6.500 yetişkin ve 184 çocuk ve adolesanda değerlendirildi.
Oral aprepitant
Yüksek derecede emetojenik kemoterapi (HEC) gören hastalarda, standart tedaviye göre aprepitant ile tedavi edilen hastalarda daha yüksek insidansla rapor edilen en yaygın advers reaksiyonlar şunlardır: hıçkırık (%4,6'e karşılık %2,9), alanin aminotransferaz (ALT) artışı (%2,8'e karşılık
%1,1), dispepsi (%2,6'a karşılık %2,0), kabızlık (%2,4'e karşılık %2,0), baş ağrısı (%2,0'a karşılık
%1,8) ve iştah azalması (%2,0'a karşılık %0,5). Orta derecede emetojenik kemoterapi (MEC) alan hastalarda, standart tedaviyle karşılaştırıldığında aprepitant tedavisi ile tedavi edilmiş hastalarda daha yüksek bir insidansla bildirilen en yaygın advers reaksiyon yorgunluk olmuştur (%1,4'e karşılık %0,9).
Emetojenik kanser kemoterapisi gören, kontrol tedavisine göre aprepitant ile tedavi edilen pediatrik hastalarda daha yüksek insidansla rapor edilen en yaygın advers reaksiyon hıçkırık (%3,3'e karşı
%0,0) ve ciltte kızarmadır (%1,1'e karşı %0,0).
Advers reaksiyonlar – aprepitant:
Aşağıdaki advers reaksiyonlar, pazarlama sonrası kullanımda veya erişkin ve pediatrik hastalarda HEC ve MEC çalışmalarının birleştirilmiş analizinde standart tedaviye kıyasla oral aprepitant tedavisi ile daha yüksek insidansla gözlenmiştir.
Verilen sıklık kategorileri yetişkinlerdeki çalışmalara dayanmaktadır; pediatrik çalışmalarda gözlenen sıklıklar, tabloda gösterilmediği sürece benzerdir ya da daha düşüktür. Yetişkin popülasyonundaki yaygın olmayan advers reaksiyonların bazıları pediatrik çalışmalarda gözlenmemiştir.
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Seyrek: Kandidiyaz, stafilokok enfeksiyonu
Kan ve lenf sistemi hastalıkları
Yaygın olmayan: Febril nötropeni, anemi
Bağışıklık sistemi hastalıkları
Bilinmiyor: Anafilaktik reaksiyonları içeren aşırı duyarlılık reaksiyonları
Metabolizma ve beslenme hastalıkları
Yaygın: İştah azalması Seyrek: Polidipsi
Psikiyatrik hastalıklar
Yaygın olmayan: Anksiyete
Seyrek: Oryantasyon bozukluğu, öforik duygu durum
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Yaygın olmayan: Baş dönmesi, somnolans (uyuklama) Seyrek: Kognitif bozukluk, letarji, disguzi
Göz hastalıkları
Seyrek: Konjonktivit
Kulak ve iç kulak hastalıkları
Seyrek: Tinnitus
Kardiyak hastalıklar
Yaygın olmayan: Palpitasyon
Seyrek: Bradikardi, kardiyovasküler bozukluk
Vasküler hastalıklar
Yaygın olmayan: Sıcak basması
Solunum göğüs hastalıkları ve mediastinal hastalıklar
Yaygın: Hıçkırık
Seyrek: Orofarengeal ağrı, hapşırma, öksürük, postnazal sızıntı, boğaz tahrişi
Gastrointestinal hastalıklar
Yaygın: Kabızlık, dispepsi
Yaygın olamayan: Erüktasyon, mide bulantısı*, kusma*, gastroözofageal reflü hastalığı, karın ağrısı, ağız kuruluğu, gaz
Seyrek: Duodenal ülser perforasyonu, stomatit, abdominal distansiyon, sert dışkı, nötropenik kolit.
Deri ve deri altı doku hastalıkları
Yaygın olamayan: Döküntü, akne
Seyrek: Fotosensitiv reaksiyon, hiperhidroz, sebore, cilt lezyonu, kaşıntılı döküntü, Stevens Johnson sendromu / toksik epidermal nekroliz
Bilinmiyor: Pruritus, ürtiker
Kas-iskelet, bağ doku ve kemik hastalıkları
Seyrek: Kas zayıflığı, kas spazmları
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Disüri Seyrek: Pollakiüri
Genel ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Yorgunluk
Yaygın olmayan: Halsizlik, kırıklık
Seyrek: Ödem, göğüste huzursuzluk, yürüme bozukluğu
Laboratuvar bulguları
Yaygın: ALT artışı
Yaygın olmayan: AST artışı, kanda alkalen fosfataz artışı
Seyrek: İdrarda kırmızı kan hücreleri pozitif, kan sodyum seviyesinde azalma, kilo kaybı, notrofil sayısında azalma, idrarda glukoz varlığı, idrar miktarında artış
* Bulantı ve kusma, postkemoterapi tedavisinin ilk 5 gününde etkinlik parametreleridir ve bundan sonra sadece advers etkileri olduğu bildirilmiştir.
Seçilmiş advers reaksiyonların tarifi
Orta derecede ve yüksek derecede emetojenik kemoterapi çalışmalarında çoklu kürlerin 6 ilave kemoterapi kürüne kadar uzatılması sırasında gözlenen advers reaksiyon profilleri 1. kürde gözlenen profillerle genel olarak benzerdir.
Aprepitant ve yüksek derecede emetojenik kemoterapi alan 1.169 hastada yürütülen başka bir aktif- kontrollü klinik çalışmada advers reaksiyonların profili, aprepitant ile yürütülen diğer emetojenik kemoterapi çalışmalarında gözlenenlerle genel olarak benzerdir.
Postoperatif bulantı ve kusma için aprepitant ile tedavi edilen hastalarda ondansetrondan daha yüksek insidansla rapor edilen diğer yan etkiler şunlardır: üst abdominal ağrı, anormal barsak sesleri, kabızlık*, disartri, dispne, hipoestezi, uykusuzluk, miyozis, bulantı, duyusal bozukluk, mide rahatsızlığı, sub-ileus*, görme keskinliğinde azalma, hırıltılı solunum.
*Aprepitantın daha yüksek bir dozunu alan hastalarda bildirilmiştir.
Fosaprepitant
HEC uygulanan hastalarda aktif kontrollü bir klinik araştırmada, fosaprepitant 150 mg'lık 1 günlük rejimi alan 1.143 hasta ile aprepitant 3 günlük rejimi alan 1.169 hasta arasında güvenlik değerlendirilmesi yapılmıştır. Ek olarak, MEC alan hastaların katıldığı plasebo kontrollü bir klinik araştırmada, kontrol rejimi alan 497 hastayla karşılaştırıldığında tek doz fosaprepitant 150 mg alan 504 hastada güvenlik değerlendirilmesi yapılmıştır.
HEC veya MEC tedavisi almakta olan ve önerilen 1 günlük rejim dozunda veya bu dozun üstünde olmak üzere tek doz fosaprepitant dimeglumin alan pediyatrik hastalarda (6 aylıktan 17 yaşa kadar) yapılmış olan 3 aktif kontrollü klinik çalışmanın birleştirilmiş analizinde, fosaprepitant dimegluminin 1 günlük rejimini alan 139 hasta için güvenlilik değerlendirilmiştir. Aynı analizde, HEC veya MEC alan hastalar ve önerilen 3 günlük fosaprepitant rejiminde veya üzerinde tek bir doz foseprepitant alan 199 hastada güvenlilik değerlendirilmiştir. 3 günlük IV/oral/oral rejiminin uygulanmasını takiben elde edilen güvenlilik verileri de dahil edilmiştir.
Pediatrik hastalarda 3 günlük IV fosaprepitant rejiminin uygulanmasına ilişkin veri bulunmamaktadır. Pediatrik hastalarda 3 günlük IV fosaprepitant rejiminin güvenlik profilinin, düşük düzeydeki günlük seviyelerin sonraki günlerde maruz kalma oranlarını önemli ölçüde artırmaması nedeniyle, 1 günlük fosaprepitant rejimine benzer olması beklenmektedir.
Yetişkinlerde ve pediatrik hastalarda fosaprepitantın güvenlilik profili, aprepitant ile gözlenene genel olarak benzerdir.
Advers reaksiyonlar - fosaprepitant
Aşağıda, yukarıda tarif edildiği gibi aprepitant ile rapor edilmemiş olan klinik çalışmalarda veya pazarlama sonrası fosaprepitant alan erişkin hastalarda rapor edilmiş olan advers reaksiyonlar verilmektedir. Verilen sıklık kategorileri yetişkinlerdeki çalışmalara dayanmaktadır; pediyatrik çalışmalarda gözlenen sıklıklar, tabloda gösterilmediği sürece benzerdir ya da daha düşüktür. Yetişkin popülasyonundaki yaygın olan advers reaksiyonların bazıları pediyatrik çalışmalarda gözlenmemiştir.
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Vasküler hastalıklar
Yaygın olmayan: Ciltte kızarma, tromboflebit (baskın olarak infüzyon bölgesi tromboflebiti) Deri ve deri altı doku hastalıkları
Yaygın olmayan: Eritem
Genel ve uygulama bölgesine ilişkin hastalıklar
Yaygın olmayan: İnfüzyon bölgesinde eritem, infüzyon bölgesi ağrısı, infüzyon bölgesinde kaşıntı. Seyrek: İnfüzyon bölgesinde sertlik.
Bilinmiyor: Kızarma, eritem, dispne ve anafilaktik reaksiyonlar/anafilaktik şok dahil ani aşırı duyarlılık reaksiyonları.
Araştırmalar
Yaygın olmayan: Kan basıncı artışı.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Doz aşımı durumunda, FOSEMAZON kesilmelidir ve genel destekleyici tedavi ve takip sağlanmalıdır. Aprepitantın antiemetik etkililiğinden dolayı, ilaç yoluyla kusturma etkili olmayabilir.
Aprepitant hemodiyaliz ile uzaklaştırılamaz.
Hazırlanan bu infüzyon torbasından, önerilen doza göre uygulanacak hacmi belirleyin (Bkz. Bölüm 4.2).
Yetişkinlerde
Hazırlanan infüzyon torbasının (150 ml) tüm hacmi uygulanmalıdır.
Pediatrik Hastalarda
12 yaş ve üzeri hastalarda uygulanacak hacim, aşağıdaki gibi hesaplanmaktadır:
Uygulanacak hacim (mL), önerilen doza (mg) eşittir.
6 ay ila 12 yaş arasındaki hastalarda uygulanacak hacim, aşağıdaki gibi hesaplanmaktadır:
Uygulanacak hacim (mL) = önerilen doz (mg / kg) x ağırlık (kg)
Not: Maksimum dozlar aşılmamalıdır (Bkz. Bölüm 4.2).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antiemetikler ve bulantıya karşı kullanılan ilaçlar ATC kodu: A04AD12
Fosaprepitant, aprepitantın ön ilacıdır ve intravenöz olarak uygulandığında hızla aprepitanta dönüşür. (Bkz. Bölüm 5.2). Fosaprepitantın genel antiemetik etkiye katkısı tam olarak karakterize edilememiştir, ancak başlangıç aşamasında geçici bir katkısının olduğu göz ardı edilemez. Aprepitant, insanda P maddesi nörokinin 1 (NK) reseptörlerinin seçici, yüksek afiniteli bir antagonistidir. Fosaprepitantın farmakolojik etkisi aprepitant'a bağlanmaktadır.
Yetişkinlerde Fosaprepitant'ın 1 Günlük Rejimi Yüksek Emetojenik Kemoterapi (HEC)
Randomize, paralel, çift kör, aktif kontrollü bir çalışmada fosaprepitant 150 mg (N = 1.147), sisplatin (≥70 mg/m) içeren, HEC rejimi alan hastalarda 3 günlük aprepitant rejimi ile (N = 1.175) karşılaştırıldı.
Fosaprepitant kombinasyon rejimi, 1. günde 150 mg fosaprepitant ve 1. günde 32 mg i.v ondansetron ve 1. günde 12 mg deksametazon, 2. gün 8 mg deksametazon ve 3. ve 4. günlerde günde iki kez 8 mg deksametazondan oluşturulmuştur.
Aprepitant kombinasyon rejimi, 1. günde 125 mg olmak üzere 2. ve 3. günlerde günde 80 mg
aprepitant, 1. günde 32 mg i.v ondansetron ve 1. günde 12 mg deksametazon ve 2. ila 4. günlerde 8 mg deksametazon olacak şekilde oluşturulmuştur. Körlüğü sürdürmek için plasebo fosaprepitant, plasebo aprepitant ve plasebo deksametazon (3. ve 4. günlerin akşamları) kullanıldı (Bkz. Bölüm 4.2). Klinik çalışmalarda 32 mg intravenöz dozda ondansetron kullanılmış olsa da, bu artık tavsiye edilen doz değildir. Uygun dozaj bilgileri için seçilen 5-HT3 antagonistinin ürün bilgilerine bakınız.
Etkinlik, aşağıdaki kompozit önlemlerin değerlendirilmesine dayanmaktadır: hem genel hem de gecikmiş fazlarda tam yanıt ve genel fazında kusma yoktur. Fosaprepitant 150 mg'ın 3 günlük aprepitant rejimine göre üstün olmadığı gösterildi. Birincil ve ikincil sonlanım noktalarının bir özeti Tablo 3'te gösterilmektedir.
Tablo 3 | |||
Yüksek derecede emetojenik kemoterapi (HEC) alan erişkin hastalarda tedavi grubu ve faza göre yanıt veren hastaların yüzdesi -l.Kür | |||
Sonlanım noktaları | Fosaprepitant rejimi (N =1,106) % | Aprepitant rejimi (N =1,134) % | Değişiklik (%95 CI) |
Tam yanıt | |||
Genel | 71,9 | 72,3 | -0,4 (-4,1, 3,3) |
Gecikmiş faz | 74,3 | 74,2 | 0,1 (-3,5, 3,7) |
Kusma Yok | |||
Genel | 72,9 | 74,6 | -1,7 (-5,3, 2,0) |
*Primer sonlanım noktaları kalın harflerle yazılmıştır.
**N: Tam yanıtın primer analizinde yer alan erişkin hasta sayısı.
†Fark ve güven aralığı (CI) Miettinen ve Nurminen tarafından önerilen ve cinsiyete göre düzeltilmiş yöntem kullanılarak hesaplanmıştır.
‡Tam yanıt = kusma yok ve kurtarma tedavisi yok.
§ Genel = Sisplatin kemoterapisinin başlamasından 0 ila 120 saat sonra.
§§ Gecikmiş faz = Sisplatin kemoterapisinin başlamasından 25 ila 120 saat sonra.
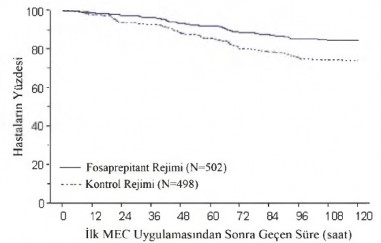
Orta derecede emetojenik kemoterapi (MEC)
Randomize, paralel, çift-kör, plasebo kontrollü bir çalışmada, orta derecede emetojenik kemoterapi rejimi alan yetişkin hastalarda ondansetron ve deksametazon ile birlikte fosaprepitant 150 mg (N
= 502), tek başına ondansetron ve deksametazon (kontrol rejimi) ile karşılaştırıldı (N = 498).
Fosaprepitant rejimi, 1. günde 150 mg fosaprepitant ile birlikte 2 doz 8 mg oral ondansetron ve 12 mg oral deksametazondan oluşmaktadır. 2. ve 3. günlerde, fosaprepitant grubundaki hastalara, her 12 saatte bir ondansetron yerine plasebo verildi.
Kontrol rejimi, 1. günde 150 mg i.v plasebo fosaprepitant ile birlikte 2 doz 8 mg oral ondansetron ve 20 mg oral deksametazondan oluşmaktadır. 2. ve 3. günde, kontrol grubundaki hastalar her 12 saatte bir 8 mg oral ondansetron aldı. Plasebo fosaprepitant ve plasebo deksametazon (1. günde) körlüğü devam ettirmek için kullanıldı.
Fosaprepitantın etkinliği, Tablo 4'de listelenen primer ve sekonder sonlanım noktalarına dayanılarak değerlendirildi ve gecikmiş ve genel fazlardaki tam yanıt açısından kontrol rejiminden daha üstün olduğu gösterildi.
Tablo 4 | |||
Orta derecede emetojenik kemoterapi (MEC) alan hastalarda tedavi grubu ve faza göre yanıt veren erişkin hastaların yüzdesi | |||
Sonlanım noktaları | Fosaprepitant rejimi (N =502) % | Kontrol rejimi (N =498) % | P değeri |
Tam yanıt | |||
Gecikmiş faz | 78,9 | 68,5 | <0,001 |
Tam yanıt | |||
Genel | 77,1 | 66,9 | <0,001 |
Akut Faz | 93,2 | 91 | 0,184 |
**Birincil sonlanım noktaları kalın harflerle gösterilmiştir.
**N: Popülasyonun tedavi edilme amacına dahil edilen erişkin hasta sayısı.
†Tam yanıt = kusma yok ve kurtarma tedavisi yok.
‡ Gecikmiş faz = Kemoterapi başlamasından sonraki 25 ve 120 saat arası.
§ Genel = Kemoterapi başlamasından sonraki 0 ve 120 saat arası.
§§Akut = Kemoterapi başlamasından sonraki 0 ve 24 saat arası.
İlk kusmaya kadar geçen tahmini süre Şekil 1'deki Kaplan-Meier grafiği ile gösterilmiştir.
Şekil 1
Orta derecede emetojenik kemoterapi alan, zamandan bağımsız kusma yaşayan yetişkin hastaların yüzdesi
Pediatrik Popülasyon
Aktif-kontrollü, açık etiketli 3 klinik çalışmada, yüksek veya orta derecede emetojenik kemoterapi alan 6 ay ila 17 yaş arası pediyatrik hastalar, önerilen tek günlük rejim dozunda (139 hasta) veya 3 günlük rejim (199 hasta) dozunda, deksametazon içeren veya içermeyen, ondansetron ile kombinasyon halinde tek doz fosaprepitant almışlardır.
1 Günlük Fosaprepitant Rejimi Alan Pediatrik Hastalar
Pediyatrik hastalarda 1 günlük fosaprepitant rejiminin etkililiği, yetişkinlerde Fosaprepitantın 1 Günlük Rejimi altbölümünde tanımlandığı gibi, 1 günlük fosaprepitant rejimini alan yetişkinlerden elde edilen verilere göre tahmin edilmiştir.
Pediyatrik hastalarda 1 günlük fosaprepitant rejiminin etkililiğinin, 1 günlük yetişkin fosaprepitant rejimine benzer olması beklenmektedir.
3 Günlük Fosaprepitant Rejimi Alan Pediatrik Hastalar
Pediatrik hastalarda 3 günlük fosaprepitant rejiminin etkililiği, 3 günlük oral aprepitant rejimini alan pediatrik hastalarda gösterilmiştir.
Pediatrik hastalarda 3 günlük fosaprepitant rejiminin etkililiğinin, 3 günlük oral aprepitant rejimine benzer olması beklenmektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Aprepitant'ın bir ön ilacı olan fosaprepitant, intravenöz uygulandığında hızla aprepitanta dönüştürülür. Fosaprepitantın plazma konsantrasyonları, infüzyonun tamamlanmasından sonraki 30 dakika içinde ölçülebilir seviyelerin altındadır.
Fosepritant uygulamasından sonra aprepitant
Sağlıklı erişkin gönüllülere 20 dakikalık bir infüzyonla uygulanan tek doz intravenöz 150 mg fosaprepitantı takiben, aprepitantın EAAortalaması 35,0 µg.saat/mL ve ortalama maksimal aprepitant konsantrasyonu 4.01 µg/mL'dir.
Dağılım
Aprepitant plazma proteinlerine yüksek oranda (ortalama %97) bağlanır. Tek bir 150 mg'lık intravenöz fosaprepitant dozundan sonra, aprepitantın kararlı durumdaki dağılımının geometrik ortalama hacmi (V), insanlarda yaklaşık 82 L'dir.
Biyotransformasyon
Fosaprepitant, insanlardan gelen karaciğer preparatlarıyla in vitro inkübasyonlarda hızla aprepitanta dönüştürülür. Ayrıca, fosaprepitant, böbrek, akciğer ve ileum da dahil olmak üzere diğer insan dokularından gelen S9 preparatlarında aprepitanta hızlı ve neredeyse tamamen dönüştürülmüştür. Böylece, fosaprepitantın aprepitanta dönüşmesinin birden fazla dokuda oluşabileceği görülmektedir. İnsanlarda intravenöz olarak uygulanan fosaprepitant, infüzyonun bitiminden sonra 30 dakika içinde hızla aprepitanta dönüştürülür.
Aprepitant geniş ölçüde metabolizasyona uğrar. Sağlıklı genç erişkinlerde, aprepitantın bir ön ilacı olan fosaprepitantın [C] ile işaretlenmiş tekli 100 mg dozunun intravenöz yolla uygulanmasından sonra aprepitant 72 saat boyunca plazmadaki radyoaktivitenin yaklaşık %19'unu oluşturmaktadır; bu, plazmada metabolitlerin kayda değer varlığını gösterir. İnsan plazmasında aprepitantın 12 metaboliti saptanmıştır. Aprepitant metabolizması büyük ölçüde morfolin halkası ve yan zincirlerinin oksidasyonuyla gerçekleşir ve oluşan metabolitler çok zayıf şekilde aktiftir. İnsan karaciğer mikrozomlarının kullanılarak yapıldığı in vitro çalışmalar, aprepitant'ın başlıca CYP3A4 ile daha az oranda CYP1A2 ve CYP2C19 ile metabolizmaya uğradığını göstermiştir.
İdrar, dışkı ve plazmada intravenöz 100 mg [C]- fosaprepitant dozunu takiben gözlemlenen tüm metabolitler, oral [C]- aprepitant dozunda da gözlemlendi. 245,3 mg fosaprepitant dimeglumin (150 mg mg fosaprepitant ile eşdeğer) aprepitanta dönüştürüldüğünde, 23,9 mg fosforik asit ve 95,3 mg meglumin oluşur.
Eliminasyon
Aprepitant idrara değişmemiş şekilde atılmaz. Metabolitler idrarla atılır ve safra yoluyla dışkıya geçerek dışkı ile atılır. Sağlıklı kişilere [ C]-fosaprepitantın tekli intravenöz 100 mg dozunun uygulanmasının ardından radyoaktivitenin %57'si idrarda ve %45'i feçeste bulunmuştur.
Aprepitantın farmakokinetiği klinik doz aralığında doğrusal değildir. 150 mg'lık bir intravenöz fosaprepitant dozunu takiben aprepitantın terminal yarı ömrü yaklaşık 11 saattir. 150 mg'lık bir intravenöz fosaprepitant dozunun ardından aprepitantın geometrik ortalama plazma klirensi yaklaşık olarak 73 mL/dakika idi.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Ciddi böbrek yetmezliği (CrCl < 30 mL/dakika) ve hemodiyaliz gerektiren son evre böbrek hastalığı (SEBH) olan hastalara tek bir doz 240 mg oral aprepitant uygulanmıştır.
Ciddi böbrek yetmezliği olan hastalarda total aprepitantın EAAdeğeri (bağlanmamış ve proteine bağlı) sağlıklı kişilere göre %21 azalırken, C%32 azalmıştır. Hemodiyalize giren SEBH'lı hastalarda total aprepitantın EAAdeğeri %42 azalırken, C%32 azalmıştır. Böbrek hastalığı olan hastalarda aprepitantın proteinlere bağlanmasındaki küçük azalmalara bağlı olarak, farmakolojik yönden aktif, bağlanmamış ilacın EAA'sı böbrek yetmezliği olan hastalarda sağlıklı kişilere göre anlamlı olarak etkilenmemiştir. Doz verildikten 4-48 saat sonra yapılan hemodiyalizin aprepitantın farmakokinetiği üzerinde anlamlı etkisi olmamış ve dozun %0,2'sinden azı diyaliz maddesinde saptanmıştır.
Böbrek yetmezliği olan hastalarda ve hemodiyalize giren SEBH'li hastalarda FOSEMAZON dozunda ayarlama yapılması gerekmez.
Karaciğer yetmezliği:
Fosaprepitant çeşitli ekstrahepatik dokularda metabolize olur; dolayısıyla karaciğer yetmezliğinin fosaprepitantın aprepitanta dönüşümünü değiştirmesi beklenmemektedir. Hafif karaciğer yetmezliği (Child-Pugh sınıf A), aprepitantın farmakokinetiğini klinik açıdan önemli derecede etkilemez. Hafif karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir. Mevcut verilere dayanarak, orta düzeyde karaciğer yetmezliğinin (Child-Pugh sınıf B) aprepitant farmakokinetiği üzerindeki etkisi hakkında yargıya varılamaz.
Şiddetli karaciğer yetmezliği olan hastalara (Child-Pugh sınıf C) ilişkin herhangi bir klinik veya farmakokinetik veri yoktur.
Pediatrik popülasyon:
3 günlük IV/IV/IV rejiminin bir parçası olarak, pediyatrik hastalarda (6 aydan 17 yaşına kadar), 1. günde medyan plazma pik konsantrasyonu (C) ve 1. gün, 2. gün ve 3. Gün sonunda medyan konsantrasyonlar ile beraber aprepitantın simüle edilmiş medyan AUCverileri Tablo 5'te gösterilmektedir.
Tablo 5. Pediatrik hastalarda 3 günlük IV fosaprepitant rejimi için aprepitantın farmakokinetik parametreleri
Popülasyon | 3-günlük IV/IV/IV doz | AUC (ng*s/mL) | C(ng/mL) | C (ng/mL) | C (ng/mL) | C (ng/mL) |
12 – 17 yaş | 115 mg, 80 mg, 80 mg |
21172 |
2475 |
454 |
424 |
417 |
6 - < 12 yaş | 3mg/kg, 2mg/kg, 2mg/kg | 25901 | 2719 | 518 | 438 | 418 |
2 - < 6 yaş | 20568 | 2335 | 336 | 248 | 232 | |
6 aylık - < 2 yaş | 16979 | 1916 | 256 | 179 | 167 |
1 günlük IV fosaprepitant uygulamasında, pediyatrik hastalarda (6 aydan < 12 yaşına kadar), 1. günde medyan plazma pik konsantrasyonu (C) ve 1. gün, 2. gün ve 3. gün sonunda medyan konsantrasyonlar ile beraber aprepitantın simüle edilmiş medyan AUCverileri ve pediatrik hastalarda (12 yaştan 17 yaşa kadar) 1. günde medyan plazma pik konsantrasyonu (C) ve 1. gün,
2. gün ve 3. gün sonunda medyan konsantrasyonlar ile beraber gözlenen ortalama AUCverileri Tablo 6'da gösterilmektedir.
Tablo 6. Pediatrik hastalarda 1 günlük fosaprepitant rejimi için aprepitantın farmakokinetik parametreleri
Popülasyon | 1-gün doz | AUC (ng*s/mL) | C (ng/mL) | C (ng/mL) | C (ng/mL) | C (ng/mL) |
12 – 17 yaş | 150 mg | 30400 | 3500 | 735 | NR* | NR* |
6 - < 12 yaş | 4 mg/kg | 35766 | 3637 | 746 | 227 | 69.2 |
2 - < 6 yaş | 28655 | 3150 | 494 | 108 | 23.5 | |
6 aylık - < 2 yaş | 5 mg/kg | 30484 | 3191 | 522 | 112 | 24.4 |
*NR = Rapor edilmedi
Pediatrik hastalarda (6 aylık ila 17 yaş arası) aprepitantın bir popülasyon farmakokinetik analizinde, cinsiyet ve ırkın aprepitantın farmakokinetiği üzerinde klinik olarak anlamlı bir etkiye sahip olmadığını belirtilmektedir.
Konsantrasyon ve etki arasındaki ilişki
Tek doz intravenöz 150 mg fosaprepitant uygulanan sağlıklı genç erkeklerde, yüksek düzeyde spesifik bir NK-reseptör izleyici kullanılarak yapılan pozitron emisyon tomografisi (PET) çalışmalarında, aprepitantın beyne nüfuz ettiği, doza ve plazma konsantrasyonuna bağlı bir şekilde NKı reseptörlerine bağlandığı, NKreseptör doluluk oranının Tve 24. Saatte >%100, 48. saatte
%97 ve 120. saatte %41 ve %75 arasında olduğu gösterilmiştir.
Bu çalışmada, beyin NKı reseptörlerinin doluluk oranı aprepitant plazma konsantrasyonları ile iyi korelasyon gösterdiği tespit edilmiştir.
5.3. Klinik öncesi güvenlilik verileri
Fosaprepitantın intravenöz uygulanması ve aprepitantın oral uygulanması ile elde edilen klinik öncesi veriler, tekli ve tekrarlı doz toksisitesi, genotoksisite (in vitro testler dahil) ve üreme toksisitesi konvansiyonel çalışmalar insanlar için herhangi bir özel tehlikeyi ortaya koymamaktadır.
Kemirgenlerdeki kanserojen potansiyeli, sadece oral aprepitant ile araştırılmıştır. Bununla birlikte, kemirgen, tavşan ve maymun ile yapılan toksisite çalışmalarının üreme toksisitesi çalışmaları da dahil olmak üzere, sınırlı olduğu düşünülmektedir, çünkü fosaprepitant ve aprepitantın sistemik maruz kalmaları, insanlardaki terapötik maruz kalmaya yalnızca benzer veya hatta insandan daha düşüktür. Yapılan güvenlik farmakolojisi ve köpeklerle yapılan tekrarlanan doz toksisite araştırmalarında, fosaprepitant Cve aprepitant EAA değerleri sırasıyla klinik değerlerden 3 kat ve 40 kata kadar daha yüksekti.
Fosaprepitant ile tedavi edilen yavru köpeklerde (doğum sonrası 14. günden 42. güne kadar), yapılan toksisite çalışmasında; erkeklerde 6 mg/kg/gün dozda, azalmış testiküler ağırlık ve Leydig hücre büyüklüğü görüldü, dişilerde 4 mg/kg/gün dozda uterus ağırlığının artması, rahim ve serviks hipertrofisi ve vajinal dokuların ödemleri görülmüştür. Doğum sonrası 10. günden 63. günde aprepitant ile tedavi edilen yavru sıçanlarda yapılan bir toksisite çalışmasında; dişilerde günde 2 defa 250 mg/kg dozda daha erken vajinal açılma ve erkeklerde günde 2 defa 10 mg/kg gecikmiş preputial ayrılma görülmüştür. Bu çalışmada çiftleşme, fertilite veya embriyonik / fetal sağkalım üzerine tedavi ile ilgili etkiler olmamıştır ve üreme organlarında patolojik bir değişiklik olmamıştır. Aprepitantın klinik açıdan anlamlı maruz kalınmasında herhangi bir marj yoktu. Kısa süreli tedavi için bu bulguların klinik açıdan anlamlı olmadığı düşünülmektedir.
Ticari olmayan formülasyonlarda, formülasyona bağlı olarak 1 mg/mL'nin altındaki ve daha yüksek konsantrasyonlardaki fosaprepitant, laboratuvar hayvanlarında vasküler toksisiteye ve hemolize neden olmuştur. Fosaprepitant konsantrasyonları 2,3 mg/mL ve daha yüksek olan ticari olmayan formülasyonlar ile insandaki yıkanmış kan hücrelerinde de hemoliz bulgusu vardı, insan kanında testler negatifti. İnsan tam kanı ve yıkanmış insan eritrositlerinde 1 mg/mL'lik bir fosaprepitant konsantrasyona kadar ticari formülasyonda herhangi bir hemoliz saptanmadı.
Tavşanlarda, fosaprepitant, paravenöz, subkütan ve intramüsküler uygulama sonrasında başlangıçta geçici lokal akut inflamasyona neden oldu. İzleme periyodunun sonunda (8. Gün doz sonrası), paravenöz ve intramüsküler uygulama sonrasında az miktarda lokal subakut inflamasyon kaydedildi ve intramüsküler uygulamayı takiben kas rejenerasyonu ile orta derece fokal kas dejenerasyonu / nekrozu eklendiği not edildi.
Eğer gerekirse, 150 mL'den daha az hacimler için, hesaplanan hacim, infüzyon yoluyla uygulamadan önce uygun büyüklükteki bir torbaya veya şırınganın içine aktarılabilir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Disodyum edetat Polisorbat 80 Laktoz anhidrus Sodyum hidroksit Hidroklorik asit Enjeksiyonluk su
6.2. Geçimsizlikler
FOSEMAZON, iki değerlikli katyonlar (örn., Ca, Mg) içeren solüsyonlarla uyumlu değildir. Bu tıbbi ürün, bölüm 6.6'da belirtilenler hariç diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
Çözündürme ve seyreltmeden sonra, kimyasal ve fiziksel kullanım stabilitesi 25°C'de 24 saattir.
Mikrobiyolojik açıdan bakıldığında, beşeri tıbbi ürün hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım öncesi saklama süreleri ve kullanım koşulları kullanıcının sorumluluğundadır ve normalde 2 ila 8°C'de 24 saatten uzun bekletilmemelidir.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında (2°C-8°C) saklayınız.
Beşeri tıbbi ürünün çözündürülmesi ve seyreltilmesinden sonra saklama koşulları için, bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
Bromobutil tıpa ve şeffaf flip-off kapak ile kapatılmış tip I renksiz cam flakon.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
FOSEMAZON önce rekonstitüye edilmeli ve daha sonra uygulama öncesinde seyreltilmelidir. İntravenöz uygulama için FOSEMAZON 150 mg'ın hazırlanması:5 mL enjeksiyonluk sodyum klorür 9 mg/mL (%0,9) solüsyonunu, köpürmeyi önlemek için flakon duvarı üzerinden flakona enjekte edin. Flakonu yavaşça döndürerek çözün ve tamamen çözündüğünden emin olun, flakonu çalkalamaktan kaçının.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| FOSAPRANT | 8699844791803 | 1,518.78TL |
| FOSEMAZON | 8699606866688 | 1,546.23TL |
| FOSEMITANT | 8699651861317 | 4,418.12TL |
| Diğer Eşdeğer İlaçlar |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Polifarma İlaç San.ve Tic. A.Ş.
| Satış Fiyatı | 1546.23 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 1546.23 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699606866688 |
| Etkin Madde | Fosaprepitant Dimeglumin |
| ATC Kodu | A04AD12 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Sindirim Sistemi ve Metabolizma > Antiemetikler ve Bulantıyı Önleyici İlaçlar > Aprepitant |
| Yerli ve Beşeri bir ilaçdır. |